Canine dermatomyositis (DM) is een inflammatoire ischemische vasculopathie, van immuun oorsprong en met een sterke genetische predispositie, die voornamelijk de huid en in mindere mate de dwarsgestreepte spieren aantast. Wij presenteren u een volledig pathogenetisch, diagnostisch en therapeutisch overzicht van deze dermatose.
Juni 2025
Inleiding
Oorspronkelijk erkend bij de Collie en de Shetland Sheepdog, dient deze aandoening als een bijzonder relevant spontaan model voor de studie van humane juveniele dermatomyositis (JDM), een systemische auto-immuunziekte met opmerkelijke klinische en histopathologische overeenkomsten. Canine DM is dus niet alleen een klinische zorg voor dierenartspractici, maar ook een waardevol translatieonderzoekveld.
In het afgelopen decennium heeft het begrip van canine DM een radicale transformatie ondergaan. Het concept van een eenvoudige erfelijke ziekte met autosomaal dominante overerving met variabele penetrantie en inconsistente expressiviteit is vervangen door een veel genuanceerder model van complexe genetische stoornis. Genomica-vooruitgangen hebben het mogelijk gemaakt specifieke risicoloci en hun epistatische interacties te identificeren, wat een voorspellend kader voor de ziekte biedt. Tegelijkertijd heeft fundamenteel onderzoek de centrale rol belicht van deregulatie van de type I interferon (IFN) signaleringsroute als een belangrijke pathogenetische drijfveer, zoals waargenomen in humane JDM. Deze convergentie van genetische en immunopathologische kennis heeft de weg geopend naar meer gerichte diagnostische en therapeutische benaderingen, die het management van deze ziekte in 2025 opnieuw definiëren. Wij presenteren een huidige stand van kennis over de canine dermatomyositis, met integratie van de meest recente ontdekkingen over zijn pathogenese, diagnose en opkomende therapeutische strategieën.
Etiopathogenese
De etiopathogenese van canine dermatomyositis is het resultaat van een complexe interactie tussen polygenetische genetische predispositie, deregulerend aangeboren immuunsysteem, en omgevingsfactoren. Het begrip van deze gebeurtenissenreeks, van gen tot laesie, is essentieel om de ziekte te begrijpen en moderne therapeutische benaderingen te rechtvaardigen.
1.1 De genetische component van canine dermatomyositis
Het historische concept van een autosomaal dominante overerving met onvolledige penetrantie is verfijnd door genome-wide association studies (GWAS) die een complex en epistatisch overervingsmodel hebben onthuld. Het risico op het ontwikkelen van DM bij voorbestemde rassen, zoals de Collie en de Shetland Sheepdog, wordt nu begrepen als bepaald door de interactie van varianten binnen drie onafhankelijke genetische loci.
Identificatie van risicoloci
Onderzoek heeft drie belangrijke chromosoomregio’s geïdentificeerd waarvan de specifieke allelen het DM-risico moduleren.
- Locus A (Chromosoom 10) : Er werd een zeer sterke associatie gevonden met een missense-mutatie in het gen PAN2. Het gen PAN2 codeert voor een subeenheid van het poly(A) nuclease deadenylation complex, dat een cruciale rol speelt in de regulering van de afbraak van boodschapper-RNA (mRNA). Deze functie is bijzonder belangrijk voor de regulering van de inflammatoire respons, met name door de stabilisatie van transcripten van pro-inflammatoire genen die adenosine-uracil-rijke elementen (ARE) bevatten, zoals die van interleukine 6 (IL-6), een cytokine dat bekendstaat om zijn overexpressie in humane JDM. Deze mutatie legt dus een directe link tussen een fundamenteel genetisch defect en een predispositie voor immuunderegulatie.
- Locus B (Chromosoom 31) : Een tweede significante associatie is geïdentificeerd met een insertie/deletie (indel) in een niet-coderend 5′-gebied van het gen MAP3K7CL . Hoewel de precieze functie van dit gen, dat voor een kinase codeert, nog weinig bestudeerd is, wordt het voornamelijk tot expressie gebracht in perifere bloedleukocyten, wat wijst op een mogelijke rol in de immuunfunctie.
- Locus C (Canine MHC) : Er is een significante associatie waargenomen met een specifiek haplotype van de klasse II Major Histocompatibility Complex (MHC) van de hond . De associatie is bijzonder sterk bij homozygote individuen voor dit haplotype. De hoge frequentie van dit risicohaplotype bij gezonde honden geeft echter aan dat het alleen niet voldoende is om de ziekte te veroorzaken en dat de invloed ervan wordt gemoduleerd door de andere risicoloci.
Epistatische interactie en risico-stratificatie
De gecombineerde analyse van de genotypen van deze drie loci heeft een risicomodel onthuld dat niet simpelweg additief maar epistatisch is, waarbij het effect van een gen wordt gemodificeerd door de aanwezigheid van een of meer andere genen. Onderzoek heeft aangetoond dat 9 van de 27 mogelijke genotypecombinaties een matig (penetrantie van 33-50%) of hoog (penetrantie van 90-100%) risico geven om DM te ontwikkelen, waarmee 93% van de bestudeerde gevallen wordt verklaard. Bijvoorbeeld, de genotypen AABB (homozygoot voor de risicogenen op loci A en B) vertonen een penetrantie van 100% wanneer ze worden geassocieerd met ten minste een risico-allel op locus C (AABBCc ou AABBCC).
Deze ontdekking transformeert het ziekteinzicht. De oude concepten van “onvolledige penetrantie” en “variabele expressiviteit” kunnen nu worden herzien in het licht van dit kwantitatieve genetische model. Deze fenotypische variaties zijn niet willekeurig maar een directe weerspiegeling van het polygeen risicoprofiel van ieder individu. Een hond met een hoogrisicogenotype ontwikkelt de ziekte vrijwel zeker als hij wordt blootgesteld aan de juiste triggers, terwijl een hond met een matig risicogenotype de ziekte mogelijk nooit tot expressie brengt of alleen milde en voorbijgaande tekenen vertoont. Genetica biedt dus een voorspellend kader dat de onzekerheid vervangt. Dit heeft diepgaande implicaties voor genetisch advies, dat overgaat van een eenvoudige aanbeveling om klinisch aangedane honden niet te fokken naar een proactieve selectie van fokparen om de productie van pups met hoogrisico-genotypische combinaties te minimaliseren.
Genotype-fenotype correlatie
Er is een significante invers correlatie vastgesteld tussen het aantal risicogenen op loci PAN2 et MAP3K7CL en de leeftijd van aanvang van de ziekte. Honden met vier risicogenen (homozygoot voor de risico op beide loci) ontwikkelen DM op een mediane leeftijd van 5 maanden, terwijl degenen met slechts twee risicogenen het ontwikkelden op een mediane leeftijd van 18,5 maanden. Deze correlatie suggereert een gen-dosiseffect op de ernst van de predispositie, waarbij een hogere genetische last een lagere milieudrempel vereist om de ziekte te initiëren.
Tabel 1: Genetische Risicoloci voor Canine Dermatomyositis
|
Naam van de Locus |
Gerelateerd Gen |
Chromosoom |
Normaal Allel (notatie) |
Bekende/Hypothetische Biologische Functie |
|---|---|---|---|---|
|
Locus A |
PAN2 |
10 |
Wildtype (a) |
Regulering van mRNA-afbraak, stabilisatie van transcripten van inflammatoire respons |
|
Locus B |
MAP3K7CL |
31 |
Wildtype (b) |
Kinase tot expressie gebracht in immunologische weefsels, potentiële rol in immuunmodulatie |
|
Locus C |
DLA-DRB1 |
12 (MHC) |
Andere DLA haplotypes (c) |
Antigeenpresentatie, regulering van adaptieve immuunrespons |
Tabel 2: Risicostratificatie van DM op Basis van Genotype (Combinaties van Loci A en B, Gemodificeerd door Locus C)
|
Locus A / Locus B Genotype |
Risico met Locus C = cc |
Risico met Locus C = Cc |
Risico met Locus C = CC |
|---|---|---|---|
|
aa bb |
Laag |
Laag |
Laag |
|
Aa bb |
Laag |
Laag |
Laag |
|
aa Bb |
Laag |
Laag |
Laag |
|
AA bb |
Onbekend |
Matig |
Matig |
|
Aa Bb |
Laag |
Laag |
Laag |
|
aa BB |
Laag |
Matig |
Matig |
|
AA Bb |
Onbekend |
Matig |
Hoog |
|
Aa BB |
Onbekend |
Matig |
Hoog |
|
AA BB |
Onbekend |
Hoog |
Hoog |
|
Tabel aangepast van gegevens van het UC Davis Veterinary Genetics Laboratory, gebaseerd op onderzoek van Evans et al. |
|||
1.2 De Cascade van Immuunderegulatie: Vasculopathie en Interferon
Genetische predispositie is slechts de eerste stap. De pathogenese van DM is fundamenteel een ziekte van het immuunsysteem dat de bloedvaten aanvalt, leidend tot weefselischemie.
De Ischemische Vasculopathie als Primaire Laesie
DM is primair een inflammatoire vasculopathie. Het centrale pathologische proces is een door immuun gemedieerde aanval gericht tegen het endotheel van de kleine bloedvaten, vooral de endomyseal capillairen in de spieren en de dermische vaten in de huid. Deze endotheïtis leidt tot een vernauwing van het vasculaire lumen, microthrombose en uiteindelijk hypoperfusie van de stroomafwaartse weefsels. De resulterende ischemie is verantwoordelijk voor de karakteristieke klinische manifestaties: atrofie en necrose van de haarfollikels en de epidermis (veroorzakend alopecia en ulceratie) en degeneratie van spiervezels (veroorzakend atrofie en zwakte).
Type I Interferon (IFN) als Centrale Pathogene Motor
Overweldigend bewijs, uit zowel humane als caniene modellen, geeft aan dat een hyperactivatie van de type I interferon signaleringsroute de primaire motor van deze vasculopathie is. Deze “IFN-handtekening” doet zich voor door een systemische en weefseloverexpressie (huid, spier, bloed) van een reeks door IFN geïnduceerde genen, zoals MXA, ISG15 et CXCL10. De kracht van deze handtekening in de huid is direct gecorreleerd aan de activiteit van de huidziekte en neemt af of verdwijnt bij patiënten in remissie, waardoor het een potentiële biomarker voor de ziekteactiviteit is. Interferonen van type I hebben overzichterende effecten die vasculopathie kunnen verklaren: ze kunnen endotheelcellen activeren, een pro-inflammatoire en pro-thrombotische toestand bevorderen en immuuncellen naar de ontstekingsplaats rekruteren, waardoor vasculaire schade wordt voortgezet.
Rol van Auto-antilichamen en Circulerende Immuuncomplexen (CIC)
Hoewel de zoektocht naar specifieke myositis auto-antilichamen minder gevorderd is bij honden dan bij mensen, hebben oudere studies een positieve correlatie aangetoond tussen de klinische ernst van canine DM en de serumspiegels van circulerende immuuncomplexen (CIC) en immunoglobuline G (IgG). Er wordt verondersteld dat deze CIC zich in de vaatwanden van microvaten kunnen afzetten, daar de complementcascade activeren en zo bijdragen aan de endotheïtis en vasculopathie.
De convergentie van deze gegevens stelt ons in staat een verenigde causale keten vast te stellen die een decennium geleden niet duidelijk was. Ten eerste creëert een genetische predispositie, met name via mutaties in genen die ontstekingen reguleren zoals PAN2, een vruchtbare bodem voor een abnormale immuunrespons. Ten tweede leidt deze predispositie, in aanwezigheid van triggers, tot een overmatige en aanhoudende productie van type I IFN, het centrale mechanisme van de ziekte. Ten derde veroorzaakt dit IFN-rijke milieu vasculopathie door directe schade aan endotheelcellen. Ten vierde compromitteert de vasculopathie de bloedvoorziening, met ischemie in kwetsbare weefsels als gevolg. Ten slotte manifesteert deze ischemie zich klinisch als de kenmerkende huid- en spierlaesies van DM. Dit verenige inzicht in de pathogenese rechtvaardigt volledig de huidige verschuiving in therapeutisch paradigma, van algemene immunosuppressors naar therapieën die specifiek gericht zijn op en de IFN-signalering blokkeren.
1.3 Omgevings- en Endogene Triggers
Bij een genetisch gepredisposeerd individu zijn vaak triggers nodig om de ziekte te initiëren of te verergeren.
- Gedocumenteerde Risicofactoren : Meerdere factoren zijn bekend die een rol spelen bij het uitlokken van klinische opflakkeringen.
-
- Mechanische Trauma : De typische lokalisatie van laesies op botuitsteeksels (gezicht, carpi, tarsi) en drukpunten suggereert sterk dat herhaalde microtraumata als een lokale trigger fungeren, een Koebner-fenomeen.
- Blootstelling aan Ultraviolet (UV) Stralen : De fotodistributie van sommige gezichtsstoringen en de gerapporteerde verergering na blootstelling aan de zon wijzen op UV als een belangrijke trigger, waarschijnlijk door apoptose van keratinocyten en vrijlating van auto-antigenen te induceren.
- Hormonale Factoren : Opflakkeringen van de ziekte zijn geassocieerd met de oestrus, wat wijst op een hormonale invloed op de immuunregulatie.
- De Rol van Vaccinatie : De verbinding tussen vaccinatie en DM is een belangrijk punt van discussie. Er is een goed erkend syndroom van post-vaccinale ischemische dermatopathie, met name na toediening van het rabiesvaccin, dat klinisch en histologisch niet te onderscheiden is van DM. Een retrospectieve studie van 177 gevallen van ischemische dermatopathie schatte dat een associatie met recente vaccinatie waarschijnlijk is in 48,3% van de gevallen. In plaats van post-vaccinale dermatopathie als een volledig aparte entiteit te beschouwen, is het logischer om het te zien als de genetische DM die wordt onthuld door de krachtige immuunstimulans die vaccinatie biedt. Voor een pup met een hoogrisicogenotype (bijvoorbeeld, AABB), kan de intense immuunstimulatie geïnduceerd door een vaccin voldoende zijn als “stresstest” om de IFN-pathogene cascade te initiëren en de klinische ziekte uit te lokken. Dit heeft belangrijke klinische implicaties: voor pups van rassen met risico, met een onbekende of hoogrisico genetische status, gaat het niet om het vermijden van vaccinatie, maar om het informeren van eigenaren en het instellen van nauwgezette monitoring om het optreden van huidlaesies in de weken en maanden na injecties te detecteren, waardoor vroege interventie mogelijk wordt.
Klinisch Spectrum en Diagnostische Benadering
De klinische presentatie van canine DM is variabel, variërend van milde en zelflimiterende cutane vormen tot ernstige systemische verwikkelingen. De diagnose berust op een multimodale benadering die de signalement, klinische tekenen en gerichte aanvullende tests combineert.
2.1 Raspredispositie en Ziekteclassificatie
- Familiale DM : De Collie en Shetland Sheepdog zijn de emblematische rassen van de ziekte, waarbij een erfelijke basis is aangetoond en de genetische risicoloci zijn geïdentificeerd.
- DM-achtige Syndromen (Dermatomyositis-achtig) : Vergelijkbare klinische en histologische patronen zijn beschreven in een toenemend aantal andere rassen, waaronder de Beauceron, Welsh Corgi, Lakeland Terrier, Chow Chow, Duitse Herder en de Kuvasz.
Het historische onderscheid tussen “familiale DM” (bij gepredisposeerde rassen) en “DM-like” (bij andere rassen) wordt steeds meer als semantisch in plaats van biologisch beschouwd. De onderliggende histopathologie is identiek, suggereert gemeenschappelijke pathogenetische routes. De term “ischemische dermatopathie” is een nauwkeuriger en verenigend histopathologisch diagnos die deze verschillende klinische presentaties overkoepelt. De moderne diagnostische benadering mag zich dus niet beperken tot ras, maar moet op zoek gaan naar genetische en pathologische markers van de ziekte bij elke hond met een compatibel klinisch beeld, ongeacht het ras.
2.2 Klinische Manifestaties
De klinische tekenen van DM variëren aanzienlijk tussen individuen, maar volgen meestal een herkenbaar patroon.
Cutane Tekenen
Huidbtrekking is de meest constante manifestatie van de ziekte.
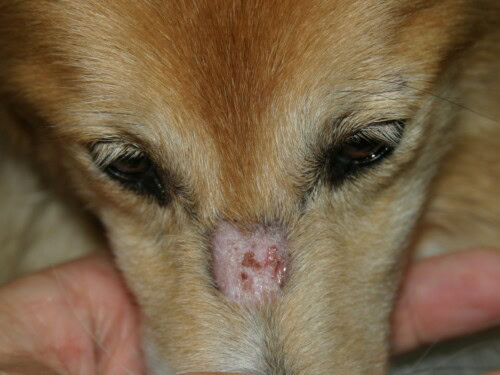
- Initiële Letsels : Ze verschijnen typisch bij de jonge hond, vóór de leeftijd van 6 maanden, en vaak al op 7 tot 11 weken. De initiële presentatie kan subtiel zijn, met papels, pustels of voorbijgaande vesikels die snel evolueren naar meer kenmerkende letsels van erytheem, alopecia, schilfers en korstjes.
- Karakteristieke Distributie : De laesies hebben een voorkeur voor gebieden met trauma en slechte collaterale circulatie: het gezicht (perioculaire en peribuccale regio’s, bovenkant neus), oorschelpen (vooral punt en plooien), staartpunt en de huid over de uitstekende botdelen van de ledematen (carpi, tarsi, tenen).
- Chronische Letsels : Na verloop van tijd evolueren de laesies naar permanente cicatriciële alopecia, huidatrofie en pigmentatieveranderingen (hyperpigmentatie of hypopigmentatie), wat een gevlekt uiterlijk oplevert dat poikiloderma wordt genoemd. Nagelaandoeningen (onychodystrofie, onychorrhexis, onychoschisis) kunnen ook worden waargenomen.
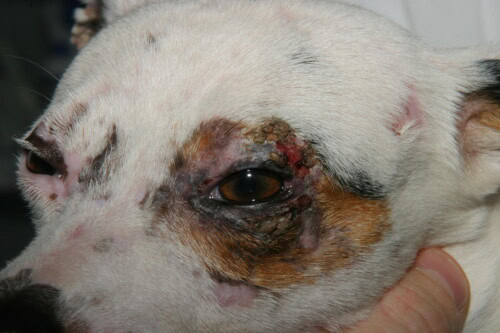
Ernstige aantasting van de staart met alopecia en korstige laesies
Voornamelijk eenzijdige ooglidbetrokkenheid bij deze hond
Laesie kan perfect een dermatofytose nabootsen
Myopathische Tekenen
Spierbetrokkenheid is meer variabel en wanneer klinisch opmerkbaar, is het meestal een teken van een ernstiger vorm van de ziekte.
- Correlatie met Cutane Tekenen : Klinische myositis treedt meestal op na het verschijnen van huidletsels, en de ernst ervan is vaak evenredig met die van de dermatologische betrokkenheid.
- Spieratrofie : Atrofie van de kauwspieren (temporalis en masseter) is het meest voorkomende spierteken en kan de enige myopathische manifestatie zijn. Bij ernstigere gevallen kan bilaterale symmetrische atrofie van de spieren van het hoofd, de nek, de romp en de ledematen zich ontwikkelen.
- Functionele Tekenen : Atrofie en ontsteking van de kauw- en slikspieren kunnen leiden tot moeite met het grijpen van voedsel (prehensie), kauwen en slikken (dysfagie). Een abnormale, stijve en stijve gang (“stiff-stilted gait” of “ganzenpas”) wordt ook beschreven.
- Ernstige complicaties : De ontwikkeling van een megaoesofagus (dilatatie en hypomotiliteit van de slokdarm) is een ernstige complicatie, die leidt tot regurgitatie, gewichtsverlies en een hoog risico op aspiratiepneumonie, een veelvoorkomende doodsoorzaak bij ernstige vormen van DM.
2.3 Diagnostische Zekerheid: Een Multimodale Strategie
De diagnose van DM is nooit gebaseerd op één enkele test, maar op de samenkomst van meerdere elementen, na uitsluiting van veelvoorkomende differentiële diagnoses zoals demodicose, bacteriële pyodermie, dermatofytose en discoïde lupus erythematosus.
- Histopathologie (Hoeksteen) : De biopsie is de sleutelonderzoek om de ischemische aard van de laesies te bevestigen.
-
- Huidbiopsie : Afgenomen van een recente en actieve laesie, onthult het karakteristieke veranderingen van ischemische dermatopathie: een interface dermatitis met weinig cellen (met weinig inflammatoire cellen), atrofie van de haarfollikels, vacuolisatie van de keratinocyten in de basale laag van de epidermis, aanwezigheid van apoptotische cellen (Civatte-lichaampjes), en fibrosis of accumulatie van mucine in de dermis. Vasculaire veranderingen kunnen subtiel zijn, met een ‘vervaging’ en eosinofiel aspect van het perivasculaire collageen (‘smudged collagen’) in plaats van een duidelijke necrotiserende vasculitis.
- Spierbiopsie : Hoewel minder vaak routinematig uitgevoerd, is het aangewezen bij vermoeden van myopathische betrokkenheid. Het toont typisch een interstitiële en perivasculaire myositis, met een overwicht van lymfocyten, plasmacellen en histiocyten, geassocieerd met tekenen van spanningen in de spiervezels (degeneratie, necrose, regeneratie en atrofie).
- Elektrodiagnostiek (EMG) : Elektromyografie is een zeer gevoelig hulpmiddel om een myopathie te detecteren, zelfs bij afwezigheid van duidelijke klinische tekenen. Het onderzoek, uitgevoerd onder anesthesie, onthult abnormale spontane elektrische activiteiten in de aangetaste spieren, zoals fibrillatiepotentialen, positieve scherpe golven, en bizarre of myotone hoogfrequente ontladingen.
- Genetische Tests : Voor Collies, Shetland herdershonden en hun kruisingen is de test van de drie risicoloci (PAN2, MAP3K7CL, DLA) een essentieel diagnostisch en prognostisch hulpmiddel geworden. Het bevestigt de genetische aanleg en stratificeert het risico van het dier (laag, matig of hoog), wat helpt bij het adviseren van eigenaren.
- Klinische Biochemie : Het meten van het serum creatine kinase (CK) is nuttig. Een sterke verhoging is een indicator van een actieve myositis en spierschade. Echter, een normale CK-waarde sluit de diagnose niet uit, aangezien de spierbetrokkenheid minimaal, focaal of chronisch kan zijn met weinig actieve ontsteking.
Tabel 3: Diagnostische Modaliteiten voor Canine Dermatomyositis
|
Diagnostische Modaliteit |
Te Verwachten Resultaten / Belangrijke Afwijkingen |
|---|---|
|
Histopathologie van de Huid |
Interface dermatitis met weinig cellen, folliculaire atrofie, basale vacuolisatie, Civatte-lichaampjes, dermale fibrose/mucinose, “smudged collagen” |
|
Histopathologie van de Spieren |
Interstitiële en perivasculaire myositis (lymfo-plasmacytair), degeneratie/regeneratie/atrofie van spiervezels |
|
Elektromyografie (EMG) |
Abnormale spontane activiteit: fibrillatiepotentialen, positieve scherpe golven, myotone/bizarre hoogfrequente ontladingen |
|
Genetische Test (3 loci) |
Identificatie van risicogenen op de loci PAN2, MAP3K7CL et DLA ; berekening van een risicoscore (Laag, Matig, Hoog) |
|
Biochemie (Creatine Kinase) |
Verhoging (vaak sterk) bij actieve myositis, maar kan normaal zijn in chronische vormen of bij geringe spierbeschadiging |
Therapeutische Strategieën en Beheer in 2025
Prognose en Lange Termijn Evolutie
De prognose van canine DM is zeer variabel en hangt af van een veelvoud aan factoren. Begrip van deze indicatoren en de evolutionaire profielen van de ziekte is essentieel om eigenaren realistische verwachtingen te geven en om langdurig beheer aan te passen.
4.1 Prognostische Indicatoren: De Toekomst Voorspellen
Verschillende factoren maken het mogelijk om de waarschijnlijke evolutie van de aandoening bij een bepaalde hond in te schatten.
- Klinische Factoren:
-
- Ernst van de Aandoening : Dit is de directe prognostische factor. Lichte gevallen, met slechts enkele niet-ulceratieve huidlaesies, hebben een uitstekende prognose en kunnen zelfs spontaan in remissie gaan zonder gevolg. Matige gevallen hebben een goede controlerende prognose, maar vaak met resterende cicatriciële alopecia. Ernstige gevallen, met uitgebreide ulceraties en/of significante spierbetrokkenheid, hebben een voorbehouden tot slechte prognose.
- Spier- en Oesofageale Betrokkenheid : De aanwezigheid van een klinisch significante myopathie, en met name de ontwikkeling van een megaoesofagus, verslechtert de prognose aanzienlijk. Het risico op ondervoeding, verslikken en aspiratiepneumonie wordt een belangrijke levensbedreiging.
- Demografische Factoren : Een retrospectieve studie van 177 gevallen van ischemische dermatopathie (exclusief de klassieke familiale DM) identificeerde twee factoren geassocieerd met een slechtere evolutie: een lichaamsgewicht van minder dan 10 kg en een hogere leeftijd op het moment van de biopsie.
- Genetische Factor : De integratie van het genetische risicoprofiel (gebaseerd op de 3 loci) in de prognostische evaluatie vertegenwoordigt een belangrijke vooruitgang. Deze test maakt het mogelijk om van een reactieve prognose, die gebaseerd is op reeds aanwezige klinische symptomen, naar een proactieve en voorspellende prognose te gaan. Een Collie- of Shetland-puppy die bij de geboorte wordt getest en een hoog-risico-genotype vertoont (bijv. AABBCC) heeft een intrinsiek meer voorbehoudende prognose, zelfs vóór het verschijnen van enig klinisch teken. Er wordt voorspeld dat hij de aandoening eerder en mogelijk in ernstiger vorm zal ontwikkelen. Deze informatie maakt een vroege stratificatie van patiënten mogelijk en de implementatie van versterkt toezicht en een agressieve therapeutische interventiestrategie bij de eerste tekenen, wat het langdurige resultaat zou kunnen verbeteren.
4.2 Evolutie van de Aandoening en Langdurig Beheer
Naar analogie met humane DMJ kan canine DM verschillende evolutionaire patronen volgen in de loop der tijd.
- Evolutionaire Profielen :
-
- Monocyclisch : De aandoening uit zich in een enkele episode, vaak bij licht aangetaste dieren, die in volledige remissie gaat (soms spontaan) en niet terugkeert. De prognose is uitstekend.
- Polycyclisch : De aandoening evolueert in opflakkeringen, met periodes van remissie afgewisseld met herhalingen. Deze opflakkeringen worden vaak geïnitieerd door uitlokkende factoren (UV-blootstelling, traumata, oestrus). De beheersing is gericht op het controleren van de opflakkeringen en verlengen van de remissieperiodes.
- Chronisch-Continu : De aandoening blijft persistent actief, zonder volledige remissieperiodes. Deze gevallen vereisen levenslange behandeling en worden geassocieerd met de meest voorbehouden prognose.
- Chronisch Beheer : Het beheer van chronische vormen (polycyclisch of continu) is een uitdaging. Het doel is de ziekte onder controle te houden met de minimale effectieve dosis medicatie om cumulatieve bijwerkingen te beperken. Het gebruik van steroïdsparende agenten (zoals ciclosporine) en steeds vaker gerichte therapieën zoals JAK-remmers, staan centraal in deze strategie. Regelmatige klinische en biologische follow-up is essentieel om de behandeling aan te passen en het optreden van complicaties te monitoren, inclusief een potentieel verhoogd risico op nierziekte bij honden die lijden aan chronische, langdurige ontsteking.
Conclusie
In 2025 is canine dermatomyositis geëvolueerd van een mysterieuze erfelijke aandoening naar een complexe genetische aandoening waarvan de moleculaire mechanismen steeds beter worden begrepen. De erkenning van zijn etiopathogenie, gecentreerd rond een ischemische vasculopathie aangedreven door een ontregeling van de type I interferonroute en ondersteund door specifieke genetische interacties, heeft zijn klinische benadering getransformeerd.
Deze paradigmaverschuiving heeft diepgaande en concrete implicaties. De diagnose is geëvolueerd om genetische tests te integreren als een essentiële pijler naast histopathologie en elektromyografie, waardoor vroege risicostratificatie en een nauwkeurigere prognose mogelijk zijn. Op therapeutisch vlak is het arsenaal uitgebreid, van breedwerkende immunosuppressiva, effectief maar belast met bijwerkingen, naar gerichte therapieën die specifiek de geïdentificeerde pathogene routes blokkeren. Het gebruik van Janus Kinase-remmers, in het bijzonder, vertegenwoordigt de nieuwe grens van behandeling, wat hoop biedt op een effectievere en veiligere controle van de aandoening.
Toekomstige onderzoeksrichtingen zijn duidelijk. Ze moeten zich richten op het identificeren van risicoloci in andere hondenrassen, de grootschalige validatie van de effectiviteit en lange-termijnveiligheid van gerichte therapieën door gerandomiseerde klinische proeven, en de ontwikkeling van bloedbiomarkers (zoals de IFN-handtekening) voor niet-invasieve monitoring van ziekteactiviteit en verhoogde personalisatie van de behandeling. Het canine model van dermatomyositis, door zijn relevantie en complexiteit, zal een onschatbare bron blijven voor de vooruitgang in het begrip en de behandeling van deze slopende ziekte, zowel voor het welzijn van honden als voor de kennis die het bijdraagt aan de humane geneeskunde.
Referenties
- Evans, J. M., Noorai, R. E., Tsai, K. L., Starr-Moss, A. N., Hill, C. M., Anderson, K. J., Famula, T. R., & Clark, L. A. (2017). Beyond the MHC: A canine model of dermatomyositis shows a complex pattern of genetic risk involving novel loci. PLOS Genetics, 13(2), e1006604.
- Hargis, A. M., Prieur, D. J., Haupt, K. H., Collier, L. L., & Evermann, J. F. (1985). Familial canine dermatomyositis. Initial characterization of the cutaneous and muscular lesions. American Journal of Pathology, 121(3), 521–530.
- Rees, C. A., & Boothe, D. M. (2003). Therapeutic response to pentoxifylline and its active metabolites in dogs with familial canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234–241.
- Hargis, A. M., Prieur, D. J., Haupt, K. H., McDonald, T. L., & Moore, M. P. (1986). Prospective study of familial canine dermatomyositis. Correlation of the severity of dermatomyositis and circulating immune complex levels. American Journal of Pathology, 123(3), 465–479.
- Hargis, A. M., & Ginn, P. E. (2001). Canine inflammatory myopathies: a clinicopathologic review of 200 cases. Veterinaire Pathologie, 38(6), 688-699.
- Hargis, A. M., Haupt, K. H., Hegreberg, G. A., Prieur, D. J., & Moore, M. P. (1984). Familiaal canine dermatomyositis. Eerste karakterisering van de cutane en musculaire laesies. American Journal of Pathology, 116(2), 234–244.
- Hargis, A. M., & Prieur, D. J. (1987). Prospectieve studie van familiale canine dermatomyositis. Correlatie van de ernst van dermatomyositis en circulerende immuuncomplexen. American Journal of Pathology, 128(1), 129–139.
- Pumphrey, S. A., & Outerbridge, C. A. (2019). De rol van oclacitinib in het beheer van ischemische dermatopathie bij vier honden. Veterinaire Dermatologie, 30(4), 346-e100.
- Mandrioli, L., & Biserni, R. (2024). Een geval van refractaire nasale dermatomyositis-achtige ziekte bij een volwassen Poedel. ResearchGate.
- Errante, P. R. (2022). Dermatomyositis Ziekte bij Honden. Internationaal Tijdschrift voor Dierkunde en Dierbiologie, 5(8).
- Mendoza, F., & Toral, M. (2019). Drie gevallen van canine dermatomyositis-achtige ziekte. Acta Scientiae Veterinariae, 47, 1632.
- Mellett, M., & Allen, A. G. (2018). Etiopathogenese van dermatomyositis: een rebelse soldaat in de spier. Huidige Opinie in Reumatologie, 30(6), 610–616.
- Marie, I., Drouot, L., Menard, J. F., & Levesque, H. (2006). Langetermijnuitkomst en prognostische factoren van juveniele dermatomyositis: een multinationale, multicenterstudie van 490 patiënten. Artritis en Reuma, 54(11), 3683–3692.
- Kmieć, P., & Gomułkiewicz, A. (2021). De rol van interferonen type I, II en III in myositis: een overzicht. Klinische en Experimentele Reumatologie, 39(4), 882-890.
- Greenberg, S. A., & Pinkus, J. L. (2011). Een breed moleculair profiel van dermatomyositishuid onthult prominente interferon-induceerbare genexpressie en demonstreert moleculaire gelijkenis met lupus huid. PLoS ONE, 6(12), e29161.
- Berger, D. (2016). Canine Dermatomyositis. Kliniek Samenvatting, 14(11), 50-52.
- Ghafour, A., & Isenberg, D. A. (2020). De immunopathogenese van dermatomyositis. Best Practice & Onderzoek Klinische Reumatologie, 34(4), 101533.
- Mandell, D. C., & Dehghanpir, S. D. (2021). Een update over de diagnose en behandeling van inflammatoire myopathieën. Journal of Clinical Medicine, 10(15), 3381.
- Main-Nolton, A., & Clark, L. A. (2022). Transcriptoomprofilering van familiaire dermatomyositishuidlaesies (DMS) bij honden en behandeling in Collies en Shetland sheepdogs. VIN.
- Santoro, D., & Pucheu-Haston, C. M. (2014). Effecten van pentoxifylline op in vivo en in vitro IgE-gemedieerde mestceldegranulatie en cutane ontsteking bij honden. Amerikaans Journal voor Veterinair Onderzoek, 75(2), 152–158.
- Olivry, T., & Banovic, F. (2019). Behandeling van canine atopische dermatitis: 2015 bijgewerkte richtlijnen van het Internationaal Comité voor Allergische Dieraandoeningen (ICADA). Veterinaire Dermatologie, 30(3), 169-e50.
- Cosgrove, S. B., Cleaver, D. M., King, V. L., Gilmer, A. R., Daniels, A. E., Wren, J. A., & Stegemann, M. R. (2013). Een geblindeerde, gerandomiseerde, placebogecontroleerde studie van de effectiviteit en veiligheid van de Janus kinase-remmer oclacitinib (Apoquel®) bij door cliënten gehouden honden met atopische dermatitis. Veterinaire Dermatologie, 25(2), 91-e23.
- Gortel, K. (2006). Wat is er nieuw in dermatologische therapie? DVM360.
- Rees, C. A., & Boothe, D. M. (2004). Therapeutische respons op pentoxifylline en de actieve metabolieten bij honden met familiale canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234-241.
- Archer, T. M., & Boothe, D. M. (2004). Cyclosporine: een overzicht van het gebruik in de veterinaire dermatologie. Veterinaire Dermatologie, 15(6), 349–361.
- Robson, D. C. (2014). Cyclosporine in Veterinary Dermatology. Procedures van de 39e World Small Animal Veterinary Association World Congress.
- Alexishcheva, A., & Guryeva, S. (2024). Interferon-kenmerk als biomarker van ziekteactiviteit bij patiënten met refractaire juveniele dermatomyositis. Frontiers in Medicine, 11, 1214920.
- Navale, S., & De, A. (2024). Klinische Vooruitgang in Mesenchymale Stamceltherapie: Een Focus op Reumatische Ziekten. ResearchGate.
- de Mello, M. F., & Hagiwara, M. K. (2007). Canine ischemische dermatopathie: een retrospectieve studie van 177 gevallen (2005-2016). Veterinaire Dermatologie, 28(5), 485-e117.
- Gury, T., & Seror, R. (2024). Prognostische factoren en langetermijnuitkomst bij honden gediagnosticeerd met primaire en secundaire immuun trombocytopenie in Ierland. Journal of Small Animal Practice.
- Fantini, D., & Ciliberto, G. (2022). Nieuwe Behandeling van Kauwspiermyositis bij Drie Honden met een Selectieve Janus Kinase (JAK)-1 Remmer. ResearchGate.
- Masi, G., & D’Alessandro, A. (2024). Recente vooruitgang in onderzoek naar dermatomyositis. Uptocure.
- Ardalan, K., & Marques, M. C. (2025). Psychometrische eigenschappen van patiënt-gerapporteerde uitvoer-meetinformatie systeem (PROMIS) vaste korte formulieren in Juveniele Myositis. Seminars in Arthritis and Rheumatism, 71.
- Bartels, C., & Putterman, C. (2022). Juveniele dermatomyositis: updates in pathogenese en biomarkers. Huidige Reumatologie Rapporten, 24(10), 307-317.
- Ziskin, J., & Fiorentino, D. (2024). Recente vooruitgang in de behandeling van dermatomyositis. Huidige Opinie in Reumatologie, 36(3), 203-210.
- Mandl, T., & Lundberg, I. E. (2019). De rol van interferonen type I, II en III in myositis: een overzicht. Klinische en Experimentele Reumatologie, 37(5), 868-877.
- van der Kooi, A. J., & van de Vlekkert, J. (2023). Een inflammatoire myopathie bij de Nederlandse Kooikerhond: een studie van 119 gevallen. Journal of Veterinary Internal Medicine, 37(2), 643-653.
- Viviano, K. R. (2016). Cyclosporine: een overzicht van het gebruik in de veterinaire geneeskunde. Veterinaire Klinieken van Noord-Amerika: Kleine Dierenpraktijk, 46(2), 245-265.
- Nuttall, T., & Gey, van Pittius, M. (2023). Immunosuppressieve Therapie in de Kleine Diergeneeskunde. Today’s Veterinary Practice.