In de veterinaire dermatologie vertegenwoordigen weinig micro-organismen een even constante en complexe klinische uitdaging als Pseudomonas aeruginosa. Deze Gram-negatieve bacil is verre van een simpel infectieus agens en blijkt een geduchte tegenstander te zijn, een opportunistische pathogeen bij uitstek die met verontrustende efficiëntie elke verstoring van de huidbarrière of elke immuundeficiëntie van de gastheer uitbuit.
Inleiding
De infecties die het veroorzaakt, voornamelijk chronische externe otitis en diepe pyodermitis, worden vaak gekenmerkt door hun ernst, chroniciteit en therapieresistente aard.
Het beheer van deze aandoeningen wordt bijzonder bemoeilijkt door twee fundamentele biologische kenmerken van deze pathogeen. Enerzijds bezit P. aeruginosa een intrinsieke resistentie tegen talrijke klassen van antibiotica, een vermogen dat wordt aangevuld door een opmerkelijk vermogen om nieuwe resistentiemechanismen te verwerven, wat leidt tot de opkomst van multiresistente (MDR) stammen. Anderzijds vormt het vermogen om biofilms te vormen — gestructureerde bacteriële gemeenschappen beschermd door een extracellulaire matrix — een ware vesting die bescherming biedt tegen de immuunafweer van de gastheer en antimicrobiële middelen. Deze dubbele verdedigings- en persistentiestrategie is de belangrijkste oorzaak van therapeutische mislukkingen en frustrerende recidieven voor de clinicus.
Tegenover deze groeiende problematiek is een simplistische of empirische therapeutische benadering gedoemd te mislukken. Deze synthese heeft tot doel een exhaustieve en geïntegreerde analyse te bieden, gebaseerd op de meest recente wetenschappelijke gegevens, voor het beheer van dermatologische infecties door P. aeruginosa. Dit referentieartikel zal de biologie en pathogenese van dit micro-organisme in detail beschrijven, een beredeneerde en gestructureerde diagnostische aanpak voorstellen, en multimodale therapeutische strategieën diepgaand verkennen. Bijzondere aandacht zal worden besteed aan de kritische interpretatie van het antibiogram in het licht van de nieuwe aanbevelingen, het beheer van multiresistente infecties en de evaluatie van veelbelovende therapeutische innovaties, zoals anti-biofilmmiddelen en faagtherapie. De ambitie van dit werk is om de clinicus de conceptuele en praktische instrumenten te verschaffen die nodig zijn om het beheer van deze complexe gevallen te transformeren van een onzekere strijd naar een beheerste en effectieve therapeutische strategie.
1. Pseudomonas aeruginosa: Portret van een Geduchte Opportunistische Pathogeen
1.1. Ecologie en Microbiologische Kenmerken
Het begrijpen van de aard van Pseudomonas aeruginosa begint met de erkenning van zijn alomtegenwoordigheid. Dit micro-organisme is alomtegenwoordig in het milieu en koloniseert gemakkelijk bodem, zoet water, plantenoppervlakken en ontbindend organisch materiaal. Deze ecologische plasticiteit verklaart niet alleen zijn frequente aanwezigheid als simpele milieuvervuiling, maar ook zijn prominente rol in nosocomiale infecties, waar het kan overleven en zich kan vermenigvuldigen in reservoirs zo gevarieerd als desinfectantia, wastafels of medische apparatuur. Het is fundamenteel om op te merken dat P. aeruginosa geen deel uitmaakt van de commensale microflora van de externe gehoorgang of de gezonde huid van de hond. De aanwezigheid ervan in een dermatologisch monster is daarom altijd klinisch significant.
Op microbiologisch gebied betreft het een Gram-negatieve bacil, strikt aeroob, die zich onderscheidt door zijn mobiliteit, verzekerd door een enkele polaire flagel. Zijn minimale voedingseisen en zijn vermogen om een breed scala aan fysisch-chemische omstandigheden te tolereren, inclusief temperaturen tot 42°C, geven het een uitzonderlijk overlevings- en aanpassingsvermogen, waardoor het vijandige omgevingen kan koloniseren waar weinig andere bacteriën kunnen overleven.
1.2. Arsenaal van Virulentie: Van Toxinen tot Enzymen
Het pathogene vermogen van P. aeruginosa ligt niet in één toxine, maar in een complex en redundant arsenaal van virulentiefactoren die synergetisch werken om weefsels binnen te dringen, aan de immuunrespons te ontsnappen en cellulaire schade te veroorzaken.
Tot de bekendste factoren behoren zijn pigmenten. Pyocyanine, een blauwgroene pigment dat de karakteristieke kleur geeft aan “pyocyanisch” pus, is niet slechts een visuele marker. Het oefent krachtige pro-inflammatoire effecten uit op fagocyten en verstoort de immuunfuncties van epitheelcellen, waardoor het actief bijdraagt aan de pathogenese. De weefelinvasie wordt op zijn beurt vergemakkelijkt door een batterij extracellulaire enzymen. Elastase breekt collageen en elastine af, belangrijke componenten van de extracellulaire matrix, terwijl alkalische protease interfereert met de vorming van fibrine, waardoor de insluiting van de infectie wordt verhinderd. Fosfolipasen breken de fosfolipiden van celmembranen af, wat leidt tot cellulaire lysis.
Aan dit arsenaal worden krachtige toxinen toegevoegd. Het cytotoxine (of leucocidine) en de hemolysinen richten zich op en vernietigen immuuncellen en erytrocyten. Bovendien gebruikt P. aeruginosa geavanceerde secretiesystemen, zoals het type III secretiesysteem (T3SS), dat werkt als een moleculaire spuit om toxische effectoren (exotoxinen S en A) direct in het hart van de gastheercellen te injecteren. Deze exotoxinen verlammen cellulaire functies, met name fagocytose, en induceren gelokaliseerde weefselnecrose, waardoor een omgeving ontstaat die gunstig is voor bacteriële proliferatie.
1.3. Biofilmvorming: Een Bacteriële Vesting
Misschien wel de meest bepalende virulentiefactor in de chroniciteit van P. aeruginosa-infecties is zijn vermogen om een biofilm te vormen. Het gaat niet om een simpele aggregatie van bacteriën, maar om een hooggeorganiseerde microbiële gemeenschap, ingebed in een zelfgeproduceerde matrix van exopolysacchariden, voornamelijk bestaande uit alginaat. Deze stroperige matrix verankert de bacteriën stevig aan het oppervlak van de gehoorgang of de geulcereerde huid en vormt een echte vesting.
Deze structuur biedt de bacterie meerdere voordelen. Ten eerste vormt het een fysieke barrière die beschermt tegen fagocytaire cellen van het immuunsysteem en de penetratie van antibiotica aanzienlijk beperkt. Studies hebben aangetoond dat bacteriën georganiseerd in biofilm honderden, zelfs duizenden keren resistenter kunnen zijn tegen antimicrobiële middelen dan hun planktonische (vrije) tegenhangers. Ten tweede communiceren de bacteriën binnen de biofilm met elkaar via een systeem van chemische signalen genaamd quorum sensing. Dit mechanisme, afhankelijk van de celdichtheid, stelt hen in staat om de expressie van virulentiegenen en verdedigingsstrategieën op collectieve wijze te coördineren, waarbij ze zich gedragen als een meercellig organisme.
De klinische impact van deze strategie is aanzienlijk. De prevalentie van biofilmvorming door klinische isolaten van P. aeruginosa afkomstig van caniene otitis is extreem hoog, gerapporteerd in 40% tot meer dan 90% van de gevallen volgens studies. Een grote Europese studie heeft zelfs onthuld dat 82% van de isolaten in staat was om sterke biofilms te vormen. Dit vermogen is een directe oorzaak van therapeutisch falen, persistentie van infectie ondanks schijnbaar aangepaste antibioticatherapie, en de vestiging van destructieve chronische ontsteking.
1.4. Mechanismen van Antibioticaresistentie: Intrinsieke en Verworven Strategieën
Het formidabele vermogen van P. aeruginosa om weerstand te bieden aan antibiotica berust op een dubbele strategie: een natuurlijke (intrinsieke) resistentie en een uitzonderlijk aanpassingsvermogen (verworven resistentie).
De intrinsieke resistentie is een inherent kenmerk van de soort. Het is voornamelijk te wijten aan de lage permeabiliteit van zijn buitenmembraan, die de toegang van vele moleculen beperkt. Hieraan wordt een arsenaal van effluxpompen toegevoegd, membraaneiwitten die antibiotica actief uit de cel pompen voordat ze hun doelwit bereiken. Tot slot drukt P. aeruginosa constitutief een chromosomaal β-lactamase (AmpC) uit, een enzym dat bepaalde penicillines en cefalosporines kan inactiveren.
De verworven resistentie is nog zorgwekkender. Het is het resultaat van spontane chromosomale mutaties of, vaker, de acquisitie van mobiel genetisch materiaal (plasmiden, transposons) door horizontale overdracht van andere bacteriën. Deze mechanismen stellen de bacterie in staat om resistenties te ontwikkelen tegen klassen van antibiotica waarvoor het aanvankelijk gevoelig was, wat leidt tot de opkomst van multiresistente (MDR) fenotypes. De belangrijkste verworven mechanismen omvatten de productie van aanvullende inactiverende enzymen (zoals extended-spectrum β-lactamasen of carbapenemases), modificatie van het antibioticumdoelwit (bijvoorbeeld mutaties in DNA-gyrase genen die resistentie tegen fluoroquinolonen verlenen) of overexpressie van effluxpompen.
Deze combinatie van agressieve virulentie, bescherming door de biofilm en meervoudige resistentiemechanismen maakt P. aeruginosa een bijzonder moeilijk uit te roeien pathogeen. Zijn klinisch succes is niet het resultaat van één enkele factor, maar van een geïntegreerde en synergetische overlevingsstrategie. De bacterie gebruikt eerst zijn enzymen en toxinen om zich te vestigen en weefsels te beschadigen. Vervolgens bouwt het zijn vesting, de biofilm, om zichzelf te beschermen tegen de eerste verdedigingsgolven van de gastheer en behandelingen. Veilig verschanst heeft het de tijd om resistentiegenen te ontwikkelen en uit te wisselen, waarbij het zich bewapent voor toekomstige aanvallen. Elke therapeutische benadering die deze globale strategie niet in aanmerking neemt, is onvermijdelijk gedoemd te mislukken. De behandeling moet daarom multimodaal zijn, gelijktijdig gericht op het ontmantelen van de vesting, het neutraliseren van de pathogenen en het herstellen van de schade toegebracht aan de gastheer.
Tabel 1: Belangrijkste Virulentiefactoren van P. aeruginosa en Hun Pathogene Rollen
|
Virulentiefactor |
Categorie |
Belangrijkste Pathogene Rol |
|
Pyocyanine |
Pigment |
Verstoring van de immuunrespons, oxidatieve stress, pro-inflammatoire effecten |
|
Elastase, Alkalische protease |
Extracellulaire enzymen |
Vernietiging van extracellulaire matrix (collageen, elastine), weefelinvasie |
|
Fosfolipase C |
Extracellulair enzym |
Lysis van gastheercellen door afbraak van lipidemembranen |
|
Exotoxine A, Exoenzym S |
Toxinen (T3-secretiesysteem) |
Remming van eiwitbiosynthese, apoptose van gastheercellen, verlamming van fagocyten |
|
Lipopolysaccharide (LPS) |
Membraancomponent |
Inductie van sterke inflammatoire respons, septische shock |
|
Alginaat / Biofilm |
Beschermende matrix |
Bescherming tegen antibiotica en immuunsysteem, adhesie, chronische persistentie |
|
Effluxpompen |
Resistentiemechanisme |
Actieve uitdrijving van meerdere klassen antibiotica uit de bacteriële cel |
|
β-lactamasen (AmpC, etc.) |
Resistentie-enzymen |
Enzymatische inactivering van antibiotica uit de β-lactam familie |
2. Klinische Manifestaties en Epidemiologie
2.1. Otitis door Pseudomonas aeruginosa
Otitis door Pseudomonas aeruginosa vertegenwoordigt een van de meest ernstige en meest frustrerende klinische entiteiten in de caniene dermatologie. Het is cruciaal om te begrijpen dat het zelden een primaire infectie is. Het is bijna systematisch een complicatie van een chronische of recidiverende externe otitis, aanvankelijk veroorzaakt door proliferatie van andere agentia, typisch gisten (Malassezia pachydermatis) of kokken (Staphylococcus pseudintermedius). De progressie naar een Pseudomonas-infectie is een echte pathologische escalatie, bevorderd door een reeks factoren. De predisponerende factoren (oorconformatie met een nauwe gehoorgang of een hangend oorschelp, overmatige vochtigheid), de primaire factoren (de initiële oorzaak van de ontsteking, zoals atopische dermatitis, een voedselallergie of een corpus alienum) en de perpetuerende factoren (pathologische veranderingen van de gehoorgang zoals hyperplasie van de cerumineuze klieren, stenose, of een gescheurd trommelvlies) creëren een ideale micro-omgeving voor kolonisatie door deze opportunistische pathogeen.
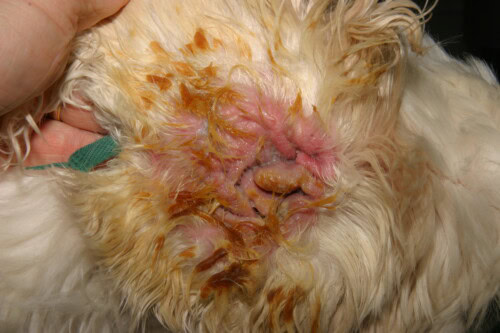
Ernstige Pseudomonas Otitis bij een Cocker
De klinische presentatie is vaak karakteristiek. De aantasting is frequent unilateraal, hoewel het bilateraal kan zijn in de context van een onderliggende allergische ziekte. Het manifesteert zich door intense oorpijn, vaak meer uitgesproken dan jeuk, ernstige erythemateuze ontsteking van de gehoorgang, en ulceraties van het epitheel. Het meest suggestieve teken is de aard van het exsudaat: het is typisch overvloedig, mucoïde of purulent, stinkend, en van een karakteristieke geelgroene kleur te wijten aan de productie van bacteriële pigmenten. In ernstige gevallen kan dit exsudaat hemorragisch zijn. Aandachtig onderzoek van de oorschelp en de ingang van de gehoorgang kan de aanwezigheid van plakkerige plekken onthullen, een directe klinische manifestatie van de bacteriële biofilm. Een belangrijke en frequente complicatie is de uitbreiding van de infectie naar het middenoor. Men schat dat meer dan 80% van de honden met chronische externe otitis door Pseudomonas een gelijktijdige media-otitis vertonen. Deze kan zich manifesteren door neurologische tekenen zoals het Horner-syndroom, verlamming van de nervus facialis of vestibulaire stoornissen.
Op epidemiologisch niveau is externe otitis een zeer veel voorkomende aandoening, die 10% tot 20% van de caniene populatie treft. Binnen deze populatie stelt P. aeruginosa zich op als de meest frequent geïsoleerde pathogeen in chronische en therapieresistente gevallen, geassocieerd met bijna 35% van deze ernstige vormen. Andere studies, uitgevoerd op specifieke populaties van honden met otitis, rapporteren prevalenties variërend van 25% tot meer dan 50%.
2.2. Pyodermitis door Pseudomonas aeruginosa
Hoewel minder frequent dan otitis, zijn pyodermitis door P. aeruginosa vaak spectaculaire en ernstige aandoeningen. Ze presenteren zich over het algemeen in twee hoofdvormen.
De acute diepe pyodermitis is de meest dramatische vorm. Het kenmerkt zich door het plotselinge optreden van extreem pijnlijke laesies, klassiek gelokaliseerd langs de ruglijn. Het klinisch onderzoek onthult meerdere circinaire ulcera (ringvormig), hemorragische korsten en furunkels die een bloederig exsudaat kunnen laten lekken. De algemene toestand van het dier is vaak aangetast, met apathie en koorts.
Het intertrigo (of huidploidermatitis) door Pseudomonas is een andere presentatie. Het ontwikkelt zich in gebieden van huidplooien waar maceratie en frictie gunstige omstandigheden creëren (gelaatsplooien bij brachycefale rassen, staartplooi, vulvaplooien). De laesies bestaan uit erosies en diepe ulceraties, bedekt met een groenachtig, dik en bijzonder kleverig exsudaat, zeer suggestief voor de betrokkenheid van deze kiem.
De exacte prevalentie van pyodermitis door Pseudomonas is minder goed gedocumenteerd dan die van otitis. Studies over caniene huidinfecties hebben echter P. aeruginosa geïdentificeerd in ongeveer 11% tot 13% van de gevallen. Een studie uitgevoerd in Roemenië over oppervlakkige huidinfecties isoleerde de kiem in bijna 34% van de pyodermitis-monsters.
Het optreden van een infectie door P. aeruginosa, of het nu in het oor of op de huid is, moet door de clinicus worden geïnterpreteerd als een alarmsignaal. Het is geen toevallige gebeurtenis, maar het hoogtepunt van een pathologische cascade. Chroniciteit is de belangrijkste risicofactor. Aanhoudende ontsteking, vochtigheid, en vooral herhaalde antibioticabehandelingen, vaak breed spectrum, creëren een intense selectiedruk. Ze elimineren de beschermende commensale flora en de meest gevoelige pathogenen, waardoor het veld vrij blijft voor P. aeruginosa, intrinsiek resistenter en perfect aangepast aan deze vijandige en gemodificeerde omgeving. Bijgevolg is de identificatie van P. aeruginosa niet het einde van de diagnose, maar het begin van een diepgaander onderzoek. Het vereist een rigoureus zoeken naar de primaire oorzaak (allergie, endocriene stoornis, enz.) die deze “crisis” mogelijk heeft gemaakt. Zonder het beheer van deze initiële factor zal elke behandelingspoging van de Pseudomonas-infectie, zelfs met het meest krachtige antibioticum, slechts een tijdelijk uitstel zijn voor een onvermijdelijk recidief.
3. Beredeneerde Diagnostische Aanpak
Het effectief beheer van een infectie door P. aeruginosa berust op een gestructureerde en hiërarchische diagnostische aanpak. Het doel is niet alleen om de pathogeen te identificeren, maar ook om de context van zijn ontwikkeling te begrijpen, de omvang van de laesies te evalueren en een gerichte en rationele therapie te begeleiden.
3.1. Klinisch en Otoscopisch Onderzoek: Cruciale Initiële Stappen
Elke diagnostische aanpak begint met een rigoureuze anamnese en een volledig klinisch onderzoek. Het ondervragen van de eigenaar moet tekenen van onderliggende ziekten zoeken, met name jeuk buiten de oren, spijsverteringsstoornissen of recidiverende huidinfecties die kunnen wijzen op atopische dermatitis of een voedselallergie. Tekenen van polyurie-polydipsie of gewichtstoename kunnen wijzen op een endocrinopathie. Het dermatologisch onderzoek moet exhaustief zijn, omdat otitis vaak slechts een van de manifestaties is van een meer globale dermatose.
Het otoscopisch onderzoek is een fundamentele stap. Het gebruik van een video-otoscoop is ideaal, omdat het superieure vergroting, verlichting en opnamemogelijkheden biedt, wat nauwkeurige evaluatie en opvolging vergemakkelijkt. Otoscopie maakt het mogelijk om de toestand van de externe gehoorgang te beoordelen: mate van erytheem, aanwezigheid van ulceraties, weefselproliferaties (stenose), of massa’s. Het is ook essentieel voor het evalueren van de integriteit van het trommelvlies. Een gescheurd, bollend of verkleurd membraan is een sterk teken van aantasting van het middenoor. De visualisatie van purulent exsudaat en ulcera is zeer suggestief voor een infectie door Gram-negatieve bacillen.
3.2. Cytologisch Onderzoek: Een Eerstelijnsinstrument voor Diagnose
Het cytologisch onderzoek van het oor is het belangrijkste, snelste en meest kosteneffectieve aanvullend onderzoek in het beheer van otitis. Het moet systematisch worden uitgevoerd bij elke consultatie voor otitis. De bemonstering wordt uitgevoerd met behulp van een wattenstaafje, waarbij geprobeerd wordt de verbinding tussen de verticale en horizontale gehoorgang te bereiken, waar de secreties het meest representatief zijn voor de infectie. Het monster wordt vervolgens uitgestreken op een objectglaasje, gekleurd (bijvoorbeeld met een snelle Romanowsky-kleuring) en onderzocht onder de microscoop.
In de context van een infectie door P. aeruginosa zijn de resultaten vaak karakteristiek. De observatie van bacteriën in de vorm van staafjes (bacillen), vaak in grote aantallen, is het belangrijkste aanwijzende teken. Deze bacillen gaan typisch gepaard met een dichte inflammatoire populatie, voornamelijk bestaande uit gedegenereerde neutrofielen, wat wijst op een actieve en purulente infectie. Cytologie biedt een quasi-onmiddellijke diagnostische en therapeutische oriëntatie, waardoor een gerichte topische behandeling tegen Gram-negatieve bacillen kan worden gestart zonder te wachten op de resultaten van een kweek.
3.3. Bacteriële Kweek en Antibiogram: Indicaties en Bemonsteringsprotocol
De bacteriële kweek met antibiogram is geen routineonderzoek voor een eerste ongecompliceerde otitis. De voorschrijving ervan moet beredeneerd zijn en voorbehouden voor specifieke klinische situaties waar het cruciale informatie oplevert voor de verdere behandeling:
- Bevestigde aanwezigheid van bacillen bij cytologisch onderzoek, vooral als de infectie chronisch of recidiverend is.
- Falen van een goed uitgevoerde empirische eerstelijnsbehandeling.
- Noodzaak om een systemische antibioticatherapie te overwegen, met name in geval van bewezen media-otitis of geassocieerde diepe pyodermitis. In dit geval is het antibiogram essentieel om de keuze van het molecuul te begeleiden.
Het bemonsteringsprotocol is kritiek voor de betrouwbaarheid van het resultaat. Het monster moet op de meest aseptische manier mogelijk worden genomen, idealiter in het diepe gedeelte van de gehoorgang. Bij vermoeden van media-otitis met een intact trommelvlies is de enige manier om een representatief monster van de bulla tympanica te verkrijgen het uitvoeren van een myringotomie. Deze handeling, uitgevoerd onder algemene anesthesie en video-otoscopische begeleiding, bestaat uit het steriel perforeren van het trommelvlies om de inhoud van het middenoor te aspireren voor cytologische analyse en kweek.
3.4. Medische Beeldvorming in de Exploratie van Media-Otitis
Wanneer aantasting van het middenoor wordt vermoed (op basis van klinische tekenen, otoscopie of therapeutisch falen), wordt medische beeldvorming een essentieel diagnostisch instrument. Het maakt het mogelijk om de aantasting te bevestigen, de ernst ervan te evalueren en een eventuele chirurgische interventie te plannen.
De scanner (computertomografie of CT-scan) wordt beschouwd als de beeldvormingsmethode bij uitstek. Het biedt een uitstekende resolutie voor het visualiseren van botstructuren, met name de wand van de bulla tympanica (zoeken naar botlyse) en de gehoorbeentjes, evenals voor het detecteren van de aanwezigheid van vloeistof of abnormaal zacht weefsel in het middenoor. Magnetic resonance imaging (MRI) is een alternatief dat een betere visualisatie van zachte weefsels biedt en bijzonder geïndiceerd is bij vermoeden van een tumormassa of uitbreiding van de infectie naar omliggende zenuwstructuren.
Deze sequentiële aanpak, gaande van snelle cytologie tot geavanceerde beeldvorming, belichaamt een rationele diagnostische benadering. Elk aanvullend onderzoek wordt niet willekeurig voorgeschreven, maar is gericht op het beantwoorden van een specifieke klinische vraag die zich in een bepaald stadium van het proces voordoet. Cytologie oriënteert de initiële behandeling. Het falen van deze behandeling roept de vraag op van resistentie (antwoord door kweek) of anatomische uitbreiding (antwoord door scanner). Deze hiërarchie voorkomt ongefundeerde therapeutische escalatie en bevordert rationeel gebruik van antibiotica en kostbare onderzoeken.
4. Geïntegreerde Therapeutische Strategieën
De behandeling van infecties door P. aeruginosa is een veeleisend proces dat een multimodale en volhardende aanpak vereist. Succes berust niet op één “wondermolecuul”, maar op een geïntegreerde strategie gericht op het elimineren van de pathogeen, het beheersen van de ontsteking, het corrigeren van onderliggende factoren en het herstellen van een gezonde auriculaire omgeving.
4.1. Fundamentele Principes: Beheer van de Primaire Oorzaak en Controle van Ontsteking
Het meest fundamentele principe, en toch soms verwaarloosd, is dat de langetermijnbehandeling van Pseudomonas-infectie onlosmakelijk verbonden is met de identificatie en het beheer van de primaire oorzaak van otitis. Of het nu gaat om een allergie, een endocrinopathie of een massa, de controle ervan is de enige garantie tegen recidieven. De Pseudomonas-infectie is een gevolg; alleen het gevolg behandelen zonder de oorzaak aan te pakken is een therapeutische impasse.
Parallel is de controle van ontsteking een pijler van de behandeling. Chronische ontsteking veroorzaakt oedeem, pijn, hyperplasie van de talg- en cerumineuze klieren, en stenose van de gehoorgang. Deze veranderingen bestendigen de infectie en verhinderen de penetratie van topische behandelingen. Het gebruik van glucocorticoïden, topisch en/of systemisch (bijvoorbeeld prednisolon in anti-inflammatoire dosis), is daarom cruciaal in de initiële fase. Ze maken het mogelijk om de gehoorgang te “heropenen”, de productie van exsudaat te verminderen, het comfort van het dier te verbeteren en bijgevolg de werkzaamheid van antimicrobiële middelen te verhogen.
4.2. Topische Therapie: Hoeksteen van de Behandeling
Topische therapie staat centraal in de therapeutische strategie, omdat alleen dit het mogelijk maakt om concentraties van antimicrobiële middelen op de plaats van infectie te bereiken die veel hoger zijn dan die verkregen via systemische toediening. De werkzaamheid hangt af van twee belangrijke stappen: reiniging en toepassing van gerichte middelen.
De oorreiniging is een niet-onderhandelbare stap. Het purulente exsudaat en de biofilm fungeren als een fysieke barrière en kunnen bepaalde antibiotica chemisch inactiveren, met name aminoglycosiden. Een grondige initiële reiniging, uitgevoerd onder algemene anesthesie met overvloedige irrigatie, is vaak onmisbaar om de meerderheid van het vuil te verwijderen. Vervolgens zijn regelmatige reinigingen thuis door de eigenaar nodig om de gehoorgang schoon te houden.
De werkzaamheid van topische therapie kan aanzienlijk worden verhoogd door het gebruik van oplossingen die Tris-EDTA bevatten. EDTA (ethyleendiaminetetra-azijnzuur) is een chelator die zich bindt aan metaalionen (calcium, magnesium) die essentieel zijn voor de stabiliteit van het buitenmembraan van Gram-negatieve bacteriën. Door dit membraan te destabiliseren, maakt Tris-EDTA het meer permeabel voor antibiotica, waardoor hun werking wordt versterkt. Studies hebben aangetoond dat het de werkzaamheid van fluoroquinolonen en aminoglycosiden tegen P. aeruginosa significant verhoogt. Het optimale protocol bestaat uit het inbrengen van de Tris-EDTA-oplossing in de gehoorgang en 20 tot 30 minuten wachten alvorens het antibioticum toe te passen, om de chelator de tijd te geven om te werken.
De keuze van het topische antimicrobiële middel moet weloverwogen zijn. Verschillende opties zijn beschikbaar:
- De fluoroquinolonen (marbofloxacine, enrofloxacine) en de aminoglycosiden (gentamicine, amikacine) zijn courante keuzes en vaak effectief. Voorzichtigheid is geboden met aminoglycosiden in geval van trommelvliesruptuur vanwege hun potentiële ototoxiciteit.
- De polymyxine B is een ander effectief antibioticum tegen P. aeruginosa.
- De zilversulfadiazine (SSD) is een bijzonder interessante optie, met name tegen multiresistente stammen. In de vorm van een 1% crème heeft het een uitstekende in vitro-activiteit aangetoond tegen caniene isolaten van P. aeruginosa, met zeer lage minimale remmende concentraties (MIC) (1-64 µg/mL), veel lager dan de concentratie van de commerciële bereiding. Het werkingsmechanisme, gericht op de celwand en het celmembraan, verschilt van dat van veel andere antibiotica.
4.3. Systemische Antibioticatherapie: Indicaties, Keuze en Risico’s
Antibioticatherapie via systemische weg is geen eerstelijnsbehandeling voor externe otitis, zelfs bij Pseudomonas. De bereikte concentraties in het cerumen en het epitheel van de gehoorgang zijn vaak onvoldoende. Het gebruik ervan moet worden voorbehouden voor specifieke en gerechtvaardigde indicaties:
- Media-otitis bevestigd door beeldvorming of otoscopie.
- Geassocieerde diepe pyodermitis.
- Ontsteking en weefselhyperplasie zo ernstig dat ze elke effectieve topische toepassing verhinderen.
- Bewezen falen van een agressieve en goed uitgevoerde topische behandeling.
De keuze van het molecuul moet imperatief worden begeleid door een antibiogram.
- De fluoroquinolonen zijn de enige oraal beschikbare klasse met betrouwbare activiteit. Echter, hoge doses, buiten vergunning, zijn vereist om effectief te zijn tegen P. aeruginosa: enrofloxacine 10-20 mg/kg/dag en marbofloxacine 5,5 mg/kg/dag. Opgemerkt moet worden dat resistentie zich snel kan ontwikkelen tijdens de behandeling.
- De parenterale (injecteerbare) opties omvatten de derde generatie cefalosporines (zoals ceftazidim) en de aminoglycosiden (amikacine, gentamicine). Het systemisch gebruik van aminoglycosiden is beperkt door hun risico op nefrotoxiciteit en ototoxiciteit, en vereist perfecte hydratatie van het dier en monitoring van de nierfunctie.
- De carbapenems (imipenem, meropenem) en de anti-pseudomonas penicillines (ticarcilline) zijn laatste-redmiddel-antibiotica, alleen te gebruiken voor gedocumenteerde multiresistente infecties, met respect voor de principes van antimicrobieel beheer om hun werkzaamheid in de humane en veterinaire geneeskunde te behouden.
- Opgemerkt moet worden dat deze laatste moleculen moeten worden gebruikt in overeenstemming met de geldende regelgeving en aanbevelingen van elk land, bijvoorbeeld de GEDAC voor Frankrijk.
Tabel 2: Doseringen van Systemische Anti-Pseudomonas Antibiotica bij de Hond
|
Molecuul |
Klasse |
Dosering (route) |
Klinische Opmerkingen / Voorzorgsmaatregelen |
|
Enrofloxacine |
Fluoroquinolon |
10–20 mg/kg/dag (PO, IV, SC) |
Vereist hoge doses. Resistentie kan zich snel ontwikkelen. |
|
Marbofloxacine |
Fluoroquinolon |
5,5 mg/kg/dag (PO) |
Maximale dosis vereist voor werkzaamheid tegen stammen met intermediaire gevoeligheid. |
|
Amikacine |
Aminoglycoside |
15–30 mg/kg/dag (IV, IM, SC) |
Risico op nefrotoxiciteit en ototoxiciteit. Zorg voor goede hydratatie en monitor de nierfunctie. |
|
Gentamicine |
Aminoglycoside |
10–14 mg/kg/dag (IV, IM, SC) |
Hoger toxiciteitsrisico dan amikacine. Monitoring vereist. |
4.4. Kritische Interpretatie van het Antibiogram volgens CLSI VET-Normen
Het antibiogram is een krachtig instrument, maar de interpretatie ervan moet niet passief zijn. Het Clinical and Laboratory Standards Institute (CLSI) heeft onlangs een belangrijke update gepubliceerd van de kritische drempelwaarden (breakpoints) voor fluoroquinolonen bij de hond, die hun interpretatie radicaal verandert.
De oude drempelwaarden, hoger, konden een stam classificeren als “Gevoelig” (S) die niet zou reageren op een behandeling met standaarddosis. De nieuwe drempelwaarden zijn veel lager en introduceren een nieuwe categorie: “Gevoelig-Dosisafhankelijk” (SDD). Deze categorie geeft aan dat een stam met succes kan worden behandeld, maar alleen als de hoogste dosis van het goedgekeurde doseringsinterval wordt gebruikt.
Deze evolutie transformeert het antibiogram van een eenvoudig “S/I/R”-rapport in een echte voorschrijfgids. Bij een stam geclassificeerd als SDD weet de clinicus dat hij de maximale aanbevolen dosis moet voorschrijven (bijvoorbeeld 20 mg/kg/dag voor enrofloxacine) om kans op klinisch succes te hebben. Een standaarddosis gebruiken bij een SDD-stam is een voorspelbare oorzaak van therapeutisch falen en resistentieselectie.
Tabel 3: Herziene CLSI VET Kritische Drempelwaarden (2023) voor Enrofloxacine en Marbofloxacine bij de Hond (Orale Route)
|
Antibioticum |
Categorie en MIC-Drempelwaarde (µg/mL) |
Corresponderende Dosis |
|
Enrofloxacine (herzien) |
S ≤ 0.06 |
5 mg/kg/dag |
|
SDD 0.12–0.25 |
10–20 mg/kg/dag |
|
|
R ≥ 0.5 |
– |
|
|
Marbofloxacine (herzien) |
S ≤ 0.12 |
2,8 mg/kg/dag |
|
SDD 0.25 |
5,5 mg/kg/dag |
|
|
R ≥ 0.5 |
– |
Uiteindelijk moet de therapeutische strategie niet worden gezien als een simpele “antibiotische strijd” maar als een “ecosysteembeheer”. Het doel is niet alleen om P. aeruginosa uit te roeien, maar om een huid- of ooromgeving te herstellen waarin het niet meer kan prolifereren. Reiniging, Tris-EDTA en anti-inflammatoire middelen wijzigen de fysieke, chemische en immunologische omgeving. De behandeling van de primaire oorzaak corrigeert het fundamentele onevenwicht. In dit schema zijn antibiotica slechts een instrument, vaak tijdelijk, om de bacteriële last te verminderen terwijl de andere maatregelen het evenwicht herstellen. Succes wordt minder gemeten aan de genezing van de infectieuze episode dan aan de preventie van recidieven.
5. Beheer van Multiresistente Infecties en Toekomstperspectieven
De opkomst van P. aeruginosa multiresistente (MDR) stammen vormt de ultieme uitdaging in de veterinaire dermatologie. Bij een antibiogram dat weinig of geen gevoeligheden toont, moet de clinicus het idee van een eenvoudige oplossing loslaten en alternatieve en gecombineerde strategieën aannemen, terwijl hij zich richt op therapeutische innovaties die de strijd tegen bacteriële infecties herdefiniëren.
5.1. Gecombineerde Strategieën voor Multiresistente (MDR) Stammen
Het beheer van een MDR-infectie door P. aeruginosa berust op een intensivering van de multimodale aanpak. Elke component van de behandeling wordt kritiek. Een rigoureuze en herhaalde mechanische reiniging, vaak onder anesthesie, is de eerste stap om de biofilm fysiek te ontmantelen en de bacteriële last te verminderen. Het systematisch gebruik van Tris-EDTA als voorbehandeling wordt niet langer een optie maar een noodzaak om te proberen een gevoeligheid, zelfs gedeeltelijk, voor antibiotica te herstellen.
De keuze van topische middelen moet creatief zijn en gebaseerd op de weinige resterende opties. Zilversulfadiazine is vaak een uitstekende empirische keuze in deze context. De extemporane bereiding van topische oplossingen op basis van injecteerbare antibiotica, zoals ticarcilline of amikacine, kan worden overwogen, hoewel de stabiliteit van deze bereidingen een zorg is. Systemische antibioticatherapie, indien absoluut noodzakelijk, moet nauwgezet worden begeleid door het antibiogram, waarbij laatste-redmiddel-moleculen worden overwogen na een rigoureuze evaluatie van de baten-risicoverhouding.
5.2. Biofilmverstoring: De Rol van N-acetylcysteïne (NAC)
De erkenning van de biofilm als een vesting die bacteriën beschermt, heeft de weg geopend voor de zoektocht naar “anti-biofilm”-middelen. N-acetylcysteïne (NAC), een bekend mucolyticum, is naar voren gekomen als een zeer veelbelovende kandidaat. In vitro-studies hebben aangetoond dat NAC niet alleen directe antibacteriële activiteit bezit tegen otitispathogenen, waaronder P. aeruginosa, maar vooral in staat is om de biofilmmatrix te verstoren, deze te degraderen en zo de bacteriën die het herbergt bloot te leggen.
De in vitro-gegevens zijn overtuigend: NAC remt de groei van P. aeruginosa bij minimale remmende concentraties (MIC) van 5 tot 20 mg/mL, niveaus die als veilig worden beschouwd en haalbaar zijn bij topische toepassing. De associatie met Tris-EDTA zou een synergie van actie kunnen bieden, waarbij Tris-EDTA de bacteriële wand verzwakt terwijl NAC de extracellulaire matrix ontmantelt. Hoewel prospectieve klinische studies nog nodig zijn om de werkzaamheid in vivo te valideren, vertegenwoordigt NAC een adjuvante therapeutische optie van groot belang voor chronische infecties en biofilm-infecties, als aanvulling op antimicrobiële behandelingen.
5.3. Innovatieve Therapieën: Faagtherapie als Veelbelovend Alternatief
Geconfronteerd met de impasse van antibioticaresistentie, wendt de wetenschappelijke gemeenschap zich tot radicaal andere benaderingen, en faagtherapie is een van de meest veelbelovende. Deze techniek maakt gebruik van bacteriofagen (of fagen), virussen die de natuurlijke roofdieren van bacteriën zijn. Zogenaamde “lytische” fagen infecteren een specifieke doelbacterie, repliceren binnenin, en laten deze vervolgens barsten (lysis), waarbij tientallen nieuwe virale deeltjes vrijkomen die klaar zijn om naburige bacteriën te infecteren.
De voordelen van deze benadering zijn veelvoudig. Fagen bezitten een hoge specificiteit, waarbij ze alleen de pathogene bacterie targeten zonder de nuttige microflora van de gastheer aan te tasten. Ze hebben het vermogen om zich te zelf-repliceren op de plaats van infectie zolang hun doelwit aanwezig is. Vooral zijn ze effectief tegen multiresistente bacteriën, omdat hun werkingsmechanisme volledig onafhankelijk is van antibioticagevoeligheid. Bovendien produceren veel fagen enzymen die de matrix van biofilms kunnen afbreken, waardoor ze deze beschermende structuur kunnen binnendringen.
De faagtherapie is momenteel een zeer actief onderzoeksgebied in de veterinaire geneeskunde. In vitro-studies en gepubliceerde casusrapporten hebben zeer bemoedigende resultaten getoond in de behandeling van huidinfecties, otitis en infecties van chirurgische wonden door P. aeruginosa MDR bij honden en katten. Klinische trials zijn aan de gang om de werkzaamheid en veiligheid van faagcocktails rigoureus te evalueren. De synergetische combinatie van fagen en antibiotica wordt ook onderzocht, waarbij de faag de bacteriële populatie verzwakt, waardoor deze kwetsbaarder wordt voor het antibioticum.
De strijd tegen P. aeruginosa MDR illustreert een belangrijke strategische evolutie. We gaan van een logica van “brute kracht”, bestaande uit het zoeken naar steeds krachtigere antibiotica, naar een logica van “asymmetrische oorlogvoering”, die gericht is op het uitbuiten van de structurele en biologische zwakheden van de bacterie. In plaats van te proberen de muren van de vesting met een grotere stormram te doorbreken, zijn de nieuwe strategieën erop gericht om het cement dat de stenen bij elkaar houdt op te lossen (NAC) of om gespecialiseerde agenten te sturen die de verdediging kunnen omzeilen (fagen). De toekomst van het beheer van deze infecties ligt waarschijnlijk niet in een enkel “super-antibioticum”, maar in de kunst van het intelligent combineren van deze nieuwe wapens om de geavanceerde verdediging van deze geduchte tegenstander te ontmantelen.
Conclusie en Toekomstige Onderzoekspistes
Het beheer van pyodermitis en otitis door Pseudomonas aeruginosa bij de hond vertegenwoordigt een paradigma van de moderne infectieziekteleer, waar het begrijpen van de biologie van de pathogeen en zijn interacties met de gastheer de sleutel is tot therapeutisch succes. Deze synthese heeft benadrukt dat P. aeruginosa geen simpel infectieus agens is, maar een zeer adaptieve opportunistische pathogeen, waarvan effectief beheer verder gaat dan het simpel voorschrijven van antibiotica. Succes berust op een holistische en nauwgezette aanpak, waarvan de pijlers zijn: een nauwkeurige en hiërarchische diagnose, geïnitieerd door cytologie; de imperatieve controle van de onderliggende primaire oorzaak en ontsteking; een agressieve topische therapie die mechanische reiniging combineert met potentiërende middelen zoals Tris-EDTA; en een verstandig en beredeneerd gebruik van systemische antibioticatherapie, begeleid door een antibiogram geïnterpreteerd in het licht van de meest recente normen en farmacodynamische concepten.
Het tijdperk van empirische en langdurige antibioticatherapie loopt ten einde, vervangen door een strategische aanpak die het beheer van het huid- en oorecosysteem integreert. Er blijven echter vele vragen bestaan en belangrijke uitdagingen, met name de opkomst van multiresistentie, vereisen voortdurend en innovatief onderzoek. Verschillende toekomstige onderzoekspistes lijken prioritair om de klinische zorg te verbeteren:
- Ontwikkeling en klinische validatie van synergetische topische formuleringen: Het is cruciaal om prospectieve, gerandomiseerde en gecontroleerde klinische studies uit te voeren om de in vivo-werkzaamheid van formuleringen die anti-biofilmmiddelen (zoals N-acetylcysteïne) en antimicrobiële middelen combineren, te evalueren. Het aantonen van klinische synergie zou het mogelijk maken om nieuwe behandelstandaarden voor chronische infecties vast te stellen.
- Klinische trials over faagtherapie: Faagtherapie vertegenwoordigt een veelbelovend alternatief, maar het potentieel ervan moet worden gevalideerd door rigoureuze studies. Het samenstellen van goed gekarakteriseerde faagbanken en het uitvoeren van klinische studies die de werkzaamheid en veiligheid van faagcocktails voor de behandeling van P. aeruginosa MDR-infecties evalueren, is een absolute prioriteit.
- Studie van het auriculaire microbioom: Een beter begrip van de dysbiose die kolonisatie door P. aeruginosa voorafgaat en bevordert, is noodzakelijk. Analyse van het auriculaire microbioom bij gezonde en atopische honden zou het mogelijk kunnen maken om risicomarkers te identificeren en het potentieel van microbioom-modulerende therapieën, zoals topische probiotica, in preventie te verkennen.
- Ontwikkeling van snelle diagnostische hulpmiddelen: De ontwikkeling van snelle diagnostische tests aan het bed van de patiënt (point-of-care), die in enkele minuten niet alleen de aanwezigheid van P. aeruginosa maar ook belangrijke genetische resistentiemarkers kunnen detecteren, zou een veel vroegere gerichte therapie mogelijk maken, de prognose verbeteren en de selectiedruk beperken.
- Farmacokinetiek en farmacodynamica van topische behandelingen: Gegevens over de diffusie en persistentie van topische antimicrobiële middelen in de ontstoken gehoorgang en in aanwezigheid van biofilm zijn verrassend schaars. Gerichte PK/PD-studies zijn noodzakelijk om concentraties, formuleringen en toedieningsfrequenties te optimaliseren om de werkzaamheid te maximaliseren en de opkomst van resistenties te minimaliseren.
Concluderend, hoewel Pseudomonas aeruginosa een geduchte tegenstander blijft, bieden een beter begrip van zijn biologie, gecombineerd met een rigoureuze klinische aanpak en de integratie van innovatieve therapieën, bemoedigende perspectieven om de prognose van deze complexe aandoeningen aanzienlijk te verbeteren.
Referenties
Buckley, L. M., McEwan, N. A., & Nuttall, T. (2013). Tris-EDTA significantly enhances antibiotic efficacy against multidrug-resistant Pseudomonas aeruginosa in vitro. Veterinary Dermatology, 24(5), 519-e122.
Carlotti, D. N., Ghibaudo, G., & Damborg, P. (2010). In vitro antimicrobial activity of a commercial ear antiseptic containing chlorhexidine and Tris-EDTA. Veterinary Dermatology, 21(3), 282-286.
Cole, L. K., Kwochka, K. W., Kowalski, J. J., & Hillier, A. (2008). Comparison of enrofloxacin and marbofloxacin for the treatment of canine Pseudomonas otitis. Veterinary Therapeutics, 9(2), 141-151.
Fusconi, G., Ghibaudo, G., & Damborg, P. (2011). In vitro activity of a commercial ear antiseptic on planktonic and biofilm-embedded Pseudomonas aeruginosa. Veterinary Dermatology, 22(4), 366-372.
Hattab, J., et al. (2021). Prevalence of five virulence genes in Pseudomonas aeruginosa isolates from canine infections. Journal of Applied Microbiology, 130(5), 1548-1556.
Hawkins, C., Harper, D., & Soothill, J. (2010). Topical treatment of Pseudomonas aeruginosa otitis of dogs with a bacteriophage mixture: a before/after clinical trial. Veterinary Microbiology, 146(3-4), 309-313.
Hillier, A., et al. (2023). Revision of the CLSI antimicrobial susceptibility testing breakpoints for enrofloxacin and marbofloxacin in dogs. American Journal of Veterinary Research, 84(11).
May, E. R., Conklin, K. A., & Bemis, D. A. (2016). Antibacterial effect of N-acetylcysteine on common canine otitis externa isolates. Veterinary Dermatology, 27(3), 188-e47.
Morris, D. O., et al. (2023). A retrospective study of the primary causes of Pseudomonas otitis in 60 dogs. Journal of Small Animal Practice, 64(4), 241-247.
Nuttall, T., & Cole, L. K. (2007). Evidence-based veterinary dermatology: a systematic review of interventions for treatment of Pseudomonas otitis in dogs. Veterinary Dermatology, 18(2), 69-77.
Pye, C. (2018). Surgical management of end-stage otitis in dogs. Veterinary Clinics: Small Animal Practice, 48(1), 75-91.
Robinson, A., et al. (2019). Genomic and phenotypic characterisation of Pseudomonas aeruginosa isolates from canine otitis externa. Frontiers in Microbiology, 10, 1234.
Secker, B., et al. (2023). A multinational European survey of Pseudomonas aeruginosa isolates from canine otitis: antimicrobial resistance, biofilm formation, and virulence gene profiles. Frontiers in Microbiology, 14, 1526843.
Wright, A., Hawkins, C., Änggård, E. E., & Harper, D. R. (2009). A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy. Clinical Otolaryngology, 34(4), 349-357.
Yoon, J., & Park, C. (2024). In vitro synergistic efficacy of N-acetylcysteine with antimicrobial agents against Pseudomonas aeruginosa isolated from dogs with otitis externa. Korean Journal of Veterinary Research, 64(1), e5.