Dermatozoönosen vormen een gevarieerde groep huidaandoeningen die overdraagbaar zijn tussen gewervelde dieren en mensen. Hoewel deze aandoeningen relatief zeldzaam zijn in vergelijking met de bekende zoönosen, vormen ze een aanzienlijke gezondheidsuitdaging, vooral in de stedelijke context waar de nabijheid met huisdieren toeneemt.
De praktiserende dierenarts, op het snijvlak van diergezondheid en menselijke gezondheid, speelt een cruciale rol bij het opsporen, behandelen en voorkomen van deze aandoeningen.
De nauwe relatie tussen mens en dier, hoewel deze onmiskenbare psychologische en sociale voordelen biedt, stelt de eigenaren en professionals die in contact staan met dieren ook bloot aan diverse overdraagbare pathogenen. Deze dermatozoönosen, van schimmel-, parasitaire, bacteriële of virale oorsprong, vereisen bijzondere waakzaamheid en een samenwerkende benadering tussen artsen en dierenartsen voor een optimale behandeling van patiënten, of ze nu twee- of viervoeters zijn.
Definitie en classificatie van dermatozoönosen
Dermatozoönosen vormen een specifieke subset binnen het brede domein van zoönosen. Ze worden gedefinieerd als ziekten of infecties die zich van nature overdragen van gewervelde dieren op mensen, en omgekeerd, en die zich bij mensen klinisch manifesteren door huidlaesies, met uitzondering van gegeneraliseerde allergische reacties. De term is afgeleid van de Griekse wortels “zoo” (dier) en “nosos” (ziekte), bedacht door Virchow in de 19e eeuw en nader gepreciseerd door de Wereldgezondheidsorganisatie in 1959.
In stedelijke omgevingen zijn de voornaamste gewervelden die verantwoordelijk zijn voor deze aandoeningen huisdieren – gedomesticeerde carnivoren zoals honden en katten, maar ook knaagdieren en haasachtigen die steeds vaker in onze woningen voorkomen. De blootgestelde populaties omvatten niet alleen huisdiereigenaren, maar ook diverse risicoberoepen: dierenartsen en hun personeel, fokkers, trimmers en andere professionals die regelmatig met deze dieren in contact komen.
Classificatie op basis van overdrachtwijzen
De Wereldgezondheidsorganisatie stelt een classificatie van zoönosen voor in vier verschillende categorieën, gebaseerd op hun overdrachtwijzen:
- Orthozoönose of directe zoönose: De verwekker heeft slechts één gevestigde soort gewervelde dieren nodig voor zijn onderhoud, hoewel hij meerdere soorten kan aantasten. Deze soort maakt overdracht naar mensen mogelijk. De meerderheid van de klassieke infectieuze zoönosen zoals hondsdolheid, miltvuur of brucellose behoren tot deze categorie.
- Cylozoönose: In dit geval omvat de biologische cyclus meerdere gewervelde diersoorten, maar slechts één daarvan is verantwoordelijk voor menselijke besmetting. De echinokokkose illustreert dit proces goed, met zijn cyclus waarbij honden en herbivoren betrokken zijn, waar de hond als besmetter van de mens fungeert.
- Métazoönose: Deze categorie vereist het doorgaan door een ongewervelde, meestal een geleedpotige, die de overdracht op mensen mogelijk maakt. De arbovirussen zoals gele koorts (onderhouden bij apen en buideldieren en vervolgens op mensen overgedragen door een mug), de rickettsiosen en leishmaniasis vallen onder deze classificatie.
- Saprozoönose: Deze aandoeningen vereisen het passeren van de veroorzaker in de buitenomgeving. Fasciolose illustreert dit mechanisme, waarbij de rijping van cercarieën verantwoordelijk is voor de furkocercariüse dermatose.
Deze systematische classificatie bevordert een beter begrip van de epidemiologische cycli en faciliteert daarom het opzetten van preventiestrategieën die zijn aangepast aan elk type overdracht.
Dermatozoönosen van schimmeloorsprong
Schimmelinfecties die overdraagbaar zijn tussen dier en mens vormen een belangrijk deel van de dermatozoönosen. Deze aandoeningen, voornamelijk vertegenwoordigd door dermatofytosen en sporotrichose, verdienen bijzondere aandacht vanwege hun prevalentie en hun potentiële impact op de menselijke gezondheid.
De dermatofytosen
De dermatofytosen, in de volksmond bekend als “ringworm”, zijn oppervlakkige infectieuze schimmels veroorzaakt door epidermotrope, keratinofiele en keratinolytische schimmels – de dermatofyten. Deze schimmels hebben de eigenschap dat ze zich voeden met keratine, een structureel eiwit van oppervlakkige structuren zoals haar, vacht, nagels en de hoornlaag van de opperhuid.
De zoöphile dermatofyten van dierlijke oorsprong vormen een belangrijke bron van dermatozoönosen. Er zijn drie hoofdsoorten om te overwegen:
- Microsporum canis: Het belangrijkste reservoir is de kat (zelden de hond, met name het Yorkshire terriër ras, en andere kleine zoogdieren). Deze soort is verantwoordelijk voor ongeveer 95% van de kattendermatofytosen en 65% van de gevallen onder honden.
- Trichophyton mentagrophytes: Zijn reservoir bestaat uit knaagdieren, haasachtigen en hoefdieren. Het percentage asymptomatische dragers varieert sterk volgens de soort: ongeveer 15% bij de cavia, 10 tot 40% bij het konijn, en bijna 50% bij de muis en rat.
- Trichophyton verrucosum: Voornamelijk gevonden bij herkauwers.
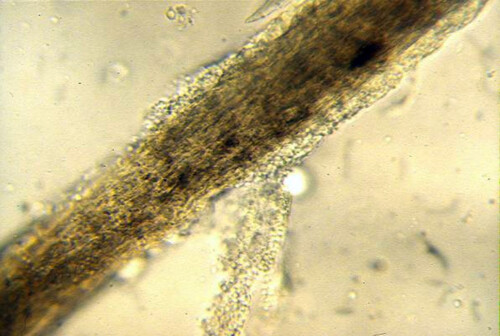
Ringworm haar
De meeste dermatofyten vertonen een nauwe aanpassing aan een doeldiersoort, waarbij ze doorgaans weinig klinische symptomen veroorzaken. Bij katten, bijvoorbeeld, ligt de incidentie van asymptomatische dragers van M. canis rond 10%, maar kan deze veel hoger liggen bij zwerfkatten of bepaalde rassen zoals Perzen. Verontrustend is dat ongeveer 50% van de mensen die in contact komen met een besmette kat, hetzij asymptomatische drager of klinisch ziek, huidletsels ontwikkelen.
Klinische presentatie bij dieren
Bij de kat worden de klassieke laesies van M. canis gekenmerkt door enkele of multipele, erythemateuze, niet-jeukende, schilferige kale plekken met centrifugale uitbreiding. De voorkeurslocaties zijn het gezicht, de oren en de poten. Een late diagnose kan regionale of gegeneraliseerde alopecia onthullen, soms gepaard gaande met jeukende ontsteking. In sommige gevallen is alleen een dorsolumbale keratoseborroeïsche toestand waarneembaar. Onychomycosen door M. canis zijn zeldzaam, terwijl mycetomen uitsluitend voorkomen bij immuungecompromitteerde individuen en bij het Perzische ras.
Bij de hond worden, naast M. canis, nog drie andere soorten aangetroffen: T. mentagrophytes, M. persicolor (beide zoöphiele agentia) en M. gypseum (geofiel agens). Er zijn bepaalde raciale predisposities: Yorkshire terriërs lijken bijzonder kwetsbaar voor gegeneraliseerde schimmelinfecties met M. canis, terwijl terriërs (Fox terriër en andere gravende honden) een verhoogde vatbaarheid vertonen voor gezichtsschimmelinfecties veroorzaakt door T. mentagrophytes en M. persicolor.
De meeste aangetaste honden vertonen klassieke laesies: enkele of multipele, ronde, licht schilferige kale plekken met centrifugale vooruitgang, meestal weinig jeukend. De voorkeurslocaties zijn het gezicht en de distale uiteinden van de ledematen. Kerions (inflammatoire, nodulaire, etterige laesies) worden regelmatig waargenomen, vooral bij T. mentagrophytes.
Bij knaagdieren en lagomorfen, die steeds populairder worden als huisdier, is het bijna-exclusieve agens T. mentagrophytes, minder vaak M. canis. Klinisch manifesteren de dermatofytosen zich door centrifugale, vaak jeukende en zeer inflammatoire kaalheid.
Diagnose van dermatofytosen
De diagnose is gebaseerd op een multi-facetbenadering:
- Wood’s lamp-onderzoek: Een typisch groene fluorescentie van besmette haren is waarneembaar in 50% van de gevallen van M. canis. Deze techniek vereist echter enige ervaring om de specifieke fluorescentie van artefactuele fluorescenties te onderscheiden.
- Direct microscopisch onderzoek van haren en schilfers: Dit kan een aantasting van de haarschacht onthullen, omhuld door sporenmantels (endoectothrix type invasie in het geval van M. canis).
- Mycologische cultuur: Dit stelt de definitieve identificatie van de verantwoordelijke dermatofyt vast. Bij asymptomatische dragers kan het monster worden genomen door het gehele lichaamsoppervlak te borstelen met een steriele tandenborstel of een steriel tapijtlapje, en vervolgens op Sabouraud-agar in cultuur te brengen.
Behandeling en preventie
Behandeling is noodzakelijk, zelfs als spontane genezing mogelijk is (hoewel dit enkele maanden of zelfs jaren kan duren). De therapeutische doeltreffendheid hangt af van de overweging van twee essentiële factoren:
- De hoge besmettelijkheid van dermatofytosen
- De langdurige weerstand van sporen in de omgeving (meerdere jaren)
De therapeutische aanpak combineert:
- Topische behandeling: scheren (afhankelijk van het geval), shampoos en baden op basis van enilconazol of miconazol gecombineerd met chloorhexidine
- Systemische behandeling: griseofulvine, ketoconazol, itraconazol
- Omgevingsbehandeling: enilconazol of bleekwater
De behandeling moet worden voortgezet tot mycologische genezing is bevestigd door negatieve culturen, met twee negatieve controles met een maand tussenpozen. Bij fokkerijen blijft het belangrijkste probleem de voortdurende herbesmetting door de hoge sporenbelasting in de omgeving, wat uitroeiing vrijwel onmogelijk maakt ondanks hygiënische maatregelen. Idealiter zou in foksituaties elk nieuw dier in quarantaine moeten worden geplaatst totdat een negatieve mycologische cultuur is verkregen.
Impact bij de mens
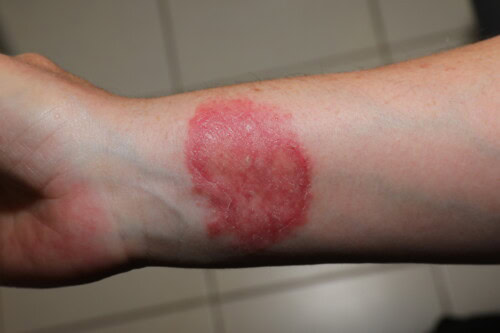
Bij de mens worden door dieren veroorzaakte dermatofytosen gekenmerkt door een opmerkelijk klinisch polymorfisme:
- Erytheem-schilferige laesies van de hoofdhuid (voornamelijk veroorzaakt door M. canis)
- Circulaire erytheem-schilferige laesies van de onbehaarde gebieden, vaak polycyclisch met vesiculocrustale randen (M. canis, T. mentagrophytes)
- Korstvormige en pijnlijke laesies met ernstige inflammatoire reactie (kerion) van de hoofdhuid, nek of baardstreek (sycosis), voornamelijk veroorzaakt door T. mentagrophytes, minder vaak M. canis
Menselijke besmetting bij ringworm
Het is belangrijk op te merken dat ringworm staat genoteerd als beroepziekte nr. 46 (cutane mycosen). Volgens het Arbeidswetboek en de Europese richtlijnen zijn de verplichtingen van de werkgever gericht op de preventie van beroepsrisico’s, specifieke regelgevende maatregelen, hygiëne- en veiligheidsmaatregelen, en medische monitoring.
De sporotrichose
Sporotrichose is een diepe mycose met een hoog zoonotisch potentieel, veroorzaakt door een dimorfe schimmel, Sporothrix schenckii. Deze pathogeen heeft een opmerkelijke eigenschap: het bestaat als filamenteuze vorm in de omgeving (rottende planten, humus, bodem) en transformeert in een gistvorm na binnendringen in de weefsels van de gastheer via een huidverbrekingswonde.
Besmettingswijzen
Hoewel steken en wonden door verontreinigde plantaardige elementen de klassieke besmettingswijze vormen, is de besmette kat een bijzonder zorgwekkende besmettingsbron. Diereneigenaren, dierenartsen en hun personeel lopen namelijk een aanzienlijk risico door contact tussen hun bestaande huidletsels en de exsudaten tijdens de manipulatie van het zieke dier.
Een kenmerkend onderscheid bij deze infectie is het verschil in schimmelbelasting afhankelijk van de gastheersoort: bij de hond of mens is de schimmel in beperkte hoeveelheid aanwezig in de letsels, terwijl bij de kat de schimmelelementen extreem hoge concentraties bereiken. Overdracht op de mens vindt voornamelijk plaats door huidtrauma: een beet of krab van een besmette kat.
Opmerkelijk is dat de sporotrichose bij honden, minder frequent dan bij katten, tot nu toe niet is geassocieerd met bevestigde gevallen van overdracht op mensen.
Klinische presentatie bij dieren
Bij honden en katten zijn drie verschillende klinische vormen beschreven, met een variabele incubatietijd van één week tot twee maanden:
- Cutaneo-lymfatische vorm (80% van de gevallen): Deze wordt gekenmerkt door een progressieve ontwikkeling van een enkele nodule op de inoculatieplaats, aanvankelijk asymptomatisch en later verzweerd, gelokaliseerd op het gezicht of een pootuiteinde. Andere verzwerende en fistulerende nodules kunnen verschijnen langs de lymfevaten.
- Strikt cutane vorm (minder vaak voorkomend): Voorkeurslocaties zijn de pootuiteinden, die nodulaire letsels of haarloze gebieden met verhoogde randen, zweren en korsten vertonen.
- Gegeneraliseerde vorm: Voornamelijk waargenomen bij immunodeficiënte katten, resulterend uit hematogene verspreiding van infectieuze sporen.
Diagnose en behandeling
De diagnose is gebaseerd op cytologisch onderzoek van huidafdrukken en biopten, die een opmerkelijke schimmelrijkdom tonen bij de kat. De mycologische cultuur bevestigt de diagnose.
De behandeling is gebaseerd op de toediening van systemische antischimmelmiddelen, met een voorkeur voor itraconazol en fluconazol. In systemische vormen geeft amfotericine B uitstekende resultaten. De behandeling moet ten minste één maand na ogenschijnlijke klinische genezing worden voortgezet. Bij de kat is naast de systemische fungicide behandeling strikte hygiënische maatregelen onmisbaar:
- Grondige reiniging van handen en armen met antischimmelmiddelen (chloorhexidine, povidonjood)
- Verplicht dragen van beschermende handschoenen
- Duidelijke informatie aan eigenaren over het grote zoonotische risico
Vanwege het hoge overdrachtsrisico en de lange behandelingsduur kan euthanasie gerechtvaardigd worden overwogen voor drager-katten.
Manifestaties bij de mens
Bij de mens varieert de incubatie van drie weken tot drie maanden. De cutaneo-lymfatische vorm, de meest voorkomende, manifesteert zich op de inoculatieplaats door een progressieve nodule, eerst asymptomatisch en daarna verzweerd, typisch gelokaliseerd op de rug van de hand, een vinger, voet of het gezicht.
Parasitische dermatozoönoses
Huidinfecties van parasitaire oorsprong overdraagbaar tussen dier en mens vormen een heterogene maar belangrijke groep binnen de dermatozoönoses. Deze parasitaire infecties, waarbij diverse mijten, insecten of wormen betrokken zijn, tonen diverse klinische beelden bij zowel dieren als mensen.
Schurft
Sarcopte schurft
Sarcopte schurft is een zeer besmettelijke acariënschurft veroorzaakt door de proliferatie van mijten van de familie Sarcoptidae, Sarcoptes scabiei var. canis in de opperhuid. Het belang ervan in de veterinaire en humane dermatologie komt voort uit de toenemende frequentie, klinische ernst en bewezen zoonotisch potentieel.
De soorten die vooral worden aangetast door Sarcoptes scabiei var. canis zijn de hond, vos en fret, maar ook soms de kat, mens en paard. De levenscyclus wordt gekenmerkt door zijn snelheid (10 tot 13 dagen) onder gunstige omgevingsomstandigheden. De vrouwtjes, die zeer vruchtbaar zijn, leggen 2 tot 3 eieren dagelijks (ongeveer 50 eieren per vrouwtje) gedurende 2 tot 4 weken. Na bevruchting graven ze epidermale tunnels (in tegenstelling tot de gangen waargenomen met menselijke sarcopten) om hun eieren te leggen.
Deze eieren komen na 2-3 dagen uit, waarbij hexapodenlarven vrijkomen die zich tot nimfen en vervolgens tot volwassen dieren ontwikkelen. De schurftmijten voeden zich met epidermisweefsels (histofagen). Hun overleving in de buitenomgeving is beperkt tot ongeveer 10 dagen, waardoor specifieke omstandigheden noodzakelijk zijn (15-25°C, relatieve vochtigheid tussen 25 en 85%).
Schurft blijft ondergediagnosticeerd bij honden. Het treft voornamelijk jonge honden van minder dan een jaar, vooral in collectieve contexten (kennels, asielen), maar kan ook volwassen of oudere honden treffen die verzwakt zijn door een bijkomende aandoening.
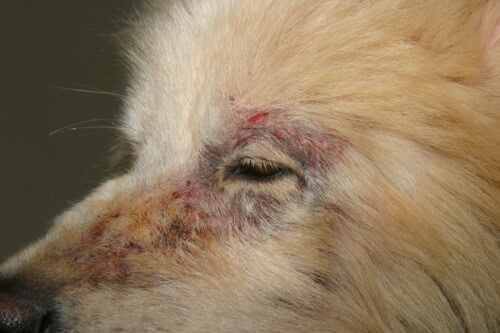
Schurft met aantasting van het gezicht
De pathogene kracht van Sarcoptes scabiei var. canis manifesteert zich via verschillende mechanismen:
- Mechanische en chemische acties (inoculatie van vaatverwijdende en anticoagulerende eiwitten)
- Antigene werking (feces, rui-producten, speeksel)
- Inductie van overgevoeligheidsreacties van type I, IV en III
Overgevoeligheid van type III kan leiden tot de afzetting van immuuncomplexen in diverse organen, waaronder de nieren, en veroorzaakt glomerulonefritis. Deze systemische dimensie rechtvaardigt het beschouwen van schurft bij honden als een algemene ziekte en niet alleen dermatologisch.
Klinisch gezien, na een variabele incubatieperiode (ongeveer 3 weken na contact), associëren de klassieke symptomen:
- Ernstige jeuk met positieve oorpootreflex
- Erythemateuze en papuleuze laesies (“schurftknobbeltjes”)
- Kale plekken in stippelpatronen
- Korstvorming
De laesionaire distributie is kenmerkend in het begin van de evolutie en beïnvloedt met name het gezicht (vrije randen van de oorschelpen), de ledematen (ellebogen) en het borstbeen. Systemische manifestaties kunnen optreden bij oude infestaties of bij oudere honden: hyperthermie, anorexie, gewichtsverlies, polyurie-polydipsie secundair aan de immunologische glomerulonefritis.
Steeds vaker worden atypische vormen gerapporteerd:
- Subtiele, lokaal beperkte vormen, weinig jeuk en weinig besmettelijk
- “Noorse schurft” gekenmerkt door dikke compacte schilfers, matige jeuk en de massale aanwezigheid van mijten in verschillende ontwikkelingsstadia op huidkrabben (typisch bij immuungecompromitteerde dieren)
De zekere diagnose is soms moeilijk. Microscopisch onderzoek van diepe huidkrabben, uitgevoerd op voorkeurslocaties, onthult de parasieten of hun sporen (sarcoptes, eieren, uitwerpselen) slechts in ongeveer 50% van de gevallen. Serologisch onderzoek is een alternatief, met een sensitiviteit en specificiteit van ongeveer 80-90%. Bij sterke klinische verdenking zonder parasitologische bevestiging wordt een proefbehandeling aanbevolen volgens het principe “if you suspect it, treat it”.
De behandeling omvat twee benaderingen:
- Topische acariciden (verdunde amitraz)
- Systemische acariciden als spot-on (selamectine of moxidectine)
De zoönotische dimensie is significant, met humane besmettingen die in 25 tot 50% van de gevallen van schurft bij honden worden waargenomen. De incubatietijd bij mensen is 8 tot 15 dagen, resulterend in prurigo van de romp, armen en benen. Kenmerkend is dat er geen schurftgangen worden waargenomen, in tegenstelling tot menselijke schurft.
Dit wordt verklaard door het feit dat Sarcoptes scabiei var. canis niet langer dan 15 tot 20 dagen bij mensen kan overleven, vanwege een nauwe gastheersoortenspecificiteit. De parasiet is niet in staat zich in de menselijke huid voort te planten (afwezigheid van eieren-leggende vrouwtjes in de epidermis, geen gangen) en blijft oppervlakkig zonder boortende noch antigene werking.
Daarom volstaat doorgaans de passende behandeling van het besmette dier om de symptomen bij de mens op te lossen – schurft wordt beschouwd als een “hemizoönose” waarbij de parasiet snel sterft in de menselijke huid zonder zich voort te planten. Blijvende menselijke symptomen moeten wijzen op een aanhoudende besmettingsbron: niet of slecht behandelde dieren, asymptomatische drager van een soortgenoot ongeïdentificeerd of overleving van de parasieten in de omgeving.
Notoëdrische schurft
Notoëdrische schurft is een besmettelijke mijtziekte die voornamelijk katten, ratten en hamsters treft. Het wordt veroorzaakt door de vermenigvuldiging op het oppervlak en in de epidermis van psorische mijten uit de familie der Sarcoptidae: Notoedres cati bij katten en Notoedres muris bij knaagdieren.
Relatief zeldzaam bij katten in het vasteland van Frankrijk, komt deze aandoening vaker voor in de overzeese departementen en gebieden (Réunion, Antillen), evenals in Italië, Slovenië en Spanje. Bij hamsters en ratten is het een van de meest voorkomende jeukende huidziekten.
De biologische cyclus van notoëdres is vergelijkbaar met die van schurftmijten, met een uitgesproken besmettelijkheid, met name door direct contact, en kan potentieel katten, honden en mensen treffen. Deze besmetting kan zoönotisch of epizoötisch voorkomen met een aanzienlijke morbiditeit. Gevoeligheidsfactoren omvatten jonge leeftijd (kittens), immunosuppressie (FeLV of FIV positieve katten), en bij knaagdieren de status van een jong of drachtig vrouwtje.
Klinisch beginnen bij de kat de laesies meestal op het gezicht (neusrug, lippen, oogleden, oorschelpen) voordat ze zich uitbreiden naar de ledematen, de perianale en abdominale gebieden. Ze manifesteren zich door diffuse erythemateuze en schilferige kaalheden die snel evolueren naar korstvorming. De jeuk is meestal intens.
Bij de hamster omvatten de huidmanifestaties korstvormige laesies die zich voornamelijk op de snuit, oorschelpen en ledematen bevinden, met frequente genitale betrokkenheid. De jeuk varieert van matig tot intens.
Bij de rat is de verdeling van de laesies meer beperkt, beperkt tot de rand van de oorschelpen en de snuit, in de vorm van pseudo-tumorale wratachtige formaties. Papulo-korstachtige laesies worden meestal op de staart waargenomen, maar generalisatie is ongebruikelijk. De intensiteit van de jeuk varieert van matig tot ernstig.
Menselijke besmettingen, waarvan de exacte frequentie moeilijk te beoordelen is, vertonen huidverschijnselen die vergelijkbaar zijn met die van schurft bij honden: jeuk op de romp, armen en benen. Net als bij Sarcoptes scabiei var. canis kunnen de notoedres zich niet voortplanten in de menselijke huid (afwezigheid van ovipeuze vrouwtjes in de epidermis en van gangen) en blijven ze aan de oppervlakte zonder perforerende werking of significante antigene respons. Het oplossen van schurft bij het dier leidt meestal tot genezing bij de mens, deze notoëdrische schurft wordt ook als een hemizoönose beschouwd.
De diagnose, relatief eenvoudig, is gebaseerd op de identificatie van notoedres in verschillende ontwikkelingsstadia (volwassenen, nimfen, larven, eitjes) en hun uitwerpselen bij huidafkrabsels.
De behandeling maakt gebruik van systemische acariciden (avermectines en milbemycines), met de noodzaak om alle dieren van de groep te behandelen, of ze nu klinische symptomen vertonen of niet.
Trixacarus schurft
Schurft veroorzaakt door Trixacarus caviae is een besmettelijke acariasis specifiek voor de cavia (en soms de muis), veroorzaakt door een psorische mijt van de familie van de Sarcoptidae. De uitlokkende factoren zijn niet goed begrepen, met vaak subtiele besmettingsomstandigheden en een variabele incubatieperiode.
Het reconstrueren van de besmettingsgeschiedenis is vaak complex, waarbij de besmetting vaak voorafgaat aan de aanschaf van de dieren. Deze cavia’s dragen waarschijnlijk een klein aantal parasieten zonder klinische manifestaties, totdat omgevingsveranderingen (voeding, verblijfplaats, overbevolking) of een verslechtering van de gezondheidstoestand leiden tot parasitaire vermeerdering boven de pathogene drempel.
Opmerkelijk is dat de aanwezigheid van ernstig aangetaste dieren niet automatisch leidt tot besmetting van contactgenoten, wat wijst op een individuele component in de vatbaarheid voor besmetting.
Het klinische beeld omvat een voortdurende, vroege en vaak intense jeuk met snel gegeneraliseerde laesies: erytheem, papels, schilfers, evoluerend naar uitgebreide korstvorming. De distributie kan lokaal of gegeneraliseerd zijn. De algemene toestand kan verslechteren bij chronische evolutie, met apathie, anorexia, gewichtsverlies en soms fatale afloop.
Menselijke besmettingen, regelmatig gerapporteerd, resulteren uit frequent en langdurig contact met het zieke dier. Er zijn episoden van besmetting beschreven in schoolomgevingen, met name onder kleuters in contact met een ernstig getroffen cavia.
Bij de mens manifesteert deze schurft zich als een papulaire jeukende dermatitis (prurigo-type) die voornamelijk de armen, nek en benen aantast. Net zoals bij andere dierlijke schurften is een geschikte behandeling van het dier doorgaans voldoende om de menselijke symptomen op te lossen, aangezien deze trixacariase ook een hemizoönose is waarbij de parasiet zich niet in de menselijke huid kan voortplanten.
Het therapeutische protocol is gebaseerd op het gebruik van lokale of systemische acariciden (avermectines of milbemycines), met verplichte behandeling van alle contactdieren. Een reiniging en ontsmetting van de omgeving vervolledigen de aanpak.
De cheyletielloses
Cheyletielloses zijn een groep parasitaire huidziekten veroorzaakt door mijten van het geslacht Cheyletiella, behorend tot de familie Cheyletidae. Drie hoofdsoorten worden geïdentificeerd, elk met een voorkeur voor een gastheer: Cheyletiella yasguri (hond), Cheyletiella blakei (kat) en Cheyletiella parasitivorax (konijn).
Deze mijten hebben specifieke biologische kenmerken: de volwassen dieren leggen eieren aan de basis van de haren en voeden zich met huidresten en weefselvloeistoffen. In tegenstelling tot andere oppervlakte-ectoparasieten kunnen cheyletiella zich ingraven in de epidermale resten of zelfs in de hoornlaag, waarbij ze zakjes vormen. Hun mobiliteit op de huid is opmerkelijk.
Het betreft verplichte parasieten die hun volledige levenscyclus op hun gastheer voltooien, met een ontwikkelingsduur van ongeveer 35 dagen. De overdracht vindt voornamelijk plaats via direct contact met klinisch aangetaste of asymptomatische dragers, maar ook indirect via de omgeving, waar de vrouwtjes tot 10 dagen kunnen overleven. Intersoortelijke besmettingen zijn mogelijk, en de overleving kan worden verlengd onder gunstige omgevingscondities (relatief lage temperatuur, hoge luchtvochtigheid, matige verlichting). De parasieten kunnen het strooisel van dieren besmetten, evenals de spleten van muren en vloeren, soms zelfs in afwezigheid van dieren.
Cheyletiellose treft voornamelijk jonge dieren (pups en kittens afkomstig uit kennels of catteries), maar ook volwassen honden (vaak asymptomatische dragers) en volwassen katten. Er zijn bepaalde raciale predisposities waargenomen: kleine hondenrassen (Yorkshire Terrier, Bichon, Poedel) en bij katten het Perzische ras.
De klinische presentatie varieert per soort en leeftijd:
- Bij de pup: intense jeuk met positief otopodaal reflex en uitgesproken schilfering van het hoofd, rug en lendenen
- Bij het kitten: discrete tekenen beperkt tot pityriasiforme schilfering op de rug-lendenen
- Bij de volwassen kat: meer inflammatoire huidlaesies met prurigineuze papuleuze korstjes dermatitis
- Bij het konijn: meestal asymptomatische besmetting of prurigineuze en schilferende dermatose, voornamelijk op de romp
Menselijke besmetting komt vaak voor (>50% van de gevallen), meestal van C. blakei en C. yasguri. Deze overdracht, vaak onderschat, komt voornamelijk door direct contact met het besmette dier (klinisch aangetast of asymptomatische drager), maar kan ook indirect plaatsvinden.
Bij mensen verschijnen de klinische verschijnselen snel, vanaf de tweede dag na contact, in de vorm van sterk jeukende papels op de onderarmen, elleboogplooi, armen, borst, buik en dijen.
De diagnose, over het algemeen eenvoudig, is gebaseerd op de identificatie van cheyletiella’s via huidafkrabsels, borstelen of “plakband-test” en microscopische observatie van schilfers en afval. Het visualiseren van de parasieten is meestal gemakkelijk bij honden (volwassenen, nimfen, eieren) maar moeilijker bij katten, waar volwassenen zelden worden geïdentificeerd en alleen eieren aan de basis van de haren kunnen worden waargenomen. Bij konijnen zijn de parasitaire vormen gemakkelijk te detecteren.
De specifieke behandeling combineert:
- Topische of systemische acariciden (avermectinen of milbemycinen)
- Langdurige behandeling (minimaal acht weken) vanwege de resistentie van de eieren tegen acariciden
- Verplichte behandeling van alle in contact gekomen dieren
- Behandeling van de omgeving
Isolatie en passende behandeling van de dieren resulteren meestal in spontane resolutie van de laesies bij mensen, aangezien cheyletiella’s zich niet in menselijke huid kunnen voortplanten.
Pulikose
Vlooienplagen (pulikose) vormen een van de meest voorkomende ectoparasieten bij honden en katten. De overheersende soort is Ctenocephalides felis felis – “de kattenvlo” – en minder vaak Ctenocephalides canis. Hoewel pulikose niet strikt als zoönosen worden beschouwd, rechtvaardigen hun frequentie en nadelige gevolgen voor mensen hun opname in deze analyse van dermatozoönosen.
Vlooien zijn apterische insecten (zonder vleugels), zijdelings afgeplat. De volwassen, kosmopolitische en sedentair parasieten besteden het grootste deel van hun tijd op de gastheer. Hun biologische cyclus kent verschillende bijzonderheden: de vrouwtjes beginnen hun eieren op de gastheer te leggen binnen 24 tot 48 uur na hun eerste bloedmaaltijd. Deze eieren, met gladde oppervlakken, vallen in de omgeving waar de ontwikkeling plaatsvindt (eieren, drie larvale stadia, popstadium).
De duur van de volledige cyclus is ongeveer drie weken onder optimale omstandigheden, maar kan worden vertraagd bij ongunstige omgevingsomstandigheden. Een cruciaal onderdeel van de epidemiologie is het vermogen van pre-volwassen volwassenen (nog in de poppen) om meerdere maanden in de omgeving te blijven bestaan, wat een aanzienlijke parasietenreservoir vormt. Deze volwassenen komen tevoorschijn onder invloed van specifieke stimuli (trillingen, licht, chemische signalen) en vormen wat gewoonlijk “parketvlo” wordt genoemd.
Besmetting door vlooien is meestal onopgemerkt bij gezonde dieren. Gezonde honden hebben een matige parasitaire druk en de vlooienpopulatie wordt van nature beperkt door zelfverzorgingsgedrag (bijten, likken) en krabbewegingen die de parasieten uit de vacht verdrijven. Deze eigenschap verklaart de occasionele moeilijkheid bij het identificeren van de parasieten op besmette dieren.
De pathologische gevolgen van pulikose omvatten twee dimensies:
- Mechanische huidirritatie door herhaalde beten en bewegingen van de parasieten
- De ontwikkeling bij sommige gevoelige individuen van een huidontsteking door overgevoeligheid voor vlooienbeten (DPPV), die de meest voorkomende allergische huidaandoening vormt bij zowel de kat als de hond
Bij de hond manifesteert DPPV zich door dorso-lumbaal haarverlies in combinatie met erytheem, papels en korsten, met meestal intense jeuk. Bij gebrek aan adequate behandeling zijn secundaire infectieuze complicaties vaak. Bij de kat wordt het beeld gekenmerkt door een prurigineuze papuleuze korstjes dermatitis, eosinofiele plaques en/of dorso-lumbaal haarverlies.
De overdracht op de mens gebeurt voornamelijk bij massale infestaties, wanneer overbevolking de vlooien dwingt van gastheer te veranderen. Het is belangrijk op te merken dat de directe overdracht van volwassen vlooien tussen dieren of naar de mens relatief beperkt is (gemiddeld 10 tot 15%). De menselijke besmetting komt voornamelijk van jonge volwassen vlooien die net uit de cocons zijn tevoorschijn gekomen en actief op zoek zijn naar een beschikbare gastheer, wie dat ook is.
Bij de mens tast DHPP bij voorkeur de ledematen aan (enkels, polsen) en kan het zich bij kinderen uitbreiden naar de romp. De laesies, intens jeukend, nemen de vorm aan van urticariale papels, orticariële plaques of voorbijgaande blaasjes. Soms wordt een secundaire impetigo door krabben en bacteriële infecties waargenomen.
De diagnose van pulicose berust op de directe identificatie van volwassen vlooien of hun uitwerpselen, hetzij met het blote oog, hetzij door te borstelen met een specifieke vlooienkam. Voor DHPP steunt de diagnose op suggestieve anamnese-elementen (seizoensgebonden dermatitis, aanwezigheid van meerdere honden/katten in de omgeving) en compatibele klinische laesies (jeukende dorsale lumbale dermatitis). Paradoxaal genoeg is de zichtbare vlooieninfestatie vaak minimaal bij dieren die met DHPP zijn besmet.
Bij honden kunnen intradermoreactietests met totale vlooienextracten DHPP bevestigen door positieve directe reacties na 20 minuten en/of vertraagde reacties na 48 uur, hoewel hun afwezigheid de diagnose niet uitsluit. Deze tests worden als weinig betrouwbaar beschouwd bij katten.
De behandeling van pulicosis en DHPP mag nooit als triviaal worden beschouwd en vereist een holistische aanpak:
- Verwijdering van vlooien op het aangetaste dier
- Verplichte behandeling van andere dieren in het huishouden
- Reiniging van de omgeving
Deze geïntegreerde strategie vereist vaak nauwe samenwerking met de eigenaar om een effectief bestrijdingsprogramma op te stellen. De bestrijding van vlooien op het dier steunt op het gebruik van langdurige adulticiden, terwijl de beheersing van niet-parasitaire stadia in de omgeving insecten-groeiregulatoren en omgevingsadulticiden omvat. Aanvullende mechanische maatregelen (grondige reiniging, eliminatie van ecologische niches) zijn ook essentieel.
Helminthische dermatozoönoses
Cutane larva migrans
De cutane larva migrans (CLM) doet zich voornamelijk voor in het vasteland van Frankrijk bij mensen die terugkeren uit tropische gebieden, waar zwerfhonden de stranden verontreinigen met hun uitwerpselen. Deze honden, die doorgaans niet behandeld of ontwormd zijn, zijn vaak besmet met haakwormen (Ancylostoma spp. en Uncinaria spp.), darmnematoden die bij hen bloederige gastro-enteritis veroorzaken. De recente beschrijving van een enzootie van larva migrans met Ankylostoma in Bretagne wees echter op de noodzaak van meer waakzaamheid in het vasteland.
De huidverschijnselen zijn het gevolg van de transcutane penetratie van L3-infectieuze larven. Klinisch presenteren deze zich als vaak korstvormende en jeukende papels, soms pustuleus, die bij voorkeur worden aangetroffen op dunne huidgebieden (abdomen) en ledematen (interdigitale ruimtes en handpalmen). Deze relatief niet-specifieke symptomen vereisen een duidelijke anamnese die wijst op een mogelijk contact met besmette omgevingen (hond die in een kennel leeft, landelijke omgeving, jachthond).
Naast de huidmanifestaties kan de besmetting ademhalingssymptomen veroorzaken door larvaire migratie (bronchopneumonie), die vaak ondergediagnosticeerd blijven. Bij chronische besmettingen worden regelmatig spijsverteringsproblemen (hemorragische enteritis) en algemene symptomen (gewichtsverlies, bloedarmoede) waargenomen.
De besmettingsbronnen zijn honden (en katten) als dragers en vochtige grond besmet met de L3-infectieuze larven. Slecht onderhouden kennels met een onverharde vloer bieden een ideale omgeving voor larvale ontwikkeling, wat de bijzondere kwetsbaarheid van jachthonden verklaart. Ook is indirecte besmetting mogelijk door het inslikken van kleine knaagdieren door honden die zelf L3-larven hebben ingenomen.
De diagnose van transcutane migraties is vaak lastig. Het direct aantonen van L3-larven door huidafkrabsels is zelden sluitend. Histopathologisch onderzoek van huidbiopten kan op deze migraties wijzen (eosinofiele infiltratie en af en toe aanwezigheid van larven). Coproscopisch onderzoek maakt meestal gemakkelijke identificatie van de, vaak talrijke, eieren mogelijk.
Preventie en controle vragen om een meervoudige aanpak:
- Vernietiging van besmette omgevingen
- Regelmatige en doordachte ontworming, vooral van drachtige teven (anthelmintica met larvicide werking)
- Heropbouw van verweerde kennels
- Dagelijks opruimen van uitwerpselen
- Wekelijkse intensieve reiniging met cresylhoudende middelen
Bij mensen veroorzaakt de larve die de huid binnendringt een karakteristieke serpiginieuze uitslag. Deze besmetting is echter een parasitaire impasse, waarbij de letsels doorgaans spontaan binnen enkele weken tot maanden regressie vertonen.
Furcocercariase dermatitis of zwemmersjeuk
De furcocercariëndermatitis, ook wel bekend als zwemmersjeuk, is een steeds vaker voorkomende seizoensgebonden dermatozoönose (van juni tot september). Deze metazoönose wordt veroorzaakt door de epidermale penetratie van de larven van een trematode, Trichobilharzia ocellata, een parasiet van de eend, soms ten onrechte “eendenvlo” genoemd. Besmetting vindt plaats tijdens het zwemmen in zoet water, vooral in merengebieden (Lac d’Annecy, Lac du Bourget, Meer van Genève, Zwitserse en Italiaanse meren).
De parasitaire cyclus betreft de trematode T. ocellata, een darmparasiet van de eend, die uitgescheiden wordt in de uitwerpselen. Deze trematoden worden vervolgens opgenomen door waterslakken van het geslacht Lymnaea, met name Lymnaea stagnalis. De cercariën (larvale vormen) worden daarna vrijgegeven in het water waar ze de eend (eindgastheer) evenals de mens of de hond (toevallige gastheren) kunnen besmetten tijdens het zwemmen.
Hoewel de hond soortgelijke letsels kan vertonen als die bij mensen, is het belangrijk te benadrukken dat de mens zich in geen geval kan besmetten via een aangetaste hond.
Bij mensen wordt het klinisch beeld gekenmerkt door een intens jeukende eruptieve dermatitis, maculo-papuleus, gelokaliseerd op blootgestelde delen. De plotselinge verschijning van papels treedt meestal op binnen 10 tot 30 minuten na onderdompeling in zoet water. De evolutie is gunstig, met spontane genezing binnen 2 tot 3 weken, hoewel symptomatische behandeling (antihistaminica of dermocorticosteroïden) vaak nodig is.
De sanitaire profylaxe berust op het onderbreken van de biologische cyclus van de parasiet, met inbegrip van de eliminatie van slakken en eenden uit de betreffende wateren. Aangezien het elimineren van weekdieren bijzonder moeilijk is, wordt zwemmers aanbevolen om ondiepe watergebieden rijk aan watervegetatie, de favoriete habitat van slakken, te vermijden.
Leishmaniose
Leishmaniose is een besmettelijke protozoönose overgedragen door inoculatie, gekenmerkt door de intracellulaire vermenigvuldiging van een geflagelleerde protozoa, Leishmania infantum, in de cellen van het mononucleair fagocytensysteem. De overdracht vindt plaats door de beet van zandvliegen, met de hond als belangrijkste reservoir. In Frankrijk zijn de haarden van canine enzootie voornamelijk geconcentreerd in het zuidoosten, aan de Middellandse Zeekust, van de Italiaanse tot de Spaanse grens, en van zeeniveau tot ongeveer 800 meter hoogte.
Hoewel de parasiet ook is geïsoleerd bij de vos en de kat, lijkt hun epidemiologische rol marginaal. Recente ontdekkingen hebben bovendien andere transmissieroutes aangetoond: uitwisseling van naalden onder heroïnegebruikers, besmetting door bloedderivaten, wat wijst op het occasionele bestaan van een antropozoötische cyclus.
Bij honden presenteert leishmaniose zich als een algemene ziekte met opmerkelijke klinische polymorfie. Epidemiologisch onderzoek in de Alpes-Maritimes en de regio Marseille toont aan dat ongeveer één op de twee leishmaniose-positieve honden asymptomatische dragers zijn. Hoewel systemisch bij deze soort, manifesteert de aandoening zich voornamelijk door huidaandoeningen, nooit geïsoleerd maar geassocieerd met verschillende klinische symptomen:
- Polyadenomegalie (frequent)
- Splenomegalie (minder vaak)
- Veranderingen in de algemene toestand (asthenie, faciale spieratrofie)
- Diverse complicaties: bilaterale uveïtis, artritis, glomerulonefritis (soms enige klinische manifestatie, ongunstige prognose)
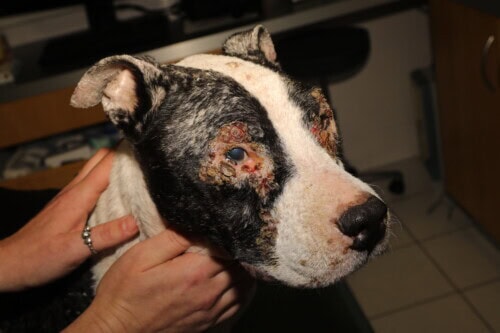
De huidletsels, doorgaans chronisch verlopen, vertonen een grote morfologische diversiteit:
- Algemene exfoliatieve dermatitis die hoofd, oorschelpen en ledematen aantast
- Zweren van de podale uiteinden en drukpunten
- Depigmentatie van de neusspiegel (primair of secundair aan zweren)
- Verdikking van de neusspiegel en/of voetzoolkussens
- Niet-geulcereerde noduli, enkelvoudig of meervoudig (vooral bij bepaalde rassen zoals de Boxer of de Dobermann)
- Gegeneraliseerde steriele pustuleuze dermatitis
Canine leishmaniose
Bij mensen presenteert leishmaniose zich als een systemische ziekte die voornamelijk kinderen en immuungecompromitteerde volwassenen treft. Het kan zich ook strikt cutaan manifesteren, met laesies die zich op de plaats van inoculatie bevinden, meestal op onbedekte gebieden. Deze nodulaire, geulcereerde en korstige laesies zijn karakteristiek pijnloos, van variabele grootte en hebben een chronische evolutie.
De diagnose in de diergeneeskunde is gebaseerd op verschillende technieken:
- Direct bewijs van de parasiet door cytologie (adenogram, myelogram)
- Serologie (ELISA, indirecte immunofluorescentie)
- Genamplificatie (PCR)
In een enzootiegebied wordt een jaarlijkse systematische screening aanbevolen, bij voorkeur uitgevoerd na het blootstellingsseizoen (november tot januari), gezien de variabele maar over het algemeen enkele maanden durende incubatieperiode.
De behandeling van besmette honden leidt tot veel controversen. Zelfs behandeld blijven deze dieren drager van de parasiet. Omdat humane viscerale leishmaniasis potentieel dodelijk is zonder behandeling, met een toenemende incidentie in enzoötische gebieden, lijkt de eliminatie van het parasietenreservoir logisch. Echter, deze aanpak zou verantwoordelijke eigenaars van correct medisch behandelde dieren benadelen, terwijl een ongecontroleerde hondenpopulatie zou blijven bestaan. Paradoxaal genoeg heeft systematische euthanasie van dragers, wanneer toegepast, niet de verwachte resultaten opgeleverd en heeft zelfs geleid tot een toename van humane gevallen.
De dierenarts speelt een cruciale rol bij het informeren van de eigenaars over de risico’s en de noodzaak van een strikte follow-up, zowel klinisch als biologisch.
De behandeling van canine leishmaniasis is gebaseerd op de combinatie van stibiumderivaten en allopurinol, met strikte therapeutische monitoring. Ondanks de bewustmaking van de eigenaren ontsnapt een deel van de honden onvermijdelijk aan de controle of krijgt ze een intermitterende zelfmedicatie, wat het ernstige probleem oplevert van de potentiële opkomst van resistente stammen. Daarom moeten dierenartsen afzien van het gebruik van bepaalde zeer effectieve moleculen zoals amfotericine B, die uitsluitend moeten worden gereserveerd voor humaan medisch gebruik voor deze indicatie.
De ontwikkeling van een hondenvaccin zou de ideale oplossing zijn voor epidemiologische controle, maar de ontwikkeling ervan stuit momenteel op tal van obstakels.
Bacteriële dermatozoönosen
De goedaardige lymforéticulose of kattenkrabziekte
De goedaardige lymforéticulose, beter bekend als kattenkrabziekte (MGC) dankzij zijn overheersende transmissiewijze, vormt bij de mens een regionale subacute lymfadenopathie van bacteriële oorsprong. De veroorzaker, Bartonella henselae (familie van de Bartonellaceae), werd pas in 1992 geïdentificeerd. Sommige gevallen kunnen ook worden toegeschreven aan Bartonella clarridgeiae. De twee bekende genotypen (I en II) van B. henselae zijn betrokken bij deze aandoening.
B. henselae wordt ook geassocieerd, samen met B. quintana, met de etiologie van bacillaire angiomatose en peliosis, vasculoproliferatieve ziekten die voornamelijk worden waargenomen bij met HIV besmette patiënten.
De kat vormt het belangrijkste, zo niet het enige reservoir van de bacterie. De rol van de hond in het dragen van de infectie lijkt zeer beperkt. Hoewel zeldzaam, zijn er gevallen gemeld zonder directe blootstelling aan een dier, wat wijst op andere mogelijke transmissiewijzen (vlooien- of tekenbeten). Menselijke besmetting treedt in 70% van de gevallen op na krabben en in 10% na een kattebeet. Uitzonderlijk kan enkel contact (strelen, een knuffel) leiden tot besmetting van een bestaande huid- of slijmvlieswonde, zoals geïllustreerd door de oculo-ganglionaire vorm die soms wordt waargenomen bij mensen die waarschijnlijk hun oog hebben gewreven na het aaien van een kat.
Experimentele infectie bij de kat veroorzaakt binnen een week een langdurige asymptomatische bacteriemie, die 2 tot 3 maanden of langer bij sommige katten aanhoudt (een aanhoudende, terugkerende bacteriemie is bij een kat gedurende 22 maanden waargenomen). Sommige katten vertonen opvallend hoge niveaus van bacteriemie (meer dan 10^6 CFU/ml bloed). De bacteriemie komt statistisch vaker voor bij jonge katten (minder dan een jaar oud). B. henselae en B. clarridgeiae kunnen hetzelfde dier co-infecteren. Onlangs zijn twee nieuwe soorten van Bartonella, B. koehlerae en B. weissii, geïsoleerd uit katten in de Verenigde Staten, maar hun pathogenetische rol in MGC moet nog aangetoond worden.
Epidemiologische studies geven aan dat een aanzienlijk deel van de geteste katten bacteriëmisch is, met een hoger percentage onder zwerfkatten vergeleken met huiskatten. Verschillende onderzoeken hebben aangetoond dat de percentages van bacteriëmische katten variëren van 16,5% tot 53% binnen de populaties van zwerfkatten, waarvan ongeveer een derde geïnfecteerd is met B. clarridgeiae.
De kattenvlo (Ctenocephalides felis felis) speelt een belangrijke rol bij de overdracht van de infectie binnen deze soort. B. henselae kan ook worden geïsoleerd uit vlooien op bacteriëmische katten. De vlo scheidt de bacterie uit in zijn uitwerpselen, waarmee het de vacht van het dier besmet. De bacteriën kunnen zich vermenigvuldigen in het spijsverteringskanaal van het insect en overleven in de uitwerpselen. De kat besmet zijn klauwen tijdens de verzorging, waardoor de transmissieketen naar de mens tot stand komt. Zwerfkatten, die vaker besmet zijn, vormen een bron van besmetting voor huiskatten.
De MGC is een ziekte die wereldwijd voorkomt (ongeveer 22.000 menselijke gevallen per jaar in de Verenigde Staten en 2.000 in Nederland in 2003) die alle leeftijden kan treffen, maar voornamelijk kinderen en jonge volwassenen treft. De helft van de gevallen wordt gemeld bij kinderen onder de 15 jaar. Bacillaire angiomatose, een ernstige vorm van de ziekte, wordt voornamelijk gediagnosticeerd bij immuungecompromitteerde volwassenen (vooral HIV+ patiënten). De MGC komt meestal sporadisch voor, maar soms worden kleine familiale epidemieën beschreven.
Het klassieke klinische beeld begint met een progressieve lymfeklierzwelling. Op de plaats van inoculatie verschijnt binnen een week een papule die zich ontwikkelt tot een vesico-pustel. In meer dan 90% van de gevallen gaat deze initiële laesie, die binnen 1 tot 3 dagen geneest, onopgemerkt voorbij. Het is meestal 2 tot 3 weken later dat een blijvende lymfadenopathie ontstaat, die bij 10 tot 30% van de patiënten evolueert naar suppuratie. Deze bijbehorende lymfeklierzwelling, uniek in 85% van de gevallen, gaat gepaard met een lichte verhoging van de lichaamstemperatuur. De laesies verdwijnen spontaan (wat de term “goedaardig” rechtvaardigt) in enkele weken tot enkele maanden, hoewel soms een chronische suppuratie kan ontstaan.
De MGC kan zich ook manifesteren in verschillende atypische vormen, waaronder het oculoglandulaire syndroom van Parinaud en andere soms ernstige presentaties (endocarditis, encefalitis, sepsis, purpura), zelfs bij immuuncompetente personen. Bij immuungecompromitteerde patiënten zijn bacillaire angiomatose en peliosis de belangrijkste klinische manifestaties.
De diagnose is gebaseerd op epidemiologische en klinische criteria. De differentiële diagnose omvat andere lymfeklierzwellingen die verband houden met verschillende algemene ziekten (rodehond, tularemie) of met banale verwondingen, beten of krassen die geïnfecteerd zijn door niet-specifieke bacteriën of door Pasteurella spp.
De katten die de besmetting overbrengen, blijven klinisch gezond. De infectieuze agent kan alleen worden geïsoleerd bij een bacteriëmische kat via bloedkweek en identificatie via PCR. Serologie is ook bruikbaar, maar een positieve reactie komt niet noodzakelijk overeen met een actieve bacteriëmie.
Een antibioticatherapie, zelfs langdurig, lijkt de bacteriëmie bij de kat niet te elimineren. Specifieke profylactische maatregelen blijven dus beperkt. Regelmatig gebruik van anti-vlooienmiddel kan echter de besmetting van het katachtige reservoir verminderen. Het is vermeldenswaard dat het ontklauwen, soms voorgesteld als een preventieve maatregel, geen enkel nut heeft.
Preventie rust op duidelijke informatie aan risicopersonen (vooral immuungecompromitteerde patiënten), het doordacht bestrijden van vlooien bij katten, handen wassen na contact met het dier, en, zoals bij alle ziekten overgedragen door beten of krassen, onmiddellijke reiniging en desinfectie van de wonden.
Pasteurelloses
Dierlijke pasteurellosen worden vaak aangetroffen bij tal van soorten (herkauwers, varkens, gevogelte, knaagdieren) en manifesteren zich klinisch door diverse aandoeningen: broncho- en pleuropneumonieën, subcutane abcessen, of septische vormen (gevogeltecholera).
Deze infecties worden op mensen overgedragen via de gebruikelijke besmettingsroutes (direct contact, voedsel, inhalatie), maar het belangrijkste mechanisme is inoculatie door een kattenbeet, een hondenbeet, minder vaak door een rat of konijn. Deze beet kan worden toegebracht door een klinisch ziek dier, maar vaker door een ogenschijnlijk gezond dier, aangezien Pasteurella spp. een commensale bacterie is van de bovenste luchtwegen van veel dieren, geïsoleerd in 40 tot 80% van de monsters bij de betrokken soorten.
De bij gebeten personen geïsoleerde pasteurella’s zijn voornamelijk P. multocida, P. canis en P. dagmatis. Gevallen van humane pasteurellose zonder geïdentificeerde beet zijn uitzonderlijk; ze omvatten pneumonieën, pleurisies, pericarditis, endocarditis, artritis en sepsis. Hoewel besmetting van dierlijke oorsprong door inhalatie of inname mogelijk is, kan Pasteurella spp. ook, zowel bij de mens als bij het dier, overleven als commensaal op de slijmvliezen en zijn pathogene vermogen alleen uiten in combinatie met verzwakkende aandoeningen of ziekten (virale infecties, kanker, uremisch syndroom, cirrose). In deze specifieke gevallen zouden deze pasteurelloses niet strikt beschouwd worden als zoönosen.
Bij mensen wordt het klinische beeld gedomineerd door vormen die zich lokaal voordoen op de plaats van cutane ingang. De acute vormen worden gekenmerkt door intense en vroege lokale ontstekingsverschijnselen. Binnen enkele uren na de penetratie van de kiem wordt de wond (die aanvankelijk vaak onopgemerkt blijft) warm, rood, oedemateus en erg pijnlijk; een ettering verschijnt snel in de vorm van enkele sereuze druppeltjes. Een lymfangitis en een bijbehorende lymfeklierzwelling worden vaak geassocieerd.
De subacute loco-regionale vormen evolueren anders: na soortgelijke of subtielere initiële manifestaties, verschijnen er pijnlijke en aanhoudende niet-etterende tendosynovitis nabij het inoculatiepunt, of metacarpofalangeale artropathieën gepaard gaande met vasomotorische stoornissen (gevoel van zwaarte, cyanose of bleekheid, paresthesieën).
De klinische diagnose is gebaseerd op de snelle ontwikkeling van een oedemateuze ontsteking van de gebeten regio. Bacteriologische isolatie uit de pus moet vroeg op gewone media worden uitgevoerd, maar de resultaten zijn variabel.
De behandeling van inoculatiepasteurellosen maakt gebruik van tetracyclines. De humane profylaxe is complex vanwege de onmogelijkheid om het dierlijke reservoir, dat voortdurend in contact staat met de mens, te elimineren. Gezien de frequentie van katooginfecties en de soms waargenomen functionele restverschijnselen wordt een preventieve maatregel overwogen die inhoudt dat aan elke gebeten of gekrabde persoon, zelfs bij afwezigheid van vroege klinische symptomen, onmiddellijk een antibioticabehandeling wordt toegediend.
Virale dermatozoönosen
Het cowpox-virus
De cowpox-ziekte is een virale ziekte veroorzaakt door een orthopoxvirus, het cowpoxvirus, beschreven bij veel soorten: koeien, kamelen, buffels, konijnen, katten en, meer recentelijk, ratten. De virussen van deze familie (pokken, cowpox, vaccinie en apenpokken) zijn nauw verwant en behoren allemaal tot het geslacht Orthopoxvirus. Deze agentia zijn moeilijk te isoleren, zelfs bij laesies en geïnfecteerde organen.
De diagnose van een infectie met Orthopoxvirus kan met verschillende technieken worden gesteld:
- Elektronenmicroscopie
- Serologie
- Genamplificatie (PCR)
- DNA-sequencing na isolatie of cultuur, voor de nauwkeurige identificatie van de virale soort
Gezien hun genetische nabijheid zijn identificatiefouten mogelijk tussen deze virussen.
Bij katten wordt poxvirus sinds ongeveer 30 jaar waargenomen in Groot-Brittannië, Nederland, België en Duitsland. De aanwezigheid in Frankrijk wordt sinds 1999 regelmatig gemeld. Deze infectie treft vrijwel uitsluitend rurale jagende katten. De besmetting komt voornamelijk van kleine wilde knaagdieren (woelmuizen, muizen), zeldzamer van runderen.
De rosse woelmuis (Clethrionomys glareolus) en, in mindere mate, de veldmuis (Microtus agrestis) spelen een belangrijke rol in het behoud van de infectie. Deze knaagdieren kunnen het virus ook overdragen aan andere soorten die dezelfde natuurlijke habitat delen (syntopisch), zoals de bosmuis (Apodemus sylvaticus), en zelfs gerbils en grond eekhoorns in oostelijke gebieden. Er zijn ook gevallen gemeld bij ratten geïmporteerd uit Oost-Europese landen. De seizoensgebonden toename van gevallen (zomer en herfst) komt overeen met de hoofdzakelijke activiteit en proliferatieperiode van deze kleine knaagdieren.
De overdracht gebeurt voornamelijk transcutaan, soms via de orale of nasale weg.
Bij katten manifesteert de infectie zich klinisch aanvankelijk door een enkele maculeuze en erythemateuze laesie, gelokaliseerd op het hoofd, de nek of de voorpoten. Binnen ongeveer tien dagen verschijnen talloze secundaire jeukende laesies: maculae, papulae, erythemateuze knobbeltjes, die geleidelijk ulcereren en het hele lichaam kunnen bereiken, inclusief de mondholte. Algemene tekenen (koorts, rhinitis, conjunctivitis) worden vaak waargenomen.
De evolutie is meestal gunstig, met spontane genezing van secundaire laesies in 3 tot 8 weken. Toch kunnen complicaties zoals bacteriële superinfecties of retrovirale co-infectie leiden tot generalisatie van huidlaesies en soms fatale longontsteking.
Bij ratten zijn de huidmanifestaties vergelijkbaar met die bij katten.
De overdracht op mensen is gedocumenteerd zowel van katten als ratten, met een bijzonder gereserveerde prognose bij immuungecompromitteerde of oudere individuen. De beëindiging van vaccinatie tegen pokken kan de kruisbescherming tegen poxvirussen in de algemene bevolking hebben verminderd, waardoor niet-gevaccineerde personen, vooral als ze immuungecompromitteerd zijn, vatbaar zijn voor deze infecties.
Bij de mens, na een incubatietijd van 2 tot 6 dagen, zijn de huidmanifestaties van cowpox meestal goedaardig: papuleuze, vesiculaire, umbilicate en omgeven laesies, gelokaliseerd op het gezicht, de handen, de armen en soms de slijmvliezen (vooral bij kinderen). Algemene tekenen (koorts, lymfadenopathie) vergezellen vaak de eruptie. Bij immuungecompromitteerde patiënten kan de infectie een ernstige vorm aannemen met gegeneraliseerde pustulaire en hemorragische pokken, potentieel dodelijk.
De diagnose bij dieren is voornamelijk gebaseerd op histopathologie van huidbiopsieën, die specifieke laesies van poxvirusziekten onthullen. Andere minder gebruikelijke technieken zijn elektronenmicroscopie, serologie, virale isolatie en PCR.
De behandeling bij katten is voornamelijk symptomatisch, gericht op het beheersen van bacteriële superinfecties en het behouden van een geschikte voeding ondanks pijnlijke orale laesies.
Preventieve maatregelen zijn essentieel:
- Isolatie van de zieke kat om inter-feline besmetting te voorkomen
- Euthanasie van getroffen ratten
- Desinfectie van de omgeving (bleekmiddel) vanwege de resistentie van het virus
- Voorzorgsmaatregelen bij manipulatie (het dragen van handschoenen) om het zoönotisch risico te beperken, vooral voor kwetsbare personen (immuungecompromitteerden, kinderen, ouderen)
Gevolgen voor de volksgezondheid en preventiestrategieën
Dermatozoönosen vormen, hoewel minder mediageniek dan andere systemische zoönosen, een meerderheid van de volksgezondheidsproblematiek, vooral in de context van een steeds nauwere mens-dier relatie. Een retrospectief onderzoek in een veterinaire dermatologische cliëntèle onthult dat bijna 35% van de eigenaren hun bed delen met hun dier (kat of hond), en in deze gewoonte volharden zelfs wanneer ze zelf dermatologische laesies vertonen die aan hun huisdier kunnen worden toegeschreven.
Deze nabijheid, samen met de veelheid aan potentieel overdraagbare ziekteverwekkers, onderstreept het belang van een gecoördineerde preventieve benadering tussen artsen, dierenartsen en diereneigenaren.
Rol van de praktiserende dierenarts
De praktiserende dierenarts bevindt zich in een strategische positie op het snijvlak van diergezondheid en menselijke gezondheid. Zijn rol beperkt zich niet tot de diagnose en behandeling van dierziekten; het strekt zich uit tot:
- Het informeren van de eigenaar over de potentiële zoönotische risico’s die zijn dier met zich meebrengt
- Het geven van voorlichting over preventieve maatregelen die passen bij elke situatie
- Vroege detectie van aandoeningen met zoönotisch potentieel
- Het instellen van passende behandelingen die niet alleen gericht zijn op het genezen van het dier maar ook op het onderbreken van de overdrachtsketen naar de mens
- Samenwerking met artsen voor een alomvattende aanpak van gevallen die overdracht naar de mens inhouden
Deze taak op het gebied van de volksgezondheid is bijzonder delicaat omdat het vereist dat de emotionele band van eigenaren met hun dieren in evenwicht wordt gebracht met gezondheidsvoorwaarden. Het is vaak illusoir om de cohabitatiepatronen tussen eigenaren en hun huisgenoten radicaal te willen veranderen, maar duidelijke en objectieve informatie maakt doorgaans de aanname van redelijke voorzorgsmaatregelen mogelijk.
Specifiek risicogroepen
Bepaalde bevolkingsgroepen vertonen een verhoogde kwetsbaarheid voor dermatozoönosen en verdienen specifieke aandacht:
- Mensen met een verminderde immuniteit (patiënten onder immunosuppressiva, mensen die leven met hiv, transplantatieontvangers, patiënten onder chemotherapie): vooral de hiv-infectie verleent een bijzondere dimensie aan zoönotisch risico, met mogelijk ernstiger manifestaties van aandoeningen zoals sporotrichose, leishmaniasis, pokkenziekten of tuberculose
- Jonge kinderen: hun nog onrijpe immuunsysteem in combinatie met risicogedrag (nauw contact met dieren, geen systematische handhygiëne) stelt hen bijzonder bloot
- Ouderen: immunologische kwetsbaarheid geassocieerd met de leeftijd
- Zwangere vrouwen: specifieke risico’s verbonden aan bepaalde pathogenen
- Professionals die met dieren werken: dierenartsen en hun personeel, fokkers, trimmers, personeel van opvangcentra
Voor deze populaties moeten specifieke aanbevelingen worden geformuleerd, variërend van eenvoudige verbeterde hygiëneaanbevelingen tot de tijdelijke uitsluiting van bepaalde diersoorten, afhankelijk van de klinische context.
Specifieke preventieve strategieën
Voor dermatofytosen
- Screening van asymptomatische dragers in dierengemeenschappen
- Isolatie en vroege behandeling van getroffen dieren
- Grondige desinfectie van de omgeving
- Voorzorgsmaatregelen bij de aanschaf van nieuwe dieren (vooral kittens uit fokkerijen of dierenwinkels)
- Bijzondere bewustwording van leidinggevenden van kinderinstellingen (scholen, crèches) over de risico’s geassocieerd met klasmascottes
Voor schurft en andere ectoparasitose
- Regelmatige antiparasitaire behandeling van huisdieren
- Beheersing van zwervende dierpopulaties
- Verhoogde voorzichtheid bij de adoptie van dieren uit opvangcentra
- Identificatie en behandeling van alle dieren in contact in geval van een positieve diagnose
Voor leishmaniose
- Jaarlijkse screening in endemische gebieden
- Gebruik van afweermiddelen tegen zandvliegjes tijdens het vectoractiviteitseizoen
- Beperking van nachtelijke uitstapjes van honden in endemische gebieden
- Strikte opvolging van geïnfecteerde honden
- Duidelijke informatie aan eigenaren over de risico’s en preventieve maatregelen
Voor door beet of krab overgedragen ziekten
- Educatie van eigenaren over het correct hanteren van dieren
- Onmiddellijke desinfectie van elke wond, hoe klein ook
- Snelle medische raadpleging bij ontstekingsverschijnselen
- Vlooienbestrijdingsprogramma ter beperking van de overdracht van B. henselae bij katten
“One Health” benadering
Het principe van “One Health” (Een Gezondheid) erkent de onderlinge afhankelijkheid tussen menselijke gezondheid, diergezondheid en milieugezondheid. Deze benadering is bijzonder relevant voor het beheersen van dermatozoönosen, die deze onderlinge verbinding uitstekend illustreren.
De nauwe samenwerking tussen artsen en dierenartsen vormt de hoeksteen van een effectieve aanpak van deze aandoeningen.
Deze samenwerking moet zich richten op verschillende pijlers:
- Delen van informatie over gedetecteerde gevallen en epidemiologische ontwikkelingen
- Standaardisatie van diagnostische protocollen om vergelijkingen tussen menselijke en dierlijke gevallen te vergemakkelijken
- Coördinatie van therapeutische benaderingen om resistentieontwikkeling te voorkomen
- Gemeenschappelijke ontwikkeling van preventieve boodschappen voor het publiek
- Collaboratief onderzoek naar overdrachtmechanismen en risicofactoren
Deze interprofessionele samenwerking moet in een ruimer kader worden geplaatst waarin ook het volgende wordt betrokken:
- De volksgezondheidsautoriteiten
- De diagnostische laboratoria
- De onderzoeksstructuren
- Dierenbeschermingsverenigingen
- Professionals in de veehouderij en het dierenverblijf
Alleen deze geïntegreerde aanpak zal een optimale beheersing van deze aandoeningen op de dier-mens interface mogelijk maken.
Fundamentele voorzorgsmaatregelen
Enkele fundamentele voorzorgsmaatregelen, geldig voor alle dermatozoönosen, kunnen worden aanbevolen aan dierenbezitters en professionals:
- Strikte handhygiëne na elk contact met dieren, vooral voor het eten
- Regelmatige ontworming en externe parasitaire behandeling van huisdieren
- Regelmatige veterinaire controle met expliciete vermelding van contact met kwetsbare personen
- Frequent schoonmaken van de slaapplaatsen van de dieren
- Het dragen van handschoenen bij het hanteren van dieren met huidlaesies
- Tijdelijke ontzegging van nauw contact (delen van het bed, likken van het gezicht) bij een gediagnosticeerde dierlijke dermatosis
- Snelle medische consultatie bij het optreden van huidlaesies bij de mens na contact met een ziek dier
Deze eenvoudige maatregelen, samen met een verhoogd bewustzijn van eigenaren voor waarschuwingssignalen, kunnen de incidentie van overdrachtsgevallen naar mensen aanzienlijk verminderen.
Conclusie
Dermatozoönosen vormen een heterogene groep van huidziekten die overdraagbaar zijn tussen gewervelde dieren en mensen, met een relatief lage prevalentie in vergelijking met alle zoönosen, maar een potentieel significante impact op de volksgezondheid. Met uitzondering van enkele specifieke entiteiten zoals sporotrichose, kattenkrabziekte, leishmaniasis en cowpox-infectie, veroorzaken deze aandoeningen zelden een ernstige medische ernst bij mensen, die over het algemeen een parasitaire eindgastheer vormen.
Echter, de genezing van de getroffen eigenaar, met of zonder behandeling, is gedoemd te mislukken als de besmettingsbron – het dier – niet adequaat wordt geïdentificeerd en behandeld. Deze onderlinge afhankelijkheid onderstreept het cruciale belang van een gecoördineerde aanpak tussen veterinaire en menselijke geneeskunde.
De praktiserende dierenarts, vanwege zijn strategische positie op het snijvlak van mens en dier, speelt een sleutelrol bij de vroege detectie, de juiste behandeling en de preventie van deze aandoeningen. Zijn verantwoordelijkheid gaat verder dan de dierverzorging en omvat een volksgezondheidsdimensie, waarbij informatie, educatie en samenwerking met artsen worden betrokken.
In een context van toenemende integratie van gezelschapsdieren binnen gezinnen, met steeds frequenter fysiek contact, neemt de waakzaamheid ten aanzien van dermatozoönosen toe. Deze nabijheid, hoewel een bron van onmiskenbare psychologische en sociale voordelen, vereist een adequate medische zorg voor gezelschapsdieren als onmisbare aanvulling op hun gezinsintegratie.
Ten slotte biedt de “One Health” benadering, waaruit de onderlinge verbinding tussen menselijke gezondheid, diergezondheid en milieugezondheid blijkt, een relevante conceptuele kader om deze ziekten aan te pakken. Alleen nauwe samenwerking tussen alle betrokken partijen – dierenartsen, artsen, huisdiereigenaren, gezondheidsautoriteiten – kan de risico’s van overdracht minimaliseren en tegelijkertijd de voordelen van de mens-dierrelatie behouden.
FAQ
1. Vertonen dieren die drager zijn van zoönotische kiemen altijd identificeerbare klinische tekenen?
Nee, veel dieren kunnen asymptomatisch dragers zijn van pathogenen die overdraagbaar zijn op mensen. Dit is met name het geval voor dermatofytosen (vooral bij katten), leishmaniasis (ongeveer 50% van de honden in endemische gebieden zijn asymptomatisch) of kattenkrabziekte (bacteriemische katten vertonen meestal geen klinische tekenen). Deze eigenschap maakt detectie moeilijker en rechtvaardigt systematische preventieve maatregelen, vooral voor risicopopulaties.
2. Hoe kunnen klinisch de verschillende vormen van dierlijke schurft worden onderscheiden en hun zoönotische potentieel worden beoordeeld?
De verschillende vormen van dierlijke schurft (sarcoptisch, notoëdrisch, trixacarisch) vertonen relatief vergelijkbare klinische beelden bij dieren (erythemateus-squameuze korstachtige laesies en jeuk), maar onderscheiden zich door hun voorkeurslocatie en de getroffen diersoort. Hun zoönotisch potentieel is variabel: ze kunnen allemaal laesies bij mensen veroorzaken, maar vormen over het algemeen “hémizoönoses” waarbij de parasiet zijn volledige cyclus niet in de menselijke huid kan afronden. Een nauwkeurige parasitologische diagnose door middel van huidafkrabsel is essentieel voor het beoordelen van het overdrachtsrisico en het aanpassen van preventieve maatregelen.
3. Bieden de preventieve antiparasitaire behandelingen die voor gezelschapsdieren worden verkocht volledige bescherming tegen parasitaire dermatozoönosen?
Moderne externe bestrijdingsmiddelen, in het bijzonder die op basis van isoxazolines, avermectines of milbemycines, bieden uitstekende bescherming tegen de meeste ectoparasieten die verantwoordelijk zijn voor dermatozoönosen (vlooien, sarcoptische schurft, notoedres, cheyletiella). Hun effectiviteit is echter niet absoluut en hangt af van meerdere factoren: naleving van de behandeling, dekking van het parasitaire spectrum, opkomende resistenties, individuele bijzonderheden. Bovendien bieden deze behandelingen over het algemeen geen bescherming tegen schimmel-, bacteriële of virale dermatozoönosen. Een alomvattende preventieve aanpak blijft dus noodzakelijk, met een combinatie van antiparasitaire behandeling, passende hygiëne en regelmatige veterinaire controle.
4. Wat te doen bij een dier met huidletsels in een huishouden met immuungecompromitteerde personen?
In deze hoogrisicosituatie zijn diverse maatregelen nodig: onmiddellijke veterinaire consultatie voor een nauwkeurige diagnose, tijdelijke isolatie van het dier in een aparte ruimte tot de letsels zijn opgelost, het dragen van handschoenen bij noodzakelijke manipulaties, grondige desinfectie van contactoppervlakken en versterking van de handhygiëne. Afhankelijk van de vastgestelde diagnose en de mate van immunosuppressie van de betrokkene, kunnen strengere maatregelen worden overwogen, altijd in overleg tussen de dierenarts en de behandelend arts. In bepaalde bijzondere gevallen, waarbij zeer pathogene agentia betrokken zijn, zoals Sporothrix schenckii bij een ernstig immuungecompromitteerde patiënt, kan tijdelijke scheiding noodzakelijk zijn.
5. De toename van gevallen van dermatozoönosen die in de afgelopen decennia is waargenomen, weerspiegelt dat een echte opkomst of gewoon betere detectie?
De schijnbare evolutie van de incidentie van dermatozoönosen ontstaat waarschijnlijk door een combinatie van factoren. Enerzijds maken de diagnostische vooruitgangen en de toegenomen bewustwording bij gezondheidsprofessionals een betere identificatie van de gevallen mogelijk. Anderzijds bevorderen verschillende factoren een daadwerkelijke opkomst: toename van het aantal huisdieren en intensivering van fysiek contact, toename van internationale reizen die de verspreiding van nieuwe pathogenen vergemakkelijken, groei van immuungecompromitteerde populaties die vatbaarder zijn voor deze infecties, milieuwijzigingen die de parasitaire cycli beïnvloeden, en de opkomst van resistenties tegen antiparasitaire behandelingen. Een rigoureuze epidemiologische aanpak, waarbij humane en veterinaire geneeskunde worden gecombineerd, is noodzakelijk om deze trends nauwkeurig te kwantificeren en preventieve strategieën aan te passen.
Referenties
- guaguère é. dermatozoonoses en milieu urbain : le point de vue du dermatologue vétérinaire = dermatozoonoses in urban settings : the veterinary dermatologist’s point of view. 33522539.pdf.
- martin s, schmutz jl. les dermatozoonoses. nouv dermatol 2002 ; 21 : suppl.2 : 37-42.
- viaud s, bensignor e. les dermatozoonoses du chien et du chat. prat med chir anim comp 2008 : 43, 131-9.
- euzéby j. mycologie médicale comparée : les mycoses des animaux et leurs relations avec les mycoses de l’homme. tome i. oullins: fondation marcel merieux; 1992.
- moriello ka, de boer dj. dermatophyties in: guaguère e, prélaud p, editors. guide pratique de dermatologie féline. lyon: mérial; 2000. p. 4.1–11.
- brouta f, deschamps f, losson b, mignon b. données récentes sur la pathogénèse de l’infection de microsporum canis chez les carnivores domestiques. ann med vet 2001; 145: 236–42.
- mignon b. dermatophyties. in: guaguère e, prélaud p, editors. guide pratique de dermatologie canine. lyon: kalianxis; 2006. p. 153–66.
- guaguère e, hubert t, muller a. dermatologie des petits mammifères de compagnie. in : encyclopédie vétérinaire – dermatologie, elsevier, paris, 2007 ; vol 2 (3700) 1-17.
- carlotti dn. le traitement des dermatophytoses du chien et du chat. gestion de la teigne en chatterie. prat med chir anim comp 2008; 43 : 1–13.
- viguié-vallanet c. les teignes. ann dermatol venereol 1999 ; 126 : 349-56.
- ferrer l, fondati a. mycoses profondes. in: guaguère e, prélaud p, editors. guide pratique de dermatologie feline. lyon: mérial; 2000. p. 5.1-11.
- schubach tm, schubach a, okamoto t, barros mb, figueiredo fb, cuzzi t, et al. evaluation of an epidemic sporotrichosis in cats: 347 cases (1998—2001). j am vet med assoc 2004; 224: 1623-9.
- cafarchia c, sasanelli m, lia rp, de caprariis d, guillot j, otranto d. lymphocutaneous and nasal sporotrichosis in a dog from sou-thern italy: case report. mycopathologia 2007; 163: 75—9.
- verde m. dermatozoonoses. in: guaguère e, prélaud p, editors. guide pratique de dermatologie féline. lyon: mérial; 2000. p. 25.1–7.
- guaguère e, beugnet f. dermatoses parasitaires. in: guaguère e, prélaud p, editors. guide pratique de dermatologie canine. lyon: kalianxis; 2006; p 181- 231.
- paterson s. skin diseases of exotic pets (paterson s, ed), blackwell publishing, oxford, 2006 ; 333 p.
- ellis c, mori m. skin diseases of rodents and small exotic mammals. vet clin north am exotic anim pract 2007 ; 4 : 523-7.
Gerelateerde zoekopdrachten
dermatologie voor huisdieren in dieren, aanvullend onderzoek, afdeling dermatologie, dierenarts dermatologie, dierenarts behandeld, medisch centrum, dermatologisch onderzoek, inwendige ziektes, microscopisch onderzoek, aanvullende onderzoeken, goede diagnose, belangrijk orgaan, eerste consult, dermatologie, uitgebreide kennis, eigen dierenarts, adviezen leiden, europees specialist, kale plekken, goed functioneren, uitgebreide ervaring, dierenarts, huidproblemen, huid, behandelplan, dier last, goed bedoeld, consult, aanvullend onderzoek nodig, huidklachten, honden, vacht, aandoeningen, doorverwijzing, allergie, nagels, dermatoloog, oorzaak, meeste dieren, infecties, begeleiding, nieuwe afspraak, roodheid