De veterinaire dermatologie heeft de afgelopen twee decennia een radicale transformatie ondergaan, gekenmerkt door de opkomst en wereldwijde verspreiding van methicilline-resistente stafylokokken (MRS). Vroeger beschouwd als eenvoudige bacteriële infecties die voorspelbaar reageerden op behandelingen, staan hondenpyodermites vandaag centraal in een crisis van antimicrobiële resistentie.
September 2025
Introductie: De Opkomst van een Klinische en Volksgezondheiduitdaging
Deze evolutie heeft het veterinaire beroep gedwongen om hun diagnostische, therapeutische en biosecurity benaderingen fundamenteel te herzien. Dit rapport beoogt een uitgebreide analyse te bieden van het belang van MRS in de veterinaire dermatologie, gebaseerd op actuele wetenschappelijke gegevens om de klinische praktijk en volksgezondheid te informeren.
De hoofduitdaging ligt in het feit dat methicilline-resistentie, die klinische ineffectiviteit van de gehele klasse van bètalactamines veroorzaakt, zeer frequent geassocieerd is met een multiresistent fenotype (MDR). Deze associatie maakt vele andere antibioticafamilies, zoals macroliden, lincosamiden, fluoroquinolonen of aminoglycosiden, ineffectief. Deze situatie heeft een therapeutisch paradigmaverschuiving veroorzaakt. Het falen van empirische behandelingen, vroeger effectief, dwingt clinici om toevlucht te nemen tot last-resort antibiotica, zoals chlooramfenicol of rifampicine. Deze alternatieven, hoewel potentieel effectief indien het antibiogram dit bevestigt, vertonen beperkendere bijwerkingsprofielen en vereisen nauwere biologische monitoring, waardoor de complexiteit, risico’s en kosten van de zorg toenemen.
Opgemerkt dient te worden dat volgens GEDAC (Groupe d’Etude Français en Dermatologie des Animaux de Compagnie), rifampicine behoort tot de antibiotica die nooit gebruikt mogen worden om deze te bewaren voor de humane geneeskunde voor de behandeling van ernstige humane infecties zoals tuberculose. Hetzelfde geldt voor mupirocine.
Historische context en paradigmaverschuiving
Het post-Tweede Wereldoorlog tijdperk introduceerde antimicrobiële middelen in de veterinaire geneeskunde, wat de behandeling van infectieziekten revolutioneerde. Gedurende decennia werden hondenpyodermites, voornamelijk veroorzaakt door stafylokokken, succesvol behandeld met ẞ-lactamine antibiotica, zoals penicillines en cefalosporines. Dit wijdverbreide, vaak empirische gebruik oefende echter intense selectiedruk uit op bacteriële populaties. Het onvermijdelijke resultaat van deze druk was de opkomst van resistente stammen, waardoor een beheersbaar klinisch probleem werd omgezet in een belangrijke therapeutische uitdaging. De significante opkomst van methicilline-resistente Staphylococcus pseudintermedius (SPIRM) rond het midden van de jaren 2000 markeerde een keerpunt, dat het einde van het tijdperk van vertrouwen in empirische behandelingen voor pyodermitis signaleerde. Dit is geen geïsoleerd evenement, maar het directe en voorspelbare gevolg van onze vroegere therapeutische praktijken. Omdat hondenpyodermitis een uiterst frequent voorkomende aandoening is, en de eerstelijnsbehandeling historisch gezien een ẞ-lactam antibioticum was, heeft het herhaalde gebruik van deze medicijnen een ideale evolutionaire omgeving gecreëerd voor de selectie en verspreiding van stammen die resistentiegenen dragen. Zo hebben onze eigen behandelingsprotocollen onbedoeld de opkomst gevormd van de pathogenen die vandaag het moeilijkst te behandelen zijn.
Definitie en taxonomie
Methicilline-resistentie bij stafylokokken is een fenotype dat resistentie verleent tegen praktisch alle antibiotica van de ẞ-lactamine klasse, inclusief penicillines, cefalosporines en carbapenems. Het onderliggende moleculaire mechanisme is de aanwezigheid van het mecA gen, dat gelokaliseerd is op een mobiel genetisch element genaamd stafylokokken chromosomale cassette (SCCmec). Dit gen codeert voor een gemodificeerd penicilline-bindend eiwit, de PBP2a (Penicillin-Binding Protein 2a), dat een zeer lage affiniteit heeft voor ẞ-lactamine antibiotica. Als gevolg hiervan kan de synthese van de bacteriële celwand doorgaan, zelfs in aanwezigheid van deze antibiotica, waardoor ze ineffectief worden.
Het multiresistent fenotype (MDR) dat frequent wordt waargenomen bij MRS is geen toevallig fenomeen. De SCCmec cassette is een genetisch platform dat, naast het mecA gen, genen kan dragen en overdragen die resistentie verlenen tegen andere antibioticastlassen (bijvoorbeeld tetracyclines, macroliden). Aldus kan selectiedruk uitgeoefend door het gebruik van een bètalactamine niet alleen stammen selecteren die resistent zijn tegen methicilline, maar ook co-selecteren, in één gebeurtenis, resistentie tegen meerdere andere antibioticafamilies. Dit fenomeen van co-selectie verklaart de snelle opkomst van bijna onbehandelbare stammen en versterkt het argument tegen empirisch gebruik van bètalactamines in stafylokokkeninfecties.
Een fundamenteel punt voor het begrijpen van de huidige epidemiologie is de taxonomische herclassificatie die plaatsvond in 2005. Voorheen werden de meeste coagulase-positieve stafylokokken geïsoleerd bij honden geïdentificeerd als Staphylococcus intermedius. Moleculaire technieken maakten het mogelijk om drie verschillende soorten te onderscheiden binnen de Staphylococcus intermedius groep (SIG): S. intermedius, S. delphini en S. pseudintermedius. Deze herziening onthulde dat S. pseudintermedius de overheersende soort is die honden en katten koloniseert en infecties veroorzaakt. Bijgevolg was de grote meerderheid van isolaten die eerder werden geïdentificeerd als S. intermedius in de veterinaire literatuur in werkelijkheid S. pseudintermedius. In hondermatologie zijn drie MRS soorten bijzonder relevant: S. pseudintermedius (SPIRM), S. aureus (SARM) en S. schleiferi (SSRM).
Wereldwijd belang en het “One Health” concept
Het probleem van MRS bij gezelschapsdieren overstijgt ruimschoots de muren van de veterinaire kliniek en wordt een volksgezondheidszorg. Deze situatie past perfect binnen het kader van het “One Health” (Eén gezondheid) concept, dat de diepe en onlosmakelijke onderlinge verbondenheid erkent tussen menselijke gezondheid, dierengezondheid en milieugezondheid. Gezelschapsdieren delen onze huiselijke omgeving, ontvangen vaak vergelijkbare antibioticastlassen als die gebruikt in de humane geneeskunde, en kunnen fungeren als reservoirs of vectoren voor resistente bacteriën. De aanwezigheid van SARM en SPIRM bij gezelschapsdieren plaatst hen in het centrum van een dynamische “driehoek” van transmissie tussen mensen, dieren en hun gemeenschappelijke omgeving. Het beheer van antibioticaresistentie in de veterinaire dermatologie is daarom niet alleen een kwestie van dierenwelzijn, maar ook een gedeelde verantwoordelijkheid in de mondiale strijd tegen de groeiende dreiging van “superbacteriën”.
Epidemiologie en Evolutie van Resistente Stafylokokken
De epidemiologie van MRS in de veterinaire geneeskunde is een dynamisch gebied, gekenmerkt door de snelle opkomst van resistente klonen en hun wereldwijde verspreiding. Het begrijpen van de prevalentie, risicofactoren en reservoirs van deze pathogenen is essentieel voor effectief klinisch en preventief beheer.
A. Methicilline-resistente Staphylococcus pseudintermedius (SPIRM): De Dominante Hondenpathogeen
Geschiedenis van de opkomst
Hoewel sporadische gevallen werden gerapporteerd in de jaren 1990, is de significante opkomst van SPIRM als een belangrijke klinische pathogeen een relatief recent fenomeen, dat momentum kreeg vanaf 2006. De eerste officiële erkennigen dateren van 2001 in Noord-Amerika en 2007 in Europa. Deze snelle opkomst was niet het gevolg van meerdere en onafhankelijke resistentiegebeurtenissen, maar werd voornamelijk veroorzaakt door de explosieve klonale verspreiding van enkele zeer performante bacteriële lijnen.
Wereldwijde klonale verspreiding
Analyse door multilocus sequentie typing (MLST) heeft de wereldwijde verspreiding van SPIRM in kaart gebracht. Een systematische review identificeerde vijf belangrijke klonale complexen (CC) die het epidemiologische landschap domineren.
- CC71: Oorspronkelijk beschreven als de “Europese epidemische kloon”, is het nu wereldwijd verspreid, hoewel de meerderheid van isolaten nog steeds uit Europa komt.
- CC68: Bekend als de “Noord-Amerikaanse epidemische kloon”, wordt het frequent geïsoleerd in Noord-Amerika maar is ook geïdentificeerd in Europa.
- CC258: Steeds vaker gerapporteerd in Europa, vertoont deze kloon een resistentieprofiel dat verschilt van CC71.
- CC45 en CC112: Deze lijnen zijn bijzonder prevalent in Azië, maar zijn ook gedetecteerd op andere continenten.
Deze dynamiek illustreert een tweestaps proces: ten eerste, lokale selectie van deze klonen door druk uitgeoefend door antibioticaragebruik in de veterinaire geneeskunde, met name bètalactamines; ten tweede, hun wereldwijde verspreiding gefaciliteerd door toenemende internationale bewegingen van gezelschapsdieren. Deze snelle verspreiding over uitgestrekte geografische gebieden wordt sterk gefaciliteerd door internationale verplaatsingen van honden, of het nu gaat om tentoonstellingen, fokkerij of reizen. Een studie uitgevoerd in Grenada documenteerde voor het eerst de introductie van SPIRM op het eiland, met genotypische en epidemiologische gegevens die suggereren dat “bezoekende” honden de pathogeen hebben overgedragen aan de lokale hondenpopulatie.
Prevalentie
De prevalentie van SPIRM varieert spectaculair afhankelijk van de bestudeerde hondenpopulatie, wat directe implicaties heeft voor klinische verdenking.
- Bij gezonde honden: Het dragerschap van SPIRM bij gezonde honden is over het algemeen laag. Studies rapporteren prevalentiecijfers van 0% tot 4,5%. Deze dieren zijn asymptomatische dragers.
- Bij zieke honden: De situatie is radicaal anders in populaties van honden die worden gepresenteerd met dermatologische problemen. In gespecialiseerde dermatologieklinieken kan de prevalentie van SPIRM bij honden met pyodermitis extreem hoog zijn, tot 40,5% in één studie. Een andere studie uitgevoerd in Thailand bij honden met pyodermitis toonde een algemene MRS prevalentie van 35,7%. Dit verschil benadrukt dat honden met chronische huidziekten een zeer hoog risico populatie vormen. Een grootschalige studie uitgevoerd in de Verenigde Staten tussen 2019 en 2022 analyseerde tienduizenden klinische isolaten en identificeerde 110.423 SPIRM isolaten. In Frankrijk rapporteren recentere gegevens van zieke dieren een SPIRM frequentie van 17%.
Risicofactoren
Identificatie van risicofactoren is cruciaal voor het richten van diagnostische en preventieve inspanningen. Verschillende factoren zijn consistent geassocieerd met een verhoogd risico op infectie of kolonisatie door SPIRM:
- Eerdere antibioticaragebruik: Dit is de belangrijkste en meest frequent geciteerde risicofactor. Recente blootstelling aan antibiotica, met name ẞ-lactamines en fluoroquinolonen, selecteert resistente stammen door het elimineren van concurrerende gevoelige flora.
- Contact met veterinaire omgeving: Recente ziekenhuisopnames of frequente bezoeken aan veterinaire klinieken verhogen het risico op blootstelling aan SPIRM.
- Onderliggende chronische huidziekten: Honden die lijden aan atopische dermatitis, allergieën of chronische otitis zijn bijzonder vatbaar. Deze aandoeningen verstoren de huidbarrière en vereisen vaak herhaalde antimicrobiële behandelingen, wat een vicieuze cirkel creëert.
Omgevingsreservoirs
Stafylokokken zijn robuuste bacteriën die gedurende lange perioden kunnen overleven op levenloze oppervlakken. Veterinaire klinieken fungeren als belangrijke omgevingsreservoirs voor SPIRM. Een studie toonde aan dat SPIRM kon worden geïsoleerd op 10% van de bemonsterde oppervlakken in eerstelijnszorgklinieken, zonder significant verschil tussen handcontactoppervlakken (bijv. deurknoppen, toetsenborden) en diercontactoppervlakken (bijv. onderzoekstafels). Typing van stammen toonde grote gelijkenis tussen isolaten van hetzelfde ziekenhuis, maar lage gelijkenis tussen ziekenhuizen, wat intra-ziekenhuis transmissie en persistentie aangeeft. Identieke SPIRM stammen werden gevonden bij zowel hondenpatiënten als op omgevingsoppervlakken binnen dezelfde kliniek, wat de rol van de omgeving in nosocomiale transmissie bevestigt. Inadequate handhygiëne van veterinair personeel, met gerapporteerde naleving zo laag als 14%, is een belangrijke factor die bijdraagt aan deze transmissie.
B. Methicilline-resistente Staphylococcus aureus (SARM) en S. schleiferi (SSRM): Een Vergelijkend Perspectief
Hoewel SPIRM de hoofdspeler is, spelen andere MRS een rol in hondermatologie.
Staphylococcus aureus (SARM)
- S. aureus is primair een commensaal en humane pathogeen. Zijn aanwezigheid bij honden is daarom epidemiologisch verschillend van die van S. pseudintermedius.
- Oorsprong en Transmissie: S. aureus is geen lid van de normale commensale flora van honden. Daarom betreft het, wanneer een SARM wordt geïsoleerd bij een hond, meestal transiente kolonisatie of infectie als gevolg van mens-naar-dier transmissie, een fenomeen bekend als omgekeerde zoönose of anthroponose. Deze kolonisatie is over het algemeen van korte duur, waarbij het organisme binnen enkele weken wordt geëlimineerd als er geen hernieuwde blootstelling is.
- Prevalentie en Risicofactoren: De prevalentie van SARM dragerschap bij gezonde honden is laag, over het algemeen tussen 0 en 4%. Dit percentage kan echter hoger zijn in specifieke dierenpopulaties die nauw contact hebben met het humane gezondheidssysteem, zoals therapiehonden die ziekenhuizen bezoeken of gezelschapsdieren van zorgverleners. Geïdentificeerde risicofactoren bij gezelschapsdieren voor SARM acquisitie weerspiegelen die van mensen: eerdere antibiotherapie, ziekenhuisopname en contact met een SARM-geïnfecteerde of gekoloniseerde persoon.
- Klinisch Belang: Hoewel minder frequent dan SPIRM, is SARM een opportunistische pathogeen die klinische infecties bij honden kan veroorzaken, met name pyodermites, chirurgische wondinfecties en urineweginfecties.
Staphylococcus schleiferi (SSRM)
- S. schleiferi, dat bestaat in twee subspecies (S. schleiferi subsp. schleiferi, coagulase-negatief, en S. schleiferi subsp. coagulans, coagulase-positief), wordt steeds meer erkend als een belangrijke huidpathogeen bij honden.
- Opkomende Pathogeen: Het wordt nu geïdentificeerd als een significante oorzaak van pyodermitis en externe otitis bij honden. In sommige studies is het de tweede meest frequent geïsoleerde stafylokok bij deze aandoeningen.
- Hoge Resistentiepercentages: Een verontrustende eigenschap van S. schleiferi is zijn hoge percentage methicilline-resistentie. Studies uitgevoerd in dermatologie referentiecentra rapporteerden resistentiepercentages van 40% tot 46,6%. Een studie op een minder bevooroordeelde populatie vond een resistentiepercentage van 20% bij honden met inflammatoire dermatitis.
- Multiresistentie: Net als SPIRM vertoont SSRM vaak multiresistentie, met name frequente resistentie tegen fluoroquinolonen, wat therapeutische opties verder compliceert.
Het onderscheid tussen deze drie pathogenen is van het grootste belang in de klinische praktijk. Een laboratoriumrapport dat een “Methicilline-resistente Stafylokok” identificeert, vereist een geïnformeerde interpretatie om casemanagement, communicatie met de cliënt en biosecuritymaatregelen te sturen. Bijvoorbeeld, identificatie van een SARM (S. aureus) moet onmiddellijk een humane bron doen vermoeden en een discussie over potentiële risico’s voor gezinsleden starten. Omgekeerd zal een diagnose van SPIRM het onderzoek richten op het beheer van de onderliggende huidziekte van de hond en controle van omgevingscontaminatie. De volgende tabel vat deze belangrijke verschillen samen.
|
Eigenschap |
Staphylococcus pseudintermedius (SPIRM) |
Staphylococcus aureus (SARM) |
Staphylococcus schleiferi (SSRM) |
|
Primaire Commensale Status |
Hond (normale huid- en slijmvliesflora) |
Mens (transiente hondenkolonisatie) |
Hond en Mens (huidflora) |
|
Prevalentie in Hondenpyodermitis |
Zeer hoog (dominante pathogeen) |
Laag tot matig |
Laag tot matig (opkomende pathogeen) |
|
Primair Reservoir |
Dier (hond) |
Mens (gezondheidssysteem, gemeenschap) |
Dier en Mens |
|
Primaire Transmissieroute |
Dier-Dier, Omgeving-Dier |
Mens-Dier (omgekeerde zoönose) |
Minder gedefinieerd, waarschijnlijk Dier-Dier |
|
Zoönotisch Potentieel (Dier -> Mens) |
Laag maar gedocumenteerd |
Significant (belangrijke volksgezondheidszorg) |
Zeldzaam, voornamelijk nosocomiaal bij mensen |
Pathogenese van Stafylokokken Pyodermitis
Stafylokokken pyodermitis is niet simpelweg de aanwezigheid van bacteriën op de huid; het is het resultaat van een complexe interactie tussen de pathogeen, gastheer en omgeving. De overgang van S. pseudintermedius van een eenvoudige huidbewoner naar een infectieus agens hangt af van de verstoring van het delicate evenwicht dat huiuhomeostase handhaaft.
Van Commensaal naar Opportunistische Pathogeen: De Rol van de Huidbarrière
- S. pseudintermedius is een commensaal goed aangepast aan zijn hondengastheer, die de huid en slijmvliezen (neusgaten, mond, farynx, perineum) van 46% tot 92% van gezonde honden koloniseert zonder ziekte te veroorzaken. Infectie is een opportunistische gebeurtenis, die alleen optreedt wanneer gastheerafweer verzwakt is. De huidbarrière, bestaande uit fysieke (stratum corneum), chemische (lipiden, antimicrobiële peptiden) en immunologische elementen, is de primaire verdedigingslinie. Elke verandering van deze barrière creëert een toegangspoort voor bacteriële invasie.
Het klinische belang van SPIRM ligt niet in verhoogde virulentie ten opzichte van zijn gevoelige tegenhanger (MSSP). Studies hebben niet aangetoond dat methicilline-resistente stammen intrinsiek agressiever of pathogener zijn. De ziekteoechanismen en klinische laesies die ze veroorzaken zijn niet te onderscheiden. De echte uitdaging ligt elders: in therapeutisch falen. Bij een SPIRM infectie is empirische behandeling met een eerstelijns antibioticum, zoals cefalexine, gedoemd te falen. Dit initiële falen veroorzaakt een cascade van negatieve gevolgen: de ziekte wordt verlengd, wat morbiditeit en ongemak van het dier verhoogt; de bacteriële last op het dier en in zijn omgeving neemt toe, wat het transmissierisico verhoogt; en dit leidt vaak tot cycli van opeenvolgende en ineffectieve antibiotherapieën, die niet alleen het probleem niet oplossen, maar aanvullende selectiedruk uitoefenen, wat de opkomst van additionele resistenties bevordert. Zo transformeert een eenvoudige pyodermitis in een complex, chronisch, kostbaar en frustrerend klinisch geval, met potentiële implicaties voor de volksgezondheid. Het is deze dimensie van therapeutisch falen die SPIRM zijn verwoestende klinische belang verleent.
Rol van Virulentiefactoren
Zodra de barrière is overgestoken, gebruikt S. pseudintermedius een arsenaal van virulentiefactoren om infectie te vestigen.
- Exfoliatieve Toxinen (ExpA en ExpB): Deze eiwitten zijn hoofdspelers in de vorming van pyodermitis laesies. Ze werken als zeer specifieke proteasen die honden desmogleïne-1 targeten en klieven, een desmosomale cadherin essentieel voor adhesie tussen keratinocyten in de epidermis. Degradatie van desmogleïne-1 verstoort epidermale cohesie, wat intra-epidermale klieving (acantholyse) en vorming van subcorneale pustels veroorzaakt. Intradermale injectie van deze gezuiverde toxinen bij honden reproduceert klinische tekenen van pyodermitis, zoals erytheem en korstvorming, wat hun directe pathogene rol bevestigt. Andere toxinen omvatten het exfoliatieve toxine SIET, een bicomponent leukotoxine, Luk-I, die leukocyten target en vernietigt, en superantigene enterotoxinen, zoals SECCANINE, die polyklonale T-lymfocyte activatie kunnen veroorzaken.
- Adhesinen en Oppervlakeiwitten: Om infectie te initiëren moet de bacterie eerst adhereren aan gastheercellen. S. pseudintermedius brengt een serie oppervlakeiwitten tot expressie, genaamd adhesinen (Sps familie), die specifiek binden aan gastheer extracellulaire matrix componenten, zoals fibrinogeen, fibronectine en cytokeratin-10. Eiwitten zoals SpsD en SpsL faciliteren niet alleen adhesie aan corneocyten, maar ook invasie van keratinocyten en biofilmvorming.
- Biofilmvorming: Biofilm is een gestructureerde gemeenschap van bacteriën ingebed in een zelf-geproduceerde polymere matrix, die bescherming biedt tegen gastheer immuunafweer en antibiotica, wat bijdraagt aan chroniciteit van infecties. Biofilmvorming is bijzonder kritiek in chronische infecties, otitis en chirurgische site infecties, met name op inerte materialen zoals implantaten of hechtingsmateriaal. Biofilm beschermt bacteriën effectief tegen gastheer immuunrespons en antibioticapenetratie, waardoor infectie-eradicatie extreem moeilijk wordt.
De Centrale Predisponerende Factor: Verstoring van de Huidbarrière
Vrijwel alle gevallen van stafylokokken pyodermitis bij honden zijn secundaire ziekten. De bewering dat “gezonde honden geen huidinfecties ontwikkelen” is een fundamenteel principe in de veterinaire dermatologie. Identificatie en beheer van de onderliggende oorzaak zijn daarom niet alleen belangrijk voor behandeling, maar absoluut essentieel voor preventie van recidieven.
- Atopische Dermatitis en Allergieën: Dit is de meest frequente onderliggende oorzaak. Allergische ontsteking (of het nu gaat om omgevingsallergenen, voedsel of vlooienbeten) compromitteert de huidbarrière op verschillende manieren. Ten eerste veroorzaakt de intense jeuk die het teweegbrengt zelftrauma (krabben, likken, bijten) dat het stratum corneum fysiek beschadigt. Ten tweede verandert de ontsteking zelf de samenstelling en organisatie van intercellulaire lipiden (ceramiden) en vermindert de productie van natuurlijke antimicrobiële peptiden, waardoor de huid permeabeler wordt en minder in staat om zich te verdedigen tegen microben. Deze ontstoken en beschadigde huidomgeving is een ideaal terrein voor S. pseudintermedius proliferatie.
- Andere Predisponerende Factoren: Andere aandoeningen kunnen ook huidintegriteit veranderen en predisponeren voor infecties. Deze omvatten endocrinopathieën zoals hypothyreoïdie en hypercorticisme (Cushing syndroom), die huidvernieuwing en lokale immuniteit beïnvloeden; ectoparasieten (Demodex, Sarcoptes) die directe schade en ontsteking veroorzaken; en keratinisatiestoornissen (seborrhoe) die het huidoppervlak modificeren.
Klinische Benadering en Diagnostiek van Resistente Stafylokokken Pyodermites
Bij een pyodermitis geval moet de clinicus een systematische en evidence-based benadering adopteren. Het tijdperk van antimicrobiële resistentie vereist meer diagnostische precisie om therapeutische faling te vermijden en verstandig antibioticaragebruik te bevorderen.
A. Klinische Presentatie
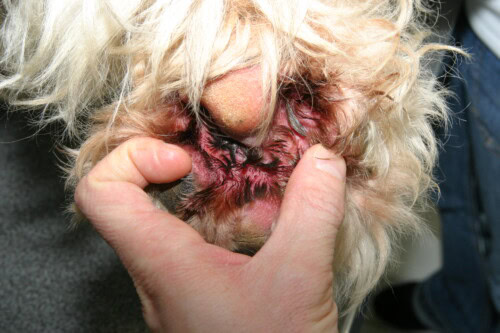
Stafylokokken huidinfecties bij honden worden geclassificeerd op basis van de diepte van weefselaantasting.
- Oppervlakkige Pyodermitis: De infectie is beperkt tot de epidermis en haarfollikels. De meest voorkomende vorm is oppervlakkige bacteriële folliculitis. Typische klinische laesies zijn gevarieerd en omvatten:
- Folliculaire Papulae en Pustels: Kleine rode verheffingen (papulae) of met pus gevulde (pustels), gecentreerd rond een haar.
- Epidermale Collaretten: Dit zijn zeer karakteristieke laesies. Ze presenteren zich als circulaire alopeciën met een rand van schilfers of korsten die centrifugaal uitbreiden.
- Doelwitlaesies: Gebieden van centraal erytheem met een blekere rand en een perifere erythemateuze ring.
- “Mottig” Aspect: Bij kortharing honden kan folliculitis zich manifesteren als meerdere kleine alopeciegebieden, wat de vacht een “door motten opgegeten” uiterlijk geeft.
- Andere tekenen zoals korsten, erytheem en post-inflammatoire hyperpigmentatie zijn ook frequent.
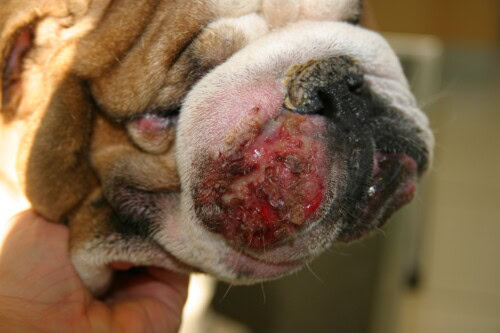
- Diepe Pyodermitis: Deze vorm is ernstiger omdat het ruptuur van haarfollikels (furunculose) en extensie van infectie in de dermis en soms hypodermis (cellulitis) inhoudt. Klinische tekenen zijn spectaculairder en vaak pijnlijk:
- Noduli en Hemorragische Bulen: Verheven, stevige of fluctuerende laesies, vaak gevuld met purulent of bloederig materiaal.
- Drainerende Fistels: Openingen in de huid waar serosanguineus of purulent exsudaat uit vloeit.
- Ernstige Tekenen: Oedeem, ulcera, dikke korsten en gemarkeerde ontsteking zijn gewoon. In tegenstelling tot oppervlakkige pyodermitis kunnen honden met diepe pyodermitis systemische tekenen vertonen zoals koorts, lethargie en anorexie.
Een punt van het grootste belang moet worden benadrukt: het is klinisch onmogelijk om pyodermitis veroorzaakt door een methicilline-resistente stafylokokstam te onderscheiden van een infectie veroorzaakt door een gevoelige stam. De laesies zijn morfologisch identiek. Verdenking van resistente infectie moet daarom nooit berusten op het uiterlijk van laesies, maar eerder op de anamnese van de patiënt, aanwezigheid van risicofactoren en, vooral, de respons op behandeling.
B. Evidence-based Diagnostische Strategie
De komst van MRS heeft een paradigmaverschuiving opgelegd in de diagnostische benadering van pyodermitis. De historische benadering van “eerst behandelen, later vragen stellen” met empirische antibiotica is niet alleen verouderd geworden, maar wordt nu als gevaarlijk en strijdig met antibiotic stewardship principes beschouwd. Cytologie, vroeger beschouwd als aanvullend instrument, is een essentiële en niet-onderhandelbare stap geworden van het initiële onderzoek. Cytologie negeren in de huidige context van wijdverspreide resistentie vormt professionele nalatigheid. Het is het draaipunt van klinische beslissing: het bevestigt de aanwezigheid van bacteriële infectie, wat antimicrobiële behandeling rechtvaardigt (die topisch zou moeten zijn in eerste instantie), het begeleidt herkenning van gevallen die onmiddellijke kweek vereisen (aanwezigheid van bacillen, diepe pyodermitis), en het maakt evaluatie van behandelingsrespons mogelijk.
Huidcytologie: Het Onmisbare Eerstelijns Instrument
Cytologie is een snelle, goedkope, minimaal invasieve en in de kliniek uitvoerbare diagnostische test die systematisch moet worden uitgevoerd bij elke patiënt met laesies compatibel met pyodermitis.
- Bemonsteringstechniek: De methode hangt af van de aard van de laesie.
- Directe impressie op glaasje: Voor vochtige of exsudatieve laesies, of na het breken van een intacte pustel met een steriele naald.
- Tape-test (Kleefband): Ideaal voor droge, schilferige laesies of gelegen in moeilijk bereikbare gebieden zoals interdigitale ruimten.
- Swab: Nuttig voor het bemonsteren van materiaal in gehoorkanalen of fistels.
- Interpretatie: Het monster wordt gekleurd (bijvoorbeeld met een Wright-Giemsa-achtige kleuring) en microscopisch onderzocht. De ontdekking van cocci gefagocyteerd door gedegenereerde neutrofielen is het pathognomonische bewijs van bacteriële pyodermitis. De aanwezigheid van vele extracellulaire bacteriën geassocieerd met een populatie van inflammatoire cellen is ook zeer suggestief. Cytologie maakt ook detectie van andere agentia mogelijk (gisten van het Malassezia type, bacillen) en evaluatie van het type inflammatoire respons.
Cytologie is het eerste primordiale onderzoek om uit te voeren
Bacteriële Kweek en Antibiogram: De Sleutel tot Gerichte Therapie
Bacteriële kweek met antimicrobiële gevoeligheidstest (antibiogram) is niet nodig voor alle pyodermitis gevallen, maar is imperatief in specifieke omstandigheden om rationele therapie te begeleiden.
- Duidelijke Indicaties: Kweek en antibiogram zijn sterk aanbevolen, zelfs verplicht, in de volgende situaties:
- Onvoldoende klinische respons (minder dan 50% verbetering van laesies) na twee weken passende systemische antibiotherapie.
- Verschijning van nieuwe laesies (papulae, pustels) tijdens lopende antibiotische behandeling van ten minste twee weken.
- Aanwezigheid van bacillen bij cytologisch onderzoek.
- Aanwezigheid van diepe pyodermitis laesies (furunculose, cellulitis, noduli).
- Voorgeschiedenis van multiresistente infectie bij het dier of een ander dier in het huishouden.
- Bemonsteringsmethodologie: Om betrouwbaar te zijn moet de bemonstering voor kweek aseptisch worden uitgevoerd om contaminatie te vermijden. De kwaliteit van bemonstering is bepalend. Ideale bemonsteringssites en technieken zijn:
- Intacte Pustel: Dit is de ideale site. Na zachte desinfectie wordt de pustel steriel gebroken met een naald en de inhoud verzameld op een swab.
- Korst: De swab wordt over het vochtige huidoppervlak gerold na het voorzichtig optillen van een recente korst.
- Epidermale Collarette: De swab wordt stevig over de actieve rand van de laesie gerold.
- Nodule of Fistel: Een weefselbiopsie voor kweek is de methode van keuze voor diepe laesies.
- Interpretatie en Nut: Het laboratorium zal de bacteriële soort identificeren en zijn gevoeligheid voor een panel antibiotica testen. Voor stafylokokken wordt de gevoeligheidstest voor oxacilline of cefoxitine gebruikt om methicilline-resistentie te detecteren (aanwezigheid van het mecA gen). Het antibiogram is de enige manier om een effectief systemisch antibioticum te kiezen tegen een SPIRM stam, die vaak multiresistent is.
Het antibiogram blijkt primordial in het beheer van MRS
Therapeutische Principes en Beheer van SPIRM Infecties
Het beheer van SPIRM pyodermites is geëvolueerd naar een multimodale benadering die de nadruk legt op topische therapie, systemische antibiotherapie reserveert voor specifieke indicaties en, vooral, de onderliggende oorzaak van infectie aanpakt.
A. Topische Therapie: Hoeksteen van Behandeling
Geconfronteerd met stijgende resistentie is topische therapie verheven van de status van ondersteunende behandeling tot die van eerstelijnsbehandeling. Internationale richtlijnen, zoals die van de World Association for Veterinary Dermatology (WAVD), bevelen nu topische therapie aan als voorkeursbehandelingsmodaliteit voor oppervlakkige pyodermites, of ze nu veroorzaakt worden door gevoelige of resistente stammen. Verschillende studies hebben aangetoond dat een goed uitgevoerd topisch behandelingsprotocol even effectief kan zijn als systemische antibiotherapie voor het oplossen van oppervlakkige pyodermitis, inclusief die veroorzaakt door SPIRM. De voordelen zijn veelvoudig: verkrijging van zeer hoge antiseptische concentraties op de infectieplaats (ruim boven de minimale remmende concentratie), vermindering van het risico op resistentieselectie in andere systemen (zoals het spijsverteringskanaal), en niet-specifieke voordelige effecten zoals mechanisch debridement van korsten en debris.
Effectieve Antiseptische Agentia
Verschillende actieve ingrediënten hebben hun effectiviteit bewezen.
- Chloorhexidine: Dit is het meest bestudeerde en aanbevolen topische agens vanwege zijn krachtige in vivo antimicrobiële activiteit en resteffect. Het is bactericide tegen stafylokokken, inclusief methicilline-resistente stammen. Effectieve concentraties in veterinaire producten variëren over het algemeen van 2% tot 4%.
- Benzoylperoxide: Bij concentraties van 2,5% tot 3% bezit het antimicrobiële activiteit, evenals keratolytische (helpt dode huidlagen te elimineren), comedolytische (opent haarfollikels) en ontvettende eigenschappen. Het kan echter uitdrogend en irriterend zijn voor de huid, wat het gebruik kan beperken of gelijktijdig gebruik van emolliënten kan vereisen.
- Andere agentia: Andere antiseptica zoals verdund natriumhypochloriet (verdunde bleekwater), azijnzuur/boorzuur, en ethyllactaat hebben ook enige effectiviteit getoond en kunnen waardevolle opties zijn.
Toepassingsprotocollen
Het succes van topische therapie hangt kritisch af van protocolnaleving.
- Formuleringen: De keuze van formulering hangt af van de uitgebreidheid van laesies, type vacht en toepassingsgemak voor de eigenaar.
- Shampoos: Ideaal voor gegeneraliseerde infecties, ze maken behandeling van grote huidoppervlakken mogelijk.
- Schuimen, Sprays, Doekjes: Zeer nuttig voor dagelijkse toepassing, voor gelokaliseerde behandelingen, of voor dagen zonder bad. Ze vereisen over het algemeen geen spoeling.
- Crèmes, Zalven, Gels: Geschikt voor gelokaliseerde laesies en weinig behaarde gebieden.
- Frequentie en Contacttijd: Een contacttijd van ten minste 10 minuten is cruciaal opdat antiseptische shampoos hun bactericide effect kunnen uitoefenen. De aanbevolen badfrequentie is over het algemeen 2 tot 3 keer per week, maar kan worden verhoogd tot dagelijkse frequentie in ernstige SPIRM gevallen. Schuimen en sprays kunnen een tot twee keer per dag worden toegepast. Behandeling moet worden voortgezet gedurende ten minste 7 tot 10 dagen na volledige klinische resolutie van laesies om vroege recidieven te voorkomen. Voor langharing of dichte vacht dieren is scheren vaak onmisbaar om het product de huid te laten bereiken en effectief te laten werken.
Tabel 1: Topische Therapieprotocollen voor Oppervlakkige Hondenpyodermitis
|
Actief Principe |
Gangbare Concentraties |
Beschikbare Formuleringen |
Aanbevolen Toepassingsprotocol |
Klinische Opmerkingen |
|
Chloorhexidine |
2%, 3%, 4% |
Shampoo, Schuim, Spray, Doekjes, Gel |
Shampoo: 2-3 keer/week, contacttijd van 10 minuten. Schuim/Spray/Doekjes: 1-2 keer/dag, vooral op dagen zonder shampoo. |
Eerstekeus antisepticum. Zeer goede effectiviteit en tolerantie. Scheren verbetert de effectiviteit significant. |
|
Benzoylperoxide |
2.5%, 3% |
Shampoo, Gel |
Shampoo: 2-3 keer/week, contacttijd van 5-10 minuten. |
Keratolytische en ontvettende werking nuttig in bepaalde gevallen. Hoger irritatie- en uitdrogingspotentieel dan chloorhexidine. |
|
Natriumhypochloriet |
0.005% (verdunning) |
Badoplossing |
Baden: 2-3 keer/week, contacttijd van 10-15 minuten. |
Interessant en goedkoop alternatief. Extemporaneous bereiding nodig (verdund bleekwater). |
|
Topische antibiotica (Mupirocine, Fusidinezuur) |
2% |
Zalf, Crème |
Toepassing: 2-3 keer/dag op zeer gelokaliseerde laesies. |
Gereserveerd voor focale laesies. Extensief gebruik is verboden om het risico van resistentieselectie te beperken. Mupirocine mag niet worden gebruikt (GEDAC Aanbevelingen) |
B. Systemische Antibiotherapie: Een Beredeneerde en Gerichte Benadering
Het gebruik van systemische antibiotica moet een weloverwogen en gerechtvaardigde beslissing zijn, geen reflex. Het is gereserveerd voor diepe pyodermites, waar infectie weefsels bereikt die topische therapie niet effectief kan penetreren, en voor gevallen van gegeneraliseerde oppervlakkige pyodermitis die niet reageren op alleen goed uitgevoerde topische behandeling.
Selectieprincipe
De keuze van een systemisch antibioticum voor een vermoede of bevestigde SPIRM infectie moet imperatief gebaseerd zijn op antibiogramresultaten. Empirisch gebruik van tweede of derde lijn antibiotica is een gevaarlijke praktijk die de opkomst van nog uitgebreidere resistenties bevordert. Het is cruciaal om de “expertregel” te respecteren: een stafylokok resistent tegen oxacilline moet worden beschouwd als klinisch resistent tegen alle bètalactamines, zelfs als het antibiogram schijnbare gevoeligheid voor bepaalde cefalosporines suggereert. De behandelingsduur moet voldoende lang zijn: minimaal 3 tot 4 weken voor oppervlakkige pyodermitis en 6 tot 8 weken voor diepe pyodermitis, altijd de behandeling voortzettend gedurende 1 tot 2 weken na volledige klinische resolutie.
Therapeutische Opties voor SPIRM (gebaseerd op gevoeligheid)
SPIRM is, per definitie, resistent tegen alle ẞ-lactamine antibiotica. Bovendien zijn epidemische klonen vaak multiresistent, met kruisresistentie tegen vele andere antibioticastlassen die gewoonlijk gebruikt worden in de veterinaire geneeskunde, zoals tetracyclines, macroliden (erythromycine), lincosamiden (clindamycine) en fluoroquinolonen (enrofloxacine). Therapeutische opties zijn daarom beperkt en moeten zorgvuldig worden gekozen op basis van kweekresultaten. Het gebruik van antibiotica van kritiek belang in de humane geneeskunde (vancomycine, linezolid, teicoplanine) wordt sterk ontmoedigd.
Tabel 2: Systemische Antibiotherapie Opties voor Resistente Stafylokokkeninfecties bij Honden (op basis van een antibiogram)
|
Antibioticum |
Dosering (Hond) |
Toedieningsfrequentie |
Opmerkelijke Bijwerkingen |
Voorzorgsmaatregelen en Aanbevolen Monitoring |
|
Chlooramfenicol |
50 mg/kg |
Elke 8 uur (TID) |
Gastro-intestinale stoornissen (braken, diarree), neurologische zwakte, reversibele myelosuppressie (dosisafhankelijk). |
Smalle veiligheidsmarge. Hematologische monitoring aanbevolen bij langdurige behandelingen. Gecontraïndiceerd bij fokdieren. |
|
Doxycycline / Minocycline |
5-10 mg/kg |
Elke 12 uur (BID) |
Gastro-intestinale stoornissen (braken, oesofagitis). Minocycline kan effectiever zijn dan doxycycline tegen bepaalde stammen. |
Toedienen met voedsel en water om het risico op oesofagitis te verminderen. Fotosensitiviteit is zeldzaam maar mogelijk. |
|
Clindamycine |
11 mg/kg |
Elke 12 uur (BID) |
Gastro-intestinale stoornissen. |
Vaak ineffectief tegen SPIRM vanwege frequente co-resistentie. Effectiviteit afhankelijk van antibiogram. |
|
Rifampicine |
5-10 mg/kg |
Elke 24 uur (SID) |
Potentieel ernstige hepatotoxiciteit, gastro-intestinale stoornissen, oranje verkleuring van urine en tranen. |
Nooit gebruiken als monotherapie (risico op snelle selectie van resistente mutanten). Monitoring van leverenzymen imperatief voor en tijdens behandeling (bijv. op 2 en 4 weken). Nooit te gebruiken (GEDAC Aanbevelingen) |
|
Gepotentieerde sulfonamiden (TMS) |
15-30 mg/kg |
Elke 12 uur (BID) |
Keratoconjunctivitis sicca (KCS), overgevoeligheidsreacties (polyartritis, anemie, trombocytopenie), hepatopathieën. |
Hoog idiosyncratisch risico bij bepaalde rassen (Doberman). Schirmer test monitoring aanbevolen bij lange behandelingen. |
Uitdagingen en Bijwerkingen
Behandeling van SPIRM infecties met “reserve” antibiotica is niet zonder moeilijkheden.
- Chlooramfenicol: Hoewel vaak effectief in vitro, is het geassocieerd met een zeer hoge incidentie van gastro-intestinale bijwerkingen (braken, diarree, anorexie), die frequent leiden tot behandelingsstop. Gevallen van reversibele neurotoxiciteit (parese van achterpoten) zijn ook beschreven.
- Doxycycline/Minocycline: Klinische faling is gerapporteerd ondanks gunstige gevoeligheidstesten. Dit kan te wijten zijn aan gevoeligheidsinterpretatie drempels (breakpoints) die niet altijd nauwkeurig klinische effectiviteit voorspellen voor S. pseudintermedius.
- Rifampicine: Moet worden gebruikt in combinatie met een ander effectief antibioticum om snelle selectie van resistente mutanten te voorkomen. Monitoring van leverfunctie wordt aanbevolen vanwege het risico op hepatotoxiciteit.
- Aminoglycosiden (bijv. amikacine): Deze medicijnen vereisen injectietoediening en zorgvuldige monitoring van nierfunctie vanwege hun potentiële nefrotoxiciteit.
C. Beheer van Onderliggende Oorzaak: De Sleutel tot Preventie van Recidieven
Antimicrobiële behandeling, of het nu topisch of systemisch is, richt zich alleen op de gevolgen van de ziekte (bacteriële infectie) en niet op de oorzaak. Zonder een rigoureuze diagnose en controle van de onderliggende primaire ziekte (atopische dermatitis, voedselallergie, hypothyreoïdie, enz.) zijn pyodermitis recidieven onvermijdelijk. Elk recidief vereist een nieuwe behandelingscyclus, wat de selectiedruk voor resistentie verhoogt en het risico op opkomst van nog moeilijker te behandelen stammen. Langetermijnbeheer van deze primaire aandoeningen is daarom de meest effectieve strategie om deze cyclus te doorbreken, de levenskwaliteit van het dier te verbeteren en de algemene afhankelijkheid van antibiotica te verminderen.
Kolonisatie versus Infectie: Klinische en Epidemiologische Implicaties
Het onderscheid tussen kolonisatie en infectie door een MRS is een fundamenteel concept waarvan begrip essentieel is voor rationeel patiëntenbeheer en transmissiepreventie. Deze twee toestanden vertegenwoordigen zeer verschillende biologische en klinische scenario’s, met verschillende implicaties voor behandeling en volksgezondheid.
Definitie en Onderscheid
- Kolonisatie (of Dragerschap): Deze toestand wordt gedefinieerd door de aanwezigheid en vermenigvuldiging van een bacterie, zoals SPIRM, op lichaamsoppervlakken van een gastheer (huid, nasale, orale, anale slijmvliezen) zonder dat er klinische ziektesignalen of inflammatoire respons van de gastheer zijn. Het dier is een “gezonde drager“; de bacterie vormt deel van zijn oppervlaktemicroflora, transiënt of persistent, maar veroorzaakt geen schade.
- Infectie: Infectie treedt op wanneer de bacterie de verdedigingsbarrières van de gastheer doordringt, weefsels binnenval