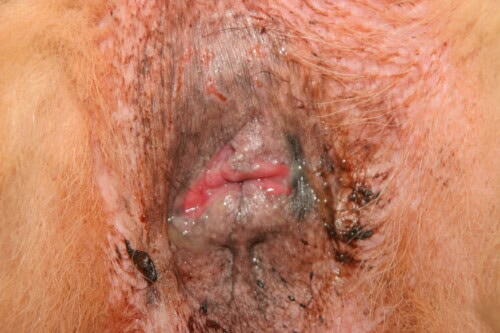
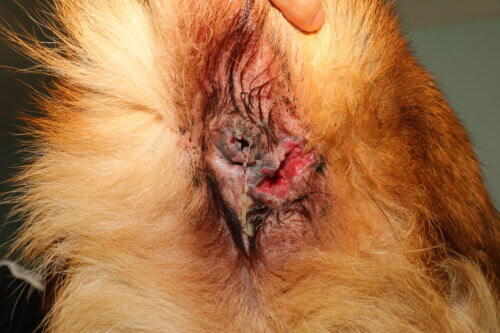
De recente jaarlijkse GEDAC-dagen die plaatsvonden in Ajaccio waren voor onze collega Vincent Bruet de gelegenheid om de stand van zaken met betrekking tot perianale fistels, hun pathogenese, hun klinische manifestaties en de huidige therapeutische benaderingen te bespreken.
Perianale fistels bij honden vertegenwoordigen een potentieel invaliderende dermatologische aandoening die, bij gebrek aan passende en snelle behandeling, kan leiden tot onomkeerbare veranderingen in het rectum en de anus, soms resulterend in euthanasie. Deze pathologie, ook bekend als anale furunculose, treft voornamelijk Duitse Herdershonden maar kan ook andere rassen treffen en manifesteert zich door fistelgangen of ulceraties rond de anus.
Lang beschouwd als gerelateerd aan anatomische factoren, wordt de pathogenese van perianale fistels tegenwoordig erkend als voornamelijk immuun-gemedieerd. De therapeutische aanpak is ook geëvolueerd, van een voornamelijk chirurgische benadering naar een hoofdzakelijk medische strategie. Dit artikel biedt een samenvatting van de huidige kennis over deze aandoening en presenteert therapeutische aanbevelingen gebaseerd op een systematische analyse van de wetenschappelijke literatuur.
Pathogenese en klinische aspecten van perianale fistels bij honden
Een complexe en multifactoriële etiologie
De exacte pathogenese van perianale fistels blijft gedeeltelijk ondoorgrond, ondanks talrijke studies. Historisch gezien zijn verschillende hypothesen aangedragen om het ontstaan van deze aandoening te verklaren. De hoge incidentie bij Duitse Herders heeft aanvankelijk een genetische link doen vermoeden, maar tot nu toe is er geen specifieke genetische marker geïdentificeerd. Evenzo werd het dragen van een lage staart als een predisponerende factor beschouwd, een theorie die tegenwoordig weerlegd is aangezien andere rassen ook worden getroffen en staartamputatie niet effectief is als behandeling.
Recent onderzoek wijst naar een immuun-gemedieerde pathogenese. Er zijn veranderingen in de lokale inflammatoire respons aangetoond, met name een infiltratie door T-lymfocyten CD31+ en een toename van de expressie van cytokininen geassocieerd met type 1 helper T-lymfocyten in de lesionale huid. Deze mechanismen omvatten waarschijnlijk:
- Een lokale ontsteking gemedieerd door T-lymfocyten
- Een abnormale activering van macrofagen, met overexpressie van matrixmetalloproteïnasen MMP-9 en MMP-13
- Een disfunctionele immuunrespons op microben in de perianale regio
- Mogelijke genezingsanomalieën in de perianale regio
- Een mogelijke voedselovergevoeligheidsreactie, hoewel deze hypothese nog moet worden bevestigd
Een genetische studie heeft een associatie aangetoond tussen het klasse II DLA-DRB1*00101 allel en een verhoogd risico op de ontwikkeling van perianale fistels bij Duitse Herders. Klasse II-moleculen van het hoofdhistocompatibiliteitscomplex dragen bij aan de presentatie van antigenen en de activering van T-lymfocyten, wat de hypothese van een immuun-gemedieerde pathogenese ondersteunt. Een andere studie onthulde een potentiële associatie met de genregio’s ADAMTS16 en CTNND2, waarvan laatstgenoemde ook wordt geassocieerd met de ziekte van Crohn en colitis ulcerosa bij mensen.
Klinische presentatie en signalement
Rasvoorkeur en leeftijd van verschijnen
Perianale fistels treffen voornamelijk Duitse Herders, die volgens sommige studies meer dan 80% van de getroffen populatie vertegenwoordigen. Verschillende andere rassen kunnen echter ook worden getroffen, waaronder:
- Beagles
- Border Collies
- Australian Shepherds
- Ierse Setters
- Chesapeake Bay Retrievers
- Leonbergers
- Staffordshire Bull Terriërs
- Shih Tzu
- Welsh Corgis Pembroke
- Boxers
- Labrador Retrievers
- Kruisinghonden
De leeftijd van optreden varieert over het algemeen van jonge volwassenheid tot middelbare leeftijd, met een bereik van 2 tot 9 jaar voor de meeste patiënten. Er is geen duidelijke geslachts- of sterilisatievoorkeur vastgesteld, hoewel een studie een verhoogd risico heeft gesuggereerd bij volledige mannelijke Duitse Herders in vergelijking met gecastreerde mannetjes.
Laesionele aspecten en klinische manifestaties
De karakteristieke laesies van perianale fistels omvatten:
- Sinussen of fistelgangen rond de anus
- Perianale ulceraties
- Erosies
- Pustels in minder ernstige gevallen
- Minder vaak rectale fistels
Matige perianale fistellaesies
Ernstige letsels voornamelijk in het onderste rechterkwadrant
Het is belangrijk op te merken dat, in tegenstelling tot wat de term “perianale fistel” doet vermoeden, de huidige sinusgangen meestal niet communiceren met het rectale lumen, in tegenstelling tot de fistels die worden waargenomen bij de ziekte van Crohn bij de mens. Deze laesies kunnen enkelvoudig of meervoudig zijn en variëren in ernst van mild tot ernstig, met vaak aanzienlijke bijbehorende pijn.
De door eigenaren gerapporteerde klinische symptomen zijn onder andere:
- Tenesmus (verhoogde aandrang om te ontlasten)
- Hematochezie (bloed in de ontlasting)
- Dyschezie (pijn bij het ontlasten)
- Uitstoot van kleine, frequente ontlastingsvolumes
- Overmatig perianaal likken
- Purulente afscheiding
- Obstipatie
- Coprofagie
- Anorexie
- Diarree
- Fecale incontinentie
- Gewichtsverlies
- Lethargie
Deze klinische manifestaties kunnen sterk invaliderend zijn en een significante impact hebben op de levenskwaliteit van het dier. Een verband tussen perianale fistels en colitis is aangetoond, en sommige getroffen honden vertonen ook zachte of slijmige ontlasting, diarree en een verhoogde frequentie van ontlastingen.
Diagnostische benadering
Klinisch onderzoek en differentiaaldiagnose
De diagnose van perianale fistels is voornamelijk gebaseerd op de klinische presentatie en lichamelijk onderzoek, vooral bij Duitse Herders. Een grondig onderzoek van het perianale gebied en een rectaal toucher zijn essentieel om de omvang van de laesies te beoordelen en eventuele bijbehorende afwijkingen te identificeren. Vanwege de pijn en het ongemak veroorzaakt door deze aandoening kan sedatie nodig zijn om een volledig rectaal onderzoek uit te voeren.
Het verkennen van de fistelgangen met een wattenstaafje of een vergelijkbaar instrument maakt het mogelijk om hun diepte te bepalen. Klinische follow-up kan worden uitgevoerd door de dieptes van deze gangen te meten. Afhankelijk van de ernst en de duur van de ziekte kan het rectaal onderzoek een afwezigheid van interne afwijkingen of ernstige fibrose aan het licht brengen, herkenbaar door een verdikking van het perianale gebied met de mogelijkheid van anale stenose.
Voor alle patiënten moeten een grondige palpatie en expressie van de anaalklieren worden uitgevoerd om een abces van de anaalklier uit te sluiten en te bepalen of de perianale fistels communiceren met de anaalklieren. Bovendien kunnen de fistelgangen worden gespoeld met een katheter en steriele fysiologische zoutoplossing om te bepalen of ze onderling communiceren of dat er sprake is van betrokkenheid van de anaalklieren.
De differentiaaldiagnose varieert aanzienlijk afhankelijk van de aanwezige klinische symptomen:
- Bij alleen perianaal jeuk: allergische dermatitis (atopische dermatitis en ongewenste voedselreacties), abcessen van de anaalklieren
- In geval van tenesmus en hematochezie zonder zichtbare fistelgangen: gastro-intestinale aandoeningen (inflammatoire darmziekte, darmparasieten, rectale stenoses)
- Geülcereerd perianaal neoplasma (perianaal adenoom of adenocarcinoom)
- Cutanieuze-mucoïsche lupus erythematosus (LECM)
Het is belangrijk op te merken dat Duitse Herders ook vatbaar zijn voor LECM, wat kan leiden tot anale of perianale laesies. Perianale fistels onderscheiden zich meestal van LECM door sinuskanalen of goed begrensde kraterachtige zweren, terwijl LECM wordt geassocieerd met meer confluente erosies, zweren, erytheem en korsten.
Als de klinische differentiatie tussen perianale fistels en LECM moeilijk is, kunnen huidbiopten voor histopathologie nuttig zijn. Evenzo, als de hond tot een minder vaak getroffen ras behoort, moeten andere oorzaken op basis van de klinische symptomen eerst worden uitgesloten.
Histopathologische beoordeling
Hoewel histopathologie zelden wordt uitgevoerd voor de diagnose van perianale fistels bij honden, kan het worden overwogen in gevallen van ongewone klinische presentatie of bij een minder vaak getroffen ras. Histopathologische kenmerken zijn onder meer:
- Een periadnexale ontsteking met of zonder furunculose
- Een uitgesproken hidradenitis
- Periadnexale fibrose
- Een ulceratie
- De vorming van met epitheel beklede sinuskanalen in de dermis
Inflammatoire infiltraten, bestaande uit neutrofielen, lymfocyten, plasmacellen en macrofagen, kunnen worden waargenomen in de sinuskanalen. Diepere laesies kunnen ook geassocieerd zijn met een pyogranulomateuze cellulitis en lymfoïde follikels.
De colonscopieën van honden met anale fistels kunnen histopathologische tekenen van colitis vertonen; een studie vond histopathologische veranderingen die consistent zijn met een diagnose van colitis bij 9 van de 18 honden met anale fistels.
Therapeutische benaderingen van perianale fistels
Chirurgische behandeling: een beperkte rol
Ontwikkeling van chirurgische praktijken
De behandeling van perianale fistels is in de loop der tijd aanzienlijk geëvolueerd. Van de jaren 1940 tot de jaren 1970 werden deze laesies als een uitsluitend chirurgische aandoening beschouwd. De ingrepen omvatten gewoonlijk de resectie van alle aangetaste weefsels, met of zonder verwijdering van de anale zakjes. Deze procedure kon een focale resectie betreffen of zich uitstrekken tot een volledige circumferentiële resectie (360 graden) met anoplastiek.
Diverse chirurgische technieken zijn beschreven:
- En-bloc excisie gevolgd door chirurgische reconstructie
- Laserexcisie (met name ND:YAG-laser)
- Cryotherapie om ziek weefsel te vernietigen
- Amputatie van de staartbasis (wanneer de fistels werden beschouwd als geassocieerd met een lage staartdracht)
Typisch kregen patiënten na de operatie een fecaal verzachtend middel om de druk tijdens darmbewegingen te verminderen en de wond te laten genezen.
Beperkingen en complicaties van de chirurgische aanpak
Het gebruik van chirurgie als exclusieve therapie kent verschillende grote problemen:
- Hoge recidiefpercentages (gerapporteerd bij meer dan 50% van de honden in een studie)
- Geen volledige oplossing in veel gevallen
- Significante chirurgische complicaties:
- Wondehiscence
- Winderigheid
- Fecale incontinentie
- Diarree
- Tenesmus
- Obstipatie
- Rectale stenosen
De resultaten van studies variëren, maar chirurgie is ineffectief gebleken bij 6% tot 21% van de honden, waarvan sommige werden afgestoten of geëuthanaseerd als gevolg daarvan.
Aanvullende chirurgische aanpak
Meer recentelijk hebben verschillende studies het gebruik van chirurgie beschreven nadat de effectiviteit van immunosuppressieve therapieën een plateau heeft bereikt. Deze gecombineerde aanpak, waarbij medische behandeling voorafgaat aan de chirurgische ingreep, lijkt betere resultaten te geven dan chirurgie alleen.
In deze strategie vindt de chirurgische behandeling plaats:
- Nadat de medische verbetering een plateau heeft bereikt
- Voor de behandeling van aanhoudende laesies na verbetering door medische behandeling
- Bij dieren die nog steeds ongemak of pijn ervaren (verminderde levenskwaliteit)
- Om budgettaire redenen, wanneer langdurige medische behandeling te duur is
De in dit kader uitgevoerde chirurgische ingrepen omvatten:
- Excisie van aanhoudende fistels
- Sacculectomie
- Cryptectomie
- Hechting van eventuele rectale fistels
Immunomodulerende therapieën: steen van de behandeling
Calcineurine-remmers
Ciclosporine A
Ciclosporine A wordt beschouwd als een van de standaardbehandelingen voor perianale fistels bij honden. Het werkingsmechanisme omvat de binding aan het intracellulaire eiwit cyclofiline-1, waardoor calcineurine wordt geremd. Deze remming voorkomt de defosforylatie van de nucleaire factor van geactiveerde T-lymfocyten en de daaropvolgende productie van pro-inflammatoire cytokinen, met name IL-2. Het verminderde IL-2-gehalte resulteert in een verminderde groei en activering van T-lymfocyten.
Verschillende studies, waaronder gerandomiseerde en gecontroleerde klinische proeven, hebben de effectiviteit van ciclosporine A aangetoond. In een gerandomiseerde klinische proef waarin ciclosporine A werd vergeleken met een placebo bij Duitse Herders met perianale fistels, werd na 16 weken behandeling een volledige resolutie van de laesies gerapporteerd bij 17 van de 20 honden (85%) die ciclosporine A kregen. De gemiddelde totale oppervlakte en diepte van de laesies namen respectievelijk met 78% en 62% af na 4 weken therapie.
De dosissen cyclosporine A bestudeerd voor de behandeling van perianale fistels variëren aanzienlijk, van 1,5 mg/kg elke 24 uur tot 10 mg/kg elke 12 uur. Over het algemeen zijn hogere dosissen geassocieerd met betere resultaten, waarbij de effectiviteit dosisafhankelijk is. De gemodificeerde of micro-emulsieformuleringen van cyclosporine A hebben een hogere biologische beschikbaarheid bij honden en zouden bij voorkeur moeten worden gebruikt. De biologische beschikbaarheid van cyclosporine A wordt ook verminderd door de aanwezigheid van voedsel; het wordt daarom het best op een lege maag toegediend (2 uur voor of na een maaltijd).
De kosten van cyclosporine A, vooral bij hoge doses of voor grote honden, kunnen aanzienlijk zijn. De gezamenlijke toediening van cyclosporine A en ketoconazol kan het metabolisme van cyclosporine A door de hepatische micro-enzymen cytochroom P450 remmen en zijn biologische beschikbaarheid verbeteren via de remming van de intestinale P-glycoproteïne (waardoor het transport van cyclosporine A naar het darmlumen vermindert). De gelijktijdige toediening van beide geneesmiddelen kan de biologische beschikbaarheid van cyclosporine A met 75% of meer verbeteren, afhankelijk van de dosis ketoconazol, en een reductie van de cyclosporinedosis mogelijk maken.
De combinatie van cyclosporine A (bij doseringen van 1 mg/kg/dag tot 5,5 mg/kg/dag) en ketoconazol (bij doseringen van 5,1 mg/kg/dag tot 11 mg/kg/dag) bleek effectief in klinische proeven met een volledige resolutie van de laesies bij 93% van de honden in 16 weken, 100% van de honden in 3 tot 10 weken, en 67% van de honden met een gemiddelde resolutietijd van 13,9 weken.
Recidieven kunnen optreden wanneer de immunomodulerende behandeling wordt stopgezet. Om deze reden wordt na de volledige resolutie van de laesies (wat over het algemeen 8 tot 12 weken behandeling vergt) aanbevolen om de doseringen van cyclosporine A en ketoconazol geleidelijk te verminderen tot de laagste effectieve dosis en frequentie van toediening.
Tacrolimus
Tacrolimus zalf bij 0,1% bleek ook effectief voor de behandeling van perianale fistels bij honden, hoewel gerandomiseerde en gecontroleerde klinische onderzoeken niet werden uitgevoerd. In een studie van 10 honden die werden behandeld met tacrolimus zalf bij 0,1% op de perianale huid tweemaal per dag gedurende 16 weken, behaalden 5 honden een volledige resolutie van de laesies.
Tacrolimus is geschikter voor topische toepassing dan cyclosporine A vanwege zijn lagere molecuulgewicht, wat een betere absorptie door de opperhuid mogelijk maakt. Vanwege mogelijk ongemak geassocieerd met de toepassing, wordt tacrolimus zalf doorgaans aanbevolen voor honden met milde laesies of voor honden met ernstigere laesies na volledige of gedeeltelijke resolutie met orale cyclosporine A (meestal in combinatie met ketoconazol).
Sommige honden kunnen overschakelen naar alleen topisch tacrolimus zalf voor onderhoud en preventie van recidieven van perianale fistels. Het belangrijkste voordeel van deze topische behandeling is het vermijden van systemische immunosuppressie.
Een grotere studie toonde een volledige remissie na 16 weken bij 15 van de 19 patiënten (79%) en een duidelijke verbetering bij de 4 resterende patiënten wanneer tacrolimus werd gebruikt in combinatie met prednisolon, een dieet gebaseerd op nieuwe eiwitten en een korte kuur met metronidazol. Wanneer tacrolimus alleen werd toegediend, werd een volledige remissie slechts bij 50% van de patiënten gerapporteerd.
Glucocorticoïden
Immunosuppressieve doses prednisolon (2 tot 4 mg/kg PO q24h) zijn beschreven als effectief, met 33,3% van de patiënten die een volledige remissie bereikten, 33,3% die een verbetering van de klinische symptomen vertoonde en 33,3% die geen verbetering vertoonde. Een voordeel van de prednisolontherapie is de snelle werking in vergelijking met andere immunosuppressieve therapieën; het probleem met prednisolontherapie ligt echter in de langetermijneffecten.
Vanwege de noodzaak van een continue toediening van immunomodulerende middelen voor het beheer, en het risico van bijwerkingen bij langdurige toediening van corticosteroïden, worden corticosteroïden over het algemeen niet alleen gebruikt voor de behandeling van perianale fistels bij honden. Ze kunnen echter nuttig zijn als onderdeel van een multimodale aanpak, vooral in de beginfase voor hun snelle anti-inflammatoire werking.
Andere immunomodulatoren
Azathioprine
Azathioprine, in combinatie met metronidazol, is effectief gebleken om de grootte van perianale fistels te verminderen vóór chirurgische verwijdering van de resterende ziekte. In de gerapporteerde gevallen werd azathioprine gedurende 2 tot 6 weken na de operatie voortgezet. Een andere studie toonde aan dat monotherapie met azathioprine leidde tot volledige remissie bij iets meer dan de helft van de honden die het ontvingen. Azathioprine kan echter aanzienlijke bijwerkingen veroorzaken (bijv. ernstige myelosuppressie, hepatotoxiciteit, pancreatitis), die in overweging moeten worden genomen bij het gebruik van dit geneesmiddel.
In een studie van Harkin en medewerkers werden 14 honden met perianale fistels behandeld met alleen azathioprine. Na 16 weken behandeling bereikten 8 van de 14 honden (57%) volledige genezing van de laesies.
Mycofenolaat mofetil
Er is, voor zover de auteur weet, slechts één verslag over het gebruik van mycofenolaat mofetil voor het beheer van perianale fistels in de veterinaire literatuur; deze hond werd gedurende 4 weken behandeld zonder verbetering van de laesies.
Alternatieve en opkomende therapieën
Injecties van mesenchymale stamcellen
Injecties van mesenchymale stamcellen, rechtstreeks toegediend in de fistels, zijn effectief gebleken bij mensen met fistuliserende ziekte van Crohn. Mesenchymale stamcellen hebben een immunomodulerende activiteit, waardoor de proliferatie en activering van T-lymfocyten en dendritische cellen afnemen en de productie van regulerende T-cellen toeneemt.
De effectiviteit van injecties van mesenchymale stamcellen voor perianale fistels bij honden is gerapporteerd voor een klein aantal honden. Zes honden met perianale fistels die niet hadden gereageerd op standaarddosering cyclosporine A-therapie gedurende ten minste 6 maanden werden opgenomen in een open studie en kregen een eenmalige injectie van mesenchymale stamcellen uit menselijke embryonale stamcellen in de perianale laesies. De honden werden gevolgd gedurende 6 maanden na de injectie; alle honden vertoonden een oplossing van sinustrajecten of zweren 3 maanden na de injectie van stamcellen. Bij twee honden trad een recidief van perianale fistels op 6 maanden na de injectie.
Na 1 tot 2 maanden kon de gemiddelde dosis cyclosporine worden verlaagd tot 3,59 mg/kg/dag (bij 3 maanden) vergeleken met aanvankelijk 8,22 mg/kg/dag. Hoewel injecties van mesenchymale stamcellen een veelbelovende behandelingsoptie zijn voor perianale fistels bij honden, zijn aanvullende gecontroleerde studies nodig om deze resultaten toe te passen op grotere populaties van getroffen honden en om de optimale frequentie van injecties te bepalen.
Andere innovatieve therapieën
Verschillende alternatieve therapieën gericht op wondgenezing zijn populair geworden als behandelingsopties voor perianale fistels.
-
Rijk plasma aan bloedplaatjes: Een monotherapie met rijk plasma aan bloedplaatjes, toegediend in de vorm van intralessionele injecties bij een hond, resulteerde in volledige remissie zonder recidief na een jaar.
-
Fluorescerende lichtenergie: Deze therapie vereist wekelijkse behandelingen om ontstekingen te verminderen en wondgenezing te bevorderen. Een studie van 4 gevallen toonde een afname van 74,3% van het aangetaste oppervlak na 6 weken, hoewel er geen volledige genezing werd waargenomen. De recente commercialisatie van fluorescerende lichtenergie heeft het gemakkelijker beschikbaar gemaakt voor dierenartsen.
-
Oclacitinib: Een recente casusreeks rapporteerde het gebruik van oclacitinib in doseringen hoger dan die gebruikt voor atopische dermatitis (1,125 mg/kg BID en 0,88 mg/kg BID) met volledige genezing in beide gevallen na 1 maand behandeling. Dit geneesmiddel werkt door de werking van interferonen en de JAK-STAT-route te blokkeren, wat het een relevante etiologische behandeling kan maken gezien de activering van interferonen in perianale fistellaesies.
Adjuvante behandelingen en aanvullende overwegingen
Beheer van secundaire infecties
Secundaire infecties kunnen gepaard gaan met perianale fistels en moeten op de juiste manier worden behandeld, hetzij met systemische medicatie, hetzij met lokale toepassingen (chloorhexidine). Routinematige hygiënische zorg voor het perianale gebied kan gunstig zijn (bijvoorbeeld antiseptische baden 2 tot 3 keer per week, of zelfs dagelijks, afhankelijk van de ernst van de laesies).
Het is belangrijk op te merken dat antibiotica alleen niet effectief lijken te zijn voor het beheer van perianale fistels bij honden. Veel honden worden behandeld met antimicrobiële middelen bij het begin van de klinische symptomen van perianale fistels, maar blijven een voortschrijdende ziekte vertonen.
Enkele studies hebben het gebruik van metronidazol in combinatie met andere therapieën (azathioprine, tacrolimus zalf, prednisolon en een dieet gebaseerd op nieuwe eiwitten) gerapporteerd voor de behandeling van honden met perianale fistels. Naast zijn werking tegen anaerobe bacteriën en protozoa, kan metronidazol ook ontstekingsremmende activiteit hebben, met name door de differentiatie van regulatorische T-cellen te bevorderen. Deze ontstekingsremmende activiteit kan helpen bij de behandeling van door het immuunsysteem gemedieerde ziekten, maar de effectiviteit van metronidazol alleen voor de behandeling van perianale fistels is tot op heden onbekend.
Pijn- en comfortbeheer
Honden met actieve perianale fistels kunnen lijden, vooral tijdens de ontlasting. Het gebruik van fecale verzachters moet overwogen worden en in sommige gevallen kunnen klysma’s nodig zijn om tenesme te verlichten. Pijnbestrijding moet een prioriteit zijn voor honden met actieve laesies, maar het potentieel voor constipatie door het gebruik van bepaalde pijnstillers, zoals opioïde agonisten, moet in overweging worden genomen bij het opstellen van een pijnbeheersingsplan.
Voedings overwegingen
Een verband tussen perianale fistels en ongewenste voedselreacties is vastgesteld. In een studie had 18,8% van de honden met een perianale fistel ook voedselallergieën. Het is onduidelijk of er een directe correlatie tussen deze ziektes bestaat of dat de honden simpelweg twee gelijktijdige ziekten hadden. Hoe dan ook, het gebruik van een dieet gebaseerd op nieuwe eiwitten of een gehydrolyseerd dieet is gunstig geweest voor sommige patiënten.
Drie studies rapporteerden een positieve klinische respons op een dieet gebaseerd op nieuwe eiwitten bij honden met perianale fistels. In een onderzoek werd een dieet op basis van vis en aardappelen op lange termijn gegeven na chirurgische excisie van sinus trajecten en bilaterale anale sacculectomie. In de tweede studie kregen honden een exclusief dieet op basis van wild en aardappelen of vis en aardappelen, maar werden ze aanvankelijk ook behandeld met metronidazol, alsmede 0,1% tacrolimus zalf lokaal en een afbouwende kuur van orale prednisolon gedurende 16 weken. In de derde studie kregen de honden een commercieel dieet op basis van lam en rijst of vegetarisch, maar werden ze tegelijkertijd behandeld met een afbouwende kuur van orale prednisolon tegen een initiële immunosuppressieve dosis.
Hoewel het instellen van een eliminatiedieet met behulp van voedsel op basis van nieuwe eiwitten of gehydrolyseerde eiwitten wordt aanbevolen als onderdeel van de diagnostische beoordeling van honden met perianale fistels, is het niet duidelijk, volgens de beschikbare literatuur, hoeveel honden langdurige remissie kunnen bereiken met alleen dieetbeheersing.
Consensuele aanbevelingen voor het beheer van perianale fistels
Methodologie voor consensusvorming
Gezien de afwezigheid van consensus over het beheer van perianale fistels, heeft de wetenschappelijke raad van GEDAC (Studiegroep voor Dermatologie van Gezelschapsdieren) de literatuur geëvalueerd om te komen tot aanbevelingen voor medische behandelingen.
De gehanteerde methodologie is gebaseerd op het Taxonomy of Strength of Recommendation (SoRT) ontwikkeld door redacteurs van tijdschriften voor eerstelijnsgeneeskunde en spoedeisende zorg in de Verenigde Staten. Het bewijsniveau (LoE) werd geclassificeerd volgens een drie-niveauschaal:
- LoE 1: Bewijs van goede kwaliteit (meta-analyse, goed uitgevoerde gerandomiseerde gecontroleerde studie)
- LoE 2: Bewijs van beperkte kwaliteit (slecht uitgevoerde gerandomiseerde gecontroleerde studie, gecontroleerd onderzoek, case-control studie, goed uitgevoerde prospectieve studie)
- LoE 3: Overig bewijs, inclusief consensusrichtlijnen, meningen, casestudies
Een systematisch literatuuronderzoek van de tussen 1980 en oktober 2023 gepubliceerde literatuur werd uitgevoerd in de PubMed-database. Artikelen in het Engels en het Frans werden gezocht met behulp van specifieke zoekwoorden, en de volgende types studies werden aanvankelijk geselecteerd: gerandomiseerde gecontroleerde proeven, klinische proeven, cohortonderzoeken en case series.
Voor het opstellen van de aanbevelingen werd een drie-niveauschaal gebruikt:
- Niveau A: Sterke aanbeveling, gebaseerd op consistente bewijs van goede kwaliteit
- Niveau B: Matige aanbeveling, gebaseerd op inconsistent of beperkt bewijs van kwaliteit
- Niveau C: Zwakke aanbeveling, voornamelijk gebaseerd op experts’ meningen
Belangrijkste therapeutische aanbevelingen
Cyclosporine A
- De effectiviteit van cyclosporine is reëel (aanbevelingsniveau A)
- Effectiviteit is dosisafhankelijk en onafhankelijk van de klinische ernst
- De minimale aanbevolen dosis is 5 mg/kg/dag, oplopend tot 10 mg/kg tweemaal per dag
- De effectieve dosis moet worden gehandhaafd tot klinische genezing is bereikt (niveau C)
- Een periode van drie maanden kan nodig zijn om genezing onder cyclosporine te observeren
Associatie cyclosporine-ketoconazol
- Deze combinatie is effectief
- Echter, experts raden deze combinatie niet aan om het risico op resistentie tegen schimmelwerende middelen en leverschade te beperken
Tacrolimus
In Frankrijk maakt de evolutie van de wetgeving het moeilijk om het gebruik van tacrolimus te overwegen.
Prednisolon
- Experts raden het gebruik van prednisolon alleen niet aan
- Corticosteroïden worden aanbevolen als onderdeel van een multimodale aanpak
- Het is aan te raden om niet meer dan 1 mg/kg/dag als startdosis te overschrijden om bijwerkingen te beperken
- Lokale corticosteroïdentherapie kan interessant zijn ondanks het ontbreken van sterke wetenschappelijke gegevens
Andere immunomodulatoren
Experts raden het gebruik van azathioprine, mycofenolaatmofetil, oclacitinib, fotobiomodulatie of stamcellen af vanwege het gebrek aan betrouwbare en herhaalde gegevens tot op heden.
Antibiotische behandeling
- Een antibiotische behandeling is niet noodzakelijk voor genezing
- Metronidazol, weinig gebruikt in studies, laat niet toe om de impact op het ziekteverloop te beoordelen
- Experts raden het systematisch gebruik van antibiotica af
- Antibioticagebruik wordt alleen aanbevolen bij rectale fistels of infectie van de anaalklieren, gebaseerd op de resultaten van een bacteriële kweek
Chirurgische benadering
- Experts bevelen chirurgie als tweede keus aan
- Deze benadering is geïndiceerd bij een dier dat nog steeds ongemak of pijn (verminderde levenskwaliteit) heeft na verbetering door medische behandeling
- Het gebruik van chirurgie kan afhangen van budgettaire redenen of stagnatie van klinische verbetering bij een dier waarvan de levenskwaliteit onvoldoende blijft
Voeding
- Er zijn geen wetenschappelijke bewijzen om het gebruik van voeding op basis van nieuwe of gehydrolyseerde eiwitten aan te bevelen
- Bij analogie met de ziekte van Crohn bij de mens en op basis van klinische ervaring, adviseren experts een hypoallergeen dieet (niveau C)
Opvolging en therapeutische aanpassing
- Het wordt aanbevolen om de medische behandeling na 6 tot 10 weken te evalueren en aan te passen op basis van de waargenomen respons
- Na het bereiken van genezing of bij aanwezigheid van aanhoudende matige laesies geassocieerd met een goede levenskwaliteit, kan de behandeling worden vereenvoudigd of zelfs gestopt
- Bij afwezigheid van wetenschappelijke gegevens, raden experts een geleidelijke en aangepaste vereenvoudiging of stopzetting van de behandeling aan
Discussie en perspectieven
Parallellen met menselijke pathologieën
Twee menselijke aandoeningen, hydradenitis suppurativa en fistulerende ziekte van Crohn, zijn voorgesteld als correlaten van perianale fistels bij honden. Net als perianale fistels bij honden zijn deze twee aandoeningen pijnlijk, invaliderend en hebben ze een negatieve invloed op de kwaliteit van leven van patiënten.
Hydradenitis suppurativa gaat gepaard met knobbels, abcessen, sinus-tracten en littekens, voornamelijk in de intertrigineuze gebieden (oksel, lies, perianaal en mammaregio). Het werd oorspronkelijk voorgesteld als een potentieel correlaat van perianale fistels bij honden vanwege vergelijkbare histopathologische kenmerken, waaronder furunculose, hydradenitis en de vorming van epitheelbeklede sinus-tracten. De pathogenese van hydradenitis suppurativa is nog niet volledig opgehelderd, maar het is waarschijnlijk een immuungemedieerde aandoening met genetische vatbaarheid. Veranderingen in de huid- of darmmicrobiota kunnen een rol spelen in de pathogenese.
De perianale manifestaties van de ziekte van Crohn komen vaak voor, naar schatting treft het 25% tot 33% van de patiënten met de ziekte van Crohn. Perianale fistels komen vaker voor bij patiënten met colitis of rectale ziekte en kunnen eenvoudig zijn (een fistelgang met een enkele externe opening) of complex (meerdere fistelgangen, perianale abcessen of anale/rectale stenose). In tegenstelling tot de typische ziekte bij honden zijn dit echte fistels die communiceren met het darmkanaal. De pathogenese van perianale fistels bij de ziekte van Crohn is niet volledig begrepen, maar zou een epitheliaal-mesenchymale transitie en een positieve regulatie van matrixmetalloproteïnasen en pro-inflammatoire cytokines impliceren.
Overeenkomsten in de pathogenese van hidradenitis suppurativa en de ziekte van Crohn zijn aangetoond, met name de infiltratie van zieke weefsels door Th17-cellen. Toekomstig onderzoek zou zich moeten richten op een betere karakterisering van de onderliggende etiologie van deze drie aandoeningen en zou kunnen bijdragen aan het ontwikkelen van toekomstige therapieën, zoals antilichamen gericht tegen specifieke cytokines, voor perianale fistels bij honden.
Toekomstige perspectieven en onderzoeksrichtingen
Verschillende onderzoeksgebieden verdienen bijzondere aandacht om de behandeling van perianale fistels bij honden te verbeteren:
-
Diepgaand onderzoek naar de immunopathogenese: Een beter begrip van de immuungemedieerde mechanismen kan leiden tot de ontwikkeling van gerichte therapieën, zoals het gebruik van JAK-remmers (oclacitinib) waarvan de effectiviteit is gesuggereerd door enkele voorlopige studies.
-
Karakterisering van het huid- en darmmicrobioom: Het verkennen van de rol van het microbioom bij de ontwikkeling en persistentie van perianale fistels kan nieuwe therapeutische wegen openen, zoals het gebruik van probiotica of fecale transplantatie.
-
Optimalisatie van therapeutische protocollen: Gecontroleerde studies zijn nodig om de optimale doseringen, behandelingsduur en ontwenningsstrategieën van de verschillende therapeutische opties te bepalen.
-
Meer gestandaardiseerde evaluatie van de levenskwaliteit: De ontwikkeling van specifieke instrumenten om de impact van perianale fistels en hun behandelingen op de levenskwaliteit van honden te evalueren, zou een meer diervriendelijke benadering mogelijk maken.
-
Ontwikkeling van innovatieve therapieën: De bemoedigende voorlopige resultaten met mesenchymale stamcellen, plaatjesrijk plasma of fluorescerende lichtenergie verdienen verdere studie door gecontroleerde studies in grotere populaties.
-
Onderzoek naar verbanden met voedselallergieën: Het verduidelijken van mogelijke verbanden tussen perianale fistels en voedselreacties zou het optimaliseren van voedingsstrategieën mogelijk maken.
- Identificatie van voorspellende biomarkers: Het zoeken naar biologische markers die de respons op de behandeling of het risico op recidive kunnen voorspellen, zou de personalisatie van therapieën verbeteren.
Belang van een geïndividualiseerde benadering
De behandeling van perianale fistels bij honden vereist een geïndividualiseerde benadering, waarbij rekening wordt gehouden met verschillende factoren:
-
Therapeutisch evenwicht: Het zoeken naar een evenwicht tussen de effectiviteit van de behandeling, kosten, ongewenste effecten en de kwaliteit van leven van het dier is essentieel.
-
Realistische doelen: Hoewel volledige klinische genezing het theoretische doel blijft, kan klinische verbetering met behoud van de levenskwaliteit in sommige gevallen een acceptabel doel zijn.
-
Therapeutische flexibiliteit: Regelmatige evaluatie van de respons op de behandeling en aanpassing van de protocollen op basis van deze respons zijn cruciaal om de behandeling te optimaliseren.
-
Multimodale aanpak: De combinatie van verschillende therapeutische modaliteiten (immunomodulerende medicatie, lokale zorg, pijnbestrijding, nutritionele aanpak) biedt vaak de beste kans op succes.
-
Rekening houden met de context: Financiële beperkingen, de mogelijkheid van de eigenaar om de behandelingen uit te voeren en de benodigde zorg te verlenen, evenals eventuele comorbiditeiten moeten in de therapeutische strategie worden geïntegreerd.
Conclusie
Perianale fistels bij honden zijn een complexe dermatologische aandoening met een immuungemedieerde pathogenese waarvan de prevalentie bijzonder hoog is bij Duitse Herders. Deze potentieel invaliderende pathologie kan een grote impact hebben op de levenskwaliteit van getroffen dieren en vereist een snelle en passende behandeling.
Het begrip van deze ziekte is in de loop der decennia aanzienlijk geëvolueerd, met een paradigmaverschuiving van een voornamelijk anatomisch en chirurgisch perspectief naar een immuungemedieerde en medische benadering. Immunomodulerende therapieën, in het bijzonder ciclosporine A, vormen tegenwoordig de hoeksteen van de behandeling, en maken het mogelijk om significante genezingspercentages te bereiken.
Systematische analyse van de wetenschappelijke literatuur heeft het mogelijk gemaakt om consensusaanbevelingen op te stellen om clinici te begeleiden bij hun therapeutische keuzes. Deze aanbevelingen benadrukken de effectiviteit van ciclosporine A in aangepaste doseringen (minimaal 5 mg/kg/dag), de beperkte maar aanvullende rol van corticosteroïdtherapie, en de potentiële interesse in opkomende therapieën zoals oclacitinib of mesenchymale stamcellen.
Chirurgie, ooit als de standaardbehandeling beschouwd, is tegenwoordig voorbehouden aan refractaire gevallen of als aanvulling na medische stabilisatie. De voedingsaanpak, hoewel nog steeds gebrek aan solide wetenschappelijke bewijs, wordt vaak geïntegreerd in de algehele therapeutische strategie.
De parallellen getrokken met menselijke pathologieën zoals hidradenitis suppurativa of fistulerende ziekte van Crohn bieden interessante perspectieven voor translationeel onderzoek en de ontwikkeling van nieuwe gerichte therapeutische benaderingen.
Het ultieme doel van de behandeling blijft het verbeteren van de levenskwaliteit van het dier, wat soms kan worden bereikt zonder volledige genezing van de laesies. Een geïndividualiseerde benadering, die rekening houdt met de specificiteiten van elke patiënt, de praktische beperkingen en de verwachtingen van de eigenaren, blijft essentieel om de kans op langdurig therapeutisch succes te optimaliseren.
Veelgestelde vragen
1. Beïnvloedt de initiële ernst van de laesies de prognose en de respons op de behandeling?
Studies hebben geen significante correlatie aangetoond tussen de initiële ernst van de laesies en de respons op de behandeling, met name met ciclosporine. Echter, een vroege diagnose en snelle start van een passende behandeling verbeteren over het algemeen de prognose. Chronische gevallen, met vastgestelde fibrose, kunnen refracterer zijn voor therapie.
2. Hoe om te gaan met terugvallen na het stoppen van de behandeling?
In geval van terugval na het stoppen van de behandeling wordt meestal aanbevolen om het aanvankelijk effectieve protocol opnieuw te starten. Zodra remissie is bereikt, kan een meer geleidelijke afbouw of een onderhoudstherapie met de minimaal effectieve dosis (bijvoorbeeld, verlaagde dosis ciclosporine of lokale tacrolimus) op lange termijn worden overwogen. Het identificeren en beheren van potentiële uitlokkende factoren, zoals voedselallergieën, is ook belangrijk.
3. Beïnvloeden omgevingsfactoren de ontwikkeling van perianale fistels?
Hoewel weinig specifiek bestudeerd, lijken sommige omgevingsfactoren de ontwikkeling van de ziekte te beïnvloeden. De perianale hygiëne, de consistentie van de ontlasting (beïnvloed door voeding), stress en lichaamsbeweging kunnen allemaal een invloed hebben op de genezing en het comfort van het dier. Een schone omgeving en regelmatige lokale zorg dragen positief bij aan het beheer van de aandoening.
4. Wat zijn de risico’s van langetermijneffecten van immunosuppressieve behandelingen?
Langdurige immunosuppressieve behandelingen brengen verschillende risico’s met zich mee:
- Voor ciclosporine: spijsverteringsstoornissen, gingivale hyperplasie, hirsutisme, verhoogd risico op opportunistische infecties en potentiële ontwikkeling van neoplasieën (zeldzaam)
- Voor corticosteroïden: iatrogene Cushing-syndroom, diabetes mellitus, huidatrofie, immunosuppressie, risico op secundaire infecties
- Voor azathioprine: myelosuppressie, hepatotoxiciteit, pancreatitis
Regelmatige opvolging inclusief klinisch onderzoek, bloedonderzoek en dosisaanpassingen zijn essentieel om deze risico’s te minimaliseren.
5. Zijn er manieren om te voorspellen welke Duitse Herders deze aandoening zullen ontwikkelen?
Momenteel bestaat er geen gevalideerde voorspellende test om met zekerheid Duitse Herders te identificeren die risico lopen op het ontwikkelen van perianale fistels. Er zijn echter enkele risicofactoren geïdentificeerd:
- Honden homozygoot voor het DLA-DRB1*00101-alleel kunnen de ziekte eerder ontwikkelen
- Een familiegeschiedenis van perianale fistels lijkt het risico te vergroten
- Sommige bloedlijnen lijken meer aangetast dan andere
Verdere onderzoeken naar genetische en immunologische markers zouden in de toekomst de ontwikkeling van voorspellende tests kunnen mogelijk maken, wat de weg opent naar preventieve strategieën bij individuen met een verhoogd risico.