Le dermatozoonosi costituiscono un gruppo eterogeneo di affezioni cutanee trasmissibili tra gli animali vertebrati e l’uomo. Tali patologie, sebbene relativamente rare rispetto all’insieme delle zoonosi conosciute, rappresentano un significativo problema sanitario, in particolare nel contesto urbano in cui la promiscuità con gli animali da compagnia si intensifica.
Il medico veterinario, all’intersezione tra salute animale e salute umana, svolge un ruolo cruciale nella diagnosi, nel trattamento e nella prevenzione di tali affezioni.
La stretta relazione tra uomo e animale, pur apportando innegabili benefici sul piano psicologico e sociale, espone anche i proprietari e i professionisti a contatto con gli animali a diversi agenti patogeni trasmissibili. Queste dermatozoonosi, di origine micotica, parassitaria, batterica o virale, richiedono una particolare vigilanza e un approccio collaborativo tra medici e veterinari per una gestione ottimale dei pazienti, sia a due che a quattro zampe.
Definizione e classificazione delle dermatozoonosi
Le dermatozoonosi rappresentano un sottogruppo specifico del vasto campo delle zoonosi. Esse sono definite come malattie o infezioni trasmissibili naturalmente dagli animali vertebrati all’uomo, e viceversa, che si manifestano clinicamente nell’uomo con lesioni cutanee, ad eccezione delle reazioni allergiche generalizzate. Questo termine deriva dalle radici greche “zoo” (animale) e “nosos” (malattia), concettualizzato da Virchow nel XIX secolo, poi precisato dall’Organizzazione Mondiale della Sanità nel 1959.
In ambiente urbano, i principali vertebrati responsabili di queste affezioni sono gli animali domestici – carnivori domestici come cane e gatto, ma anche roditori e lagomorfi sempre più presenti nelle nostre case. Le popolazioni esposte comprendono non solo i proprietari di animali, ma anche diverse professioni a rischio: veterinari e loro personale, allevatori, toelettatori e altri professionisti a contatto regolare con questi animali.
Classificazione secondo le modalità di trasmissione
L’Organizzazione Mondiale della Sanità propone una classificazione delle zoonosi in quattro categorie distinte, basata sulle loro modalità di trasmissione:
- Ortozoonosi o zoonosi diretta: L’agente causale necessita di una sola specie di vertebrati per il suo mantenimento, anche se può colpire più specie. Questa specie consente la trasmissione all’uomo. La maggior parte delle zoonosi infettive classiche come la rabbia, il carbonchio o la brucellosi appartengono a questa categoria.
- Ciclozoonosi: In questo caso, il ciclo biologico coinvolge più specie di vertebrati, ma una sola di esse è responsabile della contaminazione umana. L’echinococcosi illustra perfettamente questo processo, con il suo ciclo che coinvolge il cane e gli erbivori, dove il cane agisce come contaminatore dell’uomo.
- Metazoonosi: Questa categoria richiede il passaggio attraverso un invertebrato, generalmente un artropode, che consente la trasmissione all’uomo. Le arbovirosi come la febbre gialla (mantenuta su scimmie e marsupiali e poi trasmessa all’uomo da una zanzara), le rickettsiosi e la leishmaniosi rientrano in questa classificazione.
- Saprozoonosi: Queste affezioni richiedono il passaggio dell’agente causale nell’ambiente esterno. La fasciolosi illustra questo meccanismo, con la maturazione delle cercarie responsabili della dermatosi furcocercariale.
Questa classificazione sistematica consente una migliore comprensione dei cicli epidemiologici e, di conseguenza, favorisce l’implementazione di strategie di prevenzione adattate a ogni tipo di trasmissione.
Dermatozoonosi di origine micotica
Le infezioni fungine trasmissibili tra animale e uomo costituiscono un capitolo importante delle dermatozoonosi. Queste affezioni, principalmente rappresentate dalle dermatofitosi e dalla sporotricosi, meritano un’attenzione particolare a causa della loro prevalenza e del loro potenziale impatto sulla salute umana.
Le dermatofitosi
Le dermatofitosi, comunemente chiamate “tigne”, rappresentano micosi superficiali infettive causate da funghi epidermotropi, cheratinofili e cheratinolitici – i dermatofiti. Questi funghi hanno la particolarità di nutrirsi di cheratina, proteina costitutiva delle strutture superficiali come capelli, peli, unghie e strato corneo dell’epidermide.
I dermatofiti zoofili, di origine animale, costituiscono una fonte primaria di dermatozoonosi. Tre specie principali devono essere considerate:
- Microsporum canis: Il principale serbatoio è il gatto (più raramente il cane, in particolare la razza Yorkshire terrier, e altri piccoli mammiferi). Questa specie è responsabile di circa il 95% delle dermatofitosi feline e del 65% dei casi canini.
- Trichophyton mentagrophytes: Il suo serbatoio è costituito da roditori, lagomorfi ed equidi. La percentuale di portatori asintomatici varia considerevolmente a seconda delle specie: circa il 15% nei porcellini d’India, dal 10 al 40% nei conigli e quasi il 50% nei topi e nei ratti.
- Trichophyton verrucosum: Principalmente trovato nei ruminanti.
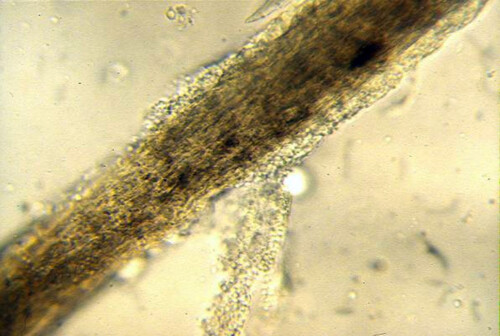
Pelo tignoso
La maggior parte dei dermatofiti presenta un’adattamento stretto a una specie target, nella quale causano generalmente pochi segni clinici. Nel gatto, ad esempio, l’incidenza dei portatori asintomatici di M. canis è circa del 10%, ma può raggiungere percentuali molto più elevate nei gatti randagi o in alcune razze come i persiani. In modo allarmante, circa il 50% delle persone a contatto con un gatto infetto, sia esso portatore asintomatico o clinicamente malato, sviluppa lesioni cutanee.
Presentazione clinica negli animali
Nel gatto, le lesioni classiche da M. canis sono caratterizzate da aree di alopecia uniche o multicentriche, eritematose, non pruriginose, squamose, con estensione centrifuga. Le localizzazioni preferenziali sono la faccia, le orecchie e le estremità podali. Una diagnosi tardiva può rivelare un’alopecia loco-regionale o generalizzata, talvolta accompagnata da infiammazione pruriginosa. In alcuni casi, è osservabile solo uno stato cheratoseborroico dorso-lombare. Le onicomicosi da M. canis sono rare, mentre i micetomi si riscontrano esclusivamente in individui immunocompromessi e nella razza Persiana.
Nel cane, oltre a M. canis, si riscontrano altre tre specie: T. mentagrophytes, M. persicolor (entrambi agenti zoofili) e M. gypseum (agente geofilo). Esistono alcune predisposizioni razziali: gli Yorkshire terrier sembrano particolarmente vulnerabili alle tigne generalizzate da M. canis, mentre i terrier (Fox terrier e altri cani da caccia al terrier) presentano una maggiore suscettibilità alle dermatofitosi facciali causate da T. mentagrophytes e M. persicolor.
La maggior parte dei cani colpiti presenta lesioni classiche: aree di alopecia uniche o multicentriche, arrotondate, leggermente squamose, ad evoluzione centrifuga, generalmente poco pruriginose. Le localizzazioni preferenziali sono la faccia e l’estremità distale degli arti. I cherioni (lesioni infiammatorie nodulari suppurative) sono regolarmente osservati, in particolare con T. mentagrophytes.
Nei roditori e lagomorfi, sempre più popolari come animali da compagnia, l’agente quasi-esclusivo è T. mentagrophytes, più raramente M. canis. Clinicamente, le dermatofitosi si manifestano con aree di alopecia centrifuga, spesso pruriginose e molto infiammatorie.
Diagnosi delle dermatofitosi
La diagnosi si basa su un approccio multifattoriale:
- Esame alla lampada di Wood: Una fluorescenza verde tipica dei peli contaminati è osservabile nel 50% dei casi di M. canis. Questa tecnica richiede tuttavia una certa esperienza per distinguere la fluorescenza specifica dalle fluorescenze artefattuali.
- Esame microscopico diretto di peli e squame: Può rivelare un’alterazione del fusto del pelo, rivestito da manicotti di spore (invasione pilare di tipo endoectothrix nel caso di M. canis).
- Coltura micologica: Consente l’identificazione definitiva del dermatofita responsabile. Nei portatori asintomatici, il prelievo può essere realizzato spazzolando tutta la superficie corporea con uno spazzolino da denti sterile o un quadrato di moquette sterile, e quindi mettendo in coltura su agar di Sabouraud.
Trattamento e prevenzione
Il trattamento è imperativo, anche se è possibile una guarigione spontanea (anche se può richiedere diversi mesi, se non anni). L’efficacia terapeutica dipende dalla considerazione di due fattori essenziali:
- L’elevata contagiosità delle dermatofitosi
- La resistenza prolungata delle spore nell’ambiente (diversi anni)
L’approccio terapeutico combina:
- Trattamento topico: tosatura (discusso a seconda dei casi), shampoo e bagni a base di enilconazolo o miconazolo associato a clorexidina
- Trattamento sistemico: griseofulvina, ketoconazolo, itraconazolo
- Trattamento ambientale: enilconazolo o candeggina
Il trattamento deve essere continuato fino a guarigione micologica confermata dalla negativizzazione delle colture, con due controlli negativi a distanza di un mese. In allevamento, il problema principale rimane la ricontaminazione permanente dovuta all’elevata carica di spore nell’ambiente, rendendo l’eradicazione praticamente impossibile nonostante i vuoti sanitari. Idealmente, negli allevamenti indenni, ogni nuovo animale dovrebbe essere messo in quarantena fino all’ottenimento di una coltura micologica negativa.
Impatto sull’uomo
Nell’uomo, le dermatofitosi di origine animale si caratterizzano per un notevole polimorfismo clinico:
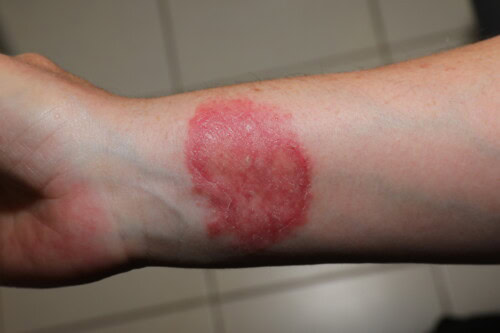
- Lesioni eritemato-squamose del cuoio capelluto (principalmente dovute a M. canis)
- Lesioni circolari eritemato-squamose delle zone glabre, spesso policicliche con bordo vescicolo-squamoso (M. canis, T. mentagrophytes)
- Lesioni crostose e dolorose con grave reazione infiammatoria (kerion) del cuoio capelluto, della nuca o della barba (sicosi), principalmente causate da T. mentagrophytes, più raramente da M. canis
Contaminazione umana in caso di tigna
È importante notare che la tinea figura nella tabella n°46 delle malattie professionali (micosi cutanee). Secondo il Codice del Lavoro e le direttive europee, gli obblighi del datore di lavoro rientrano nella prevenzione dei rischi professionali, nelle misure regolamentari specifiche, nelle misure di igiene e sicurezza, nonché nella sorveglianza sanitaria.
La sporotricosi
La sporotricosi rappresenta una micosi profonda con un elevato potenziale zoonotico, causata da un fungo dimorfico, Sporothrix schenckii. Questo patogeno presenta una caratteristica notevole: esiste in forma filamentosa nell’ambiente circostante (vegetali in decomposizione, humus, terreno) e si trasforma in lievito dopo la penetrazione nei tessuti dell’ospite a seguito di una lesione cutanea.
Modalità di contaminazione
Se le punture e le ferite da elementi vegetali contaminati costituiscono la modalità di contaminazione classica, il gatto infetto rappresenta una fonte di contaminazione particolarmente preoccupante. Infatti, i proprietari di animali, i veterinari e il loro personale sono esposti a un rischio significativo per contatto tra le loro lesioni cutanee preesistenti e gli essudati durante le manipolazioni dell’animale malato.
Una caratteristica distintiva di questa infezione è la differenza di carica fungina a seconda della specie ospite: nel cane o nell’uomo, l’agente fungino è presente in quantità limitata nelle lesioni, mentre nel gatto, gli elementi fungini raggiungono concentrazioni estremamente elevate. La trasmissione all’uomo avviene principalmente tramite trauma cutaneo: morso o graffio di gatto contaminato.
Va notato che la sporotrichosi canina, più rara della sua equivalente felina, finora non è stata associata a casi accertati di contaminazione umana.
Presentazione clinica negli animali
Nel cane e nel gatto, sono state descritte tre forme cliniche distinte, con un periodo di incubazione variabile da una settimana a due mesi:
- Forma cutaneo-linfatica (80% dei casi): Si caratterizza al sito di inoculazione per lo sviluppo progressivo di un nodulo unico, inizialmente asintomatico poi ulcerato, localizzato sul viso o su un’estremità distale. Altri noduli ulcerati e fistolizzati possono apparire lungo i vasi linfatici.
- Forma strettamente cutanea (meno frequente): Le localizzazioni preferenziali sono le estremità distali, che presentano lesioni nodulari o aree di alopecia con bordi rialzati, ulcerate e crostose.
- Forma generalizzata: Osservata principalmente nei gatti immunocompromessi, deriva dalla diffusione ematogena delle spore infettive.
Diagnosi e trattamento
La diagnosi si basa sull’esame citologico di strisci cutanei e di biopsie, che rivelano un’abbondanza notevole di elementi fungini nel gatto. La coltura micologica conferma la diagnosi.
Il trattamento si basa sulla somministrazione di antifungini sistemici, con una preferenza per l’itraconazolo e il fluconazolo. Nelle forme sistemiche, l’amfotericina B dà risultati eccellenti. Il trattamento deve essere continuato almeno un mese dopo la risoluzione clinica apparente. Nel gatto, oltre al trattamento fungicida sistemico, sono indispensabili rigorose misure igieniche:
- Pulizia accurata delle mani e delle braccia con sostanze antifungine (clorexidina, povidone iodato)
- Obbligo di indossare guanti protettivi
- Informazione chiara dei proprietari riguardo al rischio zoonotico maggiore
A causa dell’elevato rischio di trasmissione e della durata prolungata del trattamento, l’eutanasia può essere legittimamente considerata per i gatti portatori.
Manifestazioni nell’uomo
Nell’uomo, l’incubazione varia da tre settimane a tre mesi. La forma cutaneo-linfatica, la più frequente, si manifesta al sito di inoculo con un nodulo progressivo, prima asintomatico poi ulcerato, tipicamente localizzato sul dorso della mano, un dito, un piede o il viso.
Dermatozoonosi parassitarie
Le affezioni cutanee di origine parassitaria trasmissibili tra animale e uomo costituiscono un gruppo eterogeneo ma importante delle dermatozoonosi. Queste parassitosi, che coinvolgono diversi acari, insetti o elminti, presentano quadri clinici variabili sia nell’animale che nell’uomo.
Le rogne
La rogna sarcoptica
La rogna sarcoptica rappresenta un’acariasi altamente contagiosa dovuta alla proliferazione nell’epidermide di acari della famiglia dei Sarcoptidae, Sarcoptes scabiei var. canis. La sua importanza nella dermatologia veterinaria e umana deriva dalla sua crescente frequenza, dalla sua gravità clinica e dal suo potenziale zoonotico accertato.
Le specie principalmente colpite da Sarcoptes scabiei var. canis sono il cane, la volpe e il furetto, ma occasionalmente anche il gatto, l’uomo e il cavallo. Il ciclo evolutivo è caratterizzato dalla sua rapidità (da 10 a 13 giorni) in condizioni ambientali favorevoli. Le femmine, estremamente prolifiche, depongono da 2 a 3 uova quotidianamente (circa 50 uova per femmina) per 2-4 settimane. Dopo la fecondazione, scavano tane epidermiche (a differenza dei cunicoli osservati con i sarcopti umani) per deporvi le uova.
Queste uova si schiudono in 2-3 giorni, liberando larve esapode che si evolvono in ninfe e poi in adulti. I sarcopti si nutrono di tessuti epidermici (istofagi). La loro sopravvivenza nell’ambiente esterno è limitata a circa 10 giorni, richiedendo condizioni specifiche (15-25°C, umidità relativa tra 25 e 85%).
La rogna sarcoptica rimane sottodiagnosticata nel cane. Colpisce principalmente i cani giovani di età inferiore a un anno, in particolare in contesti di comunità (canili, rifugi), ma può anche colpire cani adulti o anziani indeboliti da un’affezione intercorrente.
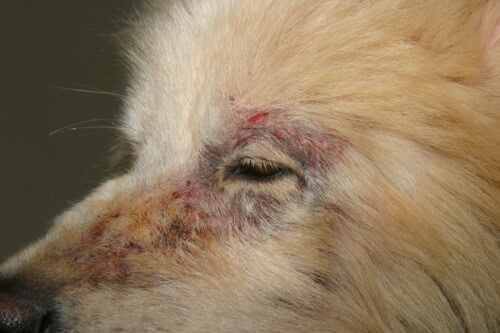
Rogna sarcoptica con interessamento facciale
Il potere patogeno di Sarcoptes scabiei var. canis si esercita attraverso diversi meccanismi:
- Azioni meccaniche e chimiche (inoculazione di proteine vasodilatatrici e anticoagulanti)
- Azione antigenica (escrementi, prodotti di muta, saliva)
- Induzione di fenomeni di ipersensibilità di tipo I, IV e III
L’ipersensibilità di tipo III può causare depositi di immunocomplessi in vari organi, in particolare i reni, provocando glomerulonefriti. Questa dimensione sistemica giustifica il considerare la rogna sarcoptica canina come una malattia generale e non solo dermatologica.
Clinicamente, dopo un’incubazione variabile (circa 3 settimane post-contatto), il quadro classico associa:
- Prurito intenso con riflesso otopodale positivo
- Lesioni eritematose e papule (“bottoni di rogna”)
- Alopecia a chiazze
- Formazione di croste
La distribuzione lesionale è caratteristica all’inizio dell’evoluzione, interessando prioritariamente la faccia (margini liberi dei padiglioni auricolari), gli arti (gomiti) e lo sterno. Manifestazioni sistemiche possono insorgere in caso di infestazione antica o in cani anziani: ipertermia, anoressia, dimagramento, poliuria-polidipsia secondaria alla glomerulonefrite immunologica.
Forme atipiche sono sempre più riportate:
- Forme fruste localizzate, poco pruriginose e poco contagiose
- “Rogna norvegese” caratterizzata da squame compatte spesse, prurito moderato e massiccia presenza di sarcopti in diversi stadi evolutivi nei raschiamenti cutanei (tipicamente negli animali immunocompromessi)
La diagnosi di certezza è talvolta difficile. L’esame microscopico di raschiamenti cutanei profondi, eseguiti nelle zone di predilezione, rivela i parassiti o le loro tracce (sarcopti, uova, deiezioni) solo in circa il 50% dei casi. La diagnosi sierologica costituisce un’alternativa, con una sensibilità e specificità di circa l’80-90%. Di fronte a un forte sospetto clinico senza conferma parassitologica, un trattamento di prova è raccomandato secondo il principio “if you suspect it, treat it”.
Il trattamento comprende due approcci:
- Acaricidi topici (amitraz diluito)
- Acaricidi sistemici in spot-on (selamectina o moxidectina)
La dimensione zoonotica è significativa, con contaminazioni umane osservate nel 25-50% dei casi di rogna sarcoptica canina. L’incubazione nell’uomo è di 8-15 giorni, culminando in un prurigo del tronco, delle braccia e delle gambe. Caratteristicamente, non si osserva nessun cunicolo scabioso, a differenza della rogna umana.
Ciò si spiega con il fatto che Sarcoptes scabiei var. canis non può sopravvivere più di 15-20 giorni nell’uomo, a causa di una stretta specificità dell’ospite. Il parassita è incapace di riprodursi nella pelle umana (assenza di femmine ovigere nell’epidermide, assenza di cunicoli) e rimane confinato in superficie senza azione perforante né antigenica.
Pertanto, il trattamento appropriato dell’animale rogna di solito è sufficiente a risolvere i sintomi nell’uomo – la rogna sarcoptica essendo considerata un’”emizoonosi” in cui il parassita muore rapidamente nella pelle umana senza riprodursi. Una persistenza dei sintomi umani dovrebbe far sospettare una fonte persistente di contaminazione: animale non o mal trattato, congeneri portatori asintomatici non identificati, o sopravvivenza dei parassiti nell’ambiente.
La rogna notoedrica
La rogna notoedrica è un’acariasi contagiosa che colpisce principalmente il gatto, il ratto e il criceto. È causata dalla moltiplicazione in superficie e nell’epidermide di acari psorici della famiglia dei Sarcoptidae: Notoedres cati nel gatto e Notoedres muris nei roditori.
Relativamente rara nel gatto in Francia metropolitana, questa affezione è più frequente nei dipartimenti e territori d’oltremare (Isola della Réunion, Antille), nonché in Italia, Slovenia e Spagna. Nel criceto e nel ratto, essa costituisce una delle dermatosi pruriginose più comuni.
Il ciclo biologico dei notoedri è paragonabile a quello dei sarcopti, con una contagiosità marcata, in particolare per contatto diretto, che può colpire gatti, cani e uomo. Questa infestazione può manifestarsi in modo enzootico o epizootico con una morbilità significativa. I fattori di sensibilità includono la giovane età (gattini), l’immunodeficienza (gatti FeLV o FIV positivi) e, nei roditori, lo stato di cucciolo o di femmina gravida.
Clinicamente, nel gatto, le lesioni iniziano generalmente sul muso (ponte nasale, labbra, palpebre, padiglioni auricolari) prima di generalizzarsi agli arti e alle regioni perianale e addominale. Si manifestano con depilazioni diffuse eritematose e squamose, che evolvono rapidamente verso formazioni crostose. Il prurito è solitamente intenso.
Nel criceto, le manifestazioni cutanee comprendono lesioni crostose localizzate preferenzialmente al muso, ai padiglioni auricolari e all’estremità degli arti, con frequente coinvolgimento genitale. Il prurito varia da moderato a intenso.
Nel ratto, la distribuzione delle lesioni è più ristretta, limitata al bordo libero dei padiglioni auricolari e al muso, sotto forma di verrucosità pseudo-tumorali. Lesioni papulo-crostose sono generalmente osservate sulla coda, ma la generalizzazione è insolita. L’intensità del prurito varia da moderata a grave.
Le contaminazioni umane, la cui incidenza precisa è difficile da valutare, producono segni cutanei simili a quelli della rogna sarcoptica canina: prurigo del tronco, delle braccia e delle gambe. Come per Sarcoptes scabiei var. canis, i notoedi non possono riprodursi nella pelle umana (assenza di femmine ovigere epidermiche e di cunicoli) e rimangono confinati in superficie, senza azione perforante né risposta antigenica significativa. La risoluzione della rogna nell’animale porta quindi generalmente alla guarigione nell’uomo, essendo questa rogna notoedrica anch’essa considerata un’emizoonosi.
La diagnosi, relativamente semplice, si basa sull’identificazione di notoedri in varie fasi di sviluppo (adulti, ninfe, larve, uova) e delle loro deiezioni durante i raschiamenti cutanei.
Il trattamento si avvale di acaricidi sistemici (avermectine e milbemicine), con la necessità di trattare tutti gli animali del gruppo, che presentino o meno segni clinici.
La rogna trixacaria
La rogna da Trixacarus caviae costituisce un’acariasi contagiosa specifica del porcellino d’India (e occasionalmente del topo), causata da un acaro psorico della famiglia dei Sarcoptidae. I fattori scatenanti rimangono poco chiari, con condizioni di contaminazione spesso discrete e un periodo di incubazione variabile.
La ricostruzione della storia dell’infestazione è spesso complessa, con la contaminazione che precede frequentemente l’acquisizione degli animali. Questi porcellini d’India ospitano probabilmente un piccolo numero di parassiti senza manifestazioni cliniche, fino a quando modifiche ambientali (alimentazione, habitat, sovrappopolazione) o un’alterazione dello stato di salute non provocano la moltiplicazione parassitaria oltre la soglia patogena.
Fatto notevole, la presenza di animali gravemente colpiti non sempre comporta la contaminazione dei congeneri a contatto, suggerendo una componente individuale nella ricettività all’infestazione.
Il quadro clinico associa un prurito costante, precoce e spesso intenso a lesioni rapidamente generalizzate: eritema, papule, squame, che evolvono verso estese formazioni crostose. La distribuzione può essere loco-regionale o generalizzata. Lo stato generale può deteriorarsi in caso di evoluzione cronica, con apatia, anoressia, dimagrimento e talvolta esito fatale.
Le contaminazioni umane, regolarmente segnalate, derivano da un contatto frequente e prolungato con l’animale malato. Sono stati in particolare descritti episodi di infestazione in comunità scolastiche, che hanno coinvolto bambini di scuola materna a contatto con un porcellino d’India gravemente colpito.
Nell’uomo, questa rogna si manifesta con una dermatosi pruriginosa papulosa (tipo prurigo) che colpisce principalmente le braccia, il collo e le gambe. Come per le altre rogne animali, il trattamento appropriato dell’animale è generalmente sufficiente per risolvere i sintomi umani, essendo questa rogna trixacaria anch’essa un’emizoonosi in cui il parassita non può riprodursi nella pelle umana.
Il protocollo terapeutico si basa sull’uso di acaricidi topici o sistemici (avermectine o milbemicine), con trattamento obbligatorio di tutti i congeneri. Una pulizia e una disinfestazione dell’ambiente completano la gestione.
Le cheiletiellosi
Le cheyletiellosi rappresentano un insieme di dermatosi parassitarie causate da acari del genere Cheyletiella, appartenenti alla famiglia dei Cheyletidae. Sono identificate tre specie principali, ciascuna con una preferenza dell’ospite: Cheyletiella yasguri (cane), Cheyletiella blakei (gatto) e Cheyletiella parasitivorax (coniglio).
Questi acari presentano caratteristiche biologiche particolari: gli adulti depongono le uova alla base dei peli e si nutrono di detriti cutanei e fluidi tissutali. A differenza di altri ectoparassiti di superficie, le cheyletielle possono penetrare nei detriti epidermici, o anche nello strato corneo, formando delle tasche. La loro mobilità sulla pelle è notevole.
Si tratta di parassiti obbligatori che compiono l’intero ciclo vitale sull’ospite, con una durata di sviluppo di circa 35 giorni. La trasmissione avviene principalmente per contatto diretto con animali clinicamente affetti o portatori asintomatici, ma anche indirettamente tramite l’ambiente, dove le femmine possono sopravvivere fino a 10 giorni. Sono possibili contaminazioni interspecifiche e la sopravvivenza potrebbe essere prolungata in condizioni ambientali favorevoli (temperatura relativamente bassa, umidità elevata, luminosità moderata). I parassiti possono contaminare i giacigli degli animali, gli interstizi dei muri e dei pavimenti, talvolta anche in assenza di animali.
Le cheyletiellosi colpiscono principalmente gli animali giovani (cuccioli e gattini provenienti da canili o gattili), ma anche i cani adulti (spesso portatori asintomatici) e i gatti adulti. Sono state osservate alcune predisposizioni razziali: razze canine nane (Yorkshire Terrier, Bichon, Barboncino) e, nel gatto, la razza Persiano.
La presentazione clinica varia a seconda della specie e dell’età:
- Nel cucciolo: prurito intenso con riflesso otopodale positivo e squamosi pronunciata che colpisce la testa, il dorso e i lombi
- Nel gattino: segni discreti limitati a una squamosi pityriasiforme dorso-lombare
- Nel gatto adulto: lesioni cutanee più infiammatorie con dermatite pruriginosa papulo-crostosa
- Nel coniglio: infestazione spesso asintomatica o dermatosi pruriginosa e squamosa principalmente tronculare
La contaminazione umana è frequente (>50% dei casi), manifestandosi generalmente da C. blakei e C. yasguri. Questa trasmissione, spesso sottostimata, deriva principalmente da un contatto diretto con l’animale parassitato (clinicamente affetto o portatore asintomatico), ma può anche avvenire indirettamente.
Nell’uomo, le manifestazioni cliniche compaiono rapidamente, già il secondo giorno dopo il contatto, sotto forma di papule molto pruriginose localizzate agli avambracci, alle pieghe dei gomiti e alle braccia, al petto, all’addome e alle cosce.
La diagnosi, generalmente semplice, si basa sull’evidenziazione delle cheyletielle tramite raschiamenti cutanei, spazzolatura o “scotch test” e l’osservazione microscopica delle squame e dei detriti. La visualizzazione dei parassiti è solitamente agevole nel cane (adulti, ninfe, uova) ma più difficile nel gatto, dove gli adulti sono raramente identificati e solo le uova alla base dei peli possono essere osservate. Nel coniglio, le forme parassitarie sono facilmente rilevabili.
Il trattamento specifico associa:
- Acaricidi topici o sistemici (avermectine o milbemicine)
- Trattamento prolungato (minimo otto settimane) a causa della resistenza delle uova agli acaricidi
- Trattamento obbligatorio di tutti gli animali a contatto
- Trattamento ambientale
L’isolamento e il trattamento appropriato degli animali consentono generalmente la risoluzione spontanea delle lesioni nell’uomo, poiché le cheyletielle non possono riprodursi nella pelle umana.
La pulicosi
Le infestazioni da pulci (pulicosi) costituiscono una delle ectoparassitosi più comuni nei cani e nei gatti. La specie predominante è Ctenocephalides felis felis – “la pulce del gatto” – più raramente Ctenocephalides canis. Sebbene le pulicosi non siano strettamente considerate zoonosi in senso proprio, la loro frequenza e le loro conseguenze negative nell’uomo giustificano la loro inclusione in questa analisi delle dermatozoonosi.
Le pulci sono insetti afaniotteri (senza ali), appiattiti lateralmente. Gli adulti, parassiti cosmopoliti e sedentari, trascorrono la maggior parte del loro tempo sull’animale ospite. Il loro ciclo biologico presenta diverse particolarità: le femmine iniziano a deporre le uova sull’ospite entro 24-48 ore dal loro primo pasto di sangue. Queste uova, dalla superficie liscia, cadono nell’ambiente dove si svolge lo sviluppo (uova, tre stadi larvali, stadio ninfale).
La durata del ciclo completo è di circa tre settimane in condizioni ottimali, ma può essere rallentata in condizioni ambientali sfavorevoli. Un elemento cruciale dell’epidemiologia è la capacità degli adulti pre-emersione (ancora nei bozzoli ninfali) di persistere per diversi mesi nell’ambiente, costituendo un considerevole serbatoio parassitario. Questi adulti emergono sotto l’influenza di stimoli specifici (vibrazioni, luce, segnali chimici) e formano ciò che è comunemente chiamato “le pulci del parquet”.
L’infestazione da pulci è generalmente inapparente negli animali in buona salute. I cani sani subiscono una pressione parassitaria moderata, e la popolazione di pulci è naturalmente limitata dai comportamenti di auto-grooming (morsicamento, leccamento) e dai movimenti di grattamento che espellono i parassiti dal pelo. Questa particolarità spiega la difficoltà occasionale di evidenziare i parassiti sugli animali infestati.
Le conseguenze patologiche delle pulicosi comprendono due dimensioni:
- Un’irritazione meccanica cutanea dovuta a ripetute punture e agli spostamenti dei parassiti
- Lo sviluppo, in alcuni soggetti sensibilizzati, di una dermatite da ipersensibilità alle punture di pulci (DHPP), che costituisce la dermatosi allergica più frequente sia nel gatto che nel cane
Nel cane, la DHPP si manifesta con un’alopecia dorso-lombare associante eritema, papule e croste, con prurito generalmente intenso. In assenza di trattamento adeguato, le complicazioni infettive secondarie sono frequenti. Nel gatto, il quadro si caratterizza per una dermatite pruriginosa papulo-crostosa, placche eosinofiliche e/o un’alopecia dorso-lombare.
La trasmissione all’uomo avviene principalmente in caso di infestazioni massive, quando la sovrappopolazione costringe le pulci a cambiare ospite. È opportuno precisare che la trasmissione diretta di pulci adulte tra animali o verso l’uomo è relativamente limitata (10-15% in media). La contaminazione umana proviene essenzialmente da giovani pulci adulte appena emerse dai bozzoli, che cercano attivamente un ospite disponibile, qualunque esso sia.
Nell’uomo, la DHPP colpisce preferenzialmente gli arti (caviglie, polsi) e, nel bambino, può estendersi al tronco. Le lesioni, intensamente pruriginose, assumono l’aspetto di papule orticarioidi, di placche orticarioidi o di vescicole transitorie. Un impetigine secondaria al grattamento e alle sovrainfezioni batteriche è talvolta osservata.
La diagnosi di pulicosi si basa sull’identificazione diretta delle pulci adulte o delle loro deiezioni, sia a occhio nudo che mediante spazzolatura con un pettine antipulci specifico. Per la DHPP, la diagnosi si basa su elementi anamnestici evocatori (dermatosi stagionale, presenza di più cani/gatti nell’ambiente) e su lesioni cliniche compatibili (dermatosi pruriginosa dorso-lombare). Paradossalmente, negli animali affetti da DHPP, l’infestazione visibile da pulci è spesso minima.
Nel cane, i test di intradermoreazione che utilizzano estratti totali di pulci possono confermare una DHPP mediante reazioni immediate positive a 20 minuti e/o ritardate a 48 ore, sebbene la loro assenza non escluda la diagnosi. Questi test sono considerati poco affidabili nel gatto.
Il trattamento delle pulicosi e della DHPP non deve mai essere banalizzato e richiede un approccio globale:
- Eliminazione delle pulci dall’animale affetto
- Trattamento obbligatorio degli animali congeneri
- Bonifica dell’ambiente
Questa strategia integrata richiede spesso una stretta collaborazione con il proprietario per stabilire un efficace programma di lotta. Il controllo delle pulci sull’animale si basa sull’uso di adulticidi remanenti, mentre la gestione degli stadi non parassitari nell’ambiente si avvale di inibitori della crescita degli insetti e di adulticidi ambientali. Sono inoltre essenziali misure meccaniche complementari (pulizia metodica, eliminazione delle nicchie ecologiche).
Dermatozoonosi elmintiche
Le larva migrans cutanee
Il fenomeno della larva migrans cutanea (LMC) si osserva principalmente in Francia metropolitana in persone di ritorno da regioni tropicali, dove i cani randagi contaminano le spiagge con le loro feci. Questi cani, generalmente non medicalizzati e non sverminati, sono frequentemente infestati da anchilostomi (Ancylostoma spp. e Uncinaria spp.), nematodi digestivi responsabili in essi di gastroenteriti emorragiche. Tuttavia, la recente descrizione di un’enzozzia di larva migrans da Ankylostoma in Bretagna invita a una maggiore vigilanza sul territorio metropolitano.
Le manifestazioni cutanee sono legate alla penetrazione transcutanea di larve infestanti L3. Clinicamente, si traducono in papule spesso crostose e pruriginose, talvolta pustolose, localizzate preferibilmente sulle zone a pelle sottile (addome) e sugli arti (spazi interdigitali e superfici palmari). Questi segni, relativamente poco specifici, richiedono un’anamnesi precisa che evochi un potenziale contatto con ambienti contaminati (cane che vive in canile, ambiente rurale, cane da caccia).
Le fonti di contaminazione comprendono i cani (e i gatti) portatori e i terreni umidi contaminati dalle larve infestanti L3. I canili mal tenuti e con terreno in terra battuta costituiscono un ambiente ideale per lo sviluppo larvale, spiegando la particolare vulnerabilità dei cani da caccia. Da notare anche la possibilità di infestazione indiretta per ingestione da parte di cani di piccoli roditori che a loro volta hanno ingerito larve L3.
La diagnosi delle migrazioni transcutanee è spesso delicata. L’evidenziazione diretta delle larve L3 tramite raschiamenti cutanei è raramente conclusiva. L’esame istopatologico di biopsie cutanee può suggerire queste migrazioni (infiltrato eosinofilico e occasionalmente presenza di larve). L’esame coprologico consente generalmente di identificare facilmente le uova, spesso numerose.
La prevenzione e il controllo implicano un approccio multiplo:
- DISTRUZIONE DEGLI AMBIENTI CONTAMINATI
- SVERMINAZIONE REGOLARE E RAGIONEVOLE, IN PARTICOLARE DELLE CANE GRAVIDI (ANTELMINTICI AD AZIONE LARVICIDA)
- RICOSTRUZIONE DEI CANILI IN TERRA BATTUTA INFESTATI
- RACCOLTA QUOTIDIANA DELLE DEIEZIONI
- PULIZIA SETTIMANALE INTENSIVA A BASE DI CRESYL
Nell’uomo, la larva penetrante la pelle produce un’eruzione serpiginosa caratteristica. Tuttavia, questa infestazione costituisce un’impasse parassitaria, con le lesioni che generalmente regrediscono spontaneamente in poche settimane o alcuni mesi.
La dermatosi furcocercariale o dermatite dei nuotatori
La dermatosi furcocercariale, conosciuta anche come dermatite dei nuotatori (o degli bagnanti), rappresenta una dermatozoonosi stagionale (giugno-settembre) sempre più frequente. Questa metazoonosi è provocata dalla penetrazione epidermica di larve di un trematode, Trichobilharzia ocellata, parassita dell’anatra, talvolta impropriamente chiamata “pulce dell’anatra”. La contaminazione avviene durante i bagni in acqua dolce, in particolare nelle zone lacustri (Lago di Annecy, Lago del Bourget, Lago di Ginevra, laghi svizzeri e italiani).
Il ciclo parassitario coinvolge il trematode T. ocellata, parassita digestivo dell’anatra, escreto nelle feci. Questi trematodi vengono successivamente ingeriti da chiocciole acquatiche del genere Lymnaea, in particolare Lymnaea stagnalis. Le cercarie (forme larvali) vengono successivamente liberate nell’acqua dove possono contaminare l’anatra (ospite definitivo) così come l’uomo o il cane (ospiti accidentali) durante il bagno.
Sebbene il cane possa presentare lesioni simili a quelle osservate nell’uomo, è importante sottolineare che in nessun caso l’uomo può contaminarsi da un cane affetto.
Nell’uomo, il quadro clinico è caratterizzato da una dermatite eruttiva intensamente pruriginosa, maculo-papulosa, localizzata nelle zone esposte. La comparsa improvvisa delle papule avviene generalmente entro 10-30 minuti dall’immersione in acqua dolce. L’evoluzione è favorevole, con guarigione spontanea in 2-3 settimane, sebbene sia frequentemente necessario un trattamento sintomatico (antistaminici o dermocorticoidi).
La profilassi sanitaria si basa sull’interruzione del ciclo biologico del parassita, implicando l’eliminazione delle chiocciole e delle anatre dai corpi idrici interessati. L’eliminazione dei molluschi essendo particolarmente difficile, si raccomanda ai bagnanti di evitare le zone di acqua poco profonda ricche di vegetazione acquatica, habitat privilegiato delle chiocciole.
La leishmaniosi
La leishmaniosi costituisce una protozoonosi infettiva trasmissibile per inoculazione, caratterizzata dalla moltiplicazione intracellulare di un protozoo flagellato, Leishmania infantum, nelle cellule del sistema dei fagociti mononucleati. La sua trasmissione avviene tramite la puntura di flebotomi, con il cane come principale serbatoio. In Francia, i focolai di enzootia canina si concentrano essenzialmente nel sud-est, lungo la costa mediterranea, dal confine italiano al confine spagnolo, e dal livello del mare fino a circa 800 metri di altitudine.
Sebbene il parassita sia stato isolato anche nella volpe e nel gatto, il loro ruolo epidemiologico sembra marginale. Scoperte recenti hanno inoltre evidenziato altre modalità di trasmissione: scambio di siringhe tra eroinomani, contaminazione tramite derivati ematici, suggerendo l’esistenza occasionale di un ciclo antropo-zoonotico.
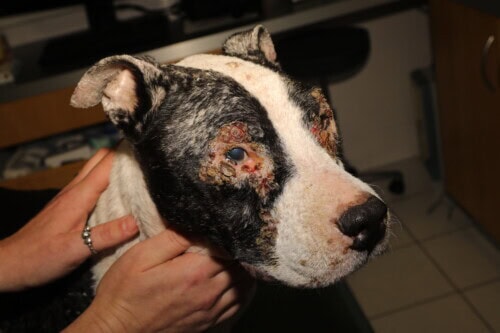
Nel cane, la leishmaniosi si presenta come una malattia generale con un notevole polimorfismo clinico. Indagini epidemiologiche condotte nelle Alpi Marittime e nella regione di Marsiglia indicano che circa un cane leishmaniotico su due è portatore asintomatico. Sebbene sistemica in questa specie, l’affezione si manifesta principalmente con alterazioni cutanee, mai isolate ma associate a vari segni clinici:
- Poliadenomegalia (frequente)
- Splenomegalia (più rara)
- Alterazione dello stato generale (astenia, amiotrofia muscolare facciale)
- Complicanze diverse: uveite bilaterale, artrite, glomerulonefrite (a volte unica manifestazione clinica, con prognosi sfavorevole)
Le lesioni cutanee, ad evoluzione tipicamente cronica, presentano una grande diversità morfologica:
- Dermatosi esfoliativa generalizzata che colpisce la testa, i padiglioni auricolari e gli arti
- Ulcerazioni delle estremità podali e dei punti di pressione
- Depigmentazione del tartufo (primaria o secondaria a ulcere)
- Ispessimento del tartufo e/o dei cuscinetti plantari
- Noduli non ulcerati, unici o multipli (particolarmente in alcune razze come il Boxer o il Dobermann)
- Dermatite pustolosa sterile generalizzata
Leishmaniosi canina
Nell’uomo, la leishmaniosi si presenta come una malattia sistemica che colpisce principalmente i bambini e gli adulti immunocompromessi. Può anche manifestarsi in forma strettamente cutanea, con lesioni localizzate nel punto di inoculo, generalmente sulle zone scoperte. Queste lesioni nodulari, ulcerate e crostose, sono caratteristicamente indolori, di dimensioni variabili e ad evoluzione cronica.
La diagnosi in medicina veterinaria si basa su diverse tecniche:
- Evidenziazione diretta del parassita tramite citologia (adenogramma, mielogramma)
- Sierologia (ELISA, immunofluorescenza indiretta)
- Amplificazione genica (PCR)
In zona di enzootia, è raccomandata una ricerca sistematica annuale, idealmente da effettuare dopo la stagione di esposizione (da novembre a gennaio), tenuto conto del periodo di incubazione variabile ma generalmente di alcuni mesi.
La gestione dei cani infetti suscita numerose controversie. Infatti, anche se trattati, questi animali rimangono portatori del parassita. La leishmaniosi viscerale umana, potenzialmente fatale in assenza di trattamento, con un’incidenza crescente in zona di enzootia, rende logica l’eliminazione del serbatoio parassitario. Tuttavia, questo approccio penalizzerebbe i proprietari responsabili di animali correttamente medicalizzati, lasciando nel contempo sussistere una popolazione canina non controllata. Paradossalmente, l’eutanasia sistematica dei portatori, quando è stata applicata, non ha dato i risultati sperati e si è addirittura accompagnata a un aumento dei casi umani.
Il veterinario svolge un ruolo determinante nell’informare i proprietari riguardo ai rischi e alla necessità di un rigoroso follow-up, sia clinico che biologico.
Il trattamento della leishmaniosi canina si basa sull’associazione di derivati stibio-antimoniali e allopurinolo, con uno stretto controllo terapeutico. Nonostante la sensibilizzazione dei proprietari, una parte dei cani sfugge inevitabilmente al controllo o riceve un’automedicazione intermittente, sollevando il grave problema della potenziale emergenza di ceppi resistenti. Di conseguenza, i veterinari devono astenersi dall’usare alcune molecole altamente efficaci come l’amfotericina B, che deve essere riservata esclusivamente alla medicina umana per questa indicazione.
Lo sviluppo di un vaccino canino rappresenterebbe la soluzione ideale per il controllo epidemiologico, ma il suo sviluppo si scontra attualmente con numerosi ostacoli.
Dermatozoonosi batteriche
La linfo-reticolosi benigna da inoculazione o malattia da graffio di gatto
La linfo-reticolosi benigna da inoculazione, più comunemente chiamata malattia da graffio di gatto (MGC) a causa della sua modalità di trasmissione predominante, costituisce nell’uomo una linfoadenopatia subacuta regionale di origine batterica. L’agente eziologico, Bartonella henselae (famiglia delle Bartonellaceae), è stato identificato solo nel 1992. Alcuni casi potrebbero anche essere attribuiti a Bartonella clarridgeiae. Entrambi i genotipi noti (I e II) di B. henselae sono implicati in questa affezione.
B. henselae è anche associata, insieme a B. quintana, all’eziologia dell’angiomatosi bacillare e della pelliosi, malattie vasculo-proliferative osservate principalmente nei pazienti infetti da HIV.
Il gatto rappresenta il principale, se non l’unico, serbatoio del batterio. Il ruolo del cane nella veicolazione dell’infezione sembra molto limitato. Sebbene rari, sono stati segnalati casi in assenza di esposizione diretta ad un animale, suggerendo altre possibili modalità di trasmissione (punture di pulci o zecche). La contaminazione umana si verifica nel 70% dei casi dopo un graffio e nel 10% dopo un morso felino. Eccezionalmente, un semplice contatto (carezza, bacio) potrebbe permettere la contaminazione di una ferita cutanea o mucosa preesistente, come illustra la forma oculo-gangliare talvolta osservata in persone che si sono probabilmente strofinate l’occhio dopo aver accarezzato un gatto.
L’infezione sperimentale nel gatto provoca rapidamente (meno di una settimana) una batteriemia asintomatica prolungata, persistente per 2-3 mesi o più in alcuni soggetti (una batteriemia ricorrente persistente è stata osservata in un gatto per 22 mesi). Alcuni gatti presentano livelli di batteriemia notevolmente elevati (superiori a 10^6 UFC/ml di sangue). La batteriemia è statisticamente più frequente nei gatti giovani (meno di un anno). B. henselae e B. clarridgeiae possono co-infettare lo stesso animale. Recentemente, due nuove specie di Bartonella, B. koehlerae e B. weissii, sono state isolate da gatti negli Stati Uniti, ma il loro ruolo patogeno nella MGC è ancora da dimostrare.
Gli studi epidemiologici indicano che una percentuale sostanziale dei gatti testati sono batteriemici, con una percentuale più alta tra i gatti randagi rispetto ai gatti domestici. Diverse indagini hanno rivelato tassi di gatti batteriemici che variano dal 16,5% al 53% all’interno delle popolazioni feline randagie, di cui circa un terzo infetto da B. clarridgeiae.
La pulce del gatto (Ctenocephalides felis felis) svolge un ruolo predominante nella trasmissione dell’infezione all’interno di questa specie. B. henselae può infatti essere isolato dalle pulci prelevate da gatti batteriemici. La pulce eliminerebbe il batterio nelle sue deiezioni, contaminando così il pelo dell’animale. I batteri possono moltiplicarsi nel tratto digestivo dell’insetto e sopravvivere nelle sue deiezioni. Il gatto contamina i propri artigli durante la toilette, stabilendo così la catena di trasmissione all’uomo. I gatti randagi, più frequentemente infetti, rappresentano una fonte di contaminazione per i gatti domestici.
La MGC è una malattia ubiquitaria (circa 22.000 casi umani annuali stimati negli Stati Uniti e 2.000 nei Paesi Bassi nel 2003) che può colpire tutte le età, ma interessa principalmente bambini e giovani adulti. La metà dei casi è segnalata in bambini di età inferiore ai 15 anni. L’angiomatosi bacillare, forma grave della malattia, è essenzialmente diagnosticata in adulti immunocompromessi (in particolare pazienti HIV+). La MGC si manifesta generalmente in modo sporadico, ma talvolta sono descritte piccole epidemie familiari.
Il quadro clinico classico inizia con un’adenopatia progressiva. Nel sito di inoculo compare in una settimana una papula che evolve verso una vescico-pustola. In oltre il 90% dei casi, questa lesione iniziale, che cicatrizza in 1-3 giorni, passa inosservata. È generalmente 2-3 settimane dopo che si sviluppa una linfoadenopatia persistente, che evolve verso la suppurazione nel 10-30% dei pazienti. Questa adenopatia satellite, unica nell’85% dei casi, si accompagna a una lieve ipertermia. Le lesioni regrediscono spontaneamente (giustificando la denominazione “benigna”) in diverse settimane o mesi, sebbene a volte possa instaurarsi una suppurazione cronica.
La MGC può anche manifestarsi in diverse forme atipiche, inclusa la sindrome oculo-ghiandolare di Parinaud e altre presentazioni talvolta gravi (endocardite, encefalite, setticemia, porpora), anche in soggetti immunocompetenti. Nei pazienti immunocompromessi, l’angiomatosi bacillare e la pelliosi rappresentano le principali manifestazioni cliniche.
La diagnosi si basa su criteri epidemiologici e clinici. La diagnosi differenziale comprende altre linfoadenopatie legate a diverse malattie generali (rosolia, tularemia) o a ferite banali, da morso o da graffio infettate da batteri non specifici o da Pasteurella spp.
I gatti vettori della trasmissione rimangono clinicamente sani. L’agente infettivo può essere isolato solo in un gatto batteriemico tramite emocoltura e identificazione mediante PCR. La sierologia è anch’essa utilizzabile, ma una reazione positiva non è necessariamente correlata a una batteriemia attiva.
Una terapia antibiotica, anche prolungata, non sembra eliminare la batteriemia nel gatto. Le misure profilattiche specifiche rimangono quindi limitate. Al contrario, l’uso regolare di prodotti antipulci può ridurre la contaminazione del serbatoio felino. Occorre notare che l’onicectomia, talvolta proposta come misura preventiva, non ha alcun interesse.
La prevenzione si basa sull’informazione chiara delle persone a rischio (particolarmente i pazienti immunocompromessi), la lotta ragionata contro le pulci nel gatto, il lavaggio delle mani dopo contatto con l’animale e, come per tutte le malattie trasmesse da morso o graffio, il lavaggio e la disinfezione immediata delle ferite.
Pasteurellosi
Le pasteurellosi animali, frequentemente riscontrate in numerose specie (ruminanti, suini, pollame, lagomorfi), si manifestano clinicamente con diverse affezioni: broncopolmoniti, pleuropolmoniti, ascessi sottocutanei, o forme setticemiche (colera del pollame).
Queste infezioni si trasmettono all’uomo secondo le consuete modalità di contagio (contatto diretto, alimentazione, inalazione), ma il meccanismo principale è l’inoculazione tramite morso di gatto, cane, più raramente ratto o coniglio. Questo morso può essere inflitto da un animale clinicamente malato, ma più spesso da un animale apparentemente sano, essendo Pasteurella spp. un batterio commensale delle vie aerodigestive superiori di molti animali, isolato nel 40-80% dei campioni nelle specie interessate.
Le pasteurelle isolate in persone morse sono essenzialmente P. multocida, P. canis e P. dagmatis. I casi di pasteurellosi umana senza morso identificato sono eccezionali; essi comprendono polmoniti, pleuriti, pericarditi, endocarditi, artriti e setticemii. Sebbene sia possibile una contaminazione di origine animale per inalazione o ingestione, Pasteurella spp. potrebbe anche, nell’uomo come nell’animale, sopravvivere come commensale sulle mucose ed esprimere il suo potere patogeno solo in associazione con affezioni o malattie debilitanti (infezioni virali, cancri, sindrome uremica, cirrosi). In questi casi particolari, queste pasteurellosi non sarebbero strettamente considerate zoonosi.
Nell’uomo, la presentazione clinica è dominata da forme localizzate con porta d’ingresso cutanea. Le forme acute sono caratterizzate da segni infiammatori locali intensi e precoci. Nelle ore successive alla penetrazione del germe, la ferita (spesso inizialmente inapparente) diventa calda, rossa, edematosa e molto dolorosa; una suppurazione compare rapidamente sotto forma di poche goccioline sierose. Una linfoangite e una linfoadenopatia satellitare sono frequentemente associate.
Le forme subacute loco-regionali evolvono diversamente: dopo manifestazioni iniziali simili o più discrete, compaiono tenosinoviti dolorose e persistenti, non suppurative, in prossimità del punto di inoculo, o artropatie metacarpo-falangee accompagnate da disturbi vasomotori (sensazione di pesantezza, cianosi o pallore, parestesie).
La diagnosi clinica si basa sul rapido sviluppo di un’infiammazione edematosa della regione morsa. L’isolamento batteriologico dal pus deve essere eseguito precocemente su terreni comuni, ma i risultati sono variabili.
Il trattamento delle pasteurellosi da inoculazione si avvale delle tetracicline. La profilassi umana è complessa a causa dell’impossibilità di eliminare il serbatoio animale in contatto permanente con l’uomo. Data la frequenza delle contaminazioni feline e le sequele funzionali talvolta osservate, una misura preventiva considerata consiste nell’amministrare un trattamento antibiotico immediato a qualsiasi persona morsa o graffiata, anche in assenza di segni clinici precoci.
La cowpox virosi
La virosi da cowpox è una malattia virale causata da un orthopoxvirus, il cowpox virus, descritto in numerose specie: vacca, cammello, bufalo, coniglio, gatto e, più recentemente, ratto. I virus di questa famiglia (vaiolo, cowpox, vaccine e vaiolo delle scimmie) sono strettamente correlati e appartengono tutti al genere Orthopoxvirus. Questi agenti presentano difficoltà di isolamento, anche da lesioni e organi infetti.
La diagnosi dell’infezione da Orthopoxvirus può essere stabilita con diverse tecniche:
- Microscopia elettronica
- Sierologia
- Amplificazione genica (PCR)
- Sequenziamento del DNA dopo isolamento o coltura, per l’identificazione precisa della specie virale
Data la loro vicinanza genetica, sono possibili errori di identificazione tra questi virus.
Nel gatto, la poxvirosi è osservata da circa 30 anni in Gran Bretagna, Paesi Bassi, Belgio e Germania. La sua presenza in Francia è regolarmente segnalata dal 1999. Questa infezione colpisce quasi esclusivamente gatti rurali cacciatori. La contaminazione proviene principalmente da piccoli roditori selvatici (arvicole, topi selvatici), più raramente da bovini.
L’arvicola rossastra (Clethrionomys glareolus) e, in misura minore, l’arvicola campestre (Microtus agrestis) svolgono un ruolo predominante nel mantenimento dell’infezione. Questi roditori possono anche trasmettere il virus ad altre specie che condividono lo stesso habitat naturale (sintopiche), come il topo selvatico (Apodemus sylvaticus), o persino gerbilli e scoiattoli terrestri nelle regioni orientali. Sono stati segnalati casi anche in ratti importati dai paesi dell’Est. L’aumento stagionale dei casi (estate e autunno) corrisponde al periodo di principale attività e proliferazione di questi piccoli roditori.
La trasmissione avviene principalmente per via transcutanea, talvolta per via oronasale.
Clinicamente, nel gatto, l’infezione si manifesta inizialmente con una singola lesione maculosa ed eritematosa, localizzata sulla testa, sul collo o sugli arti anteriori. In una decina di giorni, compaiono numerose lesioni pruriginose secondarie: macule, papule, noduli eritematosi, che progressivamente ulcerano e possono interessare tutto il corpo, inclusa la cavità orale. Segni generali (febbre, rinite, congiuntivite) sono frequentemente osservati.
L’evoluzione è generalmente favorevole, con guarigione spontanea delle lesioni secondarie in 3-8 settimane. Tuttavia, complicanze come sovrainfezioni batteriche o co-infezione retrovirale possono causare una generalizzazione delle lesioni cutanee e una polmonite talvolta fatale.
Nel ratto, le manifestazioni cutanee sono comparabili a quelle del gatto.
La trasmissione all’uomo è stata documentata sia dal gatto che dal ratto, con una prognosi particolarmente riservata negli individui immunocompromessi o anziani. L’interruzione della vaccinazione antivaiolosa potrebbe aver ridotto la protezione crociata contro i poxvirus nella popolazione generale, predisponendo così i soggetti non vaccinati, in particolare se immunocompromessi, a queste infezioni.
Nell’uomo, dopo un’incubazione di 2-6 giorni, le manifestazioni cutanee del cowpox sono generalmente benigne: lesioni papuloso-vesicolari, ombelicate e areolate, localizzate sul viso, sulle mani, sulle braccia e talvolta sulle mucose (in particolare nel bambino). Segni generali (febbre, adenopatia) accompagnano frequentemente l’eruzione. Nei pazienti immunocompromessi, l’infezione può assumere una forma grave con vaiolo pustoloso ed emorragico generalizzato, potenzialmente fatale.
La diagnosi nell’animale si basa principalmente sull’istopatologia delle biopsie cutanee, che rivela lesioni specifiche delle poxvirosi. Altre tecniche meno comuni includono la microscopia elettronica, la sierologia, l’isolamento virale e la PCR.
Il trattamento nel gatto è essenzialmente sintomatico, mirato a controllare le sovrainfezioni batteriche e a mantenere un’alimentazione adeguata nonostante le dolorose lesioni orali.
Le misure profilattiche sono fondamentali:
- Isolamento del gatto malato per evitare la contaminazione interfeline
- Eutanasia dei ratti colpiti
- Disinfezione dell’ambiente (candeggina) a causa della resistenza del virus
- Precauzioni durante le manipolazioni (uso di guanti) per limitare il rischio zoonotico, in particolare per le persone vulnerabili (immunocompromessi, bambini, anziani)
Implicazioni per la salute pubblica e strategie di prevenzione
Le dermatozoonosi, sebbene meno mediatizzate di altre zoonosi sistemiche, rappresentano un problema di salute pubblica non trascurabile, in particolare nel contesto di una relazione uomo-animale sempre più stretta. Un’indagine retrospettiva in una clientela dermatologica veterinaria rivela che quasi il 35% dei proprietari condivide il letto con il proprio animale (gatto o cane), e persiste in questa abitudine anche quando essi stessi presentano lesioni dermatologiche imputabili al proprio compagno.
Questa prossimità, associata alla molteplicità degli agenti patogeni potenzialmente trasmissibili, sottolinea l’importanza di un approccio preventivo coordinato tra medici, veterinari e proprietari di animali.
Ruolo del medico veterinario pratico
Il veterinario pratico occupa una posizione strategica all’interfaccia tra salute animale e salute umana. Il suo ruolo non si limita alla diagnosi e al trattamento delle affezioni animali; si estende a:
- L’informazione del proprietario riguardo ai potenziali rischi zoonotici associati al suo animale
- L’educazione sulle misure preventive adatte a ogni situazione
- La diagnosi precoce delle affezioni a potenziale zoonotico
- L’implementazione di trattamenti appropriati volti non solo a curare l’animale ma anche a interrompere la catena di trasmissione all’uomo
- La collaborazione con i medici per una gestione globale dei casi che implicano una trasmissione all’uomo
Questa missione di salute pubblica si rivela particolarmente delicata poiché è necessario conciliare l’attaccamento emotivo dei proprietari ai loro animali con gli imperativi sanitari. Spesso è illusorio voler modificare radicalmente i comportamenti di coabitazione tra i proprietari e i loro compagni, ma un’informazione chiara e obiettiva consente generalmente l’adozione di ragionevoli misure precauzionali.
Popolazioni a rischio particolare
Alcune popolazioni presentano una maggiore vulnerabilità alle dermatozoonosi e meritano un’attenzione specifica:
- Le persone immunocompromesse (pazienti sottoposti a immunosoppressori, persone affette da HIV, riceventi di trapianto, pazienti sottoposti a chemioterapia): l’infezione da HIV, in particolare, conferisce una dimensione particolare al rischio zoonotico, con manifestazioni potenzialmente più gravi di affezioni come la sporotricosi, la leishmaniosi, le poxvirosi o la tubercolosi
- I bambini piccoli: il loro sistema immunitario ancora immaturo, associato a comportamenti a rischio (contatti stretti con gli animali, igiene delle mani non sistematica) li espone in particolare
- Le persone anziane: fragilità immunitaria associata all’età
- Le donne in gravidanza: rischi specifici legati a taluni agenti patogeni
- I professionisti a contatto con gli animali: veterinari e loro personale, allevatori, toelettatori, personale di rifugio
Per queste popolazioni, devono essere formulate raccomandazioni specifiche, che possono andare da semplici precauzioni igieniche rafforzate all’evitamento temporaneo di determinate specie animali a seconda del contesto clinico.
Strategie preventive specifiche
Per le dermatofitosi
- Screening dei portatori asintomatici nelle comunità animali
- Isolamento e trattamento precoce degli animali affetti
- Disinfezione rigorosa dell’ambiente
- Precauzioni nell’acquisto di nuovi animali (in particolare gattini provenienti da allevamenti o negozi di animali)
- Sensibilizzazione particolare dei responsabili delle comunità infantili (scuole, asili nido) ai rischi associati alle mascotte di classe
Per la rogna e altre ectoparassitosi
- Trattamento antiparassitario regolare degli animali da compagnia
- Controllo delle popolazioni di animali randagi
- Maggiore attenzione nell’adozione di animali provenienti da rifugi
- Identificazione e trattamento di tutti gli animali a contatto in caso di diagnosi positiva
Per la leishmaniosi
- Screening annuale nelle zone di enzootia
- Uso di repellenti contro i flebotomi durante la stagione di attività vettoriale
- Limitazione delle uscite notturne dei cani nelle regioni endemiche
- Monitoraggio rigoroso dei cani infetti
- Informazione chiara dei proprietari sui rischi e sulle misure di prevenzione
Per le malattie trasmesse da morsi o graffi
- Educazione dei proprietari sulla manipolazione appropriata degli animali
- Disinfezione immediata di qualsiasi ferita, anche minima
- Consultazione medica rapida in caso di segni infiammatori
- Programma di lotta contro le pulci per limitare la trasmissione di B. henselae nel gatto
Approccio “One Health”
Il concetto “One Health” (Una sola salute) riconosce l’interdipendenza tra la salute umana, la salute animale e la salute ambientale. Questo approccio acquista il suo pieno significato nella gestione delle dermatozoonosi, che illustrano perfettamente questa interconnessione.
La stretta collaborazione tra medici e veterinari costituisce la pietra angolare di una gestione efficace di queste patologie.
Questa cooperazione deve articolarsi attorno a diversi assi:
- Condivisione di informazioni sui casi rilevati e sulle evoluzioni epidemiologiche
- Standardizzazione dei protocolli diagnostici per facilitare le comparazioni tra casi umani e animali
- Coordinamento degli approcci terapeutici per evitare l’insorgenza di resistenze
- Elaborazione congiunta di messaggi preventivi coerenti destinati al pubblico
- Ricerca collaborativa sui meccanismi di trasmissione e sui fattori di rischio
Questa collaborazione interprofessionale deve inscriversi in un contesto più ampio che coinvolge anche:
- Le autorità sanitarie pubbliche
- I laboratori di diagnosi
- Le strutture di ricerca
- Le associazioni di protezione animale
- I professionisti dell’allevamento e della gestione degli animali domestici
Solo questo approccio integrato consentirà una gestione ottimale di queste affezioni all’interfaccia uomo-animale.
Precauzioni fondamentali
Alcune precauzioni fondamentali, valide per l’insieme delle dermatozoonosi, possono essere raccomandate ai proprietari di animali e ai professionisti:
- Igiene rigorosa delle mani dopo ogni contatto con animali, in particolare prima dei pasti
- Sverminazione e antiparassitari esterni regolari degli animali domestici
- Sorveglianza veterinaria regolare con menzione esplicita di ogni contatto con persone vulnerabili
- Pulizia frequente dei luoghi dove dormono gli animali
- Indossare guanti durante la manipolazione di animali con lesioni cutanee
- Evitare temporaneamente contatti stretti (condivisione del letto, leccarsi il viso) in caso di dermatosi animale diagnosticata
- Consultazione medica rapida in caso di comparsa di lesioni cutanee nell’uomo dopo contatto con un animale malato
Queste semplici misure, associate a una maggiore sensibilizzazione dei proprietari ai segnali di allarme, consentirebbero di ridurre significativamente l’incidenza dei casi di trasmissione all’uomo.
Conclusione
Le dermatozoonosi costituiscono un gruppo eterogeneo di affezioni cutanee trasmissibili tra gli animali vertebrati e l’uomo, con una prevalenza relativamente bassa rispetto all’insieme delle zoonosi, ma un impatto potenziale significativo sulla salute pubblica. Ad eccezione di alcune entità specifiche come la sporotricosi, la malattia da graffio di gatto, la leishmaniosi e la virosi da cowpox, queste affezioni raramente presentano un carattere di gravità medica nell’uomo, il quale costituisce generalmente un’impasse parassitaria.
Tuttavia, la guarigione del proprietario affetto, con o senza trattamento, è destinata al fallimento se la fonte di contaminazione – l’animale – non viene identificata e trattata adeguatamente. Questa interdipendenza sottolinea l’importanza cruciale di un approccio coordinato tra medicina veterinaria e medicina umana.
Il medico veterinario pratico, data la sua posizione strategica all’interfaccia uomo-animale, svolge un ruolo chiave nella diagnosi precoce, nel trattamento appropriato e nella prevenzione di queste affezioni. La sua responsabilità si estende oltre la cura dell’animale per comprendere una dimensione di salute pubblica, implicando informazione, educazione e collaborazione con i medici.
In un contesto di crescente integrazione degli animali da compagnia all’interno delle famiglie, con contatti fisici stretti sempre più frequenti, la vigilanza nei confronti delle dermatozoonosi acquista importanza. Questa prossimità, pur essendo fonte di innegabili benefici psicologici e sociali, impone un’adeguata medicalizzazione degli animali da compagnia come corollario indispensabile della loro integrazione familiare.
Infine, l’approccio “One Health”, riconoscendo l’interconnessione tra salute umana, salute animale e salute ambientale, fornisce un quadro concettuale pertinente per affrontare queste patologie. Solo una stretta collaborazione tra tutti gli attori coinvolti – veterinari, medici, proprietari di animali, autorità sanitarie – consentirà di minimizzare i rischi di trasmissione pur preservando i benefici della relazione uomo-animale.
FAQ
1. Gli animali portatori di germi zoonotici presentano sistematicamente segni clinici identificabili?
No, molti animali possono essere portatori asintomatici di agenti patogeni trasmissibili all’uomo. Ciò accade in particolare per le dermatofitosi (soprattutto nel gatto), la leishmaniosi (circa il 50% dei cani infetti in zona di enzootia sono asintomatici) o la malattia da graffio di gatto (i gatti batteriemici generalmente non presentano alcun segno clinico). Questa particolarità complica la diagnosi e giustifica misure preventive sistematiche, in particolare per le popolazioni a rischio.
2. Come distinguere clinicamente le diverse forme di rogna animale e valutarne il potenziale zoonotico?
Le diverse rogne animali (sarcoptica, notoedrica, trixacaria) presentano quadri clinici relativamente simili nell’animale (lesioni eritamatose-squamose-crostose e prurito), ma si distinguono per la loro distribuzione preferenziale e la specie animale colpita. Il loro potenziale zoonotico è variabile: tutte possono causare lesioni nell’uomo, ma costituiscono generalmente “emizoonosi” in cui il parassita non può completare il suo ciclo nella pelle umana. La diagnosi parassitologica precisa tramite raschiamento cutaneo è essenziale per valutare il rischio di trasmissione e adattare le misure preventive.
3. I trattamenti antiparassitari preventivi commercializzati per gli animali da compagnia offrono una protezione completa contro le dermatozoonosi parassitarie?
I moderni antiparassitari esterni, in particolare quelli a base di isoxazoline, avermectine o milbemicine, offrono un’eccellente protezione contro la maggior parte degli ectoparassiti responsabili di dermatozoonosi (pulci, sarcopti, notoedri, cheyletielle). Tuttavia, la loro efficacia non è assoluta e dipende da molteplici fattori: aderenza al trattamento, copertura dello spettro parassitario, resistenze emergenti, peculiarità individuali. Inoltre, questi trattamenti generalmente non offrono protezione contro le dermatozoonosi fungine, batteriche o virali. È quindi necessario un approccio preventivo globale, che combini il trattamento antiparassitario, un’igiene adeguata e una regolare sorveglianza veterinaria.
4. Quale condotta tenere di fronte a un animale che presenta lesioni cutanee in un ambiente familiare con persone immunocompromesse?
In questa situazione ad alto rischio, si impongono diverse misure: consultazione veterinaria immediata per una diagnosi precisa, isolamento temporaneo dell’animale in una stanza dedicata fino alla risoluzione delle lesioni, uso di guanti durante le manipolazioni necessarie, disinfezione rigorosa delle superfici di contatto e rafforzamento dell’igiene delle mani. A seconda della diagnosi stabilita e del grado di immunosoppressione della persona interessata, possono essere prese in considerazione misure più rigorose, sempre in consultazione tra il veterinario e il medico curante. In alcuni casi particolari che coinvolgono agenti altamente patogeni come Sporothrix schenckii in un paziente gravemente immunocompromesso, può essere necessaria una separazione temporanea.
5. L’aumento dei casi di dermatozoonosi osservato negli ultimi decenni riflette una reale emergenza o semplicemente una migliore individuazione?
L’apparente evoluzione dell’incidenza delle dermatozoonosi deriva probabilmente da una combinazione di fattori. Da un lato, i progressi diagnostici e la crescente consapevolezza dei professionisti della salute consentono una migliore identificazione dei casi. D’altra parte, diversi fattori favoriscono una vera e propria emergenza: aumento del numero di animali da compagnia e intensificazione dei contatti fisici, moltiplicazione dei viaggi internazionali che facilitano la circolazione di nuovi patogeni, crescita delle popolazioni immunocompromesse più vulnerabili a queste infezioni, modificazioni ambientali che influenzano i cicli parassitari e comparsa di resistenze ai trattamenti antiparassitari. Un approccio epidemiologico rigoroso, che associ medicina umana e veterinaria, è necessario per quantificare precisamente queste tendenze e adattare le strategie preventive.
Riferimenti
- guaguère e. dermatozoonoses en milieu urbain : le point de vue du dermatologue vétérinaire = dermatozoonoses in urban settings : the veterinary dermatologist’s point of view. 33522539.pdf.
- martin s, schmutz jl. les dermatozoonoses. nouv dermatol 2002 ; 21 : suppl.2 : 37-42.
- viaud s, bensignor e. les dermatozoonoses du chien et du chat. prat med chir anim comp 2008 : 43, 131-9.
- euzéby j. mycologie médicale comparée : les mycoses des animaux et leurs relations avec les mycoses de l’homme. tome i. oullins: fondation marcel merieux; 1992.
- moriello ka, de boer dj. dermatophyties in: guaguère e, prélaud p, editors. guide pratique de dermatologie féline. lyon: mérial; 2000. p. 4.1–11.
- brouta f, deschamps f, losson b, mignon b. données récentes sur la pathogénèse de l’infection de microsporum canis chez les carnivores domestiques. ann med vet 2001; 145: 236–42.
- mignon b. dermatophyties. in: guaguère e, prélaud p, editors. guide pratique de dermatologie canine. lyon: kalianxis; 2006. p. 153–66.
- guaguère e, hubert t, muller a. dermatologie des petits mammifères de compagnie. in : encyclopédie vétérinaire – dermatologie, elsevier, paris, 2007 ; vol 2 (3700) 1-17.
- carlotti dn. le traitement des dermatophytoses du chien et du chat. gestion de la teigne en chatterie. prat med chir anim comp 2008; 43 : 1–13.
- viguié-vallanet c. les teignes. ann dermatol venereol 1999 ; 126 : 349-56.
- ferrer l, fondati a. mycoses profondes. in: guaguère e, prélaud p, editors. guide pratique de dermatologie feline. lyon: mérial; 2000. p. 5.1-11.
- schubach tm, schubach a, okamoto t, barros mb, figueiredo fb, cuzzi t, et al. evaluation of an epidemic sporotrichosis in cats: 347 cases (1998—2001). j am vet med assoc 2004; 224: 1623-9.
- cafarchia c, sasanelli m, lia rp, de caprariis d, guillot j, otranto d. lymphocutaneous and nasal sporotrichosis in a dog from sou-thern italy: case report. mycopathologia 2007; 163: 75—9.
- verde m. dermatozoonoses. in: guaguère e, prélaud p, editors. guide pratique de dermatologie féline. lyon: mérial; 2000. p. 25.1–7.
- guaguère e, beugnet f. dermatoses parasitaires. in: guaguère e, prélaud p, editors. guide pratique de dermatologie canine. lyon: kalianxis; 2006; p 181- 231.
- paterson s. skin diseases of exotic pets (paterson s, ed), blackwell publishing, oxford, 2006 ; 333 p.
- ellis c, mori m. skin diseases of rodents and small exotic mammals. vet clin north am exotic anim pract 2007 ; 4 : 523-7.
Ricerche Correlate
dermato zoonosi, punto di vista, dermatologia, nell’uomo, dermatozoonosi, animali, dermatologo, zoonosi, malattie, servizio, ambiente, gatto, cane, parassiti, nodulo, s, pratica, dermatofiti, umano, infezione, microsporum canis, contatto, pelle, pustole, trichophyton verrucosum, b, vol, viaud, roditori, pulci, nel gatto, specie, morso, virus, casi, infestazioni, francia, conoscenza, salute, rischio, dermatosi, dermatite, acaro, trasmissione, lesioni, doi, veterinario, ambiente, animali da compagnia, uccelli, bambini, carnivori domestici, avambracci, segni clinici, zoo, trichophyton mentagrophytes, causa, autori, papule, punture, informazione, persone, sarcoptes, diagnosi, compagnia, segni, contagio