Le calcinosi cutanee rappresentano una sfida diagnostica e terapeutica maggiore in dermatologia veterinaria canina. Queste affezioni, caratterizzate dall’accumulo anomalo di sali calcici nelle strutture dermiche e ipodermiche, necessitano di un approccio clinico rigoroso fondato su una comprensione precisa dei loro meccanismi fisiopatologici distinti.
Settembre 2025
L’identificazione precoce dei diversi tipi di calcinosi e l’instaurazione di un trattamento adeguato condizionano direttamente la prognosi funzionale ed estetica. Durante le ultime giornate annuali del GEDAC, il nostro confratello Vincent Bruet, presidente del GEDAC, ha presentato i progressi recenti nella classificazione eziologica, le modalità diagnostiche contemporanee e le prospettive terapeutiche emergenti, particolarmente quelle ispirate ai protocolli sviluppati in medicina umana.
Definizione e Nomenclatura della Calcinosi Cutanea
La calcinosi cutanea si definisce precisamente per depositi anomali di sali di calcio nel derma e nell’ipoderma. Questi accumuli minerali si manifestano clinicamente sotto forma di noduli o placche indurite, presentando tipicamente una colorazione biancastra caratteristica, e sono suscettibili di alterare significativamente la superficie cutanea. La classificazione moderna distingue tre entità cliniche principali secondo la loro estensione anatomica e la loro presentazione morfologica.
La calcinosi cutanea costituisce il termine generico che abbraccia l’insieme dei depositi calcici che colpiscono le strutture cutanee, indipendentemente dalla loro localizzazione o dalla loro estensione. Questa denominazione generale permette di identificare il processo patologico fondamentale senza pregiudicare le sue caratteristiche specifiche.
La calcinosi circumscritta rappresenta una forma clinica localizzata, caratterizzata da depositi calcici circoscritti, frequentemente osservati nelle regioni periarticolari o in prossimità delle estremità. Questa localizzazione preferenziale suggerisce l’intervento di fattori meccanici locali nella genesi di queste lesioni.
La calcinosi universalis costituisce la forma più estensiva e più severa, caratterizzata da un interessamento diffuso che colpisce non soltanto le strutture cutanee ma anche i tessuti sottocutanei, muscolari e tendinei. Questa forma sistemica si associa generalmente a una prognosi più riservata e necessita di una presa in carico multidisciplinare complessa.
Fondamenti Fisiopatologici e Classificazione Moderna delle Calcinosi
La tassonomia attuale delle calcinosi cutanee si articola attorno a cinque entità fisiopatologiche distinte, ciascuna rispondente a meccanismi biologici specifici. Questa stratificazione costituisce la base di ogni approccio terapeutico razionale, poiché determina l’orientamento diagnostico e condiziona le scelte terapeutiche.
La calcinosi distrofica
Essa occupa una posizione centrale in dermatologia veterinaria. Il suo sviluppo sopravviene esclusivamente su tessuti precedentemente alterati da processi infiammatori, necrotici o degenerativi, in un contesto metabolico fisiologico caratterizzato da normocalcemia e normofosfatemia. I danni tissutali iniziali scatenano una cascata molecolare complessa che implica il rilascio di proteine cellulari ad affinità fosfatica, particolarmente le proteine mitocondriali, che favoriscono la formazione di foci di nucleazione cristallina, poi la precipitazione progressiva di composti calcici attorno alle strutture fibrillari del derma, particolarmente le fibre di collagene ed elastina.
In medicina umana, questa forma rappresenta la manifestazione più frequente e riguarda fino al 70% dei bambini colpiti da dermatomiosite. Le connettiviti costituiscono le eziologie principali, includendo la sclerodermia, la dermatomiosite, il lupus eritematoso e le connettiviti miste. I processi infettivi, neoplastici e certe dermatosi ereditarie come la sindrome di Ehlers-Danlos completano lo spettro eziologico di questa forma.
La Calcinosi Metastatica
Essa procede da un meccanismo radicalmente differente, implicando la precipitazione calcica in tessuti strutturalmente intatti. Questa forma risulta direttamente da anomalie metaboliche sistemiche che provocano ipercalcemia, iperfosfatemia, o entrambe simultaneamente. L’iperparatiroidismo, che sia primario o secondario, costituisce il principale fattore scatenante per mezzo di tre vie metaboliche convergenti: l’attivazione del riassorbimento osteoclastico, l’aumento del riassorbimento tubulare renale del calcio, e la stimolazione indiretta della sintesi di calcitriolo che intensifica l’assorbimento intestinale calcico.
Il concetto di prodotto fosfocalcico riveste qui un’importanza capitale. Quando questo prodotto (calcio sierico × fosforo sierico) oltrepassa la soglia critica di 70 mg²/dL², fenomeni di cristallizzazione spontanea si avviano in diverse strutture organiche. Benché gli organi viscerali (stomaco, polmoni, reni, miocardio) costituiscano i bersagli privilegiati, la pelle può ugualmente essere colpita, benché più raramente.
Forme Particolari e Emergenti
La calcinosi idiopatica rappresenta un’entità enigmatica caratterizzata dall’assenza di ogni anomalia metabolica rilevabile e di lesione tissutale preesistente. Questa forma solleva interrogativi fondamentali riguardo l’esistenza di meccanismi fisiopatologici ancora sconosciuti o di predisposizioni genetiche latenti. In medicina umana, questa categoria include la calcinosi tumorale (tumoral calcinosis), i noduli calcificati sottoepidermici e la calcinosi scrotale.
La calcinosi iatrogena risulta direttamente da interventi o trattamenti medici specifici. La somministrazione locale o sistemica di prodotti contenenti calcio o fosfato, come il gluconato di calcio, può provocare depositi calcici localizzati. La supplementazione eccessiva di vitamina D costituisce ugualmente un fattore di rischio riconosciuto, particolarmente negli animali che ricevono complementi nutrizionali non controllati.
La calcifillassi costituisce indubbiamente la forma più temibile. Questa entità si distingue per la calcificazione selettiva della media delle arteriole dermiche e ipodermiche, generando un processo ischemico progressivo. Le conseguenze cliniche si rivelano drammatiche: necrosi cutanee estensive, lesioni tissutali, sovrinfezioni settiche ricorrenti e mortalità elevata. Questa forma rimane strettamente associata agli stadi terminali di insufficienza renale cronica e si osserva particolarmente nei pazienti dializzati in medicina umana.
Meccanismi Fisiopatologici Dettagliati della Calcinosi Distrofica
Nella calcinosi distrofica, i tassi sierici di calcio e fosfato rimangono entro i limiti fisiologici normali. Il processo patologico si inizia per danni tissutali che comportano il rilascio massiccio di proteine intracellulari, particolarmente le proteine mitocondriali dotate di un’affinità particolare per il fosfato. Queste proteine agiscono come centri di nucleazione, favorendo la precipitazione locale dei sali calcici.
L’ipossia tissutale locale, conseguenza diretta delle lesioni iniziali, crea un ambiente favorevole alla calcificazione. L’infiammazione cronica mantiene questo processo per il rilascio sostenuto di citochine pro-infiammatorie, particolarmente il TNF-α, l’IL-6 e l’IL-1β. Questi mediatori infiammatori amplificano la risposta tissutale locale e perpetuano le condizioni propizie alla mineralizzazione patologica.
La formazione di cristalli intracellulari costituisce un evento deleterio maggiore, conducendo inesorabilmente alla necrosi cellulare. Questa morte cellulare libera nuovi foci di nucleazione e mantiene un circolo vizioso autoalimentato di calcificazione progressiva. Il processo si estende gradualmente alle strutture adiacenti, particolarmente le fibre di collagene ed elastina del derma, creando le lesioni caratteristiche osservate clinicamente.
Epidemiologia e Particolarità Eziologiche in Medicina Veterinaria Canina
Distribuzione Eziologica e Dati Quantitativi
L’analisi epidemiologica rivela una ripartizione eziologica particolarmente caratteristica in medicina veterinaria canina. Uno studio retrospettivo di ampia portata ha permesso di stabilire con precisione la distribuzione delle cause sottostanti, rivelando pattern distinti da quelli osservati in medicina umana.
L’ipercorticismo domina massicciamente il panorama eziologico, rappresentando approssimativamente l’80% dell’insieme dei casi osservati. Questa predominanza si spiega per la frequenza delle corticoterapie sistemiche in medicina veterinaria e per l’incidenza non trascurabile delle sindromi di Cushing spontanee nella specie canina. All’interno di questa categoria maggioritaria, l’ipercorticismo iatrogeno, conseguenza diretta di trattamenti corticoidi prolungati, costituisce circa il 70% dei casi, mentre gli ipercorticismi endogeni (ipofisari e surrenalici) rappresentano il 30% rimanente.
Questa predominanza dell’ipercorticismo iatrogeno si spiega per l’uso frequente dei corticosteroidi in medicina veterinaria per il trattamento di diverse affezioni infiammatorie, allergiche e autoimmuni. La facilità di accesso a queste molecole e la loro efficacia terapeutica immediata favoriscono talvolta la loro prescrizione prolungata, creando le condizioni propizie allo sviluppo di calcinosi cutanee.
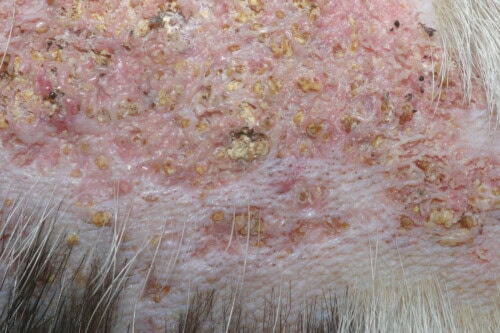
Calcinosi cutanea: Vista ravvicinata
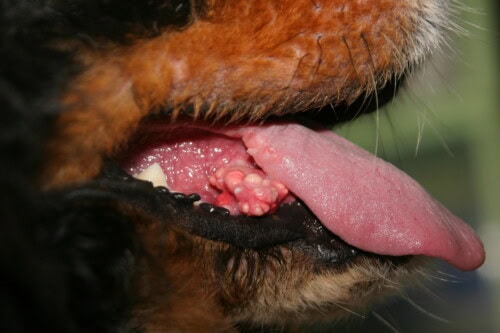
Calcinosi cutanea: Lesioni sottolinguali
Cause Minoritarie e Situazioni Particolari
L’insufficienza renale cronica occupa la seconda posizione eziologica con approssimativamente il 10% dei casi documentati. Questa proporzione relativamente modesta si spiega per la predilezione dei depositi calcici metastatici per i tessuti molli viscerali piuttosto che per le strutture cutanee in questa patologia. Tuttavia, le forme cutanee, quando sopravvengono, si associano generalmente a stadi avanzati della malattia renale e costituiscono un indicatore prognostico sfavorevole.
L’ultimo decile raggruppa un insieme eterogeneo di eziologie rare ma clinicamente significative. La calcinosi distrofica post-traumatica può sopravvenire consecutivamente a traumi ripetuti o a lesioni meccaniche croniche, particolarmente nelle zone sottoposte a frizioni ricorrenti o a pressioni meccaniche sostenute.
Le forme post-infiammatorie si osservano talvolta nel contesto di infezioni sistemiche severe, particolarmente le micosi profonde come la blastomicosi o l’istoplasmosi, e certe leptospirosi. Queste infezioni creano uno stato infiammatorio sistemico propizio allo sviluppo di lesioni di calcificazione distrofica.
La calcinosi idiopatica, benché rara, merita un’attenzione particolare poiché solleva questioni fondamentali sulla nostra comprensione dei meccanismi fisiopatologici. L’assenza di causa sottostante identificata suggerisce l’esistenza di fattori predisponenti genetici o ambientali ancora sconosciuti.
Le calcinosi iatrogene non corticoidi, legate alle perfusioni di soluzioni calciche o alle supplementazioni vitaminiche eccessive, completano questo quadro eziologico. Queste forme evitabili sottolineano l’importanza di una sorveglianza attenta durante la somministrazione di trattamenti potenzialmente calcificanti.
Considerazioni Razziali e Predisposizioni
Benché nessuna esclusività razziale sia stabilita in maniera formale, certe osservazioni cliniche suggeriscono una predisposizione delle razze di grande taglia. Questa tendenza potrebbe spiegarsi per una suscettibilità accresciuta alle patologie endocrine, particolarmente l’iperadrenocorticismo, o per differenze nelle pratiche terapeutiche secondo la taglia degli animali.
Il Bulldog inglese è oggetto di un’attenzione particolare nella letteratura veterinaria, certi dati suggerendo una predisposizione specifica in questa razza. Questa suscettibilità potrebbe essere legata alle particolarità anatomiche della razza, particolarmente le numerose pieghe cutanee che creano microtraumi ripetuti, o a fattori genetici specifici ancora non chiariti.
Le razze brachicefale nel loro insieme potrebbero presentare una predisposizione relativa, possibilmente in relazione con la loro propensione ai disturbi respiratori cronici necessitanti trattamenti antinfiammatori prolungati. Questa ipotesi necessita tuttavia di studi epidemiologici più approfonditi per essere confermata.
Semiologia Clinica e Approccio Diagnostico Contemporaneo
Polimorfismo delle Manifestazioni Cliniche
La presentazione clinica delle calcinosi cutanee canine si caratterizza per un polimorfismo notevole, riflettendo la diversità dei meccanismi fisiopatologici sottostanti e l’eterogeneità delle risposte tissutali individuali. Questa variabilità semiologica costituisce talvolta una sfida diagnostica considerevole, necessitando di un approccio clinico metodico ed esperto.
La localizzazione anatomica privilegia classicamente la regione dorsale, costituendo il sito di interessamento più frequentemente osservato. Tuttavia, l’interessamento può estendersi alle zone ventrali glabre, particolarmente l’addome e la regione inguinale, alle pieghe cutanee dove i fenomeni di macerazione favoriscono l’infiammazione locale, alla regione cervicale e alle ascelle. Questa distribuzione topografica non casuale suggerisce l’intervento di fattori meccanici locali, particolarmente le frizioni e le pressioni ripetute, o di particolarità vascolari regionali nello sviluppo e nella progressione delle lesioni.
Le zone di predilezione corrispondono spesso alle regioni sottoposte a costrizioni meccaniche particolari o presentanti caratteristiche anatomiche specifiche. Le pieghe cutanee, per esempio, creano un microambiente umido e caldo propizio all’infiammazione cronica, mentre le zone di contatto con il suolo o le superfici di giaciglio subiscono traumi ripetuti di bassa intensità.
Caratteristiche Morfologiche delle Lesioni
L’aspetto lesionale presenta due fenotipi principali distinti, ciascuno corrispondente probabilmente a stadi evolutivi differenti o a meccanismi fisiopatologici specifici. Il primo fenotipo si manifesta per placche ferme a francamente dure, esibendo una colorazione giallastra caratteristica e circoscritte da un bordo eritematoso marcato testimoniante l’intensa reazione infiammatoria perilesionale. Questa presentazione corrisponde generalmente agli stadi acuti o subacuti del processo patologico.
Il secondo fenotipo corrisponde a placche alopeciche estese, notevolmente indurite, presentanti una tinta rosea intensa evocatrice di un’infiammazione cronica sottostante. Queste lesioni testimoniano generalmente un’evoluzione più prolungata e una cronicizzazione del processo infiammatorio locale.
La palpazione rivela una consistenza caratteristica, oscillante tra la fermezza marcata e la durezza francamente pietrosa secondo il grado di mineralizzazione. Questa indurazione costituisce un elemento semiologico patognomonico, permettendo di differenziare le calcinosi dalle altre dermatosi infiammatorie croniche.
La superficie lesionale può presentare diverse alterazioni: ipercheratosi localizzata, formazione di croste superficiali, essudazione di composizione variabile, e nei casi più evoluti, ulcerazione franca con esposizione del derma sottostante. La presenza di un essudato purulento testimonia generalmente una sovrinfezione batterica secondaria.
Segni Patognomonici e Evoluzione Lesionale
L’evoluzione lesionale segue generalmente un pattern prevedibile, benché la cronologia possa variare considerevolmente da un individuo all’altro. Le fasi iniziali si accompagnano frequentemente a croste superficiali e a un essudato di composizione variabile, andando da un semplice stillicidio sieroso a uno scolo purulento in caso di sovrinfezione.
Un segno patognomonico particolarmente evocatore risiede nell’estrusione spontanea di materiale gessoso biancastro attraverso l’epidermide. Questo fenomeno corrisponde all’eliminazione transcutanea dei cristalli calcici e costituisce un elemento diagnostico di prima importanza. L’osservazione di questo materiale cristallino, facilmente riconoscibile per la sua tessitura e la sua colorazione caratteristiche, permette spesso di stabilire la diagnosi con quasi-certezza.
L’ulcerazione rappresenta una complicazione comune, particolarmente nelle forme severe o trascurate. Queste ulcere presentano caratteristiche specifiche: bordi sopraelevati e induriti, fondo anfrattuoso tappezzato di tessuto di granulazione, tendenza alla cronicizzazione e resistenza ai trattamenti cicatrizzanti convenzionali.
Durante la fase di risoluzione, osservata principalmente dopo correzione della causa sottostante, le lesioni subiscono una trasformazione progressiva del loro aspetto. La componente infiammatoria si attenua gradualmente, traducendosi in una diminuzione dell’eritema perilesionale e della sensibilità locale. La colorazione evolve verso tonalità grigie più spente, testimoniando la normalizzazione progressiva dei processi tissutali locali. Tuttavia, l’indurazione può persistere per mesi, persino definitivamente in certi casi.
Complicazioni Infettive e Evoluzione
Le sovrinfezioni batteriche secondarie costituiscono una complicazione quasi-costante, favorite dall’alterazione della barriera epidermica e dall’ambiente infiammatorio locale che compromette i meccanismi di difesa naturali. Queste sovrinfezioni possono mascherare le lesioni sottostanti e complicare significativamente la valutazione diagnostica.
La flora batterica implicata comprende classicamente gli stafilococchi e gli streptococchi, ma germi opportunisti più resistenti possono colonizzare le lesioni croniche. L’identificazione precisa di questi agenti patogeni per coltura batterica e antibiogramma si rivela spesso necessaria per adattare l’antibioterapia locale o sistemica.
La presenza di materiale calcico nei tessuti crea un ambiente particolarmente propizio allo sviluppo di biofilm batterici, strutture tridimensionali complesse che proteggono i microrganismi dall’azione degli antimicrobici e dai meccanismi di difesa dell’ospite. Questa particolarità spiega la resistenza frequente ai trattamenti antibiotici convenzionali e la tendenza alla recidiva delle sovrinfezioni.
Strategia Diagnostica Differenziale
L’instaurazione della diagnosi di calcinosi si basa principalmente sul riconoscimento dei pattern clinici caratteristici e sull’analisi del contesto anamnestico. La piodermite profonda cronica o recidivante costituisce la principale trappola diagnostica, tanto più che le due affezioni possono coesistere e potenziarsi mutuamente.
Diversi elementi permettono di orientare la diagnosi differenziale: la consistenza particolarmente dura delle lesioni di calcinosi contrasta con la consistenza più molle delle piodermiti, l’estrusione di materiale gessoso costituisce un segno patognomonico di calcinosi, e il contesto anamnestico (corticoterapia, sindrome di Cushing) orienta fortemente verso una calcinosi.
Altre affezioni possono occasionalmente prestare a confusione: i granulomi a corpo estraneo, i tumori cutanei calcificati, le cisti sebacee infette, o le panniculiti croniche. La presa in considerazione dell’insieme degli elementi clinici e anamnestici permette generalmente di dissipare queste ambiguità diagnostiche.
La citologia cutanea si rivela particolarmente preziosa per caratterizzare le sovrinfezioni batteriche concomitanti e orientare le scelte antimicrobiche locali. Benché non permettendo la conferma formale della diagnosi di calcinosi, questo esame contribuisce alla valutazione globale dello stato lesionale e guida le decisioni terapeutiche complementari. L’osservazione di cristalli calcici durante l’esame citologico può rafforzare il sospetto diagnostico.
In certi casi complessi o atipici, l’istopatologia cutanea può rivelarsi necessaria per confermare la diagnosi e caratterizzare precisamente il tipo di calcinosi. Questo esame permette di oggettivare la presenza di depositi calcici nelle strutture dermiche e di valutare l’intensità della reazione infiammatoria associata.
Strategie Terapeutiche Attuali e Limitazioni
Principio Fondamentale: Correzione della Causa Primaria
La presa in carico terapeutica delle calcinosi cutanee si basa su un principio cardinale: l’identificazione e la correzione della causa sottostante costituiscono la tappa fondamentale, condizionando l’insieme della prognosi. Questo approccio eziologico prevale su ogni considerazione sintomatica e determina le possibilità di regressione lesionale a medio e lungo termine.
Nel contesto maggioritario dell’ipercorticismo iatrogeno, questo approccio implica l’arresto progressivo e attentamente controllato della corticoterapia. Questa decrescita deve essere adattata alla durata del trattamento anteriore, alle dosi utilizzate e alla patologia inizialmente trattata. Un distacco troppo brutale espone al rischio di insufficienza surrenalica iatrogena, particolarmente temibile dopo trattamenti prolungati a dosi elevate.
Il protocollo di decrescita deve tenere conto dell’emivita biologica dei corticosteroidi utilizzati e della durata di soppressione dell’asse ipotalamo-ipofiso-surrenalico. Generalmente, una riduzione del 25-50% della dose ogni due settimane costituisce un compromesso accettabile tra efficacia e sicurezza. In certi casi, una sostituzione con antinfiammatori alternativi (immunosoppressori, bioterapie) può facilitare il distacco corticoide.
La regressione delle lesioni cutanee si osserva effettivamente dopo correzione della causa primaria, ma la sua ampiezza rimane imprevedibile, oscillando tra una risoluzione completa e un miglioramento soltanto parziale. I fattori che influenzano questa variabilità includono la durata di evoluzione delle lesioni prima del trattamento, l’intensità dell’esposizione ai corticosteroidi, e la capacità di rigenerazione tissutale individuale.
Cure Locali e Gestione delle Complicazioni
L’antisepsi locale costituisce un pilastro terapeutico incontornabile nella presa in carico delle calcinosi cutanee. L’applicazione rigorosa di antisettici topici, particolarmente la clorexidina a concentrazione adattata (0,5-2% secondo la tolleranza locale), si rivela fondamentale per controllare le sovrinfezioni batteriche secondarie e mantenere un ambiente locale propizio alla cicatrizzazione.
Questo approccio preventivo permette di limitare le complicazioni infettive che possono mascherare l’evoluzione naturale delle lesioni e compromettere la valutazione dell’efficacia terapeutica. La clorexidina presenta il vantaggio di un’eccellente tolleranza locale e di uno spettro antimicrobico ampio, includendo i batteri gram-positivi e gram-negativi abitualmente implicati nelle sovrinfezioni cutanee.
Altri antisettici possono essere utilizzati in alternativa o in rotazione: la povidone iodata, particolarmente efficace ma potenzialmente irritante, i derivati clorati a bassa concentrazione, o gli antisettici a base di argento per le lesioni ulcerate resistenti. L’alternanza degli antisettici può prevenire lo sviluppo di resistenze batteriche.
L’antibioterapia sistemica rimane raramente indicata nella presa in carico di routine, salvo in caso di setticemia accertata, di sovrinfezione estensiva con segni sistemici, o di fallimento dei trattamenti antisettici locali. Quando si rivela necessaria, la scelta dell’antibiotico deve essere guidata da una coltura batterica e un antibiogramma, tenuto conto della frequenza delle resistenze in questo contesto.
L’utilizzo di agenti cheratomodulatori ed emollienti può facilitare l’ammorbidimento delle zone ipercheratosiche e crostose, migliorando così il comfort dell’animale e favorendo l’eliminazione dei detriti superficiali. Questi topici, includendo l’urea, l’acido salicilico a bassa concentrazione, o le ceramidi, contribuiscono ugualmente al ripristino progressivo della flessibilità cutanea nelle zone periferiche alle lesioni.
Le medicazioni occlusive possono essere benefiche per mantenere l’idratazione locale e proteggere le lesioni ulcerate dai traumi meccanici. Tuttavia, il loro utilizzo necessita di una sorveglianza attenta per prevenire la macerazione eccessiva che favorirebbe le sovrinfezioni.
Approcci Chirurgici Selettivi
L’exeresi chirurgica conserva la sua pertinenza per lesioni uniche, molto localizzate e fonte di discomfort maggiore per l’animale. Questa opzione terapeutica deve essere attentamente valutata in funzione di diversi criteri: la taglia e la localizzazione delle lesioni, lo stato generale dell’animale, la fattibilità tecnica dell’exeresi, e le prospettive di cicatrizzazione.
I vantaggi dell’approccio chirurgico includono la risoluzione immediata delle lesioni problematiche, la possibilità di analisi istopatologica di conferma, e il miglioramento rapido del comfort dell’animale. Tuttavia, gli svantaggi comprendono i rischi anestetici, particolarmente negli animali presentanti ipercorticismo con le sue complicazioni cardiovascolari e metaboliche, e il rischio di disturbi di cicatrizzazione legati all’ipercorticismo.
Il laser CO2 può costituire un’alternativa interessante per certe situazioni particolari. Questa tecnica presenta il vantaggio di una migliore emostasi, di una precisione di taglio superiore, e potenzialmente di una cicatrizzazione migliorata. Tuttavia, la sua accessibilità rimane limitata e il suo utilizzo necessita di un’expertise tecnica specifica.
Le tecniche di chirurgia ricostruttiva possono rivelarsi necessarie per le lesioni estese, particolarmente nelle zone dove la chiusura primaria si rivela impossibile. I lembi cutanei locali o gli innesti possono essere previsti, benché l’ipercorticismo comprometta spesso l’attecchimento degli innesti.
Il Dimetilsulfossido: Efficacia Controversa e Limiti
Il DMSO, solvente organico dalle proprietà antinfiammatorie riconosciute, particolarmente per cattura dei radicali liberi e inibizione di certe vie infiammatorie, beneficia di un utilizzo storico nel trattamento delle calcinosi. La sua capacità di penetrazione tissutale notevole, legata alla sua struttura molecolare particolare, ne fa teoricamente un candidato interessante per questa indicazione topica.
Le proprietà fisicochimiche del DMSO spiegano il suo interesse potenziale: peso molecolare basso facilitante la diffusione transcutanea, capacità di solubilizzazione di numerose sostanze, proprietà antinfiammatorie per inibizione della polimerizzazione dei radicali liberi, ed effetto antalgico locale per blocco delle fibre nervose di piccolo calibro.
Tuttavia, la sua efficacia reale resta da dimostrare con studi controllati rigorosi. La difficoltà di valutazione proviene dal fatto che le calcinosi possono regredire spontaneamente una volta corretta la causa primaria, rendendo complessa l’attribuzione dei miglioramenti osservati al trattamento con DMSO. Il meccanismo di azione esatto in questo contesto rimane enigmatico: dissoluzione diretta dei cristalli calcici, effetto antinfiammatorio non specifico, miglioramento della microcircolazione locale, o semplice effetto placebo.
L’assenza di protocollo standardizzato costituisce una limitazione maggiore che compromette la valutazione obiettiva di questa terapeutica. La letteratura riporta schemi terapeutici estremamente variabili, da tre a quattro applicazioni quotidiane per due settimane massimo fino a un’applicazione bisettimanale su diverse settimane secondo certi rapporti di casi. Le raccomandazioni di Muller & Kirk preconizzano due applicazioni quotidiane senza precisione di durata, mentre altre fonti suggeriscono un’applicazione ogni due giorni su diverse settimane.
Questa eterogeneità protocollare riflette l’assenza di dati probanti solidi e la natura empirica di questo utilizzo. L’instaurazione di un protocollo standardizzato necessiterebbe studi clinici controllati randomizzati comparanti diversi schemi terapeutici a un placebo.
Gli effetti secondari potenziali impongono una vigilanza particolare e limitano l’uso di questa molecola. Per l’applicatore, il porto di guanti in gomma spessi si rivela indispensabile per evitare l’assorbimento percutaneo che può provocare effetti sistemici indesiderabili. L’inalazione dei vapori deve ugualmente essere evitata, necessitando una ventilazione adeguata dei locali di applicazione.
Nell’animale trattato, reazioni locali diverse sono state riportate: sensazione di bruciore immediata dopo applicazione, eritema ed edema transitori, secchezza cutanea e desquamazione, e in certi casi, aggravamento paradossale dell’infiammazione locale. Gli effetti oculari in caso di utilizzo prolungato o ad alta dose includono modificazioni del cristallino e disturbi dell’accomodazione. Un malessere generale non specifico può ugualmente sopravvenire, particolarmente durante applicazioni su superfici estese.
I dati riguardanti un’eventuale nefrotossicità o epatotossicità rimangono contraddittori e insufficientemente supportati. Certi rapporti suggeriscono alterazioni dei parametri epatici durante utilizzi prolungati, mentre altri studi non ritrovano alcuna tossicità sistemica significativa. Questa incertezza impone una sorveglianza clinica e biologica negli animali trattati in maniera prolungata.
In caso di utilizzo su ampie superfici cutanee, un approccio prudente consistente nel trattare piccole zone in maniera sequenziale è fortemente raccomandato per minimizzare i rischi di assorbimento sistemico e di effetti indesiderabili. Questa strategia permette ugualmente di valutare la tolleranza locale prima di estendere il trattamento.
Diversità degli Approcci Farmacologici Umani
La medicina umana ha sviluppato un arsenale terapeutico sostanziale per la presa in carico delle calcinosi, mirando a diversi meccanismi fisiopatologici. Questi approcci multipli offrono prospettive interessanti per una trasposizione in medicina veterinaria, benché nessuna valutazione sistematica sia ancora stata intrapresa nella specie canina. L’assenza di trattamento standard universalmente efficace in medicina umana sottolinea la complessità di questa patologia e la necessità di approcci individualizzati.
Le strategie terapeutiche umane mirano a diversi meccanismi: inibizione della formazione dei cristalli calcici, miglioramento della loro solubilizzazione nei tessuti, diminuzione dell’infiammazione locale e sistemica, o modulazione delle vie metaboliche del calcio e del fosfato. Questo approccio multimodale permette di adattare il trattamento ai meccanismi fisiopatologici predominanti in ogni caso particolare.
Il diltiazem, antagonista calcico
Esso inibisce l’entrata del calcio intracellulare per blocco dei canali calcici voltaggio-dipendenti di tipo L. Questa azione potrebbe teoricamente limitare i processi di calcificazione tissutale riducendo la disponibilità del calcio intracellulare per la formazione di cristalli. La posologia umana di 2-4 mg/kg/giorno presenta una tossicità limitata, principalmente cardiovascolare (ipotensione, bradicardia), ma l’innocuità in uso prolungato nel cane rimane non documentata.
L’utilizzo del diltiazem in medicina veterinaria cardiologica, particolarmente per il trattamento della cardiomiopatia ipertrofica felina, suggerisce una tolleranza accettabile. Tuttavia, l’adattamento posologico e la sorveglianza degli effetti secondari necessiterebbero studi specifici per l’indicazione calcinosi.
Bisfosfonati: Modulatori dell’Attività Macrofagica
I bisfosfonati (alendronato, pamidronato, etidronato) esercitano la loro azione per inibizione dell’attività macrofagica e del riassorbimento calcico osseo. Queste molecole, analoghi strutturali del pirofosfato, si fissano preferenzialmente sull’idrossiapatite e interferiscono con i processi di mineralizzazione e demineralizzazione.
La loro efficacia è stata documentata in diverse connettiviti umane, particolarmente la sclerodermia e la dermatomiosite, dove riducono significativamente la taglia e il numero dei depositi calcici. Il meccanismo di azione implica probabilmente un’inibizione dell’attività dei macrofagi tissutali che partecipano attivamente ai processi di calcificazione distrofica.
Gli effetti secondari potenziali includono l’ipocalcemia, talvolta severa e necessitante una supplementazione, la febbre post-somministrazione (particolarmente con le forme endovenose), e l’osteonecrosi mandibolare, complicazione rara ma grave osservata principalmente con i bisfosfonati di terza generazione.
In medicina veterinaria canina, il loro uso rimane attualmente limitato ma certe molecole come il pamidronato sono utilizzate per la gestione dei dolori ossei metastatici o delle osteolisi tumorali. Questa esperienza clinica limitata suggerisce una tolleranza accettabile, ma necessiterebbe un adattamento per l’indicazione calcinosi cutanea.
Agenti Chelanti e Modulatori di Solubilità
Il tiosolfato di sodio presenta la proprietà di aumentare la solubilità calcica per formazione di complessi solubili con gli ioni calcio. Questa molecola può essere utilizzata per via topica, intralesionale o endovenosa secondo le indicazioni e la tolleranza. Il suo meccanismo di azione implica una chelazione diretta del calcio tissutale e un miglioramento della sua mobilizzazione verso la circolazione sistemica.
La sua tossicità sistemica notevole comprende nausee e vomiti, ipocalcemia potenzialmente severa, e diversi disturbi elettrolitici includendo ipomagnesemia e ipokaliemia. Questi effetti indesiderabili impongono una sorveglianza biologica stretta durante utilizzi sistemici.
Benché nessun utilizzo attuale sia riportato nel cane, ricerche potrebbero essere previste per un uso locale sotto forma di gel o di soluzione topica. Questo approccio minimizzerebbe i rischi di effetti sistemici conservando l’effetto locale ricercato.
L’idrossido di alluminio agisce come legante del fosfato a livello intestinale e riduce l’assorbimento digestivo di quest’ultimo. Questa azione indiretta sul metabolismo fosfocalcico potrebbe presentare un interesse nelle forme metastatiche di calcinosi. Le dosi umane di 1,8-2,4 g/giorno suggeriscono un utilizzo potenziale nell’animale, ma questa applicazione rimane non validata nel contesto della calcinosi.
L’utilizzo di questa molecola in medicina veterinaria per la gestione dell’iperfosfatemia negli insufficienti renali cronici suggerisce una tolleranza accettabile. Tuttavia, l’adattamento posologico e la valutazione dell’efficacia specifica necessiterebbero studi dedicati.
Antibiotici dalle Proprietà Anti-calcificanti
La minociclina presenta proprietà multiple particolarmente interessanti: inibizione delle metalloproteinasi matriciali (MMP) che partecipano ai processi di rimodellamento tissutale, chelazione calcica diretta per i suoi gruppi funzionali, e riduzione dell’infiammazione per inibizione dell’attivazione microgliale e della produzione di citochine pro-infiammatorie.
La posologia umana di 50-100 mg/giorno apre prospettive di utilizzo nel cane, tanto più che questa molecola esiste già in certe indicazioni dermatologiche veterinarie, particolarmente per il trattamento delle piodermiti a germi resistenti. Questa esperienza clinica preesistente faciliterebbe l’adattamento posologico e la sorveglianza degli effetti secondari.
Le metalloproteinasi matriciali giocano un ruolo cruciale nei processi di calcificazione distrofica degradando la matrice extracellulare e liberando fattori favorenti la mineralizzazione. La loro inibizione per mezzo della minociclina potrebbe dunque presentare un interesse terapeutico diretto.
La ceftriaxone offre un effetto secondario potenzialmente benefico per inibizione delle metalloproteinasi matriciali, chelazione del calcio per i suoi gruppi β-lattamici, e azione antinfiammatoria non specifica. Tuttavia, le regole di prescrizione responsabile degli antibiotici, particolarmente severe per le cefalosporine di terza generazione, vietano formalmente di prevedere il loro utilizzo in medicina veterinaria per questa indicazione non infettiva.
Questa restrizione regolamentare sottolinea l’importanza di sviluppare alternative non antibiotiche per evitare il contributo all’antibiotico-resistenza pur esplorando vie terapeutiche innovative.
Modulatori del Metabolismo Fosfocalcico
Il probenecid aumenta l’escrezione renale del fosfato per inibizione del suo riassorbimento tubulare. Il suo effetto benefico è stato documentato nella dermatomiosite giovanile, dove riduce significativamente i depositi calcici cutanei. Questa molecola non è attualmente utilizzata in medicina veterinaria, ma il suo meccanismo di azione potrebbe presentare un interesse per le forme metastatiche di calcinosi.
L’adattamento di questo approccio in medicina veterinaria necessiterebbe studi farmacocinetici preliminari per determinare le posologie appropriate e valutare la tolleranza nella specie canina. Gli effetti secondari umani includono principalmente disturbi digestivi e reazioni di ipersensibilità.
La colchicina
Essa presenta proprietà antinfiammatorie specifiche per inibizione della polimerizzazione dei microtubuli e modulazione dell’attivazione dei neutrofili. Il suo utilizzo in medicina veterinaria rimane poco sviluppato, ma alcune applicazioni esistono, particolarmente per il trattamento della febbre familiare dello Shar-Pei.
Un rapporto di caso particolarmente incoraggiante ha documentato un netto miglioramento di lesioni di calcinosi in un cane trattato con colchicina alla dose utilizzata per la febbre familiare dello Shar-Pei (ovvero circa 0,01-0,03 mg/kg/giorno). Benché questo dato rimanga molto preliminare e costituisca soltanto un’osservazione isolata, esso illustra l’interesse potenziale di agenti antinfiammatori mirati e sottolinea la necessità di condurre studi clinici per valutare rigorosamente queste nuove opzioni.
Il meccanismo di azione della colchicina in questo contesto potrebbe implicare un’inibizione dell’attivazione degli inflammasomi, complessi multiproteici responsabili della maturazione dell’IL-1β e dell’IL-18, citochine chiave nei processi di calcificazione distrofica.
Questa osservazione preliminare con la colchicina apre prospettive particolarmente interessanti poiché dimostra la fattibilità di un approccio farmacologico specifico in medicina veterinaria. La tolleranza apparentemente soddisfacente e il miglioramento clinico osservato giustificano la messa in opera di studi clinici più rigorosi.
Il vantaggio della colchicina risiede nel suo profilo di sicurezza ben stabilito nel cane, grazie al suo utilizzo nella febbre familiare dello Shar-Pei, e nel suo meccanismo di azione specifico sulle vie infiammatorie implicate nella calcificazione distrofica.
Raccomandazioni Pratiche e Algoritmo Decisionale
Approccio Diagnostico Strutturato
Il riconoscimento precoce delle calcinosi si basa su un trittico diagnostico: identificazione dei pattern clinici caratteristici, analisi del contesto anamnestico ed esclusione delle diagnosi differenziali principali. Questo approccio sistematico permette di evitare i ritardi diagnostici che compromettono l’efficacia terapeutica e di ottimizzare la presa in carico precoce.
L’interrogatorio anamnestico deve essere particolarmente minuzioso, ricercando sistematicamente gli antecedenti di corticoterapia (molecola, posologia, durata, via di somministrazione), i segni di ipercorticismo spontaneo (poliuro-polidipsia, polifagia, alopecie bilaterali simmetriche, amiotrofia, distensione addominale), e le patologie suscettibili di provocare disturbi del metabolismo fosfocalcico (insufficienza renale cronica, tumori maligni, iperparatiroidismo).
L’esame clinico deve essere sistematico e completo, non limitandosi alle lesioni cutanee ma ricercando ugualmente i segni sistemici associati. La palpazione attenta dell’insieme del tegumento permette di identificare lesioni iniziali o asintomatiche che orientano verso un interessamento più diffuso.
La valutazione della causa sottostante deve essere esaustiva e orientata dai dati epidemiologici. La ricerca di un ipercorticismo, che sia iatrogeno o spontaneo, costituisce la priorità assoluta tenuto conto della sua frequenza dominante. Questa valutazione include la misura del cortisolo basale, i test di frenazione alla desametasone, ed eventualmente il dosaggio dell’ACTH endogeno per differenziare le forme ipofisarie e surrenali.
L’esplorazione dell’insufficienza renale cronica si impone in seconda intenzione, particolarmente negli animali anziani o presentanti antecedenti di nefropatia. Questa valutazione comprende la misura della creatinina e dell’urea sieriche, l’analisi di urina completa, e la valutazione del metabolismo fosfocalcico (calcemia, fosfatemia, paratormone se disponibile).
Strategia Terapeutica Gerarchizzata
La correzione della causa primaria rimane la tappa fondamentale incontornabile, condizionando l’insieme della prognosi a medio e lungo termine. Questo approccio eziologico deve essere privilegiato su ogni considerazione sintomatica, poiché determina direttamente le possibilità di regressione lesionale spontanea.
Nel caso maggioritario dell’ipercorticismo iatrogeno, l’arresto progressivo della corticoterapia deve essere pianificato in maniera individualizzata secondo la durata del trattamento anteriore, le dosi utilizzate, e la patologia inizialmente trattata. Un protocollo di decrescita progressiva su 4-8 settimane minimizza i rischi di insufficienza surrenalica iatrogena permettendo una recuperazione dell’asse ipotalamo-ipofiso-surrenale.
Per gli ipercorticismi spontanei, il trattamento specifico (trilostane, mitotane) o chirurgico (surrenalectomia, ipofisectomia) deve essere intrapreso secondo le raccomandazioni stabilite per queste patologie. La gestione delle calcinosi diventa allora secondaria e segue generalmente il miglioramento dell’ipercorticismo.
Le cure locali antisettiche costituiscono un complemento indispensabile per prevenire le complicazioni infettive e mantenere l’integrità dei tessuti circostanti. Questo approccio preventivo permette di preservare le condizioni ottimali per la cicatrizzazione spontanea e di evitare i fattori aggravanti.
Il protocollo antisettico raccomandato comprende una pulizia biquotidiana delle lesioni con una soluzione di clorexidina allo 0,5-2% secondo la tolleranza locale, seguita da un’asciugatura accurata e l’applicazione eventuale di un agente emolliente. Questa routine deve essere mantenuta fino a risoluzione completa delle lesioni.
L’utilizzo di trattamenti specifici come il DMSO deve essere riservato ai casi severi o resistenti, rispettando scrupolosamente le precauzioni d’impiego e informando i proprietari delle incertezze riguardo l’efficacia reale. Un approccio sequenziale, trattando piccole zone successivamente, minimizza i rischi di effetti sistemici permettendo una valutazione della tolleranza locale.
Criteri di Sorveglianza e Indicatori Prognostici
La valutazione dell’evoluzione lesionale necessita criteri obiettivi standardizzati per permettere un apprezzamento riproducibile dell’efficacia terapeutica. La fotografia medica seriale costituisce uno strumento prezioso per documentare le modificazioni morfologiche e apprezzare quantitativamente l’evoluzione della superficie lesionale.
I parametri da sorvegliare includono la taglia delle lesioni (misura bidimensionale), il loro aspetto (colorazione, rilievo, indurazione), la presenza di complicazioni (ulcerazione, estrusione di materiale calcico, sovrinfezione), e lo stato generale dell’animale (prurito, dolore, impedimento funzionale).
Un score lesionale composito integrante questi diversi parametri faciliterebbe la valutazione standardizzata e la comparazione inter-individuale. Questo score potrebbe includere una quotazione da 0 a 3 per ogni parametro (taglia, indurazione, infiammazione, ulcerazione) con un score globale massimale orientante verso la severità.
La sorveglianza delle complicazioni potenziali, particolarmente infettive, impone esami clinici regolari a intervalli adattati alla severità iniziale. Un ritmo settimanale per le forme severe, bimensile per le forme moderate, e mensile per le forme minori costituisce un compromesso ragionevole tra sorveglianza ottimale e costrizioni pratiche.
La citologia cutanea ripetuta permette di rilevare precocemente le sovrinfezioni batteriche e di aggiustare i protocolli antisettici. Questa sorveglianza microbiologica si rivela particolarmente importante per le lesioni ulcerate o essudative che presentano un rischio infettivo maggiorato.
Gestione dei Fallimenti Terapeutici
L’assenza di miglioramento dopo 6-8 settimane di trattamento eziologico ben condotto deve far riconsiderare la diagnosi o ricercare fattori aggravanti misconosciuti. Questa situazione impone una rivalutazione completa includendo la verifica della correzione effettiva della causa primaria e la ricerca di comorbidità.
Le cause di fallimento terapeutico includono la persistenza di un ipercorticismo residuo (decrescita insufficiente, ipercorticismo spontaneo misconosciuto), la presenza di complicazioni infettive non controllate, o l’esistenza di fattori intrinseci di resistenza (cronicità eccessiva, disturbi della cicatrizzazione).
In queste situazioni di impasse terapeutico, l’utilizzo di trattamenti adiuvanti ispirati dalla medicina umana può essere previsto in assenza di alternativa. Questo approccio compassionevole necessita un’informazione illuminata dei proprietari sul carattere sperimentale di questi trattamenti e la necessità di una sorveglianza rafforzata.
Prevenzione e Educazione
La prevenzione primaria delle calcinosi iatrogene si basa sull’utilizzo ragionato dei corticosteroidi: prescrizione alla dose minima efficace, limitazione della durata di trattamento, ricerca di alternative terapeutiche ogni volta che possibile, e sorveglianza clinica regolare dei pazienti sotto corticoterapia prolungata.
L’educazione dei proprietari gioca un ruolo cruciale nella rilevazione precoce delle lesioni e nell’osservanza terapeutica. I consigli includono la sorveglianza quotidiana dello stato cutaneo, il riconoscimento dei segni di allarme necessitanti una consultazione urgente, e l’importanza della compliance al protocollo terapeutico prescritto.
La formazione continua dei praticanti sui progressi diagnostici e terapeutici più recenti permetterebbe di migliorare la qualità della presa in carico e di ridurre i ritardi diagnostici. Questa formazione dovrebbe includere il riconoscimento delle forme atipiche e la conoscenza delle nuove opzioni terapeutiche.
Conclusione e Prospettive d’Avvenire
La calcinosi cutanea canina rappresenta un modello esemplare di patologia dermatologica necessitante un approccio multidisciplinare integrante dermatologia, endocrinologia e medicina interna. La comprensione approfondita dei meccanismi fisiopatologici sottostanti e l’identificazione precisa delle cause eziologiche costituiscono i fondamenti di una presa in carico ottimale che condiziona direttamente la prognosi funzionale ed estetica.
La predominanza schiacciante dell’ipercorticismo nell’eziologia delle calcinosi canine, contrastando con la diversità delle cause osservate in medicina umana, sottolinea le particolarità epidemiologiche di questa affezione nella specie canina. Questa specificità eziologica semplifica relativamente l’approccio diagnostico ma non deve far trascurare le forme minoritarie che necessitano strategie terapeutiche adattate.
Le limitazioni attuali dell’arsenale terapeutico veterinario contrastano in maniera stridente con la ricchezza delle opzioni sviluppate in medicina umana. Questa disparità sottolinea l’urgenza di sviluppare programmi di ricerca traslazionale per valutare l’efficacia e l’innocuità degli approcci farmacologici promettenti nella specie canina. L’esperienza umana offre un serbatoio considerevole di innovazioni terapeutiche che meriterebbero un adattamento e una validazione in medicina veterinaria.
L’assenza di studi clinici controllati rimane la principale limitazione al progresso terapeutico in questo dominio. Questa lacuna metodologica perpetua l’utilizzo di trattamenti empirici e limita la capacità di stabilire raccomandazioni basate sulle prove. La messa in opera di trial clinici randomizzati multicentrici costituisce un imperativo per far progredire le conoscenze e migliorare la qualità delle cure.
La ricerca fondamentale sui meccanismi molecolari della calcificazione cutanea canina potrebbe rivelare particolarità specifiche alla specie e identificare nuovi bersagli terapeutici. Questo approccio meccanicistico è indispensabile per sviluppare trattamenti razionali ed efficaci.