La dermatologia veterinaria ha conosciuto una trasformazione radicale nel corso delle ultime due decenni, caratterizzata dall’emergenza e dalla propagazione mondiale degli stafilococchi resistenti alla meticillina (SRM). Un tempo considerate come infezioni batteriche semplici e che rispondevano in modo prevedibile ai trattamenti, le piodermiti canine sono oggi al centro di una crisi di resistenza agli antimicrobici.
Settembre 2025
Introduzione: L’Emergenza di una Sfida Clinica e di Salute Pubblica
Questa evoluzione ha costretto la professione veterinaria a rivedere fondamentalmente i suoi approcci diagnostici, terapeutici e di biosicurezza. Questo rapporto mira a fornire un’analisi esaustiva dell’importanza degli SRM in dermatologia veterinaria, basandosi sui dati scientifici attuali per illuminare la pratica clinica e la salute pubblica.
La posta in gioco principale risiede nel fatto che la resistenza alla meticillina, che conferisce un’inefficacia clinica all’intera classe delle betalattamine, è molto frequentemente associata a un fenotipo di multiresistenza (MDR). Questa associazione rende inefficaci numerose altre famiglie di antibiotici, come i macrolidi, i lincosamidi, i fluorochinoloni o gli aminoglicosidi. Questa situazione ha generato un cambiamento di paradigma terapeutico. Il fallimento dei trattamenti empirici, un tempo efficaci, costringe i clinici a ricorrere a molecole antibiotiche di ultimo ricorso, come il cloramfenicolo o la rifampicina. Queste alternative, benché potenzialmente efficaci se l’antibiogramma lo conferma, presentano profili di effetti indesiderati più vincolanti e necessitano di un monitoraggio biologico più stretto, aumentando così la complessità, i rischi e il costo della presa in carico.
Da notare che per il GEDAC (Gruppo di Studio Francese in Dermatologia degli Animali da Compagnia), la rifampicina fa parte degli antibiotici da non utilizzare mai al fine di preservarla per la medicina umana per trattare infezioni umane gravi come la tubercolosi. Lo stesso vale per la mupirocina.
Contesto storico e cambiamento di paradigma
L’era post-Seconda Guerra Mondiale ha introdotto gli antimicrobici in medicina veterinaria, rivoluzionando il trattamento delle malattie infettive. Per decenni, le piodermiti canine, principalmente causate da stafilococchi, venivano trattate con successo da antibiotici ß-lattamici, come le penicilline e le cefalosporine. Tuttavia, questo uso generalizzato, spesso empirico, ha esercitato una pressione di selezione intensa sulle popolazioni batteriche. Il risultato inevitabile di questa pressione è stata l’emergenza di ceppi resistenti, trasformando un problema clinico gestibile in una sfida terapeutica maggiore. L’emergenza significativa dello Staphylococcus pseudintermedius resistente alla meticillina (SPIRM) verso la metà degli anni 2000 ha segnato un punto di svolta, segnalando la fine dell’era della fiducia nei trattamenti empirici per la piodermite. Questo non è un evento isolato, ma la conseguenza diretta e prevedibile delle nostre pratiche terapeutiche passate. Essendo la piodermite canina un’affezione estremamente frequente, e il trattamento di prima intenzione storicamente un antibiotico ß-lattamico, l’uso ripetuto di questi farmaci ha creato un ambiente evolutivo ideale per la selezione e la propagazione dei ceppi portatori dei geni di resistenza. Così, i nostri propri protocolli di trattamento hanno involontariamente modellato l’emergenza dei patogeni che sono oggi i più difficili da trattare.
Definizione e tassonomia
La resistenza alla meticillina negli stafilococchi è un fenotipo che conferisce una resistenza a praticamente tutti gli antibiotici della classe delle ß-lattamine, incluse le penicilline, le cefalosporine e i carbapenemi. Il meccanismo molecolare sottostante è la presenza del gene mecA, che è localizzato su un elemento genetico mobile chiamato cassetta cromosomica stafilococcica (SCCmec). Questo gene codifica per una proteina di legame alla penicillina modificata, la PBP2a (Penicillin-Binding Protein 2a), che possiede una affinità molto bassa per gli antibiotici ß-lattamici. Di conseguenza, la sintesi della parete cellulare batterica può continuare anche in presenza di questi antibiotici, rendendoli inefficaci.
Il fenotipo di multiresistenza (MDR) frequentemente osservato negli SRM non è un fenomeno fortuito. La cassetta SCCmec è una piattaforma genetica che, oltre al gene meca, può trasportare e trasferire geni che conferiscono resistenza ad altre classi di antibiotici (per esempio, tetracicline, macrolidi). Così, la pressione di selezione esercitata dall’uso di una betalattamina può non solo selezionare ceppi resistenti alla meticillina, ma anche co-selezionare, in un unico evento, una resistenza a multiple altre famiglie di antibiotici. Questo fenomeno di co-selezione spiega l’emergenza rapida di ceppi quasi-intraibili e rafforza l’argomento contro l’uso empirico delle betalattamine nelle infezioni stafilococciche.
Un punto fondamentale per comprendere l’epidemiologia attuale è la riclassificazione tassonomica avvenuta nel 2005. Precedentemente, la maggior parte degli stafilococchi coagulasi-positivi isolati nei cani erano identificati come Staphylococcus intermedius. Tecniche molecolari hanno permesso di distinguere tre specie distinte all’interno del gruppo Staphylococcus intermedius (SIG): S. intermedius, S. delphini e S. pseudintermedius. Questa revisione ha rivelato che S. pseudintermedius è la specie predominante che colonizza e causa infezioni nei cani e nei gatti. Di conseguenza, la grande maggioranza degli isolati precedentemente identificati come S. intermedius nella letteratura veterinaria erano in realtà S. pseudintermedius. In dermatologia canina, tre specie di SRM sono particolarmente pertinenti: S. pseudintermedius (SPIRM), S. aureus (SARM) e S. schleiferi (SSRM).
Importanza globale e il concetto “One Health”
Il problema degli SRM negli animali da compagnia supera largamente le mura della clinica veterinaria per diventare una preoccupazione di salute pubblica. Questa situazione si inscrive perfettamente nel quadro del concetto “One Health” (Una sola salute), che riconosce l’interconnessione profonda e indissociabile tra la salute umana, la salute animale e la salute dell’ambiente. Gli animali da compagnia condividono il nostro ambiente domestico, ricevono spesso classi di antibiotici simili a quelle utilizzate in medicina umana, e possono servire da serbatoi o vettori per i batteri resistenti. La presenza di SARM e di SPIRM negli animali da compagnia li pone al centro di un “triangolo” di trasmissione dinamico tra gli umani, gli animali e il loro ambiente comune. La gestione dell’antibiotico-resistenza in dermatologia veterinaria non è quindi solo una questione di benessere animale, ma anche una responsabilità condivisa nella lotta mondiale contro la minaccia crescente dei “superbatteri”.
Epidemiologia ed Evoluzione degli Stafilococchi Resistenti
L’epidemiologia degli SRM in medicina veterinaria è un campo dinamico, caratterizzato dall’emergenza rapida di cloni resistenti e dalla loro disseminazione mondiale. Comprendere la prevalenza, i fattori di rischio e i serbatoi di questi patogeni è essenziale per una gestione clinica e preventiva efficace.
A. Staphylococcus pseudintermedius Resistente alla Meticillina (SPIRM): Il Patogeno Canino Dominante
Storia dell’emergenza
Benché casi sporadici siano stati riportati negli anni 1990, l’emergenza significativa dello SPIRM come patogeno clinico maggiore è un fenomeno relativamente recente, che ha preso slancio a partire dal 2006. I primi riconoscimenti ufficiali datano del 2001 in Nord America e del 2007 in Europa. Questa emergenza rapida non è stata il frutto di eventi di resistenza multipli e indipendenti, ma è stata principalmente dovuta alla propagazione clonale esplosiva di alcune linee batteriche molto performanti.
Propagazione clonale mondiale
L’analisi tramite tipizzazione di sequenza multilocus (MLST) ha permesso di mappare la disseminazione mondiale dello SPIRM. Una revisione sistematica ha identificato cinque complessi clonali (CC) maggiori che dominano il paesaggio epidemiologico.
- CC71: Inizialmente descritto come il “clone epidemico europeo”, è oggi diffuso in tutto il mondo, benché la maggioranza degli isolati provenga ancora dall’Europa.
- CC68: Conosciuto come il “clone epidemico nord-americano”, è frequentemente isolato in Nord America ma è stato anche identificato in Europa.
- CC258: Sempre più segnalato in Europa, questo clone presenta un profilo di resistenza distinto da quello del CC71.
- CC45 e CC112: Queste linee sono particolarmente prevalenti in Asia, ma sono state anche rilevate in altri continenti.
Questa dinamica illustra un processo in due tappe: primo, la selezione locale di questi cloni per la pressione esercitata dall’uso degli antibiotici in medicina veterinaria, notevolmente le betalattamine; secondo, la loro disseminazione globale facilitata dai movimenti internazionali crescenti di animali da compagnia. Questa disseminazione rapida su vaste aree geografiche è fortemente facilitata dagli spostamenti internazionali dei cani, sia per le esposizioni, la riproduzione o i viaggi. Uno studio condotto a Granada ha documentato per la prima volta l’introduzione dello SPIRM sull’isola, con dati genotipici ed epidemiologici che suggeriscono che cani “visitatori” hanno trasmesso il patogeno alla popolazione canina locale.
Prevalenza
La prevalenza dello SPIRM varia in modo spettacolare in funzione della popolazione canina studiata, il che ha implicazioni dirette per il sospetto clinico.
- Nei cani sani: Il portage di SPIRM nei cani in buona salute è generalmente basso. Gli studi riportano tassi di prevalenza che vanno dallo 0% al 4,5%. Questi animali sono portatori asintomatici.
- Nei cani malati: La situazione è radicalmente diversa nelle popolazioni di cani presentati per problemi dermatologici. Nelle cliniche di dermatologia specializzate, la prevalenza dello SPIRM nei cani affetti da piodermite può essere estremamente elevata, raggiungendo fino al 40,5% in uno studio. Un altro studio condotto in Thailandia su cani affetti da piodermite ha rivelato una prevalenza globale di SRM del 35,7%. Questa disparità sottolinea che i cani affetti da malattie cutanee croniche costituiscono una popolazione ad altissimo rischio. Uno studio di grande portata condotto negli Stati Uniti tra il 2019 e il 2022 ha analizzato decine di migliaia di isolati clinici e ha identificato 110.423 isolati di SPIRM. In Francia, dati più recenti provenienti da animali malati riportano una frequenza di SPIRM del 17%.
Fattori di rischio
L’identificazione dei fattori di rischio è cruciale per mirare gli sforzi di diagnosi e prevenzione. Diversi fattori sono stati costantemente associati a un rischio aumentato di infezione o colonizzazione da SPIRM:
- Uso anteriore di antibiotici: È il fattore di rischio più importante e più frequentemente citato. L’esposizione recente agli antibiotici, in particolare alle ß-lattamine e ai fluorochinoloni, seleziona i ceppi resistenti eliminando la flora sensibile concorrente.
- Contatto con l’ambiente veterinario: Ospedalizzazioni recenti o visite frequenti in clinica veterinaria aumentano il rischio di esposizione allo SPIRM.
- Malattie cutanee croniche sottostanti: I cani che soffrono di dermatite atopica, di allergie o di otiti croniche sono particolarmente predisposti. Queste condizioni alterano la barriera cutanea e necessitano spesso di trattamenti antimicrobici ripetuti, creando un circolo vizioso.
Serbatoi ambientali
Gli stafilococchi sono batteri robusti capaci di sopravvivere per lunghi periodi su superfici inanimate. Le cliniche veterinarie agiscono come serbatoi ambientali importanti per lo SPIRM. Uno studio ha dimostrato che lo SPIRM poteva essere isolato sul 10% delle superfici campionate in cliniche di cure primarie, senza differenza significativa tra le superfici di contatto con le mani (es: maniglie delle porte, tastiere) e le superfici di contatto con gli animali (es: tavoli di esame). La tipizzazione dei ceppi ha rivelato una grande similarità tra gli isolati di uno stesso ospedale, ma una bassa similarità tra gli ospedali, il che indica una trasmissione e una persistenza intra-ospedaliera. Ceppi di SPIRM indistinguibili sono stati trovati sia nei pazienti canini che sulle superfici ambientali all’interno della stessa clinica, confermando il ruolo dell’ambiente nella trasmissione nosocomiale. Un’igiene delle mani inadeguata del personale veterinario, con una conformità riportata così bassa come il 14%, è un fattore maggiore che contribuisce a questa trasmissione.
B. Staphylococcus aureus Resistente alla Meticillina (SARM) e S. schleiferi (SSRM): Una Prospettiva Comparativa
Benché lo SPIRM sia l’attore principale, altri SRM giocano un ruolo in dermatologia canina.
Staphylococcus aureus (SARM)
- S. aureus è anzitutto un commensale e un patogeno umano. La sua presenza nel cane è quindi epidemiologicamente distinta da quella di S. pseudintermedius.
- Origine e Trasmissione: S. aureus non è un membro della flora commensale normale del cane. Di conseguenza, quando un SARM è isolato in un cane, si tratta il più spesso di una colonizzazione o di un’infezione transitoria risultante da una trasmissione dall’uomo all’animale, un fenomeno conosciuto con il nome di zoonosi inversa o antroponosi. Questa colonizzazione è generalmente di breve durata, l’organismo viene eliminato in alcune settimane se non c’è ri-esposizione.
- Prevalenza e Fattori di Rischio: La prevalenza del portage di SARM nei cani sani è bassa, generalmente tra 0 e 4%. Tuttavia, questo tasso può essere più elevato in popolazioni specifiche di animali che hanno un contatto stretto con il sistema sanitario umano, come i cani da terapia che visitano gli ospedali o gli animali da compagnia appartenenti a professionisti della salute. I fattori di rischio identificati negli animali da compagnia per l’acquisizione del SARM riflettono quelli dell’uomo: antibioticoterapia anteriore, ospedalizzazione e contatto con una persona infetta o colonizzata dal SARM.
- Importanza Clinica: Benché sia meno frequente dello SPIRM, il SARM è un patogeno opportunista capace di provocare infezioni cliniche nel cane, notevolmente piodermiti, infezioni di ferite chirurgiche e infezioni delle vie urinarie.
Staphylococcus schleiferi (SSRM)
- S. schleiferi, che esiste in due sottospecie (S. schleiferi subsp. schleiferi, coagulasi-negativa, e S. schleiferi subsp. coagulans, coagulasi-positiva), è sempre più riconosciuto come un patogeno cutaneo importante nel cane.
- Patogeno Emergente: È ora identificato come una causa significativa di piodermite e di otite esterna canina. In alcuni studi, è il secondo stafilococco più frequentemente isolato in queste condizioni.
- Tassi di Resistenza Elevati: Una caratteristica preoccupante di S. schleiferi è il suo tasso elevato di resistenza alla meticillina. Studi condotti in centri di riferimento in dermatologia hanno riportato tassi di resistenza dal 40% al 46,6%. Uno studio su una popolazione meno distorta ha trovato un tasso di resistenza del 20% nei cani affetti da dermatite infiammatoria.
- Multiresistenza: Come lo SPIRM, lo SSRM presenta spesso una multiresistenza, notevolmente una resistenza frequente ai fluorochinoloni, il che complica ulteriormente le opzioni terapeutiche.
La distinzione tra questi tre patogeni è di importanza capitale nella pratica clinica. Un rapporto di laboratorio che identifica uno “Stafilococco resistente alla meticillina” necessita di un’interpretazione illuminata per guidare la gestione del caso, la comunicazione con il cliente e le misure di biosicurezza. Per esempio, l’identificazione di un SARM (S. aureus) deve immediatamente far sospettare una fonte umana e scatenare una discussione sui rischi potenziali per la salute dei membri del nucleo familiare. Al contrario, una diagnosi di SPIRM orienterà l’investigazione verso la gestione della malattia cutanea sottostante del cane e il controllo della contaminazione ambientale. La tabella seguente sintetizza queste differenze chiave.
|
Caratteristica |
Staphylococcus pseudintermedius (SPIRM) |
Staphylococcus aureus (SARM) |
Staphylococcus schleiferi (SSRM) |
|
Stato Commensale Principale |
Cane (flora normale della pelle e delle mucose) |
Uomo (colonizzazione canina transitoria) |
Cane e Uomo (flora cutanea) |
|
Prevalenza nella Piodermite Canina |
Molto elevata (patogeno dominante) |
Bassa a moderata |
Bassa a moderata (patogeno emergente) |
|
Serbatoio Principale |
Animale (cane) |
Umano (sistema sanitario, comunità) |
Animale e Umano |
|
Via di Trasmissione Principale |
Animale-Animale, Ambiente-Animale |
Uomo-Animale (zoonosi inversa) |
Meno definita, probabilmente Animale-Animale |
|
Potenziale Zoonotico (Animale -> Uomo) |
Basso ma documentato |
Significativo (preoccupazione di salute pubblica maggiore) |
Raro, principalmente nosocomiale nell’uomo |
Patogenesi della Piodermite Stafilococcica
La piodermite stafilococcica non è semplicemente la presenza di batteri sulla pelle; è il risultato di un’interazione complessa tra il patogeno, l’ospite e l’ambiente. La transizione di S. pseudintermedius da semplice residente della pelle a agente infettivo dipende dalla rottura dell’equilibrio delicato che mantiene l’omeostasi cutanea.
Da Commensale a Patogeno Opportunista: Il Ruolo della Barriera Cutanea
- S. pseudintermedius è un commensale ben adattato al suo ospite canino, colonizzando la pelle e le mucose (narici, bocca, faringe, perineo) dal 46% al 92% dei cani sani senza causare malattia. L’infezione è un evento opportunista, che si produce solo quando le difese dell’ospite sono indebolite. La barriera cutanea, composta da elementi fisici (stratum corneum), chimici (lipidi, peptidi antimicrobici) e immunologici, è la principale linea di difesa. Qualsiasi alterazione di questa barriera crea una porta d’ingresso per l’invasione batterica.
L’importanza clinica dello SPIRM non risiede in una virulenza aumentata rispetto al suo omologo sensibile (MSSP). Infatti, gli studi non hanno dimostrato che i ceppi resistenti alla meticillina sono intrinsecamente più aggressivi o patogeni. I meccanismi della malattia e le lesioni cliniche che provocano sono indistinguibili. La vera posta in gioco è altrove: risiede nel fallimento terapeutico. Di fronte a un’infezione da SPIRM, un trattamento empirico con un antibiotico di prima linea, come la cefalexina, è destinato al fallimento. Questo fallimento iniziale scatena una cascata di conseguenze negative: la malattia si prolunga, aumentando la morbidità e il disagio dell’animale; il carico batterico sull’animale e nel suo ambiente aumenta, accrescendo il rischio di trasmissione; e questo conduce spesso a cicli di antibioticoterapie successive e inefficaci, che non solo non risolvono il problema, ma esercitano una pressione di selezione supplementare, favorendo l’emergenza di resistenze addizionali. Così, una semplice piodermite si trasforma in un caso clinico complesso, cronico, costoso e frustrante, con implicazioni potenziali per la salute pubblica. È questa dimensione del fallimento terapeutico che conferisce allo SPIRM la sua importanza clinica devastante.
Ruolo dei Fattori di Virulenza
Una volta franchita la barriera, S. pseudintermedius utilizza un arsenale di fattori di virulenza per stabilire l’infezione.
- Tossine Esfoliative (ExpA e ExpB): Queste proteine sono attori chiave nella formazione delle lesioni di piodermite. Agiscono come proteasi altamente specifiche che prendono di mira e scindono la desmoglaina-1 canina, una caderina desmosomale essenziale all’adesione tra i cheratinociti nell’epidermide. La degradazione della desmoglaina-1 perturba la coesione dell’epidermide, provocando una scissione intra-epidermica (acantolisi) e la formazione di pustole sotto-cornee. L’iniezione intradermica di queste tossine purificate nei cani riproduce i segni clinici della piodermite, come l’eritema e la formazione di croste, confermando il loro ruolo patogeno diretto. Altre tossine includono la tossina esfoliativa SIET, una leucotossina bicomposta, Luk-I, che prende di mira e distrugge i leucociti polimorfonucleati, e delle enterotossine superantigene, come SECCANINE, capaci di provocare un’attivazione policlonale dei linfociti T.
- Adesine e Proteine di Superficie: Per iniziare un’infezione, il batterio deve prima aderire alle cellule dell’ospite. S. pseudintermedius esprime una serie di proteine di superficie, chiamate adesine (famiglia Sps), che si legano specificamente ai componenti della matrice extracellulare dell’ospite, come il fibrinogeno, la fibronectina e la cheratina-10. Proteine come SpsD e SpsL facilitano non solo l’adesione ai corneociti, ma anche l’invasione dei cheratinociti e la formazione di biofilm.
- Formazione di Biofilm: Il biofilm è una comunità strutturata di batteri avvolti in una matrice polimerica auto-prodotta, che offre una protezione contro le difese immunitarie dell’ospite e gli antibiotici, contribuendo così alla cronicità delle infezioni. La formazione di biofilm è particolarmente critica nelle infezioni croniche, nelle otiti e nelle infezioni di siti chirurgici, notevolmente su materiali inerti come gli impianti o i fili di sutura. Il biofilm protegge efficacemente i batteri dalla risposta immunitaria dell’ospite e dalla penetrazione degli antibiotici, rendendo l’eradicazione dell’infezione estremamente difficile.
Il Fattore Predisponente Centrale: La Rottura della Barriera Cutanea
La quasi-totalità dei casi di piodermite stafilococcica canina sono malattie secondarie. L’affermazione secondo cui “i cani sani non sviluppano infezioni cutanee” è un principio fondamentale in dermatologia veterinaria. L’identificazione e la gestione della causa sottostante sono quindi non solo importanti per il trattamento, ma assolutamente essenziali per la prevenzione delle recidive.
- Dermatite Atopica e Allergie: È la causa sottostante più frequente. L’infiammazione allergica (che sia dovuta ad allergeni ambientali, alimentari o a punture di pulci) compromette la barriera cutanea in diversi modi. Prima di tutto, il prurito intenso che provoca porta a un auto-traumatismo (grattamento, leccamento, mordicchiamento) che danneggia fisicamente lo stratum corneum. In secondo luogo, l’infiammazione stessa altera la composizione e l’organizzazione dei lipidi intercellulari (ceramidi) e diminuisce la produzione di peptidi antimicrobici naturali, rendendo la pelle più permeabile e meno atta a difendersi contro i microbi. Questo ambiente cutaneo infiammato e danneggiato è un terreno ideale per la proliferazione di S. pseudintermedius.
- Altri Fattori Predisponenti: Altre condizioni possono anche alterare l’integrità della pelle e predisporre alle infezioni. Queste includono le endocrinopatie come l’ipotiroidismo e l’ipercorticismo (sindrome di Cushing), che influenzano il rinnovamento della pelle e l’immunità locale; gli ectoparassiti (Demodex, Sarcoptes) che causano danni diretti e infiammazione; e i disturbi della cheratinizzazione (seborrea) che modificano la superficie della pelle.
Approccio Clinico e Diagnostico delle Piodermiti a Stafilococchi Resistenti
Di fronte a un caso di piodermite, il clinico deve adottare un approccio sistematico e basato sulle prove. L’era della resistenza agli antimicrobici esige una maggiore rigorosità diagnostica per evitare i fallimenti terapeutici e promuovere un uso giudizioso degli antibiotici.
A. Presentazione Clinica
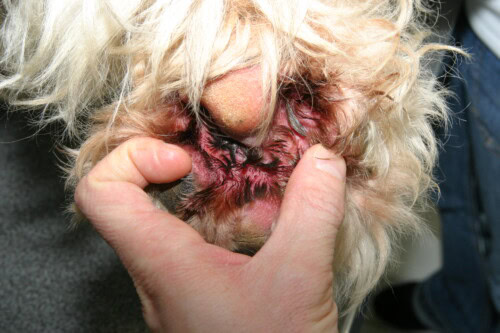
Le infezioni cutanee stafilococciche nel cane sono classificate in funzione della profondità del coinvolgimento tissutale.
- Piodermite Superficiale: L’infezione è confinata all’epidermide e ai follicoli piliferi. La forma più comune è la follicolite batterica superficiale. Le lesioni cliniche tipiche sono varie e comprendono:
- Papule e Pustole Follicolari: Piccole elevazioni rosse (papule) o riempite di pus (pustole), centrate su un pelo.
- Collaretto Epidermiche: Sono lesioni molto caratteristiche. Si presentano come zone circolari di alopecia con un bordo di squame o di croste che si estende in modo centrifugo.
- Lesioni a Bersaglio: Zone di eritema centrale con un bordo più pallido e un anello eritematoso periferico.
- Aspetto “Tarlato”: Nei cani a pelo corto, la follicolite può manifestarsi con multiple piccole zone di alopecia, dando al pelo un’apparenza “mangiata dalle tarme”.
- Altri segni come croste, eritema e iperpigmentazione post-infiammatoria sono anche frequenti.
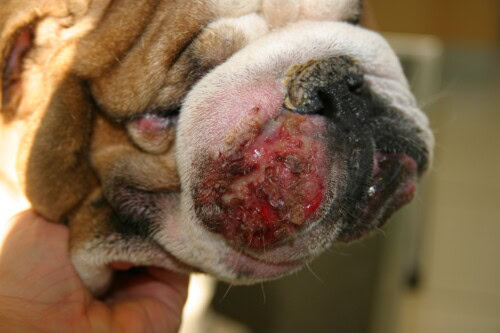
- Piodermite Profonda: Questa forma è più severa perché implica una rottura dei follicoli piliferi (furuncolosi) e un’estensione dell’infezione nel derma e talvolta nell’ipoderma (cellulite). I segni clinici sono più spettacolari e spesso dolorosi:
- Noduli e Bolle Emorragiche: Lesioni rilevate, ferme o fluttuanti, spesso riempite di un contenuto purulento o sanguinante.
- Fistole Drenanti: Aperture nella pelle attraverso le quali scorre un essudato siero-sanguinolento o purulento.
- Segni Severi: Edema, ulcere, croste spesse e infiammazione marcata sono comuni. Contrariamente alla piodermite superficiale, i cani affetti da piodermite profonda possono presentare segni sistemici come febbre, letargia e anoressia.
Un punto di importanza capitale deve essere sottolineato: è clinicamente impossibile distinguere una piodermite causata da un ceppo di stafilococco resistente alla meticillina da un’infezione causata da un ceppo sensibile. Le lesioni sono morfologicamente identiche. Il sospetto di un’infezione resistente non deve quindi mai basarsi sull’aspetto delle lesioni, ma piuttosto sull’anamnesi del paziente, la presenza di fattori di rischio e, soprattutto, la risposta al trattamento.
B. Strategia Diagnostica Basata sulle Prove
L’avvento degli SRM ha imposto un cambiamento di paradigma nell’approccio diagnostico della piodermite. L’approccio storico consistente nel “trattare prima, porre domande dopo” con antibiotici empirici non è solo diventato obsoleto, ma è ora considerato pericoloso e contrario ai principi dell’antibiotic stewardship. La citologia, un tempo considerata come uno strumento complementare, è diventata una tappa essenziale e non negoziabile dell’esame iniziale. Ignorare la citologia nel contesto attuale di resistenza generalizzata costituisce un errore professionale. È il perno della decisione clinica: conferma la presenza di un’infezione batterica, giustificando così l’instaurazione di un trattamento antimicrobico (che dovrebbe essere topico in prima intenzione), guida il riconoscimento dei casi che necessitano di una coltura immediata (presenza di bacilli, piodermite profonda), e permette di valutare la risposta al trattamento.
La Citologia Cutanea: Lo Strumento Indispensabile di Prima Linea
La citologia è un test diagnostico rapido, poco costoso, minimamente invasivo e realizzabile in clinica, che dovrebbe essere sistematicamente effettuato su ogni paziente che presenta lesioni compatibili con una piodermite.
- Tecnica di Prelievo: Il metodo dipende dalla natura della lesione.
- Impressione diretta su vetrino: Per le lesioni umide o essudative, o dopo aver rotto una pustola intatta con un ago sterile.
- Scotch-test (Nastro adesivo): Ideale per le lesioni secche, squamose o situate in zone di difficile accesso come gli spazi interdigitali.
- Tampone: Utile per prelevare materiale nei condotti auricolari o nelle fistole.
- Interpretazione: Il campione è colorato (per esempio, con una colorazione di tipo Wright-Giemsa modificata) ed esaminato al microscopio. La scoperta di cocchi fagocitati da neutrofili degenerati è la prova patognomonica di una piodermite batterica. La presenza di numerosi batteri extracellulari associati a una popolazione di cellule infiammatorie è anche molto suggestiva. La citologia permette anche di rilevare la presenza di altri agenti (lieviti di tipo Malassezia, bacilli) e di valutare il tipo di risposta infiammatoria.
La citologia è il primo esame primordiale da realizzare
Coltura Batterica e Antibiogramma: La Chiave della Terapia Mirata
La coltura batterica con test di sensibilità agli antimicrobici (antibiogramma) non è necessaria per tutti i casi di piodermite, ma è imperativa in circostanze specifiche per guidare una terapia razionale.
- Indicazioni Chiare: La coltura e l’antibiogramma sono fortemente raccomandati, persino obbligatori, nelle situazioni seguenti:
- Risposta clinica insufficiente (meno del 50% di miglioramento delle lesioni) dopo due settimane di una antibioticoterapia sistemica appropriata.
- Comparsa di nuove lesioni (papule, pustole) nel corso di un trattamento antibiotico in corso da almeno due settimane.
- Presenza di bacilli all’esame citologico.
- Presenza di lesioni di piodermite profonda (furuncolosi, cellulite, noduli).
- Antecedenti di infezione multiresistente nell’animale o in un altro animale del nucleo familiare.
- Metodologia di Prelievo: Per essere affidabile, il prelievo per coltura deve essere realizzato in modo asettico al fine di evitare ogni contaminazione. La qualità del prelievo è determinante. I siti e le tecniche di prelievo ideali sono:
- Pustola intatta: È il sito ideale. Dopo una disinfezione dolce, la pustola è rotta sterilmente con un ago e il suo contenuto raccolto su un tampone.
- Crosta: Il tampone è passato sulla superficie umida della pelle dopo aver sollevato delicatamente una crosta recente.
- Collaretto epidermico: Il tampone è fatto rotolare fermamente sul bordo attivo della lesione.
- Nodulo o fistola: Una biopsia tissutale per coltura è il metodo di scelta per le lesioni profonde.
- Interpretazione e Utilità: Il laboratorio identificherà la specie batterica e testerà la sua sensibilità a un pannello di antibiotici. Per gli stafilococchi, il test di sensibilità all’oxacillina o alla cefoxitina è utilizzato per rilevare la resistenza alla meticillina (presenza del gene mecA). L’antibiogramma è l’unico mezzo per scegliere un antibiotico sistemico efficace contro un ceppo di SPIRM, che è spesso multiresistente.
L’antibiogramma si rivela primordiale nella gestione degli SRM
Principi Terapeutici e Gestione delle Infezioni a SPIRM
La gestione delle piodermiti a SPIRM è evoluta verso un approccio multimodale che mette l’accento sulla terapia topica, riserva l’antibioticoterapia sistemica a indicazioni precise e, soprattutto, si attacca alla causa sottostante dell’infezione.
A. La Terapia Topica: Pietra Angolare del Trattamento
Di fronte alla crescita della resistenza, la terapia topica è stata elevata dallo stato di trattamento di supporto a quello di trattamento di prima linea. Le direttive internazionali, come quelle della World Association for Veterinary Dermatology (WAVD), raccomandano ora la terapia topica come modalità di trattamento di scelta per le piodermiti superficiali, che siano causate da ceppi sensibili o resistenti. Diversi studi hanno dimostrato che un protocollo di trattamento topico ben condotto può essere efficace quanto una antibioticoterapia sistemica per risolvere una piodermite superficiale, incluse quelle causate dallo SPIRM. I vantaggi sono multipli: ottenimento di concentrazioni di antisettici molto elevate al sito dell’infezione (ben al di sopra della concentrazione minima inibitoria), riduzione del rischio di selezione di resistenza in altri sistemi (come il tratto digestivo), ed effetti benefici non specifici come il debridement meccanico delle croste e dei detriti.
Agenti Antisettici Efficaci
Diversi ingredienti attivi hanno provato la loro efficacia.
- Clorexidina: È l’agente topico più studiato e più raccomandato a causa della sua potente attività antimicrobica in vivo e del suo effetto persistente. È battericida contro gli stafilococchi, inclusi i ceppi resistenti alla meticillina. Le concentrazioni efficaci nei prodotti veterinari variano generalmente dal 2% al 4%.
- Perossido di Benzoile: Alle concentrazioni del 2,5% al 3%, possiede un’attività antimicrobica, così come proprietà cheratolische (aiuta a eliminare gli strati di pelle morta), comedolitiche (apre i follicoli piliferi) e sgrassanti. Tuttavia, può essere disseccante e irritante per la pelle, il che può limitare il suo uso o necessitare l’impiego concomitante di emollienti.
- Altri agenti: Altri antisettici come l’ipoclorito di sodio diluito (candeggina diluita), l’acido acetico/acido borico, e l’etil lattato hanno anche mostrato una certa efficacia e possono essere opzioni valide.
Protocolli di Applicazione
Il successo della terapia topica dipende in modo critico dal rispetto del protocollo.
- Formulazioni: La scelta della formulazione dipende dall’estensione delle lesioni, dal tipo di pelo e dalla facilità di applicazione per il proprietario.
- Shampoo: Ideali per le infezioni generalizzate, permettono di trattare grandi superfici cutanee.
- Schiume, Spray, Salviette: Molto utili per un’applicazione quotidiana, per i trattamenti localizzati, o per i giorni senza bagno. Generalmente non necessitano di risciacquo.
- Creme, Unguenti, Gel: Convengono alle lesioni localizzate e alle zone poco pelose.
- Frequenza e Tempo di Contatto: Un tempo di contatto di almeno 10 minuti è cruciale perché gli shampoo antisettici possano esercitare il loro effetto battericida. La frequenza di bagno raccomandata è generalmente di 2-3 volte a settimana, ma può essere aumentata a una frequenza quotidiana nei casi severi di SPIRM. Le schiume e gli spray possono essere applicati una o due volte al giorno. Il trattamento deve essere continuato per almeno 7-10 giorni dopo la risoluzione clinica completa delle lesioni per prevenire le recidive precoci. Per gli animali a pelo lungo o denso, una tosatura è spesso indispensabile per permettere al prodotto di raggiungere la pelle e di agire efficacemente.
Tabella 1: Protocolli di Terapia Topica per la Piodermite Superficiale Canina
|
Principio Attivo |
Concentrazioni Comuni |
Formulazioni Disponibili |
Protocollo di Applicazione Raccomandato |
Note Cliniche |
|
Clorexidina |
2%, 3%, 4% |
Shampoo, Schiuma, Spray, Salviette, Gel |
Shampoo: 2-3 volte/settimana, tempo di contatto di 10 minuti. Schiuma/Spray/Salviette: 1-2 volte/giorno, notevolmente i giorni senza shampoo. |
Antisettico di prima scelta. Molto buona efficacia e tolleranza. La tosatura migliora significativamente l’efficacia. |
|
Perossido di benzoile |
2.5%, 3% |
Shampoo, Gel |
Shampoo: 2-3 volte/settimana, tempo di contatto di 5-10 minuti. |
Azione cheratolìtica e sgrassante utile in certi casi. Potenziale irritante e disseccante più elevato della clorexidina. |
|
Ipoclorito di sodio |
0.005% (diluizione) |
Soluzione per bagno |
Bagni: 2-3 volte/settimana, tempo di contatto di 10-15 minuti. |
Alternativa interessante e poco costosa. Preparazione estemporanea necessaria (candeggina diluita). |
|
Antibiotici topici (Mupirocina, Acido fusidico) |
2% |
Pomata, Crema |
Applicazione: 2-3 volte/giorno su lesioni molto localizzate. |
Riservati alle lesioni focali. L’uso estensivo è da proibire per limitare il rischio di selezione di resistenza. La mupirocina non deve essere utilizzata (Raccomandazioni GEDAC) |
B. L’Antibioticoterapia Sistemica: Un Approccio Ragionato e Mirato
L’uso di antibiotici sistemici deve essere una decisione riflettuta e giustificata, e non un riflesso. È riservata alle piodermiti profonde, dove l’infezione raggiunge tessuti che la terapia topica non può penetrare efficacemente, e ai casi di piodermite superficiale generalizzata che non rispondono a un trattamento topico solo ben condotto.
Principio di Selezione
La scelta di un antibiotico sistemico per un’infezione sospettata o confermata di SPIRM deve imperativamente essere basata sui risultati di un antibiogramma. L’uso empirico di antibiotici di seconda o terza linea è una pratica pericolosa che favorisce l’emergenza di resistenze ancora più estese. È cruciale rispettare la “regola dell’esperto“: uno stafilococco resistente all’oxacillina deve essere considerato come clinicamente resistente a tutte le betalattamine, anche se l’antibiogramma suggerisce una sensibilità apparente a certe cefalosporine. La durata del trattamento deve essere sufficientemente lunga: al minimo 3-4 settimane per una piodermite superficiale e 6-8 settimane per una piodermite profonda, continuando sempre il trattamento per 1-2 settimane dopo la risoluzione clinica completa.
Opzioni Terapeutiche per lo SPIRM (basate sulla sensibilità)
Lo SPIRM è, per definizione, resistente a tutti gli antibiotici ß-lattamici. Inoltre, i cloni epidemici sono spesso multiresistenti, presentando una resistenza crociata a numerose altre classi di antibiotici comunemente utilizzate in medicina veterinaria, come le tetracicline, i macrolidi (eritromicina), i lincosamidi (clindamicina) e i fluorochinoloni (enrofloxacina). Le opzioni terapeutiche sono quindi limitate e devono essere scelte con cura in funzione dei risultati della coltura. L’uso di antibiotici di importanza critica in medicina umana (vancomicina, linezolide, teicoplanina) è fortemente sconsigliato.
Tabella 2: Opzioni di Antibioticoterapia Sistemica per le Infezioni a Stafilococchi Resistenti nel Cane (sulla base di un antibiogramma)
|
Antibiotico |
Posologia (Cane) |
Frequenza di Somministrazione |
Effetti Collaterali Notevoli |
Precauzioni e Monitoraggio Raccomandato |
|
Cloramfenicolo |
50 mg/kg |
Ogni 8 ore (TID) |
Disturbi gastrointestinali (vomito, diarrea), debolezza neurologica, mielosoppressione reversibile (dose-dipendente). |
Margine di sicurezza stretto. Monitoraggio ematologico raccomandato durante trattamenti prolungati. Controindicato negli animali riproduttori. |
|
Doxiciclina / Minociclina |
5-10 mg/kg |
Ogni 12 ore (BID) |
Disturbi gastrointestinali (vomito, esofagite). La minociclina può essere più efficace della doxiciclina su certi ceppi. |
Somministrare con cibo e acqua per ridurre il rischio di esofagite. La fotosensibilità è rara ma possibile. |
|
Clindamicina |
11 mg/kg |
Ogni 12 ore (BID) |
Disturbi gastrointestinali. |
Spesso inefficace sugli SPIRM a causa di una co-resistenza frequente. Efficacia condizionata dall’antibiogramma. |
|
Rifampicina |
5-10 mg/kg |
Ogni 24 ore (SID) |
Epatotossicità potenzialmente severa, disturbi gastrointestinali, colorazione arancione delle urine e delle lacrime. |
Mai usare in monoterapia (rischio di selezione rapida di mutanti resistenti). Monitoraggio degli enzimi epatici imperativo prima e durante il trattamento (es: a 2 e 4 settimane). Da non utilizzare mai (Raccomandazioni GEDAC) |
|
Sulfamidici potenziati (TMS) |
15-30 mg/kg |
Ogni 12 ore (BID) |
Cheratocongiuntivite secca (KCS), reazioni di ipersensibilità (poliartrite, anemia, trombocitopenia), epatopatie. |
Rischio idiosincratico elevato in certe razze (Doberman). Monitoraggio del test di Schirmer raccomandato durante trattamenti lunghi. |
Sfide ed Effetti Indesiderati
Il trattamento delle infezioni a SPIRM con antibiotici di “riserva” non è senza difficoltà.
- Cloramfenicolo: Benché spesso efficace in vitro, è associato a un’incidenza molto elevata di effetti collaterali gastrointestinali (vomito, diarrea, anoressia), che conducono frequentemente all’interruzione del trattamento. Sono stati anche descritti casi di neurotossicità reversibile (paresi degli arti posteriori).
- Doxiciclina/Minociclina: Sono stati riportati fallimenti clinici malgrado test di sensibilità favorevoli. Questo può essere dovuto a soglie di interpretazione della sensibilità (breakpoint) che non predicono sempre con precisione l’efficacia clinica per S. pseudintermedius.
- Rifampicina: Deve essere utilizzata in combinazione con un altro antibiotico efficace per prevenire la selezione rapida di mutanti resistenti. Una sorveglianza della funzione epatica è raccomandata a causa del rischio di epatotossicità.
- Aminoglicosidi (es: amikacina): Questi farmaci necessitano di una somministrazione per iniezione e un monitoraggio attento della funzione renale a causa della loro potenziale nefrotossicità.
C. Gestione della Causa Sottostante: La Chiave della Prevenzione delle Recidive
Il trattamento antimicrobico, che sia topico o sistemico, si attacca solo alle conseguenze della malattia (l’infezione batterica) e non alla sua causa. Senza una diagnosi e un controllo rigoroso della malattia primaria sottostante (dermatite atopica, allergia alimentare, ipotiroidismo, ecc.), le recidive di piodermite sono ineludibili. Ogni recidiva necessita di un nuovo ciclo di trattamento, aumentando la pressione di selezione per la resistenza e il rischio di emergenza di ceppi ancora più difficili da trattare. La gestione a lungo termine di queste affezioni primarie è quindi la strategia più efficace per rompere questo ciclo, migliorare la qualità di vita dell’animale e ridurre la dipendenza globale dagli antibiotici.
Colonizzazione versus Infezione: Implicazioni Cliniche ed Epidemiologiche
La distinzione tra la colonizzazione e l’infezione da parte di un SRM è un concetto fondamentale la cui comprensione è essenziale per una gestione razionale dei pazienti e la prevenzione della trasmissione. Questi due stati rappresentano scenari biologici e clinici molto diversi, con implicazioni distinte in termini di trattamento e salute pubblica.
Definizione e Distinzione
- Colonizzazione (o Portage): Questo stato si definisce per la presenza e la moltiplicazione di un batterio, come lo SPIRM, sulle superfici corporee di un ospite (pelle, mucose nasali, orali, anali) senza che ci siano segni clinici di malattia o risposta infiammatoria da parte dell’ospite. L’animale è un “portatore sano“; il batterio fa parte della sua microflora di superficie, in modo transitorio o persistente, ma non causa danno.
- Infezione: L’infezione si produce quando il batterio attraversa le barriere di difesa dell’ospite, invade i tessuti e si moltiplica, scatenando una risposta infiammatoria e provocando segni clinici di malattia (per esempio, le pustole e l’infiammazione della piodermite).
Significato Clinico ed Epidemiologico del Portage
Lo stato di portatore, benché asintomatico, ha conseguenze cliniche ed epidemiologiche profonde. La persistenza della colonizzazione dopo la risoluzione di un’infezione clinica è un fenomeno particolarmente preoccupante che ridefinisce la nozione di “guarigione”. Un animale le cui lesioni cutanee sono scomparse può sembrare clinicamente guarito, ma può rimanere un portatore asintomatico. Questo stato di portatore “nascosto” trasforma l’animale guarito in una minaccia epidemiologica latente. Diventa un “cavallo di Troia“, capace di reintrodurre il patogeno nell’ambiente clinico, di contaminare altri pazienti vulnerabili, e di servire da serbatoio per la sua propria reinfezione futura. Questa constatazione impone un cambiamento di prospettiva: il successo terapeutico non può più essere giudicato unicamente sulla base della risoluzione dei segni clinici. Deve integrare una strategia di gestione a lungo termine dello stato di portatore, focalizzata sull’igiene, il controllo rigoroso della malattia sottostante per rinforzare la barriera cutanea, e una comunicazione chiara con il proprietario sui rischi persistenti.
- Persistenza dopo Trattamento: Una delle constatazioni più importanti è che la guarigione clinica di una piodermite a SPIRM non comporta necessariamente l’eradicazione del batterio dall’organismo. Uno studio di follow-up ha mostrato che tra i cani inizialmente diagnosticati con una piodermite a SPIRM, il 45,2% erano ancora portatori di SPIRM sulla loro pelle e il 47,6% sui loro siti di portage mucoso (naso, retto) dopo la risoluzione completa dei segni clinici.
- Fonte di Reinfezione Endogena: Un animale colonizzato diventa il proprio serbatoio per future infezioni. Il batterio risiede sulle mucose e può facilmente essere trasferito alla pelle durante la toelettatura o il leccamento. Se la barriera cutanea dell’animale è nuovamente compromessa (per esempio, durante una spinta allergica), il batterio può rapidamente proliferare e provocare una nuova infezione.
- Fonte di Trasmissione Esogena: Gli animali portatori asintomatici disseminano continuamente lo SPIRM nel loro ambiente (domicilio, parchi, cliniche veterinarie), contaminando le superfici e agendo come una fonte silenziosa di trasmissione ad altri animali e, potenzialmente, agli umani.
- Acquisizione Nosocomiale della Colonizzazione: L’ambiente clinico è un luogo ad alto rischio per l’acquisizione dello stato di portatore. Lo stesso studio ha rivelato che tra i cani che non avevano SPIRM all’inizio del trattamento della loro piodermite (causata da un ceppo sensibile), il 28,3% sono diventati colonizzati dallo SPIRM sulla loro pelle dopo il trattamento. Il tasso di portage mucoso in questo gruppo è aumentato in modo significativo, passando dal 7,8% prima del trattamento al 26,7% dopo. Questo suggerisce che l’ambiente ospedaliero e le procedure di trattamento possono facilitare la trasmissione e la colonizzazione da parte di ceppi resistenti.
Approccio della Decolonizzazione
La questione se tentare attivamente di eliminare lo stato di portatore (decolonizzazione) è complessa e controversa.
- Non-raccomandazione Generale: Per la maggior parte dei casi, la decolonizzazione attiva degli animali portatori sani non è raccomandata.
- Giustificazione:
- La colonizzazione da parte del SARM (S. aureus) negli animali da compagnia è spesso transitoria e si elimina naturalmente in alcune settimane, a condizione che la fonte di ri-esposizione (generalmente umana) sia controllata.
- L’uso di antibiotici sistemici per tentare di eradicare il portage non è solo inefficace (gli antibiotici non raggiungono concentrazioni sufficienti sulle superfici mucose), ma è anche controproducente perché esercita una pressione di selezione supplementare a favore della resistenza.
- Benché terapie topiche (shampoo antisettici, unguenti nasali) possano ridurre temporaneamente il carico batterico, la loro efficacia a lungo termine per un’eradicazione completa del portage non è stata dimostrata in studi controllati.
Attualmente, non esiste un consenso scientifico per raccomandare un tentativo di decolonizzazione sistematica di questi animali portatori. I protocolli studiati hanno mostrato un’efficacia limitata e incostante, con un rischio non trascurabile di selezionare ceppi ancora più resistenti. L’approccio privilegiato per la gestione degli animali colonizzati si concentra quindi su misure non antibiotiche: il rinforzo dell’igiene (bagni antisettici regolari per ridurre il carico cutaneo), il controllo stretto della malattia sottostante per mantenere una barriera cutanea sana, e l’implementazione di misure di controllo dell’infezione per limitare la trasmissione.
Potenziale Zoonotico e Prevenzione della Trasmissione
La presenza di batteri multiresistenti negli animali da compagnia, che condividono il nostro ambiente più intimo, solleva questioni legittime di salute pubblica. La valutazione del rischio zoonotico e l’implementazione di misure di controllo dell’infezione sono responsabilità condivise dai veterinari e dai proprietari di animali.
A. Valutazione del Rischio Zoonotico
È cruciale differenziare il rischio associato alle diverse specie di stafilococchi, perché non è uniforme.
- Confronto SPIRM vs SARM:
- S. aureus Resistente alla Meticillina (SARM): Il rischio zoonotico associato al SARM è ben stabilito e considerato come significativo. Il SARM è un patogeno umano maggiore, e gli animali da compagnia agiscono il più spesso come vittime collaterali dell’epidemia umana, venendo colonizzati da ceppi di origine umana (zoonosi inversa). Una volta colonizzati o infetti, possono tuttavia diventare serbatoi silenziosi all’interno del nucleo familiare, contribuendo alla persistenza del SARM nella comunità e ponendo un rischio di (ri)infezione per gli umani. La trasmissione può avvenire in entrambe le direzioni.
- S. pseudintermedius Resistente alla Meticillina (SPIRM): Il rischio zoonotico diretto dello SPIRM è considerato come basso. S. pseudintermedius è un batterio altamente adattato all’ospite canino ed è mal equipaggiato per colonizzare durevolmente o causare infezioni negli umani in buona salute. Tuttavia, questo rischio, benché basso, non è nullo. Sono stati riportati casi di infezioni umane a SPIRM, generalmente in persone immunodepresse o in contatto molto stretto. Il rischio principale dello SPIRM per la salute umana potrebbe essere indiretto: può agire come un serbatoio di geni di resistenza (come il gene mecA) che potrebbero potenzialmente essere trasferiti a patogeni umani più virulenti come S. aureus.
- Dinamica di Trasmissione Asimmetrica:
- Per il SARM (MRSA): Il serbatoio principale è l’umano. Gli animali da compagnia sono il più spesso “vittime collaterali”. La via di trasmissione predominante è Uomo → Animale.
- Per lo SPIRM (MRSP): Il serbatoio principale e quasi esclusivo è il cane. La trasmissione è principalmente inter-canina. La trasmissione all’uomo, benché possibile, rimane un evento raro (spillover zoonotico occasionale).
- Prove di Trasmissione:
- Trasmissione Animale-Uomo: Diversi studi hanno utilizzato la tipizzazione molecolare per provare la trasmissione di ceppi di SPIRM identici tra cani infetti e i loro proprietari.
- Rischio Professionale per il Personale Veterinario: Il personale veterinario costituisce una popolazione a rischio di portage professionale. Uno studio condotto durante una conferenza di dermatologia veterinaria ha rivelato un tasso di portage nasale di SPIRM del 3,9% tra i partecipanti.
B. Misure di Controllo dell’Infezione (“Infection Control”)
La prevenzione della trasmissione degli SRM si basa sull’applicazione rigorosa di protocolli di igiene e biosicurezza, tanto in ambiente clinico quanto a domicilio.
Raccomandazioni per le Cliniche Veterinarie
Ogni clinica veterinaria dovrebbe mettere in atto un programma formale di controllo delle infezioni. Le misure fondamentali, basate sulle “Precauzioni Standard“, includono:
- Igiene delle Mani: È la misura più semplice e più efficace per prevenire la trasmissione crociata.
- Equipaggiamento di Protezione Individuale (EPI): L’uso di guanti è obbligatorio per manipolare qualsiasi animale che presenti lesioni cutanee. Camici o grembiuli di protezione devono essere indossati.
- Gestione dei Pazienti: I pazienti ospedalizzati con un’infezione a SRM confermata o sospettata devono essere messi in isolamento. Per le consultazioni esterne, è raccomandato programmare questi pazienti a fine giornata.
- Pulizia e Disinfezione dell’Ambiente: Le superfici ad alto contatto e il materiale riutilizzabile devono essere meticolosamente puliti e disinfettati tra ogni paziente.
Consigli per i Proprietari di Animali Infetti o Colonizzati
L’educazione dei proprietari è una componente essenziale. I consigli devono essere chiari, pratici e non allarmistici.
- Igiene delle Mani Rigorosa: I proprietari devono essere istruiti a lavarsi le mani sistematicamente dopo aver toccato il loro animale.
- Limitazione dei Contatti Stretti: Durante la fase attiva dell’infezione, è prudente limitare i contatti intimi (leccamento del viso, dormire nel letto).
- Protezione delle Persone a Rischio: Se persone immunodepresse, bambini molto piccoli, persone anziane o persone con ferite cutanee vivono nel nucleo familiare, sono necessarie precauzioni supplementari.
- Igiene dell’Ambiente Domestico: La biancheria da letto dell’animale, i suoi giocattoli e le sue ciotole devono essere lavati regolarmente con acqua calda e sapone.
Conclusione: Verso una Gestione Integrata attraverso l’Antibiotic Stewardship e l’Approccio “One Health”
L’emergenza degli stafilococchi resistenti alla meticillina, e in particolare dello SPIRM, in dermatologia veterinaria, costituisce ben più di una semplice sfida terapeutica. Rappresenta una minaccia complessa che mette in luce le falle dei nostri approcci passati in materia di uso degli antimicrobici e sottolinea l’interconnessione profonda tra la salute animale, la salute umana e l’ambiente. La gestione efficace di questo problema non può più basarsi sulla sola ricerca di un nuovo antibiotico “miracolo”, ma esige un approccio integrato, olistico e sostenibile, fondato sui principi dell’antibiotic stewardship e del concetto “One Health”.
Sintesi dell’Importanza
Gli SRM hanno trasformato la piodermite canina, un’affezione un tempo banale, in una malattia potenzialmente cronica, difficile da trattare e costosa. L’importanza dello SPIRM non risiede in una virulenza aumentata, ma nella sua capacità di sfuggire alle nostre terapie di prima linea, comportando fallimenti terapeutici, morbidità prolungata e un rischio aumentato di trasmissione. La persistenza della colonizzazione dopo la guarigione clinica crea serbatoi silenziosi che perpetuano il ciclo dell’infezione e della contaminazione. Inoltre, il potenziale zoonotico, benché variabile secondo le specie di stafilococchi, pone la gestione di queste infezioni all’incrocio tra la medicina veterinaria e la salute pubblica.
Principi dell’Antibiotic Stewardship
La lotta contro la propagazione della resistenza agli antimicrobici passa inevitabilmente attraverso un uso più responsabile e giudizioso degli antibiotici. L’antibiotic stewardship è un approccio coordinato volto a promuovere l’uso appropriato degli antimicrobici per migliorare i risultati per i pazienti, minimizzando al contempo le conseguenze involontarie. In dermatologia veterinaria, questo si traduce in azioni concrete:
- Privilegiare la terapia topica: Elevare la terapia topica al rango di trattamento di prima intenzione per tutte le piodermiti superficiali.
- Diagnosticare prima di trattare: Utilizzare sistematicamente la citologia per confermare l’infezione e riservare l’antibioticoterapia sistemica ai casi dove è assolutamente necessaria.
- Trattare sulla base di prove: Fondare la scelta di qualsiasi antibiotico sistemico sui risultati di un antibiogramma.
- Trattare la causa, non solo il sintomo: Identificare e gestire rigorosamente la malattia sottostante per prevenire le recidive.
- Rispettare i protocolli: Utilizzare la dose giusta, la durata giusta e la via di somministrazione giusta.
L’Imperativo di un Approccio “One Health”
Il problema dello SPIRM in dermatologia canina è un microcosmo della crisi mondiale dell’antibiotico-resistenza. Illustra perfettamente perché un approccio compartimentato è destinato al fallimento. La resistenza agli antimicrobici è un problema che non conosce frontiere tra le specie o gli ecosistemi. L’uso di antibiotici in un cane in una clinica veterinaria può avere ripercussioni che si estendono alla salute delle persone nel suo nucleo familiare. Un approccio “One Health” efficace necessita di una collaborazione attiva tra i medici, i veterinari, e i responsabili della salute pubblica per mettere in atto una sorveglianza integrata della resistenza, armonizzare le linee guida, educare il pubblico e promuovere la ricerca.
Prospettive Future
Il futuro della gestione degli SRM in dermatologia veterinaria dipenderà dalla nostra capacità di integrare pienamente questi principi nella pratica quotidiana. Gli assi di sviluppo futuro includono il rinforzo della sorveglianza epidemiologica, lo sviluppo e la validazione di nuove strategie terapeutiche non antibiotiche, e il miglioramento continuo dell’educazione. Gli assi di ricerca futuri devono orientarsi verso diversi fronti complementari:
- Sviluppo di terapie alternative: La ricerca deve intensificarsi per sviluppare e validare approcci “post-antibiotici“. Questi includono l’uso di batteriofagi (virus uccisori di batteri), di peptidi antimicrobici, di estratti di piante, di enzimi che lisano la parete batterica (endolisine), o di molecole che prendono di mira i fattori di virulenza piuttosto che la crescita batterica.
- Ottimizzazione dell’antibiotic stewardship: Sistemi di sorveglianza epidemiologica robusti e continui sono necessari per seguire in tempo reale l’evoluzione dei cloni di SPIRM e dei loro profili di resistenza su scala locale e nazionale.
- Comprensione della transizione commensale-patogeno: Una migliore comprensione dei fattori che scatenano il passaggio di S. pseudintermedius da uno stato di commensale innocuo a quello di un agente infettivo è una via di ricerca promettente per prevenire l’incidenza delle infezioni.
La sfida è di dimensioni considerevoli, ma un approccio proattivo, collaborativo e fondato sulla scienza può permetterci di preservare l’efficacia dei nostri antimicrobici e di proteggere la salute dei nostri pazienti animali e della comunità umana nel suo insieme.
Riferimenti
- Frank, L. A., & Loeffler, A. (2012). Meticillin-resistant Staphylococcus pseudintermedius: clinical challenge and treatment options. Veterinary Dermatology, 23(4), 283-e56.
- van Duijkeren, E., Catry, B., Greko, C., Moreno, M. A., Pomba, C., Pyörälä, S., Ružauskas, M., Sanders, P., Threlfall, E. J., & Torren-Edo, J. (2011). Review on methicillin-resistant Staphylococcus pseudintermedius. Journal of Antimicrobial Chemotherapy, 66(12), 2705-2714.
- Morris, D. O., Boston, R. C., O’Shea, K., & Rankin, S. C. (2010). The prevalence of carriage of meticillin-resistant staphylococci by veterinary dermatology practice staff and their respective pets. Veterinary Dermatology, 21(4), 400-407.
- Cohn, L. A., & Middleton, J. R. (2010). A veterinary perspective on methicillin-resistant staphylococci. Journal of Veterinary Emergency and Critical Care, 20(1), 31-45.
- Duquette, R. A., & Nuttall, T. J. (2004). Methicillin-resistant Staphylococcus aureus in dogs and cats: an emerging problem? Journal of Small Animal Practice, 45(12), 591-597.
- Papich, M. G. (2023). Antimicrobial agents in small animal dermatology for treating staphylococcal infections. Journal of the American Veterinary Medical Association, 261(S1), S130-S139.
- Griffeth, G. C., Morris, D. O., Abraham, J. L., Shofer, F. S., & Rankin, S. C. (2008). Screening for skin carriage of methicillin-resistant coagulase-positive staphylococci and Staphylococcus schleiferi in dogs with healthy and inflamed skin. Veterinary Dermatology, 19(3), 142-149.
- Lilenbaum, W., et al. (2024). Nationwide analysis of methicillin-resistant staphylococci in cats and dogs: resistance patterns and geographic distribution. American Journal of Veterinary Research.
- Pomba, C., Rantala, M., Greko, C., Baptiste, K. E., Catry, B., van Duijkeren, E., Mateus, A., Moreno, M. A., Pyörälä, S., Ružauskas, M., & Torren-Edo, J. (2017). Public health risk of antimicrobial resistance transfer from companion animals. Journal of Antimicrobial Chemotherapy, 72(4), 957-968.
- Hillier, A., Lloyd, D. H., Weese, J. S., Blondeau, J. M., Cossens, C., Guardabassi, L., Papich, M. G., & Frank, L. (2014). Recommendations for approaches to meticillin-resistant staphylococcal infections of small animals: diagnosis, therapeutic considerations and preventative measures. Veterinary Dermatology, 25(3), e39-e53.
- Ngassam, C. T., et al. (2025). Meglio trattare le piodermiti richiede di meglio riconoscerle e di saper rilevare le resistenze batteriche agli antibiotici. Le Nouveau Praticien Vétérinaire canine-féline.
- Gmyterco, V. C., Luciano, F. B., Ludwig, L. A., Evangelista, A. G., Ferreira, T. S., Borek, F., & de Farias, M. R. (2025). Comparative study of a commercial formula containing natural antimicrobials versus oral cephalexin or topical chlorhexidine-miconazole therapies for treating superficial pyoderma in dogs. Veterinary Dermatology.
- Perreten, V., Kadlec, K., Schwarz, S., Grönlund Andersson, U., Finn, M., Greko, C., Moodley, A., Kania, S. A., Frank, L. A., Bemis, D. A., Franco, A., Iurescia, M., Battisti, A., Duim, B., Wagenaar, J. A., van Duijkeren, E., Weese, J. S., & Guardabassi, L. (2010). Clonal spread of methicillin-resistant Staphylococcus pseudintermedius in Europe and North America: an international collaborative study. Journal of Antimicrobial Chemotherapy, 65(6), 1145-1154.
- Loeffler, A., & Lloyd, D. H. (2010). Companion animals: a reservoir for methicillin-resistant Staphylococcus aureus. Journal of Antimicrobial Chemotherapy, 65(4), 594-601.