L’espansione demografica spettacolare del Bulldog Francese nel corso dell’ultimo decennio ha, per un effetto di collo di bottiglia genetico e di selezione fenotipica estrema, esacerbato la prevalenza di disturbi dermatologici complessi. Panoramica delle principali dermatosi che li colpiscono e la loro gestione.
Particolarità anatomiche e genetiche del Bulldog Francese
Prevalenza della dermatite atopica e vulnerabilità razziale
Il Bulldog Francese occupa una posizione singolare in dermatologia veterinaria, non solo a causa della sua crescente popolarità nei paesi occidentali, ma soprattutto per la convergenza unica di fattori anatomici, genetici e immunologici che predispongono questa razza a uno spettro patologico dermatologico eccezionalmente ampio. I dati epidemiologici recenti rivelano una prevalenza di dermatite atopica che raggiunge il 15-20% in questa popolazione canina, ovvero un tasso tre volte superiore alla media inter-razziale. Questa vulnerabilità cutanea risulta da un’architettura corporale brachicefalica estrema associata ad anomalie genetiche documentate che interessano la coesione epidermica e la risposta immunitaria.
Impatto della conformazione brachicefalica sull’intertrigo
La conformazione brachicefalica del Bulldog Francese genera ripercussioni dermatologiche maggiori attraverso la creazione di molteplici zone di piegatura cutanea. L’accorciamento cranio-facciale, risultante in parte da una mutazione del gene BMP3, genera un eccesso di tessuto cutaneo facciale che si ripiega in pieghe profonde, in particolare a livello della regione naso-facciale, del solco inter-labiale e della zona peri-vulvare nella femmina. Questi microambienti anaerobici presentano un’umidità relativa superiore all’80%, una temperatura elevata di 2-3 gradi rispetto alle zone esposte, e un’occlusione permanente che favorisce la proliferazione microbica. La fisiopatologia dell’intertrigo che ne deriva si basa su una macerazione epidermica iniziale seguita da una rottura della barriera cutanea, permettendo la colonizzazione da parte di Staphylococcus pseudintermedius e lieviti del genere Malassezia. Il pH cutaneo in queste zone confinate si alcalinizza progressivamente, passando da 5,5 a 7,2, creando un terreno favorevole alla proliferazione batterica logaritmica.
Sovraespressione dei recettori delle citochine e via JAK-STAT
Il sistema immunitario cutaneo del Bulldog Francese presenta anche particolarità funzionali documentate. L’analisi trascrittomica di biopsie cutanee non lesionali in individui atopici di questa razza rivela una sovraespressione costitutiva dei geni che codificano per i recettori dell’interleuchina-31 (IL-31RA) e dell’Oncostatin M Receptor (OSMR), con livelli di mRNA superiori ai cani sani. Questa espressione aumentata predispone a un’attivazione esagerata della via di segnalazione JAK1/JAK2-STAT3 in presenza di concentrazioni anche fisiologiche di IL-31, citochina pruritogena maggiore prodotta dai linfociti T helper di tipo 2. Il complesso IL-31RA/OSMR eterodiimerico fosforila le tirosine chinasi JAK1 e JAK2, che attivano poi STAT3 per fosforilazione della sua tirosina 705, innescando la cascata trascrizionale del prurito. Questa ipersensibilità molecolare spiega l’intensità del prurito osservata clinicamente in questa razza, anche durante stimolazioni antigeniche minime.
Densità follicolare e carenza di sebo
La densità follicolare costituisce un’altra caratteristica anatomica che influenza la patologia dermatologica del Bulldog Francese. Gli studi istomorfometrici quantitativi rivelano una densità follicolare media più bassa rispetto alle razze a pelo lungo come il Barboncino o lo Yorkshire. Questa rarefazione follicolare si accompagna a una riduzione proporzionale della secrezione sebacea, essendo le ghiandole sebacee annesse meno voluminose. Il sebo canino, ricco di trigliceridi e acidi grassi liberi, partecipa attivamente alla difesa antimicrobica cutanea attraverso il suo effetto lipofilo sui patogeni e il suo ruolo nel mantenimento del pH acido di superficie. La carenza relativa di sebo nel Bulldog Francese altera questa prima linea di difesa e favorisce la colonizzazione da parte di microrganismi opportunisti.
Anomalie ultrastrutturali e lipidomiche dello strato corneo
L’architettura dello strato corneo presenta anche anomalie ultrastrutturali nei Bulldog Francesi atopici rispetto agli individui sani della stessa razza. Gli studi in microscopia elettronica a trasmissione rivelano uno spaziamento intercorneocitario allargato con lacune lipidiche all’interno delle lamelle extracellulari. L’analisi lipidomica mediante cromatografia liquida accoppiata alla spettrometria di massa dimostra una riduzione del 35-40% delle ceramidi a catene molto lunghe, in particolare le ceramidi di classe [NP] ed [EOS], essenziali per l’organizzazione lamellare del cemento intercorneocitario. Le ceramidi [EOS], caratterizzate da una sfingosina esterificata a un acido linoleico, svolgono un ruolo strutturale critico ancorando le lamelle lipidiche all’involucro corneo proteico. Il loro deficit compromette l’organizzazione architettonica dello strato corneo, aumentando la permeabilità agli allergeni ambientali e ai microrganismi.
Alterazione del rinnovamento epidermico e gene PROM1
La predisposizione genetica all’atopia nel Bulldog Francese coinvolge anche variazioni del gene PROM1, che codifica per la prominina-1, glicoproteina transmembranaria espressa nelle cellule staminali epidermiche. Una particolare variante di questo gene, identificata mediante sequenziamento di nuova generazione in 156 Bulldog Francesi atopici, si associa a un’alterazione del rinnovamento epidermico con una durata del ciclo cheratinocitario prolungata di 19 giorni in media contro 14-16 giorni nei cani sani. Questa cinetica epidermica rallentata perturba la maturazione terminale dei cheratinociti e la sintesi dei componenti della barriera, creando un circolo vizioso dove la disfunzione strutturale favorisce l’infiammazione, che a sua volta aggrava la perturbazione della differenziazione epidermica.
Deficit di peptidi antimicrobici e formazione di biofilm
La suscettibilità alle infezioni cutanee ricorrenti osservata in questa razza trova anche una spiegazione nell’espressione ridotta dei peptidi antimicrobici endogeni. Le beta-defensine canine, in particolare cBD1, cBD3 e cBD103, costituiscono una difesa innata essenziale contro i patogeni cutanei. Le analisi mediante RT-PCR quantitativa di biopsie cutanee di Bulldog Francesi atopici dimostrano un’espressione di cBD103 diminuita del 60% rispetto ai controlli sani, con livelli di mRNA medi di 0,4 unità relative contro 1,0. Questa immunità innata deficiente facilita l’insediamento di biofilm batterici organizzati, in particolare di Staphylococcus pseudintermedius, la cui eradicazione diventa progressivamente più difficile a causa della protezione matriciale conferita dalla struttura tridimensionale del biofilm.
Modulo 2: Disfunzione della barriera epidermica – Meccanismi molecolari
Modello architettonico “mattone e malta”
La barriera epidermica del Bulldog Francese presenta anomalie strutturali e funzionali che costituiscono il substrato fisiopatologico primario della sua vulnerabilità dermatologica. Questa barriera, situata nello strato corneo, si basa su un modello architettonico detto “mattone e malta” dove i corneociti rappresentano i mattoni e le lamelle lipidiche intercellulari formano la malta. Nel Bulldog Francese predisposto all’atopia, questo sistema subisce una disorganizzazione a più livelli molecolari, compromettendo la sua funzione di baluardo contro la penetrazione degli allergeni, la colonizzazione microbica e la perdita idrica trans-epidermica.
Ruolo centrale della filaggrina nella coesione epidermica
La filaggrina (proteina di aggregazione dei filamenti di cheratina) svolge un ruolo centrale nella formazione della barriera cutanea. Questa proteina di 400 kDa, codificata dal gene FLG, subisce una maturazione proteolitica complessa durante la differenziazione terminale cheratinocitaria. Nello strato granuloso, la profilaggrina viene defosforilata poi scissa da proteasi specifiche per generare monomeri di filaggrina funzionali. Questi monomeri aggregano i filamenti di cheratina in macrofibrille dense, contribuendo all’appiattimento dei corneociti e alla compattazione dello strato corneo. Nei Bulldog Francesi atopici, le analisi immunoistochimiche rivelano un’espressione ridotta di filaggrina, con un’intensità di marcatura diminuita del 45% rispetto ai controlli sani appaiati per età.
Fattori naturali di idratazione (NMF) e perdita d’acqua
La degradazione ulteriore della filaggrina genera fattori naturali di idratazione (NMF – Natural Moisturizing Factors) essenziali per il mantenimento dell’idratazione cornea. Gli enzimi peptidasi, in particolare le caspasi-14 e le bleomicina idrolasi, frammentano la filaggrina in aminoacidi liberi, tra cui istidina, serina e arginina. L’istidina viene poi deaminata dall’istidasi in acido urocanico trans, che possiede proprietà igroscopiche e fotoprotettive. L’arginina viene convertita in citrullina dalle peptilarginine deiminasi. Nel Bulldog Francese, la quantificazione mediante cromatografia liquida ad alta prestazione dello strato corneo dimostra una riduzione del 42% dei tassi di aminoacidi liberi e una diminuzione del 38% dell’acido urocanico rispetto alle razze non predisposte. Questa carenza di NMF provoca una disidratazione cronica dello strato corneo con un aumento misurabile della perdita insensibile d’acqua, passando da 12-15 g/m²/h nei cani sani a 28-35 g/m²/h negli atopici.
Alterazione delle giunzioni serrate (tight junctions)
Le giunzioni serrate (tight junctions) dello strato granuloso costituiscono un secondo livello di barriera epidermica, controllando la permeabilità paracellulare. Questi complessi proteici, composti principalmente da claudine (claudina-1, claudina-4), occludina e proteine zonula occludens (ZO-1, ZO-2), formano una rete anastomizzata creando una sigillatura intercellulare. Le analisi trascriptomiche di pelle atopica di Bulldog Francese rivelano una sottoespressione significativa dei geni CLDN1 e OCLN, che codificano rispettivamente per la claudina-1 e l’occludina, con riduzioni di espressione di mRNA di 2,1 e 1,7 volte. Questa alterazione delle giunzioni serrate permette una penetrazione facilitata degli allergeni di alto peso molecolare, normalmente esclusi da questa barriera selettiva, scatenando l’attivazione inappropriata del sistema immunitario cutaneo.
Perturbazione del metabolismo lipidico epidermico
Il metabolismo lipidico epidermico presenta anomalie quantitative e qualitative maggiori in questa razza. I lipidi dello strato corneo, sintetizzati nei cheratinociti dello strato granuloso e immagazzinati nei corpi lamellari di tipo Odland, vengono secreti per esocitosi nello spazio intercorneocitario. Questi lipidi comprendono tre classi principali: le ceramidi (50%), il colesterolo (25%) e gli acidi grassi liberi (10-15%), in un rapporto molare ottimale di 1:1:1 necessario per la formazione di lamelle ortorombiche impermeabili. Nel Bulldog Francese atopico, le analisi mediante cromatografia in fase gassosa accoppiata alla spettrometria di massa dimostrano una perturbazione del rapporto lipidico, con una riduzione relativa delle ceramidi al 38% e un aumento compensatorio del colesterolo al 35%, alterando la cristallinità lamellare e aumentando la permeabilità.
Importanza delle ceramidi di classe [EOS]
Le ceramidi, sfingolipidi complessi composti da una sfingosina legata a un acido grasso tramite un legame amidico, si suddividono in 12 classi secondo la natura della loro base sfingoide e del loro acido grasso. Le ceramidi di classe [EOS] (acilceramidi contenenti un’esterificazione linoleato) sono particolarmente critiche per l’impermeabilità cutanea. La loro biosintesi coinvolge una cascata enzimatica comprendente la serina palmitoyltransferasi, le ceramide sintasi (in particolare CerS3 per gli acidi grassi ultra-lunghi), e la glucosilceramide-beta-glucosidasi che idrolizza le glucosilceramidi in ceramidi libere. Studi in Western blot su estratti proteici epidermici di Bulldog Francesi atopici rivelano un’espressione ridotta di CerS3 del 52% rispetto ai controlli, correlando con la diminuzione delle ceramidi a catene carboniose molto lunghe (C28-C32).
Attività della beta-glucocerebrosidasi (GBA)
L’enzima beta-glucocerebrosidasi (GBA), localizzato nei corpi lamellari, catalizza la fase terminale di conversione delle glucosilceramidi in ceramidi funzionali al momento della secrezione nello spazio extracellulare. Una deficienza di questo enzima, documentata in alcuni cani atopici, provoca un accumulo di precursori glicosilati non funzionali e un deficit di ceramidi mature. L’attività enzimatica della GBA, misurata per fluorometria su omogenati di strato corneo di Bulldog Francese, risulta ridotta del 38% in media nei soggetti atopici, suggerendo una perturbazione del processo di maturazione lipidica post-secretoria.
Ruolo della sfingomielina deacilasi (SMase)
La sfingomielina deacilasi (SMase), nota anche come ceramidasi alcalina, regola l’omeostasi delle ceramidi catalizzando la loro idrolisi. Un equilibrio delicato tra sintesi e degradazione delle ceramidi determina la loro concentrazione tissutale. Nel Bulldog Francese, studi enzimatici suggeriscono un’iperattività relativa di certe ceramidasi, contribuendo alla deplezione ceramidica osservata. L’espressione genica di ASAH2, che codifica per la ceramidasi neutra, è aumentata di 1,6 volte nella pelle lesionale atopica, favorendo un catabolismo ceramidico eccessivo che aggrava la disfunzione della barriera.
Deficit di acidi grassi liberi e acido linoleico
Gli acidi grassi liberi dello strato corneo, principalmente l’acido linoleico (C18:2 ω-6), l’acido oleico (C18:1 ω-9) e l’acido palmitico (C16:0), partecipano attivamente all’organizzazione lamellare e possiedono proprietà anti-infiammatorie intrinseche. L’acido linoleico, acido grasso essenziale, si incorpora nelle ceramidi [EOS] tramite esterificazione del residuo ω-idrossiaceramide. La sua carenza alimentare o metabolica provoca la sua sostituzione con l’acido oleico, creando ceramidi [EOO] strutturalmente anormali che perturbano l’organizzazione lamellare. Le analisi lipidomiche comparative rivelano che il 23% dei Bulldog Francesi atopici presenta un rapporto linoleico/oleico inferiore a 2,5 nello strato corneo, soglia al di sotto della quale la funzione barriera si deteriora significativamente.
Iperattivazione della calpaina-1 e degradazione desmosomiale
La calpaina-1, proteasi calcio-dipendente, regola la proteolisi controllata della desmogleina-1 e della corneodesmotsina, proteine di adesione intercorneocitaria. Questa proteolisi fisiologica permette la desquamazione ordinata dello strato corneo. Tuttavia, in un contesto infiammatorio, l’iperattivazione della calpaina-1 da parte delle citochine Th2, in particolare IL-4 e IL-13, accelera la degradazione desmosomiale prematura, creando micro-fissure nello strato corneo. Nel Bulldog Francese atopico, l’attività enzimatica della calpaina-1, misurata mediante substrati fluorogenici, risulta aumentata di 2,8 volte nella pelle lesionale, correlando con una desquamazione patologica e un aggravamento della permeabilità.
Fragilità dell’involucro corneo
L’involucro corneo, struttura proteica altamente reticolata formata sotto la membrana plasmatica dei corneociti, costituisce uno scheletro architettonico essenziale. La sua formazione coinvolge la transglutaminasi-1 epidermica che catalizza la formazione di legami isopeptidici tra le proteine precursori (loricrina, involucrina, piccole proteine ricche di prolina). La loricrina rappresenta il 70-80% della massa proteica dell’involucro. Le analisi biochimiche di corneociti isolati di Bulldog Francese atopico rivelano una reticolazione deficiente dell’involucro, con una resistenza meccanica ridotta del 35% misurata mediante test di trazione micromeccanici. Questa fragilità strutturale favorisce la frammentazione prematura dei corneociti e la formazione di brecce nella barriera.
Modulo 3: Dermatite atopica – Epidemiologia e patogenesi razziale
Dermatite atopica iniziale in un Bulldog francese
Caratteristiche generali della dermatite atopica canina
La dermatite atopica canina rappresenta la patologia dermatologica più frequente nel Bulldog Francese, colpendo tra il 15 e il 20% della popolazione razziale secondo gli studi epidemiologici europei e nordamericani. Da sfumare tuttavia con certi bias di reclutamento. Questa dermatosi infiammatoria cronica recidivante si caratterizza per un prurito intenso, una distribuzione lesionale stereotipata e un’evoluzione clinica caratterizzata da episodi acuti intervallati da remissioni parziali. La patogenesi complessa di questa affezione coinvolge un’interazione tra una predisposizione genetica poligenica, una disfunzione primaria della barriera epidermica, una deregolazione immunitaria con polarizzazione Th2 eccessiva, e fattori ambientali scatenanti inclusi allergeni aerotrasmessi e alimentari.
Cronologia e precocità dei segni clinici
L’età di esordio delle manifestazioni cliniche nel Bulldog Francese si situa tipicamente tra 6 mesi e 3 anni, con un picco di incidenza tra 12 e 18 mesi. Uno studio retrospettivo su 487 Bulldog Francesi atopici dimostra che il 62% dei casi si manifesta prima dell’età di 24 mesi, e l’89% prima dei 4 anni. Questa precocità di comparsa contrasta con certe razze come il Pastore Tedesco dove i segni possono iniziare più tardivamente. L’espressione clinica iniziale si caratterizza frequentemente per un prurito facciale isolato, che interessa il perioculare, il padiglione auricolare e le commessure labiali, evolvendo progressivamente verso una generalizzazione con interessamento podale, ascellare e ventrale su un periodo di 6-18 mesi. Il punteggio CADESI-4 (Canine Atopic Dermatitis Extent and Severity Index), che valuta l’eritema e le lesioni su 20 siti anatomici, rivela valori medi di 35-45 nei Bulldog Francesi non trattati, rispetto a 25-30 per altre razze atopiche, testimoniando una gravità clinica aumentata.
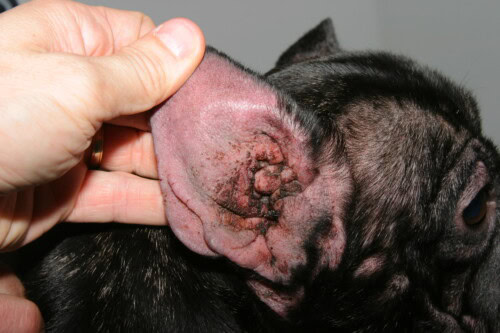
Otite di origine atopica
Particolarità della distribuzione lesionale e ipermastocitosi
La distribuzione lesionale in questa razza presenta certe particolarità rispetto al pattern classico della dermatite atopica. Se l’interessamento delle zone classiche (viso, orecchie, spazi interdigitali, pieghe ascellari e inguinali) rimane costante, il Bulldog Francese sviluppa frequentemente lesioni gravi a livello delle pieghe facciali e del solco naso-labiale, dove la macerazione aggrava l’infiammazione atopica sottostante.
La Scoperta Maggiore della Variante SLAMF1
La recente scoperta di una variante genetica maggiore associata alla dermatite atopica canina costituisce un progresso considerevole nella comprensione dei meccanismi sottostanti alle predisposizioni dermatologiche del Bulldog francese. Uno studio di associazione pangenetica condotto su più di 28.000 cani genotipizzati tramite chip a polimorfismi nucleotidici di densità media ha identificato un segnale statisticamente significativo sul cromosoma 38 canino, particolarmente intenso nel Bulldog francese. Il sequenziamento completo del genoma di casi e controlli ha rivelato una variante di splicing al sito donatore nel gene SLAMF1, che codifica per la molecola di attivazione dei linfociti di segnalazione di tipo 1, designata anche CD150. La mutazione SLAMF1 altera il sito donatore di splicing altamente conservato a valle dell’esone 4, provocando l’utilizzo di un sito criptico e l’aggiunta aberrante di 41 paia di basi all’esone 4. Questa modificazione genera una proteina troncata con 83 aminoacidi aberranti prima della terminazione precoce, sopprimendo così la coda citoplasmatica di SLAMF1 inclusi i motivi funzionali ITSM essenziali per il legame dei ligandi di segnalazione cellulare.
La prevalenza di questa variante è particolarmente allarmante nel Bulldog Francese. I dati indicano che questa variante è presente nel 71% degli individui della razza, contro il 40% nei Boxer, suggerendo una fissazione genetica involontaria legata alla selezione razziale. L’impatto clinico è diretto e quantificabile: la presenza di questa variante aumenta significativamente il rischio di sviluppare una dermatite atopica canina (DAC). Le analisi del rischio relativo mostrano che i cani portatori di una copia della variante hanno un rischio aumentato di 1,89 volte, mentre gli omozigoti per la variante vedono il loro rischio moltiplicato per 3,57.
Il recettore SLAMF1, espresso sulla superficie dei linfociti T, B, NK e delle cellule dendritiche, svolge un ruolo regolatorio critico nelle risposte immunitarie. La distruzione della coda citoplasmatica impedisce il legame della proteina adattatrice SAP e inibisce la formazione del complesso ternario SLAM-SAP-Fyn-SH3, cascata di segnalazione coinvolta nella modulazione della produzione di citochine infiammatorie dalle cellule dendritiche derivate dai monociti. L’ipotesi patogenica si basa su una deregolazione delle risposte infiammatorie conseguenti agli stimoli allergenici, le interazioni SLAM-SLAM omotiipiche inibendo normalmente la produzione di citochine pro-infiammatorie indotta da CD40. La frequenza allelica della variante SLAMF1 si stabilisce a 0,082 nel database Dog10k e si rivela particolarmente elevata o addirittura fissata in certe linee di Bulldog francesi, Boxer e Boston Terrier. L’analisi del modo di eredità e il calcolo degli odds ratio dimostrano che questa variante conferisce un rischio moltiplicato per due di sviluppare una dermatite atopica, con un effetto dose-dipendente che suggerisce un modo di eredità dominante o additivo secondo le razze studiate.
Questa conferma molecolare valida l’osservazione clinica di un'”atopia razziale” grave. Il disfunzionamento di SLAMF1 potrebbe spiegare la tendenza della razza a sviluppare risposte infiammatorie sproporzionate agli allergeni ambientali, superando il semplice quadro dell’ipersensibilità a Dermatophagoides farinae per includere una deregolazione immunitaria intrinseca.
Patogenesi immunologica e polarizzazione Th2
La patogenesi immunologica della dermatite atopica nel Bulldog Francese coinvolge una cascata di eventi cellulari e molecolari iniziata dalla penetrazione transcutanea di allergeni ambientali attraverso la barriera epidermica deficiente. Le cellule di Langerhans epidermiche, cellule dendritiche presentanti antigeni, catturano gli allergeni e migrano verso i linfonodi drenanti dove attivano i linfociti T naive. In un contesto geneticamente predisposto, questa attivazione orienta preferenzialmente la differenziazione verso un fenotipo Th2, caratterizzato dalla produzione di interleuchine IL-4, IL-5, IL-13 e IL-31. L’IL-4 e l’IL-13 inducono lo switch isotipico dei linfociti B verso la produzione di immunoglobuline E (IgE) specifiche per allergeni, che si fissano sui recettori ad alta affinità FcεRI espressi dai mastociti e basofili cutanei.
Degranulazione mastocitaria e iperproduzione di IgE
La degranulazione mastocitaria IgE-dipendente, scatenata dalla riesposizione allergenica e dalla reticolazione delle IgE membranarie, libera una pletora di mediatori preformati e neoformati. I mediatori preformati includono istamina, triptasi, chimasi ed eparina, responsabili della vasodilatazione, dell’eritema e del prurito acuto. I mediatori neoformati, sintetizzati dopo attivazione cellulare, comprendono i leucotrieni (LTB4, LTC4) derivanti dal metabolismo dell’acido arachidonico tramite la 5-lipossigenasi, e le prostaglandine (PGD2) generate via cicloossigenasi-2.
Ruolo centrale dell’interleuchina-31 (IL-31) nel prurito
L’interleuchina-31, citochina pruritogena maggiore prodotta principalmente dai linfociti Th2 attivati, svolge un ruolo centrale nella fisiopatologia del prurito atopico. Questa citochina si lega a un complesso recettoriale eterodiimerico composto dall’IL-31RA e dall’OSMR, espresso costitutivamente sui neuroni sensitivi cutanei e sui cheratinociti. L’attivazione di questo complesso scatena la fosforilazione sequenziale delle chinasi JAK1, JAK2 e dei fattori di trascrizione STAT1, STAT3 e STAT5, inducendo l’espressione di geni pro-pruritici e pro-infiammatori. I dosaggi sierici di IL-31 nei Bulldog Francesi atopici rivelano concentrazioni medie di 485 pg/ml, significativamente superiori ai 125 pg/ml misurati nei cani sani, con una correlazione positiva (r=0,72, p<0,001) tra i tassi di IL-31 e l’intensità del prurito valutata mediante scala visiva analogica.
Amplificazione della risposta tramite TSLP
La thymic stromal lymphopoietin (TSLP), citochina epiteliale prodotta dai cheratinociti in risposta alle aggressioni meccaniche e alle proteasi allergeniche, amplifica la risposta Th2 attivando le cellule dendritiche verso un fenotipo pro-allergico. La TSLP induce l’espressione di OX40-ligand sulle cellule dendritiche, molecola co-stimolatrice essenziale per la differenziazione Th2. Le analisi trascriptomiche di pelle lesionale di Bulldog Francese atopico rivelano una sovraespressione di TSLP di 4,2 volte rispetto alla pelle sana, con livelli di mRNA correlanti con lo spessore dell’epidermide e il grado di acantosi. Questo circolo di amplificazione cheratinocita-dendrocita-linfocita T perpetua l’infiammazione cronica e la sensibilizzazione allergenica progressiva.
Reclutamento e impatto degli eosinofili tissutali
Gli eosinofili, granulociti effettori maggiori dell’infiammazione di tipo 2, si accumulano nel derma delle lesioni atopiche sotto l’influenza chemiotattica dell’IL-5, dell’eotassina (CCL11) e del RANTES (CCL5). Queste cellule liberano proteine cationiche granulari citotossiche, in particolare la proteina basica maggiore (MBP), la perossidasi eosinofila (EPO) e la proteina cationica eosinofila (ECP), che danneggiano i tessuti circostanti e amplificano l’infiammazione. I conteggi istologici di eosinofili dermici su biopsie di Bulldog Francese atopico mostrano densità medie di 215 cellule per millimetro quadrato, contro 15-25 nei controlli sani. Questa eosinofilia tissutale correla con la cronicità della malattia e la presenza di lesioni lichenificate.
Disbiosi del microbioma cutaneo
Il microbioma cutaneo dei Bulldog Francesi atopici presenta alterazioni profonde della sua composizione e diversità. Le analisi mediante sequenziamento 16S rRNA rivelano una disbiosi caratterizzata da una perdita di diversità alfa (indice di Shannon ridotto da 4,2 a 2,1) e un’espansione clonale di Staphylococcus pseudintermedius, la cui abbondanza relativa passa dal 5-10% nei cani sani al 45-65% nelle zone lesionali. Questa proliferazione stafilococcica non rappresenta una semplice colonizzazione opportunista ma partecipa attivamente alla patogenesi mediante produzione di esotossine ad attività superantigenica. Le enterotossine stafilococciche (SEA, SEB, SEC) attivano in modo policlonale i linfociti T indipendentemente dalla loro specificità antigenica, collegando il recettore T cell receptor (TCR) al complesso maggiore di istocompatibilità di classe II (MHC-II), amplificando massivamente la risposta infiammatoria.
Profilo di sensibilizzazione allergenica e polisensibilizzazione
La sensibilizzazione allergenica nel Bulldog Francese atopico segue un profilo caratteristico identificato mediante test intradermici e dosaggi di IgE specifiche. Uno studio multicentrico europeo su 842 Bulldog Francesi atopici rivela che il 78% presenta reazioni positive agli acari della polvere domestica (Dermatophagoides farinae, Dermatophagoides pteronyssinus), il 56% ai pollini di graminacee, il 48% alle muffe d’interno (Malassezia sympodialis, Aspergillus fumigatus) e il 34% agli allergeni epiteliali. La polisensibilizzazione, definita da almeno 5 reattività significative, riguarda il 67% degli individui, suggerendo un’iperreattività allergenica globale piuttosto che una sensibilizzazione monoallergenica. Questa polisensibilizzazione complica la gestione terapeutica e limita l’efficacia dell’immunoterapia specifica allergenica.
Modulo 4: Dermatosi delle pieghe e complicazioni infettive
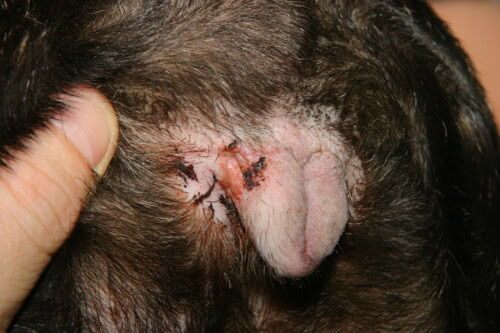
Intertrigo vulvare
Fisiopatologia dell’intertrigo
L’intertrigo o dermatite delle pieghe costituisce un’entità clinica quasi patognomonica del Bulldog Francese, risultante direttamente dalla sua conformazione brachicefalica estrema. Questa dermatosi infiammatoria si sviluppa nelle zone di piegatura cutanea dove l’apposizione permanente di due superfici epidermiche crea un microambiente occluso, caldo e umido, favorevole alla macerazione tissutale e alla proliferazione microbica. Le localizzazioni anatomiche privilegiate includono la piega naso-facciale, la piega del labbro inferiore, le pieghe vulvari nella femmina, e secondariamente le pieghe della coda quando questa è arrotolata a cavatappi. La fisiopatologia dell’intertrigo si basa su una cascata di eventi iniziata dall’attrito meccanico continuo tra le superfici cutanee opposte, generando un’infiammazione da contatto con liberazione di citochine pro-infiammatorie dai cheratinociti traumatizzati.
Conseguenze della macerazione e alcalinizzazione del pH
La macerazione epidermica, processo centrale della patogenesi dell’intertrigo, risulta dall’accumulo di secrezioni lacrimali, salivari e sebacee nello spazio confinato della piega. L’umidità relativa in queste zone raggiunge l’85-95%, favorendo l’idratazione eccessiva dello strato corneo che perde la sua coesione strutturale. Le misure di pH cutaneo mediante elettrodo di superficie rivelano una alcalinizzazione progressiva del microambiente delle pieghe, con valori che passano da 5,5 nelle zone cutanee esposte a 7,0-7,5 nelle pieghe profonde. Questa elevazione del pH inattiva parzialmente gli enzimi proteolitici dello strato corneo, normalmente attivi in ambiente acido, perturbando la desquamazione fisiologica e favorendo l’accumulo di detriti cellulari. L’alcalinizzazione modifica anche la composizione del film lipidico di superficie, riducendo la sua attività antimicrobica naturale e creando un terreno favorevole alla colonizzazione batterica e fungina.
Sequenza di colonizzazione microbica
La colonizzazione microbica delle pieghe macerate segue una sequenza prevedibile, iniziando con un’espansione della flora commensale residente, principalmente Staphylococcus pseudintermedius e lieviti Malassezia pachydermatis, che evolvono verso uno stato patogeno opportunista. I conteggi microbiologici quantitativi mediante tecnica di tampone standardizzato rivelano cariche batteriche medie di 10^6 – 10^7 unità formanti colonie per centimetro quadrato nelle pieghe infiammate, contro 10^3 – 10^4 UFC/cm² sulla pelle sana adiacente. Staphylococcus pseudintermedius, cocco gram-positivo produttore di coagulase, secerne una batteria di enzimi e tossine che favoriscono la sua invasione tissutale, in particolare lipasi, proteasi, nucleasi e la proteina A stafilococcica che inibisce l’opsonizzazione mediante legame al frammento Fc delle immunoglobuline. La transizione da commensale a patogeno si accompagna a una modificazione del profilo genomico batterico con sovraespressione di fattori di virulenza regolati dal sistema quorum sensing agr (accessory gene regulator).
Classificazione e diagnosi delle piodermiti superficiali
Le piodermiti superficiali rappresentano l’evoluzione naturale dell’intertrigo non trattato o cronico nel Bulldog Francese. Queste infezioni cutanee batteriche si caratterizzano per un’infiltrazione neutrofila del derma superficiale con formazione di pustole intra-epidermiche o sotto-cornee. La classificazione anatomica distingue l’impetigine (interessamento degli strati superficiali dell’epidermide), la follicolite superficiale (infezione del terzo superiore del follicolo pilifero) e la piodermite superficiale diffusa. Nel Bulldog Francese, la follicolite batterica superficiale si manifesta clinicamente con papule eritematose centrate da una pustola, evolvendo in collaretti epidermici dopo rottura pustolosa. Le zone glabre o a pilosità rada come la regione ascellare e inguinale sono preferenzialmente colpite. L’esame citologico mediante apposizione di vetrino rivela una popolazione neutrofila degenerata con fagocitosi di cocchi disposti a grappoli (stafilococchi) nel 92% dei casi, confermando l’origine batterica dell’infezione.
Problematica degli stafilococchi resistenti (MRSP)
La resistenza agli antibiotici di Staphylococcus pseudintermedius costituisce una problematica crescente in dermatologia veterinaria del Bulldog Francese, razza che riceve frequentemente antibioterapie iterative per le sue infezioni cutanee ricorrenti. I ceppi resistenti alla meticillina (MRSP – Methicillin-Resistant Staphylococcus pseudintermedius) sono emersi dagli anni 2000, acquisendo il gene mecA che codifica per una proteina di legame alla penicillina modificata (PBP2a) a bassa affinità per le beta-lattamine. Uno studio di prevalenza condotto in 28 cliniche veterinarie francesi rivela un tasso di portatori MRSP del 18% nei Bulldog Francesi che consultano per dermatite, contro l’8% in media per tutte le razze. Questi ceppi MRSP presentano frequentemente una multiresistenza, associando resistenza ai fluorochinoloni (mutazioni nei geni gyrA e parC che codificano per la DNA girasi e la topoisomerasi IV), ai macrolidi (acquisizione del gene ermB) e agli aminoglicosidi, limitando drasticamente l’arsenale terapeutico disponibile.
Persistenza tramite biofilm batterici
I biofilm batterici, strutture tridimensionali complesse dove i batteri si organizzano in comunità incapsulate in una matrice extracellulare di polisaccaridi, proteine e DNA extracellulare, rappresentano un meccanismo di persistenza maggiore delle infezioni cutanee croniche. Staphylococcus pseudintermedius produce un polisaccaride di adesione intercellulare (PIA) codificato dall’operone icaADBC, permettendo l’adesione batterica ai corneociti e la formazione di un’architettura biofilm matura. I batteri sessili del biofilm presentano una tolleranza antimicrobica aumentata di 100-1000 volte rispetto alle forme planctoniche libere, risultante da diversi meccanismi: penetrazione limitata degli antibiotici attraverso la matrice polimerica, microambiente nutrizionale sfavorevole che induce un rallentamento metabolico batterico, ed espressione di geni di resistenza specifici del biofilm. La microscopia confocale di biopsie cutanee di Bulldog Francesi con piodermite cronica recidivante rivela la presenza di biofilm organizzati nel 68% dei casi, spiegando la difficoltà di eradicazione mediante antibioterapia convenzionale.
Dermatite piotraumatica (hot spot)
La dermatite piotraumatica, comunemente chiamata hot spot o dermatite umida acuta, costituisce una complicazione frequente nel Bulldog Francese atopico. Questa lesione eritematosa essudativa a evoluzione fulminante risulta da un’automutilazione intensa scatenata da prurito localizzato, spesso di origine allergica o parassitaria. Il leccamento e il grattamento compulsivi creano un’erosione epidermica rapidamente colonizzata dalla flora cutanea opportunista, principalmente Staphylococcus pseudintermedius. La liberazione di mediatori infiammatori, in particolare il peptide antimicrobico LL-37 che possiede paradossalmente proprietà chemiottattiche per i neutrofili, recluta massivamente questi granulociti e amplifica l’infiammazione locale. L’essudato siero-purulento abbondante macera i peli adiacenti, creando una placca alopecica umida maleodorante di 3-10 centimetri di diametro, tipicamente localizzata sulle regioni ad alta densità di follicoli piliferi come la regione temporale, pre-auricolare o la groppa.
Complicazioni da lieviti Malassezia
Le infezioni da Malassezia rappresentano una complicazione frequente dell’intertrigo e della dermatite atopica nel Bulldog Francese. Questi lieviti lipofili commensali del genere Malassezia, principalmente M. pachydermatis (specie non lipido-dipendente) e M. sympodialis, proliferano in modo opportunista negli ambienti caldi, umidi e lipidici delle pieghe cutanee. La patogenesi della dermatite da Malassezia coinvolge un’interazione complessa tra proliferazione fungina quantitativa e reattività immunologica dell’ospite. Alcuni cani sviluppano un’ipersensibilità di tipo I e IV agli antigeni di Malassezia, mediata rispettivamente da IgE specifiche e una risposta cellulare a mediazione linfocitaria T. I conteggi citologici mediante tecnica dello Scotch-test rivelano densità di lieviti superiori a 10 organismi per campo microscopico ad alto ingrandimento nelle zone colpite, contro meno di 2 organismi nei portatori asintomatici.
Otiti esterne e rimodellamento del condotto
Le otiti esterne, affezione quasi-costante nel Bulldog Francese atopico, risultano da un’estensione dell’infiammazione cutanea al condotto uditivo esterno, zona considerata come una piega cutanea modificata. La conformazione particolare dell’orecchio del Bulldog, con un condotto uditivo esterno corto, largo e a orientamento orizzontale, favorisce l’accumulo di cerume e la ritenzione di umidità. L’infiammazione allergica dell’epitelio del condotto provoca un’iperplasia delle ghiandole ceruminose con produzione di un cerume modificato, più viscoso e in quantità eccessiva, creando un substrato nutritivo ottimale per Malassezia pachydermatis. Le analisi citologiche di cerume di Bulldog Francesi con otite esterna rivelano una predominanza di Malassezia nel 76% dei casi, un’infezione batterica mista nel 18%, e un’infezione batterica pura solo nel 6%. La cronicità otitica induce progressivamente modificazioni strutturali irreversibili del condotto, con fibrosi, calcificazione della cartilagine auricolare e stenosi progressiva, potendo necessitare un intervento chirurgico di ablazione del condotto e osteotomia della bolla timpanica negli stadi terminali.
Modulo 5: Dermatite da Malassezia e piodermiti ricorrenti
Biologia di Malassezia pachydermatis
La dermatite da Malassezia costituisce un’entità clinica maggiore nel Bulldog Francese, sopravvenendo sia come complicazione di una dermatite atopica sottostante, sia come manifestazione di un’ipersensibilità primaria agli antigeni fungini. I lieviti del genere Malassezia rappresentano organismi commensali lipofili ubiquitari della pelle e delle mucose canine, con sette specie identificate nel cane di cui Malassezia pachydermatis rimane la più frequente. Questa specie presenta la particolarità unica di essere non lipido-dipendente per la sua coltura in vitro, contrariamente alle altre specie di Malassezia che richiedono un arricchimento lipidico del mezzo. La morfologia cellulare di M. pachydermatis si caratterizza per blastoconidi ovoidali a monopolari di 3-8 micrometri con un germogliamento unipolare, facilmente identificabili all’esame citologico dopo colorazione rapida tipo Diff-Quik o colorazione di Gram dove appaiono come cocchi violetti a blu a forma di arachide.
Meccanismi di transizione verso la patogenicità
La transizione da commensale a patogeno dei lieviti Malassezia coinvolge diversi meccanismi interconnessi. Gli studi di sequenziamento genomico completo di M. pachydermatis rivelano un genoma di 7,98 megabasi che codifica per un arsenale enzimatico comprendente lipasi, fosfolipasi e proteasi secrete che degradano i lipidi cutanei e le proteine strutturali epidermiche. Le lipasi idrolizzano i trigliceridi del sebo in acidi grassi liberi, alcuni dei quali come l’acido oleico possiedono proprietà irritanti e alterano ulteriormente la funzione barriera. Le fosfolipasi A2 secrete da Malassezia scindono i fosfolipidi delle membrane cheratinocitarie, generando acido arachidonico precursore dei mediatori pro-infiammatori prostaglandine e leucotrieni via le vie cicloossigenasi e lipossigenasi. Questa attività enzimatica pro-infiammatoria spiega come anche una colonizzazione quantitativamente moderata possa indurre un’infiammazione clinicamente significativa negli individui geneticamente predisposti.
Riconoscimento immunitario e infiammazione
Il riconoscimento immunitario degli antigeni di Malassezia da parte del sistema immunitario cutaneo costituisce un elemento patogenico centrale. Le cellule dendritiche dermiche ed epidermiche esprimono recettori di riconoscimento di pattern molecolari (PRR – Pattern Recognition Receptors), in particolare i Toll-like receptor TLR2 e TLR4, che riconoscono i componenti della parete fungina come i mannani e i beta-glucani. Questo riconoscimento scatena l’attivazione della via di segnalazione NF-κB con produzione di citochine pro-infiammatorie IL-1β, IL-6, IL-8 e TNF-α da parte dei cheratinociti e delle cellule immunitarie residenti. Nei Bulldog Francesi sensibilizzati, l’esposizione ripetuta agli antigeni di Malassezia induce una polarizzazione Th2 con produzione di IgE specifiche che si fissano sui recettori FcεRI dei mastociti cutanei. La riesposizione antigenica provoca allora una degranulazione mastocitaria rapida con liberazione di istamina, scatenando prurito ed eritema in pochi minuti.
Semiologia clinica della dermatite da Malassezia
Le manifestazioni cliniche della dermatite da Malassezia nel Bulldog Francese presentano una semiologia caratteristica. L’eritema intenso, che interessa preferenzialmente le zone intertriginose (pieghe facciali, spazi interdigitali, pieghe ascellari e inguinali), si accompagna a un prurito severo e a un odore rancido particolare risultante dalla degradazione lipidica da parte delle lipasi fungine. La pelle colpita presenta un aspetto lucente grasso con talvolta una desquamazione fine aderente. L’iperpigmentazione post-infiammatoria sopraggiunge rapidamente nelle zone di cronicità, conferendo un aspetto brunastro alla pelle inizialmente eritematosa. Gli spazi interdigitali, particolarmente nei soggetti atopici, diventano un sito di predilezione con eritema intenso, essudazione e formazione di cisti interdigitali secondarie all’infiammazione follicolare profonda. Il leccamento compulsivo delle zampe rappresenta frequentemente il primo segno di allarme, con una colorazione bruno-rossastra dei peli bianchi dovuta alle porfirine salivari, indicante un leccamento cronico.
Diagnosi citologica e soglie patologiche
La diagnosi citologica della dermatite da Malassezia si basa sulla dimostrazione di un numero anormalmente elevato di lieviti all’esame microscopico. Diverse tecniche di prelievo si rivelano utilizzabili: la tecnica di apposizione diretta mediante pressione di un vetrino sulla pelle eritematosa, il tampone seguito da rotolamento su vetrino, o il scotch-test particolarmente adatto agli spazi interdigitali e alle pieghe. Dopo colorazione rapida, il conteggio microscopico all’ingrandimento 1000 sotto immersione permette una semi-quantificazione. La soglia patologica rimane controversa, ma un consenso propone come significativa la presenza di più di 10 lieviti per campo microscopico in media su 10 campi, o più di 3-5 lieviti per campo nelle zone normalmente povere di Malassezia come il tronco. Nel Bulldog Francese, i conteggi citologici nelle zone lesionali rivelano frequentemente 25-50 organismi per campo, testimoniando una proliferazione massiva.
Problematica delle piodermiti ricorrenti
Le piodermiti ricorrenti rappresentano una problematica terapeutica maggiore nel Bulldog Francese, definita dalla comparsa di tre episodi o più di piodermite batterica su un periodo di 12 mesi. Questa ricorrenza risulta raramente da un fallimento del trattamento antibiotico dell’episodio iniziale, ma piuttosto dalla persistenza di fattori predisponenti sottostanti non controllati. Le cause sottostanti documentate nel Bulldog includono la dermatite atopica nel 68% dei casi, l’ipotiroidismo nell’8%, la sindrome di Cushing nel 3%, e i deficit immunitari rari. L’atopia non controllata crea un circolo vizioso dove l’infiammazione cronica, la disfunzione della barriera e il prurito con autotraumatismo perpetuano le condizioni favorevoli all’infezione batterica. Il riconoscimento e il trattamento di questa causa sottostante si rivelano imperativi per rompere il ciclo infettivo ricorrente.
Follicolite batterica profonda e furuncolosi
La follicolite batterica profonda, evoluzione potenziale di una follicolite superficiale non trattata o recidivante, raggiunge il segmento inferiore del follicolo pilifero e può estendersi al tessuto sottocutaneo sotto forma di furuncolosi. Questa infezione grave si caratterizza clinicamente per noduli eritematosi fermi, dolorosi alla palpazione, che possono evolvere verso l’ascessualizzazione con formazione di tragitti fistolosi drenanti un essudato emorragico o purulento. Le zone corporali con follicoli profondi come la regione del mento (follicolite mentoniera o acne canina), gli spazi interdigitali e i punti di pressione sono preferenzialmente colpite. L’esame istopatologico rivela una rottura della parete follicolare con liberazione del contenuto follicolare (batteri, cheratina, sebo) nel derma circostante, scatenando una reazione granulomatosa piogranulomatosa intensa centrata sui detriti cheratinici. La presenza di macrofagi epitelioidi, di cellule giganti multinucleate e di una fibrosi progressiva caratterizza questa infiammazione cronica.
Pododermatite e cisti interdigitali
La pododermatite, infiammazione dei cuscinetti plantari e degli spazi interdigitali, costituisce una localizzazione particolarmente problematica nel Bulldog Francese a causa della conformazione anatomica degli arti e del peso corporeo elevato su una superficie di appoggio ridotta. La pododermatite del Bulldog Francese presenta spesso un’eziologia multifattoriale combinando dermatite atopica, dermatite da Malassezia e piodermite batterica secondaria. Gli spazi interdigitali diventano eritematosi, edematosi e dolorosi, con formazione di bolle emorragiche e tragitti fistolosi nei casi gravi. Il leccamento compulsivo aggrava le lesioni mediante trauma meccanico ripetuto e inoculazione salivare continua. Le cisti interdigitali, noduli fluttuanti o fermi degli spazi interdigitali, risultano da una follicolite e furuncolosi profonda con formazione di ascessi incistati. L’esame citologico del contenuto cistico rivela tipicamente un’infiammazione piogranulomatosa con neutrofili degenerati, macrofagi attivati e materiale cheratinico, con o senza batteri visibili secondo lo stadio evolutivo.
Piodermite mucocutanea: erosioni e ulcerazioni
La piodermite mucocutanea, affezione dermatologica rara ma documentata nel Pastore Tedesco e sporadicamente riportata in altre razze tra cui il Bulldog Francese, si caratterizza per un’infiammazione erosiva e ulcerativa delle giunzioni mucocutanee, particolarmente labiale, nasale, perianale e genitale. Questa dermatosi presenta una fisiopatologia immunologica complessa coinvolgente una reazione di ipersensibilità agli antigeni batterici stafilococcici combinata a un deficit funzionale dei linfociti T soppressori. Le lesioni iniziano con un eritema e edema della giunzione mucocutanea, evolvendo rapidamente verso erosioni poi ulcerazioni superficiali dolorose con formazione di croste emorragiche. L’esame istopatologico rivela una dermatite lichenoide dell’interfaccia con degenerazione idropica dello strato basale, infiltrato linfoplasmacellulare perivascolare e apoptosi cheratinocitaria. La coltura batterica isola regolarmente Staphylococcus pseudintermedius, ma il miglioramento sotto antibioterapia rimane parziale e transitorio, necessitando frequentemente l’aggiunta di immunomodulatori.
Modulo 6: La demodicosi
Demodicosi giovanile
Una dermatosi parassitaria che non è scomparsa
La demodicosi canina risulta dalla proliferazione patologica eccessiva di acari commensali del genere Demodex, principalmente Demodex canis e più raramente Demodex injai, che colonizzano normalmente i follicoli piliferi e le ghiandole sebacee della pelle canina a basse densità. La trasmissione di Demodex canis avviene verticalmente dalla cagna ai cuccioli neonati per contatto diretto durante i primi giorni di lattazione, gli acari migrando dalle mammelle materne verso i follicoli piliferi del viso e degli arti anteriori dei neonati. Nella maggioranza dei cani, le popolazioni di acari rimangono in equilibrio omeostatico a densità inferiori alla soglia patologica durante tutta l’esistenza, mantenute sotto controllo dalle difese immunitarie innate e adattive locali. In una minoranza di individui, una rottura di questo equilibrio permette la proliferazione acariana eccessiva generando lesioni cutanee infiammatorie. Questa rottura omeostatica avviene sia per disfunzione immunitaria primaria geneticamente determinata nella demodicosi giovanile, sia per immunosoppressione secondaria acquisita nella demodicosi dell’adulto.
L’analisi epidemiologica britannica VetCompass condotta su 455.553 cani in cure veterinarie primarie durante l’anno 2013 rivela una prevalenza annuale globale dello 0,17% con intervallo di confidenza al 95% di 0,16-0,19% per la demodicosi nella popolazione canina generale. La distinzione per età dimostra una prevalenza dramaticamente superiore nei giovani con 0,48% e intervallo di confidenza di 0,45-0,52% per i cani di età inferiore ai 2 anni, rispetto allo 0,05% e intervallo di confidenza di 0,04-0,06% per i cani di età superiore ai 4 anni, rapporto illustrante che la demodicosi giovanile si verifica circa dieci volte più frequentemente della forma adulta. Tra i 702 casi per i quali l’età alla prima diagnosi era disponibile, l’età mediana si stabiliva a 7 mesi con intervallo interquartile di 4-13 mesi, il 72,4% dei casi erano di età inferiore a 1 anno, il 79,6% inferiore a 1,5 anni, l’81,6% inferiore a 2 anni e solo il 14,0% superiore ai 4 anni. Questa distribuzione di età conferma la predominanza massiva della presentazione giovanile della demodicosi canina nella pratica veterinaria primaria.
Il Bulldog francese manifesta una suscettibilità razziale significativa alla demodicosi giovanile con un odds ratio aggiustato di 5,07 e intervallo di confidenza di 3,37-7,63 rispetto ai cani incrociati nel modello multivariato includendo razza, peso relativo alla media razziale, età e status sesso-sterilizzazione con clinica veterinaria come effetto casuale. Questa predisposizione pone il Bulldog francese al sesto posto delle razze a rischio elevato dopo il Bulldog inglese con odds ratio di 11,26, lo Staffordshire Bull Terrier con odds ratio di 7,11, lo Shar-Pei cinese con odds ratio di 6,57, il Dogue de Bordeaux con odds ratio di 5,92 e il Carlino con odds ratio di 5,41. La prevalenza annuale grezza di demodicosi nel Bulldog francese di età inferiore ai 2 anni raggiunge l’1,88% con intervallo di confidenza di 1,30-2,73%, ovvero quattro volte la prevalenza osservata nei cani incrociati dello 0,37% e due-tre volte superiore a quella del Boxer. Notevolmente, nessun caso di demodicosi è stato identificato nei Bulldog francesi di età superiore ai 4 anni in questa coorte, suggerendo sia che gli individui presentanti una suscettibilità genetica manifestino la loro malattia precocemente sia che i Bulldog francesi colpiti da demodicosi giovanile siano principalmente guariti e non sviluppino forma ricorrente in età adulta.
L’appartenenza comune del Bulldog inglese, del Bulldog francese, dello Staffordshire Bull Terrier, del Dogue de Bordeaux e del Boxer allo stesso clade genetico identificato dalle analisi filogenetiche pangenomiche suggerisce fortemente una base genetica condivisa per la suscettibilità alla demodicosi giovanile. Questo clade, raggruppando le razze di tipo bulldog e bull terrier, condivide varianti genetiche ancestrali comuni risultanti da colli di bottiglia popolazionali storici e da selezione intensiva su caratteristiche morfologiche comuni incluse brachicefalia, corpo tozzo e temperamento. L’osservazione convergente di studi epidemiologici indipendenti americani e britannici che identificano le stesse razze di questo clade genetico tra le più predisposte rinforza l’ipotesi di un determinismo genetico sostanziale per la demodicosi giovanile. La natura precisa delle varianti causali, il loro modo di trasmissione e la loro penetranza rimangono tuttavia non chiariti. Il consenso attuale postula un modo di eredità poligenica complessa coinvolgente multipli loci a effetto moderato piuttosto che una mutazione monogenica Mendeliana, coerente con la variabilità fenotipica osservata all’interno delle cucciolate colpite.
Un disfunzionamento immunitario prima di tutto
La fisiopatologia della demodicosi giovanile coinvolge una disfunzione immunitaria specifica agli acari Demodex, i cani colpiti manifestando risposte immunitarie normali verso altri agenti patogeni. Le indagini immunologiche hanno rivelato perturbazioni quantitative e qualitative delle sottopopolazioni linfocitarie T nei cani demodectici. Uno studio funzionale dimostrava che i linfociti T di cani demodectici generalizzati presentavano una proliferazione blastica ridotta in risposta alla stimolazione con fitoemoagglutinina e concanavalina A rispetto ai controlli sani, suggerendo un deficit di reattività linfocitaria T. I rapporti delle sottopopolazioni linfocitarie CD4 positive e CD8 positive si rivelavano alterati con una proporzione ridotta di linfociti T ausiliari CD4 positivi. La produzione di citochine da parte dei linfociti stimolati manifestava uno squilibrio verso una polarizzazione Th2 con secrezione aumentata di interleuchina-4 e interleuchina-10 immunosoppressive a scapito dell’interferone-gamma e dell’interleuchina-2 pro-infiammatorie di tipo Th1, polarizzazione inadeguata per il controllo di un’infestazione parassitaria intrafollocolare necessitante una risposta cellulare citotossica robusta.
Una dermatosi molto pleomorfa
La presentazione clinica della demodicosi canina si declina secondo due classificazioni complementari. La classificazione per età distingue la forma giovanile che inizia tipicamente tra 3 e 18 mesi dalla forma adulta che compare dopo. La classificazione per estensione lesionale differenzia la forma localizzata, caratterizzata da meno di cinque lesioni focali di diametro inferiore a 2,5 centimetri con prognosi favorevole di risoluzione spontanea nel 90% dei casi senza trattamento acaricida, dalla forma generalizzata definita da più di cinque lesioni, interessamento di più di due regioni anatomiche, pododemodecosi che colpisce almeno due zampe, o lesioni estensive che coprono una superficie corporale totale superiore a quella di un arto. La demodicosi generalizzata necessita invariabilmente un trattamento acaricida sistemico e comporta una prognosi riservata. Le lesioni cutanee primarie consistono in alopecie non infiammatorie multifocali a coalescenti predominando inizialmente in regioni perioculari, commessure labiali, faccia interna dei padiglioni auricolari e arti, zone anatomiche dove la colonizzazione acariana iniziale dei cuccioli neonati è massimale.
Nelle forme complicate, frequenti nel Bulldog francese a causa della coesistenza abituale con dermatite atopica e pieghe cutanee, l’infestazione demodettica massiva rompe la barriera cutanea follicolare e favorisce le infezioni batteriche secondarie gravi. La follicolite poi furuncolosi batteriche a Staphylococcus pseudintermedius generano pustole, papule eritematose, croste, essudazione siero-purulenta e dolore locale intenso. Le forme profonde evolvono verso cellulite dermica e ipodermica con edema massivo, fistolizzazione, drenaggio purulento e adenomegalia satellite. Le pododermatiti demodettiche interdigitate, particolarmente frequenti e refrattarie, associano eritema violaceo, tumefazione degli spazi interdigitali, fistole drenanti, ipercheratosi palmoplantare e zoppia d’appoggio per dolore. La cronicità induce iperpigmentazione, lichenificazione, fibrosi dermica e alopecia cicatriziale irreversibile nei casi trascurati.
Una diagnosi rapida e semplice
La diagnosi di demodicosi si basa sull’identificazione microscopica di acari Demodex in numero anormale nei raschiati cutanei profondi. La tecnica standardizzata richiede compressione vigorosa di una piega cutanea tra pollice e indice per 10-15 secondi per espellere gli acari dal fondo dei follicoli piliferi, seguita immediatamente dal raschiamento perpendicolare al senso del pelo con una lama di bisturi precedentemente unta di olio minerale, proseguito fino al trasudamento capillare, garante di una profondità di prelievo sufficiente raggiungendo la giunzione dermo-epidermica. Il materiale raschiato viene trasferito su vetrino, coperto con un coprioggetti ed esaminato al microscopio a ingrandimenti 40x e 100x per contare acari adulti fusiformi, ninfe, larve esapodi e uova opercolate caratteristiche. Un minimo di cinque raschiamenti provenienti da siti lesionali distinti dovrebbe essere realizzato per massimizzare la sensibilità diagnostica. Il tricogramma, consistente nello strappo di multipli peli con pinzette seguito dal loro esame microscopico dopo montaggio tra vetrino e coprioggetti in olio, costituisce un’alternativa meno invasiva particolarmente utile per le localizzazioni perioculari e interdigitate difficili da raschiare.
La rivoluzione delle isoxazoline
I protocolli terapeutici della demodicosi canina sono stati rivoluzionati dall’avvento delle isoxazoline orali, classe farmacologica di ectoparassiticidi che modula i canali del cloro dipendenti da GABA e glutammato degli invertebrati, inducendo paralisi e morte degli artropodi parassiti.
La demodicosi dell’adulto, rara ma da non trascurare
La gestione della demodicosi adulta necessita imperativamente l’identificazione e il trattamento delle cause sottostanti di immunosoppressione. Le affezioni endocrine includenti ipotiroidismo, ipercorticismo spontaneo o iatrogeno, e diabete dovrebbero essere sistematicamente ricercate mediante dosaggi ormonali appropriati. Le neoplasie, particolarmente linfoma e mastocitoma, e le malattie autoimmuni sistemiche costituiscono altre cause di immunosoppressione favorenti la demodicosi adulta. I trattamenti immunosoppressivi includenti glucocorticoidi sistemici, ciclosporina e agenti chemioterapici devono essere interrotti se possibile.
Modulo 7: Approccio diagnostico multimodale
Metodologia clinica e sistema DAMN-IT
La diagnosi dermatologica nel Bulldog Francese necessita un approccio metodico integrando l’anamnesi dettagliata, l’esame clinico rigoroso e gli esami complementari mirati. La complessità del quadro dermatologico di questa razza, combinando frequentemente diverse patologie sovrapposte (atopia primaria, dermatite da Malassezia, piodermite secondaria, intertrigo), esige dal praticante una capacità di analisi sequenziale per identificare l’affezione primaria iniziale e le sue complicazioni secondarie. L’approccio diagnostico strutturato secondo il metodo DAMN-IT (Developmental, Allergic, Metabolic, Neoplastic, Inflammatory, Traumatic, Infectious, Immunologic) permette di elaborare una lista differenziale esaustiva prima di restringerla progressivamente per eliminazione o conferma diagnostica.
L’anamnesi: pilastro del ragionamento diagnostico
L’anamnesi costituisce la pietra angolare del ragionamento diagnostico in dermatologia. L’interrogatorio minuzioso del proprietario deve documentare diversi parametri temporali e contestuali essenziali. L’età di comparsa dei primi segni clinici orienta significativamente la diagnosi differenziale: un inizio precoce prima dei 6 mesi suggerisce una dermatosi congenita o ereditaria, mentre un inizio tra 6 mesi e 3 anni evoca fortemente una dermatite atopica. La stagionalità dei sintomi differenzia un’atopia stagionale legata ai pollini da un’atopia perenne indotta dagli acari della polvere o dagli allergeni alimentari. Il carattere pruriginoso dell’affezione, valutato mediante questionario standardizzato o scala visiva analogica, rappresenta un criterio diagnostico maggiore: un prurito sine materia (prurito senza lesione primaria visibile) orienta verso un’ipersensibilità allergica, mentre lesioni primarie senza prurito suggeriscono una dermatosi metabolica o neoplastica. L’ambiente di vita (urbano/rurale), il modo di alloggio (interno/esterno), l’esposizione ad altri animali e gli antecedenti di viaggi documentano il rischio di esposizione a ectoparassiti o agenti infettivi.
Esame clinico sistematico e otoscopia
L’esame clinico dermatologico del Bulldog Francese segue una metodologia sistematica iniziando con l’osservazione a distanza dello stato generale, del comportamento e dei segni di prurito (leccamento, mordicchiamento, sfregamento). L’esame ravvicinato valuta la distribuzione delle lesioni secondo uno schema anatomico standardizzato, distinguendo le lesioni primarie (macule, papule, pustole, vescicole, noduli) dalle lesioni secondarie (erosioni, ulcere, croste, squame, iperpigmentazione, lichenificazione). La palpazione apprezza l’ispessimento cutaneo, l’edema sottocutaneo e la sensibilità dolorosa delle zone colpite. L’esame delle mucose apparenti (congiuntivale, buccale, genitale) ricerca un’estensione delle lesioni alle giunzioni mucocutanee. L’ispezione otoscopica bilaterale valuta lo stato del condotto uditivo esterno e della membrana timpanica, l’otite esterna essendo presente nel 75-80% dei Bulldog Francesi atopici. La palpazione dei linfonodi regionali (sottomandibolari, pre-scapolari, poplitei) rileva una linfoadenopatia reattiva traducente un’infiammazione o infezione cutanea del territorio drenato.
Citologia cutanea: identificazione cellulare e microbica
L’esame citologico cutaneo rappresenta l’esame complementare di prima intenzione in dermatologia veterinaria, praticabile in consultazione senza equipaggiamento sofisticato. Diverse tecniche di prelievo si applicano secondo il tipo di lesione. La tecnica di apposizione diretta su vetrino si utilizza per le superfici eritematose o essudative. Il scotch-test, particolarmente adatto agli spazi interdigitali e alle pieghe, consiste nell’applicare un pezzo di nastro adesivo trasparente sulla zona da esaminare poi incollarlo su un vetrino. Il tampone seguito da rotolamento su vetrino permette di esplorare i condotti auricolari o le lesioni profonde. La puntura con ago sottile (citoaspirazione) dei noduli o cisti preleva il contenuto cellulare per analisi. Dopo asciugatura all’aria, i vetrini subiscono una colorazione rapida tipo Diff-Quik (equivalente del May-Grünwald-Giemsa) permettendo la differenziazione cellulare. L’esame microscopico all’ingrandimento 400 poi 1000 sotto immersione caratterizza la popolazione cellulare infiammatoria (neutrofili, eosinofili, macrofagi, linfociti), identifica i microrganismi (cocchi o bacilli batterici, lieviti Malassezia, dermatofiti rari) e rileva le cellule atipiche suggerenti una neoplasia.
Raschiamento cutaneo e diagnosi parassitaria
Il raschiamento cutaneo, esame parassitologico essenziale, ricerca gli acari responsabili di scabbie. Due tipi di raschiamenti si effettuano secondo la profondità ricercata. Il raschiamento superficiale, realizzato fino alla comparsa di un eritema leggero, rileva Sarcoptes scabiei, acaro responsabile della scabbia sarcoptica caratterizzata da prurito intenso refrattario. Il raschiamento profondo, proseguito fino al trasudamento capillare, mette in evidenza Demodex canis, acaro follicolare commensale che può proliferare durante la demodicosi. Benché il Bulldog Francese non figuri tra le razze a rischio elevato di demodicosi generalizzata (contrariamente allo Shar-Pei o al Bull Terrier), casi di demodicosi localizzata perioculare o delle labbra si verificano occasionalmente. Il materiale di raschiamento, trasferito su vetrino con una goccia di olio minerale o lattofenolo, viene esaminato al microscopio all’ingrandimento 100 poi 400. L’identificazione di adulti, larve, ninfe o uova di acari conferma la diagnosi parassitaria.
Tricoscopia: analisi del fusto pilifero e del ciclo
La tricoscopia o esame microscopico del pelo completa l’arsenale diagnostico per le alopecie. Un prelievo di peli mediante strappo delicato con pinza emostatica nelle zone alopeciche permette l’analisi del fusto pilifero e del bulbo. L’esame al microscopio a basso poi alto ingrandimento valuta la fase del ciclo pilifero (anagen con bulbo pigmentato e guaina epiteliale, telogen con bulbo a clava senza guaina), ricerca anomalie strutturali del fusto (trichorrhexis nodosa, trichomalacia) e identifica spore fungine in caso di dermatofitosi. Nel Bulldog Francese, l’alopecia risulta più spesso dal prurito con strappo meccanico dei peli (alopecia traumatica), e la tricoscopia rivela allora fusti piliferi fratturati alle estremità irregolari senza anomalia del bulbo, contrastando con le alopecie endocrine dove i peli si epilano facilmente con bulbi in telogen.
Test allergologici: IDT e dosaggi sierici di IgE
I test allergologici si indicano nel Bulldog Francese dopo conferma della diagnosi di dermatite atopica secondo i criteri di Favrot, per identificare gli allergeni coinvolti e considerare un’immunoterapia specifica. Due approcci complementari coesistono: i test intradermici (IDT) e i dosaggi sierici di IgE specifiche. Il test intradermico rappresenta il gold standard, iniettando per via intradermica al livello del torace tosato una batteria di allergeni standardizzati (acari, pollini, muffe, epiteliali) diluiti in una soluzione salina. La lettura dopo 15-20 minuti quantifica la reazione papulosa ed eritematosa rispetto ai controlli positivo (istamina) e negativo (soluzione fisiologica). Un risultato positivo si definisce da una papula di diametro superiore al 50% della reazione istaminica. I dosaggi sierologici di IgE allergene-specifiche mediante tecnica ELISA o immunoblot costituiscono un’alternativa meno invasiva, benché la loro sensibilità e specificità rimangano inferiori agli IDT. Una concordanza imperfetta esiste tra questi due metodi, con un accordo solo nel 60-70% dei casi, giustificando l’interpretazione clinica dei risultati piuttosto che la loro applicazione meccanica.
Regime di evizione e prova di provocazione alimentare
Il regime di evizione alimentare rappresenta l’unico test diagnostico affidabile per confermare o escludere un’ipersensibilità alimentare contributiva al quadro clinico. Questo regime consiste nell’alimentare esclusivamente il cane per 8-12 settimane con una fonte di proteine e glucidi ai quali l’animale non è mai stato esposto (regime a proteina nuova) o con un alimento idrolizzato le cui proteine frammentate in peptidi di basso peso molecolare (<10 kDa) perdono la loro allergenicità. L’osservanza stretta costituisce il fattore limitante maggiore di questo test, qualsiasi infrazione alimentare (dolciumi, avanzi di tavola, medicinali aromatizzati) invalidando il risultato. Un miglioramento clinico superiore al 50% del prurito e delle lesioni cutanee sotto regime evoca fortemente una componente alimentare. La conferma diagnostica necessita una prova di provocazione mediante reintroduzione dell’alimentazione anteriore, dovendo scatenare una ricaduta nei 7-14 giorni. Se la ricaduta si verifica, la reintroduzione progressiva di ingredienti individuali permette di identificare l’allergene o gli allergeni specifici responsabili.
Esame istopatologico e biopsie cutanee
L’esame istopatologico cutaneo, benché non specifico per la dermatite atopica, si indica durante presentazione clinica atipica, risposta terapeutica inadeguata o sospetto di processo neoplastico o autoimmune. Le biopsie cutanee al punch di 6-8 millimetri si effettuano sotto anestesia locale o generale, prelevando lesioni primarie rappresentative evitando le zone di cronicità estrema o sovrainfette. Il prelievo di lesioni a diversi stadi evolutivi e l’inclusione di un campione di pelle periferica sana ottimizzano l’informazione diagnostica. I campioni fissati in formalina tamponata al 10% subiscono un trattamento istotecnico standard con inclusione in paraffina, taglio e colorazione ematossilina-eosina. L’analisi microscopica da parte di un dermopatologo veterinario caratterizza l’architettura lesionale, il tipo e la distribuzione dell’infiltrato infiammatorio, e ricerca indizi eziologici. La dermatite atopica presenta tipicamente una dermatite perivascolare superficiale con infiltrato linfo-istiocitario ed eosinofilo, un’iperplasia epidermica (acantosi), un’ipercheratosi ortocheratosica e una spongiosi variabile secondo l’acuità lesionale.
Modulo 8: Strategie terapeutiche integrate e prospettive
Obiettivi di una gestione multimodale
La gestione terapeutica della dermatite atopica e delle complicazioni dermatologiche associate nel Bulldog Francese necessita un approccio multimodale e individualizzato combinando controllo delle infezioni secondarie, trattamento anti-infiammatorio e antipruriginoso, restauro della barriera cutanea, e gestione dei fattori ambientali. L’obiettivo terapeutico realistico mira non alla guarigione definitiva di questa dermatosi cronica, ma al controllo soddisfacente dei sintomi permettendo una qualità di vita accettabile per l’animale e il suo proprietario, con minimizzazione degli effetti collaterali e del costo economico a lungo termine. La strategia terapeutica evolve secondo la gravità iniziale, la risposta ai trattamenti e la presenza di comorbidità, necessitando rivalutazioni regolari e aggiustamenti posologici o molecolari.
Trattamento delle infezioni secondarie e antibioterapia
Il trattamento delle infezioni secondarie costituisce imperativamente la prima tappa terapeutica prima di valutare la risposta agli anti-infiammatori. Le piodermiti superficiali a Staphylococcus pseudintermedius sensibile alla meticillina rispondono generalmente a un’antibioterapia sistemica con cefalosporine di prima generazione (cefalexina 15-25 mg/kg per os due volte al giorno) o con amoxicillina-acido clavulanico (12,5-25 mg/kg per os due volte al giorno) per 21-28 giorni minimo, ovvero una settimana oltre la risoluzione clinica completa. Le piodermiti profonde o i ceppi MRSP necessitano antibioterapie prolungate di 6-8 settimane con molecole a spettro allargato: fluorochinoloni (enrofloxacina 5-10 mg/kg una volta al giorno, marbofloxacina 2,75-5,5 mg/kg una volta al giorno) dopo realizzazione di una coltura batterica con antibiogramma. La resistenza crescente impone un utilizzo ragionato degli antibiotici secondo le raccomandazioni di antibioterapia prudente, privilegiando i trattamenti topici quando possibile.
Uso degli antisettici topici e clorexidina
Gli antisettici topici rappresentano un’alternativa o un complemento prezioso all’antibioterapia sistemica, particolarmente per le infezioni localizzate o ricorrenti. La clorexidina, biguanide cationico ad ampio spettro battericida e fungicida, si utilizza in shampoo a concentrazione del 2-4% con un tempo di contatto di 10 minuti prima del risciacquo, a ragione di due-tre applicazioni settimanali. Il suo meccanismo d’azione si basa sulla disorganizzazione membranale batterica mediante legame ai fosfolipidi anionici. Gli studi clinici controllati dimostrano un’efficacia della clorexidina 3% paragonabile agli antibiotici sistemici per le piodermiti superficiali localizzate, con il vantaggio di evitare la selezione di resistenze sistemiche. Le formulazioni combinanti clorexidina e miconazolo (antifungino azolico) trattano simultaneamente le infezioni batteriche e da Malassezia, frequentemente intricate nel Bulldog Francese. Le salviettine impregnate di clorexidina facilitano l’antisepsi quotidiana delle pieghe facciali, prevenendo l’intertrigo.
Inibitori delle Janus chinasi
Gli inibitori delle Janus chinasi (JAK inhibitors) rappresentano un progresso terapeutico maggiore in dermatologia veterinaria dall’autorizzazione all’immissione in commercio dell’oclacitinib nel 2013 per il trattamento sintomatico del prurito atopico canino. L’oclacitinib, piccola molecola di sintesi somministrata per via orale, inibisce selettivamente le tirosina chinasi JAK1 e JAK3 (e in misura minore JAK2), bloccando così la trasduzione del segnale di multiple citochine pro-pruriginose e pro-infiammatorie di cui l’IL-31, l’IL-4, l’IL-13 e l’IL-2. Recentemente nuovi inibitori delle janus chinasi sono stati commercializzati, ovvero l’ilunocitinib (Zenrelia) e l’atinvicitinib (Numelvi), ciascuno presentando diversi vantaggi e svantaggi.
Lokivetmab: anticorpo monoclonale anti-IL-31
Il lokivetmab, anticorpo monoclonale canino caninizzato diretto specificamente contro l’interleuchina-31, costituisce un’alternativa bioterapeutica all’oclacitinib. Questo anticorpo terapeutico, prodotto mediante tecnologia ricombinante, neutralizza l’IL-31 circolante mediante legame ad alta affinità, impedendo la sua interazione con il complesso recettoriale IL-31RA/OSMR. La somministrazione si fa per via sottocutanea alla posologia di 1-2 mg/kg, con una durata d’azione prolungata di 4-8 settimane permettendo iniezioni mensili. Gli studi pivot di fase III rivelano una riduzione del prurito di più del 50% nel 79% dei cani trattati dopo la prima iniezione, con un ritardo d’azione mediano di 1,2 giorni. Il vantaggio maggiore del lokivetmab risiede nella sua specificità immunologica estrema, mirando unicamente l’IL-31 senza interferire con altre vie di segnalazione, minimizzando così gli effetti collaterali sistemici. La sua natura proteica di immunoglobulina canina limita il rischio di immunogenicità con formazione di anticorpi anti-farmaco, contrariamente alle proteine ricombinanti non caninizzate.
Ciclosporina e inibizione della calcineurina
La ciclosporina, immunomodulatore inibitore della calcineurina, rappresenta storicamente il primo trattamento sistemico validato per la dermatite atopica canina con autorizzazione all’immissione in commercio dal 2003. Questa molecola lipofila ciclica derivata dal fungo Tolypocladium inflatum inibisce l’attivazione dei linfociti T mediante blocco della fosfatasi calcineurina, impedendo la defosforilazione del fattore di trascrizione NFAT (Nuclear Factor of Activated T-cells) e la sua traslocazione nucleare. La cascata trascrizionale delle citochine pro-infiammatorie IL-2, IL-4, IL-5, IL-13 e TNF-α si trova così bloccata. La posologia iniziale di 5 mg/kg per via orale una volta al giorno, somministrata a digiuno per ottimizzare l’assorbimento, si prosegue per 4-6 settimane fino all’ottenimento di una risposta clinica soddisfacente, poi si riduce progressivamente alla dose minima efficace, spesso 2,5-5 mg/kg ogni 2-3 giorni in mantenimento. Gli effetti collaterali gastrointestinali (vomiti, diarrea, anoressia) sopraggiungono nel 20-30% dei cani, principalmente durante le prime settimane, e si attenuano generalmente spontaneamente o mediante somministrazione con un pasto leggero malgrado la riduzione dell’assorbimento.
Posto dei glucocorticoidi negli episodi acuti
I glucocorticoidi sistemici, anti-infiammatori potenti ad azione rapida, conservano un posto nel trattamento d’urgenza degli episodi acuti gravi malgrado i loro effetti collaterali a lungo termine. Il prednisolone o prednisone si somministra a dose anti-infiammatoria di 0,5-1 mg/kg per via orale una o due volte al giorno fino al controllo del prurito e dell’infiammazione (generalmente 7-14 giorni), seguito da una decrescita progressiva su 2-3 settimane poi svezzamento completo o transizione verso un trattamento alternativo. L’utilizzo cronico quotidiano di corticoidi provoca inevitabilmente una sindrome di Cushing iatrogena con poliuria-polidipsia, polifagia, amiotrofia, epatomegalia e immunosoppressione favorente le infezioni opportuniste. Uno schema alterno con somministrazione un giorno sì e uno no limita parzialmente la soppressione dell’asse ipotalamo-ipofisi-surrene. I corticoidi iniettabili ad azione prolungata (metilprednisolone acetato) sono formalmente sconsigliati in dermatologia a causa dell’impossibilità di aggiustamento posologico e del rischio aumentato di effetti collaterali gravi.
Ruolo degli emollienti e topici ristrutturanti
I topici emollienti e ristrutturanti della barriera svolgono un ruolo terapeutico adiuvante essenziale spesso sottovalutato. Le formulazioni arricchite in ceramidi fisiologiche, colesterolo e acidi grassi essenziali in rapporto equimolare mimante la composizione lipidica dello strato corneo restaurano parzialmente la funzione barriera deficiente. Uno studio clinico prospettico randomizzato controllato valutante uno spray ristrutturante contenente un complesso di ceramidi, acidi grassi e fitosfingosina in 60 cani atopici dimostra una riduzione significativa del punteggio CADESI del 42% dopo 8 settimane di applicazione biquotidiana, associata a una diminuzione della perdita insensibile d’acqua trans-epidermica del 38%. Gli shampoo terapeutici a base di avena colloidale, acidi grassi omega-6 e glicerina esercitano un effetto antipruriginoso e idratante immediato, con beneficio ottimale durante utilizzo bisettimanale con tempo di contatto di 10 minuti. Le formulazioni senza sapone (syndet o synthetic detergents) al pH fisiologico acido preservano il film lipidico cutaneo contrariamente agli shampoo alcalini convenzionali.
Immunoterapia specifica allergenica (desensibilizzazione)
L’immunoterapia allergenica specifica (desensibilizzazione o iposensibilizzazione) rappresenta l’unico trattamento potenzialmente modificatore della malattia atopica, mirando a indurre una tolleranza immunologica agli allergeni identificati piuttosto che semplicemente sopprimere i sintomi. Il protocollo classico per via sottocutanea inizia con una fase di induzione con iniezioni settimanali di estratti allergenici a concentrazioni crescenti su 16-20 settimane, seguita da una fase di mantenimento con iniezioni mensili proseguite per minimo 12 mesi, idealmente 2-3 anni. I meccanismi immunologici coinvolti includono la deviazione della risposta Th2 verso Th1, l’induzione di linfociti T regolatori producenti IL-10 e TGF-β immunosoppressivi, e lo switch isotipico della produzione di IgE verso IgG4 bloccanti. I tassi di successo riportati nella letteratura veterinaria variano considerevolmente secondo gli studi, con un miglioramento eccellente a buono nel 60-75% dei cani, un miglioramento moderato nel 15-20%, e un fallimento nel 10-15%. La risposta ottimale necessita spesso 9-12 mesi di trattamento prima di valutazione definitiva. I protocolli intradermici regionali e le formulazioni sublinguali emergono come alternative potenzialmente più sicure e meglio tollerate.
Impatto degli acidi grassi polinsaturi (Omega-3 e 6)
Gli acidi grassi polinsaturi omega-3 e omega-6 a catene lunghe esercitano effetti anti-infiammatori e ristrutturanti della barriera mediante diversi meccanismi. L’acido eicosapentaenoico (EPA, C20:5 ω-3) e l’acido docosaesaenoico (DHA, C22:6 ω-3) contenuti negli oli di pesce si incorporano nei fosfolipidi delle membrane delle cellule infiammatorie, sostituendosi parzialmente all’acido arachidonico (C20:4 ω-6). Durante l’attivazione cellulare, la fosfolipasi A2 libera questi acidi grassi che vengono metabolizzati dalle cicloossigenasi e lipossigenasi in mediatori di serie 3 e 5 (prostaglandine PGE3, leucotrieni LTB5) meno pro-infiammatori dei loro omologhi di serie 2 e 4 derivati dall’acido arachidonico. La supplementazione ad alta dose (75-150 mg/kg di EPA+DHA al giorno) per minimo 8-12 settimane esercita un effetto moderato sul prurito atopico, con una riduzione media del 20-30% negli studi controllati, giustificando il loro utilizzo come adiuvante terapeutico ma non in monoterapia.
Prospettive terapeutiche future e terapia genica
Le prospettive terapeutiche future in dermatologia atopica canina si orientano verso bersagli molecolari sempre più specifici. Il dupilumab, anticorpo monoclonale umano mirante la sottounità alfa del recettore dell’IL-4 e bloccando così la segnalazione dell’IL-4 e dell’IL-13, rivoluziona attualmente il trattamento della dermatite atopica umana grave con tassi di risposta superiori al 70%. Lo sviluppo di un equivalente canino caninizzato rappresenta una pista promettente. Gli inibitori topici di JAK (ruxolitinib, tofacitinib in formulazioni dermiche) permetterebbero un blocco mirato della segnalazione pro-infiammatoria cutanea senza immunosoppressione sistemica. I probiotici e prebiotici miranti a modulare il microbioma cutaneo e intestinale fanno oggetto di ricerche intensive, certi ceppi di Lactobacillus dimostrando in vitro proprietà immunomodulatrici con induzione di linfociti T regolatori. La terapia genica mediante trasferimento del gene FLG funzionale nei cheratinociti rimane del dominio sperimentale ma potrebbe teoricamente correggere il deficit primario di filaggrina. I vaccini terapeutici a base di peptidi immunomodulatori derivano dall’allergene ma privi di epitopi IgE-reattivi potrebbero indurre una tolleranza senza rischio anafilattico.
Conclusione
Il Bulldog Francese presenta una vulnerabilità dermatologica eccezionale risultante da una convergenza unica di fattori anatomici, genetici e immunologici. La conformazione brachicefalica estrema genera piegature cutanee patologiche predisponenti all’intertrigo e alle sovrainfezioni microbiche. Le anomalie genetiche documentate interessanti il gene PROM1 e l’espressione delle proteine della barriera epidermica compromettono la coesione dello strato corneo e aumentano la permeabilità transcutanea agli allergeni. La disfunzione primaria della barriera si caratterizza per una deficienza di filaggrina, una deplezione ceramidica e un’alterazione delle giunzioni serrate, creando il substrato fisiopatologico della dermatite atopica la cui prevalenza raggiunge il 15-20% in questa popolazione razziale.
La patogenesi immunologica complessa coinvolge una polarizzazione Th2 eccessiva con iperproduzione di IL-4, IL-13, IL-5 e IL-31, conducendo a una sintesi massiva di IgE specifiche e a un reclutamento eosinofilo tissutale. La disbiosi cutanea con espansione di Staphylococcus pseudintermedius e Malassezia pachydermatis amplifica l’infiammazione mediante produzione di esotossine superantigeniche e enzimi proteolitici. Le complicazioni infettive secondarie, in particolare le piodermiti ricorrenti e le dermatiti da Malassezia, costituiscono la regola piuttosto che l’eccezione, necessitando una gestione antimicrobica rigorosa preliminare a qualsiasi valutazione della risposta anti-infiammatoria.
L’approccio diagnostico si basa su una metodologia clinica strutturata integrando anamnesi dettagliata, esame dermatologico sistematico ed esami complementari mirati, particolarmente la citologia cutanea praticabile in prima intenzione. L’identificazione delle infezioni secondarie e il loro trattamento appropriato costituiscono imperativamente la prima tappa terapeutica. La strategia di controllo a lungo termine combina trattamento sintomatico del prurito mediante inibitori di JAK o anticorpi anti-IL-31, restauro della barriera epidermica mediante topici ristrutturanti, e gestione dei fattori ambientali scatenanti.
Le prospettive di ricerca future dovranno approfondire la caratterizzazione del determinismo genetico razziale mediante studi di associazione pangenomica, identificare le varianti specifiche dei geni della barriera epidermica predisponenti all’atopia nel Bulldog Francese, e sviluppare terapie mirate correttrici di questi deficit molecolari primari. L’esplorazione del microbioma cutaneo mediante sequenziamento metagenomico e l’identificazione di signature disbiotiche predittive dell’evoluzione clinica potrebbero permettere interventi precoci mediante probiotici o trapianto microbico. Lo sviluppo di bioterapie canine miranti le citochine Th2 chiave, in particolare anticorpi monoclonali anti-IL-4Rα o anti-IL-13, apre prospettive terapeutiche rivoluzionarie. Infine, le strategie preventive precoci miranti a restaurare la barriera epidermica fin dai primi mesi di vita nei cuccioli a rischio meritano un’investigazione approfondita per determinare se un intervento neonatale potrebbe prevenire o ritardare l’insediamento della dermatite atopica clinicamente manifesta.
Riferimenti
Outerbridge CA, Jordan TJM. Current Knowledge on Canine Atopic Dermatitis: Pathogenesis and Treatment. Advances in Small Animal Care. 2021;2(1):101-117. PMC9204668.
Bajwa J. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. Canadian Veterinary Journal. 2015;56(8):758-765. PMC4531508.
Zur G, Ihrke PJ, White SD, Kass PH. Canine atopic dermatitis: a retrospective study of 266 cases examined at the University of California, Davis, 1992-1998. Part I. Clinical features and allergy testing results. Veterinary Dermatology. 2002;13(2):89-102.
Marsella R, Olivry T, Nicklin C, Lopez J. Pilot investigation of a model for canine atopic dermatitis: environmental house dust mite challenge of high-IgE-producing beagles, mite hypersensitive dogs with atopic dermatitis and normal dogs. Veterinary Dermatology. 2006;17(1):24-35.
Olivry T, DeBoer DJ, Favrot C, et al. Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Diseases of Animals (ICADA). BMC Veterinary Research. 2015;11:210. PMC4531508.
Chermprapai S, Broere F, Gooris G, Schlotter YM, Rutten VPMG, Bouwstra JA. Altered lipid properties of the stratum corneum in Canine Atopic Dermatitis. Biochim Biophys Acta Biomembr. 2018;1860(2):526-533.
Pucheu-Haston CM, Bizikova P, Eisenschenk MN, Santoro D, Nuttall T, Marsella R. Review: The role of antibodies, autoantigens and food allergens in canine atopic dermatitis. Veterinary Dermatology. 2015;26(2):115-e30.
Santoro D, Marsella R, Pucheu-Haston CM, et al. Review: Pathogenesis of canine atopic dermatitis: skin barrier and host-micro-organism interaction. Veterinary Dermatology. 2015;26(2):84-e25.
Banovic F, Linder KE, Olivry T. Clinical, microscopic and microbial characterization of exfoliative superficial pyoderma-associated epidermal collarettes in dogs. Veterinary Dermatology. 2017;28(1):107-e23.
Hensel P, Santoro D, Favrot C, Hill P, Griffin C. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. BMC Veterinary Research. 2015;11:196. PMC4531508.
Cosgrove SB, Wren JA, Cleaver DM, et al. A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis. Veterinary Dermatology. 2013;24(6):587-597.
Gonzales AJ, Humphrey WR, Messamore JE, et al. Interleukin-31: its role in canine pruritus and naturally occurring canine atopic dermatitis. Veterinary Dermatology. 2013;24(1):48-e12.
Michels GM, Ramsey DS, Walsh KF, et al. A blinded, controlled study to investigate the efficacy and safety of a canine anti-IL-31 monoclonal antibody in client-owned dogs with atopic dermatitis. Veterinary Dermatology. 2016;27(6):505-e136.
Olivry T, Bizikova P. A systematic review of randomized controlled trials for prevention or treatment of atopic dermatitis in dogs: 2008-2011 update. Veterinary Dermatology. 2013;24(1):97-e26.
Marsella R, Girolomoni G. Canine models of atopic dermatitis: a useful tool with untapped potential. Journal of Investigative Dermatology. 2009;129(10):2351-2357.
Banovic F, Olivry T, Bazzle L, Tobias JR, Atlee B, Linder KE. Deep pyoderma caused by Pseudomonas aeruginosa in dogs: 20 cases. Veterinary Dermatology. 2016;27(6):494-e131.
Little PR, King VL, Davis KR, et al. A blinded, controlled multicenter study to assess the effectiveness and rate of flea kill of orally administered afoxolaner compared with topically applied fipronil/(S)-methoprene in dogs with flea allergy dermatitis. Veterinary Parasitology. 2015;207(3-4):306-312.
Loeffler A, Cobb MA, Bond R. Comparison of a chlorhexidine and a benzoyl peroxide shampoo as sole treatment in canine superficial pyoderma. Veterinary Record. 2011;169(10):249.
Mueller RS, Bergvall K, Bensignor E, Bond R. A review of topical therapy for skin infections with bacteria and yeast. Veterinary Dermatology. 2012;23(4):330-e62.
Noli C, Borio S, Varina A, Schievano C. Development and validation of a questionnaire to evaluate the Quality of Life of cats with skin disease and their owners, and its use in 185 cats with skin disease. Veterinary Dermatology. 2016;27(4):247-e58.
Nuttall TJ, Marsella R, Rosenbaum MR, Gonzales AJ, Fadok VA. Update on pathogenesis, diagnosis, and treatment of atopic dermatitis in dogs. Journal of the American Veterinary Medical Association. 2019;254(11):1291-1300.
Olivry T, Mueller RS, International Task Force on Canine Atopic Dermatitis. Evidence-based veterinary dermatology: a systematic review of the pharmacotherapy of canine atopic dermatitis. Veterinary Dermatology. 2003;14(3):121-146.
Piekutowska A, Pin D, Reme CA, Gatto H, Haftek M. Effects of a topically applied preparation of epidermal lipids on the stratum corneum barrier of atopic dogs. Journal of Comparative Pathology. 2008;138(4):197-203.
Reedy LM, Miller WH, Willemse T. Allergic Skin Diseases of Dogs and Cats. 2nd ed. London: WB Saunders; 1997.
Saridomichelakis MN, Koutinas AF, Farmaki R, Leontides LS, Kasabalis D. Relative sensitivity of hair pluckings and exudate microscopy for the diagnosis of canine demodicosis. Veterinary Dermatology. 2007;18(2):138-141.
Shimada K, Yoon JS, Yoshihara T, Iwasaki T, Nishifuji K. Increased transepidermal water loss and decreased ceramide content in lesional and non-lesional skin of dogs with atopic dermatitis. Veterinary Dermatology. 2009;20(5-6):541-546.
Shumaker AK, Angus JC, Coyner KS, Loeffler DG, Van Den Broek AHM, Sánchez A. Microbiological and histopathological features of canine pyotraumatic dermatitis (“hot spots”). Veterinary Dermatology. 2008;19(3):131-139.
Steffan J, Alexander D, Brovedani F, Fisch RD. Comparison of cyclosporine A with methylprednisolone for treatment of canine atopic dermatitis: a parallel, blinded, randomized controlled trial. Veterinary Dermatology. 2003;14(1):11-22.
Steffan J, Favrot C, Mueller R. A systematic review and meta-analysis of the efficacy and safety of cyclosporin for the treatment of atopic dermatitis in dogs. Veterinary Dermatology. 2006;17(1):3-16.
Thyssen JP, Godoy-Gijon E, Elias PM. Ichthyosis vulgaris: the filaggrin mutation disease. British Journal of Dermatology. 2013;168(6):1155-1166.
Wilhem S, Kovalik M, Favrot C. Breed-associated phenotypes in canine atopic dermatitis. Veterinary Dermatology. 2011;22(2):143-149.
Bizikova P, Papiernik D, Mendoza ME, Haile B, Olivry T. Studies Using Antibodies against Filaggrin and Filaggrin 2 in Canine Normal and Atopic Skin Biopsies. Veterinary Sciences. 2024;11(2):53. PMC10854974.
Zur G, White SD, Ihrke PJ, Kass PH, Toebe N. Canine atopic dermatitis: a retrospective study of 169 cases examined at the University of California, Davis, 1992-1998. Part II. Response to hyposensitization. Veterinary Dermatology. 2002;13(2):103-111.
Marsella R, Samuelson D, Doerr K. Transmission electron microscopy studies in an experimental model of canine atopic dermatitis. Veterinary Dermatology. 2010;21(1):81-88.
Marsella R, Olivry T, Carlotti DN. Current evidence of skin barrier dysfunction in human and canine atopic dermatitis. Veterinary Dermatology. 2011;22(3):239-248.
Nuttall T, Knight PA, McAleese SM, Lamb JR, Hill PB. Expression of Th1, Th2 and immunosuppressive cytokine gene transcripts in canine atopic dermatitis. Clinical & Experimental Allergy. 2002;32(5):789-795.
Bruet V, Bourdeau PJ, Roussel A, Imparato L, Desfontis JC. Characterization of pruritus in canine atopic dermatitis, flea bite hypersensitivity and flea infestation and its role in diagnosis. Veterinary Dermatology. 2012;23(6):487-e93.
Olivry T, Dunston SM, Murphy KM, Moore PF. Characterization of the inflammatory infiltrate during IgE-mediated late phase reactions in the skin of normal and atopic dogs. Veterinary Dermatology. 2001;12(1):49-58.
Sousa CA, Marsella R. The ACVD task force on canine atopic dermatitis (II): genetic factors. Veterinary Immunology and Immunopathology. 2001;81(3-4):153-157.
DeBoer DJ, Marsella R. The ACVD task force on canine atopic dermatitis (XII): the relationship of cutaneous infections to the pathogenesis and clinical course of canine atopic dermatitis. Veterinary Immunology and Immunopathology. 2001;81(3-4):239-249.
Older CE, Diesel A, Patterson AP, Meason-Smith C, Johnson TJ, Rodrigues Hoffmann A. The feline skin microbiota: The bacteria inhabiting the skin of healthy and allergic cats. PLoS One. 2017;12(6):e0178555.
Bradley CW, Morris DO, Rankin SC, et al. Longitudinal evaluation of the skin microbiome and association with microenvironment and treatment in canine atopic dermatitis. Journal of Investigative Dermatology. 2016;136(6):1182-1190.
Rodrigues Hoffmann A, Patterson AP, Diesel A, et al. The skin microbiome in healthy and allergic dogs. PLoS One. 2014;9(1):e83197.
Yeon SC, Erb HN, Houpt KA. A retrospective study of canine house soiling: diagnosis and treatment. Applied Animal Behaviour Science. 1999;66(1-2):81-95.
Nuttal T, Mueller R. Advances in atopic dermatitis. Companion Animal. 2018;23(2):70-77.
Torres SMF, Gomez N, Dent P. Mast cell quantification in skin biopsies from dogs with allergic skin disease: a retrospective study. Veterinary Dermatology. 2012;23(Suppl 1):3-8.
Keppel KE, Campbell KL, Zuckermann FA, Greeley EA, Schaeffer DJ, Husmann RJ. Quantitation of canine regulatory T cell populations, serum interleukin-10 and allergen-specific IgE concentrations in healthy control dogs and canine atopic dermatitis patients receiving allergen-specific immunotherapy. Veterinary Immunology and Immunopathology. 2008;123(3-4):337-344.
Masuda K, Sakaguchi M, Fujiwara S, et al. Positive reactions to common allergens in 42 atopic dogs in Japan. Veterinary Immunology and Immunopathology. 2000;73(2):193-204.
Hill PB, Hillier A, Olivry T. The ACVD task force on canine atopic dermatitis (VI): IgE-induced immediate and late-phase reactions, two inflammatory sequences at sites of intradermal allergen injections. Veterinary Immunology and Immunopathology. 2001;81(3-4):199-204.
Bizikova P, Santoro D, Marsella R, Nuttall T, Eisenschenk MN, Pucheu-Haston CM. Review: Clinical and histological manifestations of canine atopic dermatitis. Veterinary Dermatology. 2015;26(2):79-e24.