In dermatologia veterinaria, pochi microrganismi rappresentano una sfida clinica così costante e complessa come Pseudomonas aeruginosa. Questo bacillo Gram-negativo, lungi dall’essere un semplice agente infettivo, si rivela essere un avversario formidabile, un patogeno opportunista per eccellenza che sfrutta con un’efficacia temibile la minima alterazione della barriera cutanea o il minimo deficit immunitario dell’ospite.
Introduzione
Le infezioni che genera, principalmente le otiti esterne croniche e le piodermiti profonde, sono spesso caratterizzate dalla loro gravità, cronicità e natura refrattaria al trattamento.
La gestione di queste affezioni èresa particolarmente ardua da due caratteristiche biologiche fondamentali di questo patogeno. Da un lato, P. aeruginosa possiede una resistenza intrinseca a numerose classi di antibiotici, una capacità che completa con un’attitudine notevole ad acquisire nuovi meccanismi di resistenza, conducendo all’emergenza di ceppi multiresistenti (MDR). Dall’altro, la sua capacità di formare biofilm — comunità batteriche strutturate e protette da una matrice extracellulare — costituisce una vera e propria fortezza che lo mette al riparo dalle difese immunitarie dell’ospite e dagli agenti antimicrobici. Questa doppia strategia di difesa e persistenza è la causa principale dei fallimenti terapeutici e delle recidive frustranti per il clinico.
Di fronte a questa problematica crescente, un approccio terapeutico semplicistico o empirico è destinato al fallimento. La presente sintesi ha l’obiettivo di fornire un’analisi esaustiva e integrata, fondata sui dati scientifici più recenti, per la gestione delle infezioni dermatologiche da P. aeruginosa. Questo articolo di riferimento dettaglierà la biologia e la patogenesi di questo microrganismo, proporrà un approccio diagnostico ragionato e strutturato, ed esplorerà in profondità le strategie terapeutiche multimodali. Un’attenzione particolare sarà dedicata all’interpretazione critica dell’antibiogramma alla luce delle nuove raccomandazioni, alla gestione delle infezioni multiresistenti e alla valutazione delle innovazioni terapeutiche promettenti, come gli agenti anti-biofilm e la fagoterapia. L’ambizione di questo lavoro è di dotare il clinico degli strumenti concettuali e pratici necessari per trasformare la gestione di questi casi complessi da una battaglia incerta a una strategia terapeutica controllata ed efficace.
1. Pseudomonas aeruginosa: Ritratto di un Patogeno Opportunista Formidabile
1.1. Ecologia e Caratteristiche Microbiologiche
La comprensione della natura di Pseudomonas aeruginosa inizia con il riconoscimento della sua ubiquità. Questo microrganismo è onnipresente nell’ambiente, colonizzando facilmente il suolo, l’acqua dolce, le superfici vegetali e le materie organiche in decomposizione. Questa plasticità ecologica spiega non solo la sua presenza frequente come semplice contaminante ambientale, ma anche il suo ruolo di primo piano nelle infezioni nosocomiali, dove può sopravvivere e proliferare in serbatoi tanto vari quanto i disinfettanti, i lavandini o le attrezzature mediche. È fondamentale notare che P. aeruginosa non fa parte della microflora commensale del condotto uditivo esterno o della cute sana del cane. La sua presenza in un prelievo dermatologico è quindi sempre clinicamente significativa.
Sul piano microbiologico, si tratta di un bacillo Gram-negativo, aerobio stretto, che si distingue per la sua motilità, assicurata da un unico flagello polare. Le sue esigenze nutrizionali minime e la sua capacità di tollerare un’ampia gamma di condizioni fisico-chimiche, comprese temperature fino a 42 °C, gli conferiscono una capacità di sopravvivenza e adattamento eccezionale, permettendogli di colonizzare ambienti ostili dove pochi altri batteri possono sussistere.
1.2. Arsenale di Virulenza: Dalle Tossine agli Enzimi
Il potere patogeno di P. aeruginosa non risiede in una singola tossina, ma in un arsenale complesso e ridondante di fattori di virulenza che agiscono in sinergia per invadere i tessuti, sfuggire alla risposta immunitaria e causare danni cellulari.
Tra i fattori più noti figurano i suoi pigmenti. La piocianina, un pigmento blu-verde che conferisce il suo colore caratteristico al pus “piocianico”, non è un semplice marcatore visivo. Esercita effetti pro-infiammatori potenti sui fagociti e altera le funzioni immunitarie delle cellule epiteliali, contribuendo attivamente alla patogenesi. L’invasione tissutale è, dal canto suo, facilitata da una batteria di enzimi extracellulari. L’elastasi degrada il collagene e l’elastina, componenti maggiori della matrice extracellulare, mentre la proteasi alcalina interferisce con la formazione di fibrina, impedendo il confinamento dell’infezione. Le fosfolipasi degradano i fosfolipidi delle membrane cellulari, provocando una lisi cellulare.
A questo arsenale si aggiungono tossine potenti. La citotossina (o leucocidina) e le emolisine prendono di mira e distruggono le cellule immunitarie e gli eritrociti. Inoltre, P. aeruginosa utilizza sistemi di secrezione sofisticati, come il sistema di secrezione di tipo III (SST3), che agisce come una siringa molecolare per iniettare direttamente effettori tossici (esotossine S e A) nel cuore delle cellule dell’ospite. Queste esotossine paralizzano le funzioni cellulari, in particolare la fagocitosi, e inducono una necrosi tissutale localizzata, creando un ambiente propizio alla proliferazione batterica.
1.3. La Formazione di Biofilm: Una Fortezza Batterica
Forse il fattore di virulenza più determinante nella cronicità delle infezioni da P. aeruginosa è la sua capacità di formare un biofilm. Non si tratta di una semplice aggregazione di batteri, ma di una comunità microbica altamente organizzata, incassata in una matrice di esopolisaccaridi autoprodotta, principalmente composta di alginato. Questa matrice viscosa ancora saldamente i batteri alla superficie del condotto uditivo o della cute ulcerata, formando una vera e propria fortezza.
Questa struttura conferisce molteplici vantaggi al batterio. In primo luogo, costituisce una barriera fisica che lo protegge dalle cellule fagocitarie del sistema immunitario e limita considerevolmente la penetrazione degli antibiotici. Studi hanno mostrato che i batteri organizzati in biofilm possono essere centinaia, persino migliaia di volte più resistenti agli agenti antimicrobici rispetto ai loro omologhi planctonici (liberi). In secondo luogo, all’interno del biofilm, i batteri comunicano tra loro tramite un sistema di segnali chimici chiamato quorum sensing. Questo meccanismo, dipendente dalla densità cellulare, permette loro di coordinare l’espressione di geni di virulenza e di strategie di difesa in modo collettivo, comportandosi come un organismo multicellulare.
L’impatto clinico di questa strategia è importante. La prevalenza della formazione di biofilm da parte degli isolati clinici di P. aeruginosa provenienti da otiti canine è estremamente elevata, riportata nel 40% fino a oltre il 90% dei casi secondo gli studi. Un vasto studio europeo ha persino rivelato che l’82% degli isolati era capace di formare biofilm forti. Questa capacità è una causa diretta di fallimento terapeutico, di persistenza dell’infezione nonostante un’antibioticoterapia apparentemente adeguata, e dell’instaurarsi di un’infiammazione cronica distruttiva.
1.4. Meccanismi di Resistenza agli Antibiotici: Strategie Intrinseche e Acquisite
La formidabile capacità di P. aeruginosa di resistere agli antibiotici si basa su una doppia strategia: una resistenza naturale (intrinseca) e una capacità di adattamento eccezionale (resistenza acquisita).
La resistenza intrinseca è una caratteristica inerente alla specie. È principalmente dovuta alla bassa permeabilità della sua membrana esterna, che restringe l’ingresso di numerose molecole. A ciò si aggiunge un arsenale di pompe di efflusso, proteine di membrana che espellono attivamente gli antibiotici fuori dalla cellula prima che raggiungano il loro bersaglio. Infine, P. aeruginosa esprime in modo costitutivo una β-lattamasi cromosomica (AmpC), un enzima capace di inattivare alcune penicilline e cefalosporine.
La resistenza acquisita è ancora più preoccupante. Risulta sia da mutazioni cromosomiche spontanee, sia, più frequentemente, dall’acquisizione di materiale genetico mobile (plasmidi, trasposoni) tramite trasferimento orizzontale da altri batteri. Questi meccanismi permettono al batterio di sviluppare resistenze a classi di antibiotici alle quali era inizialmente sensibile, portando all’emergenza di fenotipi di multiresistenza (MDR). I principali meccanismi acquisiti includono la produzione di enzimi inattivanti addizionali (come le β-lattamasi a spettro esteso o le carbapenemasi), la modificazione del bersaglio dell’antibiotico (per esempio, mutazioni nei geni della DNA girasi che conferiscono resistenza ai fluorochinoloni) o la sovraespressione delle pompe di efflusso.
Questa combinazione di virulenza aggressiva, di protezione tramite il biofilm e di molteplici meccanismi di resistenza fa di P. aeruginosa un patogeno particolarmente difficile da eradicare. Il suo successo clinico non è il frutto di un solo fattore, ma di una strategia di sopravvivenza integrata e sinergica. Il batterio utilizza prima i suoi enzimi e tossine per impiantarsi e danneggiare i tessuti. Costruisce poi la sua fortezza, il biofilm, per proteggersi dalle prime ondate di difesa dell’ospite e dai trattamenti. Al riparo, ha il tempo di sviluppare e scambiare geni di resistenza, armandosi per gli assalti futuri. Ogni approccio terapeutico che non prende in considerazione questa strategia globale è inevitabilmente destinato al fallimento. Il trattamento deve quindi essere multimodale, mirando simultaneamente a smantellare la fortezza, neutralizzare gli agenti patogeni e riparare i danni inflitti all’ospite.
Tabella 1: Fattori di Virulenza Chiave di P. aeruginosa e i Loro Ruoli Patogenici
|
Fattore di Virulenza |
Categoria |
Ruolo Patogenico Principale |
|
Piocianina |
Pigmento |
Alterazione della risposta immunitaria, stress ossidativo, effetti pro-infiammatori |
|
Elastasi, Proteasi alcalina |
Enzimi extracellulari |
Distruzione della matrice extracellulare (collagene, elastina), invasione tissutale |
|
Fosfolipasi C |
Enzima extracellulare |
Lisi delle cellule ospite tramite degradazione delle membrane lipidiche |
|
Esotossina A, Esoenzima S |
Tossine (Sistema di secrezione T3) |
Inibizione della sintesi proteica, apoptosi delle cellule ospite, paralisi dei fagociti |
|
Lipopolisaccaride (LPS) |
Componente di membrana |
Induzione di una forte risposta infiammatoria, shock settico |
|
Alginato / Biofilm |
Matrice protettiva |
Protezione contro antibiotici e sistema immunitario, adesione, persistenza cronica |
|
Pompe di efflusso |
Meccanismo di resistenza |
Espulsione attiva di molteplici classi di antibiotici fuori dalla cellula batterica |
|
β-lattamasi (AmpC, ecc.) |
Enzimi di resistenza |
Inattivazione enzimatica degli antibiotici della famiglia delle β-lattamine |
2. Manifestazioni Cliniche ed Epidemiologia
2.1. L’Otite da Pseudomonas aeruginosa
L’otite da Pseudomonas aeruginosa rappresenta una delle entità cliniche più gravi e frustranti in dermatologia canina. È cruciale comprendere che è molto raramente un’infezione primaria. È quasi sistematicamente una complicazione di un’otite esterna cronica o recidivante, inizialmente causata da una proliferazione di altri agenti, tipicamente lieviti (Malassezia pachydermatis) o cocchi (Staphylococcus pseudintermedius). La progressione verso un’infezione da Pseudomonas è una vera e propria escalation patologica, favorita da un insieme di fattori. I fattori predisponenti (conformazione dell’orecchio con un condotto stretto o un padiglione pendente, umidità eccessiva), i fattori primari (la causa iniziale dell’infiammazione, come la dermatite atopica, un’allergia alimentare o un corpo estraneo) e i fattori perpetuanti (modificazioni patologiche del condotto come l’iperplasia delle ghiandole ceruminose, la stenosi, o una rottura della membrana timpanica) creano un microambiente ideale per la colonizzazione da parte di questo patogeno opportunista.
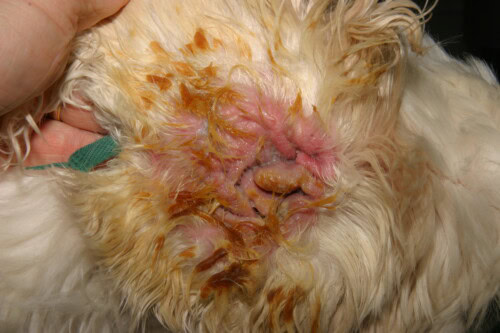
Grave Otite da Pseudomonas in un Cocker
La presentazione clinica è spesso caratteristica. Il coinvolgimento è frequentemente unilaterale, benché possa essere bilaterale in un contesto di malattia allergica sottostante. Si manifesta con un dolore auricolare intenso, spesso più marcato del prurito, un’infiammazione eritematosa grave del condotto, e ulcerazioni dell’epitelio. Il segno più evocativo è la natura dell’essudato: è tipicamente abbondante, mucoide o purulento, maleodorante, e di un colore giallo-verdastro caratteristico dovuto alla produzione di pigmenti batterici. Nei casi gravi, questo essudato può essere emorragico. L’esame attento del padiglione e dell’ingresso del condotto può rivelare la presenza di placche viscose, una manifestazione clinica diretta del biofilm batterico. Una complicazione maggiore e frequente è l’estensione dell’infezione all’orecchio medio. Si stima che oltre l’80% dei cani affetti da otite esterna cronica da Pseudomonas presentino un’otite media concomitante. Questa può manifestarsi con segni neurologici come la sindrome di Horner, una paralisi del nervo facciale o disturbi vestibolari.
Sul piano epidemiologico, l’otite esterna è un’affezione estremamente comune, che colpisce tra il 10% e il 20% della popolazione canina. All’interno di questa popolazione, P. aeruginosa si impone come l’agente patogeno più frequentemente isolato nei casi cronici e refrattari, essendo associato a quasi il 35% di queste forme gravi. Altri studi, condotti su popolazioni specifiche di cani con otite, riportano prevalenze che vanno dal 25% a oltre il 50%.
2.2. La Piodermite da Pseudomonas aeruginosa
Sebbene meno frequenti delle otiti, le piodermiti da P. aeruginosa sono spesso affezioni spettacolari e gravi. Si presentano generalmente sotto due forme principali.
La piodermite profonda acuta è la forma più drammatica. Si caratterizza per la comparsa improvvisa di lesioni estremamente dolorose, classicamente localizzate lungo la linea dorsale. L’esame clinico rivela molteplici ulcere circinali (a forma di anello), croste emorragiche e foruncoli che possono trasudare un essudato sanguinolento. Lo stato generale dell’animale è spesso compromesso, con abbattimento e febbre.
L’intertrigine (o dermatite delle pieghe) da Pseudomonas è un’altra presentazione. Si sviluppa nelle zone di pieghe cutanee dove la macerazione e la frizione creano condizioni favorevoli (pieghe facciali nelle razze brachicefaliche, piega della coda, pieghe vulvari). Le lesioni consistono in erosioni e ulcerazioni profonde, ricoperte da un essudato verdastro, denso e particolarmente appiccicoso, molto evocativo del coinvolgimento di questo germe.
La prevalenza esatta delle piodermiti da Pseudomonas è meno ben documentata di quella delle otiti. Tuttavia, studi sulle infezioni cutanee canine hanno identificato P. aeruginosa in circa l’11-13% dei casi. Uno studio condotto in Romania su infezioni cutanee superficiali ha isolato il germe in quasi il 34% dei prelievi di piodermite.
L’insorgenza di un’infezione da P. aeruginosa, sia nell’orecchio che sulla cute, deve essere interpretata dal clinico come un segnale d’allarme. Non è un evento fortuito, ma il punto culminante di una cascata patologica. La cronicità è il principale fattore di rischio. L’infiammazione persistente, l’umidità, e soprattutto i trattamenti antibiotici ripetuti, spesso a largo spettro, creano una pressione di selezione intensa. Eliminano la flora commensale protettiva e i patogeni più sensibili, lasciando campo libero a P. aeruginosa, intrinsecamente più resistente e perfettamente adattato a questo ambiente ostile e modificato. Di conseguenza, l’identificazione di P. aeruginosa non è la fine della diagnosi, ma l’inizio di un’indagine più approfondita. Impone una ricerca rigorosa della causa primaria (allergia, disturbo endocrino, ecc.) che ha permesso a questa “crisi” di instaurarsi. Senza la gestione di questo fattore iniziale, ogni tentativo di trattamento dell’infezione da Pseudomonas, anche con l’antibiotico più potente, sarà solo una tregua temporanea prima di una recidiva inevitabile.
3. Approccio Diagnostico Ragionato
La gestione efficace di un’infezione da P. aeruginosa si basa su un approccio diagnostico strutturato e gerarchizzato. L’obiettivo non è solo identificare il patogeno, ma anche comprendere il contesto del suo sviluppo, valutare l’estensione delle lesioni e guidare una terapeutica mirata e razionale.
3.1. L’Esame Clinico e Otoscopico: Tappe Iniziali Cruciali
Ogni approccio diagnostico inizia con un’anamnesi rigorosa e un esame clinico completo. L’interrogatorio del proprietario deve ricercare segni di malattie sottostanti, in particolare un prurito al di fuori delle orecchie, disturbi digestivi o infezioni cutanee recidivanti che possano suggerire una dermatite atopica o un’allergia alimentare. Segni di poliuria-polidipsia o un aumento di peso possono orientare verso un’endocrinopatia. L’esame dermatologico deve essere esaustivo, poiché l’otite è spesso solo una delle manifestazioni di una dermatosi più globale.
L’esame otoscopico è una tappa fondamentale. L’utilizzo di un video-otoscopio è ideale, poiché offre un ingrandimento, un’illuminazione e una capacità di registrazione superiori, facilitando la valutazione precisa e il follow-up. L’otoscopia permette di apprezzare lo stato del condotto uditivo esterno: grado di eritema, presenza di ulcerazioni, di proliferazioni tissutali (stenosi), o di masse. È anche indispensabile per valutare l’integrità della membrana timpanica. Una membrana rotta, bombata o decolorata è un segno forte di coinvolgimento dell’orecchio medio. La visualizzazione di un essudato purulento e di ulcere è altamente suggestiva di un’infezione da bacilli Gram-negativi.
3.2. L’Esame Citologico: Uno Strumento Diagnostico di Prima Linea
L’esame citologico auricolare è l’esame complementare più importante, più rapido e più redditizio nella gestione delle otiti. Deve essere eseguito sistematicamente ad ogni consultazione per un’otite. Il prelievo si effettua con un tampone, cercando di raggiungere la giunzione tra il condotto verticale e orizzontale, dove le secrezioni sono più rappresentative dell’infezione. Il campione viene poi strisciato su un vetrino, colorato (per esempio, con una colorazione di tipo Romanowsky rapida) ed esaminato al microscopio.
Nel contesto di un’infezione da P. aeruginosa, i risultati sono spesso caratteristici. L’osservazione di batteri a forma di bastoncelli (bacilli), spesso in gran numero, è il segno d’allarme principale. Questi bacilli sono tipicamente accompagnati da una popolazione infiammatoria densa, composta maggiormente da neutrofili degenerati, testimonianza di un’infezione attiva e suppurata. La citologia offre un orientamento diagnostico e terapeutico quasi immediato, permettendo di iniziare un trattamento topico mirato contro i bacilli Gram-negativi senza attendere i risultati di una coltura.
3.3. Coltura Batterica e Antibiogramma: Indicazioni e Protocollo di Prelievo
La coltura batterica con antibiogramma non è un esame di routine per una prima otite non complicata. La sua prescrizione deve essere ragionata e riservata a situazioni cliniche precise dove apporta un’informazione cruciale per il seguito del trattamento:
- Presenza confermata di bacilli all’esame citologico, in particolare se l’infezione è cronica o recidivante.
- Fallimento di un trattamento empirico di prima intenzione ben condotto.
- Necessità di prevedere un’antibioticoterapia per via sistemica, in particolare in caso di otite media accertata o di piodermite profonda associata. In questo caso, l’antibiogramma è indispensabile per guidare la scelta della molecola.
Il protocollo di prelievo è critico per l’affidabilità del risultato. Il campione deve essere prelevato nel modo più asettico possibile, idealmente nella porzione profonda del condotto uditivo. In caso di sospetto di otite media con una membrana timpanica intatta, l’unico modo per ottenere un prelievo rappresentativo della bolla timpanica è realizzare una miringotomia. Questo atto, realizzato sotto anestesia generale e guida video-otoscopica, consiste nel perforare sterilmente il timpano per aspirare il contenuto dell’orecchio medio in vista di un’analisi citologica e di una messa in coltura.
3.4. L’Imaging Medico nell’Esplorazione dell’Otite Media
Quando il coinvolgimento dell’orecchio medio è sospettato (sulla base dei segni clinici, dell’otoscopia o del fallimento terapeutico), l’imaging medico diventa uno strumento diagnostico essenziale. Permette di confermare il coinvolgimento, di valutarne la gravità e di pianificare un eventuale intervento chirurgico.
La TC (tomografia computerizzata o CT-scan) è considerata la modalità di imaging di scelta. Offre un’eccellente risoluzione per visualizzare le strutture ossee, in particolare la parete della bolla timpanica (ricerca di lisi ossea) e gli ossicini, così come per rilevare la presenza di liquido o di tessuto molle anomalo nell’orecchio medio. L’imaging a risonanza magnetica (RM) è un’alternativa che offre una migliore visualizzazione dei tessuti molli ed è particolarmente indicata in caso di sospetto di massa tumorale o di estensione dell’infezione alle strutture nervose circostanti.
Questo approccio sequenziale, che va dalla citologia rapida all’imaging avanzato, incarna un approccio diagnostico razionale. Ogni esame complementare non è prescritto a caso, ma mira a rispondere a una domanda clinica precisa che si pone in una data tappa del processo. La citologia orienta il trattamento iniziale. Il fallimento di questo trattamento pone la questione della resistenza (risposta tramite la coltura) o dell’estensione anatomica (risposta tramite la TC). Questa gerarchizzazione previene l’escalation terapeutica non giustificata e favorisce un uso ragionato degli antibiotici e degli esami costosi.
4. Strategie Terapeutiche Integrate
Il trattamento delle infezioni da P. aeruginosa è un processo esigente che richiede un approccio multimodale e perseverante. Il successo non si basa su una singola molecola “miracolosa”, ma su una strategia integrata che mira contemporaneamente a eliminare il patogeno, a controllare l’infiammazione, a correggere i fattori sottostanti e a ripristinare un ambiente auricolare sano.
4.1. Principi Fondamentali: Gestione della Causa Primaria e Controllo dell’Infiammazione
Il principio più fondamentale, e tuttavia a volte trascurato, è che il trattamento a lungo termine dell’infezione da Pseudomonas è indissociabile dall’identificazione e dalla gestione della causa primaria dell’otite. Che si tratti di un’allergia, di un’endocrinopatia o di una massa, il suo controllo è l’unica garanzia contro le recidive. L’infezione da Pseudomonas è una conseguenza; trattare unicamente la conseguenza senza attaccare la causa è un’impasse terapeutica.
Parallelamente, il controllo dell’infiammazione è un pilastro del trattamento. L’infiammazione cronica provoca edema, dolore, iperplasia delle ghiandole sebacee e ceruminose, e stenosi del condotto. Queste modificazioni perpetuano l’infezione e impediscono la penetrazione dei trattamenti topici. L’utilizzo di glucocorticoidi, per via topica e/o sistemica (per esempio, prednisolone a dose antinfiammatoria), è quindi cruciale in fase iniziale. Permettono di “riaprire” il condotto, di diminuire la produzione di essudato, di migliorare il comfort dell’animale e, di conseguenza, di aumentare l’efficacia degli agenti antimicrobici.
4.2. La Terapia Topica: Pietra Angolare del Trattamento
La terapia topica è al cuore della strategia terapeutica, poiché solo essa permette di raggiungere concentrazioni di antimicrobici al sito dell’infezione ben superiori a quelle ottenute per via sistemica. La sua efficacia dipende da due tappe chiave: la pulizia e l’applicazione di agenti mirati.
La pulizia auricolare è una tappa non negoziabile. L’essudato purulento e il biofilm agiscono come una barriera fisica e possono inattivare chimicamente alcuni antibiotici, in particolare gli aminoglicosidi. Una pulizia iniziale profonda, realizzata sotto anestesia generale con irrigazione abbondante, è spesso indispensabile per eliminare la maggioranza dei detriti. Successivamente, pulizie regolari a domicilio da parte del proprietario sono necessarie per mantenere il condotto pulito.
L’efficacia della terapia topica può essere considerevolmente aumentata dall’utilizzo di soluzioni contenenti Tris-EDTA. L’EDTA (acido etilendiamminotetraacetico) è un agente chelante che si lega agli ioni metallici (calcio, magnesio) essenziali alla stabilità della membrana esterna dei batteri Gram-negativi. Destabilizzando questa membrana, il Tris-EDTA la rende più permeabile agli antibiotici, potenziando così la loro azione. Studi hanno mostrato che aumenta significativamente l’efficacia dei fluorochinoloni e degli aminoglicosidi contro P. aeruginosa. Il protocollo ottimale consiste nell’instillare la soluzione di Tris-EDTA nel condotto uditivo e attendere 20-30 minuti prima di applicare il farmaco antibiotico, per lasciare il tempo all’agente chelante di agire.
La scelta dell’agente antimicrobico topico deve essere ponderata. Diverse opzioni sono disponibili:
- I fluorochinoloni (marbofloxacina, enrofloxacina) e gli aminoglicosidi (gentamicina, amikacina) sono scelte comuni e spesso efficaci. La prudenza è d’obbligo con gli aminoglicosidi in caso di rottura timpanica a causa della loro potenziale ototossicità.
- La polimixina B è un altro antibiotico efficace contro P. aeruginosa.
- La sulfadiazina d’argento (SSD) è un’opzione particolarmente interessante, in particolare di fronte a ceppi multiresistenti. Sotto forma di crema all’1%, ha dimostrato un’eccellente attività in vitro contro gli isolati canini di P. aeruginosa, con concentrazioni minime inibitorie (MIC) molto basse (1-64 µg/mL), ben inferiori alla concentrazione della preparazione commerciale. Il suo meccanismo d’azione, che prende di mira la parete e la membrana cellulare, è diverso da quello di molti altri antibiotici.
4.3. L’Antibioticoterapia Sistemica: Indicazioni, Scelta e Rischi
L’antibioticoterapia per via sistemica non è un trattamento di prima intenzione per un’otite esterna, anche da Pseudomonas. Le concentrazioni raggiunte nel cerume e nell’epitelio del condotto sono spesso insufficienti. Il suo utilizzo deve essere riservato a indicazioni precise e giustificate:
- Otite media confermata dall’imaging o dall’otoscopia.
- Piodermite profonda associata.
- Infiammazione e iperplasia tissutale così gravi da impedire ogni applicazione topica efficace.
- Fallimento accertato di un trattamento topico aggressivo e ben condotto.
La scelta della molecola deve imperativamente essere guidata da un antibiogramma.
- I fluorochinoloni sono l’unica classe disponibile per via orale con un’attività affidabile. Tuttavia, dosi elevate, fuori AMM, sono richieste per essere efficaci contro P. aeruginosa: enrofloxacina a 10-20 mg/kg/die e marbofloxacina a 5,5 mg/kg/die. Va notato che la resistenza può svilupparsi rapidamente durante il trattamento.
- Le opzioni parenterali (iniettabili) includono le cefalosporine di terza generazione (come la ceftazidima) e gli aminoglicosidi (amikacina, gentamicina). L’utilizzo sistemico degli aminoglicosidi è limitato dal loro rischio di nefrotossicità e ototossicità, e richiede un’idratazione perfetta dell’animale così come un monitoraggio della funzione renale.
- I carbapenemi (imipenem, meropenem) e le penicilline anti-pseudomonas (ticarcillina) sono antibiotici di ultima risorsa, da utilizzare solo per infezioni multiresistenti documentate, nel rispetto dei principi dell’antibiotico-governance per preservare la loro efficacia in medicina umana e veterinaria.
- Da notare che queste ultime molecole sono da impiegare in funzione della regolamentazione in vigore e delle raccomandazioni di ciascun paese, il GEDAC per quanto riguarda la Francia per esempio.
Tabella 2: Posologie degli Antibiotici Sistemici Anti-Pseudomonas nel Cane
|
Molecola |
Classe |
Posologia (via) |
Commenti Clinici / Precauzioni |
|
Enrofloxacina |
Fluorochinolone |
10–20 mg/kg/die (PO, IV, SC) |
Necessita di dosi elevate. La resistenza può svilupparsi rapidamente. |
|
Marbofloxacina |
Fluorochinolone |
5,5 mg/kg/die (PO) |
Dose massima richiesta per un’efficacia contro i ceppi a sensibilità intermedia. |
|
Amikacina |
Aminoglicoside |
15–30 mg/kg/die (IV, IM, SC) |
Rischio di nefrotossicità e ototossicità. Assicurare una buona idratazione e monitorare la funzione renale. |
|
Gentamicina |
Aminoglicoside |
10–14 mg/kg/die (IV, IM, SC) |
Rischio di tossicità più elevato dell’amikacina. Monitoraggio richiesto. |
4.4. L’Interpretazione Critica dell’Antibiogramma secondo le Norme CLSI VET
L’antibiogramma è uno strumento potente, ma la sua interpretazione non deve essere passiva. Il Clinical and Laboratory Standards Institute (CLSI) ha recentemente pubblicato un aggiornamento importante delle soglie critiche (breakpoints) per i fluorochinoloni nel cane, che cambia radicalmente la loro interpretazione.
Le vecchie soglie, più elevate, potevano classificare come “Sensibile” (S) un ceppo che non risponderebbe a un trattamento a dose standard. Le nuove soglie sono molto più basse e introducono una nuova categoria: “Sensibile-Dose Dipendente” (SDD). Questa categoria indica che un ceppo può essere trattato con successo, ma solo se viene utilizzata la dose più elevata dell’intervallo posologico approvato.
Questa evoluzione trasforma l’antibiogramma da un semplice rapporto “S/I/R” in una vera e propria guida alla prescrizione. Di fronte a un ceppo classificato SDD, il clinico sa che deve prescrivere la dose massima raccomandata (per esempio, 20 mg/kg/die per l’enrofloxacina) per avere una possibilità di successo clinico. Utilizzare una dose standard di fronte a un ceppo SDD è una causa prevedibile di fallimento terapeutico e di selezione di resistenza.
Tabella 3: Soglie Critiche CLSI VET Revisionate (2023) per Enrofloxacina e Marbofloxacina nel Cane (Via Orale)
|
Antibiotico |
Categoria e Soglia MIC (µg/mL) |
Dose corrispondente |
|
Enrofloxacina (revisionato) |
S ≤ 0,06 |
5 mg/kg/die |
|
SDD 0,12–0,25 |
10–20 mg/kg/die |
|
|
R ≥ 0,5 |
– |
|
|
Marbofloxacina (revisionato) |
S ≤ 0,12 |
2,8 mg/kg/die |
|
SDD 0,25 |
5,5 mg/kg/die |
|
|
R ≥ 0,5 |
– |
In definitiva, la strategia terapeutica non deve essere vista come una semplice “battaglia antibiotica” ma come una “gestione di ecosistema”. L’obiettivo non è solo eradicare P. aeruginosa, ma ripristinare un ambiente cutaneo o auricolare in cui non possa più proliferare. La pulizia, il Tris-EDTA e gli antinfiammatori modificano l’ambiente fisico, chimico e immunologico. Il trattamento della causa primaria corregge lo squilibrio fondamentale. In questo schema, gli antibiotici sono solo uno strumento, spesso temporaneo, per ridurre il carico batterico mentre le altre misure ripristinano l’equilibrio. Il successo si misura meno dalla guarigione dell’episodio infettivo che dalla prevenzione della sua recidiva.
5. Gestione delle Infezioni Multiresistenti e Prospettive Future
L’emergenza di ceppi di P. aeruginosa multiresistenti (MDR) costituisce la sfida ultima in dermatologia veterinaria. Di fronte a un antibiogramma che mostra poche o nessuna sensibilità, il clinico deve abbandonare l’idea di una soluzione semplice e adottare strategie alternative e combinate, rivolgendosi verso le innovazioni terapeutiche che ridefiniscono la lotta contro le infezioni batteriche.
5.1. Strategie Combinate per i Ceppi Multiresistenti (MDR)
La gestione di un’infezione MDR da P. aeruginosa si basa su un’intensificazione dell’approccio multimodale. Ogni componente del trattamento diventa critico. Una pulizia meccanica rigorosa e ripetuta, spesso sotto anestesia, è la prima tappa per smantellare fisicamente il biofilm e ridurre il carico batterico. L’utilizzo sistematico di Tris-EDTA in pretrattamento diventa non più un’opzione ma una necessità per tentare di ripristinare una sensibilità, anche parziale, agli antibiotici.
La scelta degli agenti topici deve essere creativa e fondata sulle poche opzioni rimaste. La sulfadiazina d’argento è spesso un’eccellente scelta empirica in questo contesto. La preparazione estemporanea di soluzioni topiche a base di antibiotici iniettabili, come la ticarcillina o l’amikacina, può essere considerata, benché la stabilità di queste preparazioni sia una preoccupazione. L’antibioticoterapia sistemica, se è assolutamente necessaria, deve essere scrupolosamente guidata dall’antibiogramma, considerando molecole di ultima risorsa dopo una valutazione rigorosa del rapporto beneficio/rischio.
5.2. La Disruzione del Biofilm: Il Ruolo della N-acetilcisteina (NAC)
Il riconoscimento del biofilm come una fortezza che protegge i batteri ha aperto la via alla ricerca di agenti “anti-biofilm”. La N-acetilcisteina (NAC), un agente mucolitico ben noto, è emersa come un candidato molto promettente. Studi in vitro hanno dimostrato che la NAC possiede non solo un’attività antibatterica diretta contro i patogeni dell’otite, compreso P. aeruginosa, ma che è soprattutto capace di perturbare la matrice del biofilm, degradandola ed esponendo così i batteri che ospita.
I dati in vitro sono convincenti: la NAC inibisce la crescita di P. aeruginosa a concentrazioni minime inibitorie (MIC) di 5-20 mg/mL, livelli considerati sicuri e raggiungibili durante un’applicazione topica. La sua associazione con il Tris-EDTA potrebbe offrire una sinergia d’azione, il Tris-EDTA indebolendo la parete batterica mentre la NAC smantella la matrice extracellulare. Benché studi clinici prospettici siano ancora necessari per validare la sua efficacia in vivo, la NAC rappresenta un’opzione terapeutica adiuvante di grande interesse per le infezioni croniche e a biofilm, in complemento ai trattamenti antimicrobici.
5.3. Terapie Innovative: La Fagoterapia come Alternativa Promettente
Di fronte all’impasse dell’antibiotico-resistenza, la comunità scientifica si rivolge verso approcci radicalmente differenti, e la fagoterapia è una delle più promettenti. Questa tecnica utilizza batteriofagi (o fagi), virus che sono i predatori naturali dei batteri. I fagi detti “litici” infettano un batterio bersaglio specifico, si replicano al suo interno, poi lo fanno esplodere (lisi), liberando decine di nuove particelle virali pronte a infettare i batteri vicini.
I vantaggi di questo approccio sono molteplici. I fagi possiedono un’alta specificità, prendendo di mira solo il batterio patogeno senza influenzare la microflora benefica dell’ospite. Hanno la capacità di auto-replicarsi al sito dell’infezione finché il loro bersaglio è presente. Soprattutto, sono efficaci contro i batteri multiresistenti, poiché il loro meccanismo d’azione è totalmente indipendente dalla sensibilità agli antibiotici. Inoltre, numerosi fagi producono enzimi capaci di degradare la matrice dei biofilm, permettendo loro di penetrare questa struttura protettiva.
La fagoterapia è attualmente un campo di ricerca estremamente attivo in medicina veterinaria. Studi in vitro e rapporti di casi pubblicati hanno mostrato risultati molto incoraggianti nel trattamento di infezioni cutanee, di otiti e di infezioni di ferite chirurgiche da P. aeruginosa MDR nel cane e nel gatto. Studi clinici sono in corso per valutare in modo rigoroso l’efficacia e la sicurezza di cocktail di fagi. La combinazione sinergica di fagi e antibiotici è anche una pista esplorata, dove il fago indebolisce la popolazione batterica, rendendola più vulnerabile all’antibiotico.
La lotta contro P. aeruginosa MDR illustra un’evoluzione strategica importante. Passiamo da una logica di “forza bruta”, consistente nel cercare antibiotici sempre più potenti, a una logica di “guerra asimmetrica”, che mira a sfruttare le debolezze strutturali e biologiche del batterio. Invece di tentare di sfondare i muri della fortezza con un ariete più grosso, le nuove strategie mirano a dissolvere il cemento che tiene le pietre (NAC) o a inviare agenti specializzati che possono aggirare le difese (fagi). Il futuro della gestione di queste infezioni probabilmente non risiede in un unico “super-antibiotico”, ma nell’arte di combinare intelligentemente queste nuove armi per smantellare le difese sofisticate di questo avversario formidabile.
Conclusione e Piste di Ricerca Future
La gestione delle piodermiti e delle otiti da Pseudomonas aeruginosa nel cane rappresenta un paradigma della medicina infettiva moderna, dove la comprensione della biologia del patogeno e delle sue interazioni con l’ospite è la chiave del successo terapeutico. Questa sintesi ha messo in luce che P. aeruginosa non è un semplice agente infettivo, ma un patogeno opportunista altamente adattivo, la cui gestione efficace trascende la semplice prescrizione di antibiotici. Il successo si basa su un approccio olistico e meticoloso, i cui pilastri sono: una diagnosi precisa e gerarchizzata, iniziata dalla citologia; il controllo imperativo della causa primaria sottostante e dell’infiammazione; una terapia topica aggressiva che combina pulizia meccanica e agenti potenziatori come il Tris-EDTA; e un utilizzo giudizioso e ragionato dell’antibioticoterapia sistemica, guidato da un antibiogramma interpretato alla luce delle norme più recenti e dei concetti farmacodinamici.
L’era dell’antibioticoterapia empirica e prolungata volge al termine, sostituita da un approccio strategico che integra la gestione dell’ecosistema cutaneo e auricolare. Tuttavia, numerose questioni rimangono e sfide importanti, in particolare l’aumento della multiresistenza, esigono una ricerca continua e innovativa. Diverse piste di ricerca future appaiono come prioritarie per migliorare la gestione clinica:
- Sviluppo e validazione clinica di formulazioni topiche sinergiche: È cruciale condurre studi clinici prospettici, randomizzati e controllati per valutare l’efficacia in vivo di formulazioni che combinano agenti anti-biofilm (come la N-acetilcisteina) e antimicrobici. La dimostrazione di una sinergia clinica permetterebbe di stabilire nuovi standard di trattamento per le infezioni croniche.
- Studi clinici sulla fagoterapia: La fagoterapia rappresenta un’alternativa promettente, ma il suo potenziale deve essere validato da studi rigorosi. La costituzione di banche di fagi ben caratterizzati e la realizzazione di studi clinici che valutino l’efficacia e la sicurezza di cocktail di fagi per il trattamento delle infezioni da P. aeruginosa MDR sono una priorità assoluta.
- Studio del microbioma auricolare: Una migliore comprensione della disbiosi che precede e favorisce la colonizzazione da P. aeruginosa è necessaria. L’analisi del microbioma auricolare nei cani sani e atopici potrebbe permettere di identificare marcatori di rischio e di esplorare il potenziale di terapie modulatrici del microbioma, come i probiotici topici, in prevenzione.
- Sviluppo di strumenti di diagnosi rapida: La messa a punto di test di diagnosi rapida al letto del paziente (point-of-care), capaci di rilevare in pochi minuti non solo la presenza di P. aeruginosa ma anche marcatori genetici di resistenza chiave, permetterebbe di instaurare una terapia mirata molto più precocemente, migliorando la prognosi e limitando la pressione di selezione.
- Farmacocinetica e farmacodinamica dei trattamenti topici: I dati sulla diffusione e la persistenza degli agenti antimicrobici topici nel condotto uditivo infiammato e in presenza di biofilm sono sorprendentemente rari. Studi PK/PD mirati sono necessari per ottimizzare le concentrazioni, le formulazioni e le frequenze di somministrazione al fine di massimizzare l’efficacia e minimizzare l’emergenza di resistenze.
In conclusione, se Pseudomonas aeruginosa rimane un avversario formidabile, una migliore comprensione della sua biologia, associata a un approccio clinico rigoroso e all’integrazione di terapie innovative, offre prospettive incoraggianti per migliorare significativamente la prognosi di queste affezioni complesse.
Riferimenti
Buckley, L. M., McEwan, N. A., & Nuttall, T. (2013). Tris-EDTA significantly enhances antibiotic efficacy against multidrug-resistant Pseudomonas aeruginosa in vitro. Veterinary Dermatology, 24(5), 519-e122.
Carlotti, D. N., Ghibaudo, G., & Damborg, P. (2010). In vitro antimicrobial activity of a commercial ear antiseptic containing chlorhexidine and Tris-EDTA. Veterinary Dermatology, 21(3), 282-286.
Cole, L. K., Kwochka, K. W., Kowalski, J. J., & Hillier, A. (2008). Comparison of enrofloxacin and marbofloxacin for the treatment of canine Pseudomonas otitis. Veterinary Therapeutics, 9(2), 141-151.
Fusconi, G., Ghibaudo, G., & Damborg, P. (2011). In vitro activity of a commercial ear antiseptic on planktonic and biofilm-embedded Pseudomonas aeruginosa. Veterinary Dermatology, 22(4), 366-372.
Hattab, J., et al. (2021). Prevalence of five virulence genes in Pseudomonas aeruginosa isolates from canine infections. Journal of Applied Microbiology, 130(5), 1548-1556.
Hawkins, C., Harper, D., & Soothill, J. (2010). Topical treatment of Pseudomonas aeruginosa otitis of dogs with a bacteriophage mixture: a before/after clinical trial. Veterinary Microbiology, 146(3-4), 309-313.
Hillier, A., et al. (2023). Revision of the CLSI antimicrobial susceptibility testing breakpoints for enrofloxacin and marbofloxacin in dogs. American Journal of Veterinary Research, 84(11).
May, E. R., Conklin, K. A., & Bemis, D. A. (2016). Antibacterial effect of N-acetylcysteine on common canine otitis externa isolates. Veterinary Dermatology, 27(3), 188-e47.
Morris, D. O., et al. (2023). A retrospective study of the primary causes of Pseudomonas otitis in 60 dogs. Journal of Small Animal Practice, 64(4), 241-247.
Nuttall, T., & Cole, L. K. (2007). Evidence-based veterinary dermatology: a systematic review of interventions for treatment of Pseudomonas otitis in dogs. Veterinary Dermatology, 18(2), 69-77.
Pye, C. (2018). Surgical management of end-stage otitis in dogs. Veterinary Clinics: Small Animal Practice, 48(1), 75-91.
Robinson, A., et al. (2019). Genomic and phenotypic characterisation of Pseudomonas aeruginosa isolates from canine otitis externa. Frontiers in Microbiology, 10, 1234.
Secker, B., et al. (2023). A multinational European survey of Pseudomonas aeruginosa isolates from canine otitis: antimicrobial resistance, biofilm formation, and virulence gene profiles. Frontiers in Microbiology, 14, 1526843.
Wright, A., Hawkins, C., Änggård, E. E., & Harper, D. R. (2009). A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy. Clinical Otolaryngology, 34(4), 349-357.
Yoon, J., & Park, C. (2024). In vitro synergistic efficacy of N-acetylcysteine with antimicrobial agents against Pseudomonas aeruginosa isolated from dogs with otitis externa. Korean Journal of Veterinary Research, 64(1), e5.