La dermatomiosite (DM) canina è una vasculopatia ischemica infiammatoria, di origine immunitaria e con una forte predisposizione genetica, che colpisce principalmente la pelle e, in misura minore, la muscolatura striata. Presentiamo una panoramica completa patogenetica, diagnostica e terapeutica di questa dermatosi.
Giugno 2025
Introduzione
Inizialmente riconosciuta nel Collie e nel Pastore delle Shetland, questa condizione serve da modello spontaneo particolarmente rilevante per lo studio della dermatomiosite giovanile (DMJ) umana, una malattia autoimmune sistemica che presenta sorprendenti somiglianze cliniche e istopatologiche. La DM canina è quindi non solo una preoccupazione clinica per i medici veterinari, ma anche un prezioso campo di ricerca traslazionale.
Nell’ultimo decennio, la comprensione della DM canina ha subito una trasformazione radicale. Il concetto di una semplice malattia ereditaria a trasmissione autosomica dominante con penetranza variabile ed espressività incostante è stato superato da un modello molto più sfumato di disturbo genetico complesso. I progressi nella genomica hanno permesso di identificare loci di rischio specifici e le loro interazioni epistatiche, offrendo un quadro predittivo per la malattia. Parallelamente, la ricerca fondamentale ha evidenziato il ruolo centrale di una disregolazione della via di segnalazione dell’interferone (IFN) di tipo I come principale motore patogeno, in modo simile a quanto osservato nella DMJ umana. Questa convergenza di conoscenze genetiche e immunopatologiche ha aperto la strada a approcci diagnostici e terapeutici più mirati, che ridefiniscono la gestione di questa malattia nel 2025. Vi presentiamo lo stato attuale delle conoscenze sulla dermatomiosite canina, integrando le più recenti scoperte sulla sua patogenesi, diagnosi e strategie terapeutiche emergenti.
Eziopatogenesi
L’eziopatogenesi della dermatomiosite canina è il risultato di una complessa interazione tra una predisposizione genetica poligenica, una disregolazione del sistema immunitario innato e fattori scatenanti ambientali. La comprensione di questa cascata di eventi, dal gene alla lesione, è fondamentale per comprendere la malattia e giustificare gli approcci terapeutici moderni.
1.1 La componente genetica della dermatomiosite canina
La nozione storica di una trasmissione autosomica dominante a penetranza incompleta è stata affinata da studi di associazione su tutto il genoma (GWAS) che hanno rivelato un modello di ereditarietà complesso ed epistatico. Il rischio di sviluppare la DM nelle razze predisposte, come il Collie e il Pastore delle Shetland, è ora compreso come determinato dall’interazione di varianti all’interno di tre loci genetici indipendenti.
Identificazione dei Loci di Rischio
La ricerca ha identificato tre principali regioni cromosomiche i cui alleli specifici modulano il rischio di DM.
- Locus A (Cromosoma 10) : È stata trovata un’associazione molto forte con una mutazione missenso nel gene PAN2. Il gene PAN2 codifica per una subunità del complesso della poli(A) nucleasi deadenilasica, che svolge un ruolo cruciale nella regolazione della degradazione dell’RNA messaggero (mRNA). Questa funzione è particolarmente importante per la regolazione della risposta infiammatoria, in particolare attraverso la stabilizzazione dei trascritti di geni pro-infiammatori contenenti elementi ricchi di adenina-uracile (ARE), come quello dell’interleuchina 6 (IL-6), una citochina nota per essere sovraespressa nella DMJ umana. Questa mutazione stabilisce quindi un collegamento diretto tra un difetto genetico fondamentale e una predisposizione alla disregolazione immunitaria.
- Locus B (Cromosoma 31) : Una seconda associazione significativa è stata identificata con un’inserzione/delezione (indel) in una regione non codificante 5′ del gene MAP3K7CL . Sebbene la funzione precisa di questo gene, che codifica per una chinasi, sia ancora poco studiata, è espresso principalmente nei leucociti del sangue periferico, suggerendo un ruolo nella funzione immunitaria.
- Locus C (CMH Canino) : È stata osservata un’associazione significativa con un aplotipo specifico del complesso maggiore di istocompatibilità (CMH) canino di classe II. L’associazione è particolarmente forte negli individui omozigoti per questo aplotipo. Tuttavia, l’elevata frequenza di questo aplotipo di rischio nei cani sani indica che da solo non è sufficiente a causare la malattia e che la sua influenza è modulata dagli altri loci di rischio.
Interazione Epistatica e Stratificazione del Rischio
L’analisi combinata dei genotipi di questi tre loci ha rivelato un modello di rischio non semplicemente additivo, ma epistatico, dove l’effetto di un gene è modificato dalla presenza di uno o più altri geni. Le ricerche hanno dimostrato che 9 delle 27 possibili combinazioni genotipiche conferiscono un rischio moderato (penetranza del 33-50%) o elevato (penetranza del 90-100%) di sviluppare la DM, spiegando così il 93% dei casi studiati. Ad esempio, i genotipi AABB (omozigoti per gli alleli di rischio ai loci A e B) presentano una penetranza del 100% quando associati ad almeno un allele di rischio al locus C (AABBCc o AABBCC).
Questa scoperta trasforma la comprensione della malattia. I vecchi concetti di “penetranza incompleta” e “espressività variabile” possono ora essere reinterpretati alla luce di questo modello genetico quantitativo. Queste variazioni fenotipiche non sono casuali ma sono il riflesso diretto del profilo di rischio poligenico di ogni individuo. Un cane con un genotipo ad alto rischio è quasi certo di sviluppare la malattia se esposto ai giusti fattori scatenanti, mentre un cane con un genotipo a rischio moderato potrebbe non esprimere mai la malattia o presentare solo segni lievi e transitori. La genetica fornisce così un quadro predittivo che sostituisce l’incertezza. Ciò ha profonde implicazioni per la consulenza genetica, che passa da una semplice raccomandazione di non riprodurre i cani clinicamente affetti a una strategia di selezione proattiva delle coppie riproduttive volta a minimizzare la produzione di cuccioli portatori di combinazioni genotipiche ad alto rischio.
Correlazione Genotipo-Fenotipo
È stata stabilita una correlazione inversa significativa tra il numero di alleli di rischio ai loci PAN2 e MAP3K7CL e l’età di insorgenza della malattia. I cani portatori di quattro alleli di rischio (omozigoti per il rischio ai due loci) sviluppano la DM a un’età mediana di 5 mesi, mentre quelli che hanno solo due alleli di rischio la sviluppano a un’età mediana di 18,5 mesi. Questa correlazione suggerisce un effetto di dose genica sulla gravità della predisposizione, dove un carico genetico più elevato richiede una soglia di attivazione ambientale più bassa per iniziare la malattia.
Tabella 1: Loci di Rischio Genetico per la Dermatomiosite Canina
|
Nome del Locus |
Gene Associato |
Cromosoma |
Allele Normale (notazione) |
Funzione Biologica Conosciuta/Ipotetica |
|---|---|---|---|---|
|
Locus A |
PAN2 |
10 |
Wildtype (a) |
Regolazione della degradazione dell’mRNA, stabilizzazione dei trascritti della risposta infiammatoria |
|
Locus B |
MAP3K7CL |
31 |
Wildtype (b) |
Chinasi espressa nei tessuti immunologici, ruolo potenziale nella segnalazione immunitaria |
|
Locus C |
DLA-DRB1 |
12 (CMH) |
Altri aplotipi DLA (c) |
Presentazione dell’antigene, regolazione della risposta immunitaria adattativa |
Tabella 2: Stratificazione del Rischio di DM Basata sul Genotipo (Combinazioni dei Loci A e B, modificate dal Locus C)
|
Genotipo Locus A / Locus B |
Rischio con Locus C = cc |
Rischio con Locus C = Cc |
Rischio con Locus C = CC |
|---|---|---|---|
|
aa bb |
Basso |
Basso |
Basso |
|
Aa bb |
Basso |
Basso |
Basso |
|
aa Bb |
Basso |
Basso |
Basso |
|
AA bb |
Sconosciuto |
Moderato |
Moderato |
|
Aa Bb |
Basso |
Basso |
Basso |
|
aa BB |
Basso |
Moderato |
Moderato |
|
AA Bb |
Sconosciuto |
Moderato |
Elevato |
|
Aa BB |
Sconosciuto |
Moderato |
Elevato |
|
AA BB |
Sconosciuto |
Elevato |
Elevato |
|
Tabella adattata dai dati dell’UC Davis Veterinary Genetics Laboratory, basati sulle ricerche di Evans et al. |
|||
1.2 La Cascata di Disregolazione Immunitaria: Vasculopatia e Interferone
La predisposizione genetica è solo il primo passo. La patogenesi della DM è fondamentalmente una malattia del sistema immunitario che colpisce i vasi sanguigni, portando a ischemia tissutale.
La Vasculopatia Ischemica come Lesione Primaria
La DM è innanzitutto una vasculopatia infiammatoria. Il processo patologico centrale è un attacco mediato dall’immunità diretto contro l’endotelio dei piccoli vasi sanguigni, in particolare i capillari endomisiali nei muscoli e i vasi del derma cutaneo. Questa infiammazione endoteliale, o endotelite, porta a un restringimento del lume vascolare, una microtrombosi e, infine, una ipoperfusione dei tessuti a valle. L’ischemia risultante è responsabile delle manifestazioni cliniche caratteristiche: atrofia e necrosi dei follicoli piliferi e dell’epidermide (causando alopecia e ulcerazione) e degenerazione delle fibre muscolari (causando atrofia e debolezza).
L’Interferone (IFN) di Tipo I come Motore Patogeno Centrale
Prove schiaccianti, provenienti da modelli umani e canini, indicano che un’iperattivazione della via di segnalazione dell’interferone di tipo I è il motore principale di questa vasculopatia. Questa “firma IFN” si manifesta con una sovraespressione sistemica e tissutale (pelle, muscolo, sangue) di un insieme di geni la cui trascrizione è indotta dall’IFN, come MXA, ISG15 e CXCL10. La forza di questa firma nella pelle è direttamente correlata all’attività della malattia cutanea e diminuisce o scompare nei pazienti in remissione, il che la rende un potenziale biomarcatore dell’attività della malattia. Gli interferoni di tipo I hanno effetti pleiotropici che possono spiegare la vasculopatia: possono attivare le cellule endoteliali, favorire uno stato pro-infiammatorio e pro-trombotico e reclutare cellule immunitarie nel sito dell’infiammazione, perpetuando così il danno vascolare.
Ruolo degli Auto-anticorpi e dei Complessi Immuni Circolanti (CIC)
Sebbene la ricerca di autoanticorpi specifici per la miosite sia meno avanzata nel cane rispetto all’uomo, studi più datati hanno stabilito una correlazione positiva tra la gravità clinica della DM canina e i livelli sierici di complessi immuni circolanti (CIC) e immunoglobuline G (IgG). Si ipotizza che questi CIC possano depositarsi nella parete dei microvasi, attivando la cascata del complemento e contribuendo così all’endotelitite e alla vasculopatia.
La convergenza di questi dati permette di stabilire una catena causale unificata che non era evidente dieci anni fa. In primo luogo, una predisposizione genetica, in particolare attraverso mutazioni in geni regolatori dell’infiammazione come PAN2, crea un terreno fertile per una risposta immunitaria aberrante. In secondo luogo, in presenza di fattori scatenanti, questa predisposizione porta a una produzione eccessiva e sostenuta di IFN di tipo I, il meccanismo centrale della malattia. In terzo luogo, questo ambiente ricco di IFN induce una vasculopatia danneggiando direttamente le cellule endoteliali. In quarto luogo, la vasculopatia compromette l’afflusso di sangue, causando ischemia nei tessuti vulnerabili. Infine, questa ischemia si manifesta clinicamente con le lesioni cutanee e muscolari caratteristiche della DM. Questa comprensione unificata della patogenesi giustifica pienamente il cambiamento di paradigma terapeutico attuale, che si allontana dagli immunosoppressori generali per rivolgersi a terapie che mirano e bloccano specificamente la via di segnalazione dell’IFN.
1.3 Fattori Scatenanti Ambientali ed Endogeni
In un individuo geneticamente predisposto, i fattori scatenanti sono spesso necessari per iniziare o esacerbare la malattia.
- Fattori di Rischio Documentati : Diversi fattori sono noti per svolgere un ruolo nello scatenare le crisi cliniche.
-
- Traumi Meccanici : La localizzazione tipica delle lesioni sulle prominenze ossee (faccia, carpi, tarsi) e sui punti di pressione suggerisce fortemente che i microtraumi ripetuti agiscono come un fattore scatenante locale, un fenomeno di Koebner.
- Esposizione ai Raggi Ultravioletti (UV) : La fotodistribuzione di alcune lesioni facciali e l’aggravamento riportato dopo l’esposizione al sole implicano gli UV come un importante fattore scatenante, probabilmente inducendo l’apoptosi dei cheratinociti e rilasciando autoantigeni.
- Fattori Ormonali : Le riacutizzazioni della malattia sono state associate all’estro, suggerendo un’influenza ormonale sulla regolazione immunitaria.
- Il Ruolo della Vaccinazione : Il legame tra vaccinazione e DM è un argomento di discussione importante. Esiste una sindrome ben riconosciuta di dermatopatia ischemica post-vaccinica, in particolare dopo la somministrazione del vaccino antirabbico, che è clinicamente e istologicamente indistinguibile dalla DM. Uno studio retrospettivo su 177 casi di dermatopatia ischemica ha stimato che un’associazione con una vaccinazione recente era probabile nel 48,3% dei casi. Piuttosto che considerare la dermatopatia post-vaccinica come un’entità completamente distinta, è più logico vederla come DM genetica smascherata dal potente stimolo immunitario che la vaccinazione rappresenta. Per un cucciolo portatore di un genotipo ad alto rischio (ad esempio, AABB), l’intensa stimolazione immunitaria indotta da un vaccino potrebbe essere il “test di stress” sufficiente per iniziare la cascata patogena dell’IFN e scatenare la malattia clinica. Ciò ha importanti implicazioni cliniche: per i cuccioli di razze a rischio con uno stato genetico sconosciuto o ad alto rischio, non si tratta di evitare la vaccinazione, ma di informare i proprietari e di mettere in atto una stretta sorveglianza per rilevare l’insorgenza di lesioni cutanee nelle settimane e nei mesi successivi alle iniezioni, al fine di consentire un intervento precoce.
Spettro Clinico e Approccio Diagnostico
La presentazione clinica della DM canina è variabile, dalle forme cutanee lievi e auto-limitanti alle gravi manifestazioni sistemiche. La diagnosi si basa su un approccio multimodale che combina anamnesi, segni clinici ed esami complementari mirati.
2.1 Predisposizione di Razza e Classificazione della Malattia
- DM Familiare : Il Collie e il Pastore delle Shetland sono le razze emblematiche della malattia, nelle quali è stata provata una base ereditaria e sono stati identificati i loci di rischio genetico.
- Sindrome tipo DM (Dermatomiosite-simile) : Quadri clinici e istologici simili sono stati descritti in un numero crescente di altre razze, tra cui il Beauceron, il Welsh Corgi, il Lakeland Terrier, il Chow Chow, il Pastore Tedesco e il Kuvasz.
La distinzione storica tra “DM familiare” (nelle razze predisposte) e “DM-like” (nelle altre razze) è sempre più considerata semantica piuttosto che biologica. L’istopatologia sottostante è identica, suggerendo vie patogene comuni. Il termine “dermatopatia ischemica” è una diagnosi istopatologica più precisa e unificante che comprende queste diverse presentazioni cliniche. L’approccio diagnostico moderno non dovrebbe quindi fermarsi alla razza, ma piuttosto ricercare i marcatori genetici e patologici della malattia in qualsiasi cane che presenti un quadro clinico compatibile, indipendentemente dalla sua razza.
2.2 Manifestazioni Cliniche
I segni clinici della DM variano considerevolmente da un individuo all’altro, ma generalmente seguono uno schema riconoscibile.
Segni Cutanei
Il coinvolgimento cutaneo è la manifestazione più costante della malattia.
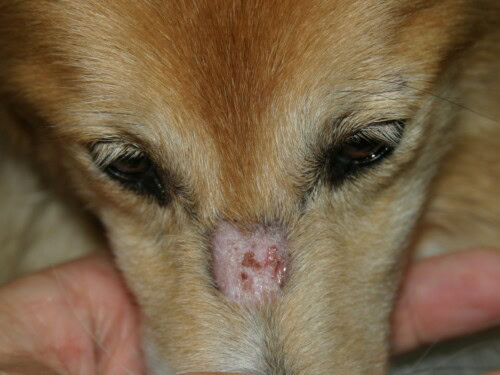
- Lesioni Iniziali : Compaiono tipicamente nel cane giovane, prima dei 6 mesi di età, e spesso già a 7-11 settimane. La presentazione iniziale può essere sottile, con papule, pustole o vescicole transitorie che evolvono rapidamente in lesioni più caratteristiche di eritema, alopecia, squame e croste.
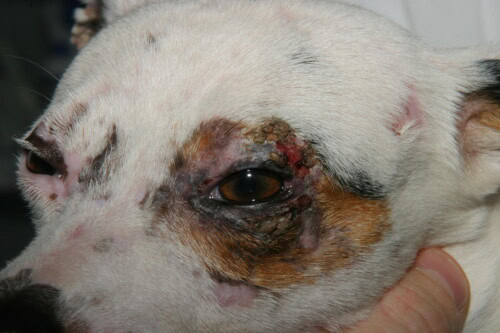
- Distribuzione Caratteristica : Le lesioni hanno una predilezione per le aree di trauma e di scarsa circolazione collaterale: la faccia (regioni perioculare e peribuccale, ponte nasale), i padiglioni auricolari (in particolare la punta e le pieghe), l’estremità della coda e la pelle in corrispondenza delle prominenze ossee degli arti (carpi, tarsi, dita).
- Lesioni Croniche : Con il tempo, le lesioni evolvono verso un’alopecia cicatriziale permanente, atrofia cutanea e alterazioni pigmentarie (iperpigmentazione o ipopigmentazione), creando un aspetto a chiazze chiamato poichilodermia. Può essere osservato anche un coinvolgimento delle unghie (onicodistrofia, onicorressi, onicoschizia).
Grave interessamento della coda con alopecia e lesioni crostose
Coinvolgimento palpebrale principalmente unilaterale in questo cane
Lesione che può perfettamente imitare una dermatofitosi
Segni Miopatici
Il coinvolgimento muscolare è più variabile e, quando clinicamente evidente, di solito è segno di una forma più grave della malattia.
- Correlazione con i Segni Cutanei : La miosite clinica si manifesta solitamente dopo l’insorgenza delle lesioni cutanee e la sua gravità è spesso proporzionale a quella del coinvolgimento dermatologico.
- Atrofia Muscolare : L’atrofia dei muscoli masticatori (temporale e masseterico) è il segno muscolare più frequente e può essere l’unica manifestazione miopatica. Nei casi più gravi, può svilupparsi un’atrofia bilaterale simmetrica dei muscoli della testa, del collo, del tronco e degli arti.
- Segni Funzionali : L’atrofia e l’infiammazione dei muscoli della masticazione e della deglutizione possono portare a difficoltà nella prensione del cibo, nella masticazione e nella deglutizione (disfagia). È descritta anche un’andatura anomala, rigida e impacciata (“stiff-stilted gait” o “andatura d’oca”).
- Complicanze Gravi : Lo sviluppo di un megaesofago (dilatazione e ipomobilità dell’esofago) è una complicanza grave, che comporta rigurgiti, perdita di peso e un alto rischio di polmonite da aspirazione, una causa frequente di mortalità nelle forme gravi di DM.
2.3 Diagnosi di Certezza: Una Strategia Multimodale
La diagnosi di DM non si basa mai su un singolo test, ma sulla convergenza di diversi elementi, dopo aver escluso le comuni diagnosi differenziali come la rogna demodettica, la piodermite batterica, la dermatofitosi e il lupus eritematoso discoide.
- Istopatologia (Pietra Angolare) : La biopsia è l’esame chiave per confermare la natura ischemica delle lesioni.
-
- Biopsia Cutanea : Prelevata su una lesione recente e attiva, rivela cambiamenti caratteristici di dermatopatia ischemica: una dermatite interfacciale paucicellulare (con poche cellule infiammatorie), atrofia dei follicoli piliferi, vacuolizzazione dei cheratinociti dello strato basale dell’epidermide, presenza di cellule apoptotiche (corpi di Civatte) e fibrosi o accumulo di mucina nel derma. I cambiamenti vascolari possono essere sottili, manifestandosi con un aspetto “sfocato” ed eosinofilico del collagene perivascolare (“smudged collagen”) piuttosto che con una evidente vasculite necrotizzante.
- Biopsia Muscolare : Sebbene meno sistematicamente praticata di routine, è indicata in caso di sospetto coinvolgimento miopatico. Mostra tipicamente una miosite interstiziale e perivascolare, a predominanza linfocitaria, plasmacellulare e istiocitaria, associata a segni di sofferenza delle fibre muscolari (degenerazione, necrosi, rigenerazione e atrofia).
- Elettrodiagnostica (EMG) : L’elettromiografia è uno strumento molto sensibile per rilevare una miopatia, anche in assenza di segni clinici evidenti. L’esame, eseguito sotto anestesia, rivela attività elettriche spontanee anomale nei muscoli colpiti, come potenziali di fibrillazione, onde appuntite positive e scariche ad alta frequenza bizzarre o miotoniche.
- Test Genetici : Per i Collie, i Pastori delle Shetland e i loro incroci, il test dei tre loci di rischio (PAN2, MAP3K7CL, DLA) è diventato uno strumento diagnostico e prognostico essenziale. Consente di confermare la predisposizione genetica e di stratificare il rischio dell’animale (basso, moderato o elevato), il che aiuta a orientare la consulenza ai proprietari.
- Biochimica Clinica : Il dosaggio della creatina chinasi (CK) sierica è utile. Un’elevazione marcata è un indicatore di miosite attiva e danno muscolare. Tuttavia, un valore normale di CK non esclude la diagnosi, poiché il coinvolgimento muscolare può essere minimo, focale o cronico con poca infiammazione attiva.
Tabella 3: Modalità Diagnostiche per la Dermatomiosite Canina
|
Modalità Diagnostica |
Risultati Attesi / Anomalia Chiave |
|---|---|
|
Istopatologia Cutanea |
Dermatite interfacciale paucicellulare, atrofia follicolare, vacuolizzazione basale, corpi di Civatte, fibrosi/mucinosis dermica, “collagene sfuocato” |
|
Istopatologia Muscolare |
Miosite interstiziale e perivascolare (linfo-plasmocitaria), degenerazione/rigenerazione/atrofia delle fibre muscolari |
|
Elettromiografia (EMG) |
Attività spontanea anormale: potenziali di fibrillazione, onde appuntite positive, scariche miotoniche/bizzarre ad alta frequenza |
|
Test Genetico (3 loci) |
Identificazione degli alleli di rischio nei loci PAN2, MAP3K7CL e DLA; calcolo di un punteggio di rischio (Basso, Moderato, Elevato) |
|
Biochimica (Creatina Chinasi) |
Elevazione (spesso marcata) in caso di miosite attiva, ma può essere normale nelle forme croniche o con scarso coinvolgimento muscolare |
Strategie Terapeutiche e Gestione nel 2025
Prognosi ed Evoluzione a Lungo Termine
La prognosi della DM canina è molto variabile e dipende da una moltitudine di fattori. La comprensione di questi indicatori e dei profili evolutivi della malattia è essenziale per fornire ai proprietari aspettative realistiche e per adattare la gestione a lungo termine.
4.1 Indicatori Prognostici: Predire il Futuro
Diversi fattori permettono di stimare la probabile evoluzione della malattia in un dato cane.
- Fattori Clinici:
-
- Gravità della Malattia : È il fattore prognostico più diretto. I casi lievi, con solo alcune lesioni cutanee non ulcerate, hanno una prognosi eccellente e possono anche entrare in remissione spontanea senza sequele. I casi moderati hanno una buona prognosi di controllo, ma spesso con un’alopecia cicatriziale residua. I casi gravi, con ulcere estese e/o significativo coinvolgimento muscolare, hanno una prognosi riservata o sfavorevole.
- Coinvolgimento Muscolare ed Esofageo : La presenza di una miopatia clinicamente significativa, e in particolare lo sviluppo di un megaesofago, peggiora considerevolmente la prognosi. Il rischio di malnutrizione, di falsa deglutizione e di polmonite da aspirazione diventa una grave minaccia vitale.
- Fattori Demografici : Uno studio retrospettivo su 177 casi di dermatopatia ischemica (escludendo la DM familiare classica) ha identificato due fattori associati a una prognosi meno favorevole: un peso corporeo inferiore a 10 kg e un’età avanzata al momento della biopsia.
- Fattore Genetico : L’integrazione del profilo di rischio genetico (basato sui 3 loci) nella valutazione prognostica rappresenta un progresso significativo. Questo test permette di passare da una prognosi reattiva, basata sui segni clinici già presenti, a una prognosi proattiva e predittiva. Un cucciolo Collie o Shetland testato alla nascita e che rivela un genotipo ad alto rischio (es: AABBCC) ha una prognosi intrinsecamente più riservata, anche prima della comparsa del minimo segno clinico. Si prevede che svilupperà la malattia più precocemente e potenzialmente in una forma più grave. Questa informazione consente una stratificazione precoce dei pazienti e l’attuazione di una sorveglianza rafforzata e di una strategia di intervento terapeutico aggressiva ai primi segni, il che potrebbe migliorare il risultato a lungo termine.
4.2 Evoluzione della Malattia e Gestione a Lungo Termine
In analogia con la DMJ umana, la DM canina può seguire diversi schemi evolutivi nel tempo.
- Profili Evolutivi :
-
- Monociclica : La malattia si manifesta con un unico episodio, spesso negli animali leggermente colpiti, che entra in remissione completa (talvolta spontaneamente) e non recidiva. La prognosi è eccellente.
- Policiclica : La malattia evolve per poussées, con periodi di remissione intervallati da recidive. Queste poussées sono spesso innescate da fattori scatenanti (esposizione UV, traumi, estro). La gestione mira a controllare le poussées e a prolungare i periodi di remissione.
- Cronico-continuo : La malattia rimane attiva in modo persistente, senza un periodo di remissione completa. Questi casi richiedono un trattamento a vita e sono associati alla prognosi più riservata.
- Gestione Cronica : La gestione delle forme croniche (policicliche o continue) è una sfida. L’obiettivo è mantenere la malattia sotto controllo con la dose minima efficace di farmaci per limitare gli effetti collaterali cumulativi. L’uso di agenti cortisone-sparing (come la Ciclosporina) e, sempre più, di terapie mirate come gli inibitori di JAK, è al centro di questa strategia. Un regolare follow-up clinico e biologico è indispensabile per aggiustare il trattamento e monitorare la comparsa di complicanze, incluso un rischio potenzialmente aumentato di malattia renale nei cani con infiammazione cronica a lungo termine.
Conclusione
Nel 2025, la dermatomiosite canina è passata dallo status di malattia ereditaria enigmatica a quello di disturbo genetico complesso i cui meccanismi molecolari sono sempre meglio compresi. Il riconoscimento della sua eziopatogenesi, incentrata su una vasculopatia ischemica guidata da una disregolazione della via dell’interferone di tipo I e sostenuta da interazioni genetiche specifiche, ha trasformato il suo approccio clinico.
Questo cambio di paradigma ha implicazioni profonde e concrete. La diagnosi si è evoluta per integrare i test genetici come pilastro essenziale accanto all’istopatologia e all’elettromiografia, consentendo una stratificazione precoce del rischio e una prognosi più precisa. Sul piano terapeutico, l’arsenale si è arricchito, passando dagli immunosoppressori ad ampio spettro, efficaci ma gravati da effetti collaterali, a terapie mirate che bloccano specificamente le vie patogene identificate. L’uso degli inibitori della Janus Chinasi, in particolare, rappresenta la nuova frontiera del trattamento, offrendo la speranza di un controllo più efficace e sicuro della malattia.
Le prospettive di ricerca future sono chiare. Dovranno concentrarsi sull’identificazione di loci di rischio in altre razze canine, sulla convalida su vasta scala dell’efficacia e della sicurezza a lungo termine delle terapie mirate attraverso studi clinici randomizzati, e sullo sviluppo di biomarcatori sanguigni (come la firma IFN) per un monitoraggio non invasivo dell’attività della malattia e una personalizzazione sempre maggiore del trattamento. Il modello canino della dermatomiosite, per la sua rilevanza e complessità, continuerà a essere una risorsa inestimabile per far progredire la comprensione e il trattamento di questa malattia invalidante, sia per il benessere dei cani che per le conoscenze che apporta alla medicina umana.
Riferimenti
- Evans, J. M., Noorai, R. E., Tsai, K. L., Starr-Moss, A. N., Hill, C. M., Anderson, K. J., Famula, T. R., & Clark, L. A. (2017). Beyond the MHC: A canine model of dermatomyositis shows a complex pattern of genetic risk involving novel loci. PLOS Genetics, 13(2), e1006604.
- Hargis, A. M., Prieur, D. J., Haupt, K. H., Collier, L. L., & Evermann, J. F. (1985). Familial canine dermatomyositis. Initial characterization of the cutaneous and muscular lesions. American Journal of Pathology, 121(3), 521–530.
- Rees, C. A., & Boothe, D. M. (2003). Therapeutic response to pentoxifylline and its active metabolites in dogs with familial canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234–241.
- Hargis, A. M., Haupt, K. H., Hegreberg, G. A., Prieur, D. J., & Moore, M. P. (1984). Familial canine dermatomyositis. Initial characterization of the cutaneous and muscular lesions. American Journal of Pathology, 116(2), 234–244.
- Hargis, A. M., & Prieur, D. J. (1987). Prospective study of familial canine dermatomyositis. Correlation of the severity of dermatomyositis and circulating immune complexes. American Journal of Pathology, 128(1), 129–139.
- Pumphrey, S. A., & Outerbridge, C. A. (2019). The role of oclacitinib in the management of ischaemic dermatopathy in four dogs. Veterinary Dermatology, 30(4), 346-e100.
- Mandrioli, L., & Biserni, R. (2024). A case of refractory nasal dermatomyositis-like disease in an adult Poodle. ResearchGate.
- Errante, P. R. (2022). Dermatomyositis Disease in Dogs. International Journal of Zoology and Animal Biology, 5(8).
- Mendoza, F., & Toral, M. (2019). Three Cases of Canine Dermatomyositis-Like Disease. Acta Scientiae Veterinariae, 47, 1632.
- Mellett, M., & Allen, A. G. (2018). Dermatomyositis etiopathogenesis: a rebel soldier in the muscle. Current Opinion in Rheumatology, 30(6), 610–616.
- Marie, I., Drouot, L., Menard, J. F., & Levesque, H. (2006). Long-term outcome and prognostic factors of juvenile dermatomyositis: a multinational, multicenter study of 490 patients. Arthritis and Rheumatism, 54(11), 3683–3692.
- Kmieć, P., & Gomułkiewicz, A. (2021). The role of interferons type I, II and III in myositis: A review. Clinical and Experimental Rheumatology, 39(4), 882-890.
- Greenberg, S. A., & Pinkus, J. L. (2011). A broad molecular profile of dermatomyositis skin reveals prominent interferon-inducible gene expression and demonstrates molecular similarity to lupus skin. PLoS ONE, 6(12), e29161.
- Berger, D. (2016). Canine Dermatomyositis. Clinician’s Brief, 14(11), 50-52.
- Ghafour, A., & Isenberg, D. A. (2020). The immunopathogenesis of dermatomyositis. Best Practice & Research Clinical Rheumatology, 34(4), 101533.
- Mandell, D. C., & Dehghanpir, S. D. (2021). An update on the diagnosis and treatment of inflammatory myopathies. Journal of Clinical Medicine, 10(15), 3381.
- Main-Nolton, A., & Clark, L. A. (2022). Transcriptome Profiling of Canine Familial Dermatomyositis (DMS) Skin Lesions and Treatment in Collies and Shetland sheepdogs. VIN.
- Santoro, D., & Pucheu-Haston, C. M. (2014). Effects of pentoxifylline on in vivo and in vitro IgE-mediated mast cell degranulation and cutaneous inflammation in dogs. American Journal of Veterinary Research, 75(2), 152–158.
- Olivry, T., & Banovic, F. (2019). Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Diseases of Animals (ICADA). Veterinary Dermatology, 30(3), 169-e50.
- Cosgrove, S. B., Cleaver, D. M., King, V. L., Gilmer, A. R., Daniels, A. E., Wren, J. A., & Stegemann, M. R. (2013). A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis. Veterinary Dermatology, 25(2), 91-e23.
- Gortel, K. (2006). What’s new in dermatologic therapy? DVM360.
- Rees, C. A., & Boothe, D. M. (2004). Therapeutic response to pentoxifylline and its active metabolites in dogs with familial canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234-241.
- Archer, T. M., & Boothe, D. M. (2004). Cyclosporine: a review of its use in veterinary dermatology. Veterinary Dermatology, 15(6), 349–361.
- Robson, D. C. (2014). Cyclosporine in Veterinary Dermatology. Proceedings of the 39th World Small Animal Veterinary Association World Congress.
- Alexishcheva, A., & Guryeva, S. (2024). Interferon signature as a biomarker of skin disease activity in patients with refractory juvenile dermatomyositis. Frontiers in Medicine, 11, 1214920.
- Navale, S., & De, A. (2024). Clinical Progress in Mesenchymal Stem Cell Therapy: A Focus on Rheumatic Diseases. ResearchGate.
- de Mello, M. F., & Hagiwara, M. K. (2007). Canine ischaemic dermatopathy: a retrospective study of 177 cases (2005-2016). Veterinary Dermatology, 28(5), 485-e117.
- Gury, T., & Seror, R. (2024). Prognostic factors and long-term outcome in dogs diagnosed with primary and secondary immune thrombocytopenia in Ireland. Journal of Small Animal Practice.
- Fantini, D., & Ciliberto, G. (2022). Novel Management of Masticatory Myositis in Three Dogs with a Selective Janus Kinase (JAK)-1 Inhibitor. ResearchGate.
- Masi, G., & D’Alessandro, A. (2024). Recent advances in research on dermatomyositis. Uptocure.
- Ardalan, K., & Marques, M. C. (2025). Psychometric properties of patient-reported outcomes measurement information system (PROMIS) fixed short forms in Juvenile Myositis. Seminars in Arthritis and Rheumatism, 71.
- Bartels, C., & Putterman, C. (2022). Juvenile dermatomyositis: updates in pathogenesis and biomarkers. Current Rheumatology Reports, 24(10), 307-317.
- Ziskin, J., & Fiorentino, D. (2024). Recent advances in the treatment of dermatomyositis. Current Opinion in Rheumatology, 36(3), 203-210.
- Mandl, T., & Lundberg, I. E. (2019). The role of interferons type I, II and III in myositis: A review. Clinical and Experimental Rheumatology, 37(5), 868-877.
- van der Kooi, A. J., & van de Vlekkert, J. (2023). An inflammatory myopathy in the Dutch Kooiker dog: a study of 119 cases. Journal of Veterinary Internal Medicine, 37(2), 643-653.
- Viviano, K. R. (2016). Cyclosporine: a review of its use in veterinary medicine. Veterinary Clinics of North America: Small Animal Practice, 46(2), 245-265.
- Nuttall, T., & Gey, van Pittius, M. (2023). Immunosuppressant Therapy in Small Animal Medicine. Today’s Veterinary Practice.
Ricerche Correlate
dermatomiosite canina, dermatomiosite, clinica veterinaria, cane, casi, nel cane, malattia, chow chow, razze, segni clinici, trattamento, dermatologia, shetland, dermatomiosite familiare, pelle, dermatosi, collie, muscoli, éric guaguère, dermatomiosite in, sintomi, emmanuel bensignor, arrossamenti, consultazione, causa, estremità, lesioni, malattia autoimmune, 6p24.1 6p25.3, peli, perdita, articolo, lupus eritematoso, cuccioli, esame clinico, faccia, orecchie, piano, animali, affezione, dita, veterinario, gestione, diagnosi, sistema immunitario, forma, diagnosi differenziale, casa, riassunto, età, benessere, ricerca, esame, modo, fatto, laboratorio, segni, espressività, tipo, alimentazione, pelle e muscoli, informazioni, dermatopatie