Les dermatozoonoses constituent un groupe diversifié d’affections cutanées transmissibles entre les animaux vertébrés et l’homme. Ces pathologies, bien que relativement rares comparativement à l’ensemble des zoonoses connues, représentent un enjeu sanitaire significatif, en particulier dans le contexte urbain où la promiscuité avec les animaux de compagnie s’intensifie.
Le vétérinaire praticien, à l’interface entre santé animale et santé humaine, joue un rôle crucial dans la détection, le traitement et la prévention de ces affections.
La relation étroite entre l’homme et l’animal, si elle apporte d’indéniables bénéfices sur le plan psychologique et social, expose également les propriétaires et les professionnels en contact avec les animaux à divers agents pathogènes transmissibles. Ces dermatozoonoses, d’origines mycosique, parasitaire, bactérienne ou virale, nécessitent une vigilance particulière et une approche collaborative entre médecins et vétérinaires pour une prise en charge optimale des patients, qu’ils soient à deux ou quatre pattes.
Définition et classification des dermatozoonoses
Les dermatozoonoses représentent un sous-ensemble spécifique du vaste domaine des zoonoses. Elles se définissent comme des maladies ou infections transmissibles naturellement des animaux vertébrés à l’homme, et inversement, se manifestant cliniquement chez l’humain par des lésions cutanées, à l’exception des réactions allergiques généralisées. Ce terme découle des racines grecques “zoo” (animal) et “nosos” (maladie), conceptualisé par Virchow au XIXe siècle, puis précisé par l’Organisation Mondiale de la Santé en 1959.
En milieu urbain, les principaux vertébrés responsables de ces affections sont les animaux de compagnie – carnivores domestiques comme le chien et le chat, mais également les rongeurs et lagomorphes de plus en plus présents dans nos foyers. Les populations exposées comprennent non seulement les propriétaires d’animaux, mais aussi diverses professions à risque : vétérinaires et leur personnel, éleveurs, toiletteurs et autres professionnels en contact régulier avec ces animaux.
Classification selon les modalités de transmission
L’Organisation Mondiale de la Santé propose une classification des zoonoses en quatre catégories distinctes, basée sur leurs modalités de transmission :
- Orthozoonose ou zoonose directe : L’agent causal nécessite une seule espèce de vertébrés pour son entretien, bien qu’il puisse affecter plusieurs espèces. Cette espèce permet la transmission à l’homme. La majorité des zoonoses infectieuses classiques comme la rage, le charbon ou la brucellose appartiennent à cette catégorie.
- Cyclozoonose : Dans ce cas, le cycle biologique implique plusieurs espèces de vertébrés, mais une seule d’entre elles est responsable de la contamination humaine. L’échinococcose illustre parfaitement ce processus, avec son cycle impliquant le chien et les herbivores, où le chien agit comme contaminateur de l’homme.
- Métazoonose : Cette catégorie nécessite le passage par un invertébré, généralement un arthropode, qui permet la transmission à l’homme. Les arboviroses comme la fièvre jaune (entretenue sur singes et marsupiaux puis transmise à l’homme par un moustique), les rickettsioses et la leishmaniose entrent dans cette classification.
- Saprozoonose : Ces affections requièrent le passage de l’agent causal dans le milieu extérieur. La fasciolose illustre ce mécanisme, avec la maturation des cercaires responsables de la dermatose furcocercarienne.
Cette classification systématique permet une meilleure compréhension des cycles épidémiologiques et, par conséquent, favorise la mise en place de stratégies de prévention adaptées à chaque type de transmission.
Dermatozoonoses d’origine mycosique
Les infections fongiques transmissibles entre l’animal et l’homme constituent un chapitre important des dermatozoonoses. Ces affections, principalement représentées par les dermatophyties et la sporotrichose, méritent une attention particulière en raison de leur prévalence et de leur impact potentiel sur la santé humaine.
Les dermatophyties
Les dermatophyties, communément appelées “teignes”, représentent des mycoses superficielles infectieuses causées par des champignons épidermotropes, kératinophiles et kératinolytiques – les dermatophytes. Ces champignons ont la particularité de se nourrir de kératine, protéine constitutive des structures superficielles comme les cheveux, les poils, les ongles et la couche cornée de l’épiderme.
Les dermatophytes zoophiles, d’origine animale, constituent une source majeure de dermatozoonoses. Trois espèces principales sont à considérer :
- Microsporum canis : Le principal réservoir est le chat (plus rarement le chien, notamment la race Yorkshire terrier, et autres petits mammifères). Cette espèce est responsable d’environ 95% des dermatophyties félines et 65% des cas canins.
- Trichophyton mentagrophytes : Son réservoir est constitué par les rongeurs, les lagomorphes et les équidés. Le pourcentage de porteurs asymptomatiques varie considérablement selon les espèces: environ 15% chez le cobaye, 10 à 40% chez le lapin, et près de 50% chez la souris et le rat.
- Trichophyton verrucosum : Principalement retrouvé chez les ruminants.
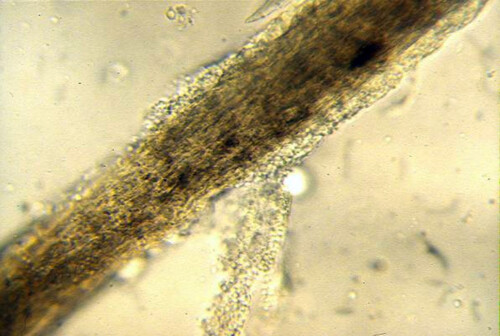
Poil teigneux
La plupart des dermatophytes présentent une adaptation étroite à une espèce cible, chez laquelle ils entraînent généralement peu de signes cliniques. Chez le chat, par exemple, l’incidence des porteurs asymptomatiques de M. canis avoisine 10%, mais peut atteindre des pourcentages bien plus élevés chez les chats errants ou certaines races comme les persans. De façon alarmante, environ 50% des personnes en contact avec un chat infecté, qu’il soit porteur asymptomatique ou cliniquement malade, développent des lésions cutanées.
Présentation clinique chez les animaux
Chez le chat, les lésions classiques de M. canis se caractérisent par des dépilations uniques ou multicentriques, érythémateuses, non prurigineuses, squameuses, à extension centrifuge. Les localisations préférentielles sont la face, les oreilles et les extrémités podales. Un diagnostic tardif peut révéler une alopécie loco-régionale ou généralisée, parfois accompagnée d’inflammation prurigineuse. Dans certains cas, seul un état kératoséborrhéique dorso-lombaire est observable. Les onychomycoses à M. canis sont rares, tandis que les mycétomes se rencontrent exclusivement chez les individus immunodéprimés et dans la race Persane.
Chez le chien, en plus de M. canis, on retrouve trois autres espèces: T. mentagrophytes, M. persicolor (tous deux agents zoophiles) et M. gypseum (agent géophile). Certaines prédispositions raciales existent: les Yorkshire terriers semblent particulièrement vulnérables aux teignes généralisées à M. canis, tandis que les terriers (Fox terrier et autres chiens de chasse au terrier) présentent une susceptibilité accrue aux dermatophyties faciales causées par T. mentagrophytes et M. persicolor.
La majorité des chiens atteints présentent des lésions classiques: dépilations uniques ou multicentriques, arrondies, légèrement squameuses, d’évolution centrifuge, généralement peu prurigineuses. Les localisations préférentielles sont la face et l’extrémité distale des membres. Les kérions (lésions inflammatoires nodulaires suppuratives) sont régulièrement observés, particulièrement avec T. mentagrophytes.
Chez les rongeurs et lagomorphes, de plus en plus populaires comme animaux de compagnie, l’agent quasi-exclusif est T. mentagrophytes, plus rarement M. canis. Cliniquement, les dermatophyties se manifestent par des dépilations centrifuges, souvent prurigineuses et très inflammatoires.
Diagnostic des dermatophyties
Le diagnostic repose sur une approche multi-facettes :
- Examen à la lampe de Wood : Une fluorescence verte typique des poils contaminés est observable dans 50% des cas de M. canis. Cette technique requiert néanmoins une certaine expérience pour distinguer la fluorescence spécifique des fluorescences artéfactuelles.
- Examen microscopique direct de poils et de squames : Il peut révéler une altération de la tige pilaire, gainée par des manchons de spores (invasion pilaire de type endoectothrix dans le cas de M. canis).
- Culture mycologique : Elle permet l’identification définitive du dermatophyte responsable. Chez les porteurs asymptomatiques, le prélèvement peut être réalisé par brossage de toute la surface corporelle avec une brosse à dents stérile ou un carré de moquette stérile, puis mise en culture sur gélose de Sabouraud.
Traitement et prévention
Le traitement est impératif, même si une guérison spontanée est possible (bien qu’elle puisse prendre plusieurs mois, voire années). L’efficacité thérapeutique dépend de la prise en compte de deux facteurs essentiels :
- La forte contagiosité des dermatophyties
- La résistance prolongée des spores dans l’environnement (plusieurs années)
L’approche thérapeutique combine :
- Traitement topique : tonte (discutée selon les cas), shampooings et balnéations à base d’énilconazole ou de miconazole associé à la chlorhexidine
- Traitement systémique : griséofulvine, kétoconazole, itraconazole
- Traitement de l’environnement : énilconazole ou eau de Javel
Le traitement doit être poursuivi jusqu’à guérison mycologique confirmée par négativation des cultures, avec deux contrôles négatifs espacés d’un mois. En élevage, le problème majeur demeure la recontamination permanente due à la charge importante de spores dans l’environnement, rendant l’éradication pratiquement impossible malgré les vides sanitaires. Idéalement, dans les élevages indemnes, tout nouvel animal devrait être placé en quarantaine jusqu’à obtention d’une culture mycologique négative.
Impact chez l’homme
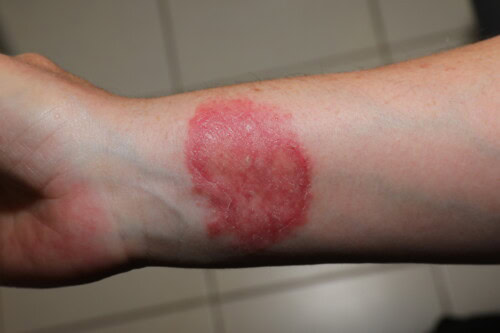
Chez l’homme, les dermatophyties d’origine animale se caractérisent par un polymorphisme clinique remarquable :
- Lésions érythémato-squameuses du cuir chevelu (principalement dues à M. canis)
- Lésions circulaires érythémato-squameuses des zones glabres, souvent polycycliques avec bordure vésiculosquameuse (M. canis, T. mentagrophytes)
- Lésions croûteuses et douloureuses avec réaction inflammatoire sévère (kérion) du cuir chevelu, de la nuque ou de la barbe (sycosis), principalement causées par T. mentagrophytes, plus rarement M. canis
Contamination humaine lors de teigne
Il est important de noter que la teigne figure au tableau n°46 des maladies professionnelles (mycoses cutanées). Selon le Code du travail et les directives européennes, les obligations de l’employeur relèvent de la prévention des risques professionnels, des mesures réglementaires spécifiques, des mesures d’hygiène et sécurité, ainsi que de la surveillance médicale.
La sporotrichose
La sporotrichose représente une mycose profonde à fort potentiel zoonotique, causée par un champignon dimorphique, Sporothrix schenckii. Ce pathogène présente une caractéristique remarquable : il existe sous forme filamenteuse dans le milieu environnant (végétaux en décomposition, humus, sol) et se transforme en levure après pénétration dans les tissus de l’hôte à la faveur d’une effraction cutanée.
Modes de contamination
Si les piqûres et blessures par éléments végétaux souillés constituent le mode de contamination classique, le chat infecté représente une source de contamination particulièrement préoccupante. En effet, les propriétaires d’animaux, les vétérinaires et leur personnel s’exposent à un risque significatif par contact entre leurs lésions cutanées préexistantes et les exsudats lors des manipulations de l’animal malade.
Une caractéristique distinctive de cette infection est la différence de charge fongique selon l’espèce hôte : chez le chien ou l’homme, l’agent fongique est présent en quantité restreinte dans les lésions, alors que chez le chat, les éléments fongiques atteignent des concentrations extrêmement élevées. La transmission à l’homme s’effectue principalement par traumatisme cutané : morsure ou griffure de chat contaminé.
Il est à noter que la sporotrichose canine, plus rare que son équivalent félin, n’a jusqu’à présent pas été associée à des cas avérés de contamination humaine.
Présentation clinique chez les animaux
Chez le chien et le chat, trois formes cliniques distinctes ont été décrites, avec une période d’incubation variable de une semaine à deux mois :
- Forme cutanéo-lymphatique (80% des cas) : Elle se caractérise au site d’inoculation par le développement progressif d’un nodule unique, initialement asymptomatique puis ulcéré, localisé sur la face ou une extrémité podale. D’autres nodules ulcérés et fistulisés peuvent apparaître le long des vaisseaux lymphatiques.
- Forme strictement cutanée (moins fréquente) : Les localisations préférentielles sont les extrémités podales, qui présentent des lésions nodulaires ou des zones de dépilation à bords surélevés, ulcérées et croûteuses.
- Forme généralisée : Observée principalement chez les chats immunodéprimés, elle résulte de la dissémination hématogène des spores infectantes.
Diagnostic et traitement
Le diagnostic s’appuie sur l’examen cytologique de calques cutanés et de biopsies, qui révèlent une abondance remarquable d’éléments fongiques chez le chat. La culture mycologique confirme le diagnostic.
Le traitement repose sur l’administration d’antifongiques systémiques, avec une préférence pour l’itraconazole et le fluconazole. Dans les formes systémiques, l’amphotéricine B donne d’excellents résultats. Le traitement doit être poursuivi au moins un mois après la résolution clinique apparente. Chez le chat, en complément du traitement fongicide systémique, des mesures hygiéniques strictes sont indispensables :
- Nettoyage soigneux des mains et des bras avec des substances antifongiques (chlorhexidine, povidone iodée)
- Port obligatoire de gants de protection
- Information claire des propriétaires concernant le risque zoonotique majeur
En raison du risque élevé de transmission et de la durée prolongée du traitement, l’euthanasie peut être légitimement envisagée pour les chats porteurs.
Manifestations chez l’homme
Chez l’homme, l’incubation varie de trois semaines à trois mois. La forme cutanéo-lymphatique, la plus fréquente, se manifeste au site d’inoculation par un nodule progressif, d’abord asymptomatique puis ulcéré, typiquement localisé sur le dos de la main, un doigt, un pied ou la face.
Dermatozoonoses parasitaires
Les affections cutanées d’origine parasitaire transmissibles entre l’animal et l’homme constituent un groupe hétérogène mais important des dermatozoonoses. Ces parasitoses, impliquant divers acariens, insectes ou helminthes, présentent des tableaux cliniques variés tant chez l’animal que chez l’homme.
Les gales
La gale sarcoptique
La gale sarcoptique représente une acariose hautement contagieuse due à la prolifération dans l’épiderme d’acariens de la famille des Sarcoptidés, Sarcoptes scabiei var. canis. Son importance en dermatologie vétérinaire et humaine découle de sa fréquence croissante, sa gravité clinique et son potentiel zoonotique avéré.
Les espèces principalement affectées par Sarcoptes scabiei var. canis sont le chien, le renard et le furet, mais occasionnellement aussi le chat, l’homme et le cheval. Le cycle évolutif est caractérisé par sa rapidité (10 à 13 jours) dans des conditions environnementales favorables. Les femelles, extrêmement prolifiques, pondent 2 à 3 œufs quotidiennement (environ 50 œufs par femelle) pendant 2 à 4 semaines. Après fécondation, elles creusent des cavernes épidermiques (contrairement aux sillons observés avec les sarcoptes humains) pour y déposer leurs œufs.
Ces œufs éclosent en 2-3 jours, libérant des larves hexapodes qui évoluent en nymphes puis en adultes. Les sarcoptes se nourrissent de tissus épidermiques (histophages). Leur survie dans l’environnement extérieur est limitée à environ 10 jours, nécessitant des conditions spécifiques (15-25°C, humidité relative entre 25 et 85%).
La gale sarcoptique reste sous-diagnostiquée chez le chien. Elle affecte principalement les jeunes chiens de moins d’un an, notamment dans des contextes de collectivités (chenils, refuges), mais peut également atteindre des chiens adultes ou âgés affaiblis par une affection intercurrente.
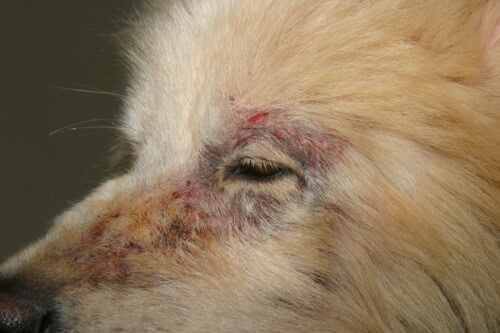
Gale sarcoptique avec atteinte faciale
Le pouvoir pathogène de Sarcoptes scabiei var. canis s’exerce par différents mécanismes :
- Actions mécaniques et chimiques (inoculation de protéines vasodilatatrices et anticoagulantes)
- Action antigénique (excréments, produits de mue, salive)
- Induction de phénomènes d’hypersensibilité de types I, IV et III
L’hypersensibilité de type III peut provoquer des dépôts d’immuns complexes dans divers organes, notamment les reins, causant des glomérulonéphrites. Cette dimension systémique justifie de considérer la gale sarcoptique canine comme une maladie générale et non uniquement dermatologique.
Cliniquement, après une incubation variable (environ 3 semaines post-contact), le tableau classique associe :
- Prurit intense avec réflexe otopodal positif
- Lésions érythémateuses et papuleuses (“boutons de gale”)
- Dépilations en mouchetures
- Formation de croûtes
La distribution lésionnelle est caractéristique en début d’évolution, affectant prioritairement la face (bords libres des pavillons auriculaires), les membres (coudes) et le sternum. Des manifestations systémiques peuvent survenir lors d’infestation ancienne ou chez les chiens âgés : hyperthermie, anorexie, amaigrissement, polyuro-polydipsie secondaire à la glomérulonéphrite immunologique.
Des formes atypiques sont de plus en plus rapportées :
- Formes frustes localisées, peu prurigineuses et peu contagieuses
- “Gale norvégienne” caractérisée par des squames compactes épaisses, un prurit modéré et la présence massive de sarcoptes à différents stades évolutifs dans les raclages cutanés (typiquement chez les animaux immunodéprimés)
Le diagnostic de certitude est parfois difficile. L’examen microscopique de raclages cutanés profonds, réalisés dans les zones de prédilection, ne révèle les parasites ou leurs traces (sarcoptes, œufs, déjections) que dans environ 50% des cas. Le diagnostic sérologique constitue une alternative, avec une sensibilité et spécificité d’environ 80-90%. Face à une forte suspicion clinique sans confirmation parasitologique, un traitement d’épreuve est recommandé selon le principe “if you suspect it, treat it”.
Le traitement comporte deux approches :
- Acaricides topiques (amitraz dilué)
- Acaricides systémiques en spot-on (sélamectine ou moxidectine)
La dimension zoonotique est significative, avec des contaminations humaines observées dans 25 à 50% des cas de gale sarcoptique canine. L’incubation chez l’homme est de 8 à 15 jours, aboutissant à un prurigo du tronc, des bras et des jambes. Caractéristiquement, aucun sillon scabieux n’est observé, contrairement à la gale humaine.
Ceci s’explique par le fait que Sarcoptes scabiei var. canis ne peut survivre plus de 15 à 20 jours chez l’homme, en raison d’une spécificité d’hôte étroite. Le parasite est incapable de se reproduire dans la peau humaine (absence de femelles ovigères dans l’épiderme, pas de sillons) et reste confiné en surface sans action térébrante ni antigénique.
Par conséquent, le traitement approprié de l’animal galeux suffit généralement à résoudre les symptômes chez l’homme – la gale sarcoptique étant considérée comme une “hémizoonose” où le parasite meurt rapidement dans la peau humaine sans s’y reproduire. Une persistance des symptômes humains doit faire suspecter une source persistante de contamination : animal non ou mal traité, congénère porteur asymptomatique non identifié, ou survie des parasites dans l’environnement.
La gale notoédrique
La gale notoédrique est une acariose contagieuse affectant principalement le chat, le rat et le hamster. Elle est causée par la multiplication en surface et dans l’épiderme d’acariens psoriques de la famille des Sarcoptidés : Notoedres cati chez le chat et Notoedres muris chez les rongeurs.
Relativement rare chez le chat en France métropolitaine, cette affection est plus fréquente dans les départements et territoires d’outre-mer (Île de la Réunion, Antilles), ainsi qu’en Italie, Slovénie et Espagne. Chez le hamster et le rat, elle constitue l’une des dermatoses prurigineuses les plus courantes.
Le cycle biologique des notoedres est comparable à celui des sarcoptes, avec une contagiosité marquée, particulièrement par contact direct, affectant potentiellement les chats, les chiens et l’homme. Cette infestation peut sévir de façon enzootique ou épizootique avec une morbidité importante. Les facteurs de sensibilité incluent le jeune âge (chatons), l’immunodépression (chats FeLV ou FIV positifs), et, chez les rongeurs, le statut de raton ou de femelle gestante.
Cliniquement, chez le chat, les lésions débutent généralement sur la face (chanfrein, lèvres, paupières, pavillons auriculaires) avant de se généraliser aux membres et aux régions périanale et abdominale. Elles se manifestent par des dépilations diffuses érythémateuses et squameuses, évoluant rapidement vers des formations croûteuses. Le prurit est habituellement intense.
Chez le hamster, les manifestations cutanées comprennent des lésions croûteuses localisées préférentiellement au museau, aux pavillons auriculaires et à l’extrémité des membres, avec fréquente atteinte génitale. Le prurit varie de modéré à intense.
Chez le rat, la distribution lésionnelle est plus restreinte, limitée au bord libre des pavillons auriculaires et au museau, sous forme de verrucosités pseudo-tumorales. Des lésions papulo-croûteuses sont généralement observées sur la queue, mais la généralisation est inhabituelle. L’intensité du prurit varie de modérée à sévère.
Les contaminations humaines, dont l’incidence précise est difficile à évaluer, produisent des signes cutanés similaires à ceux de la gale sarcoptique canine : prurigo du tronc, des bras et des jambes. Comme pour Sarcoptes scabiei var. canis, les notoedres ne peuvent se reproduire dans la peau humaine (absence de femelles ovigères épidermiques et de sillons) et restent cantonnés en surface, sans action térébrante ni réponse antigénique significative. La résolution de la gale chez l’animal entraîne donc généralement la guérison chez l’homme, cette gale notoédrique étant également considérée comme une hémizoonose.
Le diagnostic, relativement simple, repose sur l’identification de notoedres à divers stades évolutifs (adultes, nymphes, larves, œufs) et de leurs déjections lors de raclages cutanés.
Le traitement fait appel aux acaricides systémiques (avermectines et milbémycines), avec nécessité de traiter tous les animaux du groupe, qu’ils présentent ou non des signes cliniques.
La gale trixacarique
La gale à Trixacarus caviae constitue une acariose contagieuse spécifique du cobaye (et occasionnellement de la souris), causée par un acarien psorique de la famille des Sarcoptidés. Les facteurs déclenchants demeurent mal élucidés, avec des conditions de contamination souvent discrètes et une période d’incubation variable.
La reconstitution de l’historique d’infestation est souvent complexe, la contamination précédant fréquemment l’acquisition des animaux. Ces cobayes hébergent probablement un petit nombre de parasites sans manifestation clinique, jusqu’à ce que des modifications environnementales (alimentation, habitat, surpopulation) ou une altération de l’état sanitaire provoquent la multiplication parasitaire au-delà du seuil pathogène.
Fait notable, la présence d’animaux sévèrement atteints n’entraîne pas systématiquement la contamination des congénères en contact, suggérant une composante individuelle dans la réceptivité à l’infestation.
Le tableau clinique associe un prurit constant, précoce et souvent intense à des lésions rapidement généralisées : érythème, papules, squames, évoluan vers des formations croûteuses étendues. La distribution peut être loco-régionale ou généralisée. L’état général peut se détériorer lors d’évolution chronique, avec apathie, anorexie, amaigrissement et parfois issue fatale.
Les contaminations humaines, régulièrement rapportées, résultent d’un contact fréquent et prolongé avec l’animal malade. Des épisodes d’infestation ont notamment été décrits en collectivité scolaire, impliquant des enfants d’école maternelle en contact avec un cobaye sévèrement atteint.
Chez l’homme, cette gale se manifeste par une dermatose prurigineuse papuleuse (type prurigo) affectant principalement les bras, le cou et les jambes. Comme pour les autres gales animales, le traitement approprié de l’animal suffit généralement à résoudre les symptômes humains, cette gale trixacarique étant également une hémizoonose où le parasite ne peut se reproduire dans la peau humaine.
Le protocole thérapeutique repose sur l’utilisation d’acaricides topiques ou systémiques (avermectines ou milbémycines), avec traitement obligatoire de tous les congénères. Un nettoyage et une désacarisation de l’environnement complètent la prise en charge.
Les cheyletielloses
Les cheyletielloses représentent un ensemble de dermatoses parasitaires causées par des acariens du genre Cheyletiella, appartenant à la famille des Cheyletidés. Trois espèces principales sont identifiées, chacune avec une préférence d’hôte : Cheyletiella yasguri (chien), Cheyletiella blakei (chat) et Cheyletiella parasitivorax (lapin).
Ces acariens présentent des caractéristiques biologiques particulières : les adultes pondent des œufs à la base des poils et se nourrissent de débris cutanés et de fluides tissulaires. Contrairement à d’autres ectoparasites de surface, les cheyletielles peuvent s’enfoncer dans les débris épidermiques, voire dans la couche cornée, formant des poches. Leur mobilité sur la peau est remarquable.
Il s’agit de parasites obligatoires accomplissant l’intégralité de leur cycle de vie sur leur hôte, avec une durée de développement d’environ 35 jours. La transmission s’effectue principalement par contact direct avec des animaux cliniquement atteints ou porteurs asymptomatiques, mais également de façon indirecte via l’environnement, où les femelles peuvent survivre jusqu’à 10 jours. Des contaminations interspécifiques sont possibles, et la survie pourrait être prolongée dans des conditions environnementales favorables (température relativement basse, humidité élevée, luminosité modérée). Les parasites peuvent contaminer le couchage des animaux, les interstices des murs et des parquets, parfois même en l’absence d’animaux.
Les cheyletielloses affectent principalement les jeunes animaux (chiots et chatons issus de chenils ou chatteries), mais aussi les chiens adultes (souvent porteurs asymptomatiques) et les chats adultes. Certaines prédispositions raciales ont été observées : races canines naines (Yorkshire Terrier, Bichon, Caniche) et, chez le chat, la race Persane.
La présentation clinique varie selon l’espèce et l’âge :
- Chez le chiot : prurit intense avec réflexe otopodal positif et squamosis prononcé affectant la tête, le dos et les lombes
- Chez le chaton : signes discrets limités à un squamosis pityriasiforme dorso-lombaire
- Chez le chat adulte : lésions cutanées plus inflammatoires avec dermatite prurigineuse papulo-croûteuse
- Chez le lapin : infestation souvent asymptomatique ou dermatose prurigineuse et squameuse principalement tronculaire
La contamination humaine est fréquente (>50% des cas), survenant généralement à partir de C. blakei et C. yasguri. Cette transmission, souvent sous-estimée, résulte principalement d’un contact direct avec l’animal parasité (cliniquement atteint ou porteur asymptomatique), mais peut également s’effectuer indirectement.
Chez l’homme, les manifestations cliniques apparaissent rapidement, dès le deuxième jour après le contact, sous forme de papules très prurigineuses localisées aux avant-bras, aux plis des coudes et aux bras, à la poitrine, à l’abdomen et aux cuisses.
Le diagnostic, généralement simple, repose sur la mise en évidence des cheyletielles par raclages cutanés, brossage ou “scotch test” et l’observation microscopique des squames et débris. La visualisation des parasites est habituellement aisée chez le chien (adultes, nymphes, œufs) mais plus difficile chez le chat, où les adultes sont rarement identifiés et seuls les œufs à la base des poils peuvent être observés. Chez le lapin, les formes parasitaires sont facilement détectables.
Le traitement spécifique associe :
- Acaricides topiques ou systémiques (avermectines ou milbémycines)
- Traitement prolongé (minimum huit semaines) en raison de la résistance des œufs aux acaricides
- Traitement obligatoire de tous les animaux en contact
- Traitement de l’environnement
L’isolement et le traitement approprié des animaux permettent généralement la résolution spontanée des lésions chez l’homme, les cheyletielles ne pouvant se reproduire dans la peau humaine.
Les pulicoses
Les infestations par les puces (pulicoses) constituent l’une des ectoparasitoses les plus communes chez les chiens et les chats. L’espèce prédominante est Ctenocephalides felis felis – “la puce du chat” – plus rarement Ctenocephalides canis. Bien que les pulicoses ne soient pas strictement considérées comme des zoonoses au sens propre, leur fréquence et leurs conséquences néfastes chez l’homme justifient leur inclusion dans cette analyse des dermatozoonoses.
Les puces sont des insectes aphaniptères (sans ailes), aplatis latéralement. Les adultes, parasites cosmopolites et sédentaires, passent majoritairement leur temps sur l’animal hôte. Leur cycle biologique comporte plusieurs particularités : les femelles commencent à pondre leurs œufs sur l’hôte dans les 24 à 48 heures suivant leur premier repas sanguin. Ces œufs, de surface lisse, tombent dans l’environnement où se déroule le développement (œufs, trois stades larvaires, stade nymphal).
La durée du cycle complet est d’environ trois semaines dans des conditions optimales, mais peut être ralentie dans des conditions environnementales défavorables. Un élément crucial de l’épidémiologie est la capacité des adultes pré-émergés (encore dans les cocons nymphaux) à persister plusieurs mois dans l’environnement, constituant un réservoir parasitaire considérable. Ces adultes émergent sous l’influence de stimuli spécifiques (vibrations, lumière, signaux chimiques) et forment ce qu’on appelle communément “les puces du parquet”.
L’infestation par les puces est généralement inapparente chez les animaux en bonne santé. Les chiens sains subissent une pression parasitaire modérée, et la population de puces est naturellement limitée par les comportements d’auto-toilettage (mordillements, léchages) et les mouvements de grattage qui expulsent les parasites du pelage. Cette particularité explique la difficulté occasionnelle de mise en évidence des parasites sur les animaux infestés.
Les conséquences pathologiques des pulicoses comportent deux dimensions :
- Une irritation mécanique cutanée due aux piqûres répétées et aux déplacements des parasites
- Le développement, chez certains sujets sensibilisés, d’une dermatite par hypersensibilité aux piqûres de puces (DHPP), qui constitue la dermatose allergique la plus fréquente tant chez le chat que chez le chien
Chez le chien, la DHPP se manifeste par une alopécie dorso-lombaire associant érythème, papules et croûtes, avec prurit généralement intense. En l’absence de traitement adéquat, les complications infectieuses secondaires sont fréquentes. Chez le chat, le tableau se caractérise par une dermatite prurigineuse papulo-croûteuse, des plaques éosinophiliques et/ou une alopécie dorso-lombaire.
La transmission à l’homme intervient principalement lors d’infestations massives, quand la surpopulation contraint les puces à changer d’hôte. Il convient de préciser que la transmission directe de puces adultes entre animaux ou vers l’homme est relativement limitée (10 à 15% en moyenne). La contamination humaine provient essentiellement de jeunes puces adultes fraîchement émergées des cocons, qui recherchent activement un hôte disponible, quel qu’il soit.
Chez l’homme, la DHPP atteint préférentiellement les membres (chevilles, poignets) et, chez l’enfant, peut s’étendre au tronc. Les lésions, intensément prurigineuses, prennent l’aspect de papules urticariennes, de plaques ortiées ou de vésicules transitoires. Un impétigo secondaire au grattage et aux surinfections bactériennes est parfois observé.
Le diagnostic de pulicose repose sur l’identification directe des puces adultes ou de leurs déjections, soit à l’œil nu, soit par brossage avec un peigne à puces spécifique. Pour la DHPP, le diagnostic s’appuie sur des éléments anamnestiques évocateurs (dermatose saisonnière, présence de plusieurs chiens/chats dans l’environnement) et des lésions cliniques compatibles (dermatose prurigineuse dorso-lombaire). Paradoxalement, chez les animaux atteints de DHPP, l’infestation visible par les puces est souvent minime.
Chez le chien, des tests d’intradermoréaction utilisant des extraits totaux de puces peuvent confirmer une DHPP par des réactions immédiates positives à 20 minutes et/ou retardées à 48 heures, bien que leur absence n’exclue pas le diagnostic. Ces tests sont considérés comme peu fiables chez le chat.
Le traitement des pulicoses et de la DHPP ne doit jamais être banalisé et nécessite une approche globale :
- Élimination des puces sur l’animal atteint
- Traitement obligatoire des animaux congénères
- Assainissement de l’environnement
Cette stratégie intégrée requiert souvent une collaboration étroite avec le propriétaire pour établir un programme de lutte efficace. Le contrôle des puces sur l’animal repose sur l’utilisation d’adulticides rémanents, tandis que la gestion des stades non parasitaires dans l’environnement fait appel aux inhibiteurs de croissance des insectes et aux adulticides environnementaux. Des mesures mécaniques complémentaires (nettoyage méthodique, élimination des niches écologiques) sont également essentielles.
Dermatozoonoses helminthiques
Les larva migrans cutanées
Le phénomène de larva migrans cutanées (LMC) s’observe principalement en France métropolitaine chez des personnes de retour de régions tropicales, où les chiens errants contaminent les plages de leurs excréments. Ces chiens, généralement non médicalisés et non vermifugés, sont fréquemment infestés par des ankylostomes (Ancylostoma spp. et Uncinaria spp.), nématodes digestifs responsables chez eux de gastroentérites hémorragiques. Toutefois, la description récente d’une enzootie de larva migrans à Ankylostoma en Bretagne incite à une vigilance accrue sur le territoire métropolitain.
Les manifestations cutanées sont liées à la pénétration transcutanée de larves infestantes L3. Cliniquement, elles se traduisent par des papules souvent croûteuses et prurigineuses, parfois pustuleuses, localisées préférentiellement sur les zones à peau fine (abdomen) et les membres (espaces interdigités et surfaces palmaires). Ces signes, relativement peu spécifiques, nécessitent une anamnèse précise évoquant un contact potentiel avec des environnements contaminés (chien vivant en chenil, milieu rural, chien de chasse).
Au-delà des manifestations cutanées, l’infestation peut provoquer des signes respiratoires liés à la migration larvaire (bronchopneumonie), souvent sous-diagnostiqués. Des troubles digestifs (entérite hémorragique) et des signes généraux (amaigrissement, anémie) sont régulièrement observés lors d’infestations chroniques.
Les sources de contamination comprennent les chiens (et chats) porteurs ainsi que les sols humides contaminés par les larves infestantes L3. Les chenils mal entretenus et à sol en terre constituent un environnement idéal pour le développement larvaire, expliquant la particulière vulnérabilité des chiens de chasse. À noter également la possibilité d’infestation indirecte par ingestion par des chiens de petits rongeurs ayant eux-mêmes ingéré des larves L3.
Le diagnostic des migrations transcutanées est souvent délicat. La mise en évidence directe des larves L3 par raclages cutanés est rarement concluante. L’examen histopathologique de biopsies cutanées peut suggérer ces migrations (infiltrat éosinophilique et occasionnellement présence de larves). L’examen coproscopique permet généralement d’identifier aisément les œufs, souvent nombreux.
La prévention et le contrôle impliquent une approche multiple :
- Destruction des environnements contaminés
- Vermifugation régulière et raisonnée, particulièrement des chiennes gestantes (anthelminthiques à action larvicide)
- Reconstruction des chenils en terre battue infestés
- Ramassage quotidien des déjections
- Nettoyage hebdomadaire intensif à base de crésyl
Chez l’homme, la larve pénétrant la peau produit une éruption serpigineuse caractéristique. Cependant, cette infestation constitue une impasse parasitaire, les lésions régressant généralement spontanément en quelques semaines à quelques mois.
La dermatose furcocercarienne ou dermatite des nageurs
La dermatose furcocercarienne, également connue sous le nom de dermatite des nageurs (ou des baigneurs), représente une dermatozoonose saisonnière (juin à septembre) de plus en plus fréquente. Cette métazoonose est provoquée par la pénétration épidermique de larves d’un trématode, Trichobilharzia ocellata, parasite du canard, parfois improprement appelée “puce du canard”. La contamination survient lors de baignades en eau douce, particulièrement dans les zones lacustres (Lac d’Annecy, Lac du Bourget, Lac Léman, lacs suisses et italiens).
Le cycle parasitaire implique le trématode T. ocellata, parasite digestif du canard, excrété dans les fientes. Ces trématodes sont ensuite ingérés par des escargots aquatiques du genre Lymnaea, notamment Lymnaea stagnalis. Les cercaires (formes larvaires) sont ultérieurement libérées dans l’eau où elles peuvent contaminer le canard (hôte définitif) ainsi que l’homme ou le chien (hôtes accidentels) lors de la baignade.
Bien que le chien puisse présenter des lésions similaires à celles observées chez l’homme, il est important de souligner qu’en aucun cas l’homme ne peut se contaminer à partir d’un chien atteint.
Chez l’homme, le tableau clinique se caractérise par une dermatite éruptive intensément prurigineuse, maculo-papuleuse, localisée aux zones exposées. L’apparition soudaine des papules survient généralement dans les 10 à 30 minutes suivant l’immersion en eau douce. L’évolution est favorable, avec guérison spontanée en 2 à 3 semaines, bien qu’un traitement symptomatique (antihistaminiques ou dermocorticoïdes) soit fréquemment nécessaire.
La prophylaxie sanitaire repose sur l’interruption du cycle biologique du parasite, impliquant l’élimination des escargots et des canards des plans d’eau concernés. L’élimination des mollusques étant particulièrement difficile, il est recommandé aux baigneurs d’éviter les zones d’eau peu profonde riches en végétation aquatique, habitat privilégié des escargots.
La leishmaniose
La leishmaniose constitue une protozoonose infectieuse transmissible par inoculation, caractérisée par la multiplication intracellulaire d’un protozoaire flagellé, Leishmania infantum, dans les cellules du système des phagocytes mononucléés. Sa transmission s’effectue par la piqûre de phlébotomes, avec le chien comme principal réservoir. En France, les foyers d’enzootie canine se concentrent essentiellement dans le sud-est, sur le pourtour méditerranéen, de la frontière italienne à la frontière espagnole, et du niveau de la mer jusqu’à environ 800 mètres d’altitude.
Bien que le parasite ait également été isolé chez le renard et le chat, leur rôle épidémiologique semble marginal. Des découvertes récentes ont par ailleurs mis en évidence d’autres modes de transmission : échange de seringues entre héroïnomanes, contamination par dérivés sanguins, suggérant l’existence occasionnelle d’un cycle anthropozootique.
Chez le chien, la leishmaniose se présente comme une maladie générale au polymorphisme clinique remarquable. Les enquêtes épidémiologiques menées dans les Alpes-Maritimes et la région marseillaise indiquent qu’environ un chien leishmanien sur deux est porteur asymptomatique. Bien que systémique dans cette espèce, l’affection se manifeste principalement par des atteintes cutanées, jamais isolées mais associées à divers signes cliniques :
- Polyadénomégalie (fréquente)
- Splénomégalie (plus rare)
- Altération de l’état général (asthénie, amyotrophie musculaire faciale)
- Complications diverses : uvéite bilatérale, arthrite, glomérulonéphrite (parfois seule manifestation clinique, de pronostic défavorable)
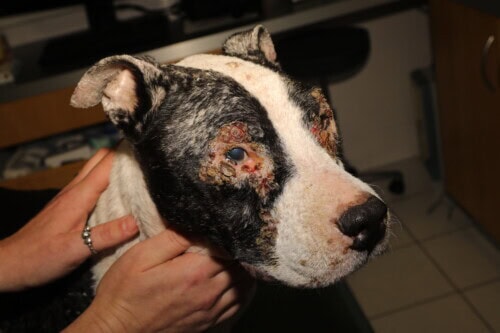
Les lésions cutanées, d’évolution typiquement chronique, présentent une grande diversité morphologique :
- Dermatose exfoliative généralisée affectant la tête, les pavillons auriculaires et les membres
- Ulcérations des extrémités podales et des points de pression
- Dépigmentation de la truffe (primaire ou secondaire à des ulcères)
- Épaississement de la truffe et/ou des coussinets plantaires
- Nodules non ulcérés, uniques ou multiples (particulièrement chez certaines races comme le Boxer ou le Dobermann)
- Dermatite pustuleuse stérile généralisée
Leishmaniose canine
Chez l’homme, la leishmaniose se présente comme une maladie systémique affectant principalement les enfants et les adultes immunodéprimés. Elle peut également se manifester sous forme strictement cutanée, avec des lésions localisées au site d’inoculation, généralement sur les zones découvertes. Ces lésions nodulaires, ulcérées et croûteuses, sont caractéristiquement indolores, de taille variable et d’évolution chronique.
Le diagnostic en médecine vétérinaire s’appuie sur diverses techniques :
- Mise en évidence directe du parasite par cytologie (adénogramme, myélogramme)
- Sérologie (ELISA, immunofluorescence indirecte)
- Amplification génique (PCR)
En zone d’enzootie, un dépistage systématique annuel est recommandé, idéalement réalisé après la saison d’exposition (novembre à janvier), compte tenu de la période d’incubation variable mais généralement de quelques mois.
La prise en charge des chiens infectés suscite de nombreuses controverses. En effet, même traités, ces animaux demeurent porteurs du parasite. La leishmaniose viscérale humaine étant potentiellement mortelle en l’absence de traitement, avec une incidence croissante en zone d’enzootie, l’élimination du réservoir parasitaire semble logique. Cependant, cette approche pénaliserait les propriétaires responsables d’animaux correctement médicalisés, tout en laissant subsister une population canine non contrôlée. Paradoxalement, l’euthanasie systématique des porteurs, lorsqu’elle a été appliquée, n’a pas donné les résultats escomptés et s’est même accompagnée d’une augmentation des cas humains.
Le vétérinaire joue un rôle déterminant dans l’information des propriétaires concernant les risques et la nécessité d’un suivi rigoureux, tant clinique que biologique.
Le traitement de la leishmaniose canine repose sur l’association de dérivés stibiés et d’allopurinol, avec une surveillance thérapeutique étroite. Malgré la sensibilisation des propriétaires, une fraction des chiens échappe inévitablement au contrôle ou reçoit une automédication intermittente, soulevant le problème grave de l’émergence potentielle de souches résistantes. Par conséquent, les vétérinaires doivent s’abstenir d’utiliser certaines molécules hautement efficaces comme l’amphotéricine B, qui doit être réservée exclusivement à la médecine humaine pour cette indication.
La mise au point d’un vaccin canin représenterait la solution idéale de contrôle épidémiologique, mais son développement se heurte actuellement à de nombreux obstacles.
Dermatozoonoses bactériennes
La lympho-réticulose bénigne d’inoculation ou maladie des griffes du chat
La lympho-réticulose bénigne d’inoculation, plus communément appelée maladie des griffes du chat (MGC) en raison de son mode de transmission prépondérant, constitue chez l’homme une lymphadénopathie subaiguë régionale d’origine bactérienne. L’agent causal, Bartonella henselae (famille des Bartonellaceae), n’a été identifié qu’en 1992. Certains cas pourraient également être attribués à Bartonella clarridgeiae. Les deux génotypes connus (I et II) de B. henselae sont impliqués dans cette affection.
B. henselae est également associée, avec B. quintana, à l’étiologie de l’angiomatose bacillaire et de la péliose, maladies vasculo-prolifératives observées principalement chez les patients infectés par le VIH.
Le chat représente le principal, voire l’unique réservoir de la bactérie. Le rôle du chien dans le portage de l’infection semble très limité. Bien que rares, des cas ont été signalés en l’absence d’exposition directe à un animal, suggérant d’autres modes de transmission possibles (piqûres de puces ou de tiques). La contamination humaine survient dans 70% des cas après griffure et dans 10% après morsure féline. Exceptionnellement, un simple contact (caresse, embrassade) pourrait permettre la contamination d’une plaie cutanée ou muqueuse préexistante, comme l’illustre la forme oculo-ganglionnaire parfois observée chez des personnes s’étant probablement frotté l’œil après avoir caressé un chat.
L’infection expérimentale chez le chat provoque rapidement (moins d’une semaine) une bactériémie asymptomatique prolongée, persistant 2 à 3 mois ou plus chez certains sujets (une bactériémie récurrente persistante a été observée chez un chat pendant 22 mois). Certains chats présentent des niveaux de bactériémie remarquablement élevés (supérieurs à 10^6 UFC/ml de sang). La bactériémie est statistiquement plus fréquente chez les jeunes chats (moins d’un an). B. henselae et B. clarridgeiae peuvent co-infecter le même animal. Récemment, deux nouvelles espèces de Bartonella, B. koehlerae et B. weissii, ont été isolées de chats aux États-Unis, mais leur rôle pathogène dans la MGC reste à démontrer.
Les études épidémiologiques indiquent qu’une proportion substantielle des chats testés sont bactériémiques, avec un pourcentage plus élevé parmi les chats errants comparativement aux chats domestiques. Diverses enquêtes ont révélé des taux de chats bactériémiques variant de 16,5% à 53% au sein des populations félines errantes, dont environ un tiers infectés par B. clarridgeiae.
La puce du chat (Ctenocephalides felis felis) joue un rôle prépondérant dans la transmission de l’infection au sein de cette espèce. B. henselae peut d’ailleurs être isolée à partir de puces prélevées sur des chats bactériémiques. La puce éliminerait la bactérie dans ses déjections, contaminant ainsi le pelage de l’animal. Les bactéries peuvent se multiplier dans le tractus digestif de l’insecte et survivre dans ses déjections. Le chat contamine ses griffes lors de la toilette, établissant ainsi la chaîne de transmission vers l’homme. Les chats errants, plus fréquemment infectés, représentent une source de contamination pour les chats domestiques.
La MGC est une maladie ubiquitaire (environ 22 000 cas humains annuels estimés aux États-Unis et 2 000 aux Pays-Bas en 2003) pouvant affecter tous les âges, mais touchant principalement les enfants et les jeunes adultes. La moitié des cas sont rapportés chez des enfants de moins de 15 ans. L’angiomatose bacillaire, forme grave de la maladie, est essentiellement diagnostiquée chez des adultes immunodéprimés (particulièrement les patients VIH+). La MGC survient généralement de façon sporadique, mais de petites épidémies familiales sont parfois décrites.
Le tableau clinique classique débute par une adénopathie progressive. Au site d’inoculation apparaît en une semaine une papule évoluant vers une vésico-pustule. Dans plus de 90% des cas, cette lésion initiale, qui cicatrise en 1 à 3 jours, passe inaperçue. C’est généralement 2 à 3 semaines plus tard que se développe une lymphadénopathie persistante, évoluant vers la suppuration chez 10 à 30% des patients. Cette adénopathie satellite, unique dans 85% des cas, s’accompagne d’une légère hyperthermie. Les lésions régressent spontanément (justifiant l’appellation “bénigne”) en plusieurs semaines à plusieurs mois, bien qu’une suppuration chronique puisse parfois s’installer.
La MGC peut également se manifester sous différentes formes atypiques, incluant le syndrome oculo-glandulaire de Parinaud et d’autres présentations parfois graves (endocardite, encéphalite, septicémie, purpura), même chez des sujets immunocompétents. Chez les patients immunodéprimés, l’angiomatose bacillaire et la péliose représentent les manifestations cliniques principales.
Le diagnostic repose sur des critères épidémiologiques et cliniques. Le diagnostic différentiel comprend d’autres adénopathies liées à diverses maladies générales (rubéole, tularémie) ou à des plaies banales, de morsure ou de griffure infectées par des bactéries non spécifiques ou par Pasteurella spp.
Les chats vecteurs de la transmission demeurent cliniquement sains. L’agent infectieux peut être isolé uniquement chez un chat bactériémique par hémoculture et identification par PCR. La sérologie est également utilisable, mais une réaction positive n’est pas nécessairement corrélée à une bactériémie active.
Une antibiothérapie, même prolongée, ne semble pas éliminer la bactériémie chez le chat. Les mesures prophylactiques spécifiques demeurent donc limitées. En revanche, l’utilisation régulière de produits anti-puces peut réduire la contamination du réservoir félin. Il convient de noter que le dégriffage, parfois proposé comme mesure préventive, n’a aucun intérêt.
La prévention repose sur l’information claire des personnes à risque (particulièrement les patients immunodéprimés), la lutte raisonnée contre les puces chez le chat, le lavage des mains après contact avec l’animal, et, comme pour toutes les maladies transmises par morsure ou griffure, le lavage et la désinfection immédiate des plaies.
Pasteurelloses
Les pasteurelloses animales, fréquemment rencontrées dans de nombreuses espèces (ruminants, porcins, volailles, lagomorphes), se manifestent cliniquement par diverses affections : broncho et pleuropneumonies, abcès sous-cutanés, ou formes septicémiques (choléra des volailles).
Ces infections se transmettent à l’homme par les modes habituels de contagion (contacts directs, alimentation, inhalation), mais le mécanisme principal est l’inoculation par morsure de chat, de chien, plus rarement de rat ou de lapin. Cette morsure peut être infligée par un animal cliniquement malade, mais plus souvent par un animal apparemment sain, Pasteurella spp. étant une bactérie commensale des voies aéro-digestives supérieures de nombreux animaux, isolée dans 40 à 80% des prélèvements chez les espèces concernées.
Les pasteurelles isolées chez les personnes mordues sont essentiellement P. multocida, P. canis et P. dagmatis. Les cas de pasteurellose humaine sans morsure identifiée sont exceptionnels ; ils comprennent des pneumonies, pleurésies, péricardites, endocardites, arthrites et septicémies. Si une contamination d’origine animale par inhalation ou ingestion est possible, Pasteurella spp. pourrait également, chez l’homme comme chez l’animal, survivre en commensal sur les muqueuses et n’exprimer son pouvoir pathogène qu’en association avec des affections ou maladies débilitantes (infections virales, cancers, syndrome urémique, cirrhose). Dans ces cas particuliers, ces pasteurelloses ne seraient pas strictement considérées comme des zoonoses.
Chez l’homme, la présentation clinique est dominée par des formes localisées à porte d’entrée cutanée. Les formes aiguës se caractérisent par des signes inflammatoires locaux intenses et précoces. Dans les heures suivant la pénétration du germe, la plaie (souvent inapparente initialement) devient chaude, rouge, œdémateuse et très douloureuse ; une suppuration apparaît rapidement sous forme de quelques gouttelettes séreuses. Une lymphangite et une adénopathie satellite sont fréquemment associées.
Les formes subaiguës loco-régionales évoluent différemment : après des manifestations initiales similaires ou plus discrètes, apparaissent des ténosynovites douloureuses et persistantes, non suppuratives, à proximité du point d’inoculation, ou des arthropathies métacarpo-phalangiennes accompagnées de troubles vasomoteurs (sensation de lourdeur, cyanose ou pâleur, paresthésies).
Le diagnostic clinique repose sur le développement rapide d’une inflammation œdémateuse de la région mordue. L’isolement bactériologique à partir du pus doit être réalisé précocement sur milieux ordinaires, mais les résultats sont variables.
Le traitement des pasteurelloses d’inoculation fait appel aux tétracyclines. La prophylaxie humaine est complexe en raison de l’impossibilité d’éliminer le réservoir animal en contact permanent avec l’homme. Compte tenu de la fréquence des contaminations félines et des séquelles fonctionnelles parfois observées, une mesure préventive envisagée consiste à administrer un traitement antibiotique immédiat à toute personne mordue ou griffée, même en l’absence de signes cliniques précoces.
La cowpox virose
La cowpox virose est une maladie virale causée par un orthopoxvirus, le cowpox virus, décrite dans de nombreuses espèces : vache, chameau, buffle, lapin, chat et, plus récemment, rat. Les virus de cette famille (variole, cowpox, vaccine et variole du singe) sont étroitement apparentés et appartiennent tous au genre Orthopoxvirus. Ces agents présentent des difficultés d’isolement, même à partir de lésions et d’organes infectés.
Le diagnostic de l’infection par Orthopoxvirus peut être établi par différentes techniques :
- Microscopie électronique
- Sérologie
- Amplification génique (PCR)
- Séquençage de l’ADN après isolement ou culture, pour l’identification précise de l’espèce virale
Compte tenu de leur proximité génétique, des erreurs d’identification sont possibles entre ces virus.
Chez le chat, la poxvirose est observée depuis environ 30 ans en Grande-Bretagne, aux Pays-Bas, en Belgique et en Allemagne. Sa présence en France est régulièrement signalée depuis 1999. Cette infection affecte quasi-exclusivement des chats ruraux chasseurs. La contamination provient principalement des petits rongeurs sauvages (campagnols, mulots), plus rarement des bovins.
Le campagnol roussâtre (Clethrionomys glareolus) et, dans une moindre mesure, le campagnol agreste (Microtus agrestis) jouent un rôle prépondérant dans l’entretien de l’infection. Ces rongeurs peuvent également transmettre le virus à d’autres espèces partageant le même habitat naturel (syntopiques), comme le mulot sylvestre (Apodemus sylvaticus), voire des gerbilles et écureuils terrestres dans les régions orientales. Des cas ont également été signalés chez des rats importés des pays de l’Est. L’augmentation saisonnière des cas (été et automne) correspond à la période d’activité principale et de prolifération de ces petits rongeurs.
La transmission s’effectue principalement par voie transcutanée, parfois par voie oronasale.
Cliniquement, chez le chat, l’infection se manifeste initialement par une lésion maculeuse et érythémateuse unique, localisée sur la tête, le cou ou les membres antérieurs. En une dizaine de jours, de nombreuses lésions prurigineuses secondaires apparaissent : macules, papules, nodules érythémateux, qui s’ulcèrent progressivement et peuvent atteindre l’ensemble du corps, y compris la cavité buccale. Des signes généraux (fièvre, rhinite, conjonctivite) sont fréquemment observés.
L’évolution est généralement favorable, avec guérison spontanée des lésions secondaires en 3 à 8 semaines. Cependant, des complications telles que surinfections bactériennes ou co-infection rétrovirale peuvent provoquer une généralisation des lésions cutanées et une pneumonie parfois fatale.
Chez le rat, les manifestations cutanées sont comparables à celles du chat.
La transmission à l’homme a été documentée tant à partir du chat que du rat, avec un pronostic particulièrement réservé chez les individus immunodéprimés ou âgés. L’arrêt de la vaccination antivariolique pourrait avoir réduit la protection croisée contre les poxvirus dans la population générale, prédisposant ainsi les sujets non vaccinés, particulièrement s’ils sont immunodéprimés, à ces infections.
Chez l’homme, après une incubation de 2 à 6 jours, les manifestations cutanées du cowpox sont généralement bénignes : lésions papuleuses, vésiculeuses, ombiliquées et auréolées, localisées sur la face, les mains, les bras et parfois les muqueuses (notamment chez l’enfant). Des signes généraux (fièvre, adénopathie) accompagnent fréquemment l’éruption. Chez les patients immunodéprimés, l’infection peut prendre une forme grave avec variole pustuleuse et hémorragique généralisée, potentiellement mortelle.
Le diagnostic chez l’animal repose principalement sur l’histopathologie des biopsies cutanées, qui révèle des lésions spécifiques des poxviroses. D’autres techniques moins courantes incluent la microscopie électronique, la sérologie, l’isolement viral et la PCR.
Le traitement chez le chat est essentiellement symptomatique, visant à contrôler les surinfections bactériennes et à maintenir une alimentation adéquate malgré les lésions buccales douloureuses.
Les mesures prophylactiques sont fondamentales :
- Isolement du chat malade pour éviter la contamination inter-féline
- Euthanasie des rats atteints
- Désinfection de l’environnement (eau de Javel) en raison de la résistance du virus
- Précautions lors des manipulations (port de gants) pour limiter le risque zoonotique, particulièrement pour les personnes vulnérables (immunodéprimés, enfants, personnes âgées)
Implications pour la santé publique et stratégies de prévention
Les dermatozoonoses, bien que moins médiatisées que d’autres zoonoses systémiques, représentent un enjeu de santé publique non négligeable, particulièrement dans le contexte d’une relation homme-animal de plus en plus étroite. Une enquête rétrospective dans une clientèle dermatologique vétérinaire révèle que près de 35% des propriétaires partagent le lit de leur animal (chat ou chien), et persistent dans cette habitude même lorsqu’ils présentent eux-mêmes des lésions dermatologiques imputables à leur compagnon.
Cette proximité, associée à la multiplicité des agents pathogènes potentiellement transmissibles, souligne l’importance d’une approche préventive coordonnée entre médecins, vétérinaires et propriétaires d’animaux.
Rôle du vétérinaire praticien
Le vétérinaire praticien occupe une position stratégique à l’interface entre la santé animale et la santé humaine. Son rôle ne se limite pas au diagnostic et au traitement des affections animales ; il s’étend à :
- L’information du propriétaire concernant les risques zoonotiques potentiels associés à son animal
- L’éducation sur les mesures préventives adaptées à chaque situation
- La détection précoce des affections à potentiel zoonotique
- La mise en place de traitements appropriés visant non seulement à soigner l’animal mais également à interrompre la chaîne de transmission vers l’homme
- La collaboration avec les médecins pour une prise en charge globale des cas impliquant une transmission à l’homme
Cette mission de santé publique s’avère particulièrement délicate car elle nécessite de concilier l’attachement émotionnel des propriétaires à leurs animaux avec les impératifs sanitaires. Il est souvent illusoire de vouloir modifier radicalement les comportements de cohabitation entre les propriétaires et leurs compagnons, mais une information claire et objective permet généralement l’adoption de mesures de précaution raisonnables.
Populations à risque particulier
Certaines populations présentent une vulnérabilité accrue aux dermatozoonoses et méritent une attention spécifique :
- Les personnes immunodéprimées (patients sous immunosuppresseurs, personnes vivant avec le VIH, receveurs de greffe, patients sous chimiothérapie) : l’infection par le VIH, notamment, confère une dimension particulière au risque zoonotique, avec des manifestations potentiellement plus graves d’affections comme la sporotrichose, la leishmaniose, les poxviroses ou la tuberculose
- Les jeunes enfants : leur système immunitaire encore immature, associé à des comportements à risque (contacts étroits avec les animaux, hygiène des mains non systématique) les expose particulièrement
- Les personnes âgées : fragilité immunitaire associée à l’âge
- Les femmes enceintes : risques spécifiques liés à certains agents pathogènes
- Les professionnels en contact avec les animaux : vétérinaires et leur personnel, éleveurs, toiletteurs, personnel de refuge
Pour ces populations, des recommandations spécifiques doivent être formulées, pouvant aller de simples précautions d’hygiène renforcée à l’éviction temporaire de certaines espèces animales selon le contexte clinique.
Stratégies préventives spécifiques
Pour les dermatophyties
- Dépistage des porteurs asymptomatiques dans les collectivités animales
- Isolement et traitement précoce des animaux atteints
- Désinfection rigoureuse de l’environnement
- Précautions lors de l’acquisition de nouveaux animaux (particulièrement les chatons en provenance d’élevages ou d’animaleries)
- Sensibilisation particulière des responsables de collectivités infantiles (écoles, crèches) aux risques associés aux mascottes de classe
Pour les gales et autres ectoparasitoses
- Traitement antiparasitaire régulier des animaux de compagnie
- Contrôle des populations d’animaux errants
- Précautions accrues lors de l’adoption d’animaux en provenance de refuges
- Identification et traitement de tous les animaux en contact en cas de diagnostic positif
Pour la leishmaniose
- Dépistage annuel dans les zones d’enzootie
- Utilisation de répulsifs contre les phlébotomes pendant la saison d’activité vectorielle
- Limitation des sorties nocturnes des chiens dans les régions endémiques
- Suivi rigoureux des chiens infectés
- Information claire des propriétaires sur les risques et les mesures de prévention
Pour les maladies transmises par morsure ou griffure
- Éducation des propriétaires sur la manipulation appropriée des animaux
- Désinfection immédiate de toute plaie, même minime
- Consultation médicale rapide en cas de signes inflammatoires
- Programme de lutte contre les puces pour limiter la transmission de B. henselae chez le chat
Approche “One Health”
Le concept “One Health” (Une seule santé) reconnaît l’interdépendance entre la santé humaine, la santé animale et la santé environnementale. Cette approche prend tout son sens dans la gestion des dermatozoonoses, qui illustrent parfaitement cette interconnexion.
La collaboration étroite entre médecins et vétérinaires constitue la pierre angulaire d’une gestion efficace de ces pathologies.
Cette coopération doit s’articuler autour de plusieurs axes :
- Partage d’informations sur les cas détectés et les évolutions épidémiologiques
- Standardisation des protocoles diagnostiques pour faciliter les comparaisons entre cas humains et animaux
- Coordination des approches thérapeutiques pour éviter l’émergence de résistances
- Élaboration conjointe de messages préventifs cohérents à destination du public
- Recherche collaborative sur les mécanismes de transmission et les facteurs de risque
Cette collaboration interprofessionnelle doit s’inscrire dans un cadre plus large impliquant également :
- Les autorités de santé publique
- Les laboratoires de diagnostic
- Les structures de recherche
- Les associations de protection animale
- Les professionnels de l’élevage et de l’animalerie
Seule cette approche intégrée permettra une gestion optimale de ces affections à l’interface homme-animal.
Précautions fondamentales
Quelques précautions fondamentales, valables pour l’ensemble des dermatozoonoses, peuvent être recommandées aux propriétaires d’animaux et aux professionnels :
- Hygiène des mains rigoureuse après tout contact avec des animaux, particulièrement avant les repas
- Vermifugation et déparasitage externes réguliers des animaux domestiques
- Surveillance vétérinaire régulière avec mention explicite de tout contact avec des personnes vulnérables
- Nettoyage fréquent des lieux de couchage des animaux
- Port de gants lors de la manipulation d’animaux présentant des lésions cutanées
- Éviction temporaire des contacts étroits (partage du lit, léchage du visage) en cas de dermatose animale diagnostiquée
- Consultation médicale rapide en cas d’apparition de lésions cutanées chez l’homme après contact avec un animal malade
Ces mesures simples, associées à une sensibilisation accrue des propriétaires aux signes d’alerte, permettraient de réduire significativement l’incidence des cas de transmission à l’homme.
Conclusion
Les dermatozoonoses constituent un groupe hétérogène d’affections cutanées transmissibles entre les animaux vertébrés et l’homme, avec une prévalence relativement faible par rapport à l’ensemble des zoonoses, mais un impact potentiel significatif sur la santé publique. À l’exception de quelques entités spécifiques comme la sporotrichose, la maladie des griffes du chat, la leishmaniose et la cowpox virose, ces affections présentent rarement un caractère de gravité médicale chez l’homme, qui constitue généralement une impasse parasitaire.
Cependant, la guérison du propriétaire atteint, avec ou sans traitement, est vouée à l’échec si la source de contamination – l’animal – n’est pas identifiée et traitée adéquatement. Cette interdépendance souligne l’importance cruciale d’une approche coordonnée entre médecine vétérinaire et médecine humaine.
Le vétérinaire praticien, par sa position stratégique à l’interface homme-animal, joue un rôle clé dans la détection précoce, le traitement approprié et la prévention de ces affections. Sa responsabilité s’étend au-delà du soin animal pour englober une dimension de santé publique, impliquant information, éducation et collaboration avec les médecins.
Dans un contexte d’intégration croissante des animaux de compagnie au sein des familles, avec des contacts physiques étroits de plus en plus fréquents, la vigilance face aux dermatozoonoses gagne en importance. Cette proximité, bien que source d’indéniables bénéfices psychologiques et sociaux, impose une médicalisation adéquate des animaux de compagnie comme corollaire indispensable de leur intégration familiale.
Enfin, l’approche “One Health”, reconnaissant l’interconnexion entre santé humaine, santé animale et santé environnementale, fournit un cadre conceptuel pertinent pour aborder ces pathologies. Seule une collaboration étroite entre tous les acteurs concernés – vétérinaires, médecins, propriétaires d’animaux, autorités sanitaires – permettra de minimiser les risques de transmission tout en préservant les bienfaits de la relation homme-animal.
FAQ
1. Les animaux porteurs de germes zoonotiques présentent-ils systématiquement des signes cliniques identifiables ?
Non, de nombreux animaux peuvent être porteurs asymptomatiques d’agents pathogènes transmissibles à l’homme. C’est notamment le cas pour les dermatophytoses (particulièrement chez le chat), la leishmaniose (environ 50% des chiens infectés en zone d’enzootie sont asymptomatiques) ou la maladie des griffes du chat (les chats bactériémiques ne présentent généralement aucun signe clinique). Cette particularité complique la détection et justifie des mesures préventives systématiques, notamment pour les populations à risque.
2. Comment distinguer cliniquement les différentes formes de gale animale et évaluer leur potentiel zoonotique ?
Les différentes gales animales (sarcoptique, notoédrique, trixacarique) présentent des tableaux cliniques relativement similaires chez l’animal (lésions érythémato-squamo-croûteuses et prurit), mais se distinguent par leur distribution préférentielle et l’espèce animale atteinte. Leur potentiel zoonotique est variable : toutes peuvent provoquer des lésions chez l’homme, mais constituent généralement des “hémizoonoses” où le parasite ne peut accomplir son cycle complet dans la peau humaine. Le diagnostic parasitologique précis par raclage cutané est essentiel pour évaluer le risque de transmission et adapter les mesures préventives.
3. Les traitements antiparasitaires préventifs commercialisés pour les animaux de compagnie offrent-ils une protection complète contre les dermatozoonoses parasitaires ?
Les antiparasitaires externes modernes, particulièrement ceux à base d’isoxazolines, d’avermectines ou de milbémycines, offrent une excellente protection contre la plupart des ectoparasites responsables de dermatozoonoses (puces, sarcoptes, notoedres, cheyletielles). Cependant, leur efficacité n’est pas absolue et dépend de multiples facteurs : observance du traitement, couverture du spectre parasitaire, résistances émergentes, particularités individuelles. De plus, ces traitements n’offrent généralement pas de protection contre les dermatozoonoses fongiques, bactériennes ou virales. Une approche préventive globale reste donc nécessaire, associant traitement antiparasitaire, hygiène appropriée et surveillance vétérinaire régulière.
4. Quelle conduite tenir face à un animal présentant des lésions cutanées dans un foyer comptant des personnes immunodéprimées ?
Dans cette situation à haut risque, plusieurs mesures s’imposent : consultation vétérinaire immédiate pour diagnostic précis, isolement temporaire de l’animal dans une pièce dédiée jusqu’à résolution des lésions, port de gants lors des manipulations nécessaires, désinfection rigoureuse des surfaces de contact, et renforcement de l’hygiène des mains. Selon le diagnostic établi et le degré d’immunosuppression de la personne concernée, des mesures plus strictes peuvent être envisagées, toujours en concertation entre le vétérinaire et le médecin traitant. Dans certains cas particuliers impliquant des agents hautement pathogènes comme Sporothrix schenckii chez un patient sévèrement immunodéprimé, une séparation temporaire peut être nécessaire.
5. L’augmentation des cas de dermatozoonoses observée ces dernières décennies reflète-t-elle une réelle émergence ou simplement une meilleure détection ?
L’évolution apparente de l’incidence des dermatozoonoses résulte probablement d’une combinaison de facteurs. D’une part, les progrès diagnostiques et la sensibilisation accrue des professionnels de santé permettent une meilleure identification des cas. D’autre part, plusieurs facteurs favorisent une réelle émergence : augmentation du nombre d’animaux de compagnie et intensification des contacts physiques, multiplication des voyages internationaux facilitant la circulation de nouveaux pathogènes, croissance des populations immunodéprimées plus vulnérables à ces infections, modifications environnementales affectant les cycles parasitaires, et émergence de résistances aux traitements antiparasitaires. Une approche épidémiologique rigoureuse, associant médecine humaine et vétérinaire, est nécessaire pour quantifier précisément ces tendances et adapter les stratégies préventives.
Références
- guaguère é. dermatozoonoses en milieu urbain : le point de vue du dermatologue vétérinaire = dermatozoonoses in urban settings : the veterinary dermatologist’s point of view. 33522539.pdf.
- martin s, schmutz jl. les dermatozoonoses. nouv dermatol 2002 ; 21 : suppl.2 : 37-42.
- viaud s, bensignor e. les dermatozoonoses du chien et du chat. prat med chir anim comp 2008 : 43, 131-9.
- euzéby j. mycologie médicale comparée : les mycoses des animaux et leurs relations avec les mycoses de l’homme. tome i. oullins: fondation marcel merieux; 1992.
- moriello ka, de boer dj. dermatophyties in: guaguère e, prélaud p, editors. guide pratique de dermatologie féline. lyon: mérial; 2000. p. 4.1–11.
- brouta f, deschamps f, losson b, mignon b. données récentes sur la pathogénèse de l’infection de microsporum canis chez les carnivores domestiques. ann med vet 2001; 145: 236–42.
- mignon b. dermatophyties. in: guaguère e, prélaud p, editors. guide pratique de dermatologie canine. lyon: kalianxis; 2006. p. 153–66.
- guaguère e, hubert t, muller a. dermatologie des petits mammifères de compagnie. in : encyclopédie vétérinaire – dermatologie, elsevier, paris, 2007 ; vol 2 (3700) 1-17.
- carlotti dn. le traitement des dermatophytoses du chien et du chat. gestion de la teigne en chatterie. prat med chir anim comp 2008; 43 : 1–13.
- viguié-vallanet c. les teignes. ann dermatol venereol 1999 ; 126 : 349-56.
- ferrer l, fondati a. mycoses profondes. in: guaguère e, prélaud p, editors. guide pratique de dermatologie feline. lyon: mérial; 2000. p. 5.1-11.
- schubach tm, schubach a, okamoto t, barros mb, figueiredo fb, cuzzi t, et al. evaluation of an epidemic sporotrichosis in cats: 347 cases (1998—2001). j am vet med assoc 2004; 224: 1623-9.
- cafarchia c, sasanelli m, lia rp, de caprariis d, guillot j, otranto d. lymphocutaneous and nasal sporotrichosis in a dog from sou-thern italy: case report. mycopathologia 2007; 163: 75—9.
- verde m. dermatozoonoses. in: guaguère e, prélaud p, editors. guide pratique de dermatologie féline. lyon: mérial; 2000. p. 25.1–7.
- guaguère e, beugnet f. dermatoses parasitaires. in: guaguère e, prélaud p, editors. guide pratique de dermatologie canine. lyon: kalianxis; 2006; p 181- 231.
- paterson s. skin diseases of exotic pets (paterson s, ed), blackwell publishing, oxford, 2006 ; 333 p.
- ellis c, mori m. skin diseases of rodents and small exotic mammals. vet clin north am exotic anim pract 2007 ; 4 : 523-7.
Recherches Connexes
dermato zoonoses, point de vue, dermatologie, chez l’homme, dermatozoonoses, animaux, dermatologue, zoonoses, maladies, service, milieu, chat, chien, parasites, nodule, s, pratique, dermatophytes, humain, infection, microsporum canis, contact, peau, pustules, trichophyton verrucosum, b, vol, viaud, rongeurs, puces, chez le chat, espèces, morsure, virus, cas, infestations, france, connaissance, santé, risque, dermatoses, dermatite, acarien, transmission, lésions, doi, vétérinaire, environnement, animaux de compagnie, oiseaux, enfants, carnivores domestiques, avant bras, signes cliniques, zoo, trichophyton mentagrophytes, cause, auteurs, papules, piqûres, information, personnes, sarcoptes, diagnostic, compagnie, signes, contagion