La dermatomyosite (DM) canine est une vasculopathie ischémique inflammatoire, d’origine immunitaire et à forte prédisposition génétique, qui affecte principalement la peau et, à un degré moindre, la musculature striée. Nous vous présentons un point complet pathogénique, diagnostique et thérapeutique sur cette dermatose.
Juin 2025
Introduction
Reconnue initialement chez le Colley et le Berger des Shetland, cette affection sert de modèle spontané particulièrement pertinent pour l’étude de la dermatomyosite juvénile (DMJ) humaine, une maladie auto-immune systémique présentant des similitudes cliniques et histopathologiques frappantes. La DM canine est donc non seulement une préoccupation clinique pour les praticiens vétérinaires, mais aussi un champ de recherche translationnelle précieux.
Au cours de la dernière décennie, la compréhension de la DM canine a connu une transformation radicale. Le concept d’une simple maladie héréditaire à transmission autosomique dominante avec une pénétrance variable et une expressivité inconstante a été supplanté par un modèle beaucoup plus nuancé de trouble génétique complexe. Les avancées en génomique ont permis d’identifier des loci de risque spécifiques et leurs interactions épistatiques, offrant un cadre prédictif pour la maladie. Parallèlement, la recherche fondamentale a mis en lumière le rôle central d’une dérégulation de la voie de signalisation de l’interféron (IFN) de type I comme moteur pathogène majeur, à l’instar de ce qui est observé dans la DMJ humaine. Cette convergence des connaissances génétiques et immunopathologiques a ouvert la voie à des approches diagnostiques et thérapeutiques plus ciblées, qui redéfinissent la prise en charge de cette maladie en 2025. Nous vous présentons un état actuel des connaissances sur la dermatomyosite canine, en intégrant les découvertes les plus récentes sur sa pathogénie, son diagnostic et les stratégies thérapeutiques émergentes.
Étiopathogénie
L’étiopathogénie de la dermatomyosite canine est le résultat d’une interaction complexe entre une prédisposition génétique polygénique, une dérégulation du système immunitaire inné, et des déclencheurs environnementaux. La compréhension de cette cascade d’événements, du gène à la lésion, est fondamentale pour appréhender la maladie et justifier les approches thérapeutiques modernes.
1.1 La composante génétique de la dermatomyosite canine
La notion historique d’une transmission autosomique dominante à pénétrance incomplète a été affinée par des études d’association pangénomique (GWAS) qui ont révélé un modèle d’hérédité complexe et épistatique. Le risque de développer une DM chez les races prédisposées, comme le Colley et le Berger des Shetland, est désormais compris comme étant déterminé par l’interaction de variants au sein de trois loci génétiques indépendants.
Identification des Loci de Risque
La recherche a identifié trois régions chromosomiques majeures dont les allèles spécifiques modulent le risque de DM.
- Locus A (Chromosome 10) : Une association très forte a été trouvée avec une mutation faux-sens dans le gène PAN2. Le gène PAN2 code pour une sous-unité du complexe de déadénylation poly(A) nuclease, qui joue un rôle crucial dans la régulation de la dégradation de l’ARN messager (ARNm). Cette fonction est particulièrement importante pour la régulation de la réponse inflammatoire, notamment par la stabilisation des transcrits de gènes pro-inflammatoires contenant des éléments riches en adénine-uracile (ARE), comme celui de l’interleukine 6 (IL-6), une cytokine connue pour être surexprimée dans la DMJ humaine. Cette mutation établit donc un lien direct entre un défaut génétique fondamental et une prédisposition à la dérégulation immunitaire.
- Locus B (Chromosome 31) : Une deuxième association significative a été identifiée avec une insertion/délétion (indel) dans une région non codante 5′ du gène MAP3K7CL . Bien que la fonction précise de ce gène, qui code pour une kinase, soit encore peu étudiée, il est principalement exprimé dans les leucocytes du sang périphérique, suggérant un rôle dans la fonction immunitaire.
- Locus C (CMH Canin) : Une association significative a été observée avec un haplotype spécifique du complexe majeur d’histocompatibilité (CMH) canin de classe II. L’association est particulièrement forte chez les individus homozygotes pour cet haplotype. Cependant, la fréquence élevée de cet haplotype de risque chez les chiens sains indique qu’il n’est pas suffisant à lui seul pour causer la maladie et que son influence est modulée par les autres loci de risque.
Interaction Épistatique et Stratification du Risque
L’analyse combinée des génotypes de ces trois loci a révélé un modèle de risque non pas simplement additif, mais épistatique, où l’effet d’un gène est modifié par la présence d’un ou plusieurs autres gènes. Des recherches ont montré que 9 des 27 combinaisons génotypiques possibles confèrent un risque modéré (pénétrance de 33-50 %) ou élevé (pénétrance de 90-100 %) de développer la DM, expliquant ainsi 93 % des cas étudiés. Par exemple, les génotypes AABB (homozygote pour les allèles de risque aux loci A et B) présentent une pénétrance de 100 % lorsqu’ils sont associés à au moins un allèle de risque au locus C (AABBCc ou AABBCC).
Cette découverte transforme la compréhension de la maladie. Les concepts anciens de “pénétrance incomplète” et “d’expressivité variable” peuvent désormais être réinterprétés à la lumière de ce modèle génétique quantitatif. Ces variations phénotypiques ne sont pas aléatoires mais sont le reflet direct du profil de risque polygénique de chaque individu. Un chien avec un génotype à haut risque est presque certain de développer la maladie s’il est exposé aux déclencheurs appropriés, tandis qu’un chien avec un génotype à risque modéré peut ne jamais exprimer la maladie ou ne présenter que des signes légers et transitoires. La génétique fournit ainsi un cadre prédictif qui remplace l’incertitude. Cela a des implications profondes pour le conseil génétique, qui passe d’une simple recommandation de ne pas reproduire les chiens cliniquement atteints à une stratégie de sélection proactive des couples reproducteurs visant à minimiser la production de chiots porteurs de combinaisons génotypiques à haut risque.
Corrélation Génotype-Phénotype
Une corrélation inverse significative a été établie entre le nombre d’allèles de risque aux loci PAN2 et MAP3K7CL et l’âge d’apparition de la maladie. Les chiens porteurs de quatre allèles de risque (homozygotes pour le risque aux deux loci) développent la DM à un âge médian de 5 mois, tandis que ceux qui n’ont que deux allèles de risque la développent à un âge médian de 18,5 mois. Cette corrélation suggère un effet de dose génique sur la sévérité de la prédisposition, où une charge génétique plus élevée nécessite un seuil de déclenchement environnemental plus bas pour initier la maladie.
Tableau 1 : Loci de Risque Génétique pour la Dermatomyosite Canine
|
Nom du Locus |
Gène Associé |
Chromosome |
Allèle Normal (notation) |
Fonction Biologique Connue/Hypothétique |
|---|---|---|---|---|
|
Locus A |
PAN2 |
10 |
Wildtype (a) |
Régulation de la dégradation de l’ARNm, stabilisation des transcrits de la réponse inflammatoire |
|
Locus B |
MAP3K7CL |
31 |
Wildtype (b) |
Kinase exprimée dans les tissus immunologiques, rôle potentiel dans la signalisation immunitaire |
|
Locus C |
DLA-DRB1 |
12 (CMH) |
Autres haplotypes DLA (c) |
Présentation de l’antigène, régulation de la réponse immunitaire adaptative |
Tableau 2 : Stratification du Risque de DM Basée sur le Génotype (Combinaisons des Loci A et B, modifiées par le Locus C)
|
Génotype Locus A / Locus B |
Risque avec Locus C = cc |
Risque avec Locus C = Cc |
Risque avec Locus C = CC |
|---|---|---|---|
|
aa bb |
Faible |
Faible |
Faible |
|
Aa bb |
Faible |
Faible |
Faible |
|
aa Bb |
Faible |
Faible |
Faible |
|
AA bb |
Inconnu |
Modéré |
Modéré |
|
Aa Bb |
Faible |
Faible |
Faible |
|
aa BB |
Faible |
Modéré |
Modéré |
|
AA Bb |
Inconnu |
Modéré |
Élevé |
|
Aa BB |
Inconnu |
Modéré |
Élevé |
|
AA BB |
Inconnu |
Élevé |
Élevé |
|
Tableau adapté des données de l’UC Davis Veterinary Genetics Laboratory, basées sur les recherches de Evans et al. |
|||
1.2 La Cascade de Dérégulation Immunitaire : Vasculopathie et Interféron
La prédisposition génétique n’est que la première étape. La pathogénie de la DM est fondamentalement une maladie du système immunitaire qui cible les vaisseaux sanguins, entraînant une ischémie tissulaire.
La Vasculopathie Ischémique comme Lésion Primaire
La DM est avant tout une vasculopathie inflammatoire. Le processus pathologique central est une attaque à médiation immunitaire dirigée contre l’endothélium des petits vaisseaux sanguins, en particulier les capillaires endomysiaux dans les muscles et les vaisseaux du derme cutané. Cette inflammation endothéliale, ou endothéliite, conduit à un rétrécissement de la lumière vasculaire, une microthrombose et, finalement, une hypoperfusion des tissus en aval. L’ischémie qui en résulte est responsable des manifestations cliniques caractéristiques : l’atrophie et la nécrose des follicules pileux et de l’épiderme (provoquant alopécie et ulcération) et la dégénérescence des fibres musculaires (provoquant atrophie et faiblesse).
L’Interféron (IFN) de Type I comme Moteur Pathogène Central
Des preuves accablantes, issues de modèles humains et canins, indiquent qu’une hyperactivation de la voie de signalisation de l’interféron de type I est le moteur principal de cette vasculopathie. Cette “signature IFN” se manifeste par une surexpression systémique et tissulaire (peau, muscle, sang) d’un ensemble de gènes dont la transcription est induite par l’IFN, tels que MXA, ISG15 et CXCL10. La force de cette signature dans la peau est directement corrélée à l’activité de la maladie cutanée et diminue ou disparaît chez les patients en rémission, ce qui en fait un biomarqueur potentiel de l’activité de la maladie. Les interférons de type I ont des effets pléiotropes qui peuvent expliquer la vasculopathie : ils peuvent activer les cellules endothéliales, favoriser un état pro-inflammatoire et pro-thrombotique, et recruter des cellules immunitaires sur le site de l’inflammation, perpétuant ainsi les dommages vasculaires.
Rôle des Auto-anticorps et des Complexes Immuns Circulants (CIC)
Bien que la recherche d’auto-anticorps spécifiques à la myosite soit moins avancée chez le chien que chez l’homme , des études plus anciennes ont établi une corrélation positive entre la sévérité clinique de la DM canine et les taux sériques de complexes immuns circulants (CIC) et d’immunoglobulines G (IgG). Il est postulé que ces CIC peuvent se déposer dans la paroi des micro-vaisseaux, y activer la cascade du complément et ainsi contribuer à l’endothéliite et à la vasculopathie.
La convergence de ces données permet d’établir une chaîne causale unifiée qui n’était pas évidente il y a une décennie. Premièrement, une prédisposition génétique, notamment via des mutations dans des gènes régulateurs de l’inflammation comme PAN2, crée un terrain fertile pour une réponse immunitaire aberrante. Deuxièmement, en présence de déclencheurs, cette prédisposition conduit à une production excessive et soutenue d’IFN de type I, le mécanisme central de la maladie. Troisièmement, cet environnement riche en IFN induit une vasculopathie en endommageant directement les cellules endothéliales. Quatrièmement, la vasculopathie compromet l’apport sanguin, provoquant une ischémie dans les tissus vulnérables. Enfin, cette ischémie se manifeste cliniquement par les lésions cutanées et musculaires caractéristiques de la DM. Cette compréhension unifiée de la pathogénie justifie pleinement le changement de paradigme thérapeutique actuel, qui s’éloigne des immunosuppresseurs généraux pour se tourner vers des thérapies qui ciblent et bloquent spécifiquement la voie de signalisation de l’IFN.
1.3 Déclencheurs Environnementaux et Endogènes
Chez un individu génétiquement prédisposé, des facteurs déclenchants sont souvent nécessaires pour initier ou exacerber la maladie.
- Facteurs de Risque Documentés : Plusieurs facteurs sont connus pour jouer un rôle dans le déclenchement des poussées cliniques.
-
- Traumatismes Mécaniques : La localisation typique des lésions sur les proéminences osseuses (face, carpes, tarses) et les points de pression suggère fortement que les microtraumatismes répétés agissent comme un déclencheur local, un phénomène de Koebner.
- Exposition aux Rayons Ultraviolets (UV) : La photodistribution de certaines lésions faciales et l’aggravation rapportée après une exposition au soleil impliquent les UV comme un facteur déclenchant important, probablement en induisant l’apoptose des kératinocytes et en libérant des auto-antigènes.
- Facteurs Hormonaux : Des poussées de la maladie ont été associées à l’œstrus, suggérant une influence hormonale sur la régulation immunitaire.
- Le Rôle de la Vaccination : Le lien entre la vaccination et la DM est un sujet de discussion important. Il existe un syndrome bien reconnu de dermatopathie ischémique post-vaccinale, notamment après l’administration du vaccin contre la rage, qui est cliniquement et histologiquement indiscernable de la DM. Une étude rétrospective portant sur 177 cas de dermatopathie ischémique a estimé qu’une association avec une vaccination récente était probable dans 48,3 % des cas. Plutôt que de considérer la dermatopathie post-vaccinale comme une entité entièrement distincte, il est plus logique de la voir comme la DM génétique démasquée par le puissant stimulus immunitaire que représente la vaccination. Pour un chiot porteur d’un génotype à haut risque (par exemple, AABB), la stimulation immunitaire intense induite par un vaccin pourrait être le “test de stress” suffisant pour initier la cascade pathogène de l’IFN et déclencher la maladie clinique. Cela a des implications cliniques importantes : pour les chiots de races à risque avec un statut génétique inconnu ou à haut risque, il ne s’agit pas d’éviter la vaccination, mais d’informer les propriétaires et de mettre en place une surveillance étroite pour détecter l’apparition de lésions cutanées dans les semaines et mois suivant les injections, afin de permettre une intervention précoce.
Spectre Clinique et Approche Diagnostique
La présentation clinique de la DM canine est variable, allant de formes cutanées légères et auto-limitantes à des atteintes systémiques sévères. Le diagnostic repose sur une approche multimodale combinant le signalement, les signes cliniques et des examens complémentaires ciblés.
2.1 Prédisposition Raciale et Classification de la Maladie
- DM Familiale : Le Colley et le Berger des Shetland sont les races emblématiques de la maladie, chez lesquelles une base héréditaire a été prouvée et les loci de risque génétique ont été identifiés.
- Syndromes de type DM (Dermatomyositis-like) : Des tableaux cliniques et histologiques similaires ont été décrits dans un nombre croissant d’autres races, notamment le Beauceron, le Welsh Corgi, le Lakeland Terrier, le Chow Chow, le Berger Allemand et le Kuvasz.
La distinction historique entre “DM familiale” (chez les races prédisposées) et “DM-like” (chez les autres races) est de plus en plus considérée comme sémantique plutôt que biologique. L’histopathologie sous-jacente est identique, suggérant des voies pathogènes communes. Le terme de “dermatopathie ischémique” est un diagnostic histopathologique plus précis et unificateur qui englobe ces différentes présentations cliniques. L’approche diagnostique moderne ne devrait donc pas s’arrêter à la race, mais plutôt rechercher les marqueurs génétiques et pathologiques de la maladie chez tout chien présentant un tableau clinique compatible, quelle que soit sa race.
2.2 Manifestations Cliniques
Les signes cliniques de la DM varient considérablement d’un individu à l’autre, mais suivent généralement un schéma reconnaissable.
Signes Cutanés
L’atteinte cutanée est la manifestation la plus constante de la maladie.
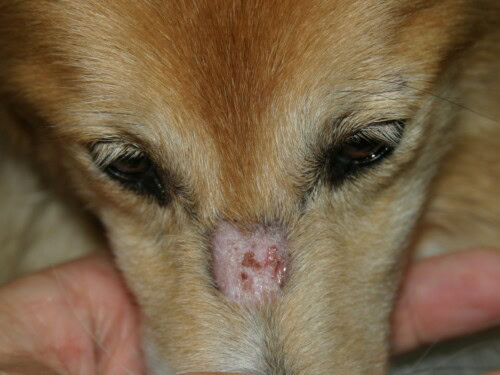
- Lésions Initiales : Elles apparaissent typiquement chez le jeune chien, avant l’âge de 6 mois, et souvent dès 7 à 11 semaines. La présentation initiale peut être subtile, avec des papules, pustules ou vésicules transitoires qui évoluent rapidement en lésions plus caractéristiques d’érythème, d’alopécie, de squames et de croûtes.
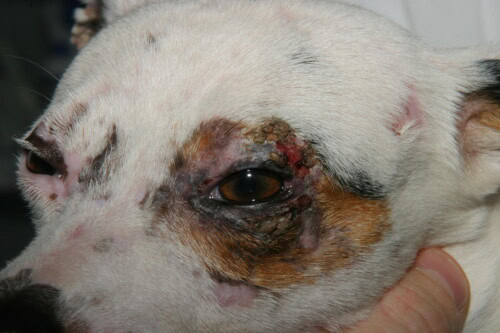
- Distribution Caractéristique : Les lésions ont une prédilection pour les zones de traumatisme et de faible circulation collatérale : la face (régions périoculaire et péribuccale, chanfrein), les pavillons auriculaires (en particulier la pointe et les plis), l’extrémité de la queue, et la peau en regard des proéminences osseuses des membres (carpes, tarses, doigts).
- Lésions Chroniques : Avec le temps, les lésions évoluent vers une alopécie cicatricielle permanente, une atrophie cutanée et des altérations pigmentaires (hyperpigmentation ou hypopigmentation), créant un aspect tacheté appelé poïkilodermie. Une atteinte des griffes (onychodystrophie, onychorrhexis, onychoschizia) peut également être observée.
Sévère atteinte de la queue avec alopécie et lésions crouteuses
Atteinte palpébrale essentiellement unilatérale chez ce chien
Lésion pouvant parfaitement mimer une dermatophytose
Signes Myopathiques
L’atteinte musculaire est plus variable et, lorsqu’elle est cliniquement apparente, elle est généralement le signe d’une forme plus sévère de la maladie.
- Corrélation avec les Signes Cutanés : La myosite clinique survient habituellement après l’apparition des lésions cutanées, et sa sévérité est souvent proportionnelle à celle de l’atteinte dermatologique.
- Atrophie Musculaire : L’atrophie des muscles masticateurs (temporal et masséter) est le signe musculaire le plus fréquent et peut être la seule manifestation myopathique. Dans les cas plus graves, une atrophie bilatéralement symétrique des muscles de la tête, du cou, du tronc et des membres peut se développer.
- Signes Fonctionnels : L’atrophie et l’inflammation des muscles de la mastication et de la déglutition peuvent entraîner des difficultés à saisir la nourriture (préhension), à mâcher et à avaler (dysphagie). Une démarche anormale, raide et guindée (“stiff-stilted gait” ou “pas d’oie”) est également décrite.
- Complications Sévères : Le développement d’un mégaœsophage (dilatation et hypomotilité de l’œsophage) est une complication grave, qui entraîne des régurgitations, une perte de poids et un risque élevé de pneumonie par aspiration, une cause fréquente de mortalité dans les formes sévères de DM.
2.3 Diagnostic de Certitude : Une Stratégie Multimodale
Le diagnostic de la DM n’est jamais basé sur un seul test, mais sur la convergence de plusieurs éléments, après avoir exclu les diagnostics différentiels courants comme la démodécie, la pyodermite bactérienne, la dermatophytose et le lupus érythémateux discoïde.
- Histopathologie (Pierre Angulaire) : La biopsie est l’examen clé pour confirmer la nature ischémique des lésions.
-
- Biopsie Cutanée : Prélevée sur une lésion récente et active, elle révèle des changements caractéristiques de dermatopathie ischémique : une dermatite d’interface pauci-cellulaire (avec peu de cellules inflammatoires), une atrophie des follicules pileux, une vacuolisation des kératinocytes de la couche basale de l’épiderme, la présence de cellules apoptotiques (corps de Civatte), et une fibrose ou une accumulation de mucine dans le derme. Les changements vasculaires peuvent être subtils, se manifestant par un aspect “flou” et éosinophilique du collagène périvasculaire (“smudged collagen”) plutôt que par une vasculite nécrosante évidente.
- Biopsie Musculaire : Bien que moins systématiquement pratiquée en routine, elle est indiquée en cas de suspicion d’atteinte myopathique. Elle montre typiquement une myosite interstitielle et périvasculaire, à prédominance lymphocytaire, plasmocytaire et histiocytaire, associée à des signes de souffrance des fibres musculaires (dégénérescence, nécrose, régénération et atrophie).
- Électrodiagnostic (EMG) : L’électromyographie est un outil très sensible pour détecter une myopathie, même en l’absence de signes cliniques évidents. L’examen, réalisé sous anesthésie, révèle des activités électriques spontanées anormales dans les muscles atteints, telles que des potentiels de fibrillation, des ondes pointues positives, et des décharges à haute fréquence bizarres ou myotoniques.
- Tests Génétiques : Pour les Colleys, les Bergers des Shetland et leurs croisements, le test des trois loci de risque (PAN2, MAP3K7CL, DLA) est devenu un outil diagnostique et pronostique essentiel. Il permet de confirmer la prédisposition génétique et de stratifier le risque de l’animal (faible, modéré ou élevé), ce qui aide à orienter le conseil aux propriétaires.
- Biochimie Clinique : Le dosage de la créatine kinase (CK) sérique est utile. Une élévation marquée est un indicateur d’une myosite active et de dommages musculaires. Cependant, une valeur normale de CK n’exclut pas le diagnostic, car l’atteinte musculaire peut être minime, focale ou chronique avec peu d’inflammation active.
Tableau 3 : Modalités Diagnostiques pour la Dermatomyosite Canine
|
Modalité Diagnostique |
Résultats Attendus / Anomalies Clés |
|---|---|
|
Histopathologie Cutanée |
Dermatite d’interface pauci-cellulaire, atrophie folliculaire, vacuolisation basale, corps de Civatte, fibrose/mucinose dermique, “smudged collagen” |
|
Histopathologie Musculaire |
Myosite interstitielle et périvasculaire (lympho-plasmocytaire), dégénérescence/régénération/atrophie des fibres musculaires |
|
Électromyographie (EMG) |
Activité spontanée anormale : potentiels de fibrillation, ondes pointues positives, décharges myotoniques/bizarres à haute fréquence |
|
Test Génétique (3 loci) |
Identification des allèles de risque aux loci PAN2, MAP3K7CL et DLA ; calcul d’un score de risque (Faible, Modéré, Élevé) |
|
Biochimie (Créatine Kinase) |
Élévation (souvent marquée) en cas de myosite active, mais peut être normale dans les formes chroniques ou à faible atteinte musculaire |
Stratégies Thérapeutiques et Gestion en 2025
Pronostic et Évolution à Long Terme
Le pronostic de la DM canine est très variable et dépend d’une multitude de facteurs. La compréhension de ces indicateurs et des profils évolutifs de la maladie est essentielle pour fournir aux propriétaires des attentes réalistes et pour adapter la gestion à long terme.
4.1 Indicateurs Pronostiques : Prédire l’Avenir
Plusieurs facteurs permettent d’estimer l’évolution probable de la maladie chez un chien donné.
- Facteurs Cliniques :
-
- Sévérité de la Maladie : C’est le facteur pronostique le plus direct. Les cas légers, avec seulement quelques lésions cutanées non ulcérées, ont un excellent pronostic et peuvent même entrer en rémission spontanée sans séquelle. Les cas modérés ont un bon pronostic de contrôle, mais souvent avec une alopécie cicatricielle résiduelle. Les cas sévères, avec des ulcérations étendues et/ou une atteinte musculaire significative, ont un pronostic réservé à mauvais.
- Atteinte Musculaire et Œsophagienne : La présence d’une myopathie cliniquement significative, et en particulier le développement d’un mégaœsophage, assombrit considérablement le pronostic. Le risque de malnutrition, de fausses déglutitions et de pneumonie par aspiration devient une menace vitale majeure.
- Facteurs Démographiques : Une étude rétrospective sur 177 cas de dermatopathie ischémique (excluant la DM familiale classique) a identifié deux facteurs associés à une moins bonne évolution : un poids corporel inférieur à 10 kg et un âge plus avancé au moment de la biopsie.
- Facteur Génétique : L’intégration du profil de risque génétique (basé sur les 3 loci) dans l’évaluation pronostique représente une avancée majeure. Ce test permet de passer d’un pronostic réactif, basé sur les signes cliniques déjà présents, à un pronostic proactif et prédictif. Un chiot Colley ou Shetland testé à la naissance et révélant un génotype à haut risque (ex: AABBCC) a un pronostic intrinsèquement plus réservé, même avant l’apparition du moindre signe clinique. Il est prédit qu’il développera la maladie plus précocement et potentiellement sous une forme plus sévère. Cette information permet une stratification précoce des patients et la mise en place d’une surveillance renforcée et d’une stratégie d’intervention thérapeutique agressive dès les premiers signes, ce qui pourrait améliorer le résultat à long terme.
4.2 Évolution de la Maladie et Gestion à Long Terme
Par analogie avec la DMJ humaine, la DM canine peut suivre différents schémas évolutifs au fil du temps.
- Profils Évolutifs :
-
- Monocyclique : La maladie se manifeste par un unique épisode, souvent chez les animaux légèrement atteints, qui entre en rémission complète (parfois spontanément) et ne récidive pas. Le pronostic est excellent.
- Polycyclique : La maladie évolue par poussées, avec des périodes de rémission entrecoupées de récidives. Ces poussées sont souvent initiées par les facteurs déclenchants (exposition aux UV, traumatismes, œstrus). La gestion vise à contrôler les poussées et à prolonger les périodes de rémission.
- Chronique-continu : La maladie reste active de manière persistante, sans période de rémission complète. Ces cas nécessitent un traitement à vie et sont associés au pronostic le plus réservé.
- Gestion Chronique : La prise en charge des formes chroniques (polycycliques ou continues) est un défi. L’objectif est de maintenir la maladie sous contrôle avec la dose minimale efficace de médicaments pour limiter les effets secondaires cumulatifs. L’utilisation d’agents d’épargne stéroïdienne (comme la cyclosporine) et, de plus en plus, de thérapies ciblées comme les inhibiteurs de JAK, est au cœur de cette stratégie. Un suivi clinique et biologique régulier est indispensable pour ajuster le traitement et surveiller l’apparition de complications, y compris un risque potentiellement accru de maladie rénale chez les chiens souffrant d’une inflammation chronique à long terme.
Conclusion
En 2025, la dermatomyosite canine est passée du statut de maladie héréditaire énigmatique à celui de trouble génétique complexe dont les mécanismes moléculaires sont de mieux en mieux compris. La reconnaissance de son étiopathogénie, centrée sur une vasculopathie ischémique pilotée par une dérégulation de la voie de l’interféron de type I et sous-tendue par des interactions génétiques spécifiques, a transformé son approche clinique.
Ce changement de paradigme a des implications profondes et concrètes. Le diagnostic a évolué pour intégrer les tests génétiques comme un pilier essentiel aux côtés de l’histopathologie et de l’électromyographie, permettant une stratification précoce du risque et un pronostic plus précis. Sur le plan thérapeutique, l’arsenal s’est enrichi, passant des immunosuppresseurs à large spectre, efficaces mais grevés d’effets secondaires, à des thérapies ciblées qui bloquent spécifiquement les voies pathogènes identifiées. L’utilisation des inhibiteurs de Janus Kinase, en particulier, représente la nouvelle frontière du traitement, offrant l’espoir d’un contrôle plus efficace et plus sûr de la maladie.
Les perspectives de recherche futures sont claires. Elles devront se concentrer sur l’identification de loci de risque dans d’autres races canines, la validation à grande échelle de l’efficacité et de la sécurité à long terme des thérapies ciblées par des essais cliniques randomisés, et le développement de biomarqueurs sanguins (tels que la signature IFN) pour un suivi non invasif de l’activité de la maladie et une personnalisation accrue du traitement. Le modèle canin de la dermatomyosite, par sa pertinence et sa complexité, continuera d’être une ressource inestimable pour faire progresser la compréhension et le traitement de cette maladie invalidante, tant pour le bien-être des chiens que pour les connaissances qu’il apporte à la médecine humaine.
Références
- Evans, J. M., Noorai, R. E., Tsai, K. L., Starr-Moss, A. N., Hill, C. M., Anderson, K. J., Famula, T. R., & Clark, L. A. (2017). Beyond the MHC: A canine model of dermatomyositis shows a complex pattern of genetic risk involving novel loci. PLOS Genetics, 13(2), e1006604.
- Hargis, A. M., Prieur, D. J., Haupt, K. H., Collier, L. L., & Evermann, J. F. (1985). Familial canine dermatomyositis. Initial characterization of the cutaneous and muscular lesions. American Journal of Pathology, 121(3), 521–530.
- Rees, C. A., & Boothe, D. M. (2003). Therapeutic response to pentoxifylline and its active metabolites in dogs with familial canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234–241.
- Hargis, A. M., Prieur, D. J., Haupt, K. H., McDonald, T. L., & Moore, M. P. (1986). Prospective study of familial canine dermatomyositis. Correlation of the severity of dermatomyositis and circulating immune complex levels. American Journal of Pathology, 123(3), 465–479.
- Hargis, A. M., & Ginn, P. E. (2001). Canine inflammatory myopathies: a clinicopathologic review of 200 cases. Veterinary Pathology, 38(6), 688-699.
- Hargis, A. M., Haupt, K. H., Hegreberg, G. A., Prieur, D. J., & Moore, M. P. (1984). Familial canine dermatomyositis. Initial characterization of the cutaneous and muscular lesions. American Journal of Pathology, 116(2), 234–244.
- Hargis, A. M., & Prieur, D. J. (1987). Prospective study of familial canine dermatomyositis. Correlation of the severity of dermatomyositis and circulating immune complexes. American Journal of Pathology, 128(1), 129–139.
- Pumphrey, S. A., & Outerbridge, C. A. (2019). The role of oclacitinib in the management of ischaemic dermatopathy in four dogs. Veterinary Dermatology, 30(4), 346-e100.
- Mandrioli, L., & Biserni, R. (2024). A case of refractory nasal dermatomyositis-like disease in an adult Poodle. ResearchGate.
- Errante, P. R. (2022). Dermatomyositis Disease in Dogs. International Journal of Zoology and Animal Biology, 5(8).
- Mendoza, F., & Toral, M. (2019). Three Cases of Canine Dermatomyositis-Like Disease. Acta Scientiae Veterinariae, 47, 1632.
- Mellett, M., & Allen, A. G. (2018). Dermatomyositis etiopathogenesis: a rebel soldier in the muscle. Current Opinion in Rheumatology, 30(6), 610–616.
- Marie, I., Drouot, L., Menard, J. F., & Levesque, H. (2006). Long-term outcome and prognostic factors of juvenile dermatomyositis: a multinational, multicenter study of 490 patients. Arthritis and Rheumatism, 54(11), 3683–3692.
- Kmieć, P., & Gomułkiewicz, A. (2021). The role of interferons type I, II and III in myositis: A review. Clinical and Experimental Rheumatology, 39(4), 882-890.
- Greenberg, S. A., & Pinkus, J. L. (2011). A broad molecular profile of dermatomyositis skin reveals prominent interferon-inducible gene expression and demonstrates molecular similarity to lupus skin. PLoS ONE, 6(12), e29161.
- Berger, D. (2016). Canine Dermatomyositis. Clinician’s Brief, 14(11), 50-52.
- Ghafour, A., & Isenberg, D. A. (2020). The immunopathogenesis of dermatomyositis. Best Practice & Research Clinical Rheumatology, 34(4), 101533.
- Mandell, D. C., & Dehghanpir, S. D. (2021). An update on the diagnosis and treatment of inflammatory myopathies. Journal of Clinical Medicine, 10(15), 3381.
- Main-Nolton, A., & Clark, L. A. (2022). Transcriptome Profiling of Canine Familial Dermatomyositis (DMS) Skin Lesions and Treatment in Collies and Shetland sheepdogs. VIN.
- Santoro, D., & Pucheu-Haston, C. M. (2014). Effects of pentoxifylline on in vivo and in vitro IgE-mediated mast cell degranulation and cutaneous inflammation in dogs. American Journal of Veterinary Research, 75(2), 152–158.
- Olivry, T., & Banovic, F. (2019). Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Diseases of Animals (ICADA). Veterinary Dermatology, 30(3), 169-e50.
- Cosgrove, S. B., Cleaver, D. M., King, V. L., Gilmer, A. R., Daniels, A. E., Wren, J. A., & Stegemann, M. R. (2013). A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis. Veterinary Dermatology, 25(2), 91-e23.
- Gortel, K. (2006). What’s new in dermatologic therapy? DVM360.
- Rees, C. A., & Boothe, D. M. (2004). Therapeutic response to pentoxifylline and its active metabolites in dogs with familial canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234-241.
- Archer, T. M., & Boothe, D. M. (2004). Cyclosporine: a review of its use in veterinary dermatology. Veterinary Dermatology, 15(6), 349–361.
- Robson, D. C. (2014). Cyclosporine in Veterinary Dermatology. Proceedings of the 39th World Small Animal Veterinary Association World Congress.
- Alexishcheva, A., & Guryeva, S. (2024). Interferon signature as a biomarker of skin disease activity in patients with refractory juvenile dermatomyositis. Frontiers in Medicine, 11, 1214920.
- Navale, S., & De, A. (2024). Clinical Progress in Mesenchymal Stem Cell Therapy: A Focus on Rheumatic Diseases. ResearchGate.
- de Mello, M. F., & Hagiwara, M. K. (2007). Canine ischaemic dermatopathy: a retrospective study of 177 cases (2005-2016). Veterinary Dermatology, 28(5), 485-e117.
- Gury, T., & Seror, R. (2024). Prognostic factors and long-term outcome in dogs diagnosed with primary and secondary immune thrombocytopenia in Ireland. Journal of Small Animal Practice.
- Fantini, D., & Ciliberto, G. (2022). Novel Management of Masticatory Myositis in Three Dogs with a Selective Janus Kinase (JAK)-1 Inhibitor. ResearchGate.
- Masi, G., & D’Alessandro, A. (2024). Recent advances in research on dermatomyositis. Uptocure.
- Ardalan, K., & Marques, M. C. (2025). Psychometric properties of patient-reported outcomes measurement information system (PROMIS) fixed short forms in Juvenile Myositis. Seminars in Arthritis and Rheumatism, 71.
- Bartels, C., & Putterman, C. (2022). Juvenile dermatomyositis: updates in pathogenesis and biomarkers. Current Rheumatology Reports, 24(10), 307-317.
- Ziskin, J., & Fiorentino, D. (2024). Recent advances in the treatment of dermatomyositis. Current Opinion in Rheumatology, 36(3), 203-210.
- Mandl, T., & Lundberg, I. E. (2019). The role of interferons type I, II and III in myositis: A review. Clinical and Experimental Rheumatology, 37(5), 868-877.
- van der Kooi, A. J., & van de Vlekkert, J. (2023). An inflammatory myopathy in the Dutch Kooiker dog: a study of 119 cases. Journal of Veterinary Internal Medicine, 37(2), 643-653.
- Viviano, K. R. (2016). Cyclosporine: a review of its use in veterinary medicine. Veterinary Clinics of North America: Small Animal Practice, 46(2), 245-265.
- Nuttall, T., & Gey, van Pittius, M. (2023). Immunosuppressant Therapy in Small Animal Medicine. Today’s Veterinary Practice.
Recherches Connexes
dermatomyosite canine, dermatomyosite, clinique vétérinaire, chien, cas, chez le chien, maladie, chow chow, races, signes cliniques, traitement, dermatologie, shetland, dermatomyosite familiale, peau, dermatose, colley, muscles, éric guaguère, dermatomyosite chez, symptômes, emmanuel bensignor, rougeurs, consultation, cause, extrémités, lésions, maladie auto immune, 6p24.1 6p25.3, poils, perte, article, lupus érythémateux, chiots, examen clinique, face, oreilles, plan, animaux, affection, doigts, vétérinaire, prise en charge, diagnostic, système immunitaire, forme, diagnostic différentiel, maison, résumé, âge, bien être, recherche, examen, mode, fait, laboratoire, signes, expressivité, type, alimentation, peau et les muscles, informations, dermatopathies