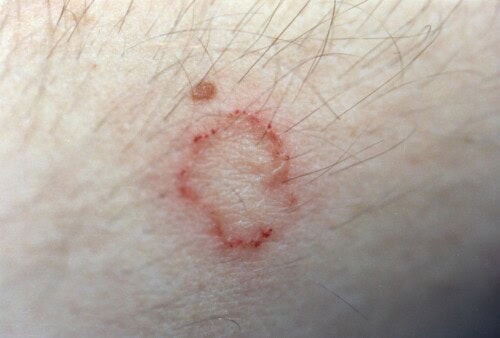
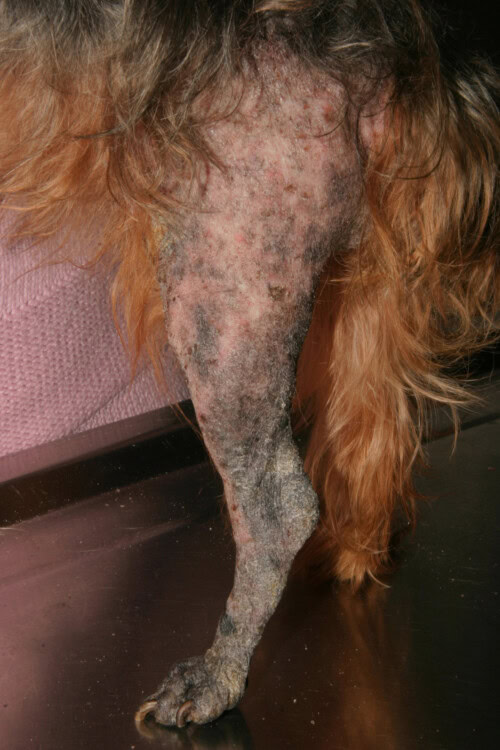
La teigne, qui est une dermatophytose, représente une infection fongique superficielle de la peau et des phanères. Cette affection cutanée, provoquée par des champignons kératinophiles appartenant aux genres Microsporum et Trichophyton, revêt une importance particulière en médecine vétérinaire du fait de son caractère contagieux, infectieux et de son potentiel zoonotique.
Introduction
Bien que généralement considérée comme une affection bénigne chez les chiens immunocompétents, sa gestion clinique demeure un défi en raison de sa présentation polymorphe et de son impact sur la santé publique.
Étiologie et agents pathogènes
Les dermatophytes responsables des infections chez le chien se répartissent en trois catégories selon leur habitat naturel :
Les espèces zoophiles, adaptées à la vie sur les hôtes animaux, constituent les agents pathogènes majeurs. Microsporum canis représente l’agent étiologique prédominant (40-80% des cas), suivi par Trichophyton mentagrophytes (5-35% des cas).
Parmi les espèces géophiles, Microsporum gypseum occupe une place non négligeable avec jusqu’à 25% des cas rapportés. Ces champignons, naturellement présents dans le sol, sont associés à la décomposition de la kératine des débris organiques.
Microsporum persicolor mérite une attention particulière en raison de sa prévalence accrue chez les chiens de chasse et de travail, probablement due à un contact plus fréquent avec les rongeurs sauvages et le sol contaminé.
Épidémiologie et facteurs de risque
Distribution et prévalence globale
L’analyse épidémiologique de la dermatophytose canine met en lumière une distribution complexe et multifactorielle. Une méta-analyse approfondie, couvrant des études menées dans 29 pays, révèle des variations considérables selon les contextes géographiques et les populations canines étudiées. Dans le cadre de la pratique vétérinaire quotidienne, la prévalence de cette affection se situe entre 0,26 et 5,6% des cas dermatologiques, soulignant ainsi son caractère relativement peu fréquent en comparaison d’autres dermatoses.
Distribution géographique et influence environnementale
Les données épidémiologiques démontrent une distribution géographique particulière, avec une prépondérance marquée dans les zones caractérisées par un climat chaud et humide. Cette tendance s’observe particulièrement au Brésil, au Chili, en Inde, en Italie et dans les régions méridionales des États-Unis. Cette répartition géographique spécifique suggère une corrélation étroite entre les conditions climatiques et l’écologie des dermatophytes, influençant leur capacité de survie et de propagation dans l’environnement.
La détermination précise de la prévalence et des prédispositions raciales se heurte à plusieurs obstacles méthodologiques. En effet, cette dermatophytose ne constitue pas une maladie à déclaration obligatoire, son évolution naturelle peut être spontanément résolutive chez de nombreux animaux immunocompétents, et sa présentation clinique varie considérablement en sévérité. Ces facteurs introduisent potentiellement des biais dans l’interprétation des données épidémiologiques.
L’analyse des facteurs de risque met en évidence plusieurs éléments déterminants :
L’âge constitue un facteur prédominant, les jeunes animaux manifestant une susceptibilité accrue. Cette vulnérabilité pourrait s’expliquer par l’immaturité de leur système immunitaire et l’absence d’exposition préalable aux agents pathogènes.
Prédispositions raciales et analyse comparative
Les études épidémiologiques mettent en évidence des variations significatives de susceptibilité entre les races canines. Les Yorkshire terriers présentent une prédisposition particulièrement marquée aux infections dermatophytiques, notamment à M. canis. Cette vulnérabilité s’exprime tant dans les formes superficielles que nodulaires de l’infection. L’analyse des données cliniques corrobore cette observation : une étude portant sur 55 cas de dermatophytose a révélé que 23,6% des chiens affectés appartenaient à cette race. Cette surreprésentation s’est vue confirmée par une seconde étude où les Yorkshire terriers constituaient 37% des cas (10 sur 27 chiens). Cette prédisposition pourrait s’expliquer par des facteurs génétiques influençant la réponse immunitaire ou la composition de la barrière cutanée, bien que les mécanismes précis restent à élucider.
Les chiens de travail et de chasse présentent quant à eux un profil de susceptibilité distinct, caractérisé par une vulnérabilité accrue aux infections à M. persicolor et M. gypseum. Cette particularité épidémiologique concerne spécifiquement les races telles que le Pointer allemand à poil court, le Fox terrier, le Labrador retriever, le Berger belge Groenendael, le Beagle et le Jagdterrier. Cette prédisposition semble davantage liée à des facteurs comportementaux et environnementaux qu’à une sensibilité intrinsèque, ces races étant fréquemment exposées aux sols contaminés et aux réservoirs sauvages lors de leurs activités.
Les chiens de chasse et de travail présentent un profil de risque distinct. Les races telles que les Pointers allemands à poil court, les Fox terriers, les Labradors retrievers, les Bergers belges Groenendael et les Beagles manifestent une susceptibilité accrue aux infections par M. persicolor et M. gypseum. Cette prédisposition s’explique vraisemblablement par leur contact fréquent avec le sol contaminé et les réservoirs animaux sauvages.
Le statut immunitaire joue un rôle déterminant dans la susceptibilité aux infections dermatophytiques. Les conditions immunosuppressives, notamment l’hyperadrénocorticisme, peuvent favoriser le développement d’infections plus sévères et prolongées. La littérature scientifique documente des cas de dermatophytose en association avec diverses affections systémiques : leishmaniose (4 cas), leishmaniose associée à l’ehrlichiose (1 cas) et diabète sucré (1 cas). La coexistence d’une démodécie concomitante, bien que rarement rapportée dans la littérature, constitue probablement une association plus fréquente que ne le suggèrent les publications disponibles.
La transmission de la dermatophytose s’effectue principalement par contact direct avec un animal infecté ou par l’intermédiaire d’objets contaminés, incluant le matériel de toilettage, la literie, les colliers et les ectoparasites. Le microtraumatisme cutané constitue un facteur favorisant essentiel dans l’établissement d’une infection clinique. Les infections à M. canis résultent typiquement du contact avec un animal infecté, principalement les chats, tandis que la transmission environnementale pure demeure peu efficace. Les infections à Trichophyton sont généralement associées au contact avec des rongeurs infectés ou leurs nids. Les infections à M. gypseum, moins fréquentes, sont présumées résulter du contact avec le sol contaminé, reflétant la nature géophile de cet organisme.
Teigne chez l’homme
Pathogénie et réponse immunitaire
L’établissement d’une infection dermatophytique résulte d’une séquence complexe d’événements moléculaires et cellulaires, orchestrée par les interactions entre le pathogène et l’hôte. Ce processus se déroule en trois phases distinctes et séquentielles, chacune caractérisée par des mécanismes spécifiques.
La phase initiale d’adhésion constitue une étape critique survenant dans les 2-6 heures suivant l’exposition. Cette adhérence est médiée par des adhésines spécifiques exprimées à la surface des arthroconidies, ainsi que par des protéases dermatophytiques, notamment les subtilisines. Ces enzymes sécrétées par le champignon jouent un rôle déterminant dans l’établissement de l’infection, facilitant l’adhésion aux cornéocytes de l’hôte.
La seconde phase, marquée par la germination des conidies fongiques, débute entre 4 et 6 heures après l’adhésion initiale. Durant cette étape, les tubes germinatifs émergent des arthroconidies et pénètrent le stratum corneum. Cette invasion a été minutieusement documentée grâce à des modèles in vitro utilisant des cornéocytes isolés et des épidermes reconstitués, permettant d’observer la progression de l’infection.
La troisième phase correspond à l’invasion active des structures kératinisées. Les hyphes fongiques colonisent le stratum corneum, se développant dans diverses directions, avec une préférence marquée pour l’unité folliculaire dans la plupart des dermatophytes vétérinaires. Cette colonisation s’accompagne d’une activité enzymatique intense, notamment la sécrétion d’endoprotéases (subtilisines et fungalysines) et d’exoprotéases qui dégradent la kératine en peptides et acides aminés assimilables. Un mécanisme sophistiqué impliquant une pompe d’efflux de sulfite, codée par le gène SSU1, facilite la dégradation de la kératine en clivant les ponts disulfures. La régulation de la formation de sulfite à partir de la cystéine dépend d’une enzyme clé, la cystéine dioxygénase (Cdo1).
Les dermatophytes ont développé des stratégies élaborées pour contrecarrer la réponse immunitaire de l’hôte. Ces mécanismes incluent l’inhibition lymphocytaire par les mannanes de la paroi cellulaire, l’altération de la fonction des macrophages et la modification du renouvellement kératinocytaire. Cependant, l’hôte déploie une réponse immunitaire complexe impliquant des composantes humorales et cellulaires.
L’infection naturelle par M. canis induit des réponses cutanées immédiates et retardées aux protéines fongiques, accompagnées d’une élévation des titres d’anticorps et d’altérations de la réponse lymphoblastique aux antigènes fongiques. Les études immunologiques ont révélé que les chats infectés ou précédemment exposés à M. canis présentent une réactivité lymphocytaire significativement plus élevée aux antigènes dermatophytiques comparés aux témoins non infectés. Bien que la réactivité lymphocytaire soit similaire chez les animaux culture-positifs et les animaux infectés/guéris, les titres d’anticorps sont significativement plus élevés dans le groupe culture-positif. Cette observation suggère que la réactivité lymphocytaire accrue pourrait représenter une réponse à médiation cellulaire de type Th1, tandis que les anticorps refléteraient davantage l’exposition sans conférer de protection significative.
La guérison clinique et la protection contre les réinfections dépendent essentiellement d’une réponse immunitaire à médiation cellulaire robuste, impliquant des cellules effectrices comme les macrophages et les neutrophiles, orchestrée par diverses cytokines, particulièrement l’interféron gamma. Cette réponse immunitaire adaptative contribue non seulement à l’élimination de l’infection active mais également à l’établissement d’une immunité protectrice contre les infections ultérieures.
Présentation clinique et diagnostic différentiel
Les dermatophytoses canines manifestent un remarquable polymorphisme clinique qui reflète la pathogenèse de l’infection fongique et la réponse immunitaire de l’hôte. Les manifestations initiales apparaissent généralement une à trois semaines après l’exposition aux arthrospores infectieuses. Les lésions classiques se caractérisent par des zones alopéciques circulaires bien délimitées, à extension périphérique, généralement asymétriques. L’érythème, particulièrement visible sur les zones de peau claire, s’accompagne de squames et de croûtes dues à une exsudation modérée. Le prurit, variable dans son intensité, reste généralement minimal à absent, bien que sa présence puisse exacerber les lésions par auto-traumatisme.
Teigne chez un Yorkshire
Les présentations cliniques atypiques méritent une attention particulière :
La dermatophytose pustuleuse représente une forme rare mais significative, pouvant simuler cliniquement et histologiquement un pemphigus foliacé. Cette manifestation particulière souligne l’importance d’inclure la dermatophytose dans le diagnostic différentiel des dermatoses pustuleuses.
Les kérions constituent une forme inflammatoire caractérisée par des nodules érythémateux, alopéciques, en forme de dôme et exsudatifs. L’examen histopathologique révèle une formation granulomateuse ou pyogranulomateuse, souvent associée à des fragments de tiges pilaires contenant des spores fongiques. Cette présentation s’observe principalement lors d’infections à M. gypseum ou T. mentagrophytes.
Les pseudomycétomes et mycétomes représentent des complications plus rares mais significatives. Cliniquement, ils se manifestent par des nodules uniques ou multiples qui fistulisent et ulcèrent, drainant un matériel séro-purulent contenant des grains tissulaires. L’examen histopathologique révèle une dermatite ou panniculite granulomateuse contenant des granules formés d’hyphes ou de pseudohyphes du champignon.
Le diagnostic différentiel nécessite une approche systématique et doit considérer :
La folliculite bactérienne et la démodécie constituent les principaux diagnostics différentiels. Dans le cas de la folliculite bactérienne, la présence de papules ou pustules folliculaires, de collerettes épidermiques et un aspect mité du pelage sont caractéristiques. La démodécie se distingue par la présence de comédons et une délimitation nette des zones alopéciques.
Les maladies auto-immunes, particulièrement le pemphigus foliacé et le lupus érythémateux cutané, doivent être considérées, notamment pour les lésions faciales. Le pemphigus foliacé se caractérise par des pustules non folliculaires, des croûtes et une alopécie. Le lupus érythémateux discoïde produit fréquemment des lésions squameuses, papulo-pustuleuses ou croûteuses affectant le planum nasal, contrairement à la dermatophytose.
L’alopécie aréata et la pseudopelade se distinguent par des zones d’alopécie circulaires où la peau apparaît le plus souvent normale.
Les dermatoses exfoliatives généralisées incluent un large spectre d’affections : endocrinopathies, leishmaniose, lupus érythémateux exfoliatif, adénite sébacée granulomateuse et lymphome cutané. Ces conditions peuvent présenter des similitudes cliniques avec les formes généralisées de dermatophytose.
La présentation clinique peut être modifiée par plusieurs facteurs, notamment l’espèce de dermatophyte en cause, le statut immunitaire de l’hôte et l’administration préalable de traitements. Les infections à M. persicolor, par exemple, se caractérisent initialement par une atteinte non folliculaire avec érythème, squames et croûtes, l’alopécie n’apparaissant que secondairement. Cette forme particulière affecte préférentiellement les chiens de chasse et se manifeste fréquemment par des lésions faciales.
Conclusion
La teigne représente une affection dermatologique complexe dont la présentation clinique variable nécessite une approche diagnostique rigoureuse. Sa gestion thérapeutique doit prendre en compte non seulement l’efficacité du traitement mais également les aspects zoonotiques et environnementaux. Une compréhension approfondie de sa pathogénie et de ses manifestations cliniques est essentielle pour optimiser sa prise en charge.
Questions fréquemment posées (FAQ)
-
La présence de spores sur le pelage indique-t-elle systématiquement une infection active ? Non, la présence de spores peut simplement refléter un portage mécanique sans invasion folliculaire.
-
Les chiens immunodéprimés présentent-ils un risque accru d’infection grave ? Oui, particulièrement chez les animaux atteints d’hyperadrénocorticisme où l’infection peut être plus sévère et prolongée.
-
La contamination environnementale représente-t-elle un risque majeur de transmission ? Non, les études montrent que la transmission par contact direct avec un animal infecté est beaucoup plus fréquente que la contamination environnementale seule.
-
Peut-on se fier uniquement à l’aspect clinique pour le diagnostic ? Non, la présentation polymorphe de la dermatophytose nécessite une confirmation diagnostique par des examens complémentaires.
Bibliographie
-
Begum, J., & Kumar, R. (2020). Prevalence of dermatophytosis in animals and antifungal susceptibility testing of isolated Trichophyton and Microsporum species. Tropical Animal Health and Production, 53(3), 1-8.
-
Moriello, K. A., Coyner, K., Paterson, S., & Mignon, B. (2017). Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Veterinary Dermatology, 28(3), 266-e68.
-
Pin, D. (2017). Non-dermatophyte dermatoses mimicking dermatophytoses in animals. Mycopathologia, 182(1-2), 1-13.
-
Yamada, S., Anzawa, K., & Mochizuki, T. (2019). An epidemiological study of feline and canine dermatophytoses in Japan. Medical Mycology Journal, 60(2), 39-44.
-
ESCCAP. (2016). Lutte contre les dermatophytes chez les chiens et les chats – Adaptation du guide de recommandations ESCCAP no. 2 pour la Suisse, août 2016. (Guide de recommandations pour la lutte contre les dermatophytoses)
Recherches Connexes
chien, teigne, teigne chez le chien, signes cliniques, corps, traitement de la teigne, tronc, visage, cheveux, mycose, personnes, humains, milieu extérieur, perte, membres, plaques, modes, environnement, symptômes, bras, homme, lampe uv, eau de javel, prévention, symptômes de la teigne, chevaux, démangeaisons, cobayes, teigne chien, teigne du chien, lapins, teigne chien, teigne, chien, signes cliniques, teigne chez le chien, maladie, chez le chien, animal, traitement, peau, poils, champignons, microsporum canis, lampe uv, causes, symptômes, animal de compagnie, développement, teigne du chien, textes, prévention, propriétaire, humains, pratiques, santé, aspect, mycose, milieu extérieur, vétérinaire, perte, dermatophytes, infection, surfaces, trichophyton mentagrophytes, environnement, chat, bien être, examen, lésions, eau de javel, fait, chien a la teigne, dermatophytoses, spores, diagnostic, teignes, traitement de la teigne, kératine, système immunitaire, corps, contact, dermatophytose, contagion, perte de poils, terriers, rongeurs, cas, comment prévenir la teigne, contagiosité, teigne est une maladie, lampe, charge, chute, griffes, prise, races, maîtres, wood, prévenir la teigne, lésions cutanées