La dermatologie vétérinaire a connu une transformation radicale au cours des deux dernières décennies, marquée par l’émergence et la propagation mondiale des staphylocoques résistants à la méthicilline (SRM). Autrefois considérées comme des infections bactériennes simples et répondant de manière prévisible aux traitements, les pyodermites canines sont aujourd’hui au centre d’une crise de résistance aux antimicrobiens.
Septembre 2025
Introduction : L’Émergence d’un Défi Clinique et de Santé Publique
Cette évolution a contraint la profession vétérinaire à revoir fondamentalement ses approches diagnostiques, thérapeutiques et de biosécurité. Ce rapport vise à fournir une analyse exhaustive de l’importance des SRM en dermatologie vétérinaire, en s’appuyant sur les données scientifiques actuelles pour éclairer la pratique clinique et la santé publique.
L’enjeu principal réside dans le fait que la résistance à la méthicilline, qui confère une inefficacité clinique à l’ensemble de la classe des bêtalactamines, est très fréquemment associée à un phénotype de multirésistance (MDR). Cette association rend inopérantes de nombreuses autres familles d’antibiotiques, telles que les macrolides, les lincosamides, les fluoroquinolones ou les aminosides. Cette situation a engendré un changement de paradigme thérapeutique. L’échec des traitements empiriques, autrefois efficaces, contraint les cliniciens à recourir à des molécules antibiotiques de dernier recours, comme le chloramphénicol ou la rifampicine. Ces alternatives, bien que potentiellement efficaces si l’antibiogramme le confirme, présentent des profils d’effets indésirables plus contraignants et nécessitent un suivi biologique plus étroit, augmentant ainsi la complexité, les risques et le coût de la prise en charge.
A noter que pour le GEDAC (Groupe d’Etude Français en Dermatologie des Animaux de Compagnie), la rifampicine fait parti des antibiotiques à ne jamais utiliser afin de la préserver pour la médecine humaine afin de traiter des infections humaines graves comme la tuberculose. Il en est de même pour la mupirocine.
Contexte historique et changement de paradigme
L’ère post-Seconde Guerre mondiale a introduit les antimicrobiens en médecine vétérinaire, révolutionnant le traitement des maladies infectieuses. Pendant des décennies, les pyodermites canines, principalement causées par des staphylocoques, étaient traitées avec succès par des antibiotiques ẞ-lactamines, tels que les pénicillines et les céphalosporines. Cependant, cette utilisation généralisée, souvent empirique, a exercé une pression de sélection intense sur les populations bactériennes. Le résultat inévitable de cette pression a été l’émergence de souches résistantes, transformant un problème clinique gérable en un défi thérapeutique majeur. L’émergence significative du Staphylococcus pseudintermedius résistant à la méthicilline (SPIRM) vers le milieu des années 2000 a marqué un tournant, signalant la fin de l’ère de la confiance dans les traitements empiriques pour la pyodermite. Ce n’est pas un événement isolé, mais la conséquence directe et prévisible de nos pratiques thérapeutiques passées. La pyodermite canine étant une affection extrêmement fréquente, et le traitement de première intention étant historiquement un antibiotique ẞ-lactame, l’utilisation répétée de ces médicaments a créé un environnement évolutif idéal pour la sélection et la propagation des souches portant les gènes de résistance. Ainsi, nos propres protocoles de traitement ont involontairement façonné l’émergence des pathogènes qui sont aujourd’hui les plus difficiles à traiter.
Définition et taxonomie
La résistance à la méthicilline chez les staphylocoques est un phénotype conférant une résistance à pratiquement tous les antibiotiques de la classe des ẞ-lactamines, incluant les pénicillines, les céphalosporines et les carbapénèmes. Le mécanisme moléculaire sous-jacent est la présence du gène mecA, qui est localisé sur un élément génétique mobile appelé cassette chromosomique staphylococcique (SCCmec). Ce gène code pour une protéine de liaison à la pénicilline modifiée, la PBP2a (Penicillin-Binding Protein 2a), qui possède une très faible affinité pour les antibiotiques ẞ-lactamines. En conséquence, la synthèse de la paroi cellulaire bactérienne peut se poursuivre même en présence de ces antibiotiques, les rendant inefficaces.
Le phénotype de multirésistance (MDR) fréquemment observé chez les SRM n’est pas un phénomène fortuit. La cassette SCCmec est une plateforme génétique qui, en plus du gène meca, peut transporter et transférer des gènes conférant une résistance à d’autres classes d’antibiotiques (par exemple, tétracyclines, macrolides). Ainsi, la pression de sélection exercée par l’utilisation d’une bêtalactamine peut non seulement sélectionner des souches résistantes à la méthicilline, mais aussi co-sélectionner, en un seul événement, une résistance à de multiples autres familles d’antibiotiques. Ce phénomène de co-sélection explique l’émergence rapide de souches quasi-intraitables et renforce l’argument contre l’usage empirique des bêtalactamines dans les infections staphylococciques.
Un point fondamental pour comprendre l’épidémiologie actuelle est la reclassification taxonomique survenue en 2005. Auparavant, la plupart des staphylocoques coagulase-positifs isolés chez les chiens étaient identifiés comme Staphylococcus intermedius. Des techniques moléculaires ont permis de distinguer trois espèces distinctes au sein du groupe Staphylococcus intermedius (SIG): S. intermedius, S. delphini et S. pseudintermedius. Cette révision a révélé que S. pseudintermedius est l’espèce prédominante qui colonise et cause des infections chez les chiens et les chats. Par conséquent, la grande majorité des isolats précédemment identifiés comme S. intermedius dans la littérature vétérinaire étaient en réalité S. pseudintermedius. En dermatologie canine, trois espèces de SRM sont particulièrement pertinentes: S. pseudintermedius (SPIRM), S. aureus (SARM) et S. schleiferi (SSRM).
Importance globale et le concept “One Health”
Le problème des SRM chez les animaux de compagnie dépasse largement les murs de la clinique vétérinaire pour devenir une préoccupation de santé publique. Cette situation s’inscrit parfaitement dans le cadre du concept “One Health” (Une seule santé), qui reconnaît l’interconnexion profonde et indissociable entre la santé humaine, la santé animale et la santé de l’environnement. Les animaux de compagnie partagent notre environnement domestique, reçoivent souvent des classes d’antibiotiques similaires à celles utilisées en médecine humaine, et peuvent servir de réservoirs ou de vecteurs pour les bactéries résistantes. La présence de SARM et de SPIRM chez les animaux de compagnie les place au centre d’un “triangle” de transmission dynamique entre les humains, les animaux et leur environnement commun. La gestion de l’antibiorésistance en dermatologie vétérinaire n’est donc pas seulement une question de bien-être animal, mais aussi une responsabilité partagée dans la lutte mondiale contre la menace croissante des “superbactéries”.
Épidémiologie et Évolution des Staphylocoques Résistants
L’épidémiologie des SRM en médecine vétérinaire est un domaine dynamique, caractérisé par l’émergence rapide de clones résistants et leur dissémination mondiale. Comprendre la prévalence, les facteurs de risque et les réservoirs de ces pathogènes est essentiel pour une gestion clinique et préventive efficace.
A. Staphylococcus pseudintermedius Résistant à la Méthicilline (SPIRM): Le Pathogène Canin Dominant
Historique de l’émergence
Bien que des cas sporadiques aient été rapportés dans les années 1990, l’émergence significative du SPIRM en tant que pathogène clinique majeur est un phénomène relativement récent, qui a pris de l’ampleur à partir de 2006. Les premières reconnaissances officielles datent de 2001 en Amérique du Nord et de 2007 en Europe. Cette émergence rapide n’a pas été le fruit d’événements de résistance multiples et indépendants, mais a été principalement due à la propagation clonale explosive de quelques lignées bactériennes très performantes.
Propagation clonale mondiale
L’analyse par typage de séquence multilocus (MLST) a permis de cartographier la dissémination mondiale du SPIRM. Une revue systématique a identifié cinq complexes clonaux (CC) majeurs qui dominent le paysage épidémiologique.
- CC71: Initialement décrit comme le “clone épidémique européen”, il est aujourd’hui répandu dans le monde entier, bien que la majorité des isolats proviennent encore d’Europe.
- CC68: Connu comme le “clone épidémique nord-américain”, il est fréquemment isolé en Amérique du Nord mais a également été identifié en Europe.
- CC258: De plus en plus signalé en Europe, ce clone présente un profil de résistance distinct de celui du CC71.
- CC45 et CC112: Ces lignées sont particulièrement prévalentes en Asie, mais ont également été détectées sur d’autres continents.
Cette dynamique illustre un processus en deux étapes: premièrement, la sélection locale de ces clones par la pression exercée par l’usage des antibiotiques en médecine vétérinaire, notamment les bêtalactamines; deuxièmement, leur dissémination globale facilitée par les mouvements internationaux croissants d’animaux de compagnie. Cette dissémination rapide sur de vastes zones géographiques est fortement facilitée par les déplacements internationaux des chiens, que ce soit pour les expositions, la reproduction ou les voyages. Une étude menée à la Grenade a documenté pour la première fois l’introduction du SPIRM sur l’île, avec des données génotypiques et épidémiologiques suggérant que des chiens “visiteurs” ont transmis le pathogène à la population canine locale.
Prévalence
La prévalence du SPIRM varie de manière spectaculaire en fonction de la population canine étudiée, ce qui a des implications directes pour la suspicion clinique.
- Chez les chiens sains: Le portage de SPIRM chez les chiens en bonne santé est généralement faible. Les études rapportent des taux de prévalence allant de 0% à 4,5 %. Ces animaux sont des porteurs asymptomatiques.
- Chez les chiens malades: La situation est radicalement différente dans les populations de chiens présentés pour des problèmes dermatologiques. Dans les cliniques de dermatologie spécialisées, la prévalence du SPIRM chez les chiens atteints de pyodermite peut être extrêmement élevée, atteignant jusqu’à 40,5% dans une étude. Une autre étude menée en Thaïlande sur des chiens atteints de pyodermite a révélé une prévalence globale de SRM de 35,7%. Cette disparité souligne que les chiens atteints de maladies cutanées chroniques constituent une population à très haut risque. Une étude de grande envergure menée aux États-Unis entre 2019 et 2022 a analysé des dizaines de milliers d’isolats cliniques et a identifié 110 423 isolats de SPIRM. En France, des données plus récentes issues d’animaux malades rapportent une fréquence de SPIRM de 17%.
Facteurs de risque
L’identification des facteurs de risque est cruciale pour cibler les efforts de diagnostic et de prévention. Plusieurs facteurs ont été constamment associés à un risque accru d’infection ou de colonisation par le SPIRM:
- Utilisation antérieure d’antibiotiques: C’est le facteur de risque le plus important et le plus fréquemment cité. L’exposition récente à des antibiotiques, en particulier les ẞ-lactamines et les fluoroquinolones, sélectionne les souches résistantes en éliminant la flore sensible concurrente.
- Contact avec le milieu vétérinaire: Des hospitalisations récentes ou des visites fréquentes en clinique vétérinaire augmentent le risque d’exposition au SPIRM.
- Maladies cutanées chroniques sous-jacentes: Les chiens souffrant de dermatite atopique, d’allergies ou d’otites chroniques sont particulièrement prédisposés. Ces conditions altèrent la barrière cutanée et nécessitent souvent des traitements antimicrobiens répétés, créant un cercle vicieux.
Réservoirs environnementaux
Les staphylocoques sont des bactéries robustes capables de survivre pendant de longues périodes sur des surfaces inanimées. Les cliniques vétérinaires agissent comme des réservoirs environnementaux importants pour le SPIRM. Une étude a montré que le SPIRM pouvait être isolé sur 10% des surfaces échantillonnées dans des cliniques de soins primaires, sans différence significative entre les surfaces de contact avec les mains (ex: poignées de porte, claviers) et les surfaces de contact avec les animaux (ex: tables d’examen). Le typage des souches a révélé une grande similarité entre les isolats d’un même hôpital, mais une faible similarité entre les hôpitaux, ce qui indique une transmission et une persistance intra-hospitalière. Des souches de SPIRM indiscernables ont été trouvées à la fois chez des patients canins et sur des surfaces environnementales au sein de la même clinique, confirmant le rôle de l’environnement dans la transmission nosocomiale. Une hygiène des mains inadéquate du personnel vétérinaire, avec une conformité rapportée aussi faible que 14%, est un facteur majeur contribuant à cette transmission.
B. Staphylococcus aureus Résistant à la Méthicilline (SARM) et S. schleiferi (SSRM): Une Perspective Comparative
Bien que le SPIRM soit le principal acteur, d’autres SRM jouent un rôle en dermatologie canine.
Staphylococcus aureus (SARM)
- S. aureus est avant tout un commensal et un pathogène humain. Sa présence chez le chien est donc épidémiologiquement distincte de celle de S. pseudintermedius.
- Origine et Transmission: S. aureus n’est pas un membre de la flore commensale normale du chien. Par conséquent, lorsqu’un SARM est isolé chez un chien, il s’agit le plus souvent d’une colonisation ou d’une infection transitoire résultant d’une transmission de l’homme à l’animal, un phénomène connu sous le nom de zoonose inverse ou anthroponose. Cette colonisation est généralement de courte durée, l’organisme étant éliminé en quelques semaines s’il n’y a pas de ré-exposition.
- Prévalence et Facteurs de Risque: La prévalence du portage de SARM chez les chiens sains est faible, généralement entre 0 et 4%. Cependant, ce taux peut être plus élevé dans des populations spécifiques d’animaux ayant un contact étroit avec le système de santé humain, comme les chiens de thérapie visitant les hôpitaux ou les animaux de compagnie appartenant à des professionnels de la santé. Les facteurs de risque identifiés chez les animaux de compagnie pour l’acquisition du SARM reflètent ceux de l’homme: antibiothérapie antérieure, hospitalisation et contact avec une personne infectée ou colonisée par le SARM.
- Importance Clinique: Bien qu’il soit moins fréquent que le SPIRM, le SARM est un pathogène opportuniste capable de provoquer des infections cliniques chez le chien, notamment des pyodermites, des infections de plaies chirurgicales et des infections des voies urinaires.
Staphylococcus schleiferi (SSRM)
- S. schleiferi, qui existe sous deux sous-espèces (S. schleiferi subsp. schleiferi, coagulase-négative, et S. schleiferi subsp. coagulans, coagulase-positive), est de plus en plus reconnu comme un pathogène cutané important chez le chien.
- Pathogène Émergent: Il est maintenant identifié comme une cause significative de pyodermite et d’otite externe canine. Dans certaines études, il est le deuxième staphylocoque le plus fréquemment isolé dans ces conditions.
- Taux de Résistance Élevés: Une caractéristique préoccupante de S. schleiferi est son taux élevé de résistance à la méthicilline. Des études menées dans des centres de référence en dermatologie ont rapporté des taux de résistance de 40% à 46,6 %. Une étude sur une population moins biaisée a trouvé un taux de résistance de 20% chez les chiens atteints de dermatite inflammatoire.
- Multirésistance: Comme le SPIRM, le SSRM présente souvent une multirésistance, notamment une résistance fréquente aux fluoroquinolones, ce qui complique davantage les options thérapeutiques.
La distinction entre ces trois pathogènes est d’une importance capitale en pratique clinique. Un rapport de laboratoire identifiant un “Staphylocoque résistant à la méthicilline” nécessite une interprétation éclairée pour guider la gestion du cas, la communication avec le client et les mesures de biosécurité. Par exemple, l’identification d’un SARM (S. aureus) doit immédiatement faire suspecter une source humaine et déclencher une discussion sur les risques potentiels pour la santé des membres du foyer. À l’inverse, un diagnostic de SPIRM orientera l’investigation vers la gestion de la maladie cutanée sous-jacente du chien et le contrôle de la contamination environnementale. Le tableau suivant synthétise ces différences clés.
|
Caractéristique |
Staphylococcus pseudintermedius (SPIRM) |
Staphylococcus aureus (SARM) |
Staphylococcus schleiferi (SSRM) |
|
Statut Commensal Principal |
Chien (flore normale de la peau et des muqueuses) |
Homme (colonisation canine transitoire) |
Chien et Homme (flore cutanée) |
|
Prévalence dans la Pyodermite Canine |
Très élevée (pathogène dominant) |
Faible à modérée |
Faible à modérée (pathogène émergent) |
|
Réservoir Principal |
Animal (chien) |
Humain (système de santé, communauté) |
Animal et Humain |
|
Voie de Transmission Principale |
Animal-Animal, Environnement-Animal |
Homme-Animal (zoonose inverse) |
Moins définie, probablement Animal-Animal |
|
Potentiel Zoonotique (Animal -> Homme) |
Faible mais documenté |
Significatif (préoccupation de santé publique majeure) |
Rare, principalement nosocomial chez l’homme |
Pathogenèse de la Pyodermite Staphylococcique
La pyodermite staphylococcique n’est pas simplement la présence de bactéries sur la peau; c’est le résultat d’une interaction complexe entre le pathogène, l’hôte et l’environnement. La transition de S. pseudintermedius d’un simple résident de la peau à un agent infectieux dépend de la rupture de l’équilibre délicat qui maintient l’homéostasie cutanée.
De Commensal à Pathogène Opportuniste: Le Rôle de la Barrière Cutanée
- S. pseudintermedius est un commensal bien adapté à son hôte canin, colonisant la peau et les muqueuses (narines, bouche, pharynx, périnée) de 46% à 92% des chiens sains sans causer de maladie. L’infection est un événement opportuniste, qui ne se produit que lorsque les défenses de l’hôte sont affaiblies. La barrière cutanée, composée d’éléments physiques (stratum corneum), chimiques (lipides, peptides antimicrobiens) et immunologiques, est la principale ligne de défense. Toute altération de cette barrière crée une porte d’entrée pour l’invasion bactérienne.
L’importance clinique du SPIRM ne réside pas dans une virulence accrue par rapport à son homologue sensible (MSSP). En effet, les études n’ont pas démontré que les souches résistantes à la méthicilline sont intrinsèquement plus agressives ou pathogènes. Les mécanismes de la maladie et les lésions cliniques qu’elles provoquent sont indiscernables. Le véritable enjeu est ailleurs: il réside dans l’échec thérapeutique. Face à une infection à SPIRM, un traitement empirique avec un antibiotique de première ligne, comme la céphalexine, est voué à l’échec. Cet échec initial déclenche une cascade de conséquences négatives: la maladie se prolonge, augmentant la morbidité et l’inconfort de l’animal; la charge bactérienne sur l’animal et dans son environnement augmente, accroissant le risque de transmission; et cela conduit souvent à des cycles d’antibiothérapies successives et inefficaces, qui non seulement ne résolvent pas le problème, mais exercent une pression de sélection supplémentaire, favorisant l’émergence de résistances additionnelles. Ainsi, une simple pyodermite se transforme en un cas clinique complexe, chronique, coûteux et frustrant, avec des implications potentielles pour la santé publique. C’est cette dimension de l’échec thérapeutique qui confère au SPIRM son importance clinique dévastatrice.
Rôle des Facteurs de Virulence
Une fois la barrière franchie, S. pseudintermedius utilise un arsenal de facteurs de virulence pour établir l’infection.
- Toxines Exfoliatives (ExpA et ExpB): Ces protéines sont des acteurs clés dans la formation des lésions de pyodermite. Elles agissent comme des protéases hautement spécifiques qui ciblent et clivent la desmogléine-1 canine, une cadhérine desmosomale essentielle à l’adhésion entre les kératinocytes dans l’épiderme. La dégradation de la desmogléine-1 perturbe la cohésion de l’épiderme, provoquant un clivage intra-épidermique (acantholyse) et la formation de pustules sous-cornéennes. L’injection intradermique de ces toxines purifiées chez des chiens reproduit les signes cliniques de la pyodermite, tels que l’érythème et la formation de croûtes, confirmant leur rôle pathogène direct. D’autres toxines incluent la toxine exfoliative SIET, une leucotoxine bicomposant, Luk-I, qui cible et détruit les leucocytes polynucléaires, et des entérotoxines superantigéniques, comme SECCANINE, capables de provoquer une activation polyclonale des lymphocytes T.
- Adhésines et Protéines de Surface: Pour initier une infection, la bactérie doit d’abord adhérer aux cellules de l’hôte. S. pseudintermedius exprime une série de protéines de surface, appelées adhésines (famille Sps), qui se lient spécifiquement aux composants de la matrice extracellulaire de l’hôte, tels que le fibrinogène, la fibronectine et le cytokeratin-10. Des protéines comme SpsD et SpsL facilitent non seulement l’adhésion aux cornéocytes, mais aussi l’invasion des kératinocytes et la formation de biofilms.
- Formation de Biofilm: Le biofilm est une communauté structurée de bactéries enrobées dans une matrice polymérique auto-produite, qui offre une protection contre les défenses immunitaires de l’hôte et les antibiotiques, contribuant ainsi à la chronicité des infections. La formation de biofilm est particulièrement critique dans les infections chroniques, les otites et les infections de sites chirurgicaux, notamment sur des matériaux inertes comme les implants ou les fils de suture. Le biofilm protège efficacement les bactéries de la réponse immunitaire de l’hôte et de la pénétration des antibiotiques, rendant l’éradication de l’infection extrêmement difficile.
Le Facteur Prédisposant Central: La Rupture de la Barrière Cutanée
La quasi-totalité des cas de pyodermite staphylococcique canine sont des maladies secondaires. L’affirmation selon laquelle “les chiens sains ne développent pas d’infections cutanées” est un principe fondamental en dermatologie vétérinaire. L’identification et la gestion de la cause sous-jacente sont donc non seulement importantes pour le traitement, mais absolument essentielles pour la prévention des récidives.
- Dermatite Atopique et Allergies: C’est la cause sous-jacente la plus fréquente. L’inflammation allergique (qu’elle soit due à des allergènes environnementaux, alimentaires ou à des piqûres de puces) compromet la barrière cutanée de plusieurs manières. Premièrement, le prurit intense qu’elle provoque entraîne un auto-traumatisme (grattage, léchage, mordillement) qui endommage physiquement le stratum corneum. Deuxièmement, l’inflammation elle-même altère la composition et l’organisation des lipides intercellulaires (céramides) et diminue la production de peptides antimicrobiens naturels, rendant la peau plus perméable et moins apte à se défendre contre les microbes. Cet environnement cutané enflammé et endommagé est un terrain idéal pour la prolifération de S. pseudintermedius.
- Autres Facteurs Prédisposants: D’autres conditions peuvent également altérer l’intégrité de la peau et prédisposer aux infections. Celles-ci incluent les endocrinopathies comme l’hypothyroïdie et l’hypercorticisme (syndrome de Cushing), qui affectent le renouvellement de la peau et l’immunité locale; les ectoparasites (Demodex, Sarcoptes) qui causent des dommages directs et de l’inflammation; et les troubles de la kératinisation (séborrhée) qui modifient la surface de la peau.
Approche Clinique et Diagnostique des Pyodermites à Staphylocoques Résistants
Face à un cas de pyodermite, le clinicien doit adopter une approche systématique et fondée sur les preuves. L’ère de la résistance aux antimicrobiens exige une plus grande rigueur diagnostique pour éviter les échecs thérapeutiques et promouvoir une utilisation judicieuse des antibiotiques.
A. Présentation Clinique
Les infections cutanées staphylococciques chez le chien sont classées en fonction de la profondeur de l’atteinte tissulaire.
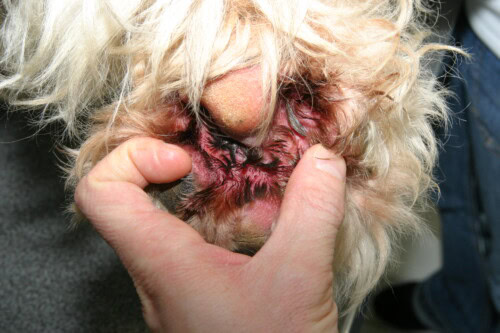
- Pyodermite Superficielle: L’infection est confinée à l’épiderme et aux follicules pileux. La forme la plus commune est la folliculite bactérienne superficielle. Les lésions cliniques typiques sont variées et comprennent:
- Papules et Pustules Folliculaires: De petites élévations rouges (papules) ou remplies de pus (pustules), centrées sur un poil.
- Collerettes Épidermiques: Ce sont des lésions très caractéristiques. Elles se présentent comme des zones circulaires d’alopécie avec une bordure de squames ou de croûtes qui s’étend de manière centrifuge.
- Lésions en Cible: Zones d’érythème central avec une bordure plus pâle et un anneau érythémateux périphérique.
- Aspect “Mité”: Chez les chiens à poil court, la folliculite peut se manifester par de multiples petites zones d’alopécie, donnant au pelage une apparence “mangée aux mites”.
- D’autres signes comme des croûtes, un érythème et une hyperpigmentation post-inflammatoire sont également fréquents.
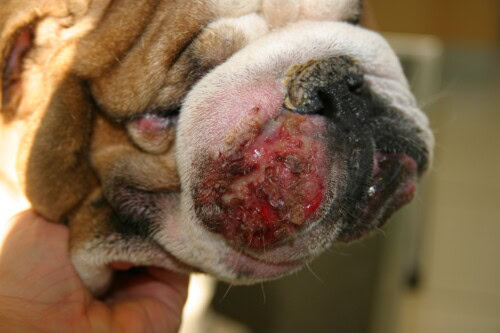
- Pyodermite Profonde: Cette forme est plus sévère car elle implique une rupture des follicules pileux (furonculose) et une extension de l’infection dans le derme et parfois l’hypoderme (cellulite). Les signes cliniques sont plus spectaculaires et souvent douloureux:
- Nodules et Bulles Hémorragiques: Lésions surélevées, fermes ou fluctuantes, souvent remplies d’un contenu purulent ou sanglant.
- Fistules Drainantes: Ouvertures dans la peau par lesquelles s’écoule un exsudat séro-sanguinolent ou purulent.
- Signes Sévères: Œdème, ulcères, croûtes épaisses et inflammation marquée sont courants. Contrairement à la pyodermite superficielle, les chiens atteints de pyodermite profonde peuvent présenter des signes systémiques tels que fièvre, léthargie et anorexie.
Un point d’une importance capitale doit être souligné: il est cliniquement impossible de distinguer une pyodermite causée par une souche de staphylocoque résistante à la méthicilline d’une infection causée par une souche sensible. Les lésions sont morphologiquement identiques. La suspicion d’une infection résistante ne doit donc jamais reposer sur l’apparence des lésions, mais plutôt sur l’anamnèse du patient, la présence de facteurs de risque et, surtout, la réponse au traitement.
B. Stratégie Diagnostique Fondée sur les Preuves
L’avènement des SRM a imposé un changement de paradigme dans l’approche diagnostique de la pyodermite. L’approche historique consistant à “traiter d’abord, poser des questions ensuite” avec des antibiotiques empiriques est non seulement devenue obsolète, mais elle est désormais considérée comme dangereuse et contraire aux principes de l’antibiogouvernance. La cytologie, autrefois considérée comme un outil complémentaire, est devenue une étape essentielle et non négociable de l’examen initial. Ignorer la cytologie dans le contexte actuel de résistance généralisée constitue une faute professionnelle. Elle est le pivot de la décision clinique: elle confirme la présence d’une infection bactérienne, justifiant ainsi l’instauration d’un traitement antimicrobien (qui devrait être topique en première intention), elle guide la reconnaissance des cas nécessitant une culture immédiate (présence de bacilles, pyodermite profonde), et elle permet d’évaluer la réponse au traitement.
La Cytologie Cutanée: L’Outil Indispensable de Première Ligne
La cytologie est un test diagnostique rapide, peu coûteux, minimalement invasif et réalisable en clinique, qui devrait être systématiquement effectué sur tout patient présentant des lésions compatibles avec une pyodermite.
- Technique de Prélèvement: La méthode dépend de la nature de la lésion.
- Impression directe sur lame: Pour les lésions humides ou exsudatives, ou après avoir rompu une pustule intacte avec une aiguille stérile.
- Scotch-test (Bande adhésive): Idéal pour les lésions sèches, squameuses ou situées dans des zones difficiles d’accès comme les espaces interdigités.
- Écouvillon: Utile pour prélever du matériel dans les conduits auditifs ou les fistules.
- Interprétation: L’échantillon est coloré (par exemple, avec une coloration de type Wright-Giemsa modifiée) et examiné au microscope. La découverte de cocci phagocytés par des neutrophiles dégénérés est la preuve pathognomonique d’une pyodermite bactérienne. La présence de nombreuses bactéries extracellulaires associées à une population de cellules inflammatoires est également très suggestive. La cytologie permet aussi de détecter la présence d’autres agents (levures de type Malassezia, bacilles) et d’évaluer le type de réponse inflammatoire.
La cytologie est le premier examen primordial à réaliser
Culture Bactérienne et Antibiogramme: La Clé de la Thérapie Ciblée
La culture bactérienne avec test de sensibilité aux antimicrobiens (antibiogramme) n’est pas nécessaire pour tous les cas de pyodermite, mais elle est impérative dans des circonstances spécifiques pour guider une thérapie rationnelle.
- Indications Claires: La culture et l’antibiogramme sont fortement recommandés, voire obligatoires, dans les situations suivantes :
- Réponse clinique insuffisante (moins de 50% d’amélioration des lésions) après deux semaines d’une antibiothérapie systémique appropriée.
- Apparition de nouvelles lésions (papules, pustules) au cours d’un traitement antibiotique en cours depuis au moins deux semaines.
- Présence de bacilles à l’examen cytologique.
- Présence de lésions de pyodermite profonde (furonculose, cellulite, nodules).
- Antécédents d’infection multirésistante chez l’animal ou un autre animal du foyer.
- Méthodologie de Prélèvement: Pour être fiable, le prélèvement pour culture doit être réalisé de manière aseptique afin d’éviter toute contamination. La qualité du prélèvement est déterminante. Les sites et techniques de prélèvement idéaux sont :
- Pustule intacte: C’est le site idéal. Après une désinfection douce, la pustule est rompue stérilement avec une aiguille et son contenu recueilli sur un écouvillon.
- Croûte: L’écouvillon est passé sur la surface humide de la peau après avoir soulevé délicatement une croûte récente.
- Collerette épidermique: L’écouvillon est roulé fermement sur la bordure active de la lésion.
- Nodule ou fistule: Une biopsie tissulaire pour culture est la méthode de choix pour les lésions profondes.
- Interprétation et Utilité: Le laboratoire identifiera l’espèce bactérienne et testera sa sensibilité à un panel d’antibiotiques. Pour les staphylocoques, le test de sensibilité à l’oxacilline ou à la céfoxitine est utilisé pour détecter la résistance à la méthicilline (présence du gène mecA). L’antibiogramme est le seul moyen de choisir un antibiotique systémique efficace contre une souche de SPIRM, qui est souvent multirésistante.
L’antibiogramme s’avère primordial dans la gestion des SRM
Principes Thérapeutiques et Gestion des Infections à SPIRM
La gestion des pyodermites à SPIRM a évolué vers une approche multimodale qui met l’accent sur la thérapie topique, réserve l’antibiothérapie systémique à des indications précises et, surtout, s’attaque à la cause sous-jacente de l’infection.
A. La Thérapie Topique: Pierre Angulaire du Traitement
Face à la montée de la résistance, la thérapie topique a été élevée du statut de traitement d’appoint à celui de traitement de première ligne. Les directives internationales, telles que celles de la World Association for Veterinary Dermatology (WAVD), recommandent désormais la thérapie topique comme modalité de traitement de choix pour les pyodermites superficielles, qu’elles soient causées par des souches sensibles ou résistantes. Plusieurs études ont démontré qu’un protocole de traitement topique bien conduit peut être aussi efficace qu’une antibiothérapie systémique pour résoudre une pyodermite superficielle, y compris celles causées par le SPIRM. Les avantages sont multiples: obtention de concentrations d’antiseptiques très élevées au site de l’infection (bien au-dessus de la concentration minimale inhibitrice), réduction du risque de sélection de résistance dans d’autres systèmes (comme le tractus digestif), et effets bénéfiques non spécifiques comme le débridement mécanique des croûtes et des débris.
Agents Antiseptiques Efficaces
Plusieurs ingrédients actifs ont prouvé leur efficacité.
- Chlorhexidine: C’est l’agent topique le plus étudié et le plus recommandé en raison de sa puissante activité antimicrobienne in vivo et de son effet rémanent. Elle est bactéricide contre les staphylocoques, y compris les souches résistantes à la méthicilline. Les concentrations efficaces dans les produits vétérinaires varient généralement de 2% à 4 %.
- Peroxyde de Benzoyle: Aux concentrations de 2,5% à 3%, il possède une activité antimicrobienne, ainsi que des propriétés kératolytiques (aide à éliminer les couches de peau morte), comédolytiques (ouvre les follicules pileux) et dégraissantes. Cependant, il peut être asséchant et irritant pour la peau, ce qui peut limiter son utilisation ou nécessiter l’emploi concomitant d’émollients.
- Autres agents: D’autres antiseptiques comme l’hypochlorite de sodium dilué (eau de Javel diluée), l’acide acétique/acide borique, et l’éthyl lactate ont également montré une certaine efficacité et peuvent être des options valables.
Protocoles d’Application
Le succès de la thérapie topique dépend de manière critique du respect du protocole.
- Formulations: Le choix de la formulation dépend de l’étendue des lésions, du type de pelage et de la facilité d’application pour le propriétaire.
- Shampoings: Idéaux pour les infections généralisées, ils permettent de traiter de grandes surfaces cutanées.
- Mousses, Sprays, Lingettes: Très utiles pour une application quotidienne, pour les traitements localisés, ou pour les jours sans bain. Ils ne nécessitent généralement pas de rinçage.
- Crèmes, Onguents, Gels: Conviennent aux lésions localisées et aux zones peu poilues.
- Fréquence et Temps de Contact: Un temps de contact d’au moins 10 minutes est crucial pour que les shampoings antiseptiques puissent exercer leur effet bactéricide. La fréquence de bain recommandée est généralement de 2 à 3 fois par semaine, mais peut être augmentée à une fréquence quotidienne dans les cas sévères de SPIRM. Les mousses et sprays peuvent être appliqués une à deux fois par jour. Le traitement doit être poursuivi pendant au moins 7 à 10 jours après la résolution clinique complète des lésions pour prévenir les rechutes précoces. Pour les animaux à poil long ou dense, une tonte est souvent indispensable pour permettre au produit d’atteindre la peau et d’agir efficacement.
Tableau 1 : Protocoles de Thérapie Topique pour la Pyodermite Superficielle Canine
|
Principe Actif |
Concentrations Courantes |
Formulations Disponibles |
Protocole d’Application Recommandé |
Remarques Cliniques |
|
Chlorhexidine |
2%, 3%, 4% |
Shampooing, Mousse, Spray, Lingettes, Gel |
Shampooing : 2-3 fois/semaine, temps de contact de 10 minutes. Mousse/Spray/Lingettes : 1-2 fois/jour, notamment les jours sans shampooing. |
Antiseptique de premier choix. Très bonne efficacité et tolérance. La tonte améliore significativement l’efficacité. |
|
Peroxyde de benzoyle |
2.5%, 3% |
Shampooing, Gel |
Shampooing : 2-3 fois/semaine, temps de contact de 5-10 minutes. |
Action kératolytique et dégraissante utile dans certains cas. Potentiel irritant et desséchant plus élevé que la chlorhexidine. |
|
Hypochlorite de sodium |
0.005% (dilution) |
Solution pour bain |
Bains : 2-3 fois/semaine, temps de contact de 10-15 minutes. |
Alternative intéressante et peu coûteuse. Préparation extemporanée nécessaire (eau de Javel diluée). |
|
Antibiotiques topiques (Mupirocine, Acide fusidique) |
2% |
Pommade, Crème |
Application : 2-3 fois/jour sur des lésions très localisées. |
Réservés aux lésions focales. L’usage extensif est à proscrire pour limiter le risque de sélection de résistance. La mupirocine ne doit pas être utilisée ( Recommandations GEDAC) |
B. L’Antibiothérapie Systémique: Une Approche Raisonnée et Ciblée
L’utilisation d’antibiotiques systémiques doit être une décision réfléchie et justifiée, et non un réflexe. Elle est réservée aux pyodermites profondes, où l’infection atteint des tissus que la thérapie topique ne peut pas pénétrer efficacement, et aux cas de pyodermite superficielle généralisée qui ne répondent pas à un traitement topique seul bien conduit.
Principe de Sélection
Le choix d’un antibiotique systémique pour une infection suspectée ou confirmée de SPIRM doit impérativement être basé sur les résultats d’un antibiogramme. L’utilisation empirique d’antibiotiques de seconde ou troisième ligne est une pratique dangereuse qui favorise l’émergence de résistances encore plus étendues. Il est crucial de respecter la “règle d’expert“: un staphylocoque résistant à l’oxacilline doit être considéré comme cliniquement résistant à toutes les bêtalactamines, même si l’antibiogramme suggère une sensibilité apparente à certaines céphalosporines. La durée du traitement doit être suffisamment longue : au minimum 3 à 4 semaines pour une pyodermite superficielle et 6 à 8 semaines pour une pyodermite profonde, en poursuivant toujours le traitement pendant 1 à 2 semaines après la résolution clinique complète.
Options Thérapeutiques pour le SPIRM (basées sur la sensibilité)
Le SPIRM est, par définition, résistant à tous les antibiotiques ẞ-lactames. De plus, les clones épidémiques sont souvent multirésistants, présentant une résistance croisée à de nombreuses autres classes d’antibiotiques couramment utilisées en médecine vétérinaire, telles que les tétracyclines, les macrolides (érythromycine), les lincosamides (clindamycine) et les fluoroquinolones (enrofloxacine). Les options thérapeutiques sont donc limitées et doivent être choisies avec soin en fonction des résultats de la culture. L’utilisation d’antibiotiques d’importance critique en médecine humaine (vancomycine, linézolide, téicoplanine) est fortement découragée.
Tableau 2: Options d’Antibiothérapie Systémique pour les Infections à Staphylocoques Résistants chez le Chien (sur la base d’un antibiogramme)
|
Antibiotique |
Posologie (Chien) |
Fréquence d’Administration |
Effets Secondaires Notables |
Précautions et Suivi Recommandé |
|
Chloramphénicol |
50 mg/kg |
Toutes les 8 heures (TID) |
Troubles gastro-intestinaux (vomissements, diarrhée), faiblesse neurologique, myélosuppression réversible (dose-dépendante). |
Marge de sécurité étroite. Suivi hématologique recommandé lors de traitements prolongés. Contre-indiqué chez les animaux reproducteurs. |
|
Doxycycline / Minocycline |
5-10 mg/kg |
Toutes les 12 heures (BID) |
Troubles gastro-intestinaux (vomissements, œsophagite). La minocycline peut être plus efficace que la doxycycline sur certaines souches. |
Administrer avec de la nourriture et de l’eau pour réduire le risque d’œsophagite. La photosensibilité est rare mais possible. |
|
Clindamycine |
11 mg/kg |
Toutes les 12 heures (BID) |
Troubles gastro-intestinaux. |
Souvent inefficace sur les SPIRM en raison d’une co-résistance fréquente. Efficacité conditionnée par l’antibiogramme. |
|
Rifampicine |
5-10 mg/kg |
Toutes les 24 heures (SID) |
Hépatotoxicité potentiellement sévère, troubles gastro-intestinaux, coloration orangée des urines et des larmes. |
Ne jamais utiliser en monothérapie (risque de sélection rapide de mutants résistants). Suivi des enzymes hépatiques impératif avant et pendant le traitement (ex: à 2 et 4 semaines). A ne jamais utiliser (Recommandations GEDAC) |
|
Sulfamides potentialisés (TMS) |
15-30 mg/kg |
Toutes les 12 heures (BID) |
Kératoconjonctivite sèche (KCS), réactions d’hypersensibilité (polyarthrite, anémie, thrombopénie), hépatopathies. |
Risque idiosyncratique élevé chez certaines races (Doberman). Suivi du test de Schirmer recommandé lors de traitements longs. |
Défis et Effets Indésirables
Le traitement des infections à SPIRM avec des antibiotiques de “réserve” n’est pas sans difficultés.
- Chloramphenicol: Bien que souvent efficace in vitro, il est associé à une incidence très élevée d’effets secondaires gastro-intestinaux (vomissements, diarrhée, anorexie), qui conduisent fréquemment à l’arrêt du traitement. Des cas de neurotoxicité réversible (parésie des membres postérieurs) ont également été décrits.
- Doxycycline/Minocycline: Des échecs cliniques ont été rapportés malgré des tests de sensibilité favorables. Cela peut être dû à des seuils d’interprétation de la sensibilité (breakpoints) qui ne prédisent pas toujours avec précision l’efficacité clinique pour S. pseudintermedius.
- Rifampicine: Doit être utilisée en combinaison avec un autre antibiotique efficace pour prévenir la sélection rapide de mutants résistants. Une surveillance de la fonction hépatique est recommandée en raison du risque d’hépatotoxicité.
- Aminoglycosides (ex: amikacine): Ces médicaments nécessitent une administration par injection et un suivi attentif de la fonction rénale en raison de leur néphrotoxicité potentielle.
C. Gestion de la Cause Sous-jacente: La Clé de la Prévention des Récidives
Le traitement antimicrobien, qu’il soit topique ou systémique, ne s’attaque qu’aux conséquences de la maladie (l’infection bactérienne) et non à sa cause. Sans un diagnostic et un contrôle rigoureux de la maladie primaire sous-jacente (dermatite atopique, allergie alimentaire, hypothyroïdie, etc.), les récidives de pyodermite sont inéluctables. Chaque récidive nécessite un nouveau cycle de traitement, augmentant la pression de sélection pour la résistance et le risque d’émergence de souches encore plus difficiles à traiter. La gestion à long terme de ces affections primaires est donc la stratégie la plus efficace pour rompre ce cycle, améliorer la qualité de vie de l’animal et réduire la dépendance globale aux antibiotiques.
Colonisation versus Infection: Implications Cliniques et Épidémiologiques
La distinction entre la colonisation et l’infection par un SRM est un concept fondamental dont la compréhension est essentielle pour une gestion rationnelle des patients et la prévention de la transmission. Ces deux états représentent des scénarios biologiques et cliniques très différents, avec des implications distinctes en termes de traitement et de santé publique.
Définition et Distinction
- Colonisation (ou Portage): Cet état se définit par la présence et la multiplication d’une bactérie, comme le SPIRM, sur les surfaces corporelles d’un hôte (peau, muqueuses nasales, orales, anales) sans qu’il y ait de signes cliniques de maladie ou de réponse inflammatoire de la part de l’hôte. L’animal est un “porteur sain“; la bactérie fait partie de sa microflore de surface, de manière transitoire ou persistante, mais ne cause pas de dommage.
- Infection: L’infection se produit lorsque la bactérie franchit les barrières de défense de l’hôte, envahit les tissus et se multiplie, déclenchant une réponse inflammatoire et provoquant des signes cliniques de maladie (par exemple, les pustules et l’inflammation de la pyodermite).
Signification Clinique et Épidémiologique du Portage
Le statut de porteur, bien qu’asymptomatique, a des conséquences cliniques et épidémiologiques profondes. La persistance de la colonisation après la résolution d’une infection clinique est un phénomène particulièrement préoccupant qui redéfinit la notion de “guérison”. Un animal dont les lésions cutanées ont disparu peut sembler cliniquement guéri, mais il peut rester un porteur asymptomatique. Ce statut de porteur “caché” transforme l’animal guéri en une menace épidémiologique latente. Il devient un “cheval de Troie“, capable de réintroduire le pathogène dans l’environnement clinique, de contaminer d’autres patients vulnérables, et de servir de réservoir pour sa propre réinfection future. Ce constat impose un changement de perspective: le succès thérapeutique ne peut plus être jugé uniquement sur la base de la résolution des signes cliniques. Il doit intégrer une stratégie de gestion à long terme du statut de porteur, axée sur l’hygiène, le contrôle rigoureux de la maladie sous-jacente pour renforcer la barrière cutanée, et une communication claire avec le propriétaire sur les risques persistants.
- Persistance après Traitement: L’un des constats les plus importants est que la guérison clinique d’une pyodermite à SPIRM n’entraîne pas nécessairement l’éradication de la bactérie de l’organisme. Une étude de suivi a montré que parmi les chiens initialement diagnostiqués avec une pyodermite à SPIRM, 45,2% étaient toujours porteurs de SPIRM sur leur peau et 47,6% sur leurs sites de portage muqueux (nez, rectum) après la résolution complète des signes cliniques.
- Source de Réinfection Endogène: Un animal colonisé devient son propre réservoir pour de futures infections. La bactérie réside sur les muqueuses et peut facilement être transférée à la peau lors du toilettage ou du léchage. Si la barrière cutanée de l’animal est à nouveau compromise (par exemple, lors d’une poussée allergique), la bactérie peut rapidement proliférer et provoquer une nouvelle infection.
- Source de Transmission Exogène: Les animaux porteurs asymptomatiques disséminent continuellement le SPIRM dans leur environnement (domicile, parcs, cliniques vétérinaires), contaminant les surfaces et agissant comme une source silencieuse de transmission à d’autres animaux et, potentiellement, aux humains.
- Acquisition Nosocomiale de la Colonisation: Le milieu clinique est un lieu à haut risque pour l’acquisition du statut de porteur. La même étude a révélé que parmi les chiens qui n’avaient pas de SPIRM au début du traitement de leur pyodermite (causée par une souche sensible), 28,3% sont devenus colonisés par le SPIRM sur leur peau après le traitement. Le taux de portage muqueux dans ce groupe a augmenté de manière significative, passant de 7,8% avant le traitement à 26,7% après. Cela suggère que l’environnement hospitalier et les procédures de traitement peuvent faciliter la transmission et la colonisation par des souches résistantes.
Approche de la Décolonisation
La question de savoir s’il faut activement tenter d’éliminer le statut de porteur (décolonisation) est complexe et controversée.
- Non-recommandation Générale: Pour la plupart des cas, la décolonisation active des animaux porteurs sains n’est pas recommandée.
- Justification:
- La colonisation par le SARM (S. aureus) chez les animaux de compagnie est souvent transitoire et s’élimine naturellement en quelques semaines, à condition que la source de ré-exposition (généralement humaine) soit contrôlée.
- L’utilisation d’antibiotiques systémiques pour tenter d’éradiquer le portage est non seulement inefficace (les antibiotiques n’atteignent pas des concentrations suffisantes sur les surfaces muqueuses), mais elle est également contre-productive car elle exerce une pression de sélection supplémentaire en faveur de la résistance.
- Bien que des thérapies topiques (shampoings antiseptiques, onguents nasaux) puissent réduire temporairement la charge bactérienne, leur efficacité à long terme pour une éradication complète du portage n’a pas été démontrée dans des études contrôlées.
À l’heure actuelle, il n’existe pas de consensus scientifique pour recommander une tentative de décolonisation systématique de ces animaux porteurs. Les protocoles étudiés ont montré une efficacité limitée et inconstante, avec un risque non négligeable de sélectionner des souches encore plus résistantes. L’approche privilégiée pour la gestion des animaux colonisés se concentre donc sur des mesures non antibiotiques: le renforcement de l’hygiène (bains antiseptiques réguliers pour réduire la charge cutanée), le contrôle strict de la maladie sous-jacente pour maintenir une barrière cutanée saine, et la mise en œuvre de mesures de contrôle de l’infection pour limiter la transmission.
Potentiel Zoonotique et Prévention de la Transmission
La présence de bactéries multirésistantes chez les animaux de compagnie, qui partagent notre environnement le plus intime, soulève des questions légitimes de santé publique. L’évaluation du risque zoonotique et la mise en œuvre de mesures de contrôle de l’infection sont des responsabilités partagées par les vétérinaires et les propriétaires d’animaux.
A. Évaluation du Risque Zoonotique
Il est crucial de différencier le risque associé aux différentes espèces de staphylocoques, car il n’est pas uniforme.
- Comparaison SPIRM vs SARM:
- S. aureus Résistant à la Méthicilline (SARM): Le risque zoonotique associé au SARM est bien établi et considéré comme significatif. Le SARM est un pathogène humain majeur, et les animaux de compagnie agissent le plus souvent comme des victimes collatérales de l’épidémie humaine, se faisant coloniser par des souches d’origine humaine (zoonose inverse). Une fois colonisés ou infectés, ils peuvent cependant devenir des réservoirs silencieux au sein du foyer, contribuant à la persistance du SARM dans la communauté et posant un risque de (ré)infection pour les humains. La transmission peut se faire dans les deux sens.
- S. pseudintermedius Résistant à la Méthicilline (SPIRM): Le risque zoonotique direct du SPIRM est considéré comme faible. S. pseudintermedius est une bactérie hautement adaptée à l’hôte canin et est mal équipée pour coloniser durablement ou causer des infections chez les humains en bonne santé. Cependant, ce risque, bien que faible, n’est pas nul. Des cas d’infections humaines à SPIRM ont été rapportés, généralement chez des personnes immunodéprimées ou en contact très étroit. Le risque principal du SPIRM pour la santé humaine pourrait être indirect: il peut agir comme un réservoir de gènes de résistance (comme le gène mecA) qui pourraient potentiellement être transférés à des pathogènes humains plus virulents comme S. aureus.
- Dynamique de Transmission Asymétrique:
- Pour le SARM (MRSA): Le réservoir principal est l’humain. Les animaux de compagnie sont le plus souvent des “victimes collatérales”. La voie de transmission prédominante est Homme → Animal.
- Pour le SPIRM (MRSP): Le réservoir principal et quasi exclusif est le chien. La transmission est principalement inter-canine. La transmission à l’homme, bien que possible, reste un événement rare (spillover zoonotique occasionnel).
- Preuves de Transmission:
- Transmission Animal-Homme: Plusieurs études ont utilisé le typage moléculaire pour prouver la transmission de souches de SPIRM identiques entre des chiens infectés et leurs propriétaires.
- Risque Professionnel pour le Personnel Vétérinaire: Le personnel vétérinaire constitue une population à risque de portage professionnel. Une étude menée lors d’une conférence de dermatologie vétérinaire a révélé un taux de portage nasal de SPIRM de 3,9% chez les participants.
B. Mesures de Contrôle de l’Infection (“Infection Control”)
La prévention de la transmission des SRM repose sur l’application rigoureuse de protocoles d’hygiène et de biosécurité, tant en milieu clinique qu’à domicile.
Recommandations pour les Cliniques Vétérinaires
Chaque clinique vétérinaire devrait mettre en place un programme formel de contrôle des infections. Les mesures fondamentales, basées sur les “Précautions Standard“, incluent :
- Hygiène des Mains: C’est la mesure la plus simple et la plus efficace pour prévenir la transmission croisée.
- Équipement de Protection Individuelle (EPI): Le port de gants est obligatoire pour manipuler tout animal présentant des lésions cutanées. Des blouses ou des tabliers de protection doivent être portés.
- Gestion des Patients: Les patients hospitalisés avec une infection à SRM confirmée ou suspectée doivent être placés en isolement. Pour les consultations externes, il est recommandé de programmer ces patients en fin de journée.
- Nettoyage et Désinfection de l’Environnement: Les surfaces à contact élevé et le matériel réutilisable doivent être méticuleusement nettoyés et désinfectés entre chaque patient.
Conseils pour les Propriétaires d’Animaux Infectés ou Colonisés
L’éducation des propriétaires est une composante essentielle. Les conseils doivent être clairs, pratiques et non alarmistes.
- Hygiène des Mains Rigoureuse: Les propriétaires doivent être instruits de se laver les mains systématiquement après avoir touché leur animal.
- Limitation des Contacts Étroits: Pendant la phase active de l’infection, il est prudent de limiter les contacts intimes (léchage du visage, dormir dans le lit).
- Protection des Personnes à Risque: Si des personnes immunodéprimées, de très jeunes enfants, des personnes âgées ou des personnes ayant des plaies cutanées vivent dans le foyer, des précautions supplémentaires sont nécessaires.
- Hygiène de l’Environnement Domestique: La literie de l’animal, ses jouets et ses gamelles doivent être lavés régulièrement à l’eau chaude et au savon.
Conclusion: Vers une Gestion Intégrée par l’Antibiogouvernance et l’Approche “One Health”
L’émergence des staphylocoques résistants à la méthicilline, et en particulier du SPIRM, en dermatologie vétérinaire, constitue bien plus qu’un simple défi thérapeutique. Elle représente une menace complexe qui met en lumière les failles de nos approches passées en matière d’utilisation des antimicrobiens et souligne l’interconnexion profonde entre la santé animale, la santé humaine et l’environnement. La gestion efficace de ce problème ne peut plus reposer sur la seule recherche d’un nouvel antibiotique “miracle”, mais exige une approche intégrée, holistique et durable, fondée sur les principes de l’antibiogouvernance et du concept “One Health”.
Synthèse de l’Importance
Les SRM ont transformé la pyodermite canine, une affection autrefois banale, en une maladie potentiellement chronique, difficile à traiter et coûteuse. L’importance du SPIRM ne réside pas dans une virulence accrue, mais dans sa capacité à échapper à nos thérapies de première ligne, entraînant des échecs thérapeutiques, une morbidité prolongée et un risque accru de transmission. La persistance de la colonisation après la guérison clinique crée des réservoirs silencieux qui perpétuent le cycle de l’infection et de la contamination. De plus, le potentiel zoonotique, bien que variable selon les espèces de staphylocoques, place la gestion de ces infections au carrefour de la médecine vétérinaire et de la santé publique.
Principes de l’Antibiogouvernance (“Antimicrobial Stewardship”)
La lutte contre la propagation de la résistance aux antimicrobiens passe inévitablement par une utilisation plus responsable et judicieuse des antibiotiques. L’antibiogouvernance est une approche coordonnée visant à promouvoir l’utilisation appropriée des antimicrobiens pour améliorer les résultats pour les patients, tout en minimisant les conséquences involontaires. En dermatologie vétérinaire, cela se traduit par des actions concrètes:
- Privilégier la thérapie topique: Élever la thérapie topique au rang de traitement de première intention pour toutes les pyodermites superficielles.
- Diagnostiquer avant de traiter: Utiliser systématiquement la cytologie pour confirmer l’infection et réserver l’antibiothérapie systémique aux cas où elle est absolument nécessaire.
- Traiter sur la base de preuves: Fonder le choix de tout antibiotique systémique sur les résultats d’un antibiogramme.
- Traiter la cause, pas seulement le symptôme: Identifier et gérer rigoureusement la maladie sous-jacente pour prévenir les récidives.
- Respecter les protocoles: Utiliser la bonne dose, la bonne durée et la bonne voie d’administration.
L’Impératif d’une Approche “One Health”
Le problème du SPIRM en dermatologie canine est un microcosme de la crise mondiale de l’antibiorésistance. Il illustre parfaitement pourquoi une approche cloisonnée est vouée à l’échec. La résistance aux antimicrobiens est un problème qui ne connaît pas de frontières entre les espèces ou les écosystèmes. L’utilisation d’antibiotiques chez un chien dans une clinique vétérinaire peut avoir des répercussions qui s’étendent à la santé des personnes dans son foyer. Une approche “One Health” efficace nécessite une collaboration active entre les médecins, les vétérinaires, et les responsables de la santé publique pour mettre en place une surveillance intégrée de la résistance, harmoniser les lignes directrices, éduquer le public et promouvoir la recherche.
Perspectives Futures
L’avenir de la gestion des SRM en dermatologie vétérinaire dépendra de notre capacité à intégrer pleinement ces principes dans la pratique quotidienne. Les axes de développement futurs incluent le renforcement de la surveillance épidémiologique, le développement et la validation de nouvelles stratégies thérapeutiques non antibiotiques, et l’amélioration continue de l’éducation. Les axes de recherche futurs doivent s’orienter vers plusieurs fronts complémentaires :
- Développement de thérapies alternatives: La recherche doit s’intensifier pour développer et valider des approches “post-antibiotiques“. Celles-ci incluent l’utilisation de bactériophages (virus tueurs de bactéries), de peptides antimicrobiens, d’extraits de plantes, d’enzymes lysant la paroi bactérienne (endolysines), ou de molécules ciblant les facteurs de virulence plutôt que la croissance bactérienne.
- Optimisation de l’antibiogouvernance: Des systèmes de surveillance épidémiologique robustes et continus sont nécessaires pour suivre en temps réel l’évolution des clones de SPIRM et de leurs profils de résistance à l’échelle locale et nationale.
- Compréhension de la transition commensal-pathogène: Une meilleure compréhension des facteurs qui déclenchent le passage de S. pseudintermedius d’un état de commensal inoffensif à celui d’un agent infectieux est une voie de recherche prometteuse pour prévenir l’incidence des infections.
Le défi est de taille, mais une approche proactive, collaborative et fondée sur la science peut nous permettre de préserver l’efficacité de nos antimicrobiens et de protéger la santé de nos patients animaux et de la communauté humaine dans son ensemble.
Références
- Frank, L. A., & Loeffler, A. (2012). Meticillin-resistant Staphylococcus pseudintermedius: clinical challenge and treatment options. Veterinary Dermatology, 23(4), 283-e56.
- van Duijkeren, E., Catry, B., Greko, C., Moreno, M. A., Pomba, C., Pyörälä, S., Ružauskas, M., Sanders, P., Threlfall, E. J., & Torren-Edo, J. (2011). Review on methicillin-resistant Staphylococcus pseudintermedius. Journal of Antimicrobial Chemotherapy, 66(12), 2705-2714.
- Morris, D. O., Boston, R. C., O’Shea, K., & Rankin, S. C. (2010). The prevalence of carriage of meticillin-resistant staphylococci by veterinary dermatology practice staff and their respective pets. Veterinary Dermatology, 21(4), 400-407.
- Cohn, L. A., & Middleton, J. R. (2010). A veterinary perspective on methicillin-resistant staphylococci. Journal of Veterinary Emergency and Critical Care, 20(1), 31-45.
- Duquette, R. A., & Nuttall, T. J. (2004). Methicillin-resistant Staphylococcus aureus in dogs and cats: an emerging problem? Journal of Small Animal Practice, 45(12), 591-597.
- Papich, M. G. (2023). Antimicrobial agents in small animal dermatology for treating staphylococcal infections. Journal of the American Veterinary Medical Association, 261(S1), S130-S139.
- Griffeth, G. C., Morris, D. O., Abraham, J. L., Shofer, F. S., & Rankin, S. C. (2008). Screening for skin carriage of methicillin-resistant coagulase-positive staphylococci and Staphylococcus schleiferi in dogs with healthy and inflamed skin. Veterinary Dermatology, 19(3), 142-149.
- Lilenbaum, W., et al. (2024). Nationwide analysis of methicillin-resistant staphylococci in cats and dogs: resistance patterns and geographic distribution. American Journal of Veterinary Research.
- Pomba, C., Rantala, M., Greko, C., Baptiste, K. E., Catry, B., van Duijkeren, E., Mateus, A., Moreno, M. A., Pyörälä, S., Ružauskas, M., & Torren-Edo, J. (2017). Public health risk of antimicrobial resistance transfer from companion animals. Journal of Antimicrobial Chemotherapy, 72(4), 957-968.
- Hillier, A., Lloyd, D. H., Weese, J. S., Blondeau, J. M., Cossens, C., Guardabassi, L., Papich, M. G., & Frank, L. (2014). Recommendations for approaches to meticillin-resistant staphylococcal infections of small animals: diagnosis, therapeutic considerations and preventative measures. Veterinary Dermatology, 25(3), e39-e53..
- Ngassam, C. T., et al. (2025). Mieux traiter les pyodermites nécessite de mieux les reconnaitre et de savoir détecter les résistances bactériennes aux antibiotiques. Le Nouveau Praticien Vétérinaire canine-féline.
- Gmyterco, V. C., Luciano, F. B., Ludwig, L. A., Evangelista, A. G., Ferreira, T. S., Borek, F., & de Farias, M. R. (2025). Comparative study of a commercial formula containing natural antimicrobials versus oral cephalexin or topical chlorhexidine-miconazole therapies for treating superficial pyoderma in dogs. Veterinary Dermatology.
- Perreten, V., Kadlec, K., Schwarz, S., Grönlund Andersson, U., Finn, M., Greko, C., Moodley, A., Kania, S. A., Frank, L. A., Bemis, D. A., Franco, A., Iurescia, M., Battisti, A., Duim, B., Wagenaar, J. A., van Duijkeren, E., Weese, J. S., & Guardabassi, L. (2010). Clonal spread of methicillin-resistant Staphylococcus pseudintermedius in Europe and North America: an international collaborative study. Journal of Antimicrobial Chemotherapy, 65(6), 1145-1154.
- Loeffler, A., & Lloyd, D. H. (2010). Companion animals: a reservoir for methicillin-resistant Staphylococcus aureus. Journal of Antimicrobial Chemotherapy, 65(4), 594-601.