Depuis la première publication de Wittich en 1941 relatant le traitement réussi d’une allergie chez un chien par ASIT (Immunothérapie Allergénique Spécifique), de nombreux progrès ont été réalisés. Si les études chez l’Homme sont nombreuses et documentent largement l’efficacité de l’ASIT dans diverses pathologies allergiques, notamment la rhinite allergique et l’asthme, les données concernant la DAC restent, paradoxalement, fragmentaires.
État des connaissances sur l’ASIT canine
Alors que chez l’Homme, certains remettent en question l’utilité de l’ASIT dans la dermatite atopique humaine, cette controverse n’a apparemment jamais émergé en médecine vétérinaire, probablement en raison de premiers rapports encourageants concernant la DAC. L’absence de controverse en médecine vétérinaire pourrait également être liée à des facteurs tels que le nombre limité d’études cliniques rigoureuses réalisées chez le chien, la complexité de l’évaluation de l’efficacité de l’ASIT dans le contexte de la DAC, et la variabilité des protocoles thérapeutiques utilisés entre les différentes études. Ces facteurs rendent difficiles la comparaison directe des résultats, limitant ainsi les conclusions globales sur l’efficacité de l’ASIT canine.
Des études, dont une étude en aveugle contrôlée par placebo portant sur 51 chiens, ont démontré des taux de réponse (généralement définis comme la proportion de chiens présentant une amélioration d’au moins 50 % des signes cliniques) de l’ordre de 60 à 70 %. Cependant, il est crucial de noter que, même dans les cas positifs, un pourcentage significatif de chiens (jusqu’à 65 % dans une étude) ont nécessité un traitement médicamenteux complémentaire, remettant en question la capacité des propriétaires à juger objectivement de l’efficacité de l’ASIT. Les directives actuelles pour le traitement de la DAC qualifient la qualité des preuves publiées concernant l’efficacité de l’ASIT de “limitée”. Cette limitation des preuves est due à plusieurs facteurs, y compris la taille restreinte de nombreuses études, le manque de standardisation des protocoles, et la difficulté d’obtenir des mesures objectives de l’efficacité de l’ASIT chez le chien. Il est important de souligner que l’évaluation de l’efficacité de l’ASIT repose souvent sur des évaluations subjectives des propriétaires, ce qui peut introduire un biais dans les résultats. Des méthodes d’évaluation plus objectives, telles que l’utilisation de biomarqueurs ou de scores cliniques validés, sont nécessaires pour améliorer la qualité des preuves disponibles.
L’interprétation des résultats des études sur l’ASIT canine est souvent compliquée par la variabilité des protocoles utilisés. Les différences en matière de dosage, de composition des extraits allergéniques, de fréquence des injections, de traitements concomitants, et de méthodes d’évaluation des résultats rendent difficile la comparaison directe des résultats obtenus dans les différentes études. L’hétérogénéité des populations de chiens incluses dans les études constitue un autre facteur de complexité. La variabilité des races, des âges, des sévérités de la DAC, et des antécédents médicaux des chiens peut influer sur la réponse à l’ASIT, rendant une analyse des résultats plus complexe. Pour améliorer l’interprétation des données, des études futures doivent se concentrer sur la standardisation des protocoles, l’homogénéité des populations étudiées et l’utilisation de mesures d’efficacité plus objectives.
Comparaison avec l’ASIT humaine: Bien que l’ASIT soit utilisée pour traiter diverses allergies chez l’homme, l’efficacité et les mécanismes d’action ne sont pas toujours totalement compris, et varient selon le type d’allergie et l’individu. Il existe une controverse concernant l’utilité de l’ASIT dans la dermatite atopique humaine, avec certaines études remettant en question son efficacité, tandis que d’autres montrent des résultats positifs. Cette nuance reflète la complexité des réponses immunitaires individuelles et l’hétérogénéité de la dermatite atopique. La comparaison avec l’ASIT humaine permet d’identifier des pistes de recherche pour l’ASIT canine, mais il est important de nuancer ces comparaisons du fait des différences physiologiques et immunologiques entre les espèces.
Mécanismes d’action : le connu et l’inconnu
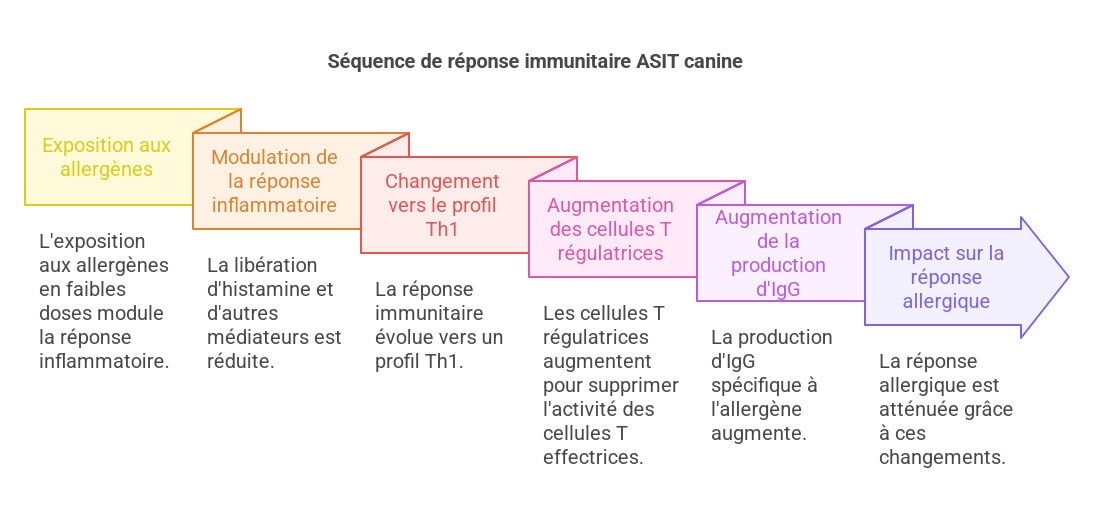
Le mode d’action précis de l’ASIT canine demeure encore incomplètement élucidé. Néanmoins, un parallèle avec les mécanismes humains est plausible. Chez l’Homme, on observe une réduction initiale de l’activité des cellules effectrices (éosinophiles, basophiles, mastocytes), suivie d’un changement immunologique à long terme, passant d’une réponse des cellules Th2 (helper 2) à une réponse des cellules Th1 (helper 1) et au développement d’une tolérance immunologique. Ce processus complexe et multifactoriel fait intervenir différentes étapes et populations cellulaires.
- Phase initiale: L’exposition aux allergènes en faibles doses provoque une modulation de la réponse inflammatoire immédiate. Cela se traduit par une réduction de la libération d’histamine et d’autres médiateurs de l’inflammation par les mastocytes et les basophiles, ce qui diminue les symptômes immédiats de l’allergie. La dégranulation des mastocytes, processus clé dans la réponse allergique immédiate, est inhibée ou atténuée.
- Phase tardive: La réponse immunitaire se déplace progressivement vers un profil Th1, avec une augmentation des lymphocytes T helper 1 qui produisent des cytokines pro-inflammatoires comme l’interféron-gamma (IFN-γ) et une diminution des lymphocytes T helper 2 et des cytokines associées (IL-4, IL-5, IL-13). Ce basculement Th1/Th2 participe à la régulation de la réponse inflammatoire à long terme.
- Rôle des cellules T régulatrices (Treg): Les cellules Treg, avec des marqueurs comme FOXP3, jouent un rôle crucial dans la tolérance immunitaire acquise par l’ASIT. Ces cellules suppriment l’activité des lymphocytes T effecteurs, contribuant à l’apaisement de la réaction inflammatoire allergique. L’augmentation du nombre et de l’activité des cellules Treg est corrélée à une meilleure réponse à l’ASIT.
- Production d’IgG: La production d’immunoglobulines G (IgG), notamment IgG4, spécifiques à l’allergène augmente après un traitement prolongé. Ces anticorps IgG bloquants pourraient réduire la liaison des IgE aux allergènes, diminuant ainsi leur capacité à déclencher une réponse inflammatoire. Les études restent cependant incertaines quant à l’impact réel des IgG sur la réduction de la réponse allergique.
Ces changements s’accompagnent d’une augmentation de cytokines telles que le facteur de croissance transformant bêta (TGFβ) et l’interleukine (IL)-10, des cytokines anti-inflammatoires jouant un rôle dans le maintien de la tolérance immunitaire. Il en résulte une augmentation des immunoglobulines (IgG) spécifiques à l’allergène, notamment IgG4, et, avec un traitement prolongé, une diminution des IgE spécifiques à l’allergène. Chez le chien, bien que les connaissances soient moins étendues, un basculement vers une réponse Th1, une augmentation des taux d’IgG, l’apparition de plus de cellules Treg et des augmentations des niveaux d’IL-10 ont toutes été démontrées, établissant ainsi des parallèles avec l’ASIT humaine. Cependant, les études chez le chien sont moins nombreuses et moins approfondies que chez l’homme, l’exploration des mécanismes d’action de l’ASIT canine nécessitant des recherches supplémentaires pour une compréhension plus complète. L’utilisation de modèles animaux (souris, par exemple) peut permettre d’élucider certains mécanismes, mais l’extrapolation à l’espèce canine doit se faire avec prudence.
L’administration sublinguale implique un effet supplémentaire par les cellules dendritiques oromucosales. Chez l’homme, ces cellules jouent un rôle important dans l’induction de la tolérance orale, un processus immunologique par lequel le système immunitaire est programmé pour ne pas réagir aux substances introduites dans la bouche (par exemple, les aliments). Le rôle précis de ces cellules dans l’ASIT canine reste encore à explorer.
Approches actuelles de l’ASIT canine : efficacité et axes d’amélioration
Les approches actuelles de l’ASIT pour la DAC reposent sur deux voies d’administration principales : sous-cutanée (SCIT) et sublinguale (SLIT). La SCIT, pratiquée depuis des décennies, utilise des extraits allergéniques aqueux conservés au phénol en Amérique du Nord et des extraits allergéniques précipités à l’alun en Europe. L’utilisation d’adjuvants à base d’aluminium, malgré l’avantage d’injections moins fréquentes, soulève des préoccupations croissantes quant à ses potentiels effets indésirables à long terme, liés à une exposition chronique à l’aluminium. Des études approfondies sur la toxicité à long terme de l’aluminium sont nécessaires pour évaluer pleinement les implications de son utilisation dans les vaccins et les traitements allergiques. Des alternatives aux adjuvants à base d’aluminium sont actuellement étudiées, notamment des adjuvants plus biocompatibles et moins toxiques.
La SLIT, plus répandue chez l’humain, est apparue plus récemment en médecine vétérinaire et fait l’objet de controverses chez l’Homme quant à la fiabilité de nombreuses études anciennes avec des protocoles très variables. Des analyses et prises de position récentes de l’Organisation mondiale de l’allergie concluent à son efficacité et à un profil de sécurité favorable par rapport à la SCIT. Cependant, les données sur la SLIT canine sont encore limitées et nécessitent des études supplémentaires pour valider son efficacité et sa sécurité dans cette espèce. Les études menées chez l’homme suggèrent que la SLIT pourrait être une approche plus pratique et plus sûre que la SCIT. Cependant, la variabilité des protocoles utilisés dans les études humaines rend difficile la détermination de protocoles optimaux pour la SLIT canine, nécessitant des études futures pour la validation de son utilisation chez le chien. De même, des études comparatives entre la SCIT et la SLIT dans la DAC sont essentielles pour évaluer leur efficacité relative et les bénéfices et inconvénients de chacune des méthodes.
Des considérations importantes quant à la qualité des extraits utilisés affectent l’efficacité. Les extraits d’allergènes pour usage vétérinaire ont reçu une licence du Département de l’Agriculture des États-Unis (USDA) il y a des décennies, en se basant sur des critères de sécurité, de pureté, de stérilité et de cohérence de fabrication, et non sur des études rigoureuses d’efficacité à long terme. Cette situation souligne le besoin de nouvelles réglementations et de normes plus strictes pour garantir la qualité et l’efficacité des extraits allergéniques utilisés en médecine vétérinaire.
La littérature scientifique concernant l’ASIT canine souffre d’un manque de standardisation des protocoles, avec une grande variabilité des régimes posologiques, des extraits allergéniques, de leur composition et de leur puissance entre les fabricants, des programmes d’administration, des traitements concomitants et des méthodes de mélange des extraits. Ce manque de standardisation limite la comparabilité des études et l’interprétation des résultats. L’absence de protocoles standardisés rend difficile l’évaluation de l’efficacité réelle de l’ASIT et la détermination des paramètres optimaux pour le traitement de la DAC.
Détails sur les différentes approches:
- SCIT (Sous-cutanée): L’allergène est injecté sous la peau. Plusieurs approches existent, avec une augmentation progressive des doses (induction) et un schéma de maintenance à long terme. Les extraits peuvent être aqueux (Amérique du Nord) ou précipités à l’alun (Europe) pour une libération plus lente. L’utilisation de l’alun pose des questions sur la toxicité à long terme de l’aluminium, nécessitant des études et une évaluation du risque bénéfice.
- SLIT (Sublinguale): L’allergène est administré sous la langue, une approche moins invasive potentiellement meilleure pour l’observance du propriétaire. Des études plus nombreuses et une meilleure standardisation sont cependant nécessaires à son étalonnage en clinique vétérinaire.
- RIT (Immunothérapie accélérée): Administration rapide de doses croissantes d’allergène sur une courte durée, nécessitant une surveillance étroite. Des risques accrus d’effets indésirables existent, mais elle peut être plus pratique pour certains chiens.
Amélioration de la standardisation de l’ASIT canine
L’établissement des principaux épitopes allergéniques chez le chien, notamment pour les allergènes courants, permettrait une standardisation des extraits, une posologie uniforme, la production d’allergènes recombinants et l’utilisation de la peptide-immunothérapie. L’identification des épitopes allergéniques majeurs chez le chien permet de créer des extraits plus spécifiques et plus purifiés. Ces extraits standardisés permettent une meilleure reproductibilité des résultats entre les différentes études, améliorant ainsi la fiabilité des données. De plus, la connaissance des épitopes permet le développement d’allergènes recombinants, synthétisés en laboratoire, ce qui permet d’obtenir des préparations d’allergènes plus pures et homogènes.
La posologie de l’allergène est fondamentale. Chez l’Homme, la dose et l’intervalle d’injection affectent l’efficacité. Ces paramètres n’ont pas été suffisamment étudiés chez le chien. Des études dose-réponse sont cruciales pour déterminer la dose optimale d’allergène qui maximise l’efficacité tout en minimisant les effets indésirables. L’identification de biomarqueurs prédictifs de la réponse à l’ASIT pourrait également permettre de personnaliser le traitement en fonction de la réponse individuelle du chien.
De même, l’immunothérapie accélérée (RIT) présente des avantages en termes de nombre d’injections à domicile, mais aussi des risques de sécurité accrue et un coût plus élevé en raison de l’hospitalisation nécessaire. L’immunothérapie accélérée (RIT) est une approche qui permet d’administrer les doses d’allergène plus rapidement. Cela peut réduire la durée du traitement et améliorer l’observance du propriétaire, mais augmente le risque d’effets indésirables. Pour optimiser l’utilisation de la RIT, il faut notamment mieux documenter la sécurité et l’efficacité de cette méthode, et éventuellement concevoir des protocoles moins intensifs afin de réduire les risques tout en préservant l’efficacité. Des études comparant la RIT avec l’immunothérapie conventionnelle sont nécessaires.
Optimisation des protocoles d’ASIT canine
L’homogénéisation des protocoles d’ASIT canine représente un défi majeur. Le nombre optimal d’extraits dans un mélange reste à définir, de même que la manière de gérer les extraits contenant des protéases, comme les moisissures. La standardisation des protocoles nécessite une approche multifactorielle. Il est nécessaire de définir les paramètres optimaux de traitement, notamment :
- Nombre et type d’allergènes: Déterminer le nombre d’allergènes à inclure dans le mélange. Des études suggèrent qu’un seul allergène dominant peut être suffisant, même en cas de polysensiibilisation, bien que cette approche soit moins courante en Amérique du Nord qu’en Europe.
- Gestion des protéases: Les moisissures contiennent des protéases qui peuvent dégrader d’autres allergènes. Cela peut compromettre l’efficacité du mélange d’allergènes. La gestion de ce problème nécessite une étude supplémentaire.
- Méthodes de sélection des allergènes: Utiliser les tests intradermiques, les tests sérologiques, ou une combinaison des deux. Les limites de chaque méthode doivent être prises en compte. Des recherches additionnelles sont nécessaires pour déterminer la méthode optimale de sélection des allergènes pour l’ASIT canine.
- Formulation du mélange d’allergènes: Plus d’études sont nécessaires pour déterminer la meilleure approche, ce qui permettra une amélioration de la reproductibilité des études.
Des directives officielles recommandent de ne pas mélanger les extraits de moisissures et de pollens dans le même flacon en raison de la dégradation des allergènes polliniques par les protéases fongiques pendant le stockage. Des données similaires, mais moins concluantes, existent pour le chien. Ces recommandations soulignent le besoin de mieux comprendre les interactions entre les différents allergènes dans le mélange. Il est important de tenir compte des potentielles dégradations enzymatiques au niveau des différents composants du mélange et ainsi de déterminer la formulation optimale afin de garantir une efficacité à long terme.
Biomarqueurs de succès thérapeutique et nouvelles approches
L’utilisation de biomarqueurs pour l’évaluation objective du succès de l’ASIT canine est essentielle pour améliorer les études cliniques, pallier le manque de données reproductibles et surmonter l’effet placebo important. Bien que des augmentations des concentrations sériques totales d’IgG1, des réponses spécifiques en IgG à l’immunothérapie aux acariens des poussières de maison, et des modifications de différents niveaux de cellules Treg aient été observées chez le chien, ces découvertes n’ont pas été suffisamment approfondies de manière à servir de moyen d’évaluation objective et rapide du succès de l’ASIT. L’identification de biomarqueurs fiables permettrait une meilleure évaluation de l’efficacité du traitement et une meilleure prédiction de la réponse individuelle à l’ASIT.
Les biomarqueurs potentiels à explorer incluent :
- Concentrations sériques d’IgG (surtout IgG4): L’augmentation des IgG spécifiques à l’allergène pourrait correspondre à une amélioration clinique. La mesure des IgG4 est particulièrement prometteuse, car cette sous-classe d’IgG est particulièrement liée à l’induction de tolérance.
- Cellules T régulatrices (Treg): Le nombre et l’activité de cellules Treg sont des indicateurs clés de la tolérance immunitaire. La mesure des Treg circulantes ou dans les tissus pourrait être utile pour monitorer la réponse à l’ASIT.
- Cytokines anti-inflammatoires (IL-10, TGF-β): L’augmentation de ces cytokines pourrait indiquer une diminution de l’inflammation allergique.
- Activité des cellules effectrices (éosinophiles, basophiles, mastocytes): Diminution de l’activité pourrait être corrélée à une meilleure réponse clinique.
- Mesures objectives du prurit: Par exemple, l’utilisation d’accéléromètres pour quantifier l’activité de grattage.
L’utilisation de biomarqueurs combinés pourrait fournir une image plus complète de la réponse à l’ASIT, améliorant ainsi l’interprétation des résultats des études cliniques.
Nouvelles approches thérapeutiques
Le développement de préparations allergéniques modifiées (allergoïdes, allergènes recombinants ou peptides) et l’amélioration de l’efficacité des allergènes via des adjuvants (inducteurs d’IL-10, encapsulation dans des particules de type viral (VLPs) ou dans les cas de SLIT, des polymères mucoadhésifs) représentent des axes de progrès prometteurs. Ces préparations modifiées présentent plusieurs avantages :
- Allergoïdes: Allergenes modifiés chimiquement pour réduire leur capacité à déclencher une réaction allergique immédiate, tout en conservant leur capacité immunogène. Cela réduirait les risques d’effets indésirables.
- Allergenes recombinants: Allergenes produits en laboratoire, offrant une pureté et une homogénéité supérieures aux extraits naturels.
- Peptides allergéniques: Petits fragments d’allergènes contenant des épitopes spécifiques aux lymphocytes T, minimisant les risques d’anaphylaxie.
L’ajout d’immunomodulateurs (CpG oligodeoxynucléotides, anticorps monoclonaux spécifiques) pourrait orienter la réponse immunitaire vers une tolérance spécifique tout en modérant le “cytokine storm” dans l’inflammation active. Ces immunomodulateurs permettent de manipuler la réponse immunitaire, en favorisant les réponses anti-inflammatoires et la tolérance immunitaire. Les CpG ODN stimulent l’immunité innée en activant les cellules dendritiques et les cellules NK, et les anticorps monoclonaux peuvent cibler des cytokines pro-inflammatoires spécifiques.
Des études conduites sur les voies alternatives d’administration (immunothérapie épicutanée ou intralymphatique) s’avèrent prometteuses. L’immunothérapie épicutanée appliquée par voie topique sur la peau pourrait induire une tolérance locale et systémique aux allergènes. L’immunothérapie intralymphatique, consistant à injecter l’allergène directement dans les ganglions lymphatiques, pourrait optimiser le contact avec les cellules immunitaires impliquées dans le développement de la tolérance. Bien qu’existent des études sur l’immunothérapie intralymphatique chez le chien, des recherches complémentaires sont nécessaires pour préciser les protocoles optimaux et évaluer à long terme son efficacité et sa sécurité. De plus, l’immunothérapie intralymphatique pourrait être moins contraignante pour le propriétaire par comparaison avec l’immunothérapie sous-cutanée classique, ce qui améliorerait l’observance thérapeutique.
Par ailleurs, les progrès réalisés en immunothérapie pour les allergies alimentaires humaines, notamment l’utilisation du diagnostic moléculaire et des méthodes d’administration alternatives, pourraient inspirer des approches innovantes pour la DAC. L’optimisation du diagnostic des allergies alimentaires chez le chien est une avenue de recherche importante. Des méthodes de diagnostics moléculaires plus précises pourraient identifier les allergènes alimentaires spécifiques responsables des réactions. De nouvelles méthodes d’administration, comme les traitements oraux, pourraient améliorer la tolérance des chiens aux protéines allergènes. Les avancées réalisées chez l’homme pourraient être source d’inspiration pour adapter ces approches dans le contexte de la DAC.
ASIT face aux nouveaux traitements
Enfin, il est important de rappeler que, face à l’efficacité de nouveaux traitements tels que la ciclosporine, l’oclacitinib ou les anticorps monoclonaux anti-IL-31, la place de l’ASIT dans le traitement multimodal des allergies canines nécessite une réflexion constante. Néanmoins, l’ASIT reste la seule thérapie capable de modifier ou d’inverser au moins une partie de la pathogenèse et d’offrir la perspective d’une guérison définitive. Il est donc essentiel que l’ASIT soit considérée, non comme un traitement de dernier recours, mais comme une option thérapeutique envisageable en première intention. L’ASIT peut être une option thérapeutique de choix en première intention, notamment chez les chiens qui ne répondent pas bien aux traitements médicamenteux conventionnels, ou chez ceux qui présentent des effets indésirables à ces médicaments. La combinaison de l’ASIT avec d’autres traitements peut améliorer l’efficacité globale du traitement de la DAC. Il est important de tenir compte du profil de sécurité et de l’efficacité relative des différents traitements disponibles.
Comparaison avec des traitements alternatifs: La ciclosporine, l’oclacitinib et les anticorps monoclonaux anti-IL-31 sont des traitements efficaces pour soulager les symptômes de la DAC, mais ils ne modifient pas la pathogenèse de la maladie et leur administration à long terme est nécessaire. L’ASIT, quant à elle, cible la cause profonde de l’allergie, en modifiant la réponse immunitaire du chien. Bien que l’ASIT puisse prendre du temps pour produire un effet, elle offre une perspective de guérison complète, en opposition aux traitements symptomatiques. L’utilisation combinée d’ASIT et de traitements symptomatiques est une approche possible.
Conclusion et perspectives
En conclusion, bien que l’ASIT soit une option thérapeutique prometteuse pour la dermatite atopique canine, son efficacité reste à démontrer formellement par des études cliniques rigoureuses et mieux standardisées. Les mécanismes d’action restent énigmatiques et des voies d’investigation complémentaires sont nécessaires. Des études plus nombreuses et plus rigoureuses sont essentielles pour combler les lacunes actuelles dans les connaissances. Il faut notamment mieux comprendre les mécanismes d’action, déterminer les paramètres optimaux de traitement, et identifier des biomarqueurs fiables pour évaluer l’efficacité et prédire la réponse.
Les études futures doivent se concentrer sur :
- Identification précise des allergènes canins: Développement de tests diagnostiques plus précis et standardisés afin d’identifier les allergènes impliqués.
- Optimisation des protocoles d’administration: Standardisation des protocoles et comparaison des différentes méthodes d’administration (SCIT, SLIT, RIT, ILIT). Des études comparatives rigoureuses sont nécessaires.
- Identification de biomarqueurs prédictifs du succès thérapeutique: Déterminer les marqueurs permettant de prédire la réponse au traitement avant son administration. Cela permettra de personnaliser le traitement.
- Exploration des préparations allergéniques modifiées: Tester les allergènes recombinants, les peptides et les allergoïdes. Ces formulations plus pures pourraient améliorer la sécurité et l’efficacité.
- Stratégies immunomodulatrices: Tester l’utilisation des immunomodulateurs pour influencer la réponse immunitaire et optimiser la tolérance.
- Études à long terme: Évaluer les effets à long terme des différents protocoles, afin de mieux comprendre la durabilité de l’efficacité du traitement.
L’ASIT pourrait ainsi devenir un traitement de première ligne dans la prise en charge de la DAC , au lieu de demeurer cantonnée à une option de second rang. L’amélioration des protocoles, la standardisation, et le développement de nouveaux outils diagnostiques et thérapeutiques permettront de faire de l’ASIT un outil de choix dans le traitement de la dermatite atopique canine.
FAQs
Q1 : Quelles sont les limites des tests intradermiques et sérologiques pour le diagnostic de la DAC ?
Les tests intradermiques (IDT) et les tests sérologiques pour la détermination des IgE spécifiques à l’allergène (ASIS) ont des limitations. Les IDT ne mesurent pas la sensibilité de tous les chemins allergiques et les réactions faussement positives chez les chiens non allergiques sont décrites. Les fausses réactions positives sont plus nombreuses pour des concentrations plus élevées, et les résultats positifs peuvent être liés à une sensibilité non spécifique des IgE (réactions croisées avec d’autres allergènes). Les ASIS ne mesurent que les IgE circulantes spécifiques à l’allergène ne tiennent pas compte d’autres voies allergiques, et des réactions faussement positives ont aussi été observées. De plus, les deux tests manquent de standardisation et des résultats faux positifs et faux négatifs sont possibles. La sensibilité peut varier d’un laboratoire à un autre.
Il est estimé qu’entre 10 et 30 % de chiens atteints de DAC cliniquement confirmée peuvent présenter un IDT négatif, en raison de facteurs divers tels que la technique, la concentration d’allergènes, les interférences médicamenteuses, les facteurs intrinsèques de l’hôte ou un choix inexact des allergènes. Les limites des tests intradermiques incluent également la nécessité d’une préparation spécifique du chien (tonte, etc.), le risque de réactions locales, et la subjectivité de l’interprétation des résultats. Les tests sérologiques (ASIS) évitent ces inconvénients, mais présentent des limites en termes de sensibilité et de spécificité; des réactions positives peuvent être observées chez les chiens non allergiques.
Au final ces tests allergologiques n’ont d’intérêt que dans la détermination des allergènes à inclure dans la désensibilisation en aucun cas pour le diagnostic de la dermatite atopique canine.
Q2 : Comment choisir les allergènes pour un protocole d’ASIT ?
Le choix des allergènes pour un protocole d’ASIT doit se baser sur les antécédents cliniques de l’animal, en association avec les réactions positives aux tests intradermiques ou sérologiques. Il ne faut toutefois pas se fier uniquement aux tests, car des réactions positives peuvent être observées chez des chiens sains, les réactions ne reflétant pas forcément une hypersensitivité clinique. Une interprétation attentive de l’histoire clinique et corrélation avec les résultats des tests permet d’identifier les allergènes pertinents pour l’établissement du protocole thérapeutique. Des tests de provocation pourraient être envisagés dans certains cas.
Q3 : Quels sont les avantages et les inconvénients de l’immunothérapie accélérée (RIT) ?
L’immunothérapie accélérée (RIT) réduit la durée d’induction comparativement à l’immunothérapie conventionnelle. Chez le chien, la RIT est bien tolérée, les effets indésirables majeurs étant rares, et elle est surtout associée au prurit. Cependant, elle nécessite une surveillance clinique hospitalière, et ce type d’approche comporte des risques de sécurité plus importants, en plus d’un coût accru. La RIT peut être envisagée chez les chiens où le risque d’anaphylaxie est faible, permettant de gagner du temps si la tolérance est bonne. L’optimisation des protocoles nécessitera une évaluation plus approfondie pour identifier les paramètres de sécurité optimaux et éviter les réactions indésirables. La comparaison entre RIT classique est nécessaire.
Q4 : Quelles sont les nouvelles pistes de recherche concernant l’ASIT canine ?
Plusieurs axes de recherche méritent d’être explorés : l’utilisation de préparations allergéniques modifiées (allergoïdes, allergènes recombinants, peptides), le développement de nouveaux adjuvants pour améliorer l’efficacité et la sécurité du traitement, l’identification de biomarqueurs de succès thérapeutique et la standardisation des protocoles. L’exploration de techniques d’administration innovantes, comme l’immunothérapie intralymphatique, épicutanée, ou l’administration orale est également prometteuse. La recherche sur l’ASIT canine est un domaine en développement constant, et de nouvelles pistes de recherche sont toujours explorées. Un effort de standardisation pour améliorer la fiabilité des études est primordial.
Q5 : Existe-t-il des interactions médicamenteuses à prendre en considération avant de réaliser des tests cutanés ?
L’administration de médicaments peut influencer les résultats des IDT. Certains médicaments, comme les antihistaminiques, les glucocorticoïdes, la ciclosporine, et les antidépresseurs tricycliques peuvent interférer avec les IDT. Un délai d’arrêt de certains médicaments peut être nécessaire avant de réaliser un IDT. Les interactions médicamenteuses potentielles doivent être prises en compte avant le début du traitement. L’effet des médicaments doit être considéré avant la réalisation des tests. Une discussion avec le vétérinaire est essentielle pour déterminer l’arrêt potentiel de quelques médicaments avant la réalisation des tests. Il faut tenir compte d’une interaction potentielle avec le médicament utilisé dans le traitement de la maladie.
Références
Hensel P, Santoro D, Favrot C, Hill P, Griffin C. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. BMC Veterinary Research 2015; 11:196. DOI: 10.1186/s12917-015-0515-5.
Mueller RS. Update on Allergen Immunotherapy. Vet Clin Small Anim 2019; 49: 1–7. DOI: 10.1016/j.cvsm.2018.08.001.
DeBoer DJ. The future of immunotherapy for canine atopic dermatitis: a review. Vet Dermatol 2017; 28: 25–66. DOI: 10.1111/vde.12416.
Pinto MSN, Gil SJRC, Ramió-Lluch L, et al. Challenging the norm: Epicutaneous immunotherapy for canine atopic dermatitis. Allergy 2023; 78: 255–257. DOI: 10.1111/all.15946.
Recherches Connexes
traitement dermatite atopique chien, dermatite atopique, dermatite, chiens, atopique chez le chien, chez le chien, dermatite atopique chez, maladie génétique, dermatite atopique canine, animal, traitement, maladie, peau, allergie, quelque chose, barrière cutanée, démangeaisons, lésions, chat, test, acariens, chez un chien, désensibilisation, pollens, prurit, acides gras essentiels, durée, vaccin, vie, schéma, allergènes, moisissures, renforcer la barrière cutanée, dac, dermite, effets secondaires, acides gras, atopique, propriétaire, maladies, symptômes, prise en charge, substances, humains, système immunitaire, puces, golden retriever, causes, but, règle, âge, jack russel terrier, piqûres, races, santé, pathologie, charge, allergologie, effet, inflammation, barrière, micro organismes, forme, shar peï, rougeurs, cas, origine, fonction, piqûres de puces, poussées, prédisposition, phase, compagnon