Les dermatoses virales cutanées demeurent souvent sous-diagnostiquées chez le chat, non seulement en raison de leur relative rareté mais également du fait de la complexité inhérente à l’identification précise de l’agent causal.
Introduction
Parmi ces affections, l’infection par l’herpès virus félin de type 1 (FHV-1) occupe une place prépondérante en dermatologie féline. Si cette infection est principalement connue pour ses manifestations respiratoires et oculaires dans le cadre du syndrome coryza, ses expressions dermatologiques méritent une attention toute particulière. La présente revue se propose d’analyser en profondeur les aspects cutanés de l’infection à FHV-1, en intégrant les dernières avancées tant sur le plan diagnostique que thérapeutique.
Étiologie et Caractéristiques Virologiques
L’herpès virus félin de type 1 appartient au genre Varicellovirus de la sous-famille des Alphaherpesvirinae. Cette classification le rapproche phylogénétiquement de l’herpès virus canin de type 1, avec lequel il partage de nombreuses caractéristiques biologiques et structurales. Le virion se distingue par une architecture complexe comprenant un ADN double brin protégé par une capside icosaédrique, elle-même enveloppée d’une bicouche glycoprotéique-lipidique. Cette structure sophistiquée confère au virus des propriétés biologiques particulières, notamment une relative fragilité dans l’environnement extérieur, sa survie se limitant à environ 18 heures en milieu humide et s’avérant encore plus réduite en conditions sèches.
Cette sensibilité aux facteurs environnementaux et aux désinfectants usuels s’explique principalement par la présence de l’enveloppe lipidique, qui rend le virus particulièrement vulnérable aux agressions physico-chimiques. Cette caractéristique, si elle facilite la décontamination environnementale, souligne également l’importance de la transmission directe dans la propagation du virus au sein des populations félines.
Pathogénie et Mécanismes de l’Infection
La pathogénie de l’infection herpétique cutanée s’inscrit dans un processus complexe impliquant plusieurs phases distinctes. La contamination initiale survient classiquement par voie respiratoire ou oculaire, le virus démontrant un tropisme marqué pour les épithéliums muqueux et cutanés. Cette affinité tissulaire explique la localisation préférentielle des lésions au niveau des jonctions cutanéo-muqueuses.
Une caractéristique fondamentale du FHV-1, commune à tous les alphaherpès virus, réside dans sa capacité à établir une latence dans le ganglion trigéminé après l’infection primaire. Cette propriété crée un réservoir viral permanent, source potentielle de réactivations ultérieures. La réactivation virale, élément clé dans la pathogénie des manifestations cliniques, peut survenir spontanément mais elle est le plus souvent déclenchée par divers facteurs de stress environnementaux ou physiologiques.
Parmi ces facteurs déclenchants, on retrouve particulièrement les modifications environnementales comme le déménagement ou l’introduction dans un foyer multi-chat, les situations physiologiques stressantes telles que la gestation, et les interventions médicales notamment la chirurgie ou l’administration de glucocorticoïdes. L’identification de ces facteurs revêt une importance capitale dans la mise en place d’une stratégie thérapeutique et préventive efficace.
Expression Clinique de la Maladie
Manifestations Cutanées Primaires
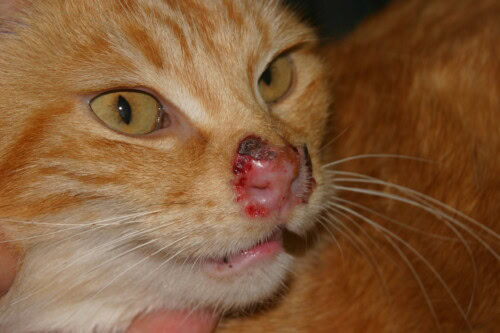
Les manifestations dermatologiques de l’infection à FHV-1 se caractérisent principalement par une dermatite ulcérative localisée préférentiellement au niveau des jonctions cutanéo-muqueuses nasales et ophtalmiques. Cette atteinte cutanée peut faire suite à une infection respiratoire supérieure ou survenir concomitamment à une conjonctivite ou une kératite herpétique.
L’évolution des lésions suit une séquence caractéristique débutant par l’apparition de vésicules qui progressent rapidement vers des ulcères. Ces ulcérations présentent la particularité d’être généralement non douloureuses et se recouvrent progressivement de croûtes. Le processus cicatriciel peut aboutir à la formation de zones d’alopécie résiduelle. Dans certains cas, les lésions peuvent s’étendre au-delà des zones péri-orificielles classiques pour atteindre les muqueuses buccales, les extrémités podales ou même l’abdomen.
Photo 1 : Herpèsvirose féline surinfectée
Manifestations Systémiques et Respiratoires
Le tableau clinique s’accompagne fréquemment de manifestations systémiques incluant un abattement marqué, une hyperthermie et une anorexie. L’atteinte respiratoire se traduit classiquement par des éternuements marqués et un jetage initialement séreux évoluant vers un aspect mucopurulent. La conjonctivite, souvent bilatérale, constitue également un signe cardinal de l’infection.
Formes Cliniques Particulières
Érythème Multiforme Associé à l’Herpès
Une forme particulière d’érythème multiforme associé à l’infection par le FHV-1 a été documentée dans la littérature scientifique. Cette manifestation, considérée comme une réaction immunitaire spécifique, se caractérise par des lésions annulaires ou polycycliques présentant une distribution symétrique sur la face. L’identification de cette forme clinique particulière nécessite une approche diagnostique spécifique et une prise en charge thérapeutique adaptée.
Infections Chroniques et Récidivantes
La chronicité potentielle de l’infection et le risque de récidives constituent des aspects majeurs de la maladie. Les épisodes de réactivation peuvent être plus ou moins sévères et fréquents selon les individus et les facteurs environnementaux. La compréhension de cette dynamique d’infection est essentielle pour établir une stratégie thérapeutique à long terme.
Approche Diagnostique
Démarche Clinique
Le diagnostic de l’herpès virose cutanée féline repose sur une démarche méthodique associant l’analyse des éléments cliniques et épidémiologiques aux résultats des examens complémentaires. Une anamnèse détaillée, recherchant notamment les facteurs de stress récents et les antécédents médicaux, constitue la première étape de cette démarche. L’examen clinique doit être minutieux et systématique, portant une attention particulière aux systèmes respiratoire et oculaire ainsi qu’à la caractérisation précise des lésions cutanées.
Examens Complémentaires
Histopathologie
L’examen histopathologique des lésions constitue un pilier du diagnostic. Les biopsies cutanées révèlent typiquement une dermatite vésiculaire et nécrotisante caractérisée par une hyperplasie épidermique associée à des zones de nécrose. L’infiltrat inflammatoire présente une composition mixte avec une prédominance d’éosinophiles. La découverte de corps d’inclusion intranucléaires basophiles dans l’épithélium de surface et annexiel représente un élément diagnostique majeur, bien que non pathognomonique.
Techniques Moléculaires et Immunologiques
Les progrès récents dans le domaine du diagnostic moléculaire ont permis le développement de techniques plus spécifiques et sensibles. La PCR réalisée sur tissu non fixé offre une excellente sensibilité pour la détection du génome viral. Les analyses immunohistochimiques permettent de mettre en évidence la présence d’antigènes viraux dans les tissus lésionnels. L’hybridation in situ RNA (RNA-ISH) constitue une nouvelle approche prometteuse pour la détection du virus dans les tissus.
Il est important de noter que la recherche d’anticorps sériques présente peu d’intérêt diagnostique en raison de l’interférence possible avec les anticorps vaccinaux et ceux issus d’infections naturelles antérieures.
Stratégie Thérapeutique
Famciclovir
Le famciclovir représente actuellement l’antiviral de référence dans le traitement de l’infection à FHV-1. Son administration à la posologie de 40 à 90 mg/kg deux à trois fois par jour s’est révélée efficace dans le contrôle des manifestations cliniques. La durée du traitement doit être adaptée à l’évolution clinique et peut s’étendre sur plusieurs semaines. Une surveillance de la fonction rénale s’impose durant le traitement en raison du potentiel néphrotoxique de la molécule.
Autres Options
D’autres molécules peuvent être envisagées dans la stratégie thérapeutique. L’azithromycine, administrée à la dose de 10 mg/kg une fois par jour pendant 10 jours, a montré une certaine efficacité. Les traitements topiques, notamment l’aciclovir en application quotidienne ou l’imiquimod utilisé deux à trois jours consécutifs par semaine, peuvent compléter utilement l’approche systémique.
Immunomodulation
Interférons
L’utilisation des interférons constitue une approche thérapeutique complémentaire intéressante. L’interféron oméga félin peut être administré à la dose de 1,5 MU/kg par voie péritonéale et sous-cutanée. L’interféron alpha-2a, utilisé à raison de 1000 unités par voie orale une fois par jour selon un cycle de 21 jours de traitement suivis de 7 jours d’arrêt, représente une alternative possible.
Soins de Support
Les soins de support revêtent une importance particulière dans la prise en charge globale. Une antibiothérapie systémique et/ou ophtalmologique peut s’avérer nécessaire pour contrôler les surinfections bactériennes secondaires. Les soins locaux doivent être adaptés à la nature et à la localisation des lésions. Il est crucial de souligner la contre-indication formelle des corticoïdes, dont l’utilisation risquerait d’aggraver l’infection virale en compromettant les défenses immunitaires locales.
Prévention et Suivi
Gestion Environnementale
La prévention des récidives constitue un aspect essentiel de la prise en charge à long terme. Elle repose principalement sur l’identification et le contrôle des facteurs de stress susceptibles de déclencher une réactivation virale. L’optimisation des conditions de vie et une hygiène environnementale rigoureuse sont des éléments clés de cette approche préventive.
Surveillance Clinique
Le suivi régulier des patients permet d’évaluer l’efficacité du traitement et d’ajuster la prise en charge si nécessaire. La réponse thérapeutique s’apprécie sur l’évolution des lésions cutanées, la régression des signes cliniques associés et l’amélioration de l’état général. La persistance ou la récurrence des manifestations cliniques doit conduire à une réévaluation de la stratégie thérapeutique.
Conclusion
L’herpès virose cutanée féline représente une entité clinique complexe dont la prise en charge nécessite une approche globale et personnalisée. La reconnaissance des manifestations dermatologiques caractéristiques, associée à une démarche diagnostique rigoureuse, permet d’instaurer rapidement un traitement adapté. Les avancées récentes dans la compréhension des mécanismes pathogéniques et le développement de nouvelles options thérapeutiques contribuent à optimiser la prise en charge des cas cliniques. Néanmoins, le caractère chronique potentiel de l’infection et le risque de récidives soulignent l’importance d’un suivi régulier et d’une stratégie préventive bien construite. Le succès thérapeutique repose sur la combinaison judicieuse des différentes modalités de traitement disponibles et sur une gestion appropriée des facteurs environnementaux.
Bibliographie
- Coyner, K. (2020). Distinguishing Between Dermatologic Disorders of the Face, Nasal Planum, and Ears: Great Lookalikes in Feline Dermatology. Veterinary Clinics of North America: Small Animal Practice, 50(4), 823-882. doi: 10.1016/j.cvsm.2020.03.008
- Nagata, M., & Rosenkrantz, W. (2013). Cutaneous viral dermatoses in dogs and cats. Compendium on Continuing Education for the Practicing Veterinarian, 35(7), E1. PMID: 23677843
- Linek, M., Rüfenacht, S., Brachelente, C., von Tscharner, C., Favrot, C., Wilhelm, S., … & Welle, M. (2015). Nonthymoma-associated exfoliative dermatitis in 18 cats. Veterinary Dermatology, 26(1), 40-45, e12-3. doi: 10.1111/vde.12169
- Gutzwiller, M. E., Brachelente, C., Taglinger, K., Suter, M. M., Weissenböck, H., & Roosje, P. J. (2007). Feline herpes dermatitis treated with interferon omega. Veterinary Dermatology, 18(1), 50-54. doi: 10.1111/j.1365-3164.2007.00556.x
- De Lucia, M., Cabref, M., Denti, D., Mezzalira, G., Rondena, M., & Tommaso, C. (2021). Presumptive herpesvirus-associated erythema multiforme in a cat. Veterinary Dermatology, 32, 86-e16. doi: 10.1111/vde.12901
Recherches Connexes
herpesvirose chat, chat, herpès, voies respiratoires, animal, l’herpès virose, symptômes, virose, virus, signes cliniques, maladie, félin, collectivité, maladie virale, prévention, cause, cas, traitement, mise bas, chatons, face, herpès virose, manière, infection, cornée, diagnostic, conjonctive, fois, peau, porteurs, élevage, vaccin, anti inflammatoires, surface, raison, crises, âge, pcr, contamination, phases, écoulement, contact, manifestations, durée, niveau, exemple, yeux, atteinte, conjonctivite, amygdales, point, fièvre, origine, acide aminé