En dermatologie vétérinaire, peu de micro-organismes représentent un défi clinique aussi constant et complexe que Pseudomonas aeruginosa. Ce bacille à Gram négatif, loin d’être un simple agent infectieux, se révèle être un adversaire redoutable, un pathogène opportuniste par excellence qui exploite avec une efficacité redoutable la moindre altération de la barrière cutanée ou la moindre défaillance immunitaire de l’hôte.
Introduction
Les infections qu’il engendre, principalement les otites externes chroniques et les pyodermites profondes, sont souvent caractérisées par leur sévérité, leur chronicité et leur nature récalcitrante au traitement.
La gestion de ces affections est rendue particulièrement ardue par deux caractéristiques biologiques fondamentales de ce pathogène. D’une part, P. aeruginosa possède une résistance intrinsèque à de nombreuses classes d’antibiotiques, une capacité qu’il complète par une aptitude remarquable à acquérir de nouveaux mécanismes de résistance, conduisant à l’émergence de souches multirésistantes (MDR). D’autre part, sa capacité à former des biofilms — des communautés bactériennes structurées et protégées par une matrice extracellulaire — constitue une véritable forteresse le mettant à l’abri des défenses immunitaires de l’hôte et des agents antimicrobiens. Cette double stratégie de défense et de persistance est la cause principale des échecs thérapeutiques et des récidives frustrantes pour le clinicien.
Face à cette problématique croissante, une approche thérapeutique simpliste ou empirique est vouée à l’échec. La présente synthèse a pour objectif de fournir une analyse exhaustive et intégrée, fondée sur les données scientifiques les plus récentes, pour la prise en charge des infections dermatologiques à P. aeruginosa. Cet article de référence détaillera la biologie et la pathogénie de ce micro-organisme, proposera une démarche diagnostique raisonnée et structurée, et explorera en profondeur les stratégies thérapeutiques multimodales. Une attention particulière sera accordée à l’interprétation critique de l’antibiogramme à la lumière des nouvelles recommandations, à la gestion des infections multirésistantes et à l’évaluation des innovations thérapeutiques prometteuses, telles que les agents anti-biofilms et la phagothérapie. L’ambition de ce travail est de doter le clinicien des outils conceptuels et pratiques nécessaires pour transformer la gestion de ces cas complexes d’un combat incertain à une stratégie thérapeutique maîtrisée et efficace.
1. Pseudomonas aeruginosa : Portrait d’un Pathogène Opportuniste Redoutable
1.1. Écologie et Caractéristiques Microbiologiques
La compréhension de la nature de Pseudomonas aeruginosa commence par la reconnaissance de son ubiquité. Ce micro-organisme est omniprésent dans l’environnement, colonisant aisément le sol, l’eau douce, les surfaces végétales et les matières organiques en décomposition. Cette plasticité écologique explique non seulement sa présence fréquente en tant que simple contaminant environnemental, mais aussi son rôle de premier plan dans les infections nosocomiales, où il peut survivre et proliférer dans des réservoirs aussi variés que les désinfectants, les éviers ou les équipements médicaux. Il est fondamental de noter que P. aeruginosa ne fait pas partie de la microflore commensale du conduit auditif externe ou de la peau saine du chien. Sa présence dans un prélèvement dermatologique est donc toujours cliniquement significative.
Sur le plan microbiologique, il s’agit d’un bacille à Gram négatif, aérobie strict, qui se distingue par sa mobilité, assurée par un unique flagelle polaire. Ses exigences nutritionnelles minimales et sa capacité à tolérer une large gamme de conditions physico-chimiques, y compris des températures allant jusqu’à 42 °C, lui confèrent une capacité de survie et d’adaptation exceptionnelle, lui permettant de coloniser des environnements hostiles où peu d’autres bactéries peuvent subsister.
1.2. Arsenal de Virulence : Des Toxines aux Enzymes
Le pouvoir pathogène de P. aeruginosa ne réside pas dans une seule toxine, mais dans un arsenal complexe et redondant de facteurs de virulence qui agissent en synergie pour envahir les tissus, échapper à la réponse immunitaire et causer des dommages cellulaires.
Parmi les facteurs les plus connus figurent ses pigments. La pyocyanine, un pigment bleu-vert qui donne sa couleur caractéristique au pus “pyocyanique”, n’est pas un simple marqueur visuel. Elle exerce des effets pro-inflammatoires puissants sur les phagocytes et altère les fonctions immunitaires des cellules épithéliales, contribuant activement à la pathogénie. L’invasion tissulaire est, quant à elle, facilitée par une batterie d’enzymes extracellulaires. L’élastase dégrade le collagène et l’élastine, composants majeurs de la matrice extracellulaire, tandis que la protéase alcaline interfère avec la formation de fibrine, empêchant le confinement de l’infection. Les phospholipases dégradent les phospholipides des membranes cellulaires, entraînant une lyse cellulaire.
À cet arsenal s’ajoutent des toxines puissantes. La cytotoxine (ou leucocidine) et les hémolysines ciblent et détruisent les cellules immunitaires et les érythrocytes. De plus, P. aeruginosa utilise des systèmes de sécrétion sophistiqués, comme le système de sécrétion de type III (SST3), qui agit comme une seringue moléculaire pour injecter directement des effecteurs toxiques (exotoxines S et A) au cœur des cellules de l’hôte. Ces exotoxines paralysent les fonctions cellulaires, notamment la phagocytose, et induisent une nécrose tissulaire localisée, créant un environnement propice à la prolifération bactérienne.
1.3. La Formation de Biofilm : Une Forteresse Bactérienne
Peut-être le facteur de virulence le plus déterminant dans la chronicité des infections à P. aeruginosa est sa capacité à former un biofilm. Il ne s’agit pas d’une simple agrégation de bactéries, mais d’une communauté microbienne hautement organisée, enchâssée dans une matrice d’exopolysaccharides auto-produite, principalement composée d’alginate. Cette matrice visqueuse ancre solidement les bactéries à la surface du conduit auditif ou de la peau ulcérée, formant une véritable forteresse.
Cette structure confère de multiples avantages à la bactérie. Premièrement, elle constitue une barrière physique qui la protège des cellules phagocytaires du système immunitaire et limite considérablement la pénétration des antibiotiques. Des études ont montré que les bactéries organisées en biofilm peuvent être des centaines, voire des milliers de fois plus résistantes aux agents antimicrobiens que leurs homologues planctoniques (libres). Deuxièmement, au sein du biofilm, les bactéries communiquent entre elles via un système de signaux chimiques appelé quorum sensing. Ce mécanisme, dépendant de la densité cellulaire, leur permet de coordonner l’expression de gènes de virulence et de stratégies de défense de manière collective, se comportant comme un organisme multicellulaire.
L’impact clinique de cette stratégie est majeur. La prévalence de la formation de biofilms par les isolats cliniques de P. aeruginosa issus d’otites canines est extrêmement élevée, rapportée dans 40 % à plus de 90 % des cas selon les études. Une vaste étude européenne a même révélé que 82 % des isolats étaient capables de former des biofilms forts. Cette capacité est une cause directe d’échec thérapeutique, de persistance de l’infection malgré une antibiothérapie apparemment adaptée, et de l’installation d’une inflammation chronique destructrice.
1.4. Mécanismes de Résistance aux Antibiotiques : Stratégies Intrinsèques et Acquises
La formidable capacité de P. aeruginosa à résister aux antibiotiques repose sur une double stratégie : une résistance naturelle (intrinsèque) et une capacité d’adaptation exceptionnelle (résistance acquise).
La résistance intrinsèque est une caractéristique inhérente à l’espèce. Elle est principalement due à la faible perméabilité de sa membrane externe, qui restreint l’entrée de nombreuses molécules. À cela s’ajoute un arsenal de pompes à efflux, des protéines membranaires qui expulsent activement les antibiotiques hors de la cellule avant qu’ils n’atteignent leur cible. Enfin, P. aeruginosa exprime de manière constitutive une β-lactamase chromosomique (AmpC), une enzyme capable d’inactiver certaines pénicillines et céphalosporines.
La résistance acquise est encore plus préoccupante. Elle résulte soit de mutations chromosomiques spontanées, soit, plus fréquemment, de l’acquisition de matériel génétique mobile (plasmides, transposons) par transfert horizontal depuis d’autres bactéries. Ces mécanismes permettent à la bactérie de développer des résistances à des classes d’antibiotiques auxquelles elle était initialement sensible, menant à l’émergence de phénotypes de multirésistance (MDR). Les principaux mécanismes acquis incluent la production d’enzymes inactivatrices additionnelles (comme les β-lactamases à spectre étendu ou les carbapénémases), la modification de la cible de l’antibiotique (par exemple, des mutations dans les gènes de l’ADN gyrase conférant une résistance aux fluoroquinolones) ou la surexpression des pompes à efflux.
Cette combinaison de virulence agressive, de protection par le biofilm et de multiples mécanismes de résistance fait de P. aeruginosa un pathogène particulièrement difficile à éradiquer. Son succès clinique n’est pas le fruit d’un seul facteur, mais d’une stratégie de survie intégrée et synergique. La bactérie utilise d’abord ses enzymes et toxines pour s’implanter et endommager les tissus. Elle construit ensuite sa forteresse, le biofilm, pour se protéger des premières vagues de défense de l’hôte et des traitements. À l’abri, elle a le temps de développer et d’échanger des gènes de résistance, s’armant pour les assauts futurs. Toute approche thérapeutique qui ne prend pas en compte cette stratégie globale est inévitablement vouée à l’échec. Le traitement doit donc être multimodal, visant simultanément à démanteler la forteresse, neutraliser les agents pathogènes et réparer les dommages infligés à l’hôte.
Tableau 1 : Facteurs de Virulence Clés de P. aeruginosa et Leurs Rôles Pathogéniques
|
Facteur de Virulence |
Catégorie |
Rôle Pathogénique Principal |
|
Pyocyanine |
Pigment |
Altération de la réponse immunitaire, stress oxydatif, effets pro-inflammatoires |
|
Élastase, Protéase alcaline |
Enzymes extracellulaires |
Destruction de la matrice extracellulaire (collagène, élastine), invasion tissulaire |
|
Phospholipase C |
Enzyme extracellulaire |
Lyse des cellules hôtes par dégradation des membranes lipidiques |
|
Exotoxine A, Exoenzyme S |
Toxines (Système de sécrétion T3) |
Inhibition de la synthèse protéique, apoptose des cellules hôtes, paralysie des phagocytes |
|
Lipopolysaccharide (LPS) |
Composant membranaire |
Induction d’une forte réponse inflammatoire, choc septique |
|
Alginate / Biofilm |
Matrice protectrice |
Protection contre les antibiotiques et le système immunitaire, adhésion, persistance chronique |
|
Pompes à efflux |
Mécanisme de résistance |
Expulsion active de multiples classes d’antibiotiques hors de la cellule bactérienne |
|
β-lactamases (AmpC, etc.) |
Enzymes de résistance |
Inactivation enzymatique des antibiotiques de la famille des β-lactamines |
2. Manifestations Cliniques et Épidémiologie
2.1. L’Otite à Pseudomonas aeruginosa
L’otite à Pseudomonas aeruginosa représente l’une des entités cliniques les plus sévères et les plus frustrantes en dermatologie canine. Il est crucial de comprendre qu’elle n’est que très rarement une infection primaire. Elle est presque systématiquement une complication d’une otite externe chronique ou récidivante, initialement causée par une prolifération d’autres agents, typiquement des levures (Malassezia pachydermatis) ou des cocci (Staphylococcus pseudintermedius). La progression vers une infection à Pseudomonas est une véritable escalade pathologique, favorisée par un ensemble de facteurs. Les facteurs prédisposants (conformation de l’oreille avec un conduit étroit ou un pavillon pendant, humidité excessive), les facteurs primaires (la cause initiale de l’inflammation, comme la dermatite atopique, une allergie alimentaire ou un corps étranger) et les facteurs perpétuants (modifications pathologiques du conduit comme l’hyperplasie des glandes cérumineuses, la sténose, ou une rupture de la membrane tympanique) créent un microenvironnement idéal pour la colonisation par ce pathogène opportuniste.
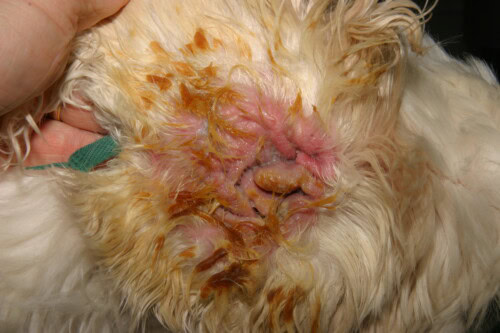
Sévère Otite à Pseudomonas chez un Cocker
La présentation clinique est souvent caractéristique. L’atteinte est fréquemment unilatérale, bien qu’elle puisse être bilatérale dans un contexte de maladie allergique sous-jacente. Elle se manifeste par une douleur auriculaire intense, souvent plus marquée que le prurit, une inflammation érythémateuse sévère du conduit, et des ulcérations de l’épithélium. Le signe le plus évocateur est la nature de l’exsudat : il est typiquement abondant, mucoïde ou purulent, malodorant, et d’une couleur jaune-verdâtre caractéristique due à la production de pigments bactériens. Dans les cas sévères, cet exsudat peut être hémorragique. L’examen attentif du pavillon et de l’entrée du conduit peut révéler la présence de plages gluantes, une manifestation clinique directe du biofilm bactérien. Une complication majeure et fréquente est l’extension de l’infection à l’oreille moyenne. On estime que plus de 80 % des chiens atteints d’otite externe chronique à Pseudomonas présentent une otite moyenne concomitante. Celle-ci peut se manifester par des signes neurologiques tels que le syndrome de Horner, une paralysie du nerf facial ou des troubles vestibulaires.
Sur le plan épidémiologique, l’otite externe est une affection extrêmement commune, touchant entre 10 % et 20 % de la population canine. Au sein de cette population, P. aeruginosa s’impose comme l’agent pathogène le plus fréquemment isolé dans les cas chroniques et récalcitrants, étant associé à près de 35 % de ces formes sévères. D’autres études, menées sur des populations spécifiques de chiens présentant une otite, rapportent des prévalences allant de 25 % à plus de 50 %.
2.2. La Pyodermite à Pseudomonas aeruginosa
Bien que moins fréquentes que les otites, les pyodermites à P. aeruginosa sont souvent des affections spectaculaires et graves. Elles se présentent généralement sous deux formes principales.
La pyodermite profonde aiguë est la forme la plus dramatique. Elle se caractérise par l’apparition soudaine de lésions extrêmement douloureuses, classiquement localisées le long de la ligne du dos. L’examen clinique révèle de multiples ulcères circinés (en forme d’anneau), des croûtes hémorragiques et des furoncles qui peuvent laisser suinter un exsudat sanguinolent. L’état général de l’animal est souvent affecté, avec de l’abattement et de la fièvre.
L’intertrigo (ou dermatite des plis) à Pseudomonas est une autre présentation. Il se développe dans les zones de plis cutanés où la macération et la friction créent des conditions favorables (plis faciaux chez les races brachycéphales, pli de la queue, plis vulvaires). Les lésions consistent en des érosions et des ulcérations profondes, recouvertes d’un exsudat verdâtre, épais et particulièrement collant, très évocateur de l’implication de ce germe.
La prévalence exacte des pyodermites à Pseudomonas est moins bien documentée que celle des otites. Cependant, des études sur les infections cutanées canines ont identifié P. aeruginosa dans environ 11 % à 13 % des cas. Une étude menée en Roumanie sur des infections cutanées superficielles a isolé le germe dans près de 34 % des prélèvements de pyodermite.
La survenue d’une infection à P. aeruginosa, que ce soit dans l’oreille ou sur la peau, doit être interprétée par le clinicien comme un signal d’alarme. Ce n’est pas un événement fortuit, mais le point culminant d’une cascade pathologique. La chronicité est le principal facteur de risque. L’inflammation persistante, l’humidité, et surtout les traitements antibiotiques répétés, souvent à large spectre, créent une pression de sélection intense. Ils éliminent la flore commensale protectrice et les pathogènes plus sensibles, laissant le champ libre à P. aeruginosa, intrinsèquement plus résistant et parfaitement adapté à cet environnement hostile et modifié. Par conséquent, l’identification de P. aeruginosa n’est pas la fin du diagnostic, mais le début d’une investigation plus approfondie. Elle impose une recherche rigoureuse de la cause primaire (allergie, trouble endocrinien, etc.) qui a permis à cette “crise” de s’installer. Sans la gestion de ce facteur initial, toute tentative de traitement de l’infection à Pseudomonas, même avec l’antibiotique le plus puissant, ne sera qu’un répit temporaire avant une récidive inévitable.
3. Approche Diagnostique Raisonnée
La prise en charge efficace d’une infection à P. aeruginosa repose sur une démarche diagnostique structurée et hiérarchisée. L’objectif n’est pas seulement d’identifier le pathogène, mais aussi de comprendre le contexte de son développement, d’évaluer l’étendue des lésions et de guider une thérapeutique ciblée et rationnelle.
3.1. L’Examen Clinique et Otoscopique : Étapes Initiales Cruciales
Toute démarche diagnostique commence par une anamnèse rigoureuse et un examen clinique complet. L’interrogatoire du propriétaire doit rechercher des signes de maladies sous-jacentes, notamment un prurit en dehors des oreilles, des troubles digestifs ou des infections cutanées récidivantes pouvant suggérer une dermatite atopique ou une allergie alimentaire. Des signes de polyuro-polydipsie ou une prise de poids peuvent orienter vers une endocrinopathie. L’examen dermatologique doit être exhaustif, car l’otite n’est souvent qu’une des manifestations d’une dermatose plus globale.
L’examen otoscopique est une étape fondamentale. L’utilisation d’un vidéo-otoscope est idéale, car elle offre un grossissement, un éclairage et une capacité d’enregistrement supérieurs, facilitant l’évaluation précise et le suivi. L’otoscopie permet d’apprécier l’état du conduit auditif externe : degré d’érythème, présence d’ulcérations, de proliférations tissulaires (sténose), ou de masses. Elle est également indispensable pour évaluer l’intégrité de la membrane tympanique. Une membrane rompue, bombée ou décolorée est un signe fort d’atteinte de l’oreille moyenne. La visualisation d’un exsudat purulent et d’ulcères est hautement suggestive d’une infection par des bacilles à Gram négatif.
3.2. L’Examen Cytologique : Un Outil Diagnostique de Première Ligne
L’examen cytologique auriculaire est l’examen complémentaire le plus important, le plus rapide et le plus rentable dans la gestion des otites. Il doit être réalisé systématiquement lors de chaque consultation pour une otite. Le prélèvement s’effectue à l’aide d’un écouvillon, en essayant d’atteindre la jonction entre le conduit vertical et horizontal, là où les sécrétions sont les plus représentatives de l’infection. L’échantillon est ensuite étalé sur une lame, coloré (par exemple, avec une coloration de type Romanowsky rapide) et examiné au microscope.
Dans le contexte d’une infection à P. aeruginosa, les résultats sont souvent caractéristiques. L’observation de bactéries en forme de bâtonnets (bacilles), souvent en grand nombre, est le signe d’appel principal. Ces bacilles sont typiquement accompagnés d’une population inflammatoire dense, majoritairement composée de neutrophiles dégénérés, témoignant d’une infection active et suppurée. La cytologie offre une orientation diagnostique et thérapeutique quasi immédiate, permettant d’initier un traitement topique ciblé contre les bacilles Gram négatif sans attendre les résultats d’une culture.
3.3. Culture Bactérienne et Antibiogramme : Indications et Protocole de Prélèvement
La culture bactérienne avec antibiogramme n’est pas un examen de routine pour une première otite non compliquée. Sa prescription doit être raisonnée et réservée à des situations cliniques précises où elle apporte une information cruciale pour la suite du traitement :
- Présence confirmée de bacilles à l’examen cytologique, en particulier si l’infection est chronique ou récidivante.
- Échec d’un traitement empirique de première intention bien conduit.
- Nécessité d’envisager une antibiothérapie par voie systémique, notamment en cas d’otite moyenne avérée ou de pyodermite profonde associée. Dans ce cas, l’antibiogramme est indispensable pour guider le choix de la molécule.
Le protocole de prélèvement est critique pour la fiabilité du résultat. L’échantillon doit être prélevé de la manière la plus aseptique possible, idéalement dans la portion profonde du conduit auditif. En cas de suspicion d’otite moyenne avec une membrane tympanique intacte, la seule façon d’obtenir un prélèvement représentatif de la bulle tympanique est de réaliser une myringotomie. Cet acte, réalisé sous anesthésie générale et guidage vidéo-otoscopique, consiste à perforer stérilement le tympan pour aspirer le contenu de l’oreille moyenne en vue d’une analyse cytologique et d’une mise en culture.
3.4. L’Imagerie Médicale dans l’Exploration de l’Otite Moyenne
Lorsque l’atteinte de l’oreille moyenne est suspectée (sur la base des signes cliniques, de l’otoscopie ou de l’échec thérapeutique), l’imagerie médicale devient un outil diagnostique essentiel. Elle permet de confirmer l’atteinte, d’en évaluer la sévérité et de planifier une éventuelle intervention chirurgicale.
Le scanner (tomodensitométrie ou CT-scan) est considéré comme la modalité d’imagerie de choix. Il offre une excellente résolution pour visualiser les structures osseuses, notamment la paroi de la bulle tympanique (recherche de lyse osseuse) et les osselets, ainsi que pour détecter la présence de liquide ou de tissu mou anormal dans l’oreille moyenne. L’imagerie par résonance magnétique (IRM) est une alternative qui offre une meilleure visualisation des tissus mous et est particulièrement indiquée en cas de suspicion de masse tumorale ou d’extension de l’infection aux structures nerveuses environnantes.
Cette démarche séquentielle, allant de la cytologie rapide à l’imagerie avancée, incarne une approche diagnostique rationnelle. Chaque examen complémentaire n’est pas prescrit au hasard, mais vise à répondre à une question clinique précise qui se pose à une étape donnée du processus. La cytologie oriente le traitement initial. L’échec de ce traitement pose la question de la résistance (réponse par la culture) ou de l’extension anatomique (réponse par le scanner). Cette hiérarchisation prévient l’escalade thérapeutique non justifiée et favorise une utilisation raisonnée des antibiotiques et des examens coûteux.
4. Stratégies Thérapeutiques Intégrées
Le traitement des infections à P. aeruginosa est un processus exigeant qui requiert une approche multimodale et persévérante. Le succès ne repose pas sur une seule molécule “miracle”, mais sur une stratégie intégrée visant à la fois à éliminer le pathogène, à contrôler l’inflammation, à corriger les facteurs sous-jacents et à restaurer un environnement auriculaire sain.
4.1. Principes Fondamentaux : Gestion de la Cause Primaire et Contrôle de l’Inflammation
Le principe le plus fondamental, et pourtant parfois négligé, est que le traitement à long terme de l’infection à Pseudomonas est indissociable de l’identification et de la gestion de la cause primaire de l’otite. Qu’il s’agisse d’une allergie, d’une endocrinopathie ou d’une masse, son contrôle est la seule garantie contre les récidives. L’infection à Pseudomonas est une conséquence ; traiter uniquement la conséquence sans s’attaquer à la cause est une impasse thérapeutique.
Parallèlement, le contrôle de l’inflammation est un pilier du traitement. L’inflammation chronique provoque un œdème, une douleur, une hyperplasie des glandes sébacées et cérumineuses, et une sténose du conduit. Ces modifications perpétuent l’infection et empêchent la pénétration des traitements topiques. L’utilisation de glucocorticoïdes, par voie topique et/ou systémique (par exemple, prednisolone à dose anti-inflammatoire), est donc cruciale en phase initiale. Ils permettent de “rouvrir” le conduit, de diminuer la production d’exsudat, d’améliorer le confort de l’animal et, par conséquent, d’augmenter l’efficacité des agents antimicrobiens.
4.2. La Thérapie Topique : Pierre Angulaire du Traitement
La thérapie topique est au cœur de la stratégie thérapeutique, car elle seule permet d’atteindre des concentrations d’antimicrobiens au site de l’infection qui sont bien supérieures à celles obtenues par voie systémique. Son efficacité dépend de deux étapes clés : le nettoyage et l’application d’agents ciblés.
Le nettoyage auriculaire est une étape non négociable. L’exsudat purulent et le biofilm agissent comme une barrière physique et peuvent inactiver chimiquement certains antibiotiques, notamment les aminosides. Un nettoyage initial profond, réalisé sous anesthésie générale avec irrigation abondante, est souvent indispensable pour éliminer la majorité des débris. Par la suite, des nettoyages réguliers à domicile par le propriétaire sont nécessaires pour maintenir le conduit propre.
L’efficacité de la thérapie topique peut être considérablement augmentée par l’utilisation de solutions contenant du Tris-EDTA. L’EDTA (acide éthylènediaminetétraacétique) est un agent chélateur qui se lie aux ions métalliques (calcium, magnésium) essentiels à la stabilité de la membrane externe des bactéries à Gram négatif. En déstabilisant cette membrane, le Tris-EDTA la rend plus perméable aux antibiotiques, potentialisant ainsi leur action. Des études ont montré qu’il augmente significativement l’efficacité des fluoroquinolones et des aminosides contre P. aeruginosa. Le protocole optimal consiste à instiller la solution de Tris-EDTA dans le conduit auditif et à attendre 20 à 30 minutes avant d’appliquer le médicament antibiotique, afin de laisser le temps à l’agent chélateur d’agir.
Le choix de l’agent antimicrobien topique doit être réfléchi. Plusieurs options sont disponibles :
- Les fluoroquinolones (marbofloxacine, enrofloxacine) et les aminosides (gentamicine, amikacine) sont des choix courants et souvent efficaces. La prudence est de mise avec les aminosides en cas de rupture tympanique en raison de leur ototoxicité potentielle.
- La polymyxine B est un autre antibiotique efficace contre P. aeruginosa.
- La sulfadiazine d’argent (SSD) est une option particulièrement intéressante, notamment face à des souches multirésistantes. Sous forme de crème à 1%, elle a démontré une excellente activité in vitro contre les isolats canins de P. aeruginosa, avec des concentrations minimales inhibitrices (CMI) très basses (1-64 µg/mL), bien inférieures à la concentration de la préparation commerciale. Son mécanisme d’action, ciblant la paroi et la membrane cellulaire, est différent de celui de nombreux autres antibiotiques.
4.3. L’Antibiothérapie Systémique : Indications, Choix et Risques
L’antibiothérapie par voie systémique n’est pas un traitement de première intention pour une otite externe, même à Pseudomonas. Les concentrations atteintes dans le cérumen et l’épithélium du conduit sont souvent insuffisantes. Son utilisation doit être réservée à des indications précises et justifiées :
- Otite moyenne confirmée par l’imagerie ou l’otoscopie.
- Pyodermite profonde associée.
- Inflammation et hyperplasie tissulaire si sévères qu’elles empêchent toute application topique efficace.
- Échec avéré d’un traitement topique agressif et bien conduit.
Le choix de la molécule doit impérativement être guidé par un antibiogramme.
- Les fluoroquinolones sont la seule classe disponible par voie orale ayant une activité fiable. Cependant, des doses élevées, hors AMM, sont requises pour être efficaces contre P. aeruginosa : enrofloxacine à 10-20 mg/kg/jour et marbofloxacine à 5,5 mg/kg/jour. Il faut noter que la résistance peut se développer rapidement en cours de traitement.
- Les options parentérales (injectables) incluent les céphalosporines de troisième génération (comme la ceftazidime) et les aminosides (amikacine, gentamicine). L’utilisation systémique des aminosides est limitée par leur risque de néphrotoxicité et d’ototoxicité, et requiert une hydratation parfaite de l’animal ainsi qu’un suivi de la fonction rénale.
- Les carbapénèmes (imipénem, méropénem) et les pénicillines anti-pseudomoniques (ticarcilline) sont des antibiotiques de dernier recours, à n’utiliser que pour des infections multirésistantes documentées, dans le respect des principes de l’antibiogouvernance pour préserver leur efficacité en médecine humaine et vétérinaire.
- A noter que ces dernières molécules sont à employer en fonction de la réglementation en vigueur et des recommandations de chaque pays, le GEDAC pour ce qui est de la France par exemple.
Tableau 2 : Posologies des Antibiotiques Systémiques Anti-Pseudomoniques chez le Chien
|
Molécule |
Classe |
Posologie (voie) |
Commentaires Cliniques / Précautions |
|
Enrofloxacine |
Fluoroquinolone |
10–20 mg/kg/jour (PO, IV, SC) |
Nécessite des doses élevées. La résistance peut se développer rapidement. |
|
Marbofloxacine |
Fluoroquinolone |
5,5 mg/kg/jour (PO) |
Dose maximale requise pour une efficacité contre les souches à sensibilité intermédiaire. |
|
Amikacine |
Aminoside |
15–30 mg/kg/jour (IV, IM, SC) |
Risque de néphrotoxicité et d’ototoxicité. Assurer une bonne hydratation et monitorer la fonction rénale. |
|
Gentamicine |
Aminoside |
10–14 mg/kg/jour (IV, IM, SC) |
Risque de toxicité plus élevé que l’amikacine. Monitorage requis. |
4.4. L’Interprétation Critique de l’Antibiogramme selon les Normes CLSI VET
L’antibiogramme est un outil puissant, mais son interprétation ne doit pas être passive. Le Clinical and Laboratory Standards Institute (CLSI) a récemment publié une mise à jour majeure des seuils critiques (breakpoints) pour les fluoroquinolones chez le chien, qui change radicalement leur interprétation.
Les anciens seuils, plus élevés, pouvaient classer comme “Sensible” (S) une souche qui ne répondrait pas à un traitement à dose standard. Les nouveaux seuils sont beaucoup plus bas et introduisent une nouvelle catégorie : “Sensible-Dose Dépendant” (SDD). Cette catégorie indique qu’une souche peut être traitée avec succès, mais uniquement si la dose la plus élevée de l’intervalle posologique approuvé est utilisée.
Cette évolution transforme l’antibiogramme d’un simple rapport “S/I/R” en un véritable guide de prescription. Face à une souche classée SDD, le clinicien sait qu’il doit prescrire la dose maximale recommandée (par exemple, 20 mg/kg/jour pour l’enrofloxacine) pour avoir une chance de succès clinique. Utiliser une dose standard face à une souche SDD est une cause prévisible d’échec thérapeutique et de sélection de résistance.
Tableau 3 : Seuils Critiques CLSI VET Révisés (2023) pour l’Enrofloxacine et la Marbofloxacine chez le Chien (Voie Orale)
|
Antibiotique |
Catégorie et Seuil CMI (µg/mL) |
Dose correspondante |
|
Enrofloxacine (révisé) |
S ≤ 0.06 |
5 mg/kg/jour |
|
SDD 0.12–0.25 |
10–20 mg/kg/jour |
|
|
R ≥ 0.5 |
– |
|
|
Marbofloxacine (révisé) |
S ≤ 0.12 |
2,8 mg/kg/jour |
|
SDD 0.25 |
5,5 mg/kg/jour |
|
|
R ≥ 0.5 |
– |
En définitive, la stratégie thérapeutique ne doit pas être vue comme une simple “bataille antibiotique” mais comme une “gestion d’écosystème”. L’objectif n’est pas seulement d’éradiquer P. aeruginosa, mais de restaurer un environnement cutané ou auriculaire dans lequel il ne peut plus proliférer. Le nettoyage, le Tris-EDTA et les anti-inflammatoires modifient l’environnement physique, chimique et immunologique. Le traitement de la cause primaire corrige le déséquilibre fondamental. Dans ce schéma, les antibiotiques ne sont qu’un outil, souvent temporaire, pour réduire la charge bactérienne pendant que les autres mesures restaurent l’équilibre. Le succès se mesure moins à la guérison de l’épisode infectieux qu’à la prévention de sa récidive.
5. Gestion des Infections Multirésistantes et Perspectives d’Avenir
L’émergence de souches de P. aeruginosa multirésistantes (MDR) constitue le défi ultime en dermatologie vétérinaire. Face à un antibiogramme ne montrant que peu ou pas de sensibilités, le clinicien doit abandonner l’idée d’une solution simple et adopter des stratégies alternatives et combinées, tout en se tournant vers les innovations thérapeutiques qui redéfinissent la lutte contre les infections bactériennes.
5.1. Stratégies Combinées pour les Souches Multirésistantes (MDR)
La gestion d’une infection MDR à P. aeruginosa repose sur une intensification de l’approche multimodale. Chaque composant du traitement devient critique. Un nettoyage mécanique rigoureux et répété, souvent sous anesthésie, est la première étape pour démanteler physiquement le biofilm et réduire la charge bactérienne. L’utilisation systématique de Tris-EDTA en prétraitement devient non plus une option mais une nécessité pour tenter de restaurer une sensibilité, même partielle, aux antibiotiques.
Le choix des agents topiques doit être créatif et fondé sur les quelques options restantes. La sulfadiazine d’argent est souvent un excellent choix empirique dans ce contexte. La préparation extemporanée de solutions topiques à base d’antibiotiques injectables, comme la ticarcilline ou l’amikacine, peut être envisagée, bien que la stabilité de ces préparations soit une préoccupation. L’antibiothérapie systémique, si elle est absolument nécessaire, doit être scrupuleusement guidée par l’antibiogramme, en envisageant des molécules de dernier recours après une évaluation rigoureuse du rapport bénéfice/risque.
5.2. La Disruption du Biofilm : Le Rôle de la N-acétylcystéine (NAC)
La reconnaissance du biofilm comme une forteresse protégeant les bactéries a ouvert la voie à la recherche d’agents “anti-biofilm”. La N-acétylcystéine (NAC), un agent mucolytique bien connu, a émergé comme un candidat très prometteur. Des études in vitro ont démontré que la NAC possède non seulement une activité antibactérienne directe contre les pathogènes de l’otite, y compris P. aeruginosa, mais qu’elle est surtout capable de perturber la matrice du biofilm, la dégradant et exposant ainsi les bactéries qu’elle abrite.
Les données in vitro sont convaincantes : la NAC inhibe la croissance de P. aeruginosa à des concentrations minimales inhibitrices (CMI) de 5 à 20 mg/mL, des niveaux considérés comme sûrs et atteignables lors d’une application topique. Son association avec le Tris-EDTA pourrait offrir une synergie d’action, le Tris-EDTA affaiblissant la paroi bactérienne tandis que la NAC démantèle la matrice extracellulaire. Bien que des essais cliniques prospectifs soient encore nécessaires pour valider son efficacité in vivo, la NAC représente une option thérapeutique adjuvante de grand intérêt pour les infections chroniques et à biofilm, en complément des traitements antimicrobiens.
5.3. Thérapies Innovantes : La Phagothérapie comme Alternative Prometteuse
Face à l’impasse de l’antibiorésistance, la communauté scientifique se tourne vers des approches radicalement différentes, et la phagothérapie est l’une des plus prometteuses. Cette technique utilise des bactériophages (ou phages), des virus qui sont les prédateurs naturels des bactéries. Les phages dits “lytiques” infectent une bactérie cible spécifique, se répliquent à l’intérieur, puis la font éclater (lyse), libérant des dizaines de nouvelles particules virales prêtes à infecter les bactéries voisines.
Les avantages de cette approche sont multiples. Les phages possèdent une haute spécificité, ne ciblant que la bactérie pathogène sans affecter la microflore bénéfique de l’hôte. Ils ont la capacité de s’auto-répliquer au site de l’infection tant que leur cible est présente. Surtout, ils sont efficaces contre les bactéries multirésistantes, car leur mécanisme d’action est totalement indépendant de la sensibilité aux antibiotiques. De plus, de nombreux phages produisent des enzymes capables de dégrader la matrice des biofilms, leur permettant de pénétrer cette structure protectrice.
La phagothérapie est actuellement un domaine de recherche extrêmement actif en médecine vétérinaire. Des études in vitro et des rapports de cas publiés ont montré des résultats très encourageants dans le traitement d’infections cutanées, d’otites et d’infections de plaies chirurgicales à P. aeruginosa MDR chez le chien et le chat. Des essais cliniques sont en cours pour évaluer de manière rigoureuse l’efficacité et la sécurité de cocktails de phages. La combinaison synergique de phages et d’antibiotiques est également une piste explorée, où le phage affaiblit la population bactérienne, la rendant plus vulnérable à l’antibiotique.
La lutte contre P. aeruginosa MDR illustre une évolution stratégique majeure. Nous passons d’une logique de “force brute”, consistant à chercher des antibiotiques toujours plus puissants, à une logique de “guerre asymétrique”, qui vise à exploiter les faiblesses structurelles et biologiques de la bactérie. Au lieu de tenter de percer les murs de la forteresse avec un bélier plus gros, les nouvelles stratégies visent à dissoudre le ciment qui tient les pierres (NAC) ou à envoyer des agents spécialisés qui peuvent contourner les défenses (phages). L’avenir de la gestion de ces infections ne réside probablement pas dans un unique “super-antibiotique”, mais dans l’art de combiner intelligemment ces nouvelles armes pour démanteler les défenses sophistiquées de cet adversaire redoutable.
Conclusion et Pistes de Recherche Futures
La prise en charge des pyodermites et des otites à Pseudomonas aeruginosa chez le chien représente un paradigme de la médecine infectieuse moderne, où la compréhension de la biologie du pathogène et de ses interactions avec l’hôte est la clé du succès thérapeutique. Cette synthèse a mis en lumière que P. aeruginosa n’est pas un simple agent infectieux, mais un pathogène opportuniste hautement adaptatif, dont la gestion efficace transcende la simple prescription d’antibiotiques. Le succès repose sur une approche holistique et méticuleuse, dont les piliers sont : un diagnostic précis et hiérarchisé, initié par la cytologie ; le contrôle impératif de la cause primaire sous-jacente et de l’inflammation ; une thérapie topique agressive combinant nettoyage mécanique et agents potentialisateurs comme le Tris-EDTA ; et une utilisation judicieuse et raisonnée de l’antibiothérapie systémique, guidée par un antibiogramme interprété à la lumière des normes les plus récentes et des concepts pharmacodynamiques.
L’ère de l’antibiothérapie empirique et prolongée touche à sa fin, remplacée par une approche stratégique qui intègre la gestion de l’écosystème cutané et auriculaire. Cependant, de nombreuses questions subsistent et des défis importants, notamment la montée de la multirésistance, exigent une recherche continue et innovante. Plusieurs pistes de recherche futures apparaissent comme prioritaires pour améliorer la prise en charge clinique :
- Développement et validation clinique de formulations topiques synergiques : Il est crucial de mener des essais cliniques prospectifs, randomisés et contrôlés pour évaluer l’efficacité in vivo de formulations combinant des agents anti-biofilm (comme la N-acétylcystéine) et des antimicrobiens. La démonstration d’une synergie clinique permettrait d’établir de nouveaux standards de traitement pour les infections chroniques.
- Essais cliniques sur la phagothérapie : La phagothérapie représente une alternative prometteuse, mais son potentiel doit être validé par des études rigoureuses. La constitution de banques de phages bien caractérisés et la réalisation d’essais cliniques évaluant l’efficacité et la sécurité de cocktails de phages pour le traitement des infections à P. aeruginosa MDR sont une priorité absolue.
- Étude du microbiome auriculaire : Une meilleure compréhension de la dysbiose qui précède et favorise la colonisation par P. aeruginosa est nécessaire. L’analyse du microbiome auriculaire chez les chiens sains et atopiques pourrait permettre d’identifier des marqueurs de risque et d’explorer le potentiel de thérapies modulatrices du microbiome, comme les probiotiques topiques, en prévention.
- Développement d’outils de diagnostic rapide : La mise au point de tests de diagnostic rapide au chevet du patient (point-of-care), capables de détecter en quelques minutes non seulement la présence de P. aeruginosa mais aussi des marqueurs génétiques de résistance clés, permettrait d’instaurer une thérapie ciblée beaucoup plus précocement, améliorant le pronostic et limitant la pression de sélection.
- Pharmacocinétique et pharmacodynamie des traitements topiques : Les données sur la diffusion et la persistance des agents antimicrobiens topiques dans le conduit auditif enflammé et en présence de biofilm sont étonnamment rares. Des études PK/PD ciblées sont nécessaires pour optimiser les concentrations, les formulations et les fréquences d’administration afin de maximiser l’efficacité et de minimiser l’émergence de résistances.
En conclusion, si Pseudomonas aeruginosa reste un adversaire formidable, une meilleure compréhension de sa biologie, associée à une approche clinique rigoureuse et à l’intégration de thérapies innovantes, offre des perspectives encourageantes pour améliorer significativement le pronostic de ces affections complexes.
Références
Buckley, L. M., McEwan, N. A., & Nuttall, T. (2013). Tris-EDTA significantly enhances antibiotic efficacy against multidrug-resistant Pseudomonas aeruginosa in vitro. Veterinary Dermatology, 24(5), 519-e122.
Carlotti, D. N., Ghibaudo, G., & Damborg, P. (2010). In vitro antimicrobial activity of a commercial ear antiseptic containing chlorhexidine and Tris-EDTA. Veterinary Dermatology, 21(3), 282-286.
Cole, L. K., Kwochka, K. W., Kowalski, J. J., & Hillier, A. (2008). Comparison of enrofloxacin and marbofloxacin for the treatment of canine Pseudomonas otitis. Veterinary Therapeutics, 9(2), 141-151.
Fusconi, G., Ghibaudo, G., & Damborg, P. (2011). In vitro activity of a commercial ear antiseptic on planktonic and biofilm-embedded Pseudomonas aeruginosa. Veterinary Dermatology, 22(4), 366-372.
Hattab, J., et al. (2021). Prevalence of five virulence genes in Pseudomonas aeruginosa isolates from canine infections. Journal of Applied Microbiology, 130(5), 1548-1556.
Hawkins, C., Harper, D., & Soothill, J. (2010). Topical treatment of Pseudomonas aeruginosa otitis of dogs with a bacteriophage mixture: a before/after clinical trial. Veterinary Microbiology, 146(3-4), 309-313.
Hillier, A., et al. (2023). Revision of the CLSI antimicrobial susceptibility testing breakpoints for enrofloxacin and marbofloxacin in dogs. American Journal of Veterinary Research, 84(11).
May, E. R., Conklin, K. A., & Bemis, D. A. (2016). Antibacterial effect of N-acetylcysteine on common canine otitis externa isolates. Veterinary Dermatology, 27(3), 188-e47.
Morris, D. O., et al. (2023). A retrospective study of the primary causes of Pseudomonas otitis in 60 dogs. Journal of Small Animal Practice, 64(4), 241-247.
Nuttall, T., & Cole, L. K. (2007). Evidence-based veterinary dermatology: a systematic review of interventions for treatment of Pseudomonas otitis in dogs. Veterinary Dermatology, 18(2), 69-77.
Pye, C. (2018). Surgical management of end-stage otitis in dogs. Veterinary Clinics: Small Animal Practice, 48(1), 75-91.
Robinson, A., et al. (2019). Genomic and phenotypic characterisation of Pseudomonas aeruginosa isolates from canine otitis externa. Frontiers in Microbiology, 10, 1234.
Secker, B., et al. (2023). A multinational European survey of Pseudomonas aeruginosa isolates from canine otitis: antimicrobial resistance, biofilm formation, and virulence gene profiles. Frontiers in Microbiology, 14, 1526843.
Wright, A., Hawkins, C., Änggård, E. E., & Harper, D. R. (2009). A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy. Clinical Otolaryngology, 34(4), 349-357.
Yoon, J., & Park, C. (2024). In vitro synergistic efficacy of N-acetylcysteine with antimicrobial agents against Pseudomonas aeruginosa isolated from dogs with otitis externa. Korean Journal of Veterinary Research, 64(1), e5.