Les maladies cutanées à médiation immunitaire félines constituent un ensemble complexe d’affections rares mais potentiellement graves, capables de mimer diverses dermatoses infectieuses ou allergiques. Cette deuxième partie d’une série consacrée aux dermatoses immuno-médiées examine six entités pathologiques distinctes caractérisées par des mécanismes physiopathologiques spécifiques.
L’identification précoce de ces affections s’avère cruciale compte tenu de leur évolution potentiellement fatale et des répercussions systémiques qu’elles peuvent engendrer. La compréhension approfondie de leur présentation clinique, de leurs caractéristiques histopathologiques et de leurs modalités thérapeutiques constitue un prérequis indispensable pour optimiser la prise en charge de ces patients particulièrement fragiles.
Syndrome érythème polymorphe et nécrolyse épidermique toxique
Érythème polymorphe : mécanismes et manifestations
L’érythème polymorphe représente une réaction immunitaire aiguë affectant la peau et les muqueuses, dont la pathogenèse implique l’activation de lymphocytes T cytotoxiques dirigés contre les kératinocytes chargés d’antigènes. Cette activation déclenche une cascade inflammatoire caractérisée par la lyse cellulaire épidermique et l’apoptose kératinocytaire. La classification distingue deux formes selon l’étendue de l’atteinte muqueuse et la présence de signes systémiques : la forme mineure, limitée aux manifestations cutanées, et la forme majeure, accompagnée d’une atteinte muqueuse et de symptômes généraux.
Les déclencheurs identifiés chez les félins incluent principalement les médicaments, bien que des infections virales des voies respiratoires supérieures et certaines vaccinations aient été rapportées. L’association avec l’herpèsvirus félin de type 1 a été proposée dans deux cas présentant une dermatite exfoliative généralisée avec érosions et squames, accompagnée d’antécédents d’infections respiratoires récurrentes. Cette hypothèse s’appuie sur la détection d’ADN viral dans les biopsies cutanées, suggérant un mécanisme similaire à celui observé chez l’humain avec le virus de l’herpès simplex.
La présentation clinique varie considérablement, allant de lésions maculopapulaires localisées avec formation de cocardes caractéristiques sur la partie ventrale du corps, jusqu’à des manifestations plus étendues comportant squames généralisées, alopécie, érosions et ulcérations avec ou sans atteinte mucocutanée. Contrairement au syndrome de Stevens-Johnson et à la nécrolyse épidermique toxique, l’érythème polymorphe ne provoque pas de décollement épidermique étendu.
Syndrome de Stevens-Johnson et nécrolyse épidermique toxique
Ces deux entités constituent les manifestations d’un même spectre pathologique, différenciées uniquement par l’étendue du décollement épidermique. Le syndrome de Stevens-Johnson affecte moins de 10% de la surface corporelle, la forme intermédiaire (chevauchement SJS/TEN) touche 10 à 30% de la surface, tandis que la nécrolyse épidermique toxique implique plus de 30% de l’épithélium.
La pathogenèse repose sur une réaction d’hypersensibilité médiée par les lymphocytes T cytotoxiques, principalement déclenchée par l’exposition médicamenteuse. Chez les félins, les antibiotiques bêta-lactamines, les insecticides organophosphorés et le d-limonène présentent une association causale forte. L’algorithme ALDEN (Algorithm of Drug Causality for Epidermal Necrolysis), récemment validé chez l’humain, a été utilisé avec succès pour l’évaluation de la causalité médicamenteuse dans un cas félin récent.
Les manifestations cliniques débutent par des macules et plaques érythémateuses douloureuses et irrégulières, évoluant vers la formation de bulles puis vers un décollement épidermique confluent. L’atteinte des jonctions mucocutanées, des muqueuses orales, rectales et conjonctivales ainsi que des coussinets plantaires constitue une caractéristique fréquente. Dans les cas sévères, la nécrolyse peut s’étendre aux épithéliums respiratoire et gastro-intestinal, entraînant des complications systémiques majeures incluant l’obstruction bronchique, la diarrhée profuse et la défaillance multiviscérale.
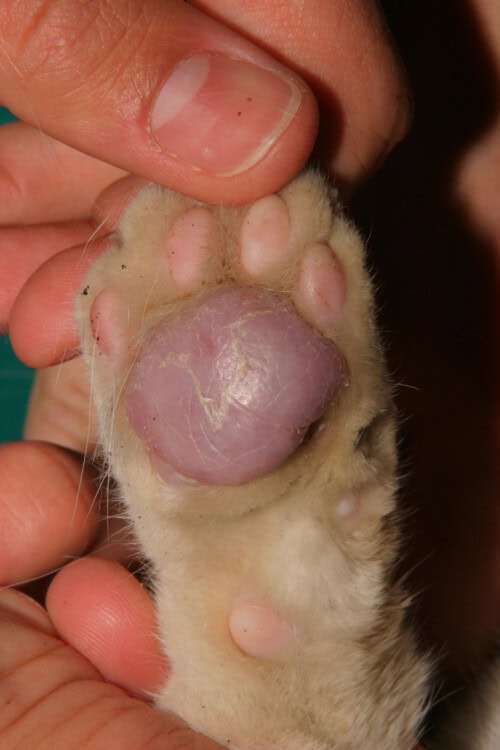
Pododermatite plasmocytaire
Caractéristiques cliniques distinctives
Affection quasi-exclusive des coussinets plantaires félins, la pododermatite plasmocytaire se manifeste par un gonflement spongieux caractéristique des coussinets multiples, d’où son appellation de “coussin-oreiller”. Les coussinets développent un aspect blanc, squameux, argenté avec des stries entrecroisées distinctives. Les coussinets métacarpiens et métatarsiens centraux sont régulièrement et plus sévèrement affectés, bien que tous les coussinets puissent être touchés.
L’évolution peut inclure ulcération, infections bactériennes secondaires, douleur et boiterie. Les lésions nodulaires ou ulcérées présentent une tendance hémorragique. Des manifestations extra-digitées ont été documentées, notamment sous forme de stomatite plasmocytaire concomitante dans deux cas sur vingt-six patients d’une étude rétrospective. Trois cas ont présenté un gonflement nasal, deux étant diagnostiqués comme “pododermatite plasmocytaire ectopique” sur la base de l’évaluation histopathologique et de la réponse thérapeutique.
Pododermatite plasmocytaire féline
Pathogenèse et facteurs prédisposants
La pathogenèse demeure partiellement élucidée, mais l’hypergammaglobulinémie constante, la plasmocytose tissulaire marquée et la réponse aux traitements immunomodulateurs suggèrent fortement un dysfonctionnement du système immunitaire. L’hypothèse d’un pattern réactionnel cutané à déclencheurs multiples, incluant les infections, reste controversée.
Une incidence élevée d’infections par le virus de l’immunodéficience féline et le virus leucémogène félin a été rapportée chez les chats affectés. Une étude a démontré une immunohistochimie positive pour le FeLV dans les biopsies des coussinets d’un chat séropositif pour les deux rétrovirus, suggérant un rôle potentiel de la stimulation polyclonale des lymphocytes B et de l’altération de la fonction des plasmocytes. Une étiologie allergique a également été proposée, certains cas présentant une récurrence saisonnière avec lésions actives durant les saisons chaudes et régression spontanée hivernale.
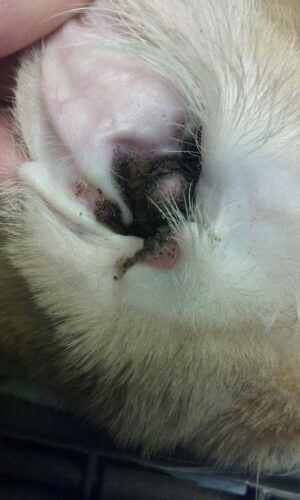
Otite externe proliférative et nécrosante
Physiopathologie et présentation clinique
Cette affection rare se caractérise par des plaques prolifératives brun foncé à noires bien délimitées recouvrant les pavillons concaves et s’étendant dans le conduit auditif vertical. La pathogenèse implique l’infiltration épidermique par des lymphocytes T CD3+ induisant l’apoptose des kératinocytes caspase-3 positifs, bien que l’origine de cette activation lymphocytaire reste inconnue.
Les plaques présentent un aspect granuleux rappelant des grains de sable et une consistance friable favorisant les saignements lors de manipulation. L’accumulation de ce matériel friable et d’un exsudat épais malodorant peut obstruer complètement les conduits auditifs. Les infections auriculaires secondaires constituent une complication fréquente. Les lésions extra-auriculaires, affectant la face avec dermatite ulcérative et croûteuse sévère, œdème tissulaire et alopécie, ont été décrites. L’atteinte palpébrale se manifeste par des débris kératineux foncés avec ulcères multifocaux.
Otite proliférative ét nécrosante
Modalités diagnostiques et thérapeutiques
Le diagnostic repose sur les caractéristiques cliniques et l’examen histopathologique. La biopsie des plaques érythémateuses doit préserver les croûtes kératineuses adhérentes pour optimiser l’interprétation diagnostique. L’histologie révèle une acanthose sévère de la gaine radiculaire externe des follicules pileux avec nécrose unicellulaire dispersée des kératinocytes à différents niveaux épithéliaux.
Le traitement topique par tacrolimus 0,1% deux fois quotidiennement constitue la thérapie initiale de référence. La résolution peut nécessiter trois à douze semaines, avec absence de récidive rapportée sur un suivi de deux ans après arrêt du traitement. La monothérapie corticostéroïde topique démontre une efficacité partielle à nulle, bien qu’une association corticostéroïdes topiques et oraux ait été rapportée comme efficace dans un cas isolé.
L’oclacitinib, utilisé hors autorisation de mise sur le marché, a récemment démontré une efficacité remarquable dans deux cas traités respectivement à 1,5 mg/kg et 0,5 mg/kg per os deux fois quotidiennement. La rémission complète a été obtenue en sept à douze semaines. Cependant, l’index thérapeutique sécuritaire n’est pas établi chez les félins, nécessitant une surveillance hématologique étroite compte tenu des niveaux significativement inférieurs de JAK2 dans les cellules félines comparativement aux cellules canines.
Alopécies immuno-médiées
Pseudopelade
Cette affection immuno-médiée rare se caractérise par un tropisme des lymphocytes T CD8+ cytotoxiques vers l’isthme folliculaire. Des titres élevés d’auto-anticorps IgG spécifiques dirigés contre les structures folliculaires inférieures, notamment la trichohyaline et la kératine pilaire, ont été détectés. La destruction des cellules souches du bulge folliculaire entraîne une alopécie définitive.
La présentation clinique débute à l’âge adulte par une alopécie cicatricielle non inflammatoire et non prurigineuse, évoluant en quelques mois selon un pattern partiellement symétrique bilatéral affectant les membres, les pattes, l’abdomen, le tronc ventrolatéral et la face. L’absence de tiges pilaires brisées dans les zones affectées distingue cette condition de l’alopécie auto-induite. L’onychorrhexis et l’onychomadèse peuvent accompagner l’alopécie, témoignant de l’atteinte matricielle unguéale.
Alopécie areata
Une dermatose similaire à l’alopécie areata a été décrite chez un chat domestique à poil court de dix ans présentant une alopécie non inflammatoire de la région ventrale et des membres, accompagnée d’onychomadèse. L’examen histologique et immunohistochimique a révélé une folliculite et périfolliculite murales modérées à sévères au niveau de l’isthme folliculaire, composées de lymphocytes T cytotoxiques. Cette localisation diffère de l’alopécie areata classique, définie par la destruction immuno-médiée du bulbe folliculaire plutôt que de l’isthme.
Chondrite auriculaire
Pathogenèse et manifestations
Cette affection rare se caractérise par l’inflammation et la destruction du cartilage auriculaire, résultant d’un processus immuno-médié ciblant principalement le collagène de type II. Les lésions pavillonnaires incluent gonflement, épaississement, déformation, douleur et érythème intense. L’évolution chronique peut conduire à une coloration violacée et un enroulement des pavillons. L’atteinte bilatérale constitue la présentation habituelle.
L’examen histopathologique révèle inflammation, dégénérescence, nécrose et perte de la coloration basophile de la matrice cartilagineuse, associées à un œdème périchondrial et une prolifération fibrocytaire et endothéliale capillaire. L’infiltrat inflammatoire cartilagineux est prédominamment lymphocytaire avec quelques cellules géantes multinucléées.
Le diagnostic de polychondrite récidivante féline nécessite la documentation histologique d’une chondrite dans au moins deux sites anatomiques différents et/ou l’atteinte d’au moins deux autres organes. Un cas de chat japonais domestique de trois ans présentant une chondrite auriculaire avec modifications chondrales costales, laryngées, trachéales et articulaires a rempli ces critères, bien que la polyarthrite érosive évoque plutôt une polyarthrite chronique progressive féline.
La réponse thérapeutique s’avère variable. La prédnisolone à dose immunosuppressive peut induire une rémission en trois semaines, tandis que la dapsone à 1 mg/kg quotidiennement, avec ou sans corticostéroïdes, a démontré son efficacité dans quatre cas sans récidive après arrêt thérapeutique. La pinnectomie constitue une option curative dans certaines situations. Une amélioration spontanée et une rémission sans traitement ont également été rapportées.
Approches diagnostiques et thérapeutiques intégrées
L’établissement du diagnostic de ces dermatoses immuno-médiées repose sur la combinaison des caractéristiques cliniques, de l’anamnèse et de l’examen histopathologique. La cytologie et les biopsies cutanées constituent les outils diagnostiques les plus précieux pour différencier ces affections des causes infectieuses, allergiques ou néoplasiques mimétiques.
L’existence d’un chevauchement histologique potentiel entre l’érythème polymorphe et le spectre SJS/TEN nécessite une approche diagnostique intégrée. L’interprétation microscopique pathologique devrait se limiter à un diagnostic générique de maladie épidermique nécrosante EM-TEN, la sous-classification ultérieure dépendant de l’anamnèse, des signes cliniques et de l’étendue lésionnelle.
La prise en charge thérapeutique varie selon la sévérité et l’étiologie présumée. L’arrêt immédiat de tout médicament suspect constitue la priorité absolue dans les cas de SJS/TEN. Les traitements immunomodulateurs, incluant ciclosporine, mycophénolate mofétil et corticostéroïdes, représentent les piliers thérapeutiques de la plupart de ces affections. L’évolution clinique et le pronostic diffèrent considérablement selon l’entité pathologique, certaines affections présentant une tendance à la résolution spontanée tandis que d’autres nécessitent un traitement immunosuppresseur prolongé ou constituent de véritables urgences dermatologiques.
Banovic F, Gomes P, Trainor K. Feline immune-mediated skin disorders: part 2. J Feline Med Surg. 2025;27:1-15.