La dermatomiositis (DM) canina es una vasculopatía isquémica inflamatoria, de origen inmunitario y con una fuerte predisposición genética, que afecta principalmente la piel y, en menor grado, la musculatura estriada. Presentamos un punto completo patogénico, diagnóstico y terapéutico sobre esta dermatosis.
Junio 2025
Introducción
Reconocida inicialmente en el Collie y el Pastor de Shetland, esta afección sirve como un modelo espontáneo particularmente relevante para el estudio de la dermatomiositis juvenil (DMJ) humana, una enfermedad autoinmune sistémica que presenta similitudes clínicas e histopatológicas sorprendentes. La DM canina es, por lo tanto, no solo una preocupación clínica para los veterinarios, sino también un valioso campo de investigación traslacional.
En la última década, la comprensión de la DM canina ha experimentado una transformación radical. El concepto de una simple enfermedad hereditaria con transmisión autosómica dominante con penetrancia variable y expresividad inconstante ha sido suplantado por un modelo mucho más matizado de trastorno genético complejo. Los avances en genómica han permitido identificar loci de riesgo específicos y sus interacciones epistáticas, ofreciendo un marco predictivo para la enfermedad. Paralelamente, la investigación fundamental ha puesto de manifiesto el papel central de una desregulación de la vía de señalización del interferón (IFN) de tipo I como principal motor patógeno, similar a lo observado en la DMJ humana. Esta convergencia de conocimientos genéticos e inmunopatológicos ha abierto el camino a enfoques diagnósticos y terapéuticos más específicos, que redefinen el manejo de esta enfermedad en 2025. Presentamos un estado actual de los conocimientos sobre la dermatomiositis canina, integrando los descubrimientos más recientes sobre su patogenia, diagnóstico y estrategias terapéuticas emergentes.
Etiopatogenia
La etiopatogenia de la dermatomiositis canina es el resultado de una interacción compleja entre una predisposición genética poligénica, una desregulación del sistema inmunitario innato y desencadenantes ambientales. La comprensión de esta cascada de eventos, desde el gen hasta la lesión, es fundamental para entender la enfermedad y justificar los enfoques terapéuticos modernos.
1.1 El componente genético de la dermatomiositis canina
La noción histórica de una transmisión autosómica dominante con penetrancia incompleta ha sido refinada por estudios de asociación de genoma completo (GWAS) que han revelado un modelo de herencia complejo y epistático. El riesgo de desarrollar una DM en razas predispuestas, como el Collie y el Pastor de Shetland, se entiende ahora como determinado por la interacción de variantes dentro de tres loci genéticos independientes.
Identificación de los Loci de Riesgo
La investigación ha identificado tres regiones cromosómicas principales cuyos alelos específicos modulan el riesgo de DM.
- Locus A (Cromosoma 10): Se encontró una asociación muy fuerte con una mutación de sentido erróneo en el gen PAN2. El gen PAN2 codifica una subunidad del complejo de deadenilación de la poli(A) nucleasa, que juega un papel crucial en la regulación de la degradación del ARN mensajero (ARNm). Esta función es particularmente importante para la regulación de la respuesta inflamatoria, especialmente mediante la estabilización de los transcritos de genes proinflamatorios que contienen elementos ricos en adenina-uracilo (ARE), como el de la interleucina 6 (IL-6), una citocina conocida por estar sobreexpresada en la DMJ humana. Esta mutación establece así un vínculo directo entre un defecto genético fundamental y una predisposición a la desregulación inmunitaria.
- Locus B (Cromosoma 31): Una segunda asociación significativa ha sido identificada con una inserción/deleción (indel) en una región no codificante 5′ del gen MAP3K7CL. Aunque la función precisa de este gen, que codifica una quinasa, aún no está bien estudiada, se expresa principalmente en los leucocitos de la sangre periférica, lo que sugiere un papel en la función inmunitaria.
- Locus C (CMH Canino): Se ha observado una asociación significativa con un haplotipo específico del complejo mayor de histocompatibilidad (CMH) canino de clase II. La asociación es particularmente fuerte en individuos homocigotos para este haplotipo. Sin embargo, la alta frecuencia de este haplotipo de riesgo en perros sanos indica que no es suficiente por sí solo para causar la enfermedad y que su influencia está modulada por los otros loci de riesgo.
Interacción Epistática y Estratificación del Riesgo
El análisis combinado de los genotipos de estos tres loci ha revelado un modelo de riesgo no simplemente aditivo, sino epistático, donde el efecto de un gen se modifica por la presencia de uno o varios otros genes. Investigaciones han demostrado que 9 de las 27 combinaciones genotípicas posibles confieren un riesgo moderado (penetrancia del 33-50%) o elevado (penetrancia del 90-100%) de desarrollar la DM, explicando así el 93% de los casos estudiados. Por ejemplo, los genotipos AABB (homocigotos para los alelos de riesgo en los loci A y B) presentan una penetrancia del 100% cuando se asocian con al menos un alelo de riesgo en el locus C (AABBCc o AABBCC).
Este descubrimiento transforma la comprensión de la enfermedad. Los antiguos conceptos de “penetrancia incompleta” y “expresividad variable” pueden ahora ser reinterpretados a la luz de este modelo genético cuantitativo. Estas variaciones fenotípicas no son aleatorias, sino que son el reflejo directo del perfil de riesgo poligénico de cada individuo. Un perro con un genotipo de alto riesgo es casi seguro que desarrollará la enfermedad si se expone a los desencadenantes adecuados, mientras que un perro con un genotipo de riesgo moderado puede que nunca exprese la enfermedad o que solo presente signos leves y transitorios. La genética proporciona así un marco predictivo que sustituye la incertidumbre. Esto tiene implicaciones profundas para el asesoramiento genético, que pasa de una simple recomendación de no reproducir perros clínicamente afectados a una estrategia de selección proactiva de parejas reproductoras con el objetivo de minimizar la producción de cachorros portadores de combinaciones genotípicas de alto riesgo.
Correlación Genotipo-Fenotipo
Se ha establecido una correlación inversa significativa entre el número de alelos de riesgo en los loci PAN2 y MAP3K7CL y la edad de aparición de la enfermedad. Los perros portadores de cuatro alelos de riesgo (homocigotos para el riesgo en ambos loci) desarrollan la DM a una edad media de 5 meses, mientras que los que solo tienen dos alelos de riesgo la desarrollan a una edad media de 18,5 meses. Esta correlación sugiere un efecto de dosis génica sobre la gravedad de la predisposición, donde una carga genética más alta requiere un umbral de desencadenamiento ambiental más bajo para iniciar la enfermedad.
Tabla 1: Loci de Riesgo Genético para la Dermatomiositis Canina
|
Nombre del Locus |
Gen Asociado |
Cromosoma |
Alelo Normal (notación) |
Función Biológica Conocida/Hipótetica |
|---|---|---|---|---|
|
Locus A |
PAN2 |
10 |
Wildtype (a) |
Regulación de la degradación del ARNm, estabilización de los transcritos de la respuesta inflamatoria |
|
Locus B |
MAP3K7CL |
31 |
Wildtype (b) |
Quinasa expresada en tejidos inmunológicos, papel potencial en la señalización inmunitaria |
|
Locus C |
DLA-DRB1 |
12 (CMH) |
Otros haplotipos DLA (c) |
Presentación del antígeno, regulación de la respuesta inmunitaria adaptativa |
Tabla 2: Estratificación del Riesgo de DM Basada en el Genotipo (Combinaciones de los Loci A y B, modificadas por el Locus C)
|
Genotipo Locus A / Locus B |
Riesgo con Locus C = cc |
Riesgo con Locus C = Cc |
Riesgo con Locus C = CC |
|---|---|---|---|
|
aa bb |
Bajo |
Bajo |
Bajo |
|
Aa bb |
Bajo |
Bajo |
Bajo |
|
aa Bb |
Bajo |
Bajo |
Bajo |
|
AA bb |
Desconocido |
Moderado |
Moderado |
|
Aa Bb |
Bajo |
Bajo |
Bajo |
|
aa BB |
Bajo |
Moderado |
Moderado |
|
AA Bb |
Desconocido |
Moderado |
Alto |
|
Aa BB |
Desconocido |
Moderado |
Alto |
|
AA BB |
Desconocido |
Alto |
Alto |
|
Tabla adaptada de datos del Laboratorio de Genética Veterinaria de la UC Davis, basados en la investigación de Evans et al. |
|||
1.2 La Cascada de Desregulación Inmunitaria: Vasculopatía e Interferón
La predisposición genética es solo el primer paso. La patogenia de la DM es fundamentalmente una enfermedad del sistema inmunitario que ataca los vasos sanguíneos, lo que provoca isquemia tisular.
La Vasculopatía Isquémica como Lesión Primaria
La DM es ante todo una vasculopatía inflamatoria. El proceso patológico central es un ataque mediado por el sistema inmunológico dirigido contra el endotelio de los pequeños vasos sanguíneos, en particular los capilares endomisiales en los músculos y los vasos de la dermis cutánea. Esta inflamación endotelial, o endotelitis, conduce a un estrechamiento de la luz vascular, una microtrombosis y, finalmente, una hipoperfusión de los tejidos aguas abajo. La isquemia resultante es responsable de las manifestaciones clínicas características: la atrofia y la necrosis de los folículos pilosos y la epidermis (que causan alopecia y ulceración) y la degeneración de las fibras musculares (que causan atrofia y debilidad).
El Interferón (IFN) de Tipo I como Motor Patógeno Central
Evidencia abrumadora, proveniente de modelos humanos y caninos, indica que una hiperactivación de la vía de señalización del interferón de tipo I es el principal motor de esta vasculopatía. Esta “firma de IFN” se manifiesta por una sobreexpresión sistémica y tisular (piel, músculo, sangre) de un conjunto de genes cuya transcripción es inducida por el IFN, tales como MXA, ISG15 y CXCL10. La fuerza de esta firma en la piel se correlaciona directamente con la actividad de la enfermedad cutánea y disminuye o desaparece en los pacientes en remisión, lo que la convierte en un biomarcador potencial de la actividad de la enfermedad. Los interferones de tipo I tienen efectos pleiotrópicos que pueden explicar la vasculopatía: pueden activar las células endoteliales, favorecer un estado proinflamatorio y protrombótico, y reclutar células inmunitarias en el sitio de la inflamación, perpetuando así el daño vascular.
Papel de los Autoanticuerpos y los Inmunocomplejos Circulantes (CIC)
Aunque la investigación de autoanticuerpos específicos de miositis está menos avanzada en perros que en humanos, estudios anteriores han establecido una correlación positiva entre la gravedad clínica de la DM canina y los niveles séricos de inmunocomplejos circulantes (CIC) e inmunoglobulinas G (IgG). Se postula que estos CIC pueden depositarse en la pared de los microvasos, activando allí la cascada del complemento y contribuyendo así a la endotelitis y la vasculopatía.
La convergencia de estos datos permite establecer una cadena causal unificada que no era evidente hace una década. Primero, una predisposición genética, especialmente a través de mutaciones en genes reguladores de la inflamación como PAN2, crea un terreno fértil para una respuesta inmunitaria aberrante. Segundo, en presencia de desencadenantes, esta predisposición conduce a una producción excesiva y sostenida de IFN de tipo I, el mecanismo central de la enfermedad. Tercero, este entorno rico en IFN induce una vasculopatía al dañar directamente las células endoteliales. Cuarto, la vasculopatía compromete el flujo sanguíneo, provocando isquemia en los tejidos vulnerables. Finalmente, esta isquemia se manifiesta clínicamente por las lesiones cutáneas y musculares características de la DM. Esta comprensión unificada de la patogenia justifica plenamente el cambio de paradigma terapéutico actual, que se aleja de los inmunosupresores generales para centrarse en terapias que atacan y bloquean específicamente la vía de señalización del IFN.
1.3 Factores Desencadenantes Ambientales y Endógenos
En un individuo genéticamente predispuesto, a menudo son necesarios factores desencadenantes para iniciar o exacerbar la enfermedad.
- Factores de Riesgo Documentados: Se sabe que varios factores desempeñan un papel en el desencadenamiento de los brotes clínicos.
-
- Traumatismos Mecánicos: La localización típica de las lesiones en las prominencias óseas (cara, carpos, tarsos) y los puntos de presión sugiere fuertemente que los microtraumatismos repetidos actúan como un desencadenante local, un fenómeno de Koebner.
- Exposición a los Rayos Ultravioleta (UV): La fotodistribución de algunas lesiones faciales y el agravamiento reportado después de la exposición al sol implican a los UV como un factor desencadenante importante, probablemente al inducir la apoptosis de los queratinocitos y liberar autoantígenos.
- Factores Hormonales: Se han asociado brotes de la enfermedad con el estro, lo que sugiere una influencia hormonal en la regulación inmunitaria.
- El Papel de la Vacunación: El vínculo entre la vacunación y la DM es un tema de debate importante. Existe un síndrome bien reconocido de dermatopatía isquémica postvacunal, particularmente después de la administración de la vacuna antirrábica, que es clínicamente e histológicamente indistinguible de la DM. Un estudio retrospectivo de 177 casos de dermatopatía isquémica estimó que una asociación con una vacunación reciente era probable en el 48,3% de los casos. En lugar de considerar la dermatopatía postvacunal como una entidad completamente distinta, es más lógico verla como la DM genética desenmascarada por el potente estímulo inmunitario que representa la vacunación. Para un cachorro portador de un genotipo de alto riesgo (por ejemplo, AABB), la intensa estimulación inmunitaria inducida por una vacuna podría ser la “prueba de estrés” suficiente para iniciar la cascada patógena del IFN y desencadenar la enfermedad clínica. Esto tiene implicaciones clínicas importantes: para los cachorros de razas en riesgo con un estado genético desconocido o de alto riesgo, no se trata de evitar la vacunación, sino de informar a los propietarios y de establecer una estrecha vigilancia para detectar la aparición de lesiones cutáneas en las semanas y meses siguientes a las inyecciones, a fin de permitir una intervención temprana.
Espectro Clínico y Enfoque Diagnóstico
La presentación clínica de la DM canina es variable, desde formas cutáneas leves y autolimitadas hasta afectaciones sistémicas graves. El diagnóstico se basa en un enfoque multimodal que combina la anamnesis, los signos clínicos y los exámenes complementarios específicos.
2.1 Predisposición Racial y Clasificación de la Enfermedad
- DM Familiar: El Collie y el Pastor de Shetland son las razas emblemáticas de la enfermedad, en las que se ha demostrado una base hereditaria y se han identificado los loci de riesgo genético.
- Síndromes tipo DM (Dermatomiositis-like): Se han descrito cuadros clínicos e histológicos similares en un número creciente de otras razas, incluidos el Beauceron, el Welsh Corgi, el Lakeland Terrier, el Chow Chow, el Pastor Alemán y el Kuvasz.
La distinción histórica entre “DM familiar” (en razas predispuestas) y “DM-like” (en otras razas) se considera cada vez más semántica en lugar de biológica. La histopatología subyacente es idéntica, lo que sugiere vías patógenas comunes. El término “dermatopatía isquémica” es un diagnóstico histopatológico más preciso y unificador que engloba estas diferentes presentaciones clínicas. Por lo tanto, el enfoque diagnóstico moderno no debe detenerse en la raza, sino más bien buscar marcadores genéticos y patológicos de la enfermedad en cualquier perro que presente un cuadro clínico compatible, independientemente de su raza.
2.2 Manifestaciones Clínicas
Los signos clínicos de la DM varían considerablemente de un individuo a otro, pero generalmente siguen un patrón reconocible.
Signos Cutáneos
La afectación cutánea es la manifestación más constante de la enfermedad.
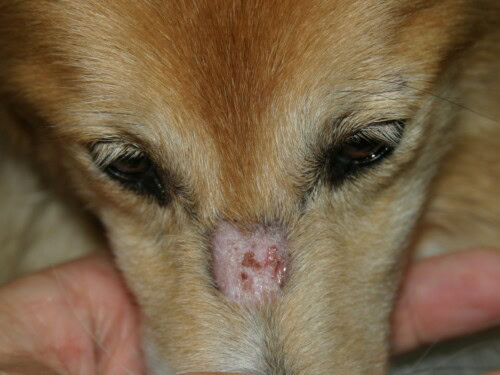
- Lesiones Iniciales: Suelen aparecer en perros jóvenes, antes de los 6 meses, y a menudo a las 7-11 semanas. La presentación inicial puede ser sutil, con pápulas, pústulas o vesículas transitorias que rápidamente evolucionan a lesiones más características de eritema, alopecia, escamas y costras.
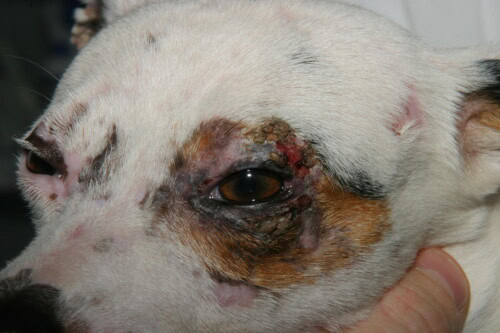
- Distribución Característica: Las lesiones tienen predilección por las zonas de traumatismo y de escasa circulación colateral: la cara (regiones periocular y peribucal, puente nasal), el pabellón auricular (especialmente la punta y los pliegues), el extremo de la cola y la piel sobre las prominencias óseas de las extremidades (carpos, tarsos, dedos).
- Lesiones Crónicas: Con el tiempo, las lesiones evolucionan hacia una alopecia cicatricial permanente, atrofia cutánea y alteraciones pigmentarias (hiperpigmentación o hipopigmentación), creando un aspecto moteado llamado poiquilodermia. También puede observarse afectación de las uñas (onicodistrofia, onicorrexis, onicosquizia).
Afectación severa de la cola con alopecia y lesiones con costras
Afectación palpebral esencialmente unilateral en este perro
Lesión que puede imitar perfectamente una dermatofitosis
Signos Miopáticos
La afectación muscular es más variable y, cuando es clínicamente aparente, generalmente es signo de una forma más grave de la enfermedad.
- Correlación con los Signos Cutáneos: La miositis clínica suele aparecer después de las lesiones cutáneas, y su gravedad suele ser proporcional a la de la afectación dermatológica.
- Atrofia Muscular: La atrofia de los músculos masticatorios (temporal y masetero) es el signo muscular más frecuente y puede ser la única manifestación miopática. En los casos más graves, puede desarrollarse una atrofia bilateral simétrica de los músculos de la cabeza, el cuello, el tronco y las extremidades.
- Signos Funcionales: La atrofia y la inflamación de los músculos de la masticación y la deglución pueden provocar dificultades para coger la comida (aprehensión), masticar y tragar (disfagia). También se describe una marcha anormal, rígida y pomposa (“stiff-stilted gait” o “marcha de ganso”).
- Complicaciones Graves: El desarrollo de un megaesófago (dilatación e hipomotilidad del esófago) es una complicación grave, que provoca regurgitaciones, pérdida de peso y un alto riesgo de neumonía por aspiración, una causa frecuente de mortalidad en las formas graves de DM.
2.3 Diagnóstico de Certeza: Una Estrategia Multimodal
El diagnóstico de la DM nunca se basa en una sola prueba, sino en la convergencia de varios elementos, después de haber excluido los diagnósticos diferenciales comunes como la demodicosis, la piodermia bacteriana, la dermatofitosis y el lupus eritematoso discoide.
- Histopatología (Piedra Angular): La biopsia es el examen clave para confirmar la naturaleza isquémica de las lesiones.
-
- Biopsia Cutánea: Tomada de una lesión reciente y activa, revela cambios característicos de dermatopatía isquémica: una dermatitis de interfase paucicelular (con pocas células inflamatorias), atrofia de los folículos pilosos, vacuolización de los queratinocitos de la capa basal de la epidermis, presencia de células apoptóticas (cuerpos de Civatte), y fibrosis o acumulación de mucina en la dermis. Los cambios vasculares pueden ser sutiles, manifestándose como un aspecto “borroso” y eosinofílico del colágeno perivascular (“colágeno manchado”) en lugar de una vasculitis necrotizante evidente.
- Biopsia Muscular: Aunque menos sistemáticamente realizada de forma rutinaria, está indicada en caso de sospecha de afectación miopática. Muestra típicamente una miositis intersticial y perivascular, predominantemente linfocitaria, plasmocitaria e histiocitaria, asociada a signos de sufrimiento de las fibras musculares (degeneración, necrosis, regeneración y atrofia).
- Electrodiagnóstico (EMG): La electromiografía es una herramienta muy sensible para detectar una miopatía, incluso en ausencia de signos clínicos evidentes. El examen, realizado bajo anestesia, revela actividades eléctricas espontáneas anormales en los músculos afectados, como potenciales de fibrilación, ondas puntiagudas positivas y descargas de alta frecuencia extrañas o miotónicas.
- Pruebas Genéticas: Para Collies, Pastores de Shetland y sus cruces, la prueba de los tres loci de riesgo (PAN2, MAP3K7CL, DLA) se ha convertido en una herramienta diagnóstica y pronóstica esencial. Permite confirmar la predisposición genética y estratificar el riesgo del animal (bajo, moderado o alto), lo que ayuda a orientar el asesoramiento a los propietarios.
- Bioquímica Clínica: La medición de la creatina cinasa (CK) sérica es útil. Una elevación marcada es un indicador de miositis activa y daño muscular. Sin embargo, un valor normal de CK no excluye el diagnóstico, ya que la afectación muscular puede ser mínima, focal o crónica con poca inflamación activa.
Tabla 3: Modalidades Diagnósticas para la Dermatomiositis Canina
|
Modalidad Diagnóstica |
Resultados Esperados / Anomalías Clave |
|---|---|
|
Histopatología Cutánea |
Dermatitis de interfase paucicelular, atrofia folicular, vacuolización basal, cuerpos de Civatte, fibrosis/mucinosis dérmica, “colágeno manchado” |
|
Histopatología Muscular |
Miositis intersticial y perivascular (linfo-plasmocitaria), degeneración/regeneración/atrofia de las fibras musculares |
|
Electromiografía (EMG) |
Actividad espontánea anormal: potenciales de fibrilación, ondas puntiagudas positivas, descargas miotónicas/bizaras de alta frecuencia |
|
Prueba Genética (3 loci) |
Identificación de los alelos de riesgo en los loci PAN2, MAP3K7CL y DLA; cálculo de una puntuación de riesgo (Bajo, Moderado, Alto) |
|
Bioquímica (Creatina Cinasa) |
Elevación (a menudo marcada) en caso de miositis activa, pero puede ser normal en formas crónicas o con poca afectación muscular |
Estrategias Terapéuticas y Gestión en 2025
Pronóstico y Evolución a Largo Plazo
El pronóstico de la DM canina es muy variable y depende de una multitud de factores. La comprensión de estos indicadores y de los perfiles evolutivos de la enfermedad es esencial para proporcionar a los propietarios expectativas realistas y para adaptar el manejo a largo plazo.
4.1 Indicadores Pronósticos: Predecir el Futuro
Varios factores permiten estimar la evolución probable de la enfermedad en un perro determinado.
- Factores Clínicos:
-
- Gravedad de la Enfermedad: Es el factor pronóstico más directo. Los casos leves, con solo unas pocas lesiones cutáneas no ulceradas, tienen un pronóstico excelente e incluso pueden entrar en remisión espontánea sin secuelas. Los casos moderados tienen un buen pronóstico de control, pero a menudo con una alopecia cicatricial residual. Los casos graves, con ulceraciones extensas y/o una afectación muscular significativa, tienen un pronóstico de reservado a malo.
- Afectación Muscular y Esofágica: La presencia de una miopatía clínicamente significativa, y en particular el desarrollo de un megaesófago, oscurece considerablemente el pronóstico. El riesgo de desnutrición, de aspiración y de neumonía por aspiración se convierte en una amenaza vital importante.
- Factores Demográficos: Un estudio retrospectivo de 177 casos de dermatopatía isquémica (excluyendo la DM familiar clásica) identificó dos factores asociados con una evolución menos favorable: un peso corporal inferior a 10 kg y una edad más avanzada en el momento de la biopsia.
- Factor Genético: La integración del perfil de riesgo genético (basado en los 3 loci) en la evaluación pronóstica representa un avance importante. Esta prueba permite pasar de un pronóstico reactivo, basado en los signos clínicos ya presentes, a un pronóstico proactivo y predictivo. Un cachorro Collie o Shetland que se somete a la prueba al nacer y revela un genotipo de alto riesgo (ej: AABBCC) tiene un pronóstico intrínsecamente más reservado, incluso antes de la aparición del menor signo clínico. Se predice que desarrollará la enfermedad más precozmente y potencialmente de forma más grave. Esta información permite una estratificación temprana de los pacientes y la implementación de una vigilancia reforzada y una estrategia de intervención terapéutica agresiva desde los primeros signos, lo que podría mejorar el resultado a largo plazo.
4.2 Evolución de la Enfermedad y Manejo a Largo Plazo
Por analogía con la DMJ humana, la DM canina puede seguir diferentes patrones evolutivos a lo largo del tiempo.
- Perfiles Evolutivos:
-
- Monocíclico: La enfermedad se manifiesta por un único episodio, a menudo en animales levemente afectados, que entra en remisión completa (a veces espontáneamente) y no recurre. El pronóstico es excelente.
- Policíclico: La enfermedad evoluciona por brotes, con períodos de remisión intercalados con recaídas. Estos brotes suelen ser iniciados por factores desencadenantes (exposición a los rayos UV, traumatismos, estro). El manejo tiene como objetivo controlar los brotes y prolongar los períodos de remisión.
- Crónico-continuo: La enfermedad permanece activa de forma persistente, sin período de remisión completa. Estos casos requieren tratamiento de por vida y están asociados con el pronóstico más reservado.
- Manejo Crónico: El manejo de las formas crónicas (policíclicas o continuas) es un desafío. El objetivo es mantener la enfermedad bajo control con la dosis mínima eficaz de medicamentos para limitar los efectos secundarios acumulativos. El uso de agentes ahorradores de esteroides (como la ciclosporina) y, cada vez más, de terapias dirigidas como los inhibidores de JAK, es el centro de esta estrategia. Un seguimiento clínico y biológico regular es indispensable para ajustar el tratamiento y controlar la aparición de complicaciones, incluido un riesgo potencialmente mayor de enfermedad renal en perros que sufren de inflamación crónica a largo plazo.
Conclusión
En 2025, la dermatomiositis canina ha pasado de ser una enfermedad hereditaria enigmática a un trastorno genético complejo cuyos mecanismos moleculares se comprenden cada vez mejor. El reconocimiento de su etiopatogenia, centrada en una vasculopatía isquémica impulsada por una desregulación de la vía del interferón de tipo I y sustentada por interacciones genéticas específicas, ha transformado su enfoque clínico.
Este cambio de paradigma tiene implicaciones profundas y concretas. El diagnóstico ha evolucionado para integrar las pruebas genéticas como un pilar esencial junto con la histopatología y la electromiografía, lo que permite una estratificación temprana del riesgo y un pronóstico más preciso. En el plano terapéutico, el arsenal se ha enriquecido, pasando de inmunosupresores de amplio espectro, eficaces pero con efectos secundarios, a terapias dirigidas que bloquean específicamente las vías patógenas identificadas. El uso de inhibidores de Janus Cinasa, en particular, representa la nueva frontera del tratamiento, ofreciendo la esperanza de un control más eficaz y seguro de la enfermedad.
Las futuras perspectivas de investigación son claras. Deberán centrarse en la identificación de loci de riesgo en otras razas caninas, la validación a gran escala de la eficacia y seguridad a largo plazo de las terapias dirigidas mediante ensayos clínicos aleatorizados, y el desarrollo de biomarcadores sanguíneos (como la firma de IFN) para un seguimiento no invasivo de la actividad de la enfermedad y una mayor personalización del tratamiento. El modelo canino de la dermatomiositis, por su relevancia y complejidad, seguirá siendo un recurso inestimable para avanzar en la comprensión y el tratamiento de esta invalidante enfermedad, tanto para el bienestar de los perros como para los conocimientos que aporta a la medicina humana.
Referencias
- Evans, J. M., Noorai, R. E., Tsai, K. L., Starr-Moss, A. N., Hill, C. M., Anderson, K. J., Famula, T. R., & Clark, L. A. (2017). Beyond the MHC: A canine model of dermatomyositis shows a complex pattern of genetic risk involving novel loci. PLOS Genetics, 13(2), e1006604.
- Hargis, A. M., Prieur, D. J., Haupt, K. H., Collier, L. L., & Evermann, J. F. (1985). Familial canine dermatomyositis. Initial characterization of the cutaneous and muscular lesions. American Journal of Pathology, 121(3), 521–530.
- Rees, C. A., & Boothe, D. M. (2003). Therapeutic response to pentoxifylline and its active metabolites in dogs with familial canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234–241.
- Hargis, A. M., Prieur, D. J., Haupt, K. H., McDonald, T. L., & Moore, M. P. (1986). Prospective study of familial canine dermatomyositis. Correlation of the severity of dermatomyositis and circulating immune complex levels. American Journal of Pathology, 123(3), 465–479.
- Hargis, A. M., & Ginn, P. E. (2001). Canine inflammatory myopathies: a clinicopathologic review of 200 cases. Veterinary Pathology, 38(6), 688-699.
- Hargis, A. M., Haupt, K. H., Hegreberg, G. A., Prieur, D. J., & Moore, M. P. (1984). Familial canine dermatomyositis. Initial characterization of the cutaneous and muscular lesions. American Journal of Pathology, 116(2), 234–244.
- Hargis, A. M., & Prieur, D. J. (1987). Prospective study of familial canine dermatomyositis. Correlation of the severity of dermatomyositis and circulating immune complexes. American Journal of Pathology, 128(1), 129–139.
- Pumphrey, S. A., & Outerbridge, C. A. (2019). The role of oclacitinib in the management of ischaemic dermatopathy in four dogs. Veterinary Dermatology, 30(4), 346-e100.
- Mandrioli, L., & Biserni, R. (2024). A case of refractory nasal dermatomyositis-like disease in an adult Poodle. ResearchGate.
- Errante, P. R. (2022). Dermatomyositis Disease in Dogs. International Journal of Zoology and Animal Biology, 5(8).
- Mendoza, F., & Toral, M. (2019). Three Cases of Canine Dermatomyositis-Like Disease. Acta Scientiae Veterinariae, 47, 1632.
- Mellett, M., & Allen, A. G. (2018). Dermatomyositis etiopathogenesis: a rebel soldier in the muscle. Current Opinion in Rheumatology, 30(6), 610–616.
- Marie, I., Drouot, L., Menard, J. F., & Levesque, H. (2006). Long-term outcome and prognostic factors of juvenile dermatomyositis: a multinational, multicenter study of 490 patients. Arthritis and Rheumatism, 54(11), 3683–3692.
- Kmieć, P., & Gomułkiewicz, A. (2021). The role of interferons type I, II and III in myositis: A review. Clinical and Experimental Rheumatology, 39(4), 882-890.
- Greenberg, S. A., & Pinkus, J. L. (2011). A broad molecular profile of dermatomyositis skin reveals prominent interferon-inducible gene expression and demonstrates molecular similarity to lupus skin. PLoS ONE, 6(12), e29161.
- Berger, D. (2016). Canine Dermatomyositis. Clinician’s Brief, 14(11), 50-52.
- Ghafour, A., & Isenberg, D. A. (2020). The immunopathogenesis of dermatomyositis. Best Practice & Research Clinical Rheumatology, 34(4), 101533.
- Mandell, D. C., & Dehghanpir, S. D. (2021). An update on the diagnosis and treatment of inflammatory myopathies. Journal of Clinical Medicine, 10(15), 3381.
- Main-Nolton, A., & Clark, L. A. (2022). Transcriptome Profiling of Canine Familial Dermatomyositis (DMS) Skin Lesions and Treatment in Collies and Shetland sheepdogs. VIN.
- Santoro, D., & Pucheu-Haston, C. M. (2014). Effects of pentoxifylline on in vivo and in vitro IgE-mediated mast cell degranulation and cutaneous inflammation in dogs. American Journal of Veterinary Research, 75(2), 152–158.
- Olivry, T., & Banovic, F. (2019). Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Diseases of Animals (ICADA). Veterinary Dermatology, 30(3), 169-e50.
- Cosgrove, S. B., Cleaver, D. M., King, V. L., Gilmer, A. R., Daniels, A. E., Wren, J. A., & Stegemann, M. R. (2013). A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis. Veterinary Dermatology, 25(2), 91-e23.
- Gortel, K. (2006). What’s new in dermatologic therapy? DVM360.
- Rees, C. A., & Boothe, D. M. (2004). Therapeutic response to pentoxifylline and its active metabolites in dogs with familial canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234-241.
- Archer, T. M., & Boothe, D. M. (2004). Cyclosporine: a review of its use in veterinary dermatology. Veterinary Dermatology, 15(6), 349–361.
- Robson, D. C. (2014). Cyclosporine in Veterinary Dermatology. Proceedings of the 39th World Small Animal Veterinary Association World Congress.
- Alexishcheva, A., & Guryeva, S. (2024). Interferon signature as a biomarker of skin disease activity in patients with refractory juvenile dermatomyositis. Frontiers in Medicine, 11, 1214920.
- Navale, S., & De, A. (2024). Clinical Progress in Mesenchymal Stem Cell Therapy: A Focus on Rheumatic Diseases. ResearchGate.
- de Mello, M. F., & Hagiwara, M. K. (2007). Canine ischaemic dermatopathy: a retrospective study of 177 cases (2005-2016). Veterinary Dermatology, 28(5), 485-e117.
- Gury, T., & Seror, R. (2024). Prognostic factors and long-term outcome in dogs diagnosed with primary and secondary immune thrombocytopenia in Ireland. Journal of Small Animal Practice.
- Fantini, D., & Ciliberto, G. (2022). Novel Management of Masticatory Myositis in Three Dogs with a Selective Janus Kinase (JAK)-1 Inhibitor. ResearchGate.
- Masi, G., & D’Alessandro, A. (2024). Recent advances in research on dermatomyositis. Uptocure.
- Ardalan, K., & Marques, M. C. (2025). Psychometric properties of patient-reported outcomes measurement information system (PROMIS) fixed short forms in Juvenile Myositis. Seminars in Arthritis and Rheumatism, 71.
- Bartels, C., & Putterman, C. (2022). Juvenile dermatomyositis: updates in pathogenesis and biomarkers. Current Rheumatology Reports, 24(10), 307-317.
- Ziskin, J., & Fiorentino, D. (2024). Recent advances in the treatment of dermatomyositis. Current Opinion in Rheumatology, 36(3), 203-210.
- Mandl, T., & Lundberg, I. E. (2019). The role of interferons type I, II and III in myositis: A review. Clinical and Experimental Rheumatology, 37(5), 868-877.
- van der Kooi, A. J., & van de Vlekkert, J. (2023). An inflammatory myopathy in the Dutch Kooiker dog: a study of 119 cases. Journal of Veterinary Internal Medicine, 37(2), 643-653.
- Viviano, K. R. (2016). Cyclosporine: a review of its use in veterinary medicine. Veterinary Clinics of North America: Small Animal Practice, 46(2), 245-265.
- Nuttall, T., & Gey, van Pittius, M. (2023). Immunosuppressant Therapy in Small Animal Medicine. Today’s Veterinary Practice.
Recherches Connexes
dermatomiositis canina, dermatomiositis, clínica veterinaria, perro, casos, en perros, enfermedad, chow chow, razas, signos clínicos, tratamiento, dermatología, shetland, dermatomiositis familiar, piel, dermatosis, collie, músculos, éric guaguère, dermatomiositis en, síntomas, emmanuel bensignor, enrojecimientos, consulta, causa, extremidades, lesiones, enfermedad autoinmune, 6p24.1 6p25.3, pelo, pérdida, artículo, lupus eritematoso, cachorros, examen clínico, cara, orejas, plan, animales, afección, dedos, veterinario, manejo, diagnóstico, sistema inmunitario, forma, diagnóstico diferencial, casa, resumen, edad, bienestar, investigación, examen, modo, hecho, laboratorio, signos, expresividad, tipo, alimentación, piel y músculos, información, dermatopatías