Las dermatozoonosis constituyen un grupo diverso de afecciones cutáneas transmisibles entre los animales vertebrados y el hombre. Estas patologías, aunque relativamente raras en comparación con el conjunto de zoonosis conocidas, representan un riesgo sanitario significativo, en particular en el contexto urbano donde la promiscuidad con los animales de compañía se intensifica.
El veterinario clínico, en la interfaz entre la salud animal y la salud humana, desempeña un papel crucial en la detección, el tratamiento y la prevención de estas afecciones.
La estrecha relación entre el hombre y el animal, si bien aporta innegables beneficios psicológicos y sociales, también expone a los propietarios y profesionales en contacto con los animales a diversos agentes patógenos transmisibles. Estas dermatozoonosis, de origen micótico, parasitario, bacteriano o viral, requieren una vigilancia particular y un enfoque colaborativo entre médicos y veterinarios para un manejo óptimo de los pacientes, ya sean de dos o cuatro patas.
Definición y clasificación de las dermatozoonosis
Las dermatozoonosis representan un subconjunto específico del vasto campo de las zoonosis. Se definen como enfermedades o infecciones transmisibles naturalmente de los animales vertebrados al hombre, y viceversa, que se manifiestan clínicamente en el ser humano por lesiones cutáneas, con la excepción de las reacciones alérgicas generalizadas. Este término deriva de las raíces griegas “zoo” (animal) y “nosos” (enfermedad), conceptualizado por Virchow en el siglo XIX, y luego precisado por la Organización Mundial de la Salud en 1959.
En el medio urbano, los principales vertebrados responsables de estas afecciones son los animales de compañía: carnívoros domésticos como el perro y el gato, pero también roedores y lagomorfos cada vez más presentes en nuestros hogares. Las poblaciones expuestas incluyen no solo a los dueños de mascotas, sino también a diversas profesiones de riesgo: veterinarios y su personal, criadores, peluqueros caninos y otros profesionales en contacto regular con estos animales.
Clasificación según las modalidades de transmisión
La Organización Mundial de la Salud propone una clasificación de las zoonosis en cuatro categorías distintas, basada en sus modalidades de transmisión:
- Ortozoonosis o zoonosis directa: El agente causal necesita una sola especie de vertebrados para su mantenimiento, aunque puede afectar a varias especies. Esta especie permite la transmisión al hombre. La mayoría de las zoonosis infecciosas clásicas como la rabia, el carbunco o la brucelosis pertenecen a esta categoría.
- Ciclozoonosis: En este caso, el ciclo biológico implica varias especies de vertebrados, pero solo una de ellas es responsable de la contaminación humana. La equinococosis ilustra perfectamente este proceso, con su ciclo que involucra al perro y los herbívoros, donde el perro actúa como contaminador del hombre.
- Metazoonosis: Esta categoría requiere el paso por un invertebrado, generalmente un artrópodo, que permite la transmisión al hombre. Las arbovirosis como la fiebre amarilla (mantenida en monos y marsupiales y luego transmitida al hombre por un mosquito), las rickettsiosis y la leishmaniosis entran en esta clasificación.
- Saprozoonosis: Estas afecciones requieren el paso del agente causal al medio exterior. La fascioliasis ilustra este mecanismo, con la maduración de las cercarías responsables de la dermatosis furcocercariana.
Esta clasificación sistemática permite una mejor comprensión de los ciclos epidemiológicos y, por lo tanto, favorece la implementación de estrategias de prevención adaptadas a cada tipo de transmisión.
Dermatozoonosis de origen micótico
Las infecciones fúngicas transmisibles entre el animal y el hombre constituyen un capítulo importante de las dermatozoonosis. Estas afecciones, principalmente representadas por las dermatofitosis y la esporotricosis, merecen una atención particular debido a su prevalencia y su impacto potencial en la salud humana.
Las dermatofitosis
Las dermatofitosis, comúnmente llamadas “tiñas”, representan micosis superficiales infecciosas causadas por hongos epidermotróficos, queratinofílicos y queratinolíticos, los dermatofitos. Estos hongos tienen la particularidad de alimentarse de queratina, una proteína constitutiva de estructuras superficiales como el cabello, el pelo, las uñas y la capa córnea de la epidermis.
Los dermatofitos zoofílicos, de origen animal, constituyen una fuente importante de dermatozoonosis. Se deben considerar tres especies principales:
- Microsporum canis: El principal reservorio es el gato (más raramente el perro, especialmente la raza Yorkshire terrier, y otros pequeños mamíferos). Esta especie es responsable de aproximadamente el 95% de las dermatofitosis felinas y el 65% de los casos caninos.
- Trichophyton mentagrophytes: Su reservorio está constituido por roedores, lagomorfos y équidos. El porcentaje de portadores asintomáticos varía considerablemente según la especie: aproximadamente el 15% en el cobaya, del 10 al 40% en el conejo, y cerca del 50% en el ratón y la rata.
- Trichophyton verrucosum: Principalmente encontrado en rumiantes.
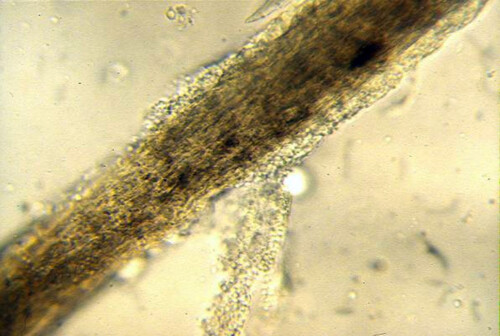
Pelo tiñoso
La mayoría de los dermatofitos presentan una estrecha adaptación a una especie objetivo, en la que generalmente causan pocos signos clínicos. En el gato, por ejemplo, la incidencia de portadores asintomáticos de M. canis ronda el 10%, pero puede alcanzar porcentajes mucho más altos en gatos callejeros o en ciertas razas como los persas. De forma alarmante, aproximadamente el 50% de las personas en contacto con un gato infectado, ya sea portador asintomático o clínicamente enfermo, desarrollan lesiones cutáneas.
Presentación clínica en animales
En el gato, las lesiones clásicas de M. canis se caracterizan por depilaciones únicas o multicéntricas, eritematosas, no pruriginosas, escamosas, con extensión centrífuga. Las localizaciones preferentes son la cara, las orejas y las extremidades podales. Un diagnóstico tardío puede revelar una alopecia loco-regional o generalizada, a veces acompañada de inflamación pruriginosa. En algunos casos, solo se observa un estado queratoseborreico dorso-lumbar. Las onicomicosis por M. canis son raras, mientras que los micetomas se encuentran exclusivamente en individuos inmunodeprimidos y en la raza persa.
En el perro, además de M. canis, se encuentran otras tres especies: T. mentagrophytes, M. persicolor (ambos agentes zoofílicos) y M. gypseum (agente geofílico). Existen ciertas predisposiciones raciales: los Yorkshire terriers parecen particularmente vulnerables a las tiñas generalizadas por M. canis, mientras que los terriers (Fox terrier y otros perros de caza de madriguera) presentan una mayor susceptibilidad a las dermatofitosis faciales causadas por T. mentagrophytes y M. persicolor.
La mayoría de los perros afectados presentan lesiones clásicas: depilaciones únicas o multicéntricas, redondeadas, ligeramente escamosas, de evolución centrífuga, generalmente poco pruriginosas. Las localizaciones preferentes son la cara y el extremo distal de las extremidades. Los queriones (lesiones inflamatorias nodulares supurativas) se observan regularmente, particularmente con T. mentagrophytes.
En roedores y lagomorfos, cada vez más populares como mascotas, el agente casi exclusivo es T. mentagrophytes, más raramente M. canis. Clínicamente, las dermatofitosis se manifiestan por depilaciones centrífugas, a menudo pruriginosas y muy inflamatorias.
Diagnóstico de dermatofitosis
El diagnóstico se basa en un enfoque multifacético:
- Examen con lámpara de Wood: Se observa una fluorescencia verde típica de los pelos contaminados en el 50% de los casos de M. canis. Sin embargo, esta técnica requiere cierta experiencia para distinguir la fluorescencia específica de las fluorescencias artificiales.
- Examen microscópico directo de pelos y escamas: Puede revelar una alteración del tallo piloso, revestido por manguitos de esporas (invasión pilosa de tipo endoectothrix en el caso de M. canis).
- Cultivo micológico: Permite la identificación definitiva del dermatofito responsable. En los portadores asintomáticos, la toma de muestras se puede realizar cepillando toda la superficie corporal con un cepillo de dientes estéril o un trozo de alfombra estéril, y luego cultivando en agar Sabouraud.
Tratamiento y prevención
El tratamiento es imperativo, aunque la curación espontánea es posible (aunque puede tardar varios meses o incluso años). La eficacia terapéutica depende de la consideración de dos factores esenciales:
- La alta contagiosidad de las dermatofitosis
- La resistencia prolongada de las esporas en el medio ambiente (varios años)
El enfoque terapéutico combina:
- Tratamiento tópico: rapado (discutido según los casos), champús y baños a base de enilconazol o miconazol asociado a clorhexidina
- Tratamiento sistémico: griseofulvina, ketoconazol, itraconazol
- Tratamiento del medio ambiente: enilconazol o lejía
El tratamiento debe continuarse hasta la curación micológica confirmada por la negativización de los cultivos, con dos controles negativos espaciados por un mes. En la cría, el principal problema sigue siendo la recontaminación permanente debido a la importante carga de esporas en el medio ambiente, lo que hace que la erradicación sea prácticamente imposible a pesar de los vacíos sanitarios. Idealmente, en las granjas libres de la enfermedad, todo animal nuevo debe ponerse en cuarentena hasta obtener un cultivo micológico negativo.
Impacto en el ser humano
En el ser humano, las dermatofitosis de origen animal se caracterizan por un polimorfismo clínico notable:
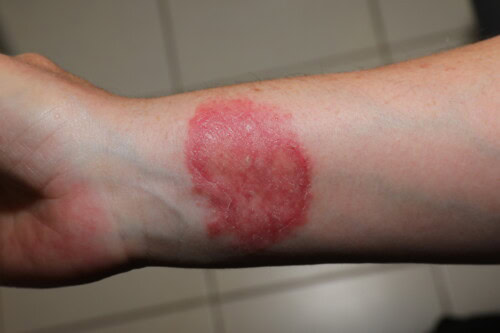
- Lesiones eritemato-escamosas del cuero cabelludo (principalmente debidas a M. canis)
- Lesiones circulares eritemato-escamosas de las zonas lampiñas, a menudo policíclicas con borde vesículo-escamoso (M. canis, T. mentagrophytes)
- Lesiones costrosas y dolorosas con reacción inflamatoria grave (querion) del cuero cabelludo, la nuca o la barba (sicosis), principalmente causadas por T. mentagrophytes, más raramente por M. canis
Contaminación humana por la tiña
Es importante señalar que la tiña figura en la tabla n.º 46 de enfermedades profesionales (micosis cutáneas). Según el Código de Trabajo y las directivas europeas, las obligaciones del empleador se refieren a la prevención de riesgos profesionales, medidas reglamentarias específicas, medidas de higiene y seguridad, así como a la vigilancia médica.
La esporotricosis
La esporotricosis representa una micosis profunda con un alto potencial zoonótico, causada por un hongo dimórfico, Sporothrix schenckii. Este patógeno presenta una característica notable: existe en forma filamentosa en el medio ambiente circundante (vegetales en descomposición, humus, suelo) y se transforma en levadura después de la penetración en los tejidos del huésped tras una lesión cutánea.
Modos de contaminación
Si bien las picaduras y heridas por elementos vegetales contaminados constituyen el modo de contaminación clásico, el gato infectado representa una fuente de contaminación particularmente preocupante. De hecho, los dueños de animales, los veterinarios y su personal se exponen a un riesgo significativo por contacto entre sus lesiones cutáneas preexistentes y los exudados durante la manipulación del animal enfermo.
Una característica distintiva de esta infección es la diferencia en la carga fúngica según la especie huésped: en el perro o el hombre, el agente fúngico está presente en cantidades restringidas en las lesiones, mientras que en el gato, los elementos fúngicos alcanzan concentraciones extremadamente altas. La transmisión al hombre se realiza principalmente por traumatismo cutáneo: mordedura o arañazo de gato contaminado.
Cabe señalar que la esporotricosis canina, más rara que su equivalente felino, hasta ahora no se ha asociado con casos confirmados de contaminación humana.
Presentación clínica en animales
En el perro y el gato, se han descrito tres formas clínicas distintas, con un período de incubación variable de una semana a dos meses:
- Forma cutáneo-linfática (80% de los casos): Se caracteriza en el sitio de inoculación por el desarrollo progresivo de un nódulo único, inicialmente asintomático y luego ulcerado, localizado en la cara o una extremidad podal. Otros nódulos ulcerados y fistulizados pueden aparecer a lo largo de los vasos linfáticos.
- Forma estrictamente cutánea (menos frecuente): Las localizaciones preferentes son las extremidades podales, que presentan lesiones nodulares o zonas de depilación con bordes elevados, ulceradas y costrosas.
- Forma generalizada: Observada principalmente en gatos inmunodeprimidos, resulta de la diseminación hematógena de las esporas infectantes.
Diagnóstico y tratamiento
El diagnóstico se basa en el examen citológico de improntas cutáneas y biopsias, que revelan una notable abundancia de elementos fúngicos en el gato. El cultivo micológico confirma el diagnóstico.
El tratamiento se basa en la administración de antifúngicos sistémicos, con preferencia por el itraconazol y el fluconazol. En las formas sistémicas, la anfotericina B da excelentes resultados. El tratamiento debe continuarse al menos un mes después de la aparente resolución clínica. En el gato, además del tratamiento fungicida sistémico, son indispensables medidas higiénicas estrictas:
- Limpieza cuidadosa de manos y brazos con sustancias antifúngicas (clorhexidina, povidona yodada).
- Uso obligatorio de guantes protectores.
- Información clara a los propietarios sobre el riesgo zoonótico principal.
Debido al alto riesgo de transmisión y la duración prolongada del tratamiento, la eutanasia puede considerarse legítimamente para los gatos portadores.
Manifestaciones en humanos
En el ser humano, el período de incubación varía de tres semanas a tres meses. La forma cutáneo-linfática, la más frecuente, se manifiesta en el sitio de inoculación por un nódulo progresivo, inicialmente asintomático y luego ulcerado, típicamente localizado en el dorso de la mano, un dedo, un pie o la cara.
Dermatozoonosis parasitarias
Las afecciones cutáneas de origen parasitario transmisibles entre el animal y el hombre constituyen un grupo heterogéneo pero importante de las dermatozoonosis. Estas parasitosis, que implican diversos ácaros, insectos o helmintos, presentan cuadros clínicos variados tanto en el animal como en el hombre.
Las sarnas
La sarna sarcóptica
La sarna sarcóptica representa una acariasis altamente contagiosa debido a la proliferación en la epidermis de ácaros de la familia Sarcoptidae, Sarcoptes scabiei var. canis. Su importancia en dermatología veterinaria y humana se deriva de su creciente frecuencia, su gravedad clínica y su potencial zoonótico confirmado.
Las especies principalmente afectadas por Sarcoptes scabiei var. canis son el perro, el zorro y el hurón, pero ocasionalmente también el gato, el hombre y el caballo. El ciclo evolutivo se caracteriza por su rapidez (10 a 13 días) en condiciones ambientales favorables. Las hembras, extremadamente prolíficas, ponen de 2 a 3 huevos diariamente (aproximadamente 50 huevos por hembra) durante 2 a 4 semanas. Después de la fecundación, excavan túneles epidérmicos (a diferencia de los surcos observados con los sarcoptes humanos) para depositar sus huevos.
Estos huevos eclosionan en 2-3 días, liberando larvas hexápodas que se desarrollan en ninfas y luego en adultos. Los sarcoptes se alimentan de tejidos epidérmicos (histiófagos). Su supervivencia en el medio exterior es limitada a unos 10 días, requiriendo condiciones específicas (15-25°C, humedad relativa entre 25 y 85%).
La sarna sarcóptica sigue siendo infradiagnosticada en perros. Afecta principalmente a perros jóvenes de menos de un año, sobre todo en entornos comunitarios (perreras, refugios), pero también puede afectar a perros adultos o mayores debilitados por una afección intercurrente.
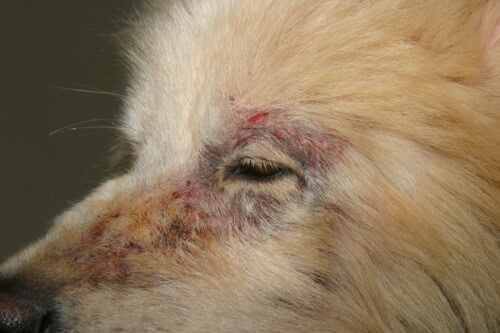
Sarna sarcóptica con afectación facial
El poder patógeno de Sarcoptes scabiei var. canis se ejerce por diferentes mecanismos:
- Acciones mecánicas y químicas (inoculación de proteínas vasodilatadoras y anticoagulantes)
- Acción antigénica (excrementos, productos de muda, saliva)
- Inducción de fenómenos de hipersensibilidad de tipos I, IV y III
La hipersensibilidad de tipo III puede causar depósitos de inmunocomplejos en diversos órganos, especialmente los riñones, provocando glomerulonefritis. Esta dimensión sistémica justifica que la sarna sarcóptica canina se considere una enfermedad general y no solo dermatológica.
Clínicamente, después de una incubación variable (aproximadamente 3 semanas post-contacto), el cuadro clásico asocia:
- Prurito intenso con reflejo otopodal positivo
- Lesiones eritematosas y papulosas (“botón de sarna”)
- Depilaciones en parches
- Formación de costras
La distribución lesional es característica al inicio de la evolución, afectando prioritariamente la cara (bordes libres de los pabellones auriculares), las extremidades (codos) y el esternón. Pueden aparecer manifestaciones sistémicas en caso de infestación antigua o en perros mayores: hipertermia, anorexia, adelgazamiento, poliuria-polidipsia secundaria a la glomerulonefritis inmunológica.
Cada vez se reportan más formas atípicas:
- Formas frustradas localizadas, poco pruriginosas y poco contagiosas
- “Sarna noruega” caracterizada por escamas compactas gruesas, un prurito moderado y la presencia masiva de sarcoptes en diferentes estadios evolutivos en los raspados cutáneos (típicamente en animales inmunodeprimidos)
El diagnóstico de certeza a veces es difícil. El examen microscópico de raspados cutáneos profundos, realizados en las zonas de predilección, solo revela los parásitos o sus rastros (sarcoptes, huevos, excrementos) en aproximadamente el 50% de los casos. El diagnóstico serológico constituye una alternativa, con una sensibilidad y especificidad de aproximadamente el 80-90%. Ante una fuerte sospecha clínica sin confirmación parasitológica, se recomienda un tratamiento de prueba según el principio “si lo sospechas, trátalo”.
El tratamiento tiene dos enfoques:
- Acaricidas tópicos (amitraz diluido)
- Acaricidas sistémicos en spot-on (selamectina o moxidectina)
La dimensión zoonótica es significativa, con contaminaciones humanas observadas en el 25 al 50% de los casos de sarna sarcóptica canina. La incubación en el ser humano es de 8 a 15 días, lo que resulta en un prurigo del tronco, los brazos y las piernas. Característicamente, no se observa ningún surco escabioso, a diferencia de la sarna humana.
Esto se explica por el hecho de que Sarcoptes scabiei var. canis no puede sobrevivir más de 15 a 20 días en el ser humano, debido a una estrecha especificidad del huésped. El parásito es incapaz de reproducirse en la piel humana (ausencia de hembras ovígeras en la epidermis, sin surcos) y permanece confinado en la superficie sin acción perforante ni antigénica.
Por lo tanto, el tratamiento adecuado del animal sarnoso suele ser suficiente para resolver los síntomas en el ser humano; la sarna sarcóptica se considera una “hemizoonosis” en la que el parásito muere rápidamente en la piel humana sin reproducirse. La persistencia de los síntomas humanos debe hacer sospechar una fuente de contaminación persistente: animal no tratado o mal tratado, congénere portador asintomático no identificado, o supervivencia de los parásitos en el medio ambiente.
La sarna notoédrica
La sarna notoédrica es una acariasis contagiosa que afecta principalmente al gato, la rata y el hámster. Es causada por la multiplicación en la superficie y en la epidermis de ácaros psóricos de la familia Sarcoptidae: Notoedres cati en el gato y Notoedres muris en los roedores.
Relativamente rara en gatos en Francia metropolitana, esta afección es más frecuente en los departamentos y territorios de ultramar (Isla de la Reunión, Antillas), así como en Italia, Eslovenia y España. En hámsteres y ratas, constituye una de las dermatosis pruriginosas más comunes.
El ciclo biológico de los notoedres es comparable al de los sarcoptes, con una marcada contagiosidad, particularmente por contacto directo, que puede afectar a gatos, perros y humanos. Esta infestación puede presentarse de forma enzoótica o epizoótica con una morbilidad importante. Los factores de susceptibilidad incluyen la edad temprana (gatitos), la inmunodepresión (gatos FeLV o FIV positivos), y, en roedores, el estado de rata joven o hembra gestante.
Clínicamente, en el gato, las lesiones suelen comenzar en la cara (hocico, labios, párpados, pabellones auriculares) antes de generalizarse a las extremidades y las regiones perianal y abdominal. Se manifiestan por depilaciones difusas eritematosas y escamosas, que evolucionan rápidamente hacia formaciones costrosas. El prurito suele ser intenso.
En el hámster, las manifestaciones cutáneas incluyen lesiones costrosas localizadas preferentemente en el hocico, los pabellones auriculares y el extremo de las extremidades, con frecuente afectación genital. El prurito varía de moderado a intenso.
En la rata, la distribución lesional es más restringida, limitada al borde libre de los pabellones auriculares y al hocico, en forma de verrugas pseudotumorales. Las lesiones papulo-costrosas suelen observarse en la cola, pero la generalización es inusual. La intensidad del prurito varía de moderada a grave.
Las contaminaciones humanas, cuya incidencia precisa es difícil de evaluar, producen signos cutáneos similares a los de la sarna sarcóptica canina: prurigo del tronco, los brazos y las piernas. Al igual que con Sarcoptes scabiei var. canis, los notoedres no pueden reproducirse en la piel humana (ausencia de hembras ovígeras epidérmicas y de surcos) y permanecen confinados en la superficie, sin acción perforante ni respuesta antigénica significativa. La resolución de la sarna en el animal, por lo tanto, generalmente conduce a la curación en el ser humano, considerándose también esta sarna notoédrica como una hemizoonosis.
El diagnóstico, relativamente sencillo, se basa en la identificación de notoedres en diversas etapas evolutivas (adultos, ninfas, larvas, huevos) y de sus excrementos al raspar la piel.
El tratamiento utiliza acaricidas sistémicos (avermectinas y milbemicinas), siendo necesario tratar a todos los animales del grupo, presenten o no signos clínicos.
La sarna trixacárica
La sarna por Trixacarus caviae constituye una acariasis contagiosa específica del cobaya (y ocasionalmente del ratón), causada por un ácaro psorico de la familia Sarcoptidae. Los factores desencadenantes siguen siendo poco claros, con condiciones de contaminación a menudo discretas y un período de incubación variable.
La reconstrucción del historial de infestación suele ser compleja, la contaminación precede con frecuencia la adquisición de los animales. Estos cobayas probablemente albergan un pequeño número de parásitos sin manifestación clínica, hasta que modificaciones ambientales (alimentación, hábitat, superpoblación) o una alteración del estado sanitario provocan la multiplicación parasitaria más allá del umbral patógeno.
Cabe destacar que la presencia de animales gravemente afectados no provoca sistemáticamente la contaminación de congéneres en contacto, lo que sugiere un componente individual en la receptividad a la infestación.
El cuadro clínico asocia un prurito constante, precoz y a menudo intenso a lesiones rápidamente generalizadas: eritema, pápulas, escamas, que evolucionan hacia formaciones costrosas extensas. La distribución puede ser loco-regional o generalizada. El estado general puede deteriorarse en caso de evolución crónica, con apatía, anorexia, adelgazamiento y a veces desenlace fatal.
Las contaminaciones humanas, regularmente reportadas, resultan de un contacto frecuente y prolongado con el animal enfermo. Se han descrito episodios de infestación, en particular, en comunidades escolares, implicando a niños de guardería en contacto con un cobaya gravemente afectado.
En el ser humano, esta sarna se manifiesta por una dermatosis pruriginosa papulosa (tipo prurigo) que afecta principalmente a los brazos, el cuello y las piernas. Al igual que con otras sarnas animales, el tratamiento adecuado del animal suele ser suficiente para resolver los síntomas humanos, siendo esta sarna trixacárica también una hemizoonosis donde el parásito no puede reproducirse en la piel humana.
El protocolo terapéutico se basa en el uso de acaricidas tópicos o sistémicos (avermectinas o milbemicinas), con el tratamiento obligatorio de todos los congéneres. Una limpieza y desacarización del ambiente complementan el manejo.
Las queiletielosis
Las cheyletiellosis representan un conjunto de dermatosis parasitarias causadas por ácaros del género Cheyletiella, pertenecientes a la familia Cheyletidae. Se identifican tres especies principales, cada una con una preferencia de hospedador: Cheyletiella yasguri (perro), Cheyletiella blakei (gato) y Cheyletiella parasitivorax (conejo).
Estos ácaros presentan características biológicas particulares: los adultos ponen huevos en la base del pelo y se alimentan de detritos cutáneos y fluidos tisulares. A diferencia de otros ectoparásitos de superficie, los cheyletiellas pueden penetrar en los detritos epidérmicos, o incluso en la capa córnea, formando bolsas. Su movilidad en la piel es notable.
Se trata de parásitos obligados que completan la totalidad de su ciclo de vida en su huésped, con una duración de desarrollo de aproximadamente 35 días. La transmisión se produce principalmente por contacto directo con animales clínicamente afectados o portadores asintomáticos, pero también de forma indirecta a través del medio ambiente, donde las hembras pueden sobrevivir hasta 10 días. Son posibles las contaminaciones interespecíficas, y la supervivencia podría prolongarse en condiciones ambientales favorables (temperatura relativamente baja, humedad elevada, luminosidad moderada). Los parásitos pueden contaminar la cama de los animales, las grietas de las paredes y los suelos de parqué, a veces incluso en ausencia de animales.
Las cheyletielosis afectan principalmente a animales jóvenes (cachorros y gatitos de criaderos o gateras), pero también a perros adultos (a menudo portadores asintomáticos) y gatos adultos. Se han observado ciertas predisposiciones raciales: razas caninas enanas (Yorkshire Terrier, Bichón, Caniche) y, en gatos, la raza Persa.
La presentación clínica varía según la especie y la edad:
- En el cachorro: prurito intenso con reflejo otopodal positivo y escamosis pronunciada que afecta la cabeza, la espalda y la región lumbar.
- En el gatito: signos discretos limitados a una escamosis pitiriasiforme dorso-lumbar.
- En el gato adulto: lesiones cutáneas más inflamatorias con dermatitis pruriginosa papulo-costrosa.
- En el conejo: infestación a menudo asintomática o dermatosis pruriginosa y escamosa principalmente troncal.
La contaminación humana es frecuente (>50% de los casos), y ocurre generalmente a partir de C. blakei y C. yasguri. Esta transmisión, a menudo subestimada, resulta principalmente del contacto directo con el animal parasitado (clínicamente afectado o portador asintomático), pero también puede ocurrir de forma indirecta.
En el ser humano, las manifestaciones clínicas aparecen rápidamente, a partir del segundo día después del contacto, en forma de pápulas muy pruriginosas localizadas en los antebrazos, los pliegues de los codos y los brazos, el pecho, el abdomen y los muslos.
El diagnóstico, generalmente sencillo, se basa en la detección de cheyletiellas mediante raspados cutáneos, cepillado o “scotch test” y la observación microscópica de las escamas y los detritus. La visualización de los parásitos suele ser fácil en el perro (adultos, ninfas, huevos) pero más difícil en el gato, donde los adultos rara vez se identifican y solo se pueden observar los huevos en la base del pelo. En el conejo, las formas parasitarias son fácilmente detectables.
El tratamiento específico asocia:
- Acaricidas tópicos o sistémicos (avermectinas o milbemicinas)
- Tratamiento prolongado (mínimo ocho semanas) debido a la resistencia de los huevos a los acaricidas
- Tratamiento obligatorio de todos los animales en contacto
- Tratamiento del medio ambiente
El aislamiento y el tratamiento adecuado de los animales suelen resolver espontáneamente las lesiones en humanos, ya que las cheyletiellas no pueden reproducirse en la piel humana.
Las pulgosis
Las infestaciones por pulgas (pulicosis) constituyen una de las ectoparasitosis más comunes en perros y gatos. La especie predominante es Ctenocephalides felis felis – “la pulga del gato” -, más raramente Ctenocephalides canis. Aunque las pulicosis no se consideran estrictamente zoonosis en el sentido propio, su frecuencia y sus consecuencias negativas en el ser humano justifican su inclusión en este análisis de las dermatozoonosis.
Las pulgas son insectos afanípteros (sin alas), aplanados lateralmente. Los adultos, parásitos cosmopolitas y sedentarios, pasan la mayor parte de su tiempo en el animal huésped. Su ciclo biológico presenta varias particularidades: las hembras comienzan a poner sus huevos en el huésped entre las 24 y 48 horas siguientes a su primera ingesta de sangre. Estos huevos, de superficie lisa, caen al medio ambiente donde tiene lugar el desarrollo (huevos, tres estadios larvarios, estadio ninfal).
La duración del ciclo completo es de aproximadamente tres semanas en condiciones óptimas, pero puede retrasarse en condiciones ambientales desfavorables. Un elemento crucial de la epidemiología es la capacidad de los adultos pre-emergidos (aún en los capullos ninfales) de persistir varios meses en el medio ambiente, constituyendo un considerable reservorio parasitario. Estos adultos emergen bajo la influencia de estímulos específicos (vibraciones, luz, señales químicas) y forman lo que comúnmente se llama “las pulgas del parqué”.
La infestación por pulgas suele ser inaparente en animales sanos. Los perros sanos sufren una presión parasitaria moderada, y la población de pulgas está naturalmente limitada por los comportamientos de autoacicalamiento (mordisqueo, lamer) y los movimientos de rascado que expulsan los parásitos del pelaje. Esta particularidad explica la dificultad ocasional de detectar parásitos en animales infestados.
Las consecuencias patológicas de las pulicosis tienen dos dimensiones:
- Una irritación mecánica cutánea debido a las repetidas picaduras y los desplazamientos de los parásitos.
- El desarrollo, en algunos sujetos sensibilizados, de una dermatitis por hipersensibilidad a las picaduras de pulgas (DHPP), que constituye la dermatosis alérgica más frecuente tanto en el gato como en el perro.
En el perro, la DHPP se manifiesta por una alopecia dorso-lumbar que asocia eritema, pápulas y costras, con prurito generalmente intenso. En ausencia de tratamiento adecuado, las complicaciones infecciosas secundarias son frecuentes. En el gato, el cuadro se caracteriza por una dermatitis pruriginosa papulo-costrosa, placas eosinofílicas y/o una alopecia dorso-lumbar.
La transmisión al ser humano se produce principalmente en caso de infestaciones masivas, cuando la superpoblación obliga a las pulgas a cambiar de huésped. Cabe señalar que la transmisión directa de pulgas adultas entre animales o hacia el ser humano es relativamente limitada (10 a 15% en promedio). La contaminación humana proviene esencialmente de pulgas jóvenes adultas recién emergidas de los capullos, que buscan activamente un huésped disponible, sea cual sea.
En el ser humano, la DHPP afecta preferentemente a las extremidades (tobillos, muñecas) y, en el niño, puede extenderse al tronco. Las lesiones, intensamente pruriginosas, adoptan la forma de pápulas urticariformes, placas urticadas o vesículas transitorias. A veces se observa un impétigo secundario al rascado y a las sobreinfecciones bacterianas.
El diagnóstico de pulicosis se basa en la identificación directa de pulgas adultas o de sus excreciones, ya sea a simple vista o mediante cepillado con un peine específico para pulgas. Para la DHPP, el diagnóstico se apoya en elementos anamnésicos sugestivos (dermatosis estacional, presencia de varios perros/gatos en el entorno) y lesiones clínicas compatibles (dermatosis pruriginosa dorso-lumbar). Paradójicamente, en animales afectados por DHPP, la infestación visible por pulgas es a menudo mínima.
En el perro, las pruebas de intradermorreacción que utilizan extractos totales de pulgas pueden confirmar una DHPP mediante reacciones inmediatas positivas a los 20 minutos y/o retardadas a las 48 horas, aunque su ausencia no excluye el diagnóstico. Estas pruebas se consideran poco fiables en el gato.
El tratamiento de las pulicosis y de la DHPP nunca debe ser trivializado y requiere un enfoque global:
- Eliminación de las pulgas en el animal afectado
- Tratamiento obligatorio de los animales congéneres
- Saneamiento del medio ambiente
Esta estrategia integrada a menudo requiere una estrecha colaboración con el propietario para establecer un programa de control eficaz. El control de pulgas en el animal se basa en el uso de adulticidas de larga duración, mientras que la gestión de los estadios no parasitarios en el medio ambiente implica el uso de inhibidores del crecimiento de insectos y adulticidas ambientales. Las medidas mecánicas complementarias (limpieza metódica, eliminación de nichos ecológicos) también son esenciales.
Dermatozoonosis helmínticas
Las larvas migratorias cutáneas
El fenómeno de la larva migrans cutánea (LMC) se observa principalmente en Francia metropolitana en personas que regresan de regiones tropicales, donde los perros callejeros contaminan las playas con sus excrementos. Estos perros, generalmente no medicados y no desparasitados, están frecuentemente infestados por anquilostomas (Ancylostoma spp. y Uncinaria spp.), nematodos digestivos responsables en ellos de gastroenteritis hemorrágicas. Sin embargo, la reciente descripción de una enzoótica de larva migrans por Ankylostoma en Bretaña incita a una mayor vigilancia en el territorio metropolitano.
Las manifestaciones cutáneas están ligadas a la penetración transcutánea de larvas infestantes L3. Clínicamente, se traducen en pápulas a menudo costrosas y pruriginosas, a veces pustulosas, localizadas preferentemente en las zonas de piel fina (abdomen) y las extremidades (espacios interdigitales y superficies palmares). Estos signos, relativamente poco específicos, requieren una anamnesis precisa que evoque un contacto potencial con ambientes contaminados (perro que vive en perrera, medio rural, perro de caza).
Más allá de las manifestaciones cutáneas, la infestación puede provocar signos respiratorios relacionados con la migración larvaria (bronconeumonía), a menudo subdiagnosticados. Trastornos digestivos (enteritis hemorrágica) y signos generales (adelgazamiento, anemia) se observan regularmente en infestaciones crónicas.
Las fuentes de contaminación incluyen perros (y gatos) portadores, así como suelos húmedos contaminados por las larvas infestantes L3. Las perreras mal cuidadas y con suelo de tierra constituyen un ambiente ideal para el desarrollo larvario, lo que explica la particular vulnerabilidad de los perros de caza. Cabe destacar también la posibilidad de infestación indirecta por ingestión por parte de perros de pequeños roedores que a su vez hayan ingerido larvas L3.
El diagnóstico de las migraciones transcutáneas suele ser delicado. La detección directa de las larvas L3 mediante raspados cutáneos rara vez es concluyente. El examen histopatológico de las biopsias cutáneas puede sugerir estas migraciones (infiltrado eosinofílico y, ocasionalmente, presencia de larvas). El examen coproscópico suele permitir identificar fácilmente los huevos, a menudo numerosos.
La prevención y el control implican un enfoque múltiple:
- Destrucción de ambientes contaminados
- Desparasitación regular y razonada, particularmente en perras gestantes (antihelmínticos con acción larvicida)
- Reconstrucción de perreras de tierra batida infestadas
- Recogida diaria de excrementos
- Limpieza semanal intensiva a base de cresilo
En el ser humano, la larva que penetra en la piel produce una erupción serpiginosa característica. Sin embargo, esta infestación constituye un callejón sin salida parasitario, ya que las lesiones suelen remitir espontáneamente en pocas semanas o meses.
La dermatosis furcocercariana o dermatitis del nadador
La dermatosis furcocercarián, también conocida como dermatitis del nadador (o del bañista), representa una dermatozoonosis estacional (de junio a septiembre) cada vez más frecuente. Esta metazoonosis es provocada por la penetración epidérmica de larvas de un trematodo, Trichobilharzia ocellata, parásito del pato, a veces erróneamente llamada “pulga del pato”. La contaminación ocurre durante el baño en agua dulce, particularmente en zonas lacustres (Lago de Annecy, Lago del Bourget, Lago Lemán, lagos suizos e italianos).
El ciclo parasitario implica el trematodo T. ocellata, parásito digestivo del pato, excretado en las heces. Estos trematodos son luego ingeridos por caracoles acuáticos del género Lymnaea, especialmente Lymnaea stagnalis. Las cercarias (formas larvarias) son posteriormente liberadas en el agua donde pueden contaminar al pato (huésped definitivo) así como al hombre o al perro (huéspedes accidentales) durante el baño.
Aunque el perro puede presentar lesiones similares a las observadas en humanos, es importante señalar que en ningún caso el hombre puede contaminarse a partir de un perro afectado.
En el ser humano, el cuadro clínico se caracteriza por una dermatitis eruptiva intensamente pruriginosa, maculopapulosa, localizada en las zonas expuestas. La aparición repentina de las pápulas suele ocurrir entre los 10 y 30 minutos siguientes a la inmersión en agua dulce. La evolución es favorable, con curación espontánea en 2 a 3 semanas, aunque con frecuencia es necesario un tratamiento sintomático (antihistamínicos o dermocorticoides).
La profilaxis sanitaria se basa en la interrupción del ciclo biológico del parásito, lo que implica la eliminación de caracoles y patos de los cuerpos de agua afectados. Dado que la eliminación de los moluscos es particularmente difícil, se recomienda a los bañistas evitar las zonas de agua poco profunda ricas en vegetación acuática, hábitat preferido de los caracoles.
La leishmaniasis
La leishmaniasis constituye una protozoosis infecciosa transmisible por inoculación, caracterizada por la multiplicación intracelular de un protozoo flagelado, Leishmania infantum, en las células del sistema de fagocitos mononucleares. Su transmisión se efectúa por la picadura de flebotomos, siendo el perro el principal reservorio. En Francia, los focos de enzoótica canina se concentran esencialmente en el sureste, en la costa mediterránea, desde la frontera italiana hasta la frontera española, y desde el nivel del mar hasta aproximadamente 800 metros de altitud.
Aunque el parásito también ha sido aislado en zorros y gatos, su papel epidemiológico parece marginal. Descubrimientos recientes han puesto de manifiesto otras vías de transmisión: intercambio de jeringuillas entre heroinómanos, contaminación por derivados sanguíneos, lo que sugiere la existencia ocasional de un ciclo antropozoonótico.
En el perro, la leishmaniosis se presenta como una enfermedad general con un polimorfismo clínico notable. Las encuestas epidemiológicas realizadas en los Alpes Marítimos y la región de Marsella indican que aproximadamente uno de cada dos perros leishmanióticos es portador asintomático. Aunque sistémica en esta especie, la afección se manifiesta principalmente por afectaciones cutáneas, nunca aisladas, sino asociadas a diversos signos clínicos:
- Poliadenomegalia (frecuente)
- Esplenomegalia (más rara)
- Alteración del estado general (astenia, amiotrofia muscular facial)
- Complicaciones diversas: uveítis bilateral, artritis, glomerulonefritis (a veces única manifestación clínica, de pronóstico desfavorable)
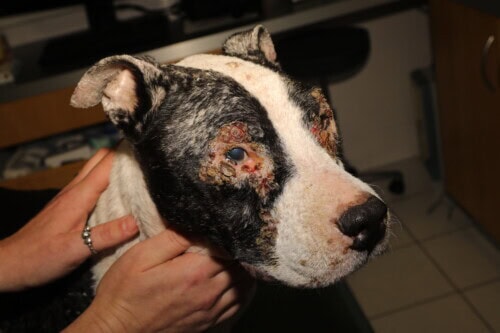
Las lesiones cutáneas, de evolución típicamente crónica, presentan una gran diversidad morfológica:
- Dermatosis exfoliativa generalizada que afecta la cabeza, los pabellones auriculares y las extremidades.
- Ulceraciones de las extremidades podales y de los puntos de presión.
- Despigmentación de la trufa (primaria o secundaria a úlceras).
- Engrosamiento de la trufa y/o de las almohadillas plantares.
- Nódulos no ulcerados, únicos o múltiples (particularmente en ciertas razas como el Bóxer o el Doberman).
- Dermatitis pustulosa estéril generalizada.
Leishmaniasis canina
En los seres humanos, la leishmaniasis se presenta como una enfermedad sistémica que afecta principalmente a niños y adultos inmunodeprimidos. También puede manifestarse estrictamente en forma cutánea, con lesiones localizadas en el sitio de inoculación, generalmente en zonas expuestas. Estas lesiones nodulares, ulceradas y costrosas, son característicamente indoloras, de tamaño variable y de evolución crónica.
El diagnóstico en medicina veterinaria se basa en diversas técnicas:
- Detección directa del parásito por citología (adenograma, mielograma)
- Serología (ELISA, inmunofluorescencia indirecta)
- Amplificación génica (PCR)
En zonas de enzoótica, se recomienda un cribado sistemático anual, idealmente realizado después de la temporada de exposición (noviembre a enero), teniendo en cuenta el período de incubación variable pero generalmente de unos pocos meses.
El manejo de los perros infectados genera mucha controversia. De hecho, incluso tratados, estos animales siguen siendo portadores del parásito. Dado que la leishmaniasis visceral humana es potencialmente mortal si no se trata, y su incidencia aumenta en zonas de endemicidad, la eliminación del reservorio parasitario parece lógica. Sin embargo, este enfoque penalizaría a los propietarios responsables de animales correctamente medicados, al tiempo que dejaría subsistir una población canina no controlada. Paradójicamente, la eutanasia sistemática de los portadores, cuando se ha aplicado, no ha dado los resultados esperados e incluso ha ido acompañada de un aumento de los casos humanos.
El veterinario juega un papel determinante en la información a los propietarios sobre los riesgos y la necesidad de un seguimiento riguroso, tanto clínico como biológico.
El tratamiento de la leishmaniasis canina se basa en la asociación de derivados estibiados y alopurinol, con una estrecha vigilancia terapéutica. A pesar de la concienciación de los propietarios, una fracción de perros inevitablemente escapa al control o recibe automedicación intermitente, lo que plantea el grave problema de la posible aparición de cepas resistentes. Por lo tanto, los veterinarios deben abstenerse de utilizar ciertas moléculas altamente eficaces como la anfotericina B, que debe reservarse exclusivamente para la medicina humana para esta indicación.
La elaboración de una vacuna canina representaría la solución ideal para el control epidemiológico, pero su desarrollo se enfrenta actualmente a numerosos obstáculos.
Dermatozoonosis bacterianas
La linforreticulosis benigna de inoculación o enfermedad por arañazo de gato
La linforreticulosis benigna de inoculación, más comúnmente conocida como enfermedad por arañazo de gato (EAG) debido a su modo de transmisión predominante, constituye en el ser humano una linfadenopatía subaguda regional de origen bacteriano. El agente causal, Bartonella henselae (familia Bartonellaceae), no fue identificado hasta 1992. Algunos casos también podrían atribuirse a Bartonella clarridgeiae. Los dos genotipos conocidos (I y II) de B. henselae están implicados en esta afección.
B. henselae también está asociada, junto con B. quintana, a la etiología de la angiomatosis bacilar y la peliosis, enfermedades vasculoproliferativas observadas principalmente en pacientes infectados por el VIH.
El gato representa el principal, o incluso el único, reservorio de la bacteria. El papel del perro en la portación de la infección parece muy limitado. Aunque raros, se han reportado casos en ausencia de exposición directa a un animal, lo que sugiere otros posibles modos de transmisión (picaduras de pulgas o garrapatas). La contaminación humana ocurre en el 70% de los casos después de arañazos y en el 10% después de mordeduras felinas. Excepcionalmente, un simple contacto (caricia, abrazo) podría permitir la contaminación de una herida cutánea o mucosa preexistente, como ilustra la forma oculo-ganglionar a veces observada en personas que probablemente se frotaron el ojo después de acariciar a un gato.
La infección experimental en gatos provoca rápidamente (menos de una semana) una bacteriemia asintomática prolongada, que persiste de 2 a 3 meses o más en algunos sujetos (se ha observado una bacteriemia recurrente persistente en un gato durante 22 meses). Algunos gatos presentan niveles de bacteriemia notablemente altos (superiores a 10^6 UFC/ml de sangre). La bacteriemia es estadísticamente más frecuente en gatos jóvenes (menos de un año). B. henselae y B. clarridgeiae pueden coinfectar al mismo animal. Recientemente, se han aislado dos nuevas especies de Bartonella, B. koehlerae y B. weissii, de gatos en los Estados Unidos, pero su papel patógeno en la MGC aún no se ha demostrado.
Los estudios epidemiológicos indican que una proporción sustancial de los gatos analizados son bacteriémicos, con un porcentaje mayor entre los gatos callejeros en comparación con los gatos domésticos. Diversas encuestas han revelado tasas de gatos bacteriémicos que varían del 16,5% al 53% dentro de las poblaciones felinas callejeras, de las cuales aproximadamente un tercio están infectadas por B. clarridgeiae.
La pulga del gato (Ctenocephalides felis felis) desempeña un papel predominante en la transmisión de la infección dentro de esta especie. B. henselae puede, de hecho, aislarse de pulgas recolectadas de gatos bacteriémicos. La pulga eliminaría la bacteria en sus heces, contaminando así el pelaje del animal. Las bacterias pueden multiplicarse en el tracto digestivo del insecto y sobrevivir en sus heces. El gato contamina sus garras durante el aseo, estableciendo así la cadena de transmisión al ser humano. Los gatos callejeros, más frecuentemente infectados, representan una fuente de contaminación para los gatos domésticos.
La MGC es una enfermedad ubicua (aproximadamente 22.000 casos humanos anuales estimados en Estados Unidos y 2.000 en Países Bajos en 2003) que puede afectar a todas las edades, pero que afecta principalmente a niños y adultos jóvenes. La mitad de los casos se reportan en niños menores de 15 años. La angiomatosis bacilar, forma grave de la enfermedad, se diagnostica esencialmente en adultos inmunodeprimidos (particularmente pacientes VIH+). La MGC ocurre generalmente de forma esporádica, pero ocasionalmente se describen pequeñas epidemias familiares.
El cuadro clínico clásico comienza con una adenopatía progresiva. En el sitio de inoculación aparece en una semana una pápula que evoluciona a una vesico-pústula. En más del 90% de los casos, esta lesión inicial, que cicatriza en 1 a 3 días, pasa desapercibida. Generalmente, 2 a 3 semanas más tarde se desarrolla una linfoadenopatía persistente, que evoluciona hacia la supuración en el 10 al 30% de los pacientes. Esta adenopatía satélite, única en el 85% de los casos, se acompaña de una ligera hipertermia. Las lesiones remiten espontáneamente (lo que justifica la denominación “benigna”) en varias semanas a varios meses, aunque a veces puede establecerse una supuración crónica.
La MGC también puede manifestarse en diferentes formas atípicas, incluyendo el síndrome óculo-glandular de Parinaud y otras presentaciones a veces graves (endocarditis, encefalitis, septicemia, púrpura), incluso en sujetos inmunocompetentes. En pacientes inmunodeprimidos, la angiomatosis bacilar y la peliosis representan las principales manifestaciones clínicas.
El diagnóstico se basa en criterios epidemiológicos y clínicos. El diagnóstico diferencial incluye otras adenopatías relacionadas con diversas enfermedades generales (rubéola, tularemia) o con heridas banales, mordeduras o arañazos infectados por bacterias no específicas o por Pasteurella spp.
Los gatos vectores de la transmisión permanecen clínicamente sanos. El agente infeccioso solo puede aislarse en un gato bacteriémico mediante hemocultivo e identificación por PCR. La serología también es utilizable, pero una reacción positiva no necesariamente se correlaciona con una bacteriemia activa.
Una antibioticoterapia, incluso prolongada, no parece eliminar la bacteriemia en el gato. Las medidas profilácticas específicas, por lo tanto, siguen siendo limitadas. En cambio, el uso regular de productos antipulgas puede reducir la contaminación del reservorio felino. Cabe señalar que la desungulación, a veces propuesta como medida preventiva, no tiene ningún interés.
La prevención se basa en la información clara a las personas en riesgo (especialmente a los pacientes inmunodeprimidos), el control razonado de las pulgas en el gato, el lavado de manos después del contacto con el animal y, como en todas las enfermedades transmitidas por mordedura o arañazo, el lavado y la desinfección inmediata de las heridas.
Pasteurelosis
Las pasteurelosis animales, frecuentemente encontradas en numerosas especies (rumiantes, porcinos, aves de corral, lagomorfos), se manifiestan clínicamente por diversas afecciones: bronco y pleuroneumonías, abscesos subcutáneos o formas septicémicas (cólera aviar).
Estas infecciones se transmiten al ser humano por los modos habituales de contagio (contactos directos, alimentación, inhalación), pero el mecanismo principal es la inoculación por mordedura de gato, de perro, más raramente de rata o de conejo. Esta mordedura puede ser infligida por un animal clínicamente enfermo, pero más a menudo por un animal aparentemente sano, siendo Pasteurella spp. una bacteria comensal de las vías aero-digestivas superiores de numerosos animales, aislada en el 40 al 80% de las muestras en las especies afectadas.
Las pasteurellas aisladas en personas mordidas son principalmente P. multocida, P. canis y P. dagmatis. Los casos de pasteurelosis humana sin mordedura identificada son excepcionales; incluyen neumonías, pleuritis, pericarditis, endocarditis, artritis y septicemias. Si bien es posible una contaminación de origen animal por inhalación o ingestión, Pasteurella spp. también podría, en el ser humano como en el animal, sobrevivir como comensal en las mucosas y expresar su poder patógeno solo en asociación con afecciones o enfermedades debilitantes (infecciones virales, cáncer, síndrome urémico, cirrosis). En estos casos particulares, estas pasteurelosis no se considerarían estrictamente zoonosis.
En el ser humano, la presentación clínica está dominada por formas localizadas con puerta de entrada cutánea. Las formas agudas se caracterizan por signos inflamatorios locales intensos y precoces. En las horas siguientes a la penetración del germen, la herida (a menudo inaparente inicialmente) se vuelve caliente, roja, edematosa y muy dolorosa; aparece rápidamente una supuración en forma de unas pocas gotas serosas. Con frecuencia se asocia una linfangitis y una adenopatía satélite.
Las formas subagudas loco-regionales evolucionan de forma diferente: después de manifestaciones iniciales similares o más discretas, aparecen tenosinovitis dolorosas y persistentes, no supurativas, cerca del punto de inoculación, o artropatías metacarpo-falángicas acompañadas de trastornos vasomotores (sensación de pesadez, cianosis o palidez, parestesias).
El diagnóstico clínico se basa en el rápido desarrollo de una inflamación edematosa de la región mordida. El aislamiento bacteriológico a partir del pus debe realizarse precozmente en medios ordinarios, pero los resultados son variables.
El tratamiento de las pasteurelosis por inoculación requiere el uso de tetraciclinas. La profilaxis humana es compleja debido a la imposibilidad de eliminar el reservorio animal en contacto permanente con el hombre. Dada la frecuencia de contaminaciones felinas y las secuelas funcionales a veces observadas, una medida preventiva considerada es administrar un tratamiento antibiótico inmediato a toda persona mordida o arañada, incluso en ausencia de signos clínicos precoces.
La viruela bovina
La viruela bovina es una enfermedad viral causada por un ortopoxvirus, el virus de la viruela bovina, descrito en numerosas especies: vaca, camello, búfalo, conejo, gato y, más recientemente, rata. Los virus de esta familia (viruela, viruela bovina, vaccinia y viruela del mono) están estrechamente relacionados y todos pertenecen al género Orthopoxvirus. Estos agentes presentan dificultades de aislamiento, incluso a partir de lesiones y órganos infectados.
El diagnóstico de la infección por Orthopoxyvirus puede establecerse mediante diferentes técnicas:
- Microscopía electrónica
- Serología
- Amplificación génica (PCR)
- Secuenciación del ADN después del aislamiento o cultivo, para la identificación precisa de la especie viral
Dada su proximidad genética, pueden producirse errores de identificación entre estos virus.
En el gato, la poxvirosis se observa desde hace unos 30 años en Gran Bretaña, Países Bajos, Bélgica y Alemania. Su presencia en Francia se ha notificado regularmente desde 1999. Esta infección afecta casi exclusivamente a gatos rurales cazadores. La contaminación procede principalmente de pequeños roedores salvajes (topillos, ratones de campo), más raramente de bovinos.
El topillo rojizo (Clethrionomys glareolus) y, en menor medida, el topillo agreste (Microtus agrestis) desempeñan un papel predominante en el mantenimiento de la infección. Estos roedores también pueden transmitir el virus a otras especies que comparten el mismo hábitat natural (sintópicas), como el ratón de campo (Apodemus sylvaticus), e incluso a jerbos y ardillas terrestres en las regiones orientales. También se han notificado casos en ratas importadas de países de Europa del Este. El aumento estacional de los casos (verano y otoño) corresponde al período de actividad principal y de proliferación de estos pequeños roedores.
La transmisión se efectúa principalmente por vía transcutánea, a veces por vía oronasal.
Clínicamente, en el gato, la infección se manifiesta inicialmente por una lesión macular y eritematosa única, localizada en la cabeza, el cuello o las extremidades anteriores. En unos diez días, aparecen numerosas lesiones pruriginosas secundarias: máculas, pápulas, nódulos eritematosos, que se ulceran progresivamente y pueden afectar todo el cuerpo, incluida la cavidad bucal. Con frecuencia se observan signos generales (fiebre, rinitis, conjuntivitis).
La evolución suele ser favorable, con curación espontánea de las lesiones secundarias en 3 a 8 semanas. Sin embargo, complicaciones como sobreinfecciones bacterianas o coinfección retroviral pueden provocar una generalización de las lesiones cutáneas y una neumonía a veces mortal.
En la rata, las manifestaciones cutáneas son comparables a las del gato.
La transmisión al ser humano se ha documentado tanto a partir del gato como de la rata, con un pronóstico particularmente reservado en individuos inmunodeprimidos o de edad avanzada. El cese de la vacunación antivariólica podría haber reducido la protección cruzada contra los poxvirus en la población general, predisponiendo así a los sujetos no vacunados, particularmente si están inmunodeprimidos, a estas infecciones.
En el ser humano, después de un período de incubación de 2 a 6 días, las manifestaciones cutáneas de la viruela bovina suelen ser benignas: lesiones papulosas, vesiculares, umbilicadas y areoladas, localizadas en la cara, las manos, los brazos y, a veces, las mucosas (especialmente en niños). Con frecuencia, la erupción va acompañada de signos generales (fiebre, adenopatía). En pacientes inmunodeprimidos, la infección puede adoptar una forma grave con viruela pustulosa y hemorrágica generalizada, potencialmente mortal.
El diagnóstico en animales se basa principalmente en la histopatología de las biopsias cutáneas, que revelan lesiones específicas de las poxvirosis. Otras técnicas menos comunes incluyen la microscopía electrónica, la serología, el aislamiento viral y la PCR.
El tratamiento en el gato es esencialmente sintomático, con el objetivo de controlar las sobreinfecciones bacterianas y mantener una alimentación adecuada a pesar de las lesiones bucales dolorosas.
Las medidas profilácticas son fundamentales:
- Aislamiento del gato enfermo para evitar la contaminación interfesina.
- Eutanasia de las ratas afectadas.
- Desinfección del medio ambiente (lejía) debido a la resistencia del virus.
- Precauciones durante las manipulaciones (uso de guantes) para limitar el riesgo zoonótico, especialmente para personas vulnerables (inmunodeprimidos, niños, ancianos).
Implicaciones para la salud pública y estrategias de prevención
Las dermatozoonosis, aunque menos mediáticas que otras zoonosis sistémicas, representan un problema de salud pública no despreciable, particularmente en el contexto de una relación hombre-animal cada vez más estrecha. Una encuesta retrospectiva en una clientela dermatológica veterinaria revela que casi el 35% de los propietarios comparten la cama de su animal (gato o perro), y persisten en esta costumbre incluso cuando ellos mismos presentan lesiones dermatológicas atribuibles a su compañero.
Esta proximidad, asociada a la multiplicidad de agentes patógenos potencialmente transmisibles, subraya la importancia de un enfoque preventivo coordinado entre médicos, veterinarios y dueños de animales.
Papel del veterinario clínico
El veterinario clínico ocupa una posición estratégica en la interfaz entre la salud animal y la salud humana. Su papel no se limita al diagnóstico y tratamiento de las afecciones animales; se extiende a:
- Información al propietario sobre los riesgos zoonóticos potenciales asociados a su animal.
- Educación sobre las medidas preventivas adaptadas a cada situación.
- Detección precoz de las afecciones con potencial zoonótico.
- Implementación de tratamientos apropiados con el objetivo no solo de curar al animal sino también de interrumpir la cadena de transmisión al hombre.
- Colaboración con los médicos para un manejo global de los casos que implican una transmisión al hombre.
Esta misión de salud pública resulta particularmente delicada porque requiere conciliar el apego emocional de los propietarios a sus animales con los imperativos sanitarios. A menudo es ilusorio querer modificar radicalmente los comportamientos de convivencia entre los propietarios y sus compañeros, pero una información clara y objetiva suele permitir la adopción de medidas de precaución razonables.
Poblaciones en riesgo particular
Ciertas poblaciones presentan una mayor vulnerabilidad a las dermatozoonosis y merecen una atención específica:
- Personas inmunodeprimidas (pacientes bajo inmunosupresores, personas que viven con el VIH, receptores de trasplantes, pacientes bajo quimioterapia): la infección por el VIH, en particular, confiere una dimensión particular al riesgo zoonótico, con manifestaciones potencialmente más graves de afecciones como la esporotricosis, la leishmaniasis, las poxvirosis o la tuberculosis.
- Niños pequeños: su sistema inmunitario aún inmaduro, asociado a comportamientos de riesgo (contactos estrechos con animales, higiene de manos no sistemática) los expone particularmente.
- Personas mayores: fragilidad inmunitaria asociada a la edad.
- Mujeres embarazadas: riesgos específicos relacionados con ciertos agentes patógenos.
- Profesionales en contacto con animales: veterinarios y su personal, criadores, peluqueros caninos, personal de refugios.
Para estas poblaciones, deben formularse recomendaciones específicas, que pueden ir desde simples precauciones de higiene reforzada hasta la evitación temporal de ciertas especies animales según el contexto clínico.
Estrategias preventivas específicas
Para las dermatofitosis
- Detección de portadores asintomáticos en las colectividades de animales.
- Aislamiento y tratamiento temprano de los animales afectados.
- Desinfección rigurosa del entorno.
- Precauciones al adquirir nuevos animales (particularmente gatitos de criaderos o tiendas de animales).
- Sensibilización especial de los responsables de colectividades infantiles (escuelas, guarderías) sobre los riesgos asociados a las mascotas de clase.
Para las sarnas y otras ectoparasitosis
- Tratamiento antiparasitario regular de las mascotas.
- Control de las poblaciones de animales vagabundos.
- Precauciones adicionales al adoptar animales de refugios.
- Identificación y tratamiento de todos los animales en contacto en caso de diagnóstico positivo.
Para la leishmaniosis
- Detección anual en zonas de enzoótica.
- Uso de repelentes contra flebótomos durante la temporada de actividad vectorial.
- Limitación de las salidas nocturnas de perros en regiones endémicas.
- Seguimiento riguroso de los perros infectados.
- Información clara a los propietarios sobre los riesgos y las medidas de prevención.
Para las enfermedades transmitidas por mordedura o arañazo
- Educación de los propietarios sobre el manejo adecuado de los animales.
- Desinfección inmediata de cualquier herida, por mínima que sea.
- Consulta médica rápida en caso de signos inflamatorios.
- Programa de control de pulgas para limitar la transmisión de B. henselae en gatos.
Enfoque “Una sola salud”
El concepto “One Health” (Una sola salud) reconoce la interdependencia entre la salud humana, la salud animal y la salud ambiental. Este enfoque adquiere todo su sentido en la gestión de las dermatozoonosis, que ilustran perfectamente esta interconexión.
La estrecha colaboración entre médicos y veterinarios constituye la piedra angular de una gestión eficaz de estas patologías.
Esta cooperación debe articularse en torno a varios ejes:
- Intercambio de información sobre los casos detectados y las evoluciones epidemiológicas.
- Estandarización de los protocolos diagnósticos para facilitar las comparaciones entre casos humanos y animales.
- Coordinación de los enfoques terapéuticos para evitar la aparición de resistencias.
- Elaboración conjunta de mensajes preventivos coherentes dirigidos al público.
- Investigación colaborativa sobre los mecanismos de transmisión y los factores de riesgo.
Esta colaboración interprofesional debe enmarcarse en un contexto más amplio que implique también:
- Las autoridades de salud pública
- Los laboratorios de diagnóstico
- Las estructuras de investigación
- Las asociaciones de protección animal
- Los profesionales de la ganadería y las tiendas de mascotas
Solo este enfoque integrado permitirá una gestión óptima de estas afecciones en la interfaz hombre-animal.
Precauciones fundamentales
Se pueden recomendar algunas precauciones fundamentales, válidas para todas las dermatozoonosis, a los propietarios de animales y profesionales:
- Higiene rigurosa de las manos después de cualquier contacto con animales, particularmente antes de las comidas.
- Desparasitación y desparasitación externa regulares de los animales domésticos.
- Vigilancia veterinaria regular con mención explícita de cualquier contacto con personas vulnerables.
- Limpieza frecuente de los lugares donde duermen los animales.
- Uso de guantes al manipular animales que presenten lesiones cutáneas.
- Evitar temporalmente contactos estrechos (compartir cama, lamer la cara) en caso de dermatosis animal diagnosticada.
- Consulta médica rápida en caso de aparición de lesiones cutáneas en el ser humano después del contacto con un animal enfermo.
Estas medidas sencillas, asociadas a una mayor concienciación de los propietarios sobre los signos de alerta, permitirían reducir significativamente la incidencia de casos de transmisión al hombre.
Conclusión
Las dermatozoonosis constituyen un grupo heterogéneo de afecciones cutáneas transmisibles entre los animales vertebrados y el hombre, con una prevalencia relativamente baja en comparación con el conjunto de zoonosis, pero un impacto potencial significativo en la salud pública. A excepción de algunas entidades específicas como la esporotricosis, la enfermedad por arañazo de gato, la leishmaniasis y la viruela bovina, estas afecciones rara vez presentan un carácter de gravedad médica en el hombre, que generalmente constituye un callejón sin salida parasitario.
Sin embargo, la curación del propietario afectado, con o sin tratamiento, está destinada al fracaso si la fuente de contaminación —el animal— no es identificada y tratada adecuadamente. Esta interdependencia subraya la importancia crucial de un enfoque coordinado entre la medicina veterinaria y la medicina humana.
El veterinario clínico, por su posición estratégica en la interfaz hombre-animal, desempeña un papel clave en la detección precoz, el tratamiento adecuado y la prevención de estas afecciones. Su responsabilidad se extiende más allá del cuidado animal para englobar una dimensión de salud pública, que implica información, educación y colaboración con los médicos.
En un contexto de creciente integración de las mascotas en las familias, con contactos físicos estrechos cada vez más frecuentes, la vigilancia ante las dermatozoonosis cobra mayor importancia. Esta proximidad, si bien es fuente de innegables beneficios psicológicos y sociales, impone una medicalización adecuada de las mascotas como corolario indispensable de su integración familiar.
Finalmente, el enfoque “One Health”, que reconoce la interconexión entre la salud humana, la salud animal y la salud ambiental, proporciona un marco conceptual relevante para abordar estas patologías. Solo una estrecha colaboración entre todos los actores implicados (veterinarios, médicos, dueños de animales, autoridades sanitarias) permitirá minimizar los riesgos de transmisión al tiempo que se preservan los beneficios de la relación hombre-animal.
FAQ
1. ¿Los animales portadores de gérmenes zoonóticos presentan sistemáticamente signos clínicos identificables?
No, muchos animales pueden ser portadores asintomáticos de agentes patógenos transmisibles al hombre. Este es el caso, en particular, de las dermatofitosis (especialmente en gatos), la leishmaniasis (aproximadamente el 50% de los perros infectados en zonas enzoóticas son asintomáticos) o la enfermedad por arañazo de gato (los gatos bacteriémicos generalmente no presentan ningún signo clínico). Esta particularidad complica la detección y justifica medidas preventivas sistemáticas, especialmente para las poblaciones en riesgo.
2. ¿Cómo distinguir clínicamente las diferentes formas de sarna animal y evaluar su potencial zoonótico?
Las diferentes sarnas animales (sarcóptica, notoédrica, trixacárica) presentan cuadros clínicos relativamente similares en el animal (lesiones eritemato-escamo-costrosas y prurito), pero se distinguen por su distribución preferente y la especie animal afectada. Su potencial zoonótico es variable: todas pueden provocar lesiones en el ser humano, pero constituyen generalmente “hemizoonosis” en las que el parásito no puede completar su ciclo vital en la piel humana. El diagnóstico parasitológico preciso mediante raspado cutáneo es esencial para evaluar el riesgo de transmisión y adaptar las medidas preventivas.
3. ¿Los tratamientos antiparasitarios preventivos comercializados para animales de compañía ofrecen una protección completa contra las dermatozoonosis parasitarias?
Los antiparasitarios externos modernos, especialmente aquellos a base de isoxazolinas, avermectinas o milbemicinas, ofrecen una excelente protección contra la mayoría de los ectoparásitos responsables de dermatozoonosis (pulgas, sarcoptes, notoedres, cheyletiellas). Sin embargo, su eficacia no es absoluta y depende de múltiples factores: cumplimiento del tratamiento, cobertura del espectro parasitario, resistencias emergentes, particularidades individuales. Además, estos tratamientos generalmente no ofrecen protección contra las dermatozoonosis fúngicas, bacterianas o virales. Por lo tanto, sigue siendo necesario un enfoque preventivo global que combine el tratamiento antiparasitario, una higiene adecuada y una vigilancia veterinaria regular.
4. ¿Qué hacer ante un animal que presenta lesiones cutáneas en un hogar con personas inmunodeprimidas?
En esta situación de alto riesgo, se imponen varias medidas: consulta veterinaria inmediata para un diagnóstico preciso, aislamiento temporal del animal en una habitación dedicada hasta la resolución de las lesiones, uso de guantes durante las manipulaciones necesarias, desinfección rigurosa de las superficies de contacto y refuerzo de la higiene de manos. Según el diagnóstico establecido y el grado de inmunodepresión de la persona afectada, se pueden considerar medidas más estrictas, siempre en consulta entre el veterinario y el médico tratante. En algunos casos particulares que implican agentes altamente patógenos como Sporothrix schenckii en un paciente gravemente inmunodeprimido, puede ser necesaria una separación temporal.
5. ¿El aumento de casos de dermatozoonosis observado en las últimas décadas refleja una verdadera emergencia o simplemente una mejor detección?
La aparente evolución de la incidencia de las dermatozoonosis probablemente se debe a una combinación de factores. Por un lado, los avances diagnósticos y la mayor concienciación de los profesionales de la salud permiten una mejor identificación de los casos. Por otro lado, varios factores favorecen una verdadera emergencia: aumento del número de animales de compañía e intensificación de los contactos físicos, multiplicación de los viajes internacionales que facilitan la circulación de nuevos patógenos, crecimiento de las poblaciones inmunodeprimidas más vulnerables a estas infecciones, modificaciones ambientales que afectan los ciclos parasitarios y aparición de resistencias a los tratamientos antiparasitarios. Es necesario un enfoque epidemiológico riguroso, que asocie la medicina humana y veterinaria, para cuantificar con precisión estas tendencias y adaptar las estrategias preventivas.
Referencias
- guaguère é. dermatozoonosis en entorno urbano: el punto de vista del dermatólogo veterinario = dermatozoonosis en entornos urbanos: el punto de vista del dermatólogo veterinario. 33522539.pdf.
- martín s, schmutz jl. las dermatozoonosis. nouv dermatol 2002 ; 21 : supl.2 : 37-42.
- viaud s, bensignor e. las dermatozoonosis del perro y el gato. prat med chir anim comp 2008 : 43, 131-9.
- euzéby j. micología médica comparada: las micosis de los animales y sus relaciones con las micosis del hombre. tomo i. oullins: fundación marcel merieux; 1992.
- moriello ka, de boer dj. dermatofitosis en: guaguère e, prélaud p, editores. guía práctica de dermatología felina. lyon: mérial; 2000. p. 4.1–11.
- brouta f, deschamps f, losson b, mignon b. datos recientes sobre la patogénesis de la infección por microsporum canis en carnívoros domésticos. ann med vet 2001; 145: 236–42.
- mignon b. dermatofitosis. en: guaguère e, prélaud p, editores. guía práctica de dermatología canina. lyon: kalianxis; 2006. p. 153–66.
- guaguère e, hubert t, muller a. dermatología de pequeños mamíferos de compañía. en: enciclopedia veterinaria – dermatología, elsevier, parís, 2007; vol 2 (3700) 1-17.
- carlotti dn. el tratamiento de las dermatofitosis del perro y el gato. manejo de la tiña en gateras. prat med chir anim comp 2008; 43: 1–13.
- viguié-vallanet c. las tiñas. ann dermatol venereol 1999 ; 126 : 349-56.
- ferrer l, fondati a. micosis profundas. en: guaguère e, prélaud p, editores. guía práctica de dermatología felina. lyon: mérial; 2000. p. 5.1-11.
- schubach tm, schubach a, okamoto t, barros mb, figueiredo fb, cuzzi t, et al. evaluación de una epidemia de esporotricosis en gatos: 347 casos (1998—2001). j am vet med assoc 2004; 224: 1623-9.
- cafarchia c, sasanelli m, lia rp, de caprariis d, guillot j, otranto d. esporotricosis linfocutánea y nasal en un perro del sur de italia: informe de caso. mycopathologia 2007; 163: 75—9.
- verde m. dermatozoonosis. en: guaguère e, prélaud p, editores. guía práctica de dermatología felina. lyon: mérial; 2000. p. 25.1–7.
- guaguère e, beugnet f. dermatosis parasitarias. en: guaguère e, prélaud p, editores. guía práctica de dermatología canina. lyon: kalianxis; 2006; p 181- 231.
- paterson s. enfermedades de la piel de mascotas exóticas (paterson s, ed), blackwell publishing, oxford, 2006; 333 p.
- ellis c, mori m. enfermedades de la piel de roedores y pequeños mamíferos exóticos. vet clin north am exotic anim pract 2007; 4: 523-7.
Recherches Connexes
dermato zoonosis, punto de vista, dermatología, en el hombre, dermatozoonosis, animales, dermatólogo, zoonosis, enfermedades, servicio, medio, gato, perro, parásitos, nódulo, s, práctica, dermatofitos, humano, infección, microsporum canis, contacto, piel, pústulas, trichophyton verrucosum, b, vol, viaud, roedores, pulgas, en el gato, especies, mordedura, virus, casos, infestaciones, francia, conocimiento, salud, riesgo, dermatosis, dermatitis, ácaro, transmisión, lesiones, doi, veterinario, ambiente, animales de compañía, aves, niños, carnívoros domésticos, antebrazos, signos clínicos, zoo, trichophyton mentagrophytes, causa, autores, pápulas, picaduras, información, personas, sarcoptes, diagnóstico, compañía, signos, contagio