La dermatología veterinaria ha experimentado una transformación radical durante las dos últimas décadas, marcada por la emergencia y propagación mundial de los estafilococos resistentes a la meticilina (ERM). Anteriormente consideradas como infecciones bacterianas simples y que respondían de manera predecible a los tratamientos, las piodermatitis caninas están hoy en el centro de una crisis de resistencia a los antimicrobianos.
Septiembre 2025
Introducción: La Emergencia de un Desafío Clínico y de Salud Pública
Esta evolución ha obligado a la profesión veterinaria a revisar fundamentalmente sus enfoques diagnósticos, terapéuticos y de bioseguridad. Este informe tiene como objetivo proporcionar un análisis exhaustivo de la importancia de los ERM en dermatología veterinaria, basándose en los datos científicos actuales para orientar la práctica clínica y la salud pública.
El desafío principal reside en el hecho de que la resistencia a la meticilina, que confiere una ineficacia clínica a todo el grupo de los betalactámicos, está muy frecuentemente asociada a un fenotipo de multirresistencia (MDR). Esta asociación hace inoperantes numerosas otras familias de antibióticos, como los macrólidos, las lincosamidas, las fluoroquinolonas o los aminoglucósidos. Esta situación ha generado un cambio de paradigma terapéutico. El fracaso de los tratamientos empíricos, anteriormente eficaces, obliga a los clínicos a recurrir a moléculas antibióticas de último recurso, como el cloranfenicol o la rifampicina. Estas alternativas, aunque potencialmente eficaces si el antibiograma lo confirma, presentan perfiles de efectos indeseables más limitantes y requieren un seguimiento biológico más estrecho, aumentando así la complejidad, los riesgos y el costo del manejo.
Es importante señalar que para el GEDAC (Grupo de Estudio Francés en Dermatología de Animales de Compañía), la rifampicina forma parte de los antibióticos que nunca se deben utilizar para preservarla para la medicina humana y tratar infecciones humanas graves como la tuberculosis. Lo mismo ocurre con la mupirocina.
Contexto histórico y cambio de paradigma
La era posterior a la Segunda Guerra Mundial introdujo los antimicrobianos en medicina veterinaria, revolucionando el tratamiento de las enfermedades infecciosas. Durante décadas, las piodermatitis caninas, causadas principalmente por estafilococos, se trataron con éxito con antibióticos β-lactámicos, como las penicilinas y las cefalosporinas. Sin embargo, este uso generalizado, a menudo empírico, ejerció una presión de selección intensa sobre las poblaciones bacterianas. El resultado inevitable de esta presión fue la aparición de cepas resistentes, transformando un problema clínico manejable en un desafío terapéutico mayor. La aparición significativa del Staphylococcus pseudintermedius resistente a la meticilina (SPIRM) hacia mediados de los años 2000 marcó un punto de inflexión, señalando el final de la era de confianza en los tratamientos empíricos para la piodermatitis. Esto no es un evento aislado, sino la consecuencia directa y predecible de nuestras prácticas terapéuticas pasadas. Siendo la piodermatitis canina una afección extremadamente frecuente, y el tratamiento de primera intención históricamente un antibiótico β-lactámico, el uso repetido de estos medicamentos creó un ambiente evolutivo ideal para la selección y propagación de cepas portadoras de genes de resistencia. Así, nuestros propios protocolos de tratamiento han moldeado involuntariamente la aparición de los patógenos que hoy son más difíciles de tratar.
Definición y taxonomía
La resistencia a la meticilina en los estafilococos es un fenotipo que confiere resistencia a prácticamente todos los antibióticos de la clase de los β-lactámicos, incluyendo las penicilinas, las cefalosporinas y los carbapenemes. El mecanismo molecular subyacente es la presencia del gen mecA, que se localiza en un elemento genético móvil llamado casete cromosómico estafilocócico (SCCmec). Este gen codifica para una proteína de unión a la penicilina modificada, la PBP2a (Proteína de Unión a la Penicilina 2a), que posee una afinidad muy baja por los antibióticos β-lactámicos. En consecuencia, la síntesis de la pared celular bacteriana puede continuar incluso en presencia de estos antibióticos, haciéndolos ineficaces.
El fenotipo de multirresistencia (MDR) frecuentemente observado en los ERM no es un fenómeno fortuito. El casete SCCmec es una plataforma genética que, además del gen mecA, puede transportar y transferir genes que confieren resistencia a otras clases de antibióticos (por ejemplo, tetraciclinas, macrólidos). Así, la presión de selección ejercida por el uso de un betalactámico puede no solo seleccionar cepas resistentes a la meticilina, sino también co-seleccionar, en un solo evento, resistencia a múltiples otras familias de antibióticos. Este fenómeno de co-selección explica la aparición rápida de cepas casi intratable y refuerza el argumento contra el uso empírico de betalactámicos en las infecciones estafilocócicas.
Un punto fundamental para comprender la epidemiología actual es la reclasificación taxonómica ocurrida en 2005. Anteriormente, la mayoría de los estafilococos coagulasa-positivos aislados en perros se identificaban como Staphylococcus intermedius. Las técnicas moleculares permitieron distinguir tres especies distintas dentro del grupo Staphylococcus intermedius (SIG): S. intermedius, S. delphini y S. pseudintermedius. Esta revisión reveló que S. pseudintermedius es la especie predominante que coloniza y causa infecciones en perros y gatos. Por consiguiente, la gran mayoría de los aislados previamente identificados como S. intermedius en la literatura veterinaria eran en realidad S. pseudintermedius. En dermatología canina, tres especies de ERM son particularmente relevantes: S. pseudintermedius (SPIRM), S. aureus (SARM) y S. schleiferi (SSRM).
Importancia global y el concepto “One Health”
El problema de los ERM en animales de compañía trasciende ampliamente las paredes de la clínica veterinaria para convertirse en una preocupación de salud pública. Esta situación se enmarca perfectamente en el concepto “One Health” (Una Sola Salud), que reconoce la interconexión profunda e indisociable entre la salud humana, la salud animal y la salud del medio ambiente. Los animales de compañía comparten nuestro ambiente doméstico, reciben a menudo clases de antibióticos similares a las utilizadas en medicina humana, y pueden servir como reservorios o vectores para las bacterias resistentes. La presencia de SARM y SPIRM en animales de compañía los coloca en el centro de un “triángulo” de transmisión dinámico entre humanos, animales y su ambiente común. El manejo de la resistencia a los antibióticos en dermatología veterinaria no es por tanto solo una cuestión de bienestar animal, sino también una responsabilidad compartida en la lucha mundial contra la amenaza creciente de las “superbacterias”.
Epidemiología y Evolución de los Estafilococos Resistentes
La epidemiología de los ERM en medicina veterinaria es un campo dinámico, caracterizado por la aparición rápida de clones resistentes y su diseminación mundial. Comprender la prevalencia, los factores de riesgo y los reservorios de estos patógenos es esencial para un manejo clínico y preventivo eficaz.
A. Staphylococcus pseudintermedius Resistente a la Meticilina (SPIRM): El Patógeno Canino Dominante
Historial de la aparición
Aunque se reportaron casos esporádicos en los años 1990, la aparición significativa del SPIRM como patógeno clínico mayor es un fenómeno relativamente reciente, que tomó impulso a partir de 2006. Los primeros reconocimientos oficiales datan de 2001 en América del Norte y de 2007 en Europa. Esta aparición rápida no fue fruto de eventos de resistencia múltiples e independientes, sino que se debió principalmente a la propagación clonal explosiva de algunas líneas bacterianas muy eficientes.
Propagación clonal mundial
El análisis por tipificación de secuencia multilocus (MLST) permitió cartografiar la diseminación mundial del SPIRM. Una revisión sistemática identificó cinco complejos clonales (CC) mayores que dominan el panorama epidemiológico.
- CC71: Inicialmente descrito como el “clon epidémico europeo”, hoy está extendido mundialmente, aunque la mayoría de los aislados provienen aún de Europa.
- CC68: Conocido como el “clon epidémico norteamericano”, se aísla frecuentemente en América del Norte pero también ha sido identificado en Europa.
- CC258: Cada vez más reportado en Europa, este clon presenta un perfil de resistencia distinto al del CC71.
- CC45 y CC112: Estos linajes son particularmente prevalentes en Asia, pero también han sido detectados en otros continentes.
Esta dinámica ilustra un proceso en dos etapas: primero, la selección local de estos clones por la presión ejercida por el uso de antibióticos en medicina veterinaria, notablemente los betalactámicos; segundo, su diseminación global facilitada por los movimientos internacionales crecientes de animales de compañía. Esta diseminación rápida en vastas áreas geográficas está fuertemente facilitada por los desplazamientos internacionales de perros, ya sea para exposiciones, reproducción o viajes. Un estudio realizado en Granada documentó por primera vez la introducción del SPIRM en la isla, con datos genotípicos y epidemiológicos que sugieren que perros “visitantes” transmitieron el patógeno a la población canina local.
Prevalencia
La prevalencia del SPIRM varía de manera espectacular según la población canina estudiada, lo que tiene implicaciones directas para la sospecha clínica.
- En perros sanos: El portaje de SPIRM en perros sanos es generalmente bajo. Los estudios reportan tasas de prevalencia que van del 0% al 4,5%. Estos animales son portadores asintomáticos.
- En perros enfermos: La situación es radicalmente diferente en las poblaciones de perros presentados por problemas dermatológicos. En las clínicas de dermatología especializadas, la prevalencia del SPIRM en perros con piodermatitis puede ser extremadamente alta, alcanzando hasta el 40,5% en un estudio. Otro estudio realizado en Tailandia en perros con piodermatitis reveló una prevalencia global de ERM del 35,7%. Esta disparidad subraya que los perros con enfermedades cutáneas crónicas constituyen una población de muy alto riesgo. Un estudio de gran envergadura realizado en Estados Unidos entre 2019 y 2022 analizó decenas de miles de aislados clínicos e identificó 110,423 aislados de SPIRM. En Francia, datos más recientes de animales enfermos reportan una frecuencia de SPIRM del 17%.
Factores de riesgo
La identificación de los factores de riesgo es crucial para enfocar los esfuerzos de diagnóstico y prevención. Varios factores han sido constantemente asociados a un riesgo aumentado de infección o colonización por SPIRM:
- Uso previo de antibióticos: Es el factor de riesgo más importante y frecuentemente citado. La exposición reciente a antibióticos, particularmente β-lactámicos y fluoroquinolonas, selecciona las cepas resistentes eliminando la flora sensible competidora.
- Contacto con el medio veterinario: Hospitalizaciones recientes o visitas frecuentes a clínica veterinaria aumentan el riesgo de exposición al SPIRM.
- Enfermedades cutáneas crónicas subyacentes: Los perros que sufren de dermatitis atópica, alergias u otitis crónicas están particularmente predispuestos. Estas condiciones alteran la barrera cutánea y requieren a menudo tratamientos antimicrobianos repetidos, creando un círculo vicioso.
Reservorios ambientales
Los estafilococos son bacterias robustas capaces de sobrevivir durante largos períodos en superficies inanimadas. Las clínicas veterinarias actúan como reservorios ambientales importantes para el SPIRM. Un estudio mostró que el SPIRM podía aislarse en el 10% de las superficies muestreadas en clínicas de atención primaria, sin diferencia significativa entre las superficies de contacto con las manos (ej: manillas de puertas, teclados) y las superficies de contacto con los animales (ej: mesas de examen). La tipificación de las cepas reveló una gran similitud entre los aislados de un mismo hospital, pero una baja similitud entre hospitales, lo que indica transmisión y persistencia intrahospitalaria. Cepas de SPIRM indistinguibles fueron encontradas tanto en pacientes caninos como en superficies ambientales dentro de la misma clínica, confirmando el papel del ambiente en la transmisión nosocomial. Una higiene de manos inadecuada del personal veterinario, con un cumplimiento reportado tan bajo como el 14%, es un factor mayor que contribuye a esta transmisión.
B. Staphylococcus aureus Resistente a la Meticilina (SARM) y S. schleiferi (SSRM): Una Perspectiva Comparativa
Aunque el SPIRM es el actor principal, otros ERM juegan un papel en dermatología canina.
Staphylococcus aureus (SARM)
- S. aureus es ante todo un comensal y patógeno humano. Su presencia en el perro es por tanto epidemiológicamente distinta a la de S. pseudintermedius.
- Origen y Transmisión: S. aureus no es miembro de la flora comensal normal del perro. Por consiguiente, cuando se aísla un SARM en un perro, se trata más frecuentemente de una colonización o infección transitoria resultante de una transmisión del hombre al animal, fenómeno conocido como zoonosis reversa o antroponosis. Esta colonización es generalmente de corta duración, eliminándose el organismo en algunas semanas si no hay re-exposición.
- Prevalencia y Factores de Riesgo: La prevalencia del portaje de SARM en perros sanos es baja, generalmente entre 0 y 4%. Sin embargo, esta tasa puede ser más elevada en poblaciones específicas de animales que tienen contacto estrecho con el sistema de salud humano, como los perros de terapia que visitan hospitales o los animales de compañía pertenecientes a profesionales de la salud. Los factores de riesgo identificados en animales de compañía para la adquisición del SARM reflejan los del hombre: antibioterapia previa, hospitalización y contacto con una persona infectada o colonizada por SARM.
- Importancia Clínica: Aunque es menos frecuente que el SPIRM, el SARM es un patógeno oportunista capaz de provocar infecciones clínicas en el perro, notablemente piodermatitis, infecciones de heridas quirúrgicas e infecciones del tracto urinario.
Staphylococcus schleiferi (SSRM)
- S. schleiferi, que existe en dos subespecies (S. schleiferi subsp. schleiferi, coagulasa-negativa, y S. schleiferi subsp. coagulans, coagulasa-positiva), es cada vez más reconocido como un patógeno cutáneo importante en el perro.
- Patógeno Emergente: Ahora se identifica como una causa significativa de piodermatitis y otitis externa canina. En algunos estudios, es el segundo estafilococo más frecuentemente aislado en estas condiciones.
- Tasas de Resistencia Elevadas: Una característica preocupante de S. schleiferi es su alta tasa de resistencia a la meticilina. Estudios realizados en centros de referencia en dermatología han reportado tasas de resistencia del 40% al 46,6%. Un estudio en una población menos sesgada encontró una tasa de resistencia del 20% en perros con dermatitis inflamatoria.
- Multirresistencia: Como el SPIRM, el SSRM presenta a menudo multirresistencia, notablemente resistencia frecuente a las fluoroquinolonas, lo que complica aún más las opciones terapéuticas.
La distinción entre estos tres patógenos es de importancia capital en la práctica clínica. Un reporte de laboratorio que identifica un “Estafilococo resistente a la meticilina” requiere una interpretación informada para guiar el manejo del caso, la comunicación con el cliente y las medidas de bioseguridad. Por ejemplo, la identificación de un SARM (S. aureus) debe inmediatamente hacer sospechar una fuente humana y desencadenar una discusión sobre los riesgos potenciales para la salud de los miembros del hogar. Por el contrario, un diagnóstico de SPIRM orientará la investigación hacia el manejo de la enfermedad cutánea subyacente del perro y el control de la contaminación ambiental. La siguiente tabla sintetiza estas diferencias clave.
|
Característica |
Staphylococcus pseudintermedius (SPIRM) |
Staphylococcus aureus (SARM) |
Staphylococcus schleiferi (SSRM) |
|
Estado Comensal Principal |
Perro (flora normal de la piel y mucosas) |
Hombre (colonización canina transitoria) |
Perro y Hombre (flora cutánea) |
|
Prevalencia en la Piodermatitis Canina |
Muy elevada (patógeno dominante) |
Baja a moderada |
Baja a moderada (patógeno emergente) |
|
Reservorio Principal |
Animal (perro) |
Humano (sistema de salud, comunidad) |
Animal y Humano |
|
Vía de Transmisión Principal |
Animal-Animal, Ambiente-Animal |
Hombre-Animal (zoonosis reversa) |
Menos definida, probablemente Animal-Animal |
|
Potencial Zoonótico (Animal → Hombre) |
Bajo pero documentado |
Significativo (preocupación de salud pública mayor) |
Raro, principalmente nosocomial en el hombre |
Patogénesis de la Piodermatitis Estafilocócica
La piodermatitis estafilocócica no es simplemente la presencia de bacterias en la piel; es el resultado de una interacción compleja entre el patógeno, el huésped y el ambiente. La transición de S. pseudintermedius de un simple residente de la piel a un agente infeccioso depende de la ruptura del equilibrio delicado que mantiene la homeostasis cutánea.
De Comensal a Patógeno Oportunista: El Papel de la Barrera Cutánea
- S. pseudintermedius es un comensal bien adaptado a su huésped canino, colonizando la piel y las mucosas (fosas nasales, boca, faringe, perineo) del 46% al 92% de los perros sanos sin causar enfermedad. La infección es un evento oportunista, que solo se produce cuando las defensas del huésped están debilitadas. La barrera cutánea, compuesta de elementos físicos (stratum corneum), químicos (lípidos, péptidos antimicrobianos) e inmunológicos, es la principal línea de defensa. Cualquier alteración de esta barrera crea una puerta de entrada para la invasión bacteriana.
La importancia clínica del SPIRM no reside en una virulencia aumentada comparada con su homólogo sensible (MSSP). En efecto, los estudios no han demostrado que las cepas resistentes a la meticilina sean intrínsecamente más agresivas o patógenas. Los mecanismos de la enfermedad y las lesiones clínicas que provocan son indistinguibles. El verdadero desafío está en otra parte: reside en el fracaso terapéutico. Frente a una infección por SPIRM, un tratamiento empírico con un antibiótico de primera línea, como la cefalexina, está condenado al fracaso. Este fracaso inicial desencadena una cascada de consecuencias negativas: la enfermedad se prolonga, aumentando la morbilidad e incomodidad del animal; la carga bacteriana en el animal y su ambiente aumenta, incrementando el riesgo de transmisión; y esto lleva a menudo a ciclos de antibioterapias sucesivas e ineficaces, que no solo no resuelven el problema, sino que ejercen una presión de selección adicional, favoreciendo la aparición de resistencias adicionales. Así, una simple piodermatitis se transforma en un caso clínico complejo, crónico, costoso y frustrante, con implicaciones potenciales para la salud pública. Es esta dimensión del fracaso terapéutico lo que confiere al SPIRM su importancia clínica devastadora.
Papel de los Factores de Virulencia
Una vez franqueada la barrera, S. pseudintermedius utiliza un arsenal de factores de virulencia para establecer la infección.
- Toxinas Exfoliativas (ExpA y ExpB): Estas proteínas son actores clave en la formación de las lesiones de piodermatitis. Actúan como proteasas altamente específicas que atacan y escinden la desmogleína-1 canina, una cadherina desmosomal esencial para la adhesión entre los queratinocitos en la epidermis. La degradación de la desmogleína-1 perturba la cohesión de la epidermis, provocando un clivaje intraepidérmico (acantólisis) y la formación de pústulas subcórneas. La inyección intradérmica de estas toxinas purificadas en perros reproduce los signos clínicos de la piodermatitis, como el eritema y la formación de costras, confirmando su papel patógeno directo. Otras toxinas incluyen la toxina exfoliativa SIET, una leucotoxina bicomponente, Luk-I, que ataca y destruye los leucocitos polimorfonucleares, y enterotoxinas superantigénicas, como SECCANINE, capaces de provocar una activación policlonal de los linfocitos T.
- Adhesinas y Proteínas de Superficie: Para iniciar una infección, la bacteria debe primero adherirse a las células del huésped. S. pseudintermedius expresa una serie de proteínas de superficie, llamadas adhesinas (familia Sps), que se unen específicamente a los componentes de la matriz extracelular del huésped, como el fibrinógeno, la fibronectina y la citoqueratina-10. Proteínas como SpsD y SpsL facilitan no solo la adhesión a los corneocitos, sino también la invasión de los queratinocitos y la formación de biofilms.
- Formación de Biofilm: El biofilm es una comunidad estructurada de bacterias envueltas en una matriz polimérica autoproducida, que ofrece protección contra las defensas inmunitarias del huésped y los antibióticos, contribuyendo así a la cronicidad de las infecciones. La formación de biofilm es particularmente crítica en las infecciones crónicas, las otitis y las infecciones de sitios quirúrgicos, especialmente en materiales inertes como implantes o hilos de sutura. El biofilm protege eficazmente las bacterias de la respuesta inmune del huésped y de la penetración de antibióticos, haciendo la erradicación de la infección extremadamente difícil.
El Factor Predisponente Central: La Ruptura de la Barrera Cutánea
La casi totalidad de los casos de piodermatitis estafilocócica canina son enfermedades secundarias. La afirmación según la cual “los perros sanos no desarrollan infecciones cutáneas” es un principio fundamental en dermatología veterinaria. La identificación y manejo de la causa subyacente son por tanto no solo importantes para el tratamiento, sino absolutamente esenciales para la prevención de recidivas.
- Dermatitis Atópica y Alergias: Es la causa subyacente más frecuente. La inflamación alérgica (ya sea debida a alérgenos ambientales, alimentarios o a picaduras de pulgas) compromete la barrera cutánea de varias maneras. Primero, el prurito intenso que provoca lleva a un autotraumatismo (rascado, lamido, mordisqueo) que daña físicamente el stratum corneum. Segundo, la inflamación misma altera la composición y organización de los lípidos intercelulares (ceramidas) y disminuye la producción de péptidos antimicrobianos naturales, haciendo la piel más permeable y menos apta para defenderse contra los microbios. Este ambiente cutáneo inflamado y dañado es un terreno ideal para la proliferación de S. pseudintermedius.
- Otros Factores Predisponentes: Otras condiciones también pueden alterar la integridad de la piel y predisponer a las infecciones. Estas incluyen las endocrinopatías como el hipotiroidismo y el hipercorticismo (síndrome de Cushing), que afectan la renovación de la piel y la inmunidad local; los ectoparásitos (Demodex, Sarcoptes) que causan daños directos e inflamación; y los trastornos de la queratinización (seborrea) que modifican la superficie de la piel.
Enfoque Clínico y Diagnóstico de las Piodermatitis por Estafilococos Resistentes
Frente a un caso de piodermatitis, el clínico debe adoptar un enfoque sistemático y basado en la evidencia. La era de la resistencia a los antimicrobianos exige mayor rigor diagnóstico para evitar los fracasos terapéuticos y promover un uso juicioso de los antibióticos.
A. Presentación Clínica
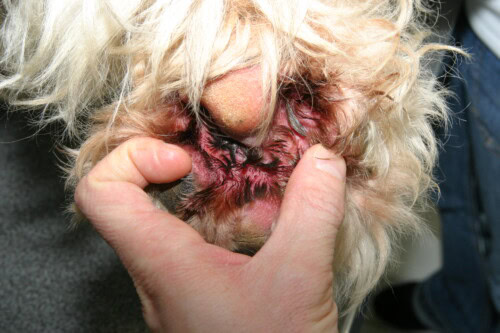
Las infecciones cutáneas estafilocócicas en el perro se clasifican según la profundidad de la afectación tisular.
- Piodermatitis Superficial: La infección está confinada a la epidermis y los folículos pilosos. La forma más común es la foliculitis bacteriana superficial. Las lesiones clínicas típicas son variadas e incluyen:
- Pápulas y Pústulas Foliculares: Pequeñas elevaciones rojas (pápulas) o llenas de pus (pústulas), centradas en un pelo.
- Collarines Epidérmicos: Son lesiones muy características. Se presentan como zonas circulares de alopecia con un borde de escamas o costras que se extiende de manera centrífuga.
- Lesiones en Diana: Zonas de eritema central con un borde más pálido y un anillo eritematoso periférico.
- Aspecto “Apolillado”: En perros de pelo corto, la foliculitis puede manifestarse por múltiples pequeñas zonas de alopecia, dando al pelaje una apariencia “comida por polillas”.
- Otros signos como costras, eritema e hiperpigmentación postinflamatoria también son frecuentes.
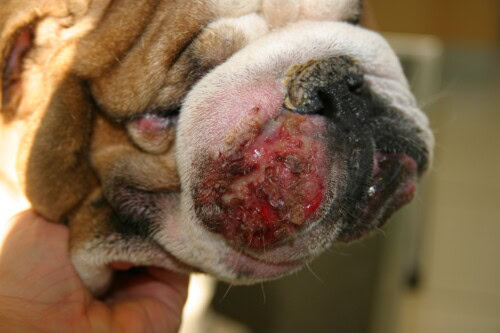
- Piodermatitis Profunda: Esta forma es más severa ya que implica una ruptura de los folículos pilosos (furunculosis) y una extensión de la infección en la dermis y a veces la hipodermis (celulitis). Los signos clínicos son más espectaculares y a menudo dolorosos:
- Nódulos y Ampollas Hemorrágicas: Lesiones elevadas, firmes o fluctuantes, a menudo llenas de contenido purulento o sanguinolento.
- Fístulas Drenantes: Aberturas en la piel por las que fluye un exudado sero-sanguinolento o purulento.
- Signos Severos: Edema, úlceras, costras gruesas e inflamación marcada son comunes. A diferencia de la piodermatitis superficial, los perros con piodermatitis profunda pueden presentar signos sistémicos como fiebre, letargo y anorexia.
Un punto de importancia capital debe subrayarse: es clínicamente imposible distinguir una piodermatitis causada por una cepa de estafilococo resistente a la meticilina de una infección causada por una cepa sensible. Las lesiones son morfológicamente idénticas. La sospecha de una infección resistente no debe por tanto basarse nunca en la apariencia de las lesiones, sino en la anamnesis del paciente, la presencia de factores de riesgo y, sobre todo, la respuesta al tratamiento.
B. Estrategia Diagnóstica Basada en la Evidencia
El advenimiento de los ERM ha impuesto un cambio de paradigma en el enfoque diagnóstico de la piodermatitis. El enfoque histórico de “tratar primero, hacer preguntas después” con antibióticos empíricos no solo se ha vuelto obsoleto, sino que ahora se considera peligroso y contrario a los principios de la administración de antimicrobianos. La citología, anteriormente considerada como una herramienta complementaria, se ha convertido en una etapa esencial e innegociable del examen inicial. Ignorar la citología en el contexto actual de resistencia generalizada constituye una falta profesional. Es el pivote de la decisión clínica: confirma la presencia de una infección bacteriana, justificando así la instauración de un tratamiento antimicrobiano (que debería ser tópico en primera intención), guía el reconocimiento de casos que necesitan cultivo inmediato (presencia de bacilos, piodermatitis profunda), y permite evaluar la respuesta al tratamiento.
La Citología Cutánea: La Herramienta Indispensable de Primera Línea
La citología es una prueba diagnóstica rápida, poco costosa, mínimamente invasiva y realizable en clínica, que debería efectuarse sistemáticamente en todo paciente que presente lesiones compatibles con piodermatitis.
- Técnica de Toma de Muestra: El método depende de la naturaleza de la lesión.
- Impresión directa en lámina: Para lesiones húmedas o exudativas, o después de haber roto una pústula intacta con una aguja estéril.
- Test de cinta adhesiva: Ideal para lesiones secas, descamativas o situadas en zonas de difícil acceso como los espacios interdigitales.
- Hisopo: Útil para tomar material de los conductos auditivos o fístulas.
- Interpretación: La muestra se tiñe (por ejemplo, con una tinción tipo Wright-Giemsa modificada) y se examina al microscopio. El hallazgo de cocos fagocitados por neutrófilos degenerados es la prueba patognomónica de una piodermatitis bacteriana. La presencia de numerosas bacterias extracelulares asociadas a una población de células inflamatorias también es muy sugestiva. La citología también permite detectar la presencia de otros agentes (levaduras tipo Malassezia, bacilos) y evaluar el tipo de respuesta inflamatoria.
La citología es el primer examen primordial a realizar
Cultivo Bacteriano y Antibiograma: La Clave de la Terapia Dirigida
El cultivo bacteriano con prueba de sensibilidad a antimicrobianos (antibiograma) no es necesario para todos los casos de piodermatitis, pero es imperativo en circunstancias específicas para guiar una terapia racional.
- Indicaciones Claras: El cultivo y antibiograma son fuertemente recomendados, incluso obligatorios, en las siguientes situaciones:
- Respuesta clínica insuficiente (menos del 50% de mejoría de las lesiones) después de dos semanas de antibioterapia sistémica apropiada.
- Aparición de nuevas lesiones (pápulas, pústulas) durante un tratamiento antibiótico en curso desde al menos dos semanas.
- Presencia de bacilos en el examen citológico.
- Presencia de lesiones de piodermatitis profunda (furunculosis, celulitis, nódulos).
- Antecedentes de infección multirresistente en el animal u otro animal del hogar.
- Metodología de Toma de Muestra: Para ser confiable, la toma de muestra para cultivo debe realizarse de manera aséptica para evitar cualquier contaminación. La calidad de la toma de muestra es determinante. Los sitios y técnicas de muestreo ideales son:
- Pústula intacta: Es el sitio ideal. Después de una desinfección suave, la pústula se rompe estérilmente con una aguja y su contenido se recoge en un hisopo.
- Costra: El hisopo se pasa sobre la superficie húmeda de la piel después de haber levantado delicadamente una costra reciente.
- Collarín epidérmico: El hisopo se rueda firmemente sobre el borde activo de la lesión.
- Nódulo o fístula: Una biopsia tisular para cultivo es el método de elección para lesiones profundas.
- Interpretación y Utilidad: El laboratorio identificará la especie bacteriana y probará su sensibilidad a un panel de antibióticos. Para los estafilococos, la prueba de sensibilidad a la oxacilina o cefoxitina se usa para detectar la resistencia a la meticilina (presencia del gen mecA). El antibiograma es la única manera de elegir un antibiótico sistémico eficaz contra una cepa de SPIRM, que a menudo es multirresistente.
El antibiograma resulta primordial en el manejo de los ERM
Principios Terapéuticos y Manejo de las Infecciones por SPIRM
El manejo de las piodermatitis por SPIRM ha evolucionado hacia un enfoque multimodal que pone énfasis en la terapia tópica, reserva la antibioterapia sistémica a indicaciones precisas y, sobre todo, ataca la causa subyacente de la infección.
A. La Terapia Tópica: Piedra Angular del Tratamiento
Frente al aumento de la resistencia, la terapia tópica ha sido elevada del estatus de tratamiento de apoyo al de tratamiento de primera línea. Las directrices internacionales, como las de la Asociación Mundial de Dermatología Veterinaria (WAVD), recomiendan ahora la terapia tópica como modalidad de tratamiento de elección para las piodermatitis superficiales, ya sean causadas por cepas sensibles o resistentes. Varios estudios han demostrado que un protocolo de tratamiento tópico bien conducido puede ser tan eficaz como una antibioterapia sistémica para resolver una piodermatitis superficial, incluyendo aquellas causadas por SPIRM. Las ventajas son múltiples: obtención de concentraciones de antisépticos muy elevadas en el sitio de la infección (muy por encima de la concentración mínima inhibitoria), reducción del riesgo de selección de resistencia en otros sistemas (como el tracto digestivo), y efectos benéficos no específicos como el desbridamiento mecánico de costras y detritos.
Agentes Antisépticos Eficaces
Varios ingredientes activos han probado su eficacia.
- Clorhexidina: Es el agente tópico más estudiado y recomendado debido a su potente actividad antimicrobiana in vivo y su efecto remanente. Es bactericida contra los estafilococos, incluyendo las cepas resistentes a la meticilina. Las concentraciones eficaces en productos veterinarios varían generalmente del 2% al 4%.
- Peróxido de Benzoilo: A concentraciones del 2,5% al 3%, posee actividad antimicrobiana, así como propiedades queratolíticas (ayuda a eliminar las capas de piel muerta), comedolíticas (abre los folículos pilosos) y desengrasantes. Sin embargo, puede ser resecante e irritante para la piel, lo que puede limitar su uso o requerir el empleo concomitante de emolientes.
- Otros agentes: Otros antisépticos como el hipoclorito de sodio diluido (lejía diluida), el ácido acético/ácido bórico, y el lactato de etilo también han mostrado cierta eficacia y pueden ser opciones válidas.
Protocolos de Aplicación
El éxito de la terapia tópica depende de manera crítica del cumplimiento del protocolo.
- Formulaciones: La elección de la formulación depende de la extensión de las lesiones, el tipo de pelaje y la facilidad de aplicación para el propietario.
- Champús: Ideales para infecciones generalizadas, permiten tratar grandes superficies cutáneas.
- Espumas, Sprays, Toallitas: Muy útiles para aplicación diaria, para tratamientos localizados, o para días sin baño. Generalmente no requieren enjuague.
- Cremas, Ungüentos, Geles: Convienen para lesiones localizadas y zonas poco peludas.
- Frecuencia y Tiempo de Contacto: Un tiempo de contacto de al menos 10 minutos es crucial para que los champús antisépticos puedan ejercer su efecto bactericida. La frecuencia de baño recomendada es generalmente de 2 a 3 veces por semana, pero puede aumentarse a frecuencia diaria en casos severos de SPIRM. Las espumas y sprays pueden aplicarse una o dos veces por día. El tratamiento debe continuarse durante al menos 7 a 10 días después de la resolución clínica completa de las lesiones para prevenir recaídas precoces. Para animales de pelo largo o denso, un rapado es a menudo indispensable para permitir que el producto alcance la piel y actúe eficazmente.
Tabla 1: Protocolos de Terapia Tópica para la Piodermatitis Superficial Canina
|
Principio Activo |
Concentraciones Comunes |
Formulaciones Disponibles |
Protocolo de Aplicación Recomendado |
Observaciones Clínicas |
|
Clorhexidina |
2%, 3%, 4% |
Champú, Espuma, Spray, Toallitas, Gel |
Champú: 2-3 veces/semana, tiempo de contacto de 10 minutos. Espuma/Spray/Toallitas: 1-2 veces/día, especialmente los días sin champú. |
Antiséptico de primera elección. Muy buena eficacia y tolerancia. El rapado mejora significativamente la eficacia. |
|
Peróxido de benzoilo |
2.5%, 3% |
Champú, Gel |
Champú: 2-3 veces/semana, tiempo de contacto de 5-10 minutos. |
Acción queratolítica y desengrasante útil en ciertos casos. Potencial irritante y resecante más elevado que la clorhexidina. |
|
Hipoclorito de sodio |
0.005% (dilución) |
Solución para baño |
Baños: 2-3 veces/semana, tiempo de contacto de 10-15 minutos. |
Alternativa interesante y poco costosa. Preparación extemporánea necesaria (lejía diluida). |
|
Antibióticos tópicos (Mupirocina, Ácido fusídico) |
2% |
Pomada, Crema |
Aplicación: 2-3 veces/día sobre lesiones muy localizadas. |
Reservados para lesiones focales. El uso extensivo está proscrito para limitar el riesgo de selección de resistencia. La mupirocina no debe usarse (Recomendaciones GEDAC) |
B. La Antibioterapia Sistémica: Un Enfoque Razonado y Dirigido
El uso de antibióticos sistémicos debe ser una decisión reflexiva y justificada, no un reflejo. Se reserva para las piodermatitis profundas, donde la infección alcanza tejidos que la terapia tópica no puede penetrar eficazmente, y para los casos de piodermatitis superficial generalizada que no responden a un tratamiento tópico solo bien conducido.
Principio de Selección
La elección de un antibiótico sistémico para una infección sospechosa o confirmada de SPIRM debe imperativamente basarse en los resultados de un antibiograma. El uso empírico de antibióticos de segunda o tercera línea es una práctica peligrosa que favorece la aparición de resistencias aún más extendidas. Es crucial respetar la “regla de experto“: un estafilococo resistente a la oxacilina debe considerarse como clínicamente resistente a todos los betalactámicos, incluso si el antibiograma sugiere una sensibilidad aparente a ciertas cefalosporinas. La duración del tratamiento debe ser suficientemente larga: mínimo 3 a 4 semanas para una piodermatitis superficial y 6 a 8 semanas para una piodermatitis profunda, continuando siempre el tratamiento durante 1 a 2 semanas después de la resolución clínica completa.
Opciones Terapéuticas para el SPIRM (basadas en la sensibilidad)
El SPIRM es, por definición, resistente a todos los antibióticos β-lactámicos. Además, los clones epidémicos son a menudo multirresistentes, presentando resistencia cruzada a numerosas otras clases de antibióticos comúnmente usados en medicina veterinaria, como las tetraciclinas, macrólidos (eritromicina), lincosamidas (clindamicina) y fluoroquinolonas (enrofloxacina). Las opciones terapéuticas son por tanto limitadas y deben elegirse con cuidado según los resultados del cultivo. El uso de antibióticos de importancia crítica en medicina humana (vancomicina, linezolid, teicoplanina) está fuertemente desaconsejado.
Tabla 2: Opciones de Antibioterapia Sistémica para las Infecciones por Estafilococos Resistentes en el Perro (basado en un antibiograma)
|
Antibiótico |
Posología (Perro) |
Frecuencia de Administración |
Efectos Secundarios Notables |
Precauciones y Seguimiento Recomendado |
|
Cloranfenicol |
50 mg/kg |
Cada 8 horas (TID) |
Trastornos gastrointestinales (vómitos, diarrea), debilidad neurológica, mielosupresión reversible (dosis-dependiente). |
Margen de seguridad estrecho. Seguimiento hematológico recomendado durante tratamientos prolongados. Contraindicado en animales reproductores. |
|
Doxiciclina / Minociclina |
5-10 mg/kg |
Cada 12 horas (BID) |
Trastornos gastrointestinales (vómitos, esofagitis). La minociclina puede ser más eficaz que la doxiciclina en ciertas cepas. |
Administrar con alimento y agua para reducir el riesgo de esofagitis. La fotosensibilidad es rara pero posible. |
|
Clindamicina |
11 mg/kg |
Cada 12 horas (BID) |
Trastornos gastrointestinales. |
A menudo ineficaz en SPIRM debido a co-resistencia frecuente. Eficacia condicionada por el antibiograma. |
|
Rifampicina |
5-10 mg/kg |
Cada 24 horas (SID) |
Hepatotoxicidad potencialmente severa, trastornos gastrointestinales, coloración anaranjada de orina y lágrimas. |
Nunca usar en monoterapia (riesgo de selección rápida de mutantes resistentes). Seguimiento de enzimas hepáticas imperativo antes y durante tratamiento (ej: a 2 y 4 semanas). Nunca debe usarse (Recomendaciones GEDAC) |
|
Sulfamidas potenciadas (TMS) |
15-30 mg/kg |
Cada 12 horas (BID) |
Queratoconjuntivitis seca (KCS), reacciones de hipersensibilidad (poliartritis, anemia, trombocitopenia), hepatopatías. |
Riesgo idiosincrásico elevado en ciertas razas (Doberman). Seguimiento del test de Schirmer recomendado durante tratamientos largos. |
Desafíos y Efectos Indeseables
El tratamiento de las infecciones por SPIRM con antibióticos de “reserva” no está exento de dificultades.
- Cloranfenicol: Aunque a menudo eficaz in vitro, está asociado a una incidencia muy elevada de efectos secundarios gastrointestinales (vómitos, diarrea, anorexia), que llevan frecuentemente a la suspensión del tratamiento. Casos de neurotoxicidad reversible (paresia de miembros posteriores) también han sido descritos.
- Doxiciclina/Minociclina: Fracasos clínicos han sido reportados a pesar de pruebas de sensibilidad favorables. Esto puede deberse a umbrales de interpretación de sensibilidad (breakpoints) que no siempre predicen con precisión la eficacia clínica para S. pseudintermedius.
- Rifampicina: Debe usarse en combinación con otro antibiótico eficaz para prevenir la selección rápida de mutantes resistentes. Vigilancia de la función hepática es recomendada debido al riesgo de hepatotoxicidad.
- Aminoglucósidos (ej: amikacina): Estos medicamentos requieren administración por inyección y seguimiento atento de la función renal debido a su nefrotoxicidad potencial.
C. Manejo de la Causa Subyacente: La Clave de la Prevención de Recidivas
El tratamiento antimicrobiano, ya sea tópico o sistémico, solo ataca las consecuencias de la enfermedad (la infección bacteriana) y no su causa. Sin un diagnóstico y control riguroso de la enfermedad primaria subyacente (dermatitis atópica, alergia alimentaria, hipotiroidismo, etc.), las recidivas de piodermatitis son ineludibles. Cada recidiva requiere un nuevo ciclo de tratamiento, aumentando la presión de selección para la resistencia y el riesgo de aparición de cepas aún más difíciles de tratar. El manejo a largo plazo de estas afecciones primarias es por tanto la estrategia más eficaz para romper este ciclo, mejorar la calidad de vida del animal y reducir la dependencia global de los antibióticos.
Colonización versus Infección: Implicaciones Clínicas y Epidemiológicas
La distinción entre colonización e infección por un ERM es un concepto fundamental cuya comprensión es esencial para un manejo racional de los pacientes y la prevención de la transmisión. Estos dos estados representan escenarios biológicos y clínicos muy diferentes, con implicaciones distintas en términos de tratamiento y salud pública.
Definición y Distinción
- Colonización (o Portaje): Este estado se define por la presencia y multiplicación de una bacteria, como el SPIRM, en las superficies corporales de un huésped (piel, mucosas nasales, orales, anales) sin que haya signos clínicos de enfermedad o respuesta inflamatoria por parte del huésped. El animal es un “portador sano“; la bacteria forma parte de su microflora de superficie, de manera transitoria o persistente, pero no causa daño.
- Infección: La infección se produce cuando la bacteria franquea las barreras de defensa del huésped, invade los tejidos y se multiplica, desencadenando una respuesta inflamatoria y provocando signos clínicos de enfermedad (por ejemplo, las pústulas e inflamación de la piodermatitis).
Significación Clínica y Epidemiológica del Portaje
El estatus de portador, aunque asintomático, tiene consecuencias clínicas y epidemiológicas profundas. La persistencia de la colonización después de la resolución de una infección clínica es un fenómeno particularmente preocupante que redefine la noción de “curación”. Un animal cuyas lesiones cutáneas han desaparecido puede parecer clínicamente curado, pero puede seguir siendo un portador asintomático. Este estatus de portador “oculto” transforma al animal curado en una amenaza epidemiológica latente. Se convierte en un “caballo de Troya“, capaz de reintroducir el patógeno en el ambiente clínico, contaminar otros pacientes vulnerables, y servir de reservorio para su propia reinfección futura. Esta constatación impone un cambio de perspectiva: el éxito terapéutico ya no puede juzgarse únicamente sobre la base de la resolución de los signos clínicos. Debe integrar una estrategia de manejo a largo plazo del estatus de portador, basada en la higiene, el control riguroso de la enfermedad subyacente para reforzar la barrera cutánea, y una comunicación clara con el propietario sobre los riesgos persistentes.
- Persistencia después del Tratamiento: Una de las constataciones más importantes es que la curación clínica de una piodermatitis por SPIRM no conlleva necesariamente la erradicación de la bacteria del organismo. Un estudio de seguimiento mostró que entre los perros inicialmente diagnosticados con piodermatitis por SPIRM, el 45,2% seguían siendo portadores de SPIRM en su piel y el 47,6% en sus sitios de portaje mucosos (nariz, recto) después de la resolución completa de los signos clínicos.
- Fuente de Reinfección Endógena: Un animal colonizado se convierte en su propio reservorio para futuras infecciones. La bacteria reside en las mucosas y puede fácilmente transferirse a la piel durante el aseo o lamido. Si la barrera cutánea del animal se ve comprometida de nuevo (por ejemplo, durante un brote alérgico), la bacteria puede rápidamente proliferar y provocar una nueva infección.
- Fuente de Transmisión Exógena: Los animales portadores asintomáticos diseminan continuamente el SPIRM en su ambiente (domicilio, parques, clínicas veterinarias), contaminando las superficies y actuando como fuente silenciosa de transmisión a otros animales y, potencialmente, a los humanos.
- Adquisición Nosocomial de la Colonización: El medio clínico es un lugar de alto riesgo para la adquisición del estatus de portador. El mismo estudio reveló que entre los perros que no tenían SPIRM al inicio del tratamiento de su piodermatitis (causada por una cepa sensible), el 28,3% se colonizaron por SPIRM en su piel después del tratamiento. La tasa de portaje mucoso en este grupo aumentó significativamente, pasando del 7,8% antes del tratamiento al 26,7% después. Esto sugiere que el ambiente hospitalario y los procedimientos de tratamiento pueden facilitar la transmisión y colonización por cepas resistentes.
Enfoque de la Descolonización
La cuestión de si se debe intentar activamente eliminar el estatus de portador (descolonización) es compleja y controvertida.
- No-recomendación General: Para la mayoría de los casos, la descolonización activa de animales portadores sanos no se recomienda.
- Justificación:
- La colonización por SARM (S. aureus) en animales de compañía es a menudo transitoria y se elimina naturalmente en algunas semanas, siempre que la fuente de re-exposición (generalmente humana) sea controlada.
- El uso de antibióticos sistémicos para intentar erradicar el portaje no solo es ineficaz (los antibióticos no alcanzan concentraciones suficientes en las superficies mucosas), sino que también es contraproducente ya que ejerce presión de selección adicional a favor de la resistencia.
- Aunque las terapias tópicas (champús antisépticos, ungüentos nasales) pueden reducir temporalmente la carga bacteriana, su eficacia a largo plazo para una erradicación completa del portaje no ha sido demostrada en estudios controlados.
En la actualidad, no existe consenso científico para recomendar un intento de descolonización sistemática de estos animales portadores. Los protocolos estudiados han mostrado eficacia limitada e inconstante, con un riesgo no despreciable de seleccionar cepas aún más resistentes. El enfoque privilegiado para el manejo de animales colonizados se concentra por tanto en medidas no antibióticas: el refuerzo de la higiene (baños antisépticos regulares para reducir la carga cutánea), el control estricto de la enfermedad subyacente para mantener una barrera cutánea sana, y la implementación de medidas de control de infección para limitar la transmisión.
Potencial Zoonótico y Prevención de la Transmisión
La presencia de bacterias multirresistentes en animales de compañía, que comparten nuestro ambiente más íntimo, plantea cuestiones legítimas de salud pública. La evaluación del riesgo zoonótico y la implementación de medidas de control de infección son responsabilidades compartidas por veterinarios y propietarios de animales.
A. Evaluación del Riesgo Zoonótico
Es crucial diferenciar el riesgo asociado a las diferentes especies de estafilococos, ya que no es uniforme.
- Comparación SPIRM vs SARM:
- S. aureus Resistente a la Meticilina (SARM): El riesgo zoonótico asociado al SARM está bien establecido y se considera significativo. El SARM es un patógeno humano mayor, y los animales de compañía actúan más frecuentemente como víctimas colaterales de la epidemia humana, colonizándose por cepas de origen humano (zoonosis reversa). Una vez colonizados o infectados, pueden sin embargo convertirse en reservorios silenciosos dentro del hogar, contribuyendo a la persistencia del SARM en la comunidad y planteando un riesgo de (re)infección para los humanos. La transmisión puede ocurrir en ambas direcciones.
- S. pseudintermedius Resistente a la Meticilina (SPIRM): El riesgo zoonótico directo del SPIRM se considera bajo. S. pseudintermedius es una bacteria altamente adaptada al huésped canino y está mal equipada para colonizar duraderamente o causar infecciones en humanos sanos. Sin embargo, este riesgo, aunque bajo, no es nulo. Casos de infecciones humanas por SPIRM han sido reportados, generalmente en personas inmunodeprimidas o en contacto muy estrecho. El riesgo principal del SPIRM para la salud humana podría ser indirecto: puede actuar como reservorio de genes de resistencia (como el gen mecA) que podrían potencialmente transferirse a patógenos humanos más virulentos como S. aureus.
- Dinámica de Transmisión Asimétrica:
- Para el SARM (MRSA): El reservorio principal es el humano. Los animales de compañía son más frecuentemente “víctimas colaterales”. La vía de transmisión predominante es Hombre → Animal.
- Para el SPIRM (MRSP): El reservorio principal y casi exclusivo es el perro. La transmisión es principalmente inter-canina. La transmisión al hombre, aunque posible, sigue siendo un evento raro (spillover zoonótico ocasional).
- Pruebas de Transmisión:
- Transmisión Animal-Hombre: Varios estudios han usado tipificación molecular para probar la transmisión de cepas de SPIRM idénticas entre perros infectados y sus propietarios.
- Riesgo Profesional para el Personal Veterinario: El personal veterinario constituye una población en riesgo de portaje profesional. Un estudio realizado durante una conferencia de dermatología veterinaria reveló una tasa de portaje nasal de SPIRM del 3,9% entre los participantes.
B. Medidas de Control de Infección (“Infection Control”)
La prevención de la transmisión de ERM se basa en la aplicación rigurosa de protocolos de higiene y bioseguridad, tanto en medio clínico como en el hogar.
Recomendaciones para las Clínicas Veterinarias
Cada clínica veterinaria debería implementar un programa formal de control de infecciones. Las medidas fundamentales, basadas en las “Precauciones Estándar“, incluyen:
- Higiene de Manos: Es la medida más simple y eficaz para prevenir la transmisión cruzada.
- Equipo de Protección Individual (EPI): El uso de guantes es obligatorio para manipular cualquier animal que presente lesiones cutáneas. Batas o delantales de protección deben usarse.
- Manejo de Pacientes: Los pacientes hospitalizados con infección por ERM confirmada o sospechosa deben colocarse en aislamiento. Para las consultas externas, se recomienda programar estos pacientes al final del día.
- Limpieza y Desinfección del Ambiente: Las superficies de alto contacto y el material reutilizable deben limpiarse y desinfectarse meticulosamente entre cada paciente.
Consejos para Propietarios de Animales Infectados o Colonizados
La educación de los propietarios es un componente esencial. Los consejos deben ser claros, prácticos y no alarmistas.
- Higiene de Manos Rigurosa: Los propietarios deben ser instruidos para lavarse las manos sistemáticamente después de tocar su animal.
- Limitación de Contactos Estrechos: Durante la fase activa de la infección, es prudente limitar los contactos íntimos (lamido de la cara, dormir en la cama).
- Protección de Personas en Riesgo: Si personas inmunodeprimidas, niños muy pequeños, personas mayores o personas con heridas cutáneas viven en el hogar, precauciones adicionales son necesarias.
- Higiene del Ambiente Doméstico: La cama del animal, sus juguetes y comederos deben lavarse regularmente con agua caliente y jabón.
Conclusión: Hacia un Manejo Integrado por la Administración de Antimicrobianos y el Enfoque “One Health”
La aparición de los estafilococos resistentes a la meticilina, y en particular del SPIRM, en dermatología veterinaria, constituye mucho más que un simple desafío terapéutico. Representa una amenaza compleja que pone en evidencia las fallas de nuestros enfoques pasados en materia de uso de antimicrobianos y subraya la interconexión profunda entre la salud animal, la salud humana y el medio ambiente. El manejo eficaz de este problema ya no puede basarse únicamente en la búsqueda de un nuevo antibiótico “milagroso”, sino que exige un enfoque integrado, holístico y sostenible, fundado en los principios de la administración de antimicrobianos y del concepto “One Health”.
Síntesis de la Importancia
Los ERM han transformado la piodermatitis canina, una afección antaño banal, en una enfermedad potencialmente crónica, difícil de tratar y costosa. La importancia del SPIRM no reside en una virulencia aumentada, sino en su capacidad para escapar a nuestras terapias de primera línea, llevando a fracasos terapéuticos, morbilidad prolongada y riesgo aumentado de transmisión. La persistencia de la colonización después de la curación clínica crea reservorios silenciosos que perpetúan el ciclo de infección y contaminación. Además, el potencial zoonótico, aunque variable según las especies de estafilococos, coloca el manejo de estas infecciones en la encrucijada de la medicina veterinaria y la salud pública.
Principios de la Administración de Antimicrobianos (“Antimicrobial Stewardship”)
La lucha contra la propagación de la resistencia a antimicrobianos pasa inevitablemente por un uso más responsable y juicioso de los antibióticos. La administración de antimicrobianos es un enfoque coordinado que busca promover el uso apropiado de antimicrobianos para mejorar los resultados para los pacientes, minimizando las consecuencias involuntarias. En dermatología veterinaria, esto se traduce en acciones concretas:
- Privilegiar la terapia tópica: Elevar la terapia tópica al rango de tratamiento de primera intención para todas las piodermatitis superficiales.
- Diagnosticar antes de tratar: Usar sistemáticamente la citología para confirmar la infección y reservar la antibioterapia sistémica para casos donde sea absolutamente necesaria.
- Tratar basándose en evidencias: Basar la elección de cualquier antibiótico sistémico en los resultados de un antibiograma.
- Tratar la causa, no solo el síntoma: Identificar y manejar rigurosamente la enfermedad subyacente para prevenir recidivas.
- Respetar los protocolos: Usar la dosis correcta, duración correcta y vía de administración correcta.
El Imperativo de un Enfoque “One Health”
El problema del SPIRM en dermatología canina es un microcosmos de la crisis mundial de resistencia a antibióticos. Ilustra perfectamente por qué un enfoque compartimentado está condenado al fracaso. La resistencia a antimicrobianos es un problema que no conoce fronteras entre especies o ecosistemas. El uso de antibióticos en un perro en una clínica veterinaria puede tener repercusiones que se extienden a la salud de las personas en su hogar. Un enfoque “One Health” eficaz requiere colaboración activa entre médicos, veterinarios y responsables de salud pública para establecer vigilancia integrada de la resistencia, armonizar las directrices, educar al público y promover la investigación.
Perspectivas Futuras
El futuro del manejo de ERM en dermatología veterinaria dependerá de nuestra capacidad para integrar plenamente estos principios en la práctica diaria. Los ejes de desarrollo futuro incluyen el refuerzo de la vigilancia epidemiológica, el desarrollo y validación de nuevas estrategias terapéuticas no antibióticas, y la mejora continua de la educación. Los ejes de investigación futura deben orientarse hacia varios frentes complementarios:
- Desarrollo de terapias alternativas: La investigación debe intensificarse para desarrollar y validar enfoques “post-antibióticos“. Estos incluyen el uso de bacteriófagos (virus matadores de bacterias), péptidos antimicrobianos, extractos de plantas, enzimas que lisan la pared bacteriana (endolisinas), o moléculas que atacan factores de virulencia en lugar del crecimiento bacteriano.
- Optimización de la administración de antimicrobianos: Sistemas de vigilancia epidemiológica robustos y continuos son necesarios para seguir en tiempo real la evolución de los clones de SPIRM y sus perfiles de resistencia a escala local y nacional.
- Comprensión de la transición comensal-patógeno: Una mejor comprensión de los factores que desencadenan el paso de S. pseudintermedius de un estado de comensal inofensivo al de agente infeccioso es una vía de investigación prometedora para prevenir la incidencia de infecciones.
El desafío es considerable, pero un enfoque proactivo, colaborativo y basado en la ciencia puede permitirnos preservar la eficacia de nuestros antimicrobianos y proteger la salud de nuestros pacientes animales y de la comunidad humana en su conjunto.
Referencias
- Frank, L. A., & Loeffler, A. (2012). Meticillin-resistant Staphylococcus pseudintermedius: clinical challenge and treatment options. Veterinary Dermatology, 23(4), 283-e56.
- van Duijkeren, E., Catry, B., Greko, C., Moreno, M. A., Pomba, C., Pyörälä, S., Ružauskas, M., Sanders, P., Threlfall, E. J., & Torren-Edo, J. (2011). Review on methicillin-resistant Staphylococcus pseudintermedius. Journal of Antimicrobial Chemotherapy, 66(12), 2705-2714.
- Morris, D. O., Boston, R. C., O’Shea, K., & Rankin, S. C. (2010). The prevalence of carriage of meticillin-resistant staphylococci by veterinary dermatology practice staff and their respective pets. Veterinary Dermatology, 21(4), 400-407.
- Cohn, L. A., & Middleton, J. R. (2010). A veterinary perspective on methicillin-resistant staphylococci. Journal of Veterinary Emergency and Critical Care, 20(1), 31-45.
- Duquette, R. A., & Nuttall, T. J. (2004). Methicillin-resistant Staphylococcus aureus in dogs and cats: an emerging problem? Journal of Small Animal Practice, 45(12), 591-597.
- Papich, M. G. (2023). Antimicrobial agents in small animal dermatology for treating staphylococcal infections. Journal of the American Veterinary Medical Association, 261(S1), S130-S139.
- Griffeth, G. C., Morris, D. O., Abraham, J. L., Shofer, F. S., & Rankin, S. C. (2008). Screening for skin carriage of methicillin-resistant coagulase-positive staphylococci and Staphylococcus schleiferi in dogs with healthy and inflamed skin. Veterinary Dermatology, 19(3), 142-149.
- Lilenbaum, W., et al. (2024). Nationwide analysis of methicillin-resistant staphylococci in cats and dogs: resistance patterns and geographic distribution. American Journal of Veterinary Research.
- Pomba, C., Rantala, M., Greko, C., Baptiste, K. E., Catry, B., van Duijkeren, E., Mateus, A., Moreno, M. A., Pyörälä, S., Ružauskas, M., & Torren-Edo, J. (2017). Public health risk of antimicrobial resistance transfer from companion animals. Journal of Antimicrobial Chemotherapy, 72(4), 957-968.
- Hillier, A., Lloyd, D. H., Weese, J. S., Blondeau, J. M., Cossens, C., Guardabassi, L., Papich, M. G., & Frank, L. (2014). Recommendations for approaches to meticillin-resistant staphylococcal infections of small animals: diagnosis, therapeutic considerations and preventative measures. Veterinary Dermatology, 25(3), e39-e53..
- Ngassam, C. T., et al. (2025). Mejor tratar las piodermatitis requiere reconocerlas mejor y saber detectar las resistencias bacterianas a los antibióticos. Le Nouveau Praticien Vétérinaire canine-féline.
- Gmyterco, V. C., Luciano, F. B., Ludwig, L. A., Evangelista, A. G., Ferreira, T. S., Borek, F., & de Farias, M. R. (2025). Estudio comparativo de una fórmula comercial que contiene antimicrobianos naturales versus terapias orales con cefalexina o tópicas con clorhexidina-miconazol para tratar pioderma superficial en perros. Veterinary Dermatology.
- Perreten, V., Kadlec, K., Schwarz, S., Grönlund Andersson, U., Finn, M., Greko, C., Moodley, A., Kania, S. A., Frank, L. A., Bemis, D. A., Franco, A., Iurescia, M., Battisti, A., Duim, B., Wagenaar, J. A., van Duijkeren, E., Weese, J. S., & Guardabassi, L. (2010). Propagación clonal de Staphylococcus pseudintermedius resistente a la meticilina en Europa y América del Norte: un estudio colaborativo internacional. Journal of Antimicrobial Chemotherapy, 65(6), 1145-1154.
- Loeffler, A., & Lloyd, D. H. (2010). Animales de compañía: un reservorio para Staphylococcus aureus resistente a la meticilina. Journal of Antimicrobial Chemotherapy, 65(4), 594-601.