En dermatología veterinaria, pocos microorganismos representan un desafío clínico tan constante y complejo como Pseudomonas aeruginosa. Este bacilo Gram negativo, lejos de ser un simple agente infeccioso, se revela como un adversario formidable, un patógeno oportunista por excelencia que explota con una eficacia temible la menor alteración de la barrera cutánea o la menor falla inmunitaria del huésped.
Introducción
Las infecciones que genera, principalmente las otitis externas crónicas y las piodermas profundas, se caracterizan a menudo por su severidad, su cronicidad y su naturaleza recalcitrante al tratamiento.
La gestión de estas afecciones es particularmente ardua debido a dos características biológicas fundamentales de este patógeno. Por una parte, P. aeruginosa posee una resistencia intrínseca a numerosas clases de antibióticos, una capacidad que complementa con una aptitud notable para adquirir nuevos mecanismos de resistencia, conduciendo a la emergencia de cepas multirresistentes (MDR). Por otra parte, su capacidad para formar biofilms — comunidades bacterianas estructuradas y protegidas por una matriz extracelular — constituye una verdadera fortaleza que lo pone a salvo de las defensas inmunitarias del huésped y de los agentes antimicrobianos. Esta doble estrategia de defensa y persistencia es la causa principal de los fracasos terapéuticos y de las recidivas frustrantes para el clínico.
Frente a esta problemática creciente, un enfoque terapéutico simplista o empírico está condenado al fracaso. La presente síntesis tiene por objetivo proporcionar un análisis exhaustivo e integrado, fundado en los datos científicos más recientes, para el manejo de las infecciones dermatológicas por P. aeruginosa. Este artículo de referencia detallará la biología y la patogenia de este microorganismo, propondrá un abordaje diagnóstico razonado y estructurado, y explorará en profundidad las estrategias terapéuticas multimodales. Se prestará especial atención a la interpretación crítica del antibiograma a la luz de las nuevas recomendaciones, a la gestión de las infecciones multirresistentes y a la evaluación de las innovaciones terapéuticas prometedoras, tales como los agentes anti-biofilm y la fagoterapia. La ambición de este trabajo es dotar al clínico de las herramientas conceptuales y prácticas necesarias para transformar la gestión de estos casos complejos de un combate incierto a una estrategia terapéutica controlada y eficaz.
1. Pseudomonas aeruginosa: Retrato de un Patógeno Oportunista Formidable
1.1. Ecología y Características Microbiológicas
La comprensión de la naturaleza de Pseudomonas aeruginosa comienza por el reconocimiento de su ubicuidad. Este microorganismo es omnipresente en el medio ambiente, colonizando fácilmente el suelo, el agua dulce, las superficies vegetales y las materias orgánicas en descomposición. Esta plasticidad ecológica explica no solamente su presencia frecuente como simple contaminante ambiental, sino también su papel preponderante en las infecciones nosocomiales, donde puede sobrevivir y proliferar en reservorios tan variados como los desinfectantes, los lavabos o los equipos médicos. Es fundamental señalar que P. aeruginosa no forma parte de la microflora comensal del conducto auditivo externo ni de la piel sana del perro. Su presencia en una muestra dermatológica es, por lo tanto, siempre clínicamente significativa.
Desde el punto de vista microbiológico, se trata de un bacilo Gram negativo, aerobio estricto, que se distingue por su movilidad, asegurada por un único flagelo polar. Sus exigencias nutricionales mínimas y su capacidad para tolerar una amplia gama de condiciones fisicoquímicas, incluidas temperaturas de hasta 42 °C, le confieren una capacidad de supervivencia y adaptación excepcional, permitiéndole colonizar ambientes hostiles donde pocas otras bacterias pueden subsistir.
1.2. Arsenal de Virulencia: De las Toxinas a las Enzimas
El poder patógeno de P. aeruginosa no reside en una sola toxina, sino en un arsenal complejo y redundante de factores de virulencia que actúan en sinergia para invadir los tejidos, escapar a la respuesta inmunitaria y causar daños celulares.
Entre los factores más conocidos figuran sus pigmentos. La piocianina, un pigmento azul-verdoso que da su color característico al pus “piociánico”, no es un simple marcador visual. Ejerce efectos proinflamatorios potentes sobre los fagocitos y altera las funciones inmunitarias de las células epiteliales, contribuyendo activamente a la patogenia. La invasión tisular es, por su parte, facilitada por una batería de enzimas extracelulares. La elastasa degrada el colágeno y la elastina, componentes mayores de la matriz extracelular, mientras que la proteasa alcalina interfiere con la formación de fibrina, impidiendo el confinamiento de la infección. Las fosfolipasas degradan los fosfolípidos de las membranas celulares, provocando una lisis celular.
A este arsenal se añaden toxinas potentes. La citotoxina (o leucocidina) y las hemolisinas atacan y destruyen las células inmunitarias y los eritrocitos. Además, P. aeruginosa utiliza sistemas de secreción sofisticados, como el sistema de secreción de tipo III (SST3), que actúa como una jeringa molecular para inyectar directamente efectores tóxicos (exotoxinas S y A) en el corazón de las células del huésped. Estas exotoxinas paralizan las funciones celulares, especialmente la fagocitosis, e inducen una necrosis tisular localizada, creando un ambiente propicio para la proliferación bacteriana.
1.3. La Formación de Biofilm: Una Fortaleza Bacteriana
Quizás el factor de virulencia más determinante en la cronicidad de las infecciones por P. aeruginosa es su capacidad para formar un biofilm. No se trata de una simple agregación de bacterias, sino de una comunidad microbiana altamente organizada, encerrada en una matriz de exopolisacáridos autoproducida, principalmente compuesta de alginato. Esta matriz viscosa ancla sólidamente las bacterias a la superficie del conducto auditivo o de la piel ulcerada, formando una verdadera fortaleza.
Esta estructura confiere múltiples ventajas a la bacteria. En primer lugar, constituye una barrera física que la protege de las células fagocíticas del sistema inmunitario y limita considerablemente la penetración de los antibióticos. Estudios han mostrado que las bacterias organizadas en biofilm pueden ser cientos, incluso miles de veces más resistentes a los agentes antimicrobianos que sus homólogos planctónicos (libres). En segundo lugar, dentro del biofilm, las bacterias se comunican entre sí mediante un sistema de señales químicas llamado quorum sensing. Este mecanismo, dependiente de la densidad celular, les permite coordinar la expresión de genes de virulencia y de estrategias de defensa de manera colectiva, comportándose como un organismo multicelular.
El impacto clínico de esta estrategia es importante. La prevalencia de la formación de biofilms por los aislados clínicos de P. aeruginosa provenientes de otitis caninas es extremadamente elevada, reportándose en el 40 % a más del 90 % de los casos según los estudios. Un amplio estudio europeo incluso reveló que el 82 % de los aislados eran capaces de formar biofilms fuertes. Esta capacidad es una causa directa de fracaso terapéutico, de persistencia de la infección a pesar de una antibioterapia aparentemente adaptada, y de la instalación de una inflamación crónica destructora.
1.4. Mecanismos de Resistencia a los Antibióticos: Estrategias Intrínsecas y Adquiridas
La formidable capacidad de P. aeruginosa para resistir a los antibióticos reposa sobre una doble estrategia: una resistencia natural (intrínseca) y una capacidad de adaptación excepcional (resistencia adquirida).
La resistencia intrínseca es una característica inherente a la especie. Se debe principalmente a la baja permeabilidad de su membrana externa, que restringe la entrada de numerosas moléculas. A esto se añade un arsenal de bombas de eflujo, proteínas membranarias que expulsan activamente los antibióticos fuera de la célula antes de que alcancen su objetivo. Finalmente, P. aeruginosa expresa de manera constitutiva una β-lactamasa cromosómica (AmpC), una enzima capaz de inactivar ciertas penicilinas y cefalosporinas.
La resistencia adquirida es aún más preocupante. Resulta sea de mutaciones cromosómicas espontáneas, sea, más frecuentemente, de la adquisición de material genético móvil (plásmidos, transposones) por transferencia horizontal desde otras bacterias. Estos mecanismos permiten a la bacteria desarrollar resistencias a clases de antibióticos a las cuales era inicialmente sensible, conduciendo a la emergencia de fenotipos de multirresistencia (MDR). Los principales mecanismos adquiridos incluyen la producción de enzimas inactivadoras adicionales (como las β-lactamasas de espectro extendido o las carbapenemasas), la modificación del objetivo del antibiótico (por ejemplo, mutaciones en los genes de la ADN girasa confiriendo una resistencia a las fluoroquinolonas) o la sobreexpresión de las bombas de eflujo.
Esta combinación de virulencia agresiva, de protección por el biofilm y de múltiples mecanismos de resistencia hace de P. aeruginosa un patógeno particularmente difícil de erradicar. Su éxito clínico no es el fruto de un solo factor, sino de una estrategia de supervivencia integrada y sinérgica. La bacteria utiliza primero sus enzimas y toxinas para implantarse y dañar los tejidos. Construye luego su fortaleza, el biofilm, para protegerse de las primeras oleadas de defensa del huésped y de los tratamientos. Al abrigo, tiene el tiempo de desarrollar e intercambiar genes de resistencia, armándose para los asaltos futuros. Todo enfoque terapéutico que no tome en cuenta esta estrategia global está inevitablemente condenado al fracaso. El tratamiento debe, por lo tanto, ser multimodal, apuntando simultáneamente a desmantelar la fortaleza, neutralizar los agentes patógenos y reparar los daños infligidos al huésped.
Tabla 1: Factores de Virulencia Clave de P. aeruginosa y sus Roles Patogénicos
|
Factor de Virulencia |
Categoría |
Papel Patogénico Principal |
|
Piocianina |
Pigmento |
Alteración de la respuesta inmunitaria, estrés oxidativo, efectos proinflamatorios |
|
Elastasa, Proteasa alcalina |
Enzimas extracelulares |
Destrucción de la matriz extracelular (colágeno, elastina), invasión tisular |
|
Fosfolipasa C |
Enzima extracelular |
Lisis de las células huésped por degradación de las membranas lipídicas |
|
Exotoxina A, Exoenzima S |
Toxinas (Sistema de secreción T3) |
Inhibición de la síntesis proteica, apoptosis de las células huésped, parálisis de los fagocitos |
|
Lipopolisacárido (LPS) |
Componente membranario |
Inducción de una fuerte respuesta inflamatoria, choque séptico |
|
Alginato / Biofilm |
Matriz protectora |
Protección contra los antibióticos y el sistema inmunitario, adhesión, persistencia crónica |
|
Bombas de eflujo |
Mecanismo de resistencia |
Expulsión activa de múltiples clases de antibióticos fuera de la célula bacteriana |
|
β-lactamasas (AmpC, etc.) |
Enzimas de resistencia |
Inactivación enzimática de los antibióticos de la familia de las β-lactaminas |
2. Manifestaciones Clínicas y Epidemiología
2.1. La Otitis por Pseudomonas aeruginosa
La otitis por Pseudomonas aeruginosa representa una de las entidades clínicas más severas y más frustrantes en dermatología canina. Es crucial comprender que rara vez es una infección primaria. Es casi sistemáticamente una complicación de una otitis externa crónica o recidivante, inicialmente causada por una proliferación de otros agentes, típicamente levaduras (Malassezia pachydermatis) o cocos (Staphylococcus pseudintermedius). La progresión hacia una infección por Pseudomonas es una verdadera escalada patológica, favorecida por un conjunto de factores. Los factores predisponentes (conformación de la oreja con un conducto estrecho o un pabellón colgante, humedad excesiva), los factores primarios (la causa inicial de la inflamación, como la dermatitis atópica, una alergia alimentaria o un cuerpo extraño) y los factores perpetuantes (modificaciones patológicas del conducto como la hiperplasia de las glándulas ceruminosas, la estenosis, o una ruptura de la membrana timpánica) crean un microambiente ideal para la colonización por este patógeno oportunista.
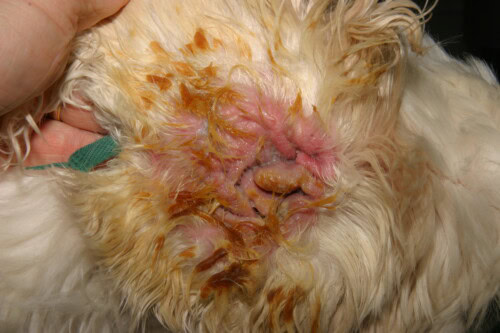
Otitis Severa por Pseudomonas en un Cocker
La presentación clínica es a menudo característica. La afección es frecuentemente unilateral, aunque puede ser bilateral en un contexto de enfermedad alérgica subyacente. Se manifiesta por un dolor auricular intenso, a menudo más marcado que el prurito, una inflamación eritematosa severa del conducto, y ulceraciones del epitelio. El signo más evocador es la naturaleza del exudado: es típicamente abundante, mucoide o purulento, maloliente, y de un color amarillo-verdoso característico debido a la producción de pigmentos bacterianos. En los casos severos, este exudado puede ser hemorrágico. El examen atento del pabellón y de la entrada del conducto puede revelar la presencia de placas pegajosas, una manifestación clínica directa del biofilm bacteriano. Una complicación mayor y frecuente es la extensión de la infección al oído medio. Se estima que más del 80 % de los perros afectados de otitis externa crónica por Pseudomonas presentan una otitis media concomitante. Esta puede manifestarse por signos neurológicos tales como el síndrome de Horner, una parálisis del nervio facial o trastornos vestibulares.
Desde el punto de vista epidemiológico, la otitis externa es una afección extremadamente común, afectando entre el 10 % y el 20 % de la población canina. Dentro de esta población, P. aeruginosa se impone como el agente patógeno más frecuentemente aislado en los casos crónicos y recalcitrantes, estando asociado a cerca del 35 % de estas formas severas. Otros estudios, realizados sobre poblaciones específicas de perros que presentan una otitis, reportan prevalencias que van del 25 % a más del 50 %.
2.2. La Pioderma por Pseudomonas aeruginosa
Aunque menos frecuentes que las otitis, las piodermas por P. aeruginosa son a menudo afecciones espectaculares y graves. Se presentan generalmente bajo dos formas principales.
La pioderma profunda aguda es la forma más dramática. Se caracteriza por la aparición repentina de lesiones extremadamente dolorosas, clásicamente localizadas a lo largo de la línea del dorso. El examen clínico revela múltiples úlceras circinadas (en forma de anillo), costras hemorrágicas y forúnculos que pueden dejar rezumar un exudado sanguinolento. El estado general del animal está a menudo afectado, con abatimiento y fiebre.
El intertrigo (o dermatitis de los pliegues) por Pseudomonas es otra presentación. Se desarrolla en las zonas de pliegues cutáneos donde la maceración y la fricción crean condiciones favorables (pliegues faciales en las razas braquicéfalas, pliegue de la cola, pliegues vulvares). Las lesiones consisten en erosiones y ulceraciones profundas, recubiertas de un exudado verdoso, espeso y particularmente pegajoso, muy evocador de la implicación de este germen.
La prevalencia exacta de las piodermas por Pseudomonas está menos bien documentada que la de las otitis. Sin embargo, estudios sobre las infecciones cutáneas caninas han identificado P. aeruginosa en aproximadamente el 11 % al 13 % de los casos. Un estudio realizado en Rumania sobre infecciones cutáneas superficiales aisló el germen en cerca del 34 % de las muestras de pioderma.
La aparición de una infección por P. aeruginosa, sea en la oreja o en la piel, debe ser interpretada por el clínico como una señal de alarma. No es un evento fortuito, sino el punto culminante de una cascada patológica. La cronicidad es el principal factor de riesgo. La inflamación persistente, la humedad, y sobre todo los tratamientos antibióticos repetidos, a menudo de amplio espectro, crean una presión de selección intensa. Eliminan la flora comensal protectora y los patógenos más sensibles, dejando el campo libre a P. aeruginosa, intrínsecamente más resistente y perfectamente adaptado a este ambiente hostil y modificado. Por consiguiente, la identificación de P. aeruginosa no es el final del diagnóstico, sino el comienzo de una investigación más profunda. Impone una búsqueda rigurosa de la causa primaria (alergia, trastorno endocrino, etc.) que ha permitido a esta “crisis” instalarse. Sin la gestión de este factor inicial, todo intento de tratamiento de la infección por Pseudomonas, incluso con el antibiótico más potente, no será más que un respiro temporal antes de una recidiva inevitable.
3. Abordaje Diagnóstico Razonado
El manejo eficaz de una infección por P. aeruginosa reposa sobre un abordaje diagnóstico estructurado y jerarquizado. El objetivo no es solamente identificar el patógeno, sino también comprender el contexto de su desarrollo, evaluar la extensión de las lesiones y guiar una terapéutica dirigida y racional.
3.1. El Examen Clínico y Otoscópico: Etapas Iniciales Cruciales
Todo abordaje diagnóstico comienza por una anamnesis rigurosa y un examen clínico completo. El interrogatorio del propietario debe buscar signos de enfermedades subyacentes, especialmente un prurito fuera de las orejas, trastornos digestivos o infecciones cutáneas recidivantes que puedan sugerir una dermatitis atópica o una alergia alimentaria. Signos de poliuria-polidipsia o un aumento de peso pueden orientar hacia una endocrinopatía. El examen dermatológico debe ser exhaustivo, pues la otitis a menudo no es más que una de las manifestaciones de una dermatosis más global.
El examen otoscópico es una etapa fundamental. La utilización de un video-otoscopio es ideal, pues ofrece un aumento, una iluminación y una capacidad de registro superiores, facilitando la evaluación precisa y el seguimiento. La otoscopia permite apreciar el estado del conducto auditivo externo: grado de eritema, presencia de ulceraciones, de proliferaciones tisulares (estenosis), o de masas. Es igualmente indispensable para evaluar la integridad de la membrana timpánica. Una membrana rota, abombada o decolorada es un signo fuerte de afección del oído medio. La visualización de un exudado purulento y de úlceras es altamente sugestiva de una infección por bacilos Gram negativos.
3.2. El Examen Citológico: Una Herramienta Diagnóstica de Primera Línea
El examen citológico auricular es el examen complementario más importante, más rápido y más rentable en la gestión de las otitis. Debe realizarse sistemáticamente en cada consulta por una otitis. La muestra se efectúa con ayuda de un hisopo, intentando alcanzar la unión entre el conducto vertical y horizontal, donde las secreciones son las más representativas de la infección. La muestra es luego extendida sobre una lámina, teñida (por ejemplo, con una tinción de tipo Romanowsky rápida) y examinada al microscopio.
En el contexto de una infección por P. aeruginosa, los resultados son a menudo característicos. La observación de bacterias en forma de bastoncillos (bacilos), a menudo en gran número, es el signo de alerta principal. Estos bacilos están típicamente acompañados de una población inflamatoria densa, mayoritariamente compuesta de neutrófilos degenerados, testimoniando una infección activa y supurada. La citología ofrece una orientación diagnóstica y terapéutica casi inmediata, permitiendo iniciar un tratamiento tópico dirigido contra los bacilos Gram negativos sin esperar los resultados de un cultivo.
3.3. Cultivo Bacteriano y Antibiograma: Indicaciones y Protocolo de Toma de Muestra
El cultivo bacteriano con antibiograma no es un examen de rutina para una primera otitis no complicada. Su prescripción debe ser razonada y reservada a situaciones clínicas precisas donde aporta una información crucial para la continuación del tratamiento:
- Presencia confirmada de bacilos en el examen citológico, particularmente si la infección es crónica o recidivante.
- Fracaso de un tratamiento empírico de primera intención bien conducido.
- Necesidad de considerar una antibioterapia por vía sistémica, especialmente en caso de otitis media comprobada o de pioderma profunda asociada. En este caso, el antibiograma es indispensable para guiar la elección de la molécula.
El protocolo de toma de muestra es crítico para la fiabilidad del resultado. La muestra debe tomarse de la manera más aséptica posible, idealmente en la porción profunda del conducto auditivo. En caso de sospecha de otitis media con una membrana timpánica intacta, la única forma de obtener una muestra representativa de la bula timpánica es realizar una miringotomía. Este acto, realizado bajo anestesia general y guía video-otoscópica, consiste en perforar estérilmente el tímpano para aspirar el contenido del oído medio con vistas a un análisis citológico y puesta en cultivo.
3.4. La Imagenología Médica en la Exploración de la Otitis Media
Cuando se sospecha la afección del oído medio (sobre la base de los signos clínicos, de la otoscopia o del fracaso terapéutico), la imagenología médica se convierte en una herramienta diagnóstica esencial. Permite confirmar la afección, evaluar su severidad y planificar una eventual intervención quirúrgica.
El escáner (tomografía computarizada o CT-scan) es considerado como la modalidad de imagen de elección. Ofrece una excelente resolución para visualizar las estructuras óseas, especialmente la pared de la bula timpánica (búsqueda de lisis ósea) y los huesecillos, así como para detectar la presencia de líquido o de tejido blando anormal en el oído medio. La imagen por resonancia magnética (IRM) es una alternativa que ofrece una mejor visualización de los tejidos blandos y está particularmente indicada en caso de sospecha de masa tumoral o de extensión de la infección a las estructuras nerviosas circundantes.
Este abordaje secuencial, yendo de la citología rápida a la imagenología avanzada, encarna un enfoque diagnóstico racional. Cada examen complementario no es prescrito al azar, sino que apunta a responder a una pregunta clínica precisa que se plantea en una etapa dada del proceso. La citología orienta el tratamiento inicial. El fracaso de este tratamiento plantea la cuestión de la resistencia (respuesta por el cultivo) o de la extensión anatómica (respuesta por el escáner). Esta jerarquización previene la escalada terapéutica no justificada y favorece una utilización razonada de los antibióticos y de los exámenes costosos.
4. Estrategias Terapéuticas Integradas
El tratamiento de las infecciones por P. aeruginosa es un proceso exigente que requiere un abordaje multimodal y perseverante. El éxito no reposa sobre una sola molécula “milagro”, sino sobre una estrategia integrada apuntando a la vez a eliminar el patógeno, a controlar la inflamación, a corregir los factores subyacentes y a restaurar un ambiente auricular sano.
4.1. Principios Fundamentales: Gestión de la Causa Primaria y Control de la Inflamación
El principio más fundamental, y sin embargo a veces descuidado, es que el tratamiento a largo plazo de la infección por Pseudomonas es indisociable de la identificación y de la gestión de la causa primaria de la otitis. Ya se trate de una alergia, de una endocrinopatía o de una masa, su control es la única garantía contra las recidivas. La infección por Pseudomonas es una consecuencia; tratar únicamente la consecuencia sin atacar la causa es un callejón sin salida terapéutico.
Paralelamente, el control de la inflamación es un pilar del tratamiento. La inflamación crónica provoca un edema, un dolor, una hiperplasia de las glándulas sebáceas y ceruminosas, y una estenosis del conducto. Estas modificaciones perpetúan la infección e impiden la penetración de los tratamientos tópicos. La utilización de glucocorticoides, por vía tópica y/o sistémica (por ejemplo, prednisolona a dosis antiinflamatoria), es por lo tanto crucial en fase inicial. Permiten “reabrir” el conducto, disminuir la producción de exudado, mejorar el confort del animal y, en consecuencia, aumentar la eficacia de los agentes antimicrobianos.
4.2. La Terapia Tópica: Piedra Angular del Tratamiento
La terapia tópica está en el corazón de la estrategia terapéutica, pues solo ella permite alcanzar concentraciones de antimicrobianos en el sitio de la infección que son muy superiores a las obtenidas por vía sistémica. Su eficacia depende de dos etapas clave: la limpieza y la aplicación de agentes dirigidos.
La limpieza auricular es una etapa no negociable. El exudado purulento y el biofilm actúan como una barrera física y pueden inactivar químicamente ciertos antibióticos, especialmente los aminoglucósidos. Una limpieza inicial profunda, realizada bajo anestesia general con irrigación abundante, es a menudo indispensable para eliminar la mayoría de los detritos. Posteriormente, limpiezas regulares en casa por el propietario son necesarias para mantener el conducto limpio.
La eficacia de la terapia tópica puede ser considerablemente aumentada por la utilización de soluciones que contienen Tris-EDTA. El EDTA (ácido etilendiaminotetraacético) es un agente quelante que se liga a los iones metálicos (calcio, magnesio) esenciales a la estabilidad de la membrana externa de las bacterias Gram negativas. Al desestabilizar esta membrana, el Tris-EDTA la hace más permeable a los antibióticos, potenciando así su acción. Estudios han mostrado que aumenta significativamente la eficacia de las fluoroquinolonas y de los aminoglucósidos contra P. aeruginosa. El protocolo óptimo consiste en instilar la solución de Tris-EDTA en el conducto auditivo y esperar 20 a 30 minutos antes de aplicar el medicamento antibiótico, a fin de dejar el tiempo al agente quelante para actuar.
La elección del agente antimicrobiano tópico debe ser reflexiva. Varias opciones están disponibles:
- Las fluoroquinolonas (marbofloxacina, enrofloxacina) y los aminoglucósidos (gentamicina, amikacina) son elecciones corrientes y a menudo eficaces. Se debe tener precaución con los aminoglucósidos en caso de ruptura timpánica debido a su ototoxicidad potencial.
- La polimixina B es otro antibiótico eficaz contra P. aeruginosa.
- La sulfadiazina de plata (SSD) es una opción particularmente interesante, especialmente frente a cepas multirresistentes. Bajo forma de crema al 1%, ha demostrado una excelente actividad in vitro contra los aislados caninos de P. aeruginosa, con concentraciones mínimas inhibitorias (CMI) muy bajas (1-64 µg/mL), muy inferiores a la concentración de la preparación comercial. Su mecanismo de acción, dirigido a la pared y a la membrana celular, es diferente del de muchos otros antibióticos.
4.3. La Antibioterapia Sistémica: Indicaciones, Elección y Riesgos
La antibioterapia por vía sistémica no es un tratamiento de primera intención para una otitis externa, incluso por Pseudomonas. Las concentraciones alcanzadas en el cerumen y el epitelio del conducto son a menudo insuficientes. Su utilización debe reservarse a indicaciones precisas y justificadas:
- Otitis media confirmada por la imagenología o la otoscopia.
- Pioderma profunda asociada.
- Inflamación e hiperplasia tisular tan severas que impiden toda aplicación tópica eficaz.
- Fracaso comprobado de un tratamiento tópico agresivo y bien conducido.
La elección de la molécula debe imperativamente ser guiada por un antibiograma.
- Las fluoroquinolonas son la única clase disponible por vía oral que tiene una actividad fiable. Sin embargo, se requieren dosis elevadas, fuera de AMM, para ser eficaces contra P. aeruginosa: enrofloxacina a 10-20 mg/kg/día y marbofloxacina a 5,5 mg/kg/día. Hay que señalar que la resistencia puede desarrollarse rápidamente en el curso del tratamiento.
- Las opciones parenterales (inyectables) incluyen las cefalosporinas de tercera generación (como la ceftazidima) y los aminoglucósidos (amikacina, gentamicina). La utilización sistémica de los aminoglucósidos está limitada por su riesgo de nefrotoxicidad y de ototoxicidad, y requiere una hidratación perfecta del animal así como un seguimiento de la función renal.
- Los carbapenemes (imipenem, meropenem) y las penicilinas anti-pseudomónicas (ticarcilina) son antibióticos de último recurso, a utilizar solamente para infecciones multirresistentes documentadas, respetando los principios de la antibiogobernanza para preservar su eficacia en medicina humana y veterinaria.
- Hay que señalar que estas últimas moléculas deben emplearse en función de la reglamentación vigente y de las recomendaciones de cada país, el GEDAC en lo que respecta a Francia por ejemplo.
Tabla 2: Posologías de los Antibióticos Sistémicos Anti-Pseudomónicos en el Perro
|
Molécula |
Clase |
Posología (vía) |
Comentarios Clínicos / Precauciones |
|
Enrofloxacina |
Fluoroquinolona |
10–20 mg/kg/día (PO, IV, SC) |
Necesita dosis elevadas. La resistencia puede desarrollarse rápidamente. |
|
Marbofloxacina |
Fluoroquinolona |
5,5 mg/kg/día (PO) |
Dosis máxima requerida para una eficacia contra las cepas de sensibilidad intermedia. |
|
Amikacina |
Aminoglucósido |
15–30 mg/kg/día (IV, IM, SC) |
Riesgo de nefrotoxicidad y de ototoxicidad. Asegurar una buena hidratación y monitorear la función renal. |
|
Gentamicina |
Aminoglucósido |
10–14 mg/kg/día (IV, IM, SC) |
Riesgo de toxicidad más elevado que la amikacina. Monitoreo requerido. |
4.4. La Interpretación Crítica del Antibiograma según las Normas CLSI VET
El antibiograma es una herramienta poderosa, pero su interpretación no debe ser pasiva. El Clinical and Laboratory Standards Institute (CLSI) ha publicado recientemente una actualización mayor de los umbrales críticos (breakpoints) para las fluoroquinolonas en el perro, que cambia radicalmente su interpretación.
Los umbrales antiguos, más elevados, podían clasificar como “Sensible” (S) una cepa que no respondería a un tratamiento a dosis estándar. Los nuevos umbrales son mucho más bajos e introducen una nueva categoría: “Sensible-Dosis Dependiente” (SDD). Esta categoría indica que una cepa puede ser tratada con éxito, pero únicamente si se utiliza la dosis más elevada del intervalo posológico aprobado.
Esta evolución transforma el antibiograma de un simple informe “S/I/R” en una verdadera guía de prescripción. Frente a una cepa clasificada SDD, el clínico sabe que debe prescribir la dosis máxima recomendada (por ejemplo, 20 mg/kg/día para la enrofloxacina) para tener una oportunidad de éxito clínico. Utilizar una dosis estándar frente a una cepa SDD es una causa previsible de fracaso terapéutico y de selección de resistencia.
Tabla 3: Umbrales Críticos CLSI VET Revisados (2023) para la Enrofloxacina y la Marbofloxacina en el Perro (Vía Oral)
|
Antibiótico |
Categoría y Umbral CMI (µg/mL) |
Dosis correspondiente |
|
Enrofloxacina (revisado) |
S ≤ 0.06 |
5 mg/kg/día |
|
SDD 0.12–0.25 |
10–20 mg/kg/día |
|
|
R ≥ 0.5 |
– |
|
|
Marbofloxacina (revisado) |
S ≤ 0.12 |
2,8 mg/kg/día |
|
SDD 0.25 |
5,5 mg/kg/día |
|
|
R ≥ 0.5 |
– |
En definitiva, la estrategia terapéutica no debe ser vista como una simple “batalla antibiótica” sino como una “gestión de ecosistema”. El objetivo no es solamente erradicar P. aeruginosa, sino restaurar un ambiente cutáneo o auricular en el cual ya no pueda proliferar. La limpieza, el Tris-EDTA y los antiinflamatorios modifican el ambiente físico, químico e inmunológico. El tratamiento de la causa primaria corrige el desequilibrio fundamental. En este esquema, los antibióticos no son más que una herramienta, a menudo temporal, para reducir la carga bacteriana mientras las otras medidas restauran el equilibrio. El éxito se mide menos por la curación del episodio infeccioso que por la prevención de su recidiva.
5. Gestión de las Infecciones Multirresistentes y Perspectivas de Futuro
La emergencia de cepas de P. aeruginosa multirresistentes (MDR) constituye el desafío último en dermatología veterinaria. Frente a un antibiograma que muestra pocas o ninguna sensibilidad, el clínico debe abandonar la idea de una solución simple y adoptar estrategias alternativas y combinadas, al tiempo que se dirige hacia las innovaciones terapéuticas que redefinen la lucha contra las infecciones bacterianas.
5.1. Estrategias Combinadas para las Cepas Multirresistentes (MDR)
La gestión de una infección MDR por P. aeruginosa reposa sobre una intensificación del enfoque multimodal. Cada componente del tratamiento se vuelve crítico. Una limpieza mecánica rigurosa y repetida, a menudo bajo anestesia, es el primer paso para desmantelar físicamente el biofilm y reducir la carga bacteriana. La utilización sistemática de Tris-EDTA en pretratamiento se vuelve no ya una opción sino una necesidad para intentar restaurar una sensibilidad, incluso parcial, a los antibióticos.
La elección de los agentes tópicos debe ser creativa y fundada en las pocas opciones restantes. La sulfadiazina de plata es a menudo una excelente elección empírica en este contexto. La preparación extemporánea de soluciones tópicas a base de antibióticos inyectables, como la ticarcilina o la amikacina, puede ser considerada, aunque la estabilidad de estas preparaciones sea una preocupación. La antibioterapia sistémica, si es absolutamente necesaria, debe ser escrupulosamente guiada por el antibiograma, considerando moléculas de último recurso después de una evaluación rigurosa de la relación beneficio/riesgo.
5.2. La Disrupción del Biofilm: El Papel de la N-acetilcisteína (NAC)
El reconocimiento del biofilm como una fortaleza protegiendo las bacterias ha abierto la vía a la búsqueda de agentes “anti-biofilm”. La N-acetilcisteína (NAC), un agente mucolítico bien conocido, ha emergido como un candidato muy prometedor. Estudios in vitro han demostrado que la NAC posee no solamente una actividad antibacteriana directa contra los patógenos de la otitis, incluida P. aeruginosa, sino que es sobre todo capaz de perturbar la matriz del biofilm, degradándola y exponiendo así las bacterias que alberga.
Los datos in vitro son convincentes: la NAC inhibe el crecimiento de P. aeruginosa a concentraciones mínimas inhibitorias (CMI) de 5 a 20 mg/mL, niveles considerados como seguros y alcanzables durante una aplicación tópica. Su asociación con el Tris-EDTA podría ofrecer una sinergia de acción, el Tris-EDTA debilitando la pared bacteriana mientras que la NAC desmantela la matriz extracelular. Aunque ensayos clínicos prospectivos sean todavía necesarios para validar su eficacia in vivo, la NAC representa una opción terapéutica adyuvante de gran interés para las infecciones crónicas y de biofilm, como complemento de los tratamientos antimicrobianos.
5.3. Terapias Innovadoras: La Fagoterapia como Alternativa Prometedora
Frente al callejón sin salida de la antibiorresistencia, la comunidad científica se dirige hacia enfoques radicalmente diferentes, y la fagoterapia es una de las más prometedoras. Esta técnica utiliza bacteriófagos (o fagos), virus que son los depredadores naturales de las bacterias. Los fagos llamados “líticos” infectan una bacteria objetivo específica, se replican en su interior, luego la hacen estallar (lisis), liberando decenas de nuevas partículas virales listas para infectar las bacterias vecinas.
Las ventajas de este enfoque son múltiples. Los fagos poseen una alta especificidad, apuntando solamente a la bacteria patógena sin afectar la microflora beneficiosa del huésped. Tienen la capacidad de autorreplicarse en el sitio de la infección mientras su objetivo esté presente. Sobre todo, son eficaces contra las bacterias multirresistentes, pues su mecanismo de acción es totalmente independiente de la sensibilidad a los antibióticos. Además, numerosos fagos producen enzimas capaces de degradar la matriz de los biofilms, permitiéndoles penetrar esta estructura protectora.
La fagoterapia es actualmente un campo de investigación extremadamente activo en medicina veterinaria. Estudios in vitro y reportes de casos publicados han mostrado resultados muy alentadores en el tratamiento de infecciones cutáneas, de otitis y de infecciones de heridas quirúrgicas por P. aeruginosa MDR en el perro y el gato. Ensayos clínicos están en curso para evaluar de manera rigurosa la eficacia y la seguridad de cócteles de fagos. La combinación sinérgica de fagos y de antibióticos es igualmente una pista explorada, donde el fago debilita la población bacteriana, haciéndola más vulnerable al antibiótico.
La lucha contra P. aeruginosa MDR ilustra una evolución estratégica mayor. Pasamos de una lógica de “fuerza bruta”, consistente en buscar antibióticos siempre más potentes, a una lógica de “guerra asimétrica”, que apunta a explotar las debilidades estructurales y biológicas de la bacteria. En lugar de intentar perforar los muros de la fortaleza con un ariete más grande, las nuevas estrategias apuntan a disolver el cemento que mantiene las piedras (NAC) o a enviar agentes especializados que pueden sortear las defensas (fagos). El futuro de la gestión de estas infecciones probablemente no resida en un único “super-antibiótico”, sino en el arte de combinar inteligentemente estas nuevas armas para desmantelar las defensas sofisticadas de este adversario formidable.
Conclusión y Pistas de Investigación Futuras
El manejo de las piodermas y de las otitis por Pseudomonas aeruginosa en el perro representa un paradigma de la medicina infecciosa moderna, donde la comprensión de la biología del patógeno y de sus interacciones con el huésped es la clave del éxito terapéutico. Esta síntesis ha puesto de relieve que P. aeruginosa no es un simple agente infeccioso, sino un patógeno oportunista altamente adaptativo, cuya gestión eficaz trasciende la simple prescripción de antibióticos. El éxito reposa sobre un enfoque holístico y meticuloso, cuyos pilares son: un diagnóstico preciso y jerarquizado, iniciado por la citología; el control imperativo de la causa primaria subyacente y de la inflamación; una terapia tópica agresiva combinando limpieza mecánica y agentes potenciadores como el Tris-EDTA; y una utilización juiciosa y razonada de la antibioterapia sistémica, guiada por un antibiograma interpretado a la luz de las normas más recientes y de los conceptos farmacodinámicos.
La era de la antibioterapia empírica y prolongada llega a su fin, reemplazada por un enfoque estratégico que integra la gestión del ecosistema cutáneo y auricular. Sin embargo, numerosas preguntas subsisten y desafíos importantes, especialmente el aumento de la multirresistencia, exigen una investigación continua e innovadora. Varias pistas de investigación futuras aparecen como prioritarias para mejorar el manejo clínico:
- Desarrollo y validación clínica de formulaciones tópicas sinérgicas: Es crucial realizar ensayos clínicos prospectivos, aleatorizados y controlados para evaluar la eficacia in vivo de formulaciones combinando agentes anti-biofilm (como la N-acetilcisteína) y antimicrobianos. La demostración de una sinergia clínica permitiría establecer nuevos estándares de tratamiento para las infecciones crónicas.
- Ensayos clínicos sobre la fagoterapia: La fagoterapia representa una alternativa prometedora, pero su potencial debe ser validado por estudios rigurosos. La constitución de bancos de fagos bien caracterizados y la realización de ensayos clínicos evaluando la eficacia y la seguridad de cócteles de fagos para el tratamiento de las infecciones por P. aeruginosa MDR son una prioridad absoluta.
- Estudio del microbioma auricular: Una mejor comprensión de la disbiosis que precede y favorece la colonización por P. aeruginosa es necesaria. El análisis del microbioma auricular en los perros sanos y atópicos podría permitir identificar marcadores de riesgo y explorar el potencial de terapias moduladoras del microbioma, como los probióticos tópicos, en prevención.
- Desarrollo de herramientas de diagnóstico rápido: La puesta a punto de tests de diagnóstico rápido junto al paciente (point-of-care), capaces de detectar en pocos minutos no solamente la presencia de P. aeruginosa sino también marcadores genéticos de resistencia clave, permitiría instaurar una terapia dirigida mucho más precozmente, mejorando el pronóstico y limitando la presión de selección.
- Farmacocinética y farmacodinámica de los tratamientos tópicos: Los datos sobre la difusión y la persistencia de los agentes antimicrobianos tópicos en el conducto auditivo inflamado y en presencia de biofilm son asombrosamente raros. Estudios PK/PD dirigidos son necesarios para optimizar las concentraciones, las formulaciones y las frecuencias de administración a fin de maximizar la eficacia y minimizar la emergencia de resistencias.
En conclusión, si Pseudomonas aeruginosa sigue siendo un adversario formidable, una mejor comprensión de su biología, asociada a un enfoque clínico riguroso y a la integración de terapias innovadoras, ofrece perspectivas alentadoras para mejorar significativamente el pronóstico de estas afecciones complejas.
Referencias
Buckley, L. M., McEwan, N. A., & Nuttall, T. (2013). Tris-EDTA significantly enhances antibiotic efficacy against multidrug-resistant Pseudomonas aeruginosa in vitro. Veterinary Dermatology, 24(5), 519-e122.
Carlotti, D. N., Ghibaudo, G., & Damborg, P. (2010). In vitro antimicrobial activity of a commercial ear antiseptic containing chlorhexidine and Tris-EDTA. Veterinary Dermatology, 21(3), 282-286.
Cole, L. K., Kwochka, K. W., Kowalski, J. J., & Hillier, A. (2008). Comparison of enrofloxacin and marbofloxacin for the treatment of canine Pseudomonas otitis. Veterinary Therapeutics, 9(2), 141-151.
Fusconi, G., Ghibaudo, G., & Damborg, P. (2011). In vitro activity of a commercial ear antiseptic on planktonic and biofilm-embedded Pseudomonas aeruginosa. Veterinary Dermatology, 22(4), 366-372.
Hattab, J., et al. (2021). Prevalence of five virulence genes in Pseudomonas aeruginosa isolates from canine infections. Journal of Applied Microbiology, 130(5), 1548-1556.
Hawkins, C., Harper, D., & Soothill, J. (2010). Topical treatment of Pseudomonas aeruginosa otitis of dogs with a bacteriophage mixture: a before/after clinical trial. Veterinary Microbiology, 146(3-4), 309-313.
Hillier, A., et al. (2023). Revision of the CLSI antimicrobial susceptibility testing breakpoints for enrofloxacin and marbofloxacin in dogs. American Journal of Veterinary Research, 84(11).
May, E. R., Conklin, K. A., & Bemis, D. A. (2016). Antibacterial effect of N-acetylcysteine on common canine otitis externa isolates. Veterinary Dermatology, 27(3), 188-e47.
Morris, D. O., et al. (2023). A retrospective study of the primary causes of Pseudomonas otitis in 60 dogs. Journal of Small Animal Practice, 64(4), 241-247.
Nuttall, T., & Cole, L. K. (2007). Evidence-based veterinary dermatology: a systematic review of interventions for treatment of Pseudomonas otitis in dogs. Veterinary Dermatology, 18(2), 69-77.
Pye, C. (2018). Surgical management of end-stage otitis in dogs. Veterinary Clinics: Small Animal Practice, 48(1), 75-91.
Robinson, A., et al. (2019). Genomic and phenotypic characterisation of Pseudomonas aeruginosa isolates from canine otitis externa. Frontiers in Microbiology, 10, 1234.
Secker, B., et al. (2023). A multinational European survey of Pseudomonas aeruginosa isolates from canine otitis: antimicrobial resistance, biofilm formation, and virulence gene profiles. Frontiers in Microbiology, 14, 1526843.
Wright, A., Hawkins, C., Änggård, E. E., & Harper, D. R. (2009). A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy. Clinical Otolaryngology, 34(4), 349-357.
Yoon, J., & Park, C. (2024). In vitro synergistic efficacy of N-acetylcysteine with antimicrobial agents against Pseudomonas aeruginosa isolated from dogs with otitis externa. Korean Journal of Veterinary Research, 64(1), e5.