El auge demográfico espectacular del Bulldog Francés durante la última década ha, por un efecto de cuello de botella genético y selección fenotípica extrema, exacerbado la prevalencia de trastornos dermatológicos complejos. Revisión de las principales dermatosis que los afectan y su manejo.
Particularidades anatómicas y genéticas del Bulldog Francés
Prevalencia de la dermatitis atópica y vulnerabilidad racial
El Bulldog Francés ocupa una posición singular en dermatología veterinaria, no solo por su popularidad creciente en los países occidentales, sino sobre todo por la convergencia única de factores anatómicos, genéticos e inmunológicos que predisponen a esta raza a un espectro patológico dermatológico excepcionalmente amplio. Los datos epidemiológicos recientes revelan una prevalencia de dermatitis atópica que alcanza del 15 al 20% en esta población canina, es decir, una tasa tres veces superior al promedio inter-racial. Esta vulnerabilidad cutánea resulta de una arquitectura corporal braquicefálica extrema asociada a anomalías genéticas documentadas que afectan la cohesión epidérmica y la respuesta inmunitaria.
Impacto de la conformación braquicefálica en el intertrigo
La conformación braquicefálica del Bulldog Francés genera repercusiones dermatológicas mayores por la creación de múltiples zonas de pliegue cutáneo. El acortamiento craneo-facial, resultante en parte de una mutación del gen BMP3, engendra un exceso de tejido cutáneo facial que se repliega en pliegues profundos, notablemente a nivel de la región naso-facial, del surco inter-labial y de la zona peri-vulvar en la hembra. Estos microambientes anaeróbicos presentan una humedad relativa superior al 80%, una temperatura elevada de 2 a 3 grados respecto a las zonas expuestas, y una oclusión permanente que favorece la proliferación microbiana. La fisiopatología del intertrigo que resulta reposa sobre una maceración epidérmica inicial seguida de una ruptura de la barrera cutánea, permitiendo la colonización por Staphylococcus pseudintermedius y las levaduras del género Malassezia. El pH cutáneo en estas zonas confinadas se alcaliniza progresivamente, pasando de 5,5 a 7,2, creando un terreno propicio para la proliferación bacteriana logarítmica.
Sobreexpresión de los receptores de citocinas y vía JAK-STAT
El sistema inmunitario cutáneo del Bulldog Francés presenta también particularidades funcionales documentadas. El análisis transcriptómico de biopsias cutáneas no lesionales en individuos atópicos de esta raza revela una sobreexpresión constitutiva de los genes que codifican para los receptores de la interleucina-31 (IL-31RA) y de la Oncostatin M Receptor (OSMR), con niveles de ARNm superiores a los perros sanos. Esta expresión aumentada predispone a una activación exagerada de la vía de señalización JAK1/JAK2-STAT3 en presencia de concentraciones incluso fisiológicas de IL-31, citocina pruritógena mayor producida por los linfocitos T helper de tipo 2. El complejo IL-31RA/OSMR heterodimérico fosforila las tirosinas quinasas JAK1 y JAK2, que activan luego STAT3 por fosforilación de su tirosina 705, desencadenando la cascada transcripcional del prurito. Esta hipersensibilidad molecular explica la intensidad del prurito observada clínicamente en esta raza, incluso durante estimulaciones antigénicas mínimas.
Densidad folicular y carencia de sebo
La densidad folicular constituye otra característica anatómica que influye en la patología dermatológica del Bulldog Francés. Los estudios histomorfométricos cuantitativos revelan una densidad folicular media más baja que en las razas de pelo largo como el Caniche o el Yorkshire. Esta rarefacción folicular se acompaña de una reducción proporcional de la secreción sebácea, siendo las glándulas sebáceas anexas menos voluminosas. El sebo canino, rico en triglicéridos y en ácidos grasos libres, participa activamente en la defensa antimicrobiana cutánea por su efecto lipófilo sobre los patógenos y su papel en el mantenimiento del pH ácido de superficie. La carencia relativa en sebo en el Bulldog Francés altera esta primera línea de defensa y favorece la colonización por microorganismos oportunistas.
Anomalías ultraestructurales y lipidómicas del stratum corneum
La arquitectura del stratum corneum presenta también anomalías ultraestructurales en los Bulldogs Franceses atópicos comparativamente a los individuos sanos de la misma raza. Los estudios en microscopía electrónica de transmisión revelan un espaciamiento intercorneal ampliado con lagunas lipídicas en el seno de las lamelas extracelulares. El análisis lipidómico por cromatografía líquida acoplada a la espectrometría de masa demuestra una reducción de 35 a 40% de las ceramidas de cadenas muy largas, notablemente las ceramidas de clase [NP] y [EOS], esenciales para la organización lamelar del cemento intercorneal. Las ceramidas [EOS], caracterizadas por una esfingosina esterificada a un ácido linoleico, juegan un papel estructural crítico anclando las lamelas lipídicas a la envoltura córnea proteíca. Su déficit compromete la organización arquitectural del stratum corneum, aumentando la permeabilidad a los alérgenos ambientales y a los microorganismos.
Alteración de la renovación epidérmica y gen PROM1
La predisposición genética a la atopia en el Bulldog Francés implica también variaciones del gen PROM1, que codifica para la prominin-1, glicoproteína transmembrana expresada en las células madre epidérmicas. Una variante particular de este gen, identificada por secuenciación de nueva generación en 156 Bulldogs Franceses atópicos, se asocia a una alteración de la renovación epidérmica con una duración del ciclo queratinócito prolongada de 19 días en promedio contra 14 a 16 días en los perros sanos. Esta cinética epidérmica ralentizada perturba la maduración terminal de los queratinocitos y la síntesis de los componentes de la barrera, creando un círculo vicioso donde la disfunción estructural favorece la inflamación, que a su vez agrava la perturbación de la diferenciación epidérmica.
Déficit en péptidos antimicrobianos y formación de biofilms
La susceptibilidad a las infecciones cutáneas recurrentes observada en esta raza encuentra también una explicación en la expresión reducida de los péptidos antimicrobianos endógenos. Las beta-defensinas caninas, notablemente cBD1, cBD3 y cBD103, constituyen una defensa innata esencial contra los patógenos cutáneos. Los análisis por RT-PCR cuantitativa de biopsias cutáneas de Bulldogs Franceses atópicos demuestran una expresión de cBD103 disminuida en un 60% comparativamente a los testigos sanos, con niveles de ARNm medios de 0,4 unidades relativas contra 1,0. Esta inmunidad innata deficiente facilita la instalación de biofilms bacterianos organizados, particularmente de Staphylococcus pseudintermedius, cuya erradicación se vuelve progresivamente más difícil debido a la protección matricial conferida por la estructura tridimensional del biofilm.
Módulo 2: Disfunción de la barrera epidérmica – Mecanismos moleculares
Modelo arquitectural “ladrillo y mortero”
La barrera epidérmica del Bulldog Francés presenta anomalías estructurales y funcionales que constituyen el sustrato fisiopatológico primario de su vulnerabilidad dermatológica. Esta barrera, situada en el stratum corneum, reposa sobre un modelo arquitectural dicho “ladrillo y mortero” donde los corneocitos representan los ladrillos y las lamelas lipídicas intercelulares forman el mortero. En el Bulldog Francés predispuesto a la atopia, este sistema sufre una desorganización a varios niveles moleculares, comprometiendo su función de muralla contra la penetración de los alérgenos, la colonización microbiana y la pérdida hídrica trans-epidérmica.
Papel central de la filagrina en la cohesión epidérmica
La filagrina (proteína de agregación de los filamentos de queratina) juega un papel central en la formación de la barrera cutánea. Esta proteína de 400 kDa, codificada por el gen FLG, sufre una maduración proteolítica compleja durante la diferenciación terminal queratinócito. En la capa granular, la profilagrina es desfosforilada luego escindida por proteasas específicas para generar monómeros de filagrina funcionales. Estos monómeros agregan los filamentos de queratina en macrofibrillas densas, contribuyendo al aplanamiento de los corneocitos y a la compactación del stratum corneum. En los Bulldogs Franceses atópicos, los análisis inmunohistoquímicos revelan una expresión reducida de filagrina, con una intensidad de marcaje disminuida en un 45% comparativamente a los testigos sanos apareados por edad.
Factores naturales de hidratación (NMF) y pérdida de agua
La degradación ulterior de la filagrina genera factores naturales de hidratación (NMF – Natural Moisturizing Factors) esenciales para el mantenimiento de la hidratación córnea. Las enzimas peptidasas, notablemente las caspase-14 y las bleomicina hidrolasas, fragmentan la filagrina en aminoácidos libres, entre ellos la histidina, la serina y la arginina. La histidina es luego desaminada por la histidasa en ácido urocánico trans, que posee propiedades higroscópicas y fotoprotectoras. La arginina es convertida en citrulina por las peptilarginine deiminasas. En el Bulldog Francés, la cuantificación por cromatografía líquida de alta resolución del stratum corneum demuestra una reducción del 42% de las tasas de aminoácidos libres y una disminución del 38% del ácido urocánico comparativamente a las razas no predispuestas. Esta carencia en NMF conlleva una deshidratación crónica del stratum corneum con un aumento mensurable de la pérdida insensible en agua, pasando de 12-15 g/m²/h en los perros sanos a 28-35 g/m²/h en los atópicos.
Alteración de las uniones estrechas (tight junctions)
Las uniones estrechas (tight junctions) de la capa granular constituyen un segundo nivel de barrera epidérmica, controlando la permeabilidad paracelular. Estos complejos proteínicos, compuestos principalmente de claudinas (claudina-1, claudina-4), de ocludina y de proteínas zonula occludens (ZO-1, ZO-2), forman una red anastomosada creando un sellado intercelular. Los análisis transcriptómicos de piel atópica de Bulldog Francés revelan una subexpresión significativa de los genes CLDN1 y OCLN, codificando respectivamente para la claudina-1 y la ocludina, con reducciones de expresión de ARNm de 2,1 y 1,7 veces. Esta alteración de las uniones estrechas permite una penetración facilitada de los alérgenos de alto peso molecular, normalmente excluidos por esta barrera selectiva, desencadenando la activación inapropiada del sistema inmunitario cutáneo.
Perturbación del metabolismo lipídico epidérmico
El metabolismo lipídico epidérmico presenta anomalías cuantitativas y cualitativas mayores en esta raza. Los lípidos del stratum corneum, sintetizados en los queratinocitos de la capa granular y almacenados en los cuerpos lamelares de tipo Odland, son secretados por exocitosis en el espacio intercorneal. Estos lípidos comprenden tres clases principales: las ceramidas (50%), el colesterol (25%) y los ácidos grasos libres (10-15%), en un ratio molar óptimo de 1:1:1 necesario para la formación de lamelas ortorómbicas impermeables. En el Bulldog Francés atópico, los análisis por cromatografía en fase gaseosa acoplada a la espectrometría de masa demuestran una perturbación del ratio lipídico, con una reducción relativa de las ceramidas al 38% y un aumento compensatorio del colesterol al 35%, alterando la cristalinidad lamelar y aumentando la permeabilidad.
Importancia de las ceramidas de clase [EOS]
Las ceramidas, esfingolípidos complejos compuestos de una esfingosina ligada a un ácido graso por una unión amida, se subdividen en 12 clases según la naturaleza de su base esfingoide y de su ácido graso. Las ceramidas de clase [EOS] (acilceramidas que contienen una esterificación linoleato) son particularmente críticas para la impermeabilidad cutánea. Su biosíntesis implica una cascada enzimática que comprende la serina palmitoyltransferasa, las ceramidas sintasas (notablemente CerS3 para los ácidos grasos ultra-largos), y la glucosilceramida-beta-glucosidasa que hidroliza las glucosilceramidas en ceramidas libres. Estudios en Western blot sobre extractos proteínicos epidérmicos de Bulldogs Franceses atópicos revelan una expresión reducida de CerS3 del 52% respecto a los testigos, correlacionando con la disminución de las ceramidas de cadenas carbonadas muy largas (C28-C32).
Actividad de la beta-glucocerebrosidasa (GBA)
La enzima beta-glucocerebrosidasa (GBA), localizada en los cuerpos lamelares, cataliza la etapa terminal de conversión de las glucosilceramidas en ceramidas funcionales en el momento de la secreción en el espacio extracelular. Una deficiencia en esta enzima, documentada en ciertos perros atópicos, conlleva una acumulación de precursores glucosilados no funcionales y un déficit en ceramidas maduras. La actividad enzimática de la GBA, medida por fluorometría sobre homogeneizados de stratum corneum de Bulldog Francés, se revela reducida en un 38% en promedio en los sujetos atópicos, sugiriendo una perturbación del proceso de maduración lipídica post-secretoria.
Papel de la esfingomielina deacilasa (SMasa)
La esfingomielina deacilasa (SMasa), también conocida bajo el nombre de ceramidasa alcalina, regula la homeostasis de las ceramidas catalizando su hidrólisis. Un equilibrio delicado entre síntesis y degradación de las ceramidas determina su concentración tisular. En el Bulldog Francés, estudios enzimáticos sugieren una hiperactividad relativa de ciertas ceramidasas, contribuyendo a la depleción cerámida observada. La expresión génica de ASAH2, codificando para la ceramidasa neutra, está aumentada 1,6 veces en la piel lesional atópica, favoreciendo un catabolismo cerámico excesivo que agrava la disfunción barrera.
Déficit en ácidos grasos libres y ácido linoleico
Los ácidos grasos libres del stratum corneum, principalmente el ácido linoleico (C18:2 ω-6), el ácido oleico (C18:1 ω-9) y el ácido palmítico (C16:0), participan activamente en la organización lamelar y poseen propiedades antiinflamatorias intrínsecas. El ácido linoleico, ácido graso esencial, se incorpora en las ceramidas [EOS] vía esterificación del residuo ω-hidroxiceramida. Su carencia alimentaria o metabólica conlleva su reemplazo por el ácido oleico, creando ceramidas [EOO] estructuralmente anormales que perturban la organización lamelar. Los análisis lipidómicos comparativos revelan que el 23% de los Bulldogs Franceses atópicos presentan un ratio linoleico/oleico inferior a 2,5 en el stratum corneum, umbral por debajo del cual la función barrera se deteriora significativamente.
Hiperactivación de la calpaína-1 y degradación desmosomal
La calpaína-1, proteasa calcio-dependiente, regula la proteólisis controlada de la desmogleína-1 y de la corneodesmoina, proteínas de adhesión intercorneal. Esta proteólisis fisiológica permite la descamación ordenada de la capa córnea. Sin embargo, en un contexto inflamatorio, la hiperactivación de la calpaína-1 por las citocinas Th2, notablemente la IL-4 e IL-13, acelera la degradación desmosomal prematura, creando micro-fisuras en el stratum corneum. En el Bulldog Francés atópico, la actividad enzimática de la calpaína-1, medida por sustratos fluorogénicos, se revela aumentada 2,8 veces en la piel lesional, correlacionando con una descamación patológica y un agravamiento de la permeabilidad.
Fragilidad de la envoltura córnea
La envoltura córnea, estructura proteínica altamente reticulada formada bajo la membrana plasmática de los corneocitos, constituye un esqueleto arquitectural esencial. Su formación implica la transglutaminasa-1 epidérmica que cataliza la formación de uniones isopeptídicas entre las proteínas precursoras (loricrina, involucrina, pequeñas proteínas ricas en prolina). La loricrina representa el 70 a 80% de la masa proteínica de la envoltura. Los análisis bioquímicos de corneocitos aislados de Bulldog Francés atópicos revelan una reticulación deficiente de la envoltura, con una resistencia mecánica reducida en un 35% medida por tests de tracción micromecánicos. Esta fragilidad estructural favorece la fragmentación prematura de los corneocitos y la formación de brechas en la barrera.
Módulo 3: Dermatitis atópica – Epidemiología y patogénesis racial
Dermatitis atópica inicial en un Bulldog francés
Características generales de la dermatitis atópica canina
La dermatitis atópica canina representa la patología dermatológica más frecuente en el Bulldog Francés, afectando entre el 15 y 20% de la población racial según los estudios epidemiológicos europeos y norteamericanos. A matizar sin embargo con ciertos sesgos de reclutamiento. Esta dermatosis inflamatoria crónica recidivante se caracteriza por un prurito intenso, una distribución lesional estereotipada y una evolución clínica marcada por brotes entrecortados de remisiones parciales. La patogénesis compleja de esta afección implica una interacción entre una predisposición genética poligénica, una disfunción primaria de la barrera epidérmica, una desregulación inmunitaria con polarización Th2 excesiva, y factores ambientales desencadenantes incluyendo los alérgenos aerotransportados y alimentarios.
Cronología y precocidad de los signos clínicos
La edad de inicio de las manifestaciones clínicas en el Bulldog Francés se sitúa típicamente entre 6 meses y 3 años, con un pico de incidencia entre 12 y 18 meses. Un estudio retrospectivo sobre 487 Bulldogs Franceses atópicos demuestra que el 62% de los casos se manifiestan antes de los 24 meses, y el 89% antes de los 4 años. Esta precocidad de aparición contrasta con ciertas razas como el Pastor Alemán donde los signos pueden comenzar más tardíamente. La expresión clínica inicial se caracteriza frecuentemente por un prurito facial aislado, tocando el periocular, el pabellón auricular y las comisuras labiales, evolucionando progresivamente hacia una generalización con afectación podal, axilar y ventral sobre un período de 6 a 18 meses. El score CADESI-4 (Canine Atopic Dermatitis Extent and Severity Index), evaluando el eritema y las lesiones sobre 20 sitios anatómicos, revela valores medios de 35 a 45 en los Bulldogs Franceses no tratados, comparativamente a 25-30 para otras razas atópicas, testimoniando una severidad clínica acrecentada.
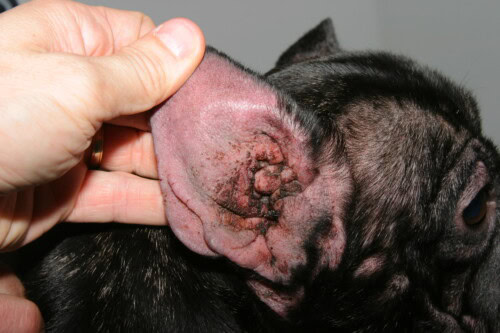
Otitis de origen atópico
Particularidades de la distribución lesional e hipermastocitosis
La distribución lesional en esta raza presenta ciertas particularidades respecto al patrón clásico de la dermatitis atópica. Si la afectación de las zonas clásicas (cara, orejas, espacios interdigitales, pliegues axiales e inguinales) permanece constante, el Bulldog Francés desarrolla frecuentemente lesiones severas a nivel de los pliegues faciales y del surco naso-labial, donde la maceración agrava la inflamación atópica subyacente.
El Descubrimiento Mayor de la Variante SLAMF1
El descubrimiento reciente de una variante genética mayor asociada a la dermatitis atópica canina constituye un avance considerable en la comprensión de los mecanismos subyacentes a las predisposiciones dermatológicas del Bulldog francés. Un estudio de asociación pangenómica conducido sobre más de 28 000 perros genotipados por chip de polimorfismos nucleotídicos de densidad media ha identificado una señal estadísticamente significativa sobre el cromosoma 38 canino, particularmente intensa en el Bulldog francés. La secuenciación completa del genoma de casos y testigos ha revelado una variante de splicing en el sitio donador en el gen SLAMF1, codificando para la molécula de activación de los linfocitos de señalización de tipo 1, designada también CD150. La mutación SLAMF1 altera el sitio donador de splicing altamente conservado aguas abajo del exón 4, conllevando el uso de un sitio críptico y la adición aberrante de 41 pares de bases al exón 4. Esta modificación genera una proteína truncada con 83 aminoácidos aberrantes antes de la terminación precoz, suprimiendo así la cola citoplasmática de SLAMF1 incluyendo los motivos funcionales ITSM esenciales para la unión de los ligandos de señalización celular.
La prevalencia de esta variante es particularmente alarmante en el Bulldog Francés. Los datos indican que esta variante está presente en el 71% de los individuos de la raza, contra el 40% en los Bóxers, sugiriendo una fijación genética involuntaria ligada a la selección racial. El impacto clínico es directo y cuantificable: la presencia de esta variante aumenta significativamente el riesgo de desarrollar una dermatitis atópica canina (DAC). Los análisis de riesgo relativo muestran que los perros portadores de una copia de la variante tienen un riesgo acrecentado de 1,89 veces, mientras que los homocigotos para la variante ven su riesgo multiplicado por 3,57.
El receptor SLAMF1, expresado en la superficie de los linfocitos T, B, NK y de las células dendríticas, juega un papel regulador crítico en las respuestas inmunitarias. La disrupción de la cola citoplasmática impide la unión de la proteína adaptadora SAP e inhibe la formación del complejo ternario SLAM-SAP-Fyn-SH3, cascada de señalización implicada en la modulación de la producción de citocinas inflamatorias por las células dendríticas derivadas de los monocitos. La hipótesis patogénica reposa sobre una desregulación de las respuestas inflamatorias consecutivas a los estímulos alergénicos, las interacciones SLAM-SLAM homotípicas inhibiendo normalmente la producción de citocinas pro-inflamatorias inducida por CD40. La frecuencia alélica de la variante SLAMF1 se establece en 0,082 en la base de datos Dog10k y se revela particularmente elevada incluso fijada en ciertas líneas de Bulldogs franceses, Bóxers y Boston Terriers. El análisis del modo de herencia y el cálculo de los odds ratios demuestran que esta variante confiere un riesgo multiplicado por dos de desarrollar una dermatitis atópica, con un efecto dosis-dependiente sugiriendo un modo de herencia dominante o aditivo según las razas estudiadas.
Esta confirmación molecular valida la observación clínica de una “atopia racial” severa. La disfunción de SLAMF1 podría explicar la tendencia de la raza a desarrollar respuestas inflamatorias desproporcionadas a los alérgenos ambientales, superando el simple marco de la hipersensibilidad a Dermatophagoides farinae para incluir una desregulación inmunitaria intrínseca.
Patogénesis inmunológica y polarización Th2
La patogénesis inmunológica de la dermatitis atópica en el Bulldog Francés implica una cascada de eventos celulares y moleculares iniciada por la penetración transcutánea de alérgenos ambientales a través de la barrera epidérmica deficiente. Las células de Langerhans epidérmicas, células dendríticas presentadoras de antígenos, capturan los alérgenos y migran hacia los ganglios linfáticos drenantes donde activan los linfocitos T naïfs. En un contexto genéticamente predispuesto, esta activación orienta preferencialmente la diferenciación hacia un fenotipo Th2, caracterizado por la producción de interleucinas IL-4, IL-5, IL-13 e IL-31. La IL-4 e IL-13 inducen el cambio isotípico de los linfocitos B hacia la producción de inmunoglobulinas E (IgE) específicas de alérgenos, que se fijan sobre los receptores de alta afinidad FcεRI expresados por los mastocitos y basófilos cutáneos.
Degranulación mastocitaria e hiperproducción de IgE
La degranulación mastocitaria IgE-dependiente, desencadenada por la reexposición alergénica y la reticulación de las IgE membranales, libera una pléyade de mediadores preformados y neoformados. Los mediadores preformados incluyen la histamina, la triptasa, la quimasa y la heparina, responsables de la vasodilatación, del eritema y del prurito agudo. Los mediadores neoformados, sintetizados después de la activación celular, comprenden los leucotrienos (LTB4, LTC4) provenientes del metabolismo del ácido araquidónico por la 5-lipoxigenasa, y las prostaglandinas (PGD2) generadas vía la ciclooxigenasa-2.
Papel central de la interleucina-31 (IL-31) en el prurito
La interleucina-31, citocina pruritógena mayor producida principalmente por los linfocitos Th2 activados, juega un papel central en la fisiopatología del prurito atópico. Esta citocina se une a un complejo receptor heterodimérico compuesto del IL-31RA y del OSMR, expresado constitutivamente sobre las neuronas sensitivas cutáneas y los queratinocitos. La activación de este complejo desencadena la fosforilación secuencial de las quinasas JAK1, JAK2 y de los factores de transcripción STAT1, STAT3 y STAT5, induciendo la expresión de genes pro-pruríticos y pro-inflamatorios. Los dosajes séricos de IL-31 en los Bulldogs Franceses atópicos revelan concentraciones medias de 485 pg/ml, significativamente superiores a los 125 pg/ml medidos en los perros sanos, con una correlación positiva (r=0,72, p<0,001) entre las tasas de IL-31 y la intensidad del prurito evaluada por escala visual analógica.
Amplificación de la respuesta por la TSLP
La thymic stromal lymphopoietin (TSLP), citocina epitelial producida por los queratinocitos en respuesta a las agresiones mecánicas y a las proteasas alergénicas, amplifica la respuesta Th2 activando las células dendríticas hacia un fenotipo pro-alérgico. La TSLP induce la expresión de OX40-ligand sobre las células dendríticas, molécula co-estimuladora esencial para la diferenciación Th2. Los análisis transcriptómicos de piel lesional de Bulldog Francés atópicos revelan una sobreexpresión de TSLP de 4,2 veces comparativamente a la piel sana, con niveles de ARNm correlacionando con el grosor de la epidermis y el grado de acantosis. Este bucle de amplificación queratinocito-dendrocito-linfocito T perpetúa la inflamación crónica y la sensibilización alergénica progresiva.
Reclutamiento e impacto de los eosinófilos tisulares
Los eosinófilos, granulocitos efectores mayores de la inflamación de tipo 2, se acumulan en la dermis de las lesiones atópicas bajo la influencia quimiotáctica de la IL-5, de la eotaxina (CCL11) y del RANTES (CCL5). Estas células liberan proteínas catiónicas granulares citotóxicas, notablemente la proteína básica mayor (MBP), la peroxidasa eosinofílica (EPO) y la proteína catiónica eosinofílica (ECP), que dañan los tejidos circundantes y amplifican la inflamación. Los recuentos histológicos de eosinófilos dérmicos sobre biopsias de Bulldog Francés atópicos muestran densidades medias de 215 células por milímetro cuadrado, contra 15 a 25 en los testigos sanos. Esta eosinofilia tisular correlaciona con la cronicidad de la enfermedad y la presencia de lesiones liquenificadas.
Disbiosis del microbioma cutáneo
El microbioma cutáneo de los Bulldogs Franceses atópicos presenta alteraciones profundas de su composición y de su diversidad. Los análisis por secuenciación 16S ARNr revelan una disbiosis caracterizada por una pérdida de diversidad alfa (índice de Shannon reducido de 4,2 a 2,1) y una expansión clonal de Staphylococcus pseudintermedius, cuya abundancia relativa pasa del 5-10% en los perros sanos al 45-65% en las zonas lesionales. Esta proliferación estafilocócica no representa una simple colonización oportunista sino que participa activamente en la patogénesis por producción de exotoxinas con actividad superantigénica. Las enterotoxinas estafilocócicas (SEA, SEB, SEC) activan de manera policlonal los linfocitos T independientemente de su especificidad antigénica, conectando el receptor T cell receptor (TCR) al complejo mayor de histocompatibilidad de clase II (CMH-II), amplificando masivamente la respuesta inflamatoria.
Perfil de sensibilización alergénica y polisensibilización
La sensibilización alergénica en el Bulldog Francés atópico sigue un perfil característico identificado por tests intradérmicos y dosajes de IgE específicas. Un estudio multicéntrico europeo sobre 842 Bulldogs Franceses atópicos revela que el 78% presentan reacciones positivas a los ácaros del polvo doméstico (Dermatophagoides farinae, Dermatophagoides pteronyssinus), el 56% a los pólenes de gramíneas, el 48% a los mohos de interior (Malassezia sympodialis, Aspergillus fumigatus) y el 34% a los alérgenos epiteliales. La polisensibilización, definida por al menos 5 reactividades significativas, concierne al 67% de los individuos, sugiriendo una hiperreactividad alergénica global más que una sensibilización monoalergénica. Esta polisensibilización complica la gestión terapéutica y limita la eficacia de la inmunoterapia específica alergénica.
Módulo 4: Dermatosis de los pliegues y complicaciones infecciosas
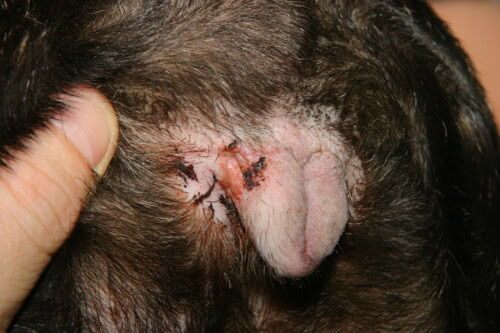
Intertrigo vulvar
Fisiopatología del intertrigo
El intertrigo o dermatitis de los pliegues constituye una entidad clínica cuasi patognomónica del Bulldog Francés, resultante directamente de su conformación braquicefálica extrema. Esta dermatosis inflamatoria se desarrolla en las zonas de pliegue cutáneo donde la aposición permanente de dos superficies epidérmicas crea un microambiente ocluido, caliente y húmedo, propicio para la maceración tisular y la proliferación microbiana. Las localizaciones anatómicas privilegiadas incluyen el pliegue naso-facial, el pliegue del labio inferior, los pliegues vulvares en la hembra, y secundariamente los pliegues de cola cuando esta está enrollada en tirabuzón. La fisiopatología del intertrigo reposa sobre una cascada de eventos iniciada por la fricción mecánica continua entre las superficies cutáneas opuestas, generando una inflamación de contacto con liberación de citocinas pro-inflamatorias por los queratinocitos traumatizados.
Consecuencias de la maceración y alcalinización del pH
La maceración epidérmica, proceso central de la patogénesis del intertrigo, resulta de la acumulación de secreciones lagrimales, salivales y sebáceas en el espacio confinado del pliegue. La humedad relativa en estas zonas alcanza el 85 a 95%, favoreciendo la hidratación excesiva del stratum corneum que pierde su cohesión estructural. Las medidas de pH cutáneo por electrodo de superficie revelan una alcalinización progresiva del microambiente de los pliegues, con valores pasando de 5,5 en las zonas cutáneas expuestas a 7,0-7,5 en los pliegues profundos. Esta elevación del pH inactiva parcialmente las enzimas proteolíticas del stratum corneum, normalmente activas en medio ácido, perturbando la descamación fisiológica y favoreciendo la acumulación de detritos celulares. La alcalinización modifica también la composición de la película lipídica de superficie, reduciendo su actividad antimicrobiana natural y creando un terreno favorable a la colonización bacteriana y fúngica.
Secuencia de colonización microbiana
La colonización microbiana de los pliegues macerados sigue una secuencia previsible, comenzando por una expansión de la flora comensal residente, principalmente Staphylococcus pseudintermedius y levaduras Malassezia pachydermatis, que evolucionan hacia un estatus patógeno oportunista. Los recuentos microbiológicos cuantitativos por técnica de hisopado estandarizado revelan cargas bacterianas medias de 10^6 a 10^7 unidades formadoras de colonias por centímetro cuadrado en los pliegues inflamados, contra 10^3 a 10^4 UFC/cm² sobre la piel sana adyacente. Staphylococcus pseudintermedius, cocos Gram positivo productor de coagulasa, secreta una batería de enzimas y toxinas favoreciendo su invasión tisular, notablemente lipasas, proteasas, nucleasas y la proteína A estafilocócica que inhibe la opsonización por unión al fragmento Fc de las inmunoglobulinas. La transición de comensal a patógeno se acompaña de una modificación del perfil genómico bacteriano con sobreexpresión de factores de virulencia regulados por el sistema quorum sensing agr (accessory gene regulator).
Clasificación y diagnóstico de las piodermas superficiales
Las piodermas superficiales representan la evolución natural del intertrigo no tratado o crónico en el Bulldog Francés. Estas infecciones cutáneas bacterianas se caracterizan por una infiltración neutrofílica de la dermis superficial con formación de pústulas intra-epidérmicas o subcórneas. La clasificación anatómica distingue el impétigo (afectación de las capas superficiales de la epidermis), la foliculitis superficial (infección del tercio superior del folículo piloso) y la pioderma superficial difusa. En el Bulldog Francés, la foliculitis bacteriana superficial se manifiesta clínicamente por pápulas eritematosas centradas por una pústula, evolucionando en coleretas epidérmicas después de la ruptura pustular. Las zonas glabras o con pilosidad rala como la región axilar e inguinal son preferencialmente afectadas. El examen citológico por aposición de lámina revela una población neutrofílica degenerada con fagocitosis de cocos arreglados en racimos (estafilococos) en el 92% de los casos, confirmando el origen bacteriano de la infección.
Problemática de los estafilococos resistentes (MRSP)
La resistencia a los antibióticos de Staphylococcus pseudintermedius constituye una problemática creciente en dermatología veterinaria del Bulldog Francés, raza que recibe frecuentemente antibioterapias iterativas para sus infecciones cutáneas recurrentes. Las cepas resistentes a la meticilina (MRSP – Methicillin-Resistant Staphylococcus pseudintermedius) han emergido desde los años 2000, adquiriendo el gen mecA codificante para una proteína de unión a la penicilina modificada (PBP2a) con baja afinidad para los beta-lactámicos. Un estudio de prevalencia realizado en 28 clínicas veterinarias francesas revela una tasa de portaje de MRSP del 18% en los Bulldogs Franceses consultando por dermatitis, contra el 8% en promedio de todas las razas confundidas. Estas cepas MRSP presentan frecuentemente una multirresistencia, asociando resistencia a las fluoroquinolonas (mutaciones en los genes gyrA y parC codificantes para la ADN girasa y la topoisomerasa IV), a los macrólidos (adquisición del gen ermB) y a los aminoglucósidos, limitando drásticamente el arsenal terapéutico disponible.
Persistencia por los biofilms bacterianos
Los biofilms bacterianos, estructuras tridimensionales complejas donde las bacterias se organizan en comunidades encapsuladas en una matriz extracelular de polisacáridos, proteínas y ADN extracelular, representan un mecanismo de persistencia mayor de las infecciones cutáneas crónicas. Staphylococcus pseudintermedius produce un polisacárido de adhesión intercelular (PIA) codificado por el operón icaADBC, permitiendo la adhesión bacteriana a los corneocitos y la formación de una arquitectura biofilm madura. Las bacterias sésiles del biofilm presentan una tolerancia antimicrobiana acrecentada de 100 a 1000 veces comparativamente a las formas planctónicas libres, resultando de varios mecanismos: penetración limitada de los antibióticos a través de la matriz polimérica, microambiente nutricional desfavorable induciendo una ralentización metabólica bacteriana, y expresión de genes de resistencia específicos al biofilm. La microscopía confocal de biopsias cutáneas de Bulldogs Franceses con pioderma crónica recidivante revela la presencia de biofilms organizados en el 68% de los casos, explicando la dificultad de erradicación por antibioterapia convencional.
Dermatitis piotraumática (hot spot)
La dermatitis piotraumática, comúnmente llamada hot spot o dermatitis húmeda aguda, constituye una complicación frecuente en el Bulldog Francés atópico. Esta lesión eritematosa exudativa de evolución fulminante resulta de una auto-mutilación intensa desencadenada por un prurito localizado, a menudo de origen alérgico o parasitario. El lamido y rascado compulsivos crean una erosión epidérmica rápidamente colonizada por la flora cutánea oportunista, principalmente Staphylococcus pseudintermedius. La liberación de mediadores inflamatorios, notablemente el péptido antimicrobiano LL-37 que posee paradójicamente propiedades quimiotácticas para los neutrófilos, recluta masivamente estos granulocitos y amplifica la inflamación local. El exudado sero-purulento abundante macea los pelos adyacentes, creando una placa alopécica húmeda maloliente de 3 a 10 centímetros de diámetro, típicamente localizada sobre las regiones con alta densidad de folículos pilosos como la región temporal, pre-auricular o la grupa.
Complicaciones por las levaduras Malassezia
Las infecciones a Malassezia representan una complicación frecuente del intertrigo y de la dermatitis atópica en el Bulldog Francés. Estas levaduras lipófilas comensales del género Malassezia, principalmente M. pachydermatis (especie no lípido-dependiente) y M. sympodialis, proliferan de manera oportunista en los ambientes calientes, húmedos y lipídicos de los pliegues cutáneos. La patogénesis de la dermatitis a Malassezia implica una interacción compleja entre proliferación fúngica cuantitativa y reactividad inmunológica del huésped. Ciertos perros desarrollan una hipersensibilidad de tipo I y IV a los antígenos de Malassezia, mediada respectivamente por IgE específicas y una respuesta celular mediada por linfocitos T. Los recuentos citológicos por técnica del Scotch-test revelan densidades de levaduras superiores a 10 organismos por campo microscópico con gran aumento en las zonas afectadas, contra menos de 2 organismos en los portadores asintomáticos.
Otitis externas y remodelado del conducto
Las otitis externas, afección cuasi-constante en el Bulldog Francés atópico, resultan de una extensión de la inflamación cutánea al conducto auditivo externo, zona considerada como un pliegue cutáneo modificado. La conformación particular de la oreja del Bulldog, con un conducto auditivo externo corto, ancho y de orientación horizontal, favorece la acumulación de cerumen y la retención de humedad. La inflamación alérgica del epitelio del conducto conlleva una hiperplasia de las glándulas ceruminosas con producción de un cerumen modificado, más viscoso y en cantidad excesiva, creando un sustrato nutritivo óptimo para Malassezia pachydermatis. Los análisis citológicos de cerumen de Bulldogs Franceses con otitis externa revelan una predominancia de Malassezia en el 76% de los casos, una infección bacteriana mixta en el 18%, y una infección bacteriana pura en solo el 6%. La cronicidad otítica induce progresivamente modificaciones estructurales irreversibles del conducto, con fibrosis, calcificación del cartílago auricular y estenosis progresiva, pudiendo necesitar una intervención quirúrgica de ablación del conducto y osteotomía de la bulla timpánica en los estadios terminales.
Módulo 5: Dermatitis a Malassezia y piodermas recurrentes
Biología de Malassezia pachydermatis
La dermatitis a Malassezia constituye una entidad clínica mayor en el Bulldog Francés, sobreviniendo sea como complicación de una dermatitis atópica subyacente, sea como manifestación de una hipersensibilidad primaria a los antígenos fúngicos. Las levaduras del género Malassezia representan organismos comensales lipófilos ubicuos de la piel y mucosas caninas, con siete especies identificadas en el perro donde Malassezia pachydermatis permanece la más frecuente. Esta especie presenta la particularidad única de ser no lípido-dependiente para su cultivo in vitro, contrariamente a las otras especies de Malassezia que requieren un enriquecimiento lipídico del medio. La morfología celular de M. pachydermatis se caracteriza por blastoconidias ovoides a monopolares de 3 a 8 micrómetros con una gemación unipolar, fácilmente identificables al examen citológico después de coloración rápida tipo Diff-Quik o coloración de Gram donde aparecen como cocos violetas a azules en forma de cacahuete.
Mecanismos de transición hacia la patogenicidad
La transición de comensal a patógeno de las levaduras Malassezia implica varios mecanismos interconectados. Los estudios de secuenciación genómica completa de M. pachydermatis revelan un genoma de 7,98 megabases codificando para un arsenal enzimático que comprende lipasas, fosfolipasas y proteasas secretadas que degradan los lípidos cutáneos y las proteínas estructurales epidérmicas. Las lipasas hidrolizan los triglicéridos del sebo en ácidos grasos libres, algunos como el ácido oleico poseen propiedades irritantes y alteran aún más la función barrera. Las fosfolipasas A2 secretadas por Malassezia escinden los fosfolípidos membranales queratinócitos, generando ácido araquidónico precursor de los mediadores pro-inflamatorios prostaglandinas y leucotrienos vía las vías ciclooxigenasa y lipoxigenasa. Esta actividad enzimática pro-inflamatoria explica cómo incluso una colonización cuantitativamente moderada puede inducir una inflamación clínicamente significativa en los individuos genéticamente predispuestos.
Reconocimiento inmunitario e inflamación
El reconocimiento inmunitario de los antígenos de Malassezia por el sistema inmunitario cutáneo constituye un elemento patogénico central. Las células dendríticas dérmicas y epidérmicas expresan receptores de reconocimiento de patrones moleculares (PRR – Pattern Recognition Receptors), notablemente los Toll-like receptors TLR2 y TLR4, que reconocen los componentes de la pared fúngica como los mananos y los beta-glucanos. Este reconocimiento desencadena la activación de la vía de señalización NF-κB con producción de citocinas pro-inflamatorias IL-1β, IL-6, IL-8 y TNF-α por los queratinocitos y las células inmunitarias residentes. En los Bulldogs Franceses sensibilizados, la exposición repetida a los antígenos de Malassezia induce una polarización Th2 con producción de IgE específicas que se fijan sobre los receptores FcεRI de los mastocitos cutáneos. La reexposición antigénica provoca entonces una degranulación mastocitaria rápida con liberación de histamina, desencadenando prurito y eritema en algunos minutos.
Semiología clínica de la dermatitis a Malassezia
Las manifestaciones clínicas de la dermatitis a Malassezia en el Bulldog Francés presentan una semiología característica. El eritema intenso, tocando preferencialmente las zonas intertriginosas (pliegues faciales, espacios interdigitales, pliegues axiales e inguinales), se acompaña de un prurito severo y un olor rancio particular resultante de la degradación lipídica por las lipasas fúngicas. La piel afectada presenta un aspecto brillante graso con a veces una descamación fina adherente. La hiperpigmentación post-inflamatoria sobreviene rápidamente en las zonas de cronicidad, confiriendo un aspecto brunáceo a la piel inicialmente eritematosa. Los espacios interdigitales, particularmente en los sujetos atópicos, se vuelven un sitio de predilección con eritema intenso, exudación y formación de quistes interdigitales secundarios a la inflamación folicular profunda. El lamido compulsivo de las patas representa frecuentemente el primer signo de alerta, con una coloración marrón-rojiza de los pelos blancos por las porfirinas salivales, indicando un lamido crónico.
Diagnóstico citológico y umbrales patológicos
El diagnóstico citológico de la dermatitis a Malassezia reposa sobre la puesta en evidencia de un número anormalmente elevado de levaduras al examen microscópico. Varias técnicas de muestreo se revelan utilizables: la técnica de aposición directa por presión de una lámina de vidrio sobre la piel eritematosa, el hisopado seguido de un rodado sobre lámina, o el scotch-test particularmente adaptado a los espacios interdigitales y a los pliegues. Después de coloración rápida, el recuento microscópico con aumento 1000 bajo inmersión permite una semi-cuantificación. El umbral patológico permanece controvertido, pero un consenso propone como significativa la presencia de más de 10 levaduras por campo microscópico en promedio sobre 10 campos, o más de 3 a 5 levaduras por campo en las zonas normalmente pobres en Malassezia como el tronco. En el Bulldog Francés, los recuentos citológicos en las zonas lesionales revelan frecuentemente 25 a 50 organismos por campo, testimoniando una proliferación masiva.
Problemática de las piodermas recurrentes
Las piodermas recurrentes representan una problemática terapéutica mayor en el Bulldog Francés, definida por la sobrevención de tres episodios o más de pioderma bacteriana sobre un período de 12 meses. Esta recurrencia resulta raramente de una falla del tratamiento antibiótico del episodio inicial, sino más bien de la persistencia de factores predisponentes subyacentes no controlados. Las causas subyacentes documentadas en el Bulldog incluyen la dermatitis atópica en el 68% de los casos, el hipotiroidismo en el 8%, el síndrome de Cushing en el 3%, y los déficits inmunitarios raros. La atopia no controlada crea un círculo vicioso donde la inflamación crónica, la disfunción de barrera y el prurito con auto-traumatismo perpetúan las condiciones favorables a la infección bacteriana. El reconocimiento y tratamiento de esta causa subyacente se revelan imperativos para romper el ciclo infeccioso recurrente.
Foliculitis bacteriana profunda y furunculosis
La foliculitis bacteriana profunda, evolución potencial de una foliculitis superficial no tratada o recidivante, alcanza el segmento inferior del folículo piloso y puede extenderse al tejido subcutáneo bajo forma de furunculosis. Esta infección severa se caracteriza clínicamente por nódulos eritematosos firmes, dolorosos a la palpación, que pueden evolucionar hacia la abscedación con formación de trayectos fistulosos drenando un exudado hemorrágico o purulento. Las zonas corporales con folículos profundos como la región del mentón (foliculitis mentoniana o acné canino), los espacios interdigitales y los puntos de presión son preferencialmente afectadas. El examen histopatológico revela una ruptura de la pared folicular con liberación del contenido folicular (bacterias, queratina, sebo) en la dermis circundante, desencadenando una reacción granulomatosa piogranulomatosa intensa centrada sobre los detritos queratínicos. La presencia de macrófagos epitelioides, de células gigantes multinucleadas y de una fibrosis progresiva caracteriza esta inflamación crónica.
Pododermatitis y quistes interdigitales
La pododermatitis, inflamación de las almohadillas plantares y de los espacios interdigitales, constituye una localización particularmente problemática en el Bulldog Francés debido a la conformación anatómica de los miembros y el peso corporal elevado sobre una superficie de apoyo reducida. La pododermatitis del Bulldog Francés presenta a menudo una etiología multifactorial combinando dermatitis atópica, dermatitis a Malassezia y pioderma bacteriana secundaria. Los espacios interdigitales se vuelven eritematosos, edematosos y dolorosos, con formación de bullas hemorrágicas y de trayectos fistulosos en los casos severos. El lamido compulsivo agrava las lesiones por traumatismo mecánico repetido e inoculación salival continua. Los quistes interdigitales, nódulos fluctuantes o firmes de los espacios interdigitales, resultan de una foliculitis y furunculosis profunda con formación de abscesos enquistados. El examen citológico del contenido quístico revela típicamente una inflamación piogranulomatosa con neutrófilos degenerados, macrófagos activados y material queratinoso, con o sin bacterias visibles según el estadio evolutivo.
Pioderma mucocutánea: erosiones y ulceraciones
La pioderma mucocutánea, afección dermatológica rara pero documentada en el Pastor Alemán y esporádicamente reportada en otras razas entre ellas el Bulldog Francés, se caracteriza por una inflamación erosiva y ulcerativa de las uniones mucocutáneas, particularmente labial, nasal, perianal y genital. Esta dermatosis presenta una fisiopatología inmunológica compleja implicando una reacción de hipersensibilidad a los antígenos bacterianos estafilocócicos combinada con un déficit funcional de los linfocitos T supresores. Las lesiones comienzan por un eritema y un edema de la unión mucocutánea, evolucionando rápidamente hacia erosiones luego ulceraciones superficiales dolorosas con formación de costras hemorrágicas. El examen histopatológico revela una dermatitis liquenoide de interfaz con degeneración hidrópica de la capa basal, infiltrado linfoplasmocitario perivascular y apoptosis queratinócita. El cultivo bacteriano aísla regularmente Staphylococcus pseudintermedius, pero la mejoría bajo antibioterapia permanece parcial y transitoria, necesitando frecuentemente la adición de inmunomoduladores.
Módulo 6: La demodecia
Demodecia juvenil
Una dermatosis parasitaria que no ha desaparecido
La demodecia canina resulta de la proliferación patológica excesiva de ácaros comensales del género Demodex, principalmente Demodex canis y más raramente Demodex injai, colonizando normalmente los folículos pilosos y las glándulas sebáceas de la piel canina a bajas densidades. La transmisión de Demodex canis sobreviene verticalmente de la perra a los cachorros recién nacidos por contacto directo durante los primeros días de lactancia, los ácaros migrando de las mamas maternas hacia los folículos pilosos de la cara y de los miembros anteriores de los recién nacidos. En la mayoría de los perros, las poblaciones de ácaros permanecen en equilibrio homeostático a densidades inferiores al umbral patológico durante toda la existencia, mantenidas bajo control por las defensas inmunitarias innatas y adaptativas locales. En una minoría de individuos, una ruptura de este equilibrio permite la proliferación acariana excesiva generando lesiones cutáneas inflamatorias. Esta ruptura homeostática sobreviene sea por disfunción inmunitaria primaria genéticamente determinada en la demodecia juvenil, sea por inmunosupresión secundaria adquirida en la demodecia del adulto.
El análisis epidemiológico británico VetCompass conducido sobre 455 553 perros en cuidados veterinarios primarios durante el año 2013 revela una prevalencia anual global del 0,17% con intervalo de confianza al 95% del 0,16 al 0,19% para la demodecia en la población canina general. La distinción por edad demuestra una prevalencia dramáticamente superior en los jóvenes con 0,48% e intervalo de confianza del 0,45 al 0,52% para los perros de menos de 2 años, comparativamente al 0,05% e intervalo de confianza del 0,04 al 0,06% para los perros de más de 4 años, ratio ilustrando que la demodecia juvenil sobreviene aproximadamente diez veces más frecuentemente que la forma adulta. Entre los 702 casos para los cuales la edad en el primer diagnóstico estaba disponible, la edad mediana se establecía en 7 meses con intervalo intercuartil de 4 a 13 meses, el 72,4% de los casos tenían menos de 1 año, el 79,6% menos de 1,5 años, el 81,6% menos de 2 años y solamente el 14,0% más de 4 años. Esta distribución de edad confirma la predominancia masiva de la presentación juvenil de la demodecia canina en la práctica veterinaria primaria.
El Bulldog francés manifiesta una susceptibilidad racial significativa a la demodecia juvenil con un odds ratio ajustado de 5,07 e intervalo de confianza de 3,37 a 7,63 comparativamente a los perros mestizos en el modelo multivariado incluyendo raza, peso relativo al promedio racial, edad y estatus sexo-esterilización con clínica veterinaria como efecto aleatorio. Esta predisposición sitúa al Bulldog francés en el sexto rango de las razas de riesgo elevado después del Bulldog inglés con odds ratio de 11,26, el Staffordshire Bull Terrier con odds ratio de 7,11, el Shar-Pei chino con odds ratio de 6,57, el Dogo de Burdeos con odds ratio de 5,92 y el Carlino con odds ratio de 5,41. La prevalencia anual bruta de demodecia en el Bulldog francés de menos de 2 años alcanza el 1,88% con intervalo de confianza del 1,30 al 2,73%, sea cuatro veces la prevalencia observada en los perros mestizos del 0,37% y dos a tres veces superior a la del Bóxer. Notablemente, ningún caso de demodecia fue identificado en los Bulldogs franceses de más de 4 años en esta cohorte, sugiriendo sea que los individuos presentando una susceptibilidad genética manifiestan su enfermedad precozmente sea que los Bulldogs franceses afectados por demodecia juvenil son mayoritariamente curados y no desarrollan forma recurrente en la edad adulta.
La pertenencia común del Bulldog inglés, del Bulldog francés, del Staffordshire Bull Terrier, del Dogo de Burdeos y del Bóxer al mismo clado genético identificado por análisis filogenéticos pangenómicos sugiere fuertemente una base genética compartida para la susceptibilidad a la demodecia juvenil. Este clado, reagrupando las razas de tipo bulldog y bull terrier, comparte variantes genéticas ancestrales comunes resultantes de cuellos de botella poblacionales históricos y de selección intensiva sobre características morfológicas comunes incluyendo braquicefalia, cuerpo rechoncho y temperamento. La observación convergente de estudios epidemiológicos independientes americanos y británicos identificando las mismas razas de este clado genético entre las más predispuestas refuerza la hipótesis de un determinismo genético sustancial para la demodecia juvenil. La naturaleza precisa de las variantes causales, su modo de transmisión y su penetrancia permanecen sin embargo no elucidadas. El consenso actual postula un modo de herencia poligénica compleja implicando múltiples loci de efecto moderado más que una mutación monogénica Mendeliana, coherente con la variabilidad fenotípica observada en el seno de las camadas afectadas.
Una disfunción inmunitaria ante todo
La fisiopatología de la demodecia juvenil implica una disfunción inmunitaria específica a los ácaros Demodex, los perros afectados manifestando respuestas inmunitarias normales vis-à-vis otros agentes patógenos. Las investigaciones inmunológicas han revelado perturbaciones cuantitativas y cualitativas de las subpoblaciones linfocitarias T en los perros demodécicos. Un estudio funcional demostraba que los linfocitos T de perros demodécicos generalizados presentaban una proliferación blástica reducida en respuesta a la estimulación por fitohemaglutinina y concanavalina A comparativamente a los controles sanos, sugiriendo un déficit de reactividad linfocitaria T. Los ratios de subpoblaciones linfocitarias CD4 positivo y CD8 positivo se revelaban alterados con una proporción reducida de linfocitos T auxiliares CD4 positivo. La producción de citocinas por los linfocitos estimulados manifestaba un desequilibrio hacia una polarización Th2 con secreción acrecentada de interleucina-4 e interleucina-10 inmunosupresivas en detrimento del interferón-gamma e interleucina-2 pro-inflamatorias de tipo Th1, polarización inadecuada para el control de una infestación parasitaria intrafolicular necesitando una respuesta celular citotóxica robusta.
Una dermatosis muy pleomórfica
La presentación clínica de la demodecia canina se declina según dos clasificaciones complementarias. La clasificación por edad distingue la forma juvenil comenzando típicamente entre 3 y 18 meses de la forma adulta apareciendo después. La clasificación por extensión lesional diferencia la forma localizada, caracterizada por menos de cinco lesiones focales de diámetro inferior a 2,5 centímetros con pronóstico favorable de resolución espontánea en el 90% de los casos sin tratamiento acaricida, de la forma generalizada definida por más de cinco lesiones, afectación de más de dos regiones anatómicas, pododemodecia afectando al menos dos patas, o lesiones extensas cubriendo una superficie corporal total superior a la de un miembro. La demodecia generalizada necesita invariablemente un tratamiento acaricida sistémico y comporta un pronóstico reservado. Las lesiones cutáneas primarias consisten en alopecias no inflamatorias multifocales a coalescentes predominando inicialmente en regiones peri-oculares, comisuras labiales, cara interna de los pabellones auriculares y miembros, zonas anatómicas donde la colonización acariana inicial de los cachorros recién nacidos es máxima.
En las formas complicadas, frecuentes en el Bulldog francés debido a la coexistencia habitual con dermatitis atópica y pliegues cutáneos, la infestación demodécica masiva rompe la barrera cutánea folicular y favorece las infecciones bacterianas secundarias severas. La foliculitis luego furunculosis bacterianas a Staphylococcus pseudintermedius generan pústulas, pápulas eritematosas, costras, exudación sero-purulenta y dolor local intenso. Las formas profundas evolucionan hacia celulitis dérmica e hipodérmica con edema masivo, fistulización, drenaje purulento y adenomegalia satélite. Las pododermatitis demodécicas interdigitadas, particularmente frecuentes y refractarias, asocian eritema violáceo, tumefacción de los espacios interdigitados, fístulas drenantes, hiperqueratosis palmoplantar y cojera de apoyo por dolor. La cronicidad induce hiperpigmentación, liquenificación, fibrosis dérmica y alopecia cicatricial irreversible en los casos negligentes.
Un diagnóstico rápido y simple
El diagnóstico de demodecia reposa sobre la identificación microscópica de ácaros Demodex en número anormal en los raspados cutáneos profundos. La técnica estandarizada requiere compresión vigorosa de un pliegue cutáneo entre el pulgar y el índice durante 10 a 15 segundos para expulsar los ácaros del fondo de los folículos pilosos, seguida inmediatamente del raspado perpendicular al sentido del pelo con una lámina de bisturí previamente embadurnada de aceite mineral, proseguido hasta suintamiento capilar, garante de una profundidad de muestreo suficiente alcanzando la unión dermo-epidérmica. El material raspado se transfiere sobre lámina, se recubre de una laminilla y se examina al microscopio a aumentos 40 veces y 100 veces para contar ácaros adultos fusiformes, ninfas, larvas hexápodas y huevos operculados característicos. Un mínimo de cinco raspados procedentes de sitios lesionales distintos debería realizarse para maximizar la sensibilidad diagnóstica. El tricograma, consistente en el arrancamiento de múltiples pelos con pinza seguido de su examen microscópico después de montaje entre lámina y laminilla en aceite, constituye una alternativa menos invasiva particularmente útil para las localizaciones perioculares e interdigitadas difíciles de raspar.
La revolución de las isoxazolinas
Los protocolos terapéuticos de la demodecia canina han sido revolucionados por el advenimiento de las isoxazolinas orales, clase farmacológica de ectoparasiticidas modulando los canales cloruro dependientes del GABA y del glutamato de los invertebrados, induciendo parálisis y muerte de los artrópodos parásitos.
La demodecia del adulto, rara pero a no descuidar
El manejo de la demodecia adulta necesita imperativamente la identificación y tratamiento de las causas subyacentes de inmunosupresión. Las afecciones endocrinas incluyendo hipotiroidismo, hipercorticismo espontáneo o iatrogénico, y diabetes azucarada deberían ser sistemáticamente despistadas por dosajes hormonales apropiados. Las neoplasias, particularmente linfoma y mastocitoma, y las enfermedades autoinmunes sistémicas constituyen otras causas de inmunosupresión favoreciendo la demodecia adulta. Los tratamientos inmunosupresores incluyendo glucocorticoides sistémicos, ciclosporina y agentes quimioterápicos deben ser interrumpidos si es posible.
Módulo 7: Abordaje diagnóstico multimodal
Metodología clínica y sistema DAMN-IT
El diagnóstico dermatológico en el Bulldog Francés necesita un abordaje metódico integrando la anamnesis detallada, el examen clínico riguroso y los exámenes complementarios dirigidos. La complejidad del cuadro dermatológico de esta raza, combinando frecuentemente varias patologías superpuestas (atopia primaria, dermatitis a Malassezia, pioderma secundaria, intertrigo), exige del practicante una capacidad de análisis secuencial para identificar la afección primaria inicial y sus complicaciones secundarias. El abordaje diagnóstico estructurado según el método DAMN-IT (Developmental, Allergic, Metabolic, Neoplastic, Inflammatory, Traumatic, Infectious, Immunologic) permite elaborar una lista diferencial exhaustiva antes de restringirla progresivamente por eliminación o confirmación diagnóstica.
La anamnesis: pilar del razonamiento diagnóstico
La anamnesis constituye la piedra angular del razonamiento diagnóstico en dermatología. El interrogatorio minucioso del propietario debe documentar varios parámetros temporales y contextuales esenciales. La edad de aparición de los primeros signos clínicos orienta significativamente el diagnóstico diferencial: un inicio precoz antes de 6 meses sugiere una dermatosis congénita o hereditaria, mientras que un inicio entre 6 meses y 3 años evoca fuertemente una dermatitis atópica. La estacionalidad de los síntomas diferencia una atopia estacional ligada a los pólenes de una atopia perenne inducida por los ácaros del polvo o los alérgenos alimentarios. El carácter pruriginoso de la afección, evaluado por cuestionario estandarizado o escala visual analógica, representa un criterio diagnóstico mayor: un prurito sine materia (prurito sin lesión primaria visible) orienta hacia una hipersensibilidad alérgica, mientras que las lesiones primarias sin prurito sugieren una dermatosis metabólica o neoplásica. El ambiente de vida (urbano/rural), el modo de alojamiento (interior/exterior), la exposición a otros animales y los antecedentes de viajes documentan el riesgo de exposición a ectoparásitos o agentes infecciosos.
Examen clínico sistemático y otoscopía
El examen clínico dermatológico del Bulldog Francés sigue una metodología sistemática comenzando por la observación a distancia del estado general, del comportamiento y de los signos de prurito (lamido, mordisqueo, frotamiento). El examen cercano evalúa la distribución de las lesiones según un esquema anatómico estandarizado, distinguiendo las lesiones primarias (máculas, pápulas, pústulas, vesículas, nódulos) de las lesiones secundarias (erosiones, úlceras, costras, escamas, hiperpigmentación, liquenificación). La palpación aprecia el engrosamiento cutáneo, el edema subcutáneo y la sensibilidad dolorosa de las zonas afectadas. El examen de las mucosas aparentes (conjuntival, bucal, genital) busca una extensión de las lesiones a las uniones mucocutáneas. La inspección otoscópica bilateral evalúa el estado del conducto auditivo externo y de la membrana timpánica, la otitis externa estando presente en el 75 a 80% de los Bulldogs Franceses atópicos. La palpación de los ganglios linfáticos regionales (submandibulares, pre-escapulares, poplíteos) detecta una linfadenomegalia reaccional traduciendo una inflamación o infección cutánea del territorio drenado.
Citología cutánea: identificación celular y microbiana
El examen citológico cutáneo representa el examen complementario de primera intención en dermatología veterinaria, practicable en consulta sin equipamiento sofisticado. Varias técnicas de muestreo se aplican según el tipo de lesión. La técnica de aposición directa sobre lámina de vidrio se utiliza para las superficies eritematosas o exudativas. El scotch-test, particularmente adaptado a los espacios interdigitales y pliegues, consiste en aplicar un trozo de cinta adhesiva transparente sobre la zona a examinar luego pegarlo sobre una lámina. El hisopado seguido de un rodado sobre lámina permite explorar los conductos auriculares o las lesiones profundas. La punción con aguja fina (citoponción) de los nódulos o quistes toma el contenido celular para análisis. Después de secado al aire, las láminas sufren una coloración rápida tipo Diff-Quik (equivalente del May-Grünwald-Giemsa) permitiendo la diferenciación celular. El examen microscópico con aumento 400 luego 1000 bajo inmersión caracteriza la población celular inflamatoria (neutrófilos, eosinófilos, macrófagos, linfocitos), identifica los microorganismos (cocos o bacilos bacterianos, levaduras Malassezia, dermatofitos raros) y detecta las células atípicas sugiriendo una neoplasia.
Raspado cutáneo y diagnóstico parasitario
El raspado cutáneo, examen parasitológico esencial, busca los ácaros responsables de sarnas. Dos tipos de raspados se efectúan según la profundidad buscada. El raspado superficial, realizado hasta la aparición de un eritema ligero, detecta Sarcoptes scabiei, ácaro responsable de la sarna sarcóptica caracterizada por un prurito intenso recalcitrante. El raspado profundo, proseguido hasta el suintamiento capilar, pone en evidencia Demodex canis, ácaro folicular comensal pudiendo proliferar durante demodecia. Aunque el Bulldog Francés no figura entre las razas de riesgo elevado de demodecia generalizada (contrariamente al Shar-Pei o al Bull Terrier), casos de demodecia localizada periocular o de los labios sobrevienen ocasionalmente. El material de raspado, transferido sobre lámina con una gota de aceite mineral o de lactofenol, se examina al microscopio con aumento 100 luego 400. La identificación de adultos, larvas, ninfas o huevos de ácaros confirma el diagnóstico parasitario.
Tricoscopía: análisis del tallo piloso y del ciclo
La tricoscopía o examen microscópico del pelo completa el arsenal diagnóstico para las alopecias. Un muestreo de pelos por arrancamiento suave con pinza hemostática en las zonas alopécicas permite el análisis del tallo piloso y del bulbo. El examen al microscopio con débil luego fuerte aumento evalúa la fase del ciclo piloso (anágeno con bulbo pigmentado y vaina epitelial, telógeno con bulbo en maza sin vaina), busca anomalías estructurales del tallo (trichorrhexis nodosa, trichomalacia) e identifica esporas fúngicas en caso de dermatofitosis. En el Bulldog Francés, la alopecia resulta lo más a menudo del prurito con arrancamiento mecánico de los pelos (alopecia traumática), y la tricoscopía revela entonces tallos pilosos fracturados con extremidades irregulares sin anomalía del bulbo, contrastando con las alopecias endocrinas donde los pelos se depilan fácilmente con bulbos en telógeno.
Tests alergolegicos: IDT y dosajes séricos de IgE
Los tests alergológicos se indican en el Bulldog Francés después de confirmación del diagnóstico de dermatitis atópica según los criterios de Favrot, a fin de identificar los alérgenos implicados y considerar una inmunoterapia específica. Dos abordajes complementarios coexisten: los tests intradérmicos (IDT) y los dosajes séricos de IgE específicas. El test intradérmico representa el gold standard, inyectando en intradérmico a nivel del tórax tonsurado una batería de alérgenos estandarizados (ácaros, pólenes, mohos, epiteliales) diluidos en una solución salina. La lectura después de 15 a 20 minutos cuantifica la reacción papular y eritematosa comparativamente a los testigos positivo (histamina) y negativo (suero fisiológico). Un resultado positivo se define por una pápula de diámetro superior al 50% de la reacción histamínica. Los dosajes serológicos de IgE alérgeno-específicas por técnica ELISA o inmunoblot constituyen una alternativa menos invasiva, aunque su sensibilidad y especificidad permanecen inferiores a los IDT. Una concordancia imperfecta existe entre estos dos métodos, con un acuerdo en solamente el 60 a 70% de los casos, justificando la interpretación clínica de los resultados más que su aplicación mecánica.
Régimen de evicción y prueba de provocación alimentaria
El régimen de evicción alimentaria representa el único test diagnóstico fiable para confirmar o excluir una hipersensibilidad alimentaria contributiva al cuadro clínico. Este régimen consiste en alimentar exclusivamente al perro durante 8 a 12 semanas con una fuente de proteínas y de glucosas a las cuales el animal nunca ha sido expuesto (régimen con proteína nueva) o con un alimento hidrolizado cuyas proteínas fragmentadas en péptidos de bajo peso molecular (< 10 kDa) pierden su alergenicidad. La observancia estricta constituye el factor limitante mayor de este test, toda infracción alimentaria (golosinas, restos de mesa, medicamentos aromatizados) invalidando el resultado. Una mejoría clínica superior al 50% del prurito y de las lesiones cutáneas bajo régimen evoca fuertemente un componente alimentario. La confirmación diagnóstica necesita una prueba de provocación por reintroducción de la alimentación anterior, debiendo desencadenar una recaída en los 7 a 14 días. Si la recaída sobreviene, la reintroducción progresiva de ingredientes individuales permite identificar el o los alérgenos específicos responsables.
Examen histopatológico y biopsias cutáneas
El examen histopatológico cutáneo, aunque no específico para la dermatitis atópica, se indica durante presentación clínica atípica, de respuesta terapéutica inadecuada o de sospecha de proceso neoplásico o autoinmune. Las biopsias cutáneas al punch de 6 a 8 milímetros se efectúan bajo anestesia local o general, tomando lesiones primarias representativas evitando las zonas de cronicidad extrema o sobreinfectadas. El muestreo de lesiones en diferentes estadios evolutivos y la inclusión de una muestra de piel periférica sana optimizan la información diagnóstica. Las muestras fijadas en formol tamponado al 10% sufren un tratamiento histotécnico estándar con inclusión en parafina, corte y coloración hematoxilina-eosina. El análisis microscópico por un dermatopatólogo veterinario caracteriza la arquitectura lesional, el tipo y la distribución del infiltrado inflamatorio, y busca índices etiológicos. La dermatitis atópica presenta típicamente una dermatitis perivascular superficial con infiltrado linfohistiocitario y eosinofílico, una hiperplasia epidérmica (acantosis), una hiperqueratosis ortoqueratósica y una espongiosis variable según la acuidad lesional.
Módulo 8: Estrategias terapéuticas integradas y perspectivas
Objetivos de un manejo multimodal
El manejo terapéutico de la dermatitis atópica y de las complicaciones dermatológicas asociadas en el Bulldog Francés necesita un abordaje multimodal e individualizado combinando control de las infecciones secundarias, tratamiento anti-inflamatorio y anti-pruriginoso, restauración de la barrera cutánea, y gestión de los factores ambientales. El objetivo terapéutico realista visa no la curación definitiva de esta dermatosis crónica, sino el control satisfactorio de los síntomas permitiendo una calidad de vida aceptable para el animal y su propietario, con minimización de los efectos secundarios y del costo económico a largo plazo. La estrategia terapéutica evoluciona según la severidad inicial, la respuesta a los tratamientos y la presencia de comorbilidades, necesitando reevaluaciones regulares y ajustes posológicos o de moléculas.
Tratamiento de las infecciones secundarias y antibioterapia
El tratamiento de las infecciones secundarias constituye imperativamente la primera etapa terapéutica antes de evaluar la respuesta a los anti-inflamatorios. Las piodermas superficiales a Staphylococcus pseudintermedius sensible a la meticilina responden generalmente a una antibioterapia sistémica por cefalosporinas de primera generación (cefalexina 15 a 25 mg/kg per os dos veces por día) o por amoxicilina-ácido clavulánico (12,5 a 25 mg/kg per os dos veces por día) durante 21 a 28 días mínimo, sea una semana más allá de la resolución clínica completa. Las piodermas profundas o las cepas MRSP necesitan antibioterapias prolongadas de 6 a 8 semanas con moléculas de espectro ampliado: fluoroquinolonas (enrofloxacina 5 a 10 mg/kg una vez por día, marbofloxacina 2,75 a 5,5 mg/kg una vez por día) después de realización de un cultivo bacteriano con antibiograma. La resistencia creciente impone una utilización razonada de los antibióticos según las recomendaciones de antibioterapia prudente, privilegiando los tratamientos tópicos cuando sea posible.
Uso de los antisépticos tópicos y clorhexidina
Los antisépticos tópicos representan una alternativa o un complemento precioso a la antibioterapia sistémica, particularmente para las infecciones localizadas o recurrentes. La clorhexidina, biguanida catiónica de amplio espectro bactericida y fungicida, se utiliza en champú a concentración del 2 al 4% con un tiempo de contacto de 10 minutos antes del aclarado, a razón de dos a tres aplicaciones hebdomadarias. Su mecanismo de acción reposa sobre la desorganización membranal bacteriana por unión a los fosfolípidos aniónicos. Los estudios clínicos controlados demuestran una eficacia de la clorhexidina 3% comparable a los antibióticos sistémicos para las piodermas superficiales localizadas, con la ventaja de evitar la selección de resistencias sistémicas. Las formulaciones combinando clorhexidina y miconazol (antifúngico azólico) tratan simultáneamente las infecciones bacterianas y a Malassezia, frecuentemente intrincadas en el Bulldog Francés. Las toallitas impregnadas de clorhexidina facilitan la antisepsia diaria de los pliegues faciales, previniendo el intertrigo.
Inhibidores de Janus kinasas
Los inhibidores de Janus kinasas (JAK inhibitors) representan un avance terapéutico mayor en dermatología veterinaria desde la autorización de puesta en el mercado del oclacitinib en 2013 para el tratamiento sintomático del prurito atópico canino. El oclacitinib, pequeña molécula de síntesis administrada por vía oral, inhibe selectivamente las tirosinas kinasas JAK1 y JAK3 (y en menor medida JAK2), bloqueando así la transducción de la señal de múltiples citocinas pro-pruriginosas y pro-inflamatorias entre las cuales la IL-31, la IL-4, la IL-13 y la IL-2. Recientemente nuevos inhibidores de las janus kinasa han sido comercializados, a saber el ilunocitinib (Zenrelia) y el atinvicitinib (Numelvi), cada uno presentando diversas ventajas e inconvenientes.
Lokivetmab: anticuerpo monoclonal anti-IL-31
El lokivetmab, anticuerpo monoclonal canino caninizado dirigido específicamente contra la interleucina-31, constituye una alternativa bioterapéutica al oclacitinib. Este anticuerpo terapéutico, producido por tecnología recombinante, neutraliza la IL-31 circulante por unión de alta afinidad, impidiendo su interacción con el complejo receptor IL-31RA/OSMR. La administración se hace por vía subcutánea a la posología de 1 a 2 mg/kg, con una duración de acción prolongada de 4 a 8 semanas permitiendo inyecciones mensuales. Los estudios pivots de fase III revelan una reducción del prurito de más del 50% en el 79% de los perros tratados después de la primera inyección, con un plazo de acción mediano de 1,2 días. La ventaja mayor del lokivetmab reside en su especificidad inmunológica extrema, apuntando únicamente a la IL-31 sin interferir con otras vías de señalización, minimizando así los efectos secundarios sistémicos. Su naturaleza proteíca de inmunoglobulina canina limita el riesgo de inmunogenicidad con formación de anticuerpos anti-medicamento, contrariamente a las proteínas recombinantes no caninizadas.
Ciclosporina e inhibición de la calcineurina
La ciclosporina, inmunomodulador inhibidor de la calcineurina, representa históricamente el primer tratamiento sistémico validado para la dermatitis atópica canina con autorización de puesta en el mercado desde 2003. Esta molécula lipófila cíclica derivada del hongo Tolypocladium inflatum inhibe la activación de los linfocitos T por bloqueo de la fosfatasa calcineurina, impidiendo la desfosforilación del factor de transcripción NFAT (Nuclear Factor of Activated T-cells) y su translocación nuclear. La cascada transcripcional de las citocinas pro-inflamatorias IL-2, IL-4, IL-5, IL-13 y TNF-α se encuentra así bloqueada. La posología inicial de 5 mg/kg por vía oral una vez por día, administrada en ayunas para optimizar la absorción, se prosigue durante 4 a 6 semanas hasta obtención de una respuesta clínica satisfactoria, luego se reduce progresivamente a la dosis mínima eficaz, a menudo 2,5 a 5 mg/kg cada 2 a 3 días en mantenimiento. Los efectos secundarios gastrointestinales (vómitos, diarrea, anorexia) sobrevienen en el 20 a 30% de los perros, principalmente durante las primeras semanas, y se atenúan generalmente espontáneamente o por administración con una comida ligera a pesar de la reducción de absorción.
Lugar de los glucocorticoides en los brotes agudos
Los glucocorticoides sistémicos, anti-inflamatorios potentes de acción rápida, conservan un lugar en el tratamiento de urgencia de los brotes agudos severos a pesar de sus efectos secundarios a largo plazo. La prednisolona o prednisona se administra a dosis anti-inflamatoria de 0,5 a 1 mg/kg por vía oral una a dos veces por día hasta el control del prurito y de la inflamación (generalmente 7 a 14 días), seguida de una decrecencia progresiva sobre 2 a 3 semanas luego destete completo o transición hacia un tratamiento alternativo. La utilización crónica diaria de corticoides conlleva inevitablemente un síndrome de Cushing iatrogénico con poliuro-polidipsia, polifagia, amiotrofia, hepatomegalia e inmunosupresión favoreciendo las infecciones oportunistas. Un esquema alternado con administración un día sobre dos limita parcialmente la supresión del eje hipotálamo-hipófiso-suprarrenal. Los corticoides inyectables de acción prolongada (metilprednisolona acetato) son formalmente desaconsejados en dermatología debido a la imposibilidad de ajuste posológico y del riesgo acrecentado de efectos secundarios severos.
Papel de los emolientes y tópicos reestructurantes
Los tópicos emolientes y reestructurantes de la barrera juegan un papel terapéutico adyuvante esencial a menudo subestimado. Las formulaciones enriquecidas en ceramidas fisiológicas, colesterol y ácidos grasos esenciales en un ratio equimolar mimando la composición lipídica del stratum corneum restauran parcialmente la función barrera deficiente. Un estudio clínico prospectivo randomizado controlado evaluando un spray reestructurante conteniendo un complejo de ceramidas, ácidos grasos y fitoesfingosina en 60 perros atópicos demuestra una reducción significativa del score CADESI del 42% después de 8 semanas de aplicación biquotidiana, asociada a una disminución de la pérdida insensible en agua trans-epidérmica del 38%. Los champús terapéuticos a base de avena coloidal, de ácidos grasos omega-6 y de glicerina ejercen un efecto antipruriginoso e hidratante inmediato, con un beneficio óptimo durante utilización bisemanal con tiempo de contacto de 10 minutos. Las formulaciones sin jabón (syndets o synthetic detergents) al pH fisiológico ácido preservan la película lipídica cutánea contrariamente a los champús alcalinos convencionales.
Inmunoterapia específica alergénica (desensibilización)
La inmunoterapia alergénica específica (desensibilización o hiposensibilización) representa el único tratamiento potencialmente modificador de la enfermedad atópica, visando inducir una tolerancia inmunológica a los alérgenos identificados más que simplemente suprimir los síntomas. El protocolo clásico por vía subcutánea comienza por una fase de inducción con inyecciones semanales de extractos alergénicos a concentraciones crecientes sobre 16 a 20 semanas, seguida de una fase de mantenimiento con inyecciones mensuales proseguidas durante mínimo 12 meses, idealmente 2 a 3 años. Los mecanismos inmunológicos implicados incluyen la desviación de la respuesta Th2 hacia Th1, la inducción de linfocitos T reguladores produciendo la IL-10 y el TGF-β inmunosupresores, y el switch isotípico de la producción de IgE hacia IgG4 bloqueantes. Las tasas de éxito reportadas en la literatura veterinaria varían considerablemente según los estudios, con una mejoría excelente a buena en el 60 a 75% de los perros, una mejoría moderada en el 15 a 20%, y un fracaso en el 10 a 15%. La respuesta óptima necesita a menudo 9 a 12 meses de tratamiento antes de evaluación definitiva. Los protocolos intradérmicos regionales y las formulaciones sublinguales emergen como alternativas potencialmente más seguras y mejor toleradas.
Impacto de los ácidos grasos poliinsaturados (Omega-3 y 6)
Los ácidos grasos poliinsaturados omega-3 y omega-6 de cadenas largas ejercen efectos anti-inflamatorios y reestructurantes de la barrera por varios mecanismos. El ácido eicosapentaenoico (EPA, C20:5 ω-3) y el ácido docosahexaenoico (DHA, C22:6 ω-3) contenidos en los aceites de pescados se incorporan en los fosfolípidos membranales de las células inflamatorias, sustituyéndose parcialmente al ácido araquidónico (C20:4 ω-6). Durante la activación celular, la fosfolipasa A2 libera estos ácidos grasos que son metabolizados por las ciclooxigenasas y lipoxigenasas en mediadores de serie 3 y 5 (prostaglandinas PGE3, leucotrienos LTB5) menos pro-inflamatorios que sus homólogos de serie 2 y 4 derivados del ácido araquidónico. La suplementación a dosis elevada (75 a 150 mg/kg de EPA+DHA por día) durante mínimo 8 a 12 semanas ejerce un efecto moderado sobre el prurito atópico, con una reducción media del 20 a 30% en los estudios controlados, justificando su utilización como adyuvante terapéutico pero no en monoterapia.
Perspectivas terapéuticas futuras y terapia génica
Las perspectivas terapéuticas futuras en dermatología atópica canina se orientan hacia dianas moleculares cada vez más específicas. El dupilumab, anticuerpo monoclonal humano apuntando a la subunidad alfa del receptor de la IL-4 y bloqueando así la señalización de la IL-4 e IL-13, revoluciona actualmente el tratamiento de la dermatitis atópica humana severa con tasas de respuesta superiores al 70%. El desarrollo de un equivalente canino caninizado representa una pista prometedora. Los inhibidores tópicos de JAK (ruxolitinib, tofacitinib en formulaciones dérmicas) permitirían un bloqueo dirigido de la señalización pro-inflamatoria cutánea sin inmunosupresión sistémica. Los probióticos y prebióticos visando modular el microbioma cutáneo e intestinal hacen objeto de investigaciones intensivas, ciertas cepas de Lactobacillus demostrando in vitro propiedades inmunomoduladoras con inducción de linfocitos T reguladores. La terapia génica por transferencia del gen FLG funcional en los queratinocitos permanece del dominio experimental pero podría teóricamente corregir el déficit primario de filagrina. Las vacunas terapéuticas a base de péptidos inmunomoduladores derivan del alérgeno pero desprovistas de epítopos IgE-reactivos podrían inducir una tolerancia sin riesgo anafiláctico.
Conclusión
El Bulldog Francés presenta una vulnerabilidad dermatológica excepcional resultante de una convergencia única de factores anatómicos, genéticos e inmunológicos. La conformación braquicefálica extrema engendra plegaduras cutáneas patológicas predisponiendo al intertrigo y a las sobreinfecciones microbianas. Las anomalías genéticas documentadas afectando el gen PROM1 y la expresión de las proteínas de la barrera epidérmica comprometen la cohesión del stratum corneum y aumentan la permeabilidad transcutánea a los alérgenos. La disfunción primaria de la barrera se caracteriza por una deficiencia en filagrina, una depleción cerámida y una alteración de las uniones estrechas, creando el sustrato fisiopatológico de la dermatitis atópica cuya prevalencia alcanza el 15 al 20% en esta población racial.
La patogénesis inmunológica compleja implica una polarización Th2 excesiva con hiperproducción de IL-4, IL-13, IL-5 e IL-31, conduciendo a una síntesis masiva de IgE específicas y a un reclutamiento eosinofílico tisular. La disbiosis cutánea con expansión de Staphylococcus pseudintermedius y Malassezia pachydermatis amplifica la inflamación por producción de exotoxinas superantigénicas y de enzimas proteolíticas. Las complicaciones infecciosas secundarias, notablemente las piodermas recurrentes y las dermatitis a Malassezia, constituyen la regla más que la excepción, necesitando un manejo antimicrobiano riguroso previo a toda evaluación de la respuesta anti-inflamatoria.
El abordaje diagnóstico reposa sobre una metodología clínica estructurada integrando anamnesis detallada, examen dermatológico sistemático y exámenes complementarios dirigidos, particularmente la citología cutánea practicable en primera intención. La identificación de las infecciones secundarias y su tratamiento apropiado constituyen imperativamente la primera etapa terapéutica. La estrategia de control a largo plazo combina tratamiento sintomático del prurito por inhibidores de JAK o anticuerpos anti-IL-31, restauración de la barrera epidérmica por tópicos reestructurantes, y gestión de los factores ambientales desencadenantes.
Las perspectivas de investigación futuras deberán profundizar la caracterización del determinismo genético racial por estudios de asociación pangenómica, identificar las variantes específicas de los genes de la barrera epidérmica predisponiendo a la atopia en el Bulldog Francés, y desarrollar terapias dirigidas correctoras de estos déficits moleculares primarios. La exploración del microbioma cutáneo por secuenciación metagenómica y la identificación de firmas disbióticas predictivas de la evolución clínica podrían permitir intervenciones precoces por probióticos o trasplantación microbiana. El desarrollo de bioterapias caninas apuntando a las citocinas Th2 claves, notablemente anticuerpos monoclonales anti-IL-4Rα o anti-IL-13, abre perspectivas terapéuticas revolucionarias. Finalmente, las estrategias preventivas precoces visando restaurar la barrera epidérmica desde los primeros meses de vida en los cachorros de riesgo merecen una investigación profundizada para determinar si una intervención neonatal podría prevenir o retrasar la instalación de la dermatitis atópica clínicamente manifiesta.
Referencias
Outerbridge CA, Jordan TJM. Current Knowledge on Canine Atopic Dermatitis: Pathogenesis and Treatment. Advances in Small Animal Care. 2021;2(1):101-117. PMC9204668.
Bajwa J. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. Canadian Veterinary Journal. 2015;56(8):758-765. PMC4531508.
Zur G, Ihrke PJ, White SD, Kass PH. Canine atopic dermatitis: a retrospective study of 266 cases examined at the University of California, Davis, 1992-1998. Part I. Clinical features and allergy testing results. Veterinary Dermatology. 2002;13(2):89-102.
Marsella R, Olivry T, Nicklin C, Lopez J. Pilot investigation of a model for canine atopic dermatitis: environmental house dust mite challenge of high-IgE-producing beagles, mite hypersensitive dogs with atopic dermatitis and normal dogs. Veterinary Dermatology. 2006;17(1):24-35.
Olivry T, DeBoer DJ, Favrot C, et al. Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Diseases of Animals (ICADA). BMC Veterinary Research. 2015;11:210. PMC4531508.
Chermprapai S, Broere F, Gooris G, Schlotter YM, Rutten VPMG, Bouwstra JA. Altered lipid properties of the stratum corneum in Canine Atopic Dermatitis. Biochim Biophys Acta Biomembr. 2018;1860(2):526-533.
Pucheu-Haston CM, Bizikova P, Eisenschenk MN, Santoro D, Nuttall T, Marsella R. Review: The role of antibodies, autoantigens and food allergens in canine atopic dermatitis. Veterinary Dermatology. 2015;26(2):115-e30.
Santoro D, Marsella R, Pucheu-Haston CM, et al. Review: Pathogenesis of canine atopic dermatitis: skin barrier and host-micro-organism interaction. Veterinary Dermatology. 2015;26(2):84-e25.
Banovic F, Linder KE, Olivry T. Clinical, microscopic and microbial characterization of exfoliative superficial pyoderma-associated epidermal collarettes in dogs. Veterinary Dermatology. 2017;28(1):107-e23.
Hensel P, Santoro D, Favrot C, Hill P, Griffin C. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. BMC Veterinary Research. 2015;11:196. PMC4531508.
Cosgrove SB, Wren JA, Cleaver DM, et al. A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis. Veterinary Dermatology. 2013;24(6):587-597.
Gonzales AJ, Humphrey WR, Messamore JE, et al. Interleukin-31: its role in canine pruritus and naturally occurring canine atopic dermatitis. Veterinary Dermatology. 2013;24(1):48-e12.
Michels GM, Ramsey DS, Walsh KF, et al. A blinded, controlled study to investigate the efficacy and safety of a canine anti-IL-31 monoclonal antibody in client-owned dogs with atopic dermatitis. Veterinary Dermatology. 2016;27(6):505-e136.
Olivry T, Bizikova P. A systematic review of randomized controlled trials for prevention or treatment of atopic dermatitis in dogs: 2008-2011 update. Veterinary Dermatology. 2013;24(1):97-e26.
Marsella R, Girolomoni G. Canine models of atopic dermatitis: a useful tool with untapped potential. Journal of Investigative Dermatology. 2009;129(10):2351-2357.
Banovic F, Olivry T, Bazzle L, Tobias JR, Atlee B, Linder KE. Deep pyoderma caused by Pseudomonas aeruginosa in dogs: 20 cases. Veterinary Dermatology. 2016;27(6):494-e131.
Little PR, King VL, Davis KR, et al. A blinded, controlled multicenter study to assess the effectiveness and rate of flea kill of orally administered afoxolaner compared with topically applied fipronil/(S)-methoprene in dogs with flea allergy dermatitis. Veterinary Parasitology. 2015;207(3-4):306-312.
Loeffler A, Cobb MA, Bond R. Comparison of a chlorhexidine and a benzoyl peroxide shampoo as sole treatment in canine superficial pyoderma. Veterinary Record. 2011;169(10):249.
Mueller RS, Bergvall K, Bensignor E, Bond R. A review of topical therapy for skin infections with bacteria and yeast. Veterinary Dermatology. 2012;23(4):330-e62.
Noli C, Borio S, Varina A, Schievano C. Development and validation of a questionnaire to evaluate the Quality of Life of cats with skin disease and their owners, and its use in 185 cats with skin disease. Veterinary Dermatology. 2016;27(4):247-e58.
Nuttall TJ, Marsella R, Rosenbaum MR, Gonzales AJ, Fadok VA. Update on pathogenesis, diagnosis, and treatment of atopic dermatitis in dogs. Journal of the American Veterinary Medical Association. 2019;254(11):1291-1300.
Olivry T, Mueller RS, International Task Force on Canine Atopic Dermatitis. Evidence-based veterinary dermatology: a systematic review of the pharmacotherapy of canine atopic dermatitis. Veterinary Dermatology. 2003;14(3):121-146.
Piekutowska A, Pin D, Reme CA, Gatto H, Haftek M. Effects of a topically applied preparation of epidermal lipids on the stratum corneum barrier of atopic dogs. Journal of Comparative Pathology. 2008;138(4):197-203.
Reedy LM, Miller WH, Willemse T. Allergic Skin Diseases of Dogs and Cats. 2nd ed. London: WB Saunders; 1997.
Saridomichelakis MN, Koutinas AF, Farmaki R, Leontides LS, Kasabalis D. Relative sensitivity of hair pluckings and exudate microscopy for the diagnosis of canine demodicosis. Veterinary Dermatology. 2007;18(2):138-141.
Shimada K, Yoon JS, Yoshihara T, Iwasaki T, Nishifuji K. Increased transepidermal water loss and decreased ceramide content in lesional and non-lesional skin of dogs with atopic dermatitis. Veterinary Dermatology. 2009;20(5-6):541-546.
Shumaker AK, Angus JC, Coyner KS, Loeffler DG, Van Den Broek AHM, Sánchez A. Microbiological and histopathological features of canine pyotraumatic dermatitis (“hot spots”). Veterinary Dermatology. 2008;19(3):131-139.
Steffan J, Alexander D, Brovedani F, Fisch RD. Comparison of cyclosporine A with methylprednisolone for treatment of canine atopic dermatitis: a parallel, blinded, randomized controlled trial. Veterinary Dermatology. 2003;14(1):11-22.
Steffan J, Favrot C, Mueller R. A systematic review and meta-analysis of the efficacy and safety of cyclosporin for the treatment of atopic dermatitis in dogs. Veterinary Dermatology. 2006;17(1):3-16.
Thyssen JP, Godoy-Gijon E, Elias PM. Ichthyosis vulgaris: the filaggrin mutation disease. British Journal of Dermatology. 2013;168(6):1155-1166.
Wilhem S, Kovalik M, Favrot C. Breed-associated phenotypes in canine atopic dermatitis. Veterinary Dermatology. 2011;22(2):143-149.
Bizikova P, Papiernik D, Mendoza ME, Haile B, Olivry T. Studies Using Antibodies against Filaggrin and Filaggrin 2 in Canine Normal and Atopic Skin Biopsies. Veterinary Sciences. 2024;11(2):53. PMC10854974.
Zur G, White SD, Ihrke PJ, Kass PH, Toebe N. Canine atopic dermatitis: a retrospective study of 169 cases examined at the University of California, Davis, 1992-1998. Part II. Response to hyposensitization. Veterinary Dermatology. 2002;13(2):103-111.
Marsella R, Samuelson D, Doerr K. Transmission electron microscopy studies in an experimental model of canine atopic dermatitis. Veterinary Dermatology. 2010;21(1):81-88.
Marsella R, Olivry T, Carlotti DN. Current evidence of skin barrier dysfunction in human and canine atopic dermatitis. Veterinary Dermatology. 2011;22(3):239-248.
Nuttall T, Knight PA, McAleese SM, Lamb JR, Hill PB. Expression of Th1, Th2 and immunosuppressive cytokine gene transcripts in canine atopic dermatitis. Clinical & Experimental Allergy. 2002;32(5):789-795.
Bruet V, Bourdeau PJ, Roussel A, Imparato L, Desfontis JC. Characterization of pruritus in canine atopic dermatitis, flea bite hypersensitivity and flea infestation and its role in diagnosis. Veterinary Dermatology. 2012;23(6):487-e93.
Olivry T, Dunston SM, Murphy KM, Moore PF. Characterization of the inflammatory infiltrate during IgE-mediated late phase reactions in the skin of normal and atopic dogs. Veterinary Dermatology. 2001;12(1):49-58.
Sousa CA, Marsella R. The ACVD task force on canine atopic dermatitis (II): genetic factors. Veterinary Immunology and Immunopathology. 2001;81(3-4):153-157.
DeBoer DJ, Marsella R. The ACVD task force on canine atopic dermatitis (XII): the relationship of cutaneous infections to the pathogenesis and clinical course of canine atopic dermatitis. Veterinary Immunology and Immunopathology. 2001;81(3-4):239-249.
Older CE, Diesel A, Patterson AP, Meason-Smith C, Johnson TJ, Rodrigues Hoffmann A. The feline skin microbiota: The bacteria inhabiting the skin of healthy and allergic cats. PLoS One. 2017;12(6):e0178555.
Bradley CW, Morris DO, Rankin SC, et al. Longitudinal evaluation of the skin microbiome and association with microenvironment and treatment in canine atopic dermatitis. Journal of Investigative Dermatology. 2016;136(6):1182-1190.
Rodrigues Hoffmann A, Patterson AP, Diesel A, et al. The skin microbiome in healthy and allergic dogs. PLoS One. 2014;9(1):e83197.
Yeon SC, Erb HN, Houpt KA. A retrospective study of canine house soiling: diagnosis and treatment. Applied Animal Behaviour Science. 1999;66(1-2):81-95.
Nuttal T, Mueller R. Advances in atopic dermatitis. Companion Animal. 2018;23(2):70-77.
Torres SMF, Gomez N, Dent P. Mast cell quantification in skin biopsies from dogs with allergic skin disease: a retrospective study. Veterinary Dermatology. 2012;23(Suppl 1):3-8.
Keppel KE, Campbell KL, Zuckermann FA, Greeley EA, Schaeffer DJ, Husmann RJ. Quantitation of canine regulatory T cell populations, serum interleukin-10 and allergen-specific IgE concentrations in healthy control dogs and canine atopic dermatitis patients receiving allergen-specific immunotherapy. Veterinary Immunology and Immunopathology. 2008;123(3-4):337-344.
Masuda K, Sakaguchi M, Fujiwara S, et al. Positive reactions to common allergens in 42 atopic dogs in Japan. Veterinary Immunology and Immunopathology. 2000;73(2):193-204.
Hill PB, Hillier A, Olivry T. The ACVD task force on canine atopic dermatitis (VI): IgE-induced immediate and late-phase reactions, two inflammatory sequences at sites of intradermal allergen injections. Veterinary Immunology and Immunopathology. 2001;81(3-4):199-204.
Bizikova P, Santoro D, Marsella R, Nuttall T, Eisenschenk MN, Pucheu-Haston CM. Review: Clinical and histological manifestations of canine atopic dermatitis. Veterinary Dermatology. 2015;26(2):79-e24.