Die canine Dermatomyositis (DM) ist eine entzündliche, ischämische Vaskulopathie immunologischen Ursprungs mit starker genetischer Prädisposition, die hauptsächlich die Haut und in geringerem Maße die gestreifte Muskulatur betrifft. Wir bieten Ihnen einen umfassenden Überblick über die Pathogenese, Diagnose und Therapie dieser Dermatose.
Juni 2025
Einleitung
Ursprünglich beim Collie und Shetland Sheepdog erkannt, dient diese Erkrankung als besonders relevantes Spontanmodell zur Untersuchung der humanen juvenilen Dermatomyositis (JDM), einer systemischen Autoimmunerkrankung mit auffallenden klinischen und histopathologischen Ähnlichkeiten. Die canine DM ist somit nicht nur für Tierärzte von klinischer Bedeutung, sondern auch ein wertvolles Feld für die translationale Forschung.
In den letzten zehn Jahren hat das Verständnis der caninen DM eine radikale Transformation erfahren. Das Konzept einer einfachen Erbkrankheit mit autosomal-dominantem Erbgang, variabler Penetranz und inkonstanter Expressivität wurde durch ein viel nuancierteres Modell einer komplexen genetischen Störung abgelöst. Fortschritte in der Genomik haben die Identifizierung spezifischer Risikoloci und ihrer epistatischen Interaktionen ermöglicht, was einen prädiktiven Rahmen für die Krankheit bietet. Gleichzeitig hat die Grundlagenforschung die zentrale Rolle einer Dysregulation des Typ-I-Interferon (IFN)-Signalwegs als wichtigen pathogenen Motor beleuchtet, ähnlich wie bei der humanen JDM. Diese Konvergenz von genetischem und immunopathologischem Wissen hat den Weg für gezieltere Diagnose- und Therapieansätze geebnet, die das Management dieser Krankheit im Jahr 2025 neu definieren. Wir präsentieren Ihnen den aktuellen Wissensstand zur caninen Dermatomyositis, unter Einbeziehung der neuesten Entdeckungen zu ihrer Pathogenese, Diagnose und emerging therapeutischen Strategien.
Ätiopathogenese
Die Ätiopathogenese der caninen Dermatomyositis ist das Ergebnis einer komplexen Interaktion zwischen einer polygenen genetischen Prädisposition, einer Dysregulation des angeborenen Immunsystems und Umweltfaktoren. Das Verständnis dieser Ereigniskaskade, vom Gen zur Läsion, ist grundlegend für das Verständnis der Krankheit und die Begründung moderner Therapieansätze.
1.1 Die genetische Komponente der caninen Dermatomyositis
Das historische Konzept einer autosomal-dominanten Vererbung mit unvollständiger Penetranz wurde durch genomweite Assoziationsstudien (GWAS) verfeinert, die ein komplexes und epistatisches Erbmuster aufdeckten. Das Risiko, bei prädisponierten Rassen wie dem Collie und dem Shetland Sheepdog eine DM zu entwickeln, wird nun als das Ergebnis der Interaktion von Varianten innerhalb von drei unabhängigen genetischen Loci verstanden.
Identifizierung der Risikoloci
Die Forschung hat drei wichtige Chromosomenregionen identifiziert, deren spezifische Allele das DM-Risiko modulieren.
- Locus A (Chromosom 10): Eine sehr starke Assoziation wurde mit einer Missense-Mutation im PAN2-Gen gefunden. Das PAN2-Gen kodiert für eine Untereinheit des Poly(A)-Nuklease-Deadenylierungskomplexes, der eine entscheidende Rolle bei der Regulation des Abbaus von Boten-RNA (mRNA) spielt. Diese Funktion ist besonders wichtig für die Regulation der Entzündungsantwort, insbesondere durch die Stabilisierung von Transkripten proinflammatorischer Gene, die Adenin-Uracil-reiche Elemente (ARE) enthalten, wie das von Interleukin 6 (IL-6), einem Zytokin, das bekanntermaßen bei humaner JDM überexprimiert ist. Diese Mutation stellt somit eine direkte Verbindung zwischen einem grundlegenden genetischen Defekt und einer Prädisposition für eine Immunregulationsstörung her.
- Locus B (Chromosom 31): Eine zweite signifikante Assoziation wurde mit einer Insertion/Deletion (Indel) in einer nicht-kodierenden 5′-Region des MAP3K7CL-Gens identifiziert. Obwohl die genaue Funktion dieses Gens, das für eine Kinase kodiert, noch wenig erforscht ist, wird es hauptsächlich in peripheren Blutzellen exprimiert, was auf eine Rolle bei der Immunfunktion hindeutet.
- Locus C (Canines MHC): Eine signifikante Assoziation wurde mit einem spezifischen Haplotypen des caninen Haupthistokompatibilitätskomplexes (MHC) Klasse II beobachtet. Die Assoziation ist besonders stark bei Individuen, die homozygot für diesen Haplotyp sind. Die hohe Frequenz dieses Risiko-Haplotyps bei gesunden Hunden weist jedoch darauf hin, dass er allein nicht ausreicht, um die Krankheit zu verursachen, und dass sein Einfluss durch die anderen Risikoloci moduliert wird.
Epistatische Interaktion und Risikostratifizierung
Die kombinierte Analyse der Genotypen dieser drei Loci hat ein nicht nur additives, sondern epistatisches Risikomodell offenbart, bei dem die Wirkung eines Gens durch das Vorhandensein eines oder mehrerer anderer Gene modifiziert wird. Untersuchungen haben gezeigt, dass 9 der 27 möglichen Genotyp-Kombinationen ein moderates (Penetranz von 33-50 %) oder hohes (Penetranz von 90-100 %) Risiko für die Entwicklung von DM bergen und somit 93 % der untersuchten Fälle erklären. Zum Beispiel zeigen die Genotypen AABB (homozygot für die Risiko-Allele an den Loci A und B) eine Penetranz von 100 %, wenn sie mit mindestens einem Risiko-Allel am Locus C assoziiert sind (AABBCc oder AABBCC).
Diese Entdeckung verändert das Verständnis der Krankheit. Die alten Konzepte der “unvollständigen Penetranz” und “variablen Expressivität” können nun im Lichte dieses quantitativen genetischen Modells neu interpretiert werden. Diese phänotypischen Variationen sind nicht zufällig, sondern spiegeln direkt das polygene Risikoprofil jedes Individuums wider. Ein Hund mit einem Hochrisiko-Genotyp wird die Krankheit mit ziemlicher Sicherheit entwickeln, wenn er den entsprechenden Auslösern ausgesetzt ist, während ein Hund mit einem moderaten Risiko-Genotyp die Krankheit möglicherweise nie oder nur mit leichten und vorübergehenden Anzeichen äußert. Die Genetik bietet somit einen prädiktiven Rahmen, der die Unsicherheit ersetzt. Dies hat tiefgreifende Auswirkungen auf die genetische Beratung, die von einer einfachen Empfehlung, klinisch betroffene Hunde nicht zu züchten, zu einer proaktiven Selektionsstrategie für Zuchtpaare übergeht, die darauf abzielt, die Produktion von Welpen mit Hochrisiko-Genotyp-Kombinationen zu minimieren.
Genotyp-Phänotyp-Korrelation
Es wurde eine signifikante inverse Korrelation zwischen der Anzahl der Risiko-Allele an den Loci PAN2 und MAP3K7CL und dem Alter des Krankheitsbeginns festgestellt. Hunde, die vier Risiko-Allele tragen (homozygot für das Risiko an beiden Loci), entwickeln DM im Medianalter von 5 Monaten, während solche mit nur zwei Risiko-Allelen sie im Medianalter von 18,5 Monaten entwickeln. Diese Korrelation deutet auf einen Gendosis-Effekt auf die Schwere der Prädisposition hin, wobei eine höhere genetische Belastung einen niedrigeren Umweltauslöseschwellenwert für die Initiierung der Krankheit erfordert.
Tabelle 1: Genetische Risikoloci für canine Dermatomyositis
|
Name des Locus |
Assoziiertes Gen |
Chromosom |
Normales Allel (Notation) |
Bekannte/Hypothetische Biologische Funktion |
|---|---|---|---|---|
|
Locus A |
PAN2 |
10 |
Wildtyp (a) |
Regulation des mRNA-Abbaus, Stabilisierung von Entzündungsantworttranskripten |
|
Locus B |
MAP3K7CL |
31 |
Wildtyp (b) |
Kinase, die in immunologischen Geweben exprimiert wird, potenzielle Rolle in der Immun-Signalgebung |
|
Locus C |
DLA-DRB1 |
12 (MHC) |
Andere DLA-Haplotypen (c) |
Antigenpräsentation, Regulation der adaptiven Immunantwort |
Tabelle 2: Risikostratifizierung von DM basierend auf dem Genotyp (Kombinationen der Loci A und B, modifiziert durch Locus C)
|
Genotyp Locus A / Locus B |
Risiko mit Locus C = cc |
Risiko mit Locus C = Cc |
Risiko mit Locus C = CC |
|---|---|---|---|
|
aa bb |
Niedrig |
Niedrig |
Niedrig |
|
Aa bb |
Niedrig |
Niedrig |
Niedrig |
|
aa Bb |
Niedrig |
Niedrig |
Niedrig |
|
AA bb |
Unbekannt |
Moderat |
Moderat |
|
Aa Bb |
Niedrig |
Niedrig |
Niedrig |
|
aa BB |
Niedrig |
Moderat |
Moderat |
|
AA Bb |
Unbekannt |
Moderat |
Hoch |
|
Aa BB |
Unbekannt |
Moderat |
Hoch |
|
AA BB |
Unbekannt |
Hoch |
Hoch |
|
Tabelle angepasst nach Daten des UC Davis Veterinary Genetics Laboratory, basierend auf den Forschungen von Evans et al. |
|||
1.2 Die Kaskade der Immunedysregulation: Vaskulopathie und Interferon
Die genetische Prädisposition ist nur der erste Schritt. Die Pathogenese der DM ist im Grunde eine Krankheit des Immunsystems, die die Blutgefäße angreift, was zu Gewebeischämie führt.
Ischämische Vaskulopathie als Primärläsion
DM ist vor allem eine entzündliche Vaskulopathie. Der zentrale pathologische Prozess ist ein immunvermittelter Angriff auf das Endothel kleiner Blutgefäße, insbesondere der Endomysialkapillaren in den Muskeln und der Hautgefäße. Diese Endothelentzündung, oder Endotheliitis, führt zu einer Verengung des Gefäßlumens, Mikrothrombose und schließlich einer Hypoperfusion der nachgeschalteten Gewebe. Die daraus resultierende Ischämie ist verantwortlich für die charakteristischen klinischen Manifestationen: Atrophie und Nekrose von Haarfollikeln und Epidermis (verursacht Alopezie und Ulzerationen) und Degeneration von Muskelfasern (verursacht Atrophie und Schwäche).
Typ-I-Interferon (IFN) als zentraler pathogenes Treiber
Überwältigende Beweise aus humanen und kaninen Modellen deuten darauf hin, dass eine Hyperaktivierung des Typ-I-Interferon-Signalwegs der Haupttreiber dieser Vaskulopathie ist. Diese „IFN-Signatur“ äußert sich durch eine systemische und Gewebe-Überexpression (Haut, Muskel, Blut) einer Reihe von Genen, deren Transkription durch IFN induziert wird, wie MXA, ISG15 und CXCL10. Die Stärke dieser Signatur in der Haut korreliert direkt mit der Aktivität der Hauterkrankung und nimmt bei Patienten in Remission ab oder verschwindet ganz, was sie zu einem potenziellen Biomarker für die Krankheitsaktivität macht. Typ-I-Interferone haben pleiotrope Effekte, die die Vaskulopathie erklären können: Sie können Endothelzellen aktivieren, einen proinflammatorischen und prothrombotischen Zustand fördern und Immunzellen zum Entzündungsort rekrutieren, wodurch die Gefäßschäden aufrechterhalten werden.
Rolle von Autoantikörpern und zirkulierenden Immunkomplexen (ZIK)
Obwohl die Suche nach Myositis-spezifischen Autoantikörpern beim Hund weniger fortgeschritten ist als beim Menschen, haben ältere Studien eine positive Korrelation zwischen der klinischen Schwere der kaninen DM und den Serumspiegeln von zirkulierenden Immunkomplexen (ZIK) und Immunglobulin G (IgG) festgestellt. Es wird postuliert, dass diese ZIK sich in der Wand von Mikrogefäßen ablagern, dort die Komplementkaskade aktivieren und so zur Endotheliitis und Vaskulopathie beitragen können.
Die Konvergenz dieser Daten ermöglicht die Festlegung einer einheitlichen Kausalkette, die vor einem Jahrzehnt noch nicht offensichtlich war. Erstens schafft eine genetische Prädisposition, insbesondere über Mutationen in entzündungsregulierenden Genen wie PAN2, einen fruchtbaren Boden für eine aberrante Immunantwort. Zweitens führt diese Prädisposition bei Vorhandensein von Auslösern zu einer übermäßigen und anhaltenden Produktion von Typ-I-IFN, dem zentralen Mechanismus der Krankheit. Drittens induziert diese IFN-reiche Umgebung eine Vaskulopathie, indem sie Endothelzellen direkt schädigt. Viertens beeinträchtigt die Vaskulopathie die Blutversorgung und verursacht Ischämie in anfälligen Geweben. Schließlich manifestiert sich diese Ischämie klinisch in den charakteristischen Haut- und Muskelläsionen der DM. Dieses einheitliche Verständnis der Pathogenese rechtfertigt den Paradigmenwechsel in der aktuellen Therapie voll und ganz, der sich von allgemeinen Immunsuppressiva abwendet und sich Therapien zuwendet, die den IFN-Signalweg gezielt blockieren.
1.3 Umweltbedingte und endogene Auslöser
Bei einem genetisch prädisponierten Individuum sind oft auslösende Faktoren notwendig, um die Krankheit zu initiieren oder zu verschlimmern.
- Dokumentierte Risikofaktoren: Mehrere Faktoren spielen bekanntermaßen eine Rolle bei der Auslösung klinischer Schübe.
-
- Mechanische Traumata: Die typische Lokalisation der Läsionen an Knochenvorsprüngen (Gesicht, Karpus, Tarsus) und Druckpunkten legt stark nahe, dass wiederholte Mikrotraumata als lokaler Auslöser wirken, ein Koebner-Phänomen.
- Exposition gegenüber UV-Strahlen: Die Photoverteilung bestimmter Gesichtsläsionen und die berichtete Verschlechterung nach Sonneneinstrahlung implizieren UV-Strahlung als wichtigen auslösenden Faktor, wahrscheinlich durch Induktion der Keratinozyten-Apoptose und Freisetzung von Autoantigenen.
- Hormonelle Faktoren: Krankheitsausbrüche wurden mit dem Östrus in Verbindung gebracht, was auf einen hormonellen Einfluss auf die Immunregulation hindeutet.
- Die Rolle der Impfung: Der Zusammenhang zwischen Impfung und DM ist ein wichtiges Diskussionsthema. Es gibt ein bekanntes Syndrom der post-impflischen ischämischen Dermatopathie, insbesondere nach der Tollwutimpfung, das klinisch und histologisch nicht von DM zu unterscheiden ist. Eine retrospektive Studie an 177 Fällen von ischämischer Dermatopathie schätzte, dass eine Assoziation mit einer kürzlich erfolgten Impfung in 48,3 % der Fälle wahrscheinlich war. Anstatt die post-impflische Dermatopathie als eine völlig eigenständige Entität zu betrachten, ist es sinnvoller, sie als genetische DM zu sehen, die durch den starken Immunstimulus der Impfung demaskiert wird. Für einen Welpen aus Risikorassen mit unbekanntem oder hohem genetischem Status (z. B. AABB) könnte die intensive Immunstimulation durch einen Impfstoff der ausreichende “Stresstest” sein, um die pathogene IFN-Kaskade zu initiieren und die klinische Krankheit auszulösen. Dies hat wichtige klinische Implikationen: Bei Welpen von Risikorassen mit unbekanntem oder hohem genetischem Status geht es nicht darum, die Impfung zu vermeiden, sondern die Besitzer zu informieren und eine engmaschige Überwachung einzurichten, um das Auftreten von Hautläsionen in den Wochen und Monaten nach den Injektionen zu erkennen, um ein frühzeitiges Eingreifen zu ermöglichen.
Klinisches Spektrum und Diagnoseansatz
Das klinische Bild der caninen DM ist variabel und reicht von leichten, selbstlimitierenden Hautformen bis zu schweren systemischen Manifestationen. Die Diagnose stützt sich auf einen multimodalen Ansatz, der Krankengeschichte, klinische Anzeichen und gezielte Zusatzuntersuchungen kombiniert.
2.1 Rassedisposition und Klassifikation der Krankheit
- Familiäre DM: Der Collie und der Shetland Sheepdog sind die emblematischen Rassen der Krankheit, bei denen eine erbliche Grundlage nachgewiesen und die genetischen Risikoloci identifiziert wurden.
- DM-ähnliche Syndrome (Dermatomyositis-like): Ähnliche klinische und histologische Bilder wurden bei einer wachsenden Anzahl anderer Rassen beschrieben, insbesondere beim Beauceron, Welsh Corgi, Lakeland Terrier, Chow Chow, Deutschen Schäferhund und Kuvasz.
Die historische Unterscheidung zwischen “familiärer DM” (bei prädisponierten Rassen) und “DM-like” (bei anderen Rassen) wird zunehmend als semantisch statt biologisch betrachtet. Die zugrunde liegende Histopathologie ist identisch, was auf gemeinsame pathogene Wege hindeutet. Der Begriff “ischämische Dermatopathie” ist eine präzisere und vereinheitlichende histopathologische Diagnose, die diese verschiedenen klinischen Erscheinungsbilder umfasst. Der moderne diagnostische Ansatz sollte daher nicht bei der Rasse aufhören, sondern vielmehr genetische und pathologische Marker der Krankheit bei jedem Hund mit einem kompatiblen klinischen Bild suchen, unabhängig von seiner Rasse.
2.2 Klinische Manifestationen
Die klinischen Anzeichen der DM variieren stark von Individuum zu Individuum, folgen aber in der Regel einem erkennbaren Muster.
Hautanzeichen
Dermale Beteiligung ist die konstanteste Manifestation der Krankheit.
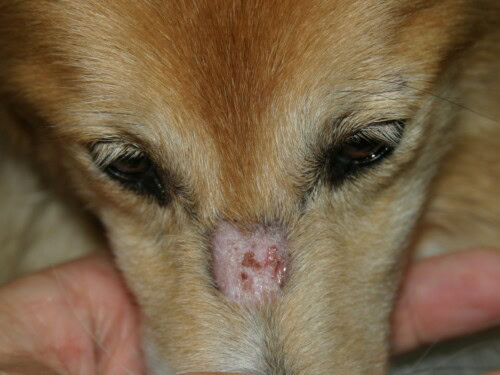
- Anfangsläsionen: Sie treten typischerweise bei jungen Hunden vor dem 6. Lebensmonat auf, oft schon im Alter von 7 bis 11 Wochen. Die anfängliche Erscheinung kann subtil sein, mit vorübergehenden Papeln, Pusteln oder Bläschen, die sich schnell zu charakteristischeren Läsionen von Erythem, Alopezie, Schuppen und Krusten entwickeln.
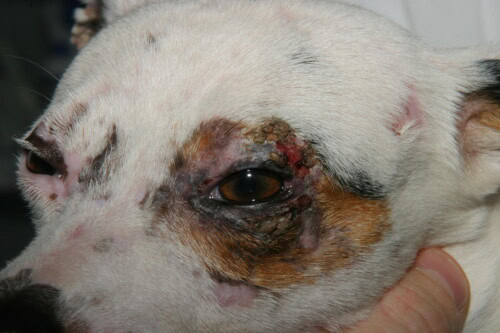
- Charakteristische Verteilung: Die Läsionen bevorzugen Bereiche mit Trauma und geringer Kollateralzirkulation: Gesicht (periorbitale und peribukkalen Regionen, Nasenrücken), Ohrmuscheln (insbesondere die Spitze und Falten), die Schwanzspitze und die Haut über Knochenvorsprüngen der Gliedmaßen (Karpus, Tarsus, Zehen).
- Chronische Läsionen: Mit der Zeit entwickeln sich die Läsionen zu einer permanenten vernarbenden Alopezie, Hautatrophie und Pigmentveränderungen (Hyper- oder Hypopigmentierung), wodurch ein fleckiges Aussehen, Poikilodermie genannt, entsteht. Eine Beteiligung der Krallen (Onychodystrophie, Onychorexis, Onychoschizia) kann ebenfalls beobachtet werden.
Schwere Schwanzbeteiligung mit Alopezie und krustigen Läsionen
Überwiegend einseitiger Lidbefall bei diesem Hund
Läsion, die perfekt eine Dermatophytose nachahmen kann
Myopathiesche Zeichen
Die Muskelbeteiligung ist variabler, und wenn sie klinisch sichtbar ist, deutet sie meist auf eine schwerere Form der Krankheit hin.
- Korrelation mit Hauterscheinungen: Klinische Myositis tritt in der Regel nach dem Auftreten von Hautläsionen auf, und ihre Schwere ist oft proportional zur dermatologischen Beteiligung.
- Muskelatrophie: Die Atrophie der Kaumuskeln (Temporal- und Massetermuskel) ist das häufigste muskuläre Zeichen und kann die einzige myopathische Manifestation sein. In schwereren Fällen kann sich eine bilateral symmetrische Atrophie der Kopf-, Nacken-, Rumpf- und Gliedmaßenmuskulatur entwickeln.
- Funktionelle Anzeichen: Atrophie und Entzündung der Kau- und Schluckmuskulatur können zu Schwierigkeiten beim Greifen der Nahrung (Prähension), Kauen und Schlucken (Dysphagie) führen. Ein abnormaler, steifer und stolzierender Gang (“stiff-stilted gait” oder “Gänsegang”) wird ebenfalls beschrieben.
- Schwere Komplikationen: Die Entwicklung eines Megaösophagus (Dilatation und Hypomotilität der Speiseröhre) ist eine schwerwiegende Komplikation, die zu Regurgitation, Gewichtsverlust und einem hohen Risiko für Aspirationspneumonie führt, einer häufigen Todesursache bei schweren Formen der DM.
2.3 Gesicherte Diagnose: Eine multimodale Strategie
Die Diagnose der DM stützt sich niemals auf einen einzigen Test, sondern auf die Konvergenz mehrerer Elemente, nachdem häufige Differentialdiagnosen wie Demodikose, bakterielle Pyodermie, Dermatophytose und diskoidaler Lupus erythematodes ausgeschlossen wurden.
- Histopathologie (Eckpfeiler): Die Biopsie ist die Schlüsseluntersuchung zur Bestätigung der ischämischen Natur der Läsionen.
-
- Hautbiopsie: Entnommen von einer frischen, aktiven Läsion, zeigt sie charakteristische ischämische Dermatopathie-Veränderungen: eine paucizelluläre Interfacedermatitis (mit wenigen Entzündungszellen), Atrophie der Haarfollikel, Vakuolisierung der Keratinozyten der Basalschicht der Epidermis, das Vorhandensein apoptotischer Zellen (Civatte-Körperchen) und Fibrose oder Mucinansammlung im Dermisbereich. Die vaskulären Veränderungen können subtil sein und sich eher durch ein “unscharfes” und eosinophiles Aussehen des perivaskulären Kollagens (“smudged collagen”) manifestieren als durch eine offensichtliche nekrotisierende Vaskulitis.
- Muskelbiopsie: Obwohl in der Routine weniger systematisch durchgeführt, ist sie bei Verdacht auf myopathische Beteiligung indiziert. Sie zeigt typischerweise eine interstitielle und perivaskuläre Myositis, vorwiegend lymphozytär, plasmozytär und histiozytär, verbunden mit Anzeichen von Muskelfaserleiden (Degeneration, Nekrose, Regeneration und Atrophie).
- Elektrodiagnostik (EMG): Die Elektromyographie ist ein sehr sensibles Instrument zum Nachweis einer Myopathie, selbst in Abwesenheit offensichtlicher klinischer Anzeichen. Die unter Anästhesie durchgeführte Untersuchung zeigt abnormale spontane elektrische Aktivitäten in den betroffenen Muskeln, wie Fibrillationspotentiale, positive scharfe Wellen und abnorme oder myotonische Hochfrequenzentladungen.
- Gentests: Bei Collies, Shetland Sheppards und deren Kreuzungen ist der Test auf die drei Risikoloci (PAN2, MAP3K7CL, DLA) zu einem wesentlichen diagnostischen und prognostischen Instrument geworden. Er ermöglicht die Bestätigung der genetischen Prädisposition und die Stratifizierung des Risikos des Tieres (niedrig, moderat oder hoch), was die Beratung der Besitzer erleichtert.
- Klinische Biochemie: Die Bestimmung der Serumkreatinkinase (CK) ist nützlich. Eine deutliche Erhöhung ist ein Indikator für eine aktive Myositis und Muskelschäden. Eine normale CK-Wert schließt die Diagnose jedoch nicht aus, da die Muskelbeteiligung minimal, fokal oder chronisch mit geringer aktiver Entzündung sein kann.
Tabelle 3: Diagnostische Modalitäten für canine Dermatomyositis
|
Diagnostische Modalität |
Erwartete Ergebnisse / Schlüsselanomalien |
|---|---|
|
Haut-Histopathologie |
Paucizelluläre Interfacedermatitis, follikuläre Atrophie, basale Vakuolisierung, Civatte-Körperchen, dermale Fibrose/Mucinose, “verschmiertes Kollagen” |
|
Muskel-Histopathologie |
Interstitielle und perivaskuläre Myositis (lympho-plasmozytär), Degeneration/Regeneration/Atrophie der Muskelfasern |
|
Elektromyographie (EMG) |
Abnormale Spontanaktivität: Fibrillationspotentiale, positive scharfe Wellen, myotone/ bizarre Hochfrequenz-Entladungen |
|
Gentest (3 Loci) |
Identifizierung von Risikoallelen an den Loci PAN2, MAP3K7CL und DLA; Berechnung eines Risikoscores (Niedrig, Moderat, Hoch) |
|
Biochemie (Kreatinkinase) |
Erhöhung (oft deutlich) bei aktiver Myositis, kann aber bei chronischen Formen oder geringer Muskelbeteiligung normal sein |
Therapeutische Strategien und Management im Jahr 2025
Prognose und Langzeitentwicklung
Die Prognose der kaninen DM ist sehr variabel und hängt von einer Vielzahl von Faktoren ab. Das Verständnis dieser Indikatoren und der Krankheitsverläufe ist entscheidend, um den Besitzern realistische Erwartungen zu vermitteln und das Langzeitmanagement anzupassen.
4.1 Prognostische Indikatoren: Die Zukunft vorhersagen
Mehrere Faktoren ermöglichen es, den voraussichtlichen Verlauf der Krankheit bei einem bestimmten Hund abzuschätzen.
- Klinische Faktoren:
-
- Schweregrad der Krankheit: Dies ist der direkteste prognostische Faktor. Leichte Fälle mit nur wenigen nicht-ulzerierenden Hautläsionen haben eine ausgezeichnete Prognose und können sogar ohne Folgen spontan in Remission gehen. Moderate Fälle haben eine gute Prognose hinsichtlich der Kontrolle, aber oft mit einer restlichen vernarbenden Alopezie. Schwere Fälle mit ausgedehnten Ulzerationen und/oder signifikanter Muskelbeteiligung haben eine verhaltene bis schlechte Prognose.
- Muskel- und Ösophagusbeteiligung: Das Vorhandensein einer klinisch signifikanten Myopathie, insbesondere die Entwicklung eines Megaösophagus, verdunkelt die Prognose erheblich. Das Risiko von Mangelernährung, Aspiration und Aspirationspneumonie wird zu einer großen Lebensbedrohung.
- Demografische Faktoren: Eine retrospektive Studie an 177 Fällen von ischämischer Dermatopathie (ausschließlich der klassischen familiären DM) identifizierte zwei Faktoren, die mit einem schlechteren Verlauf assoziiert waren: ein Körpergewicht unter 10 kg und ein höheres Alter zum Zeitpunkt der Biopsie.
- Genetischer Faktor: Die Einbeziehung des genetischen Risikoprofils (basierend auf den 3 Loci) in die prognostische Bewertung stellt einen großen Fortschritt dar. Dieser Test ermöglicht den Übergang von einer reaktiven Prognose, die auf bereits vorhandenen klinischen Anzeichen basiert, zu einer proaktiven und prädiktiven Prognose. Ein Collie- oder Shetland-Welpe, der bei der Geburt getestet wird und einen Hochrisiko-Genotyp (z.B. AABBCC) aufweist, hat eine intrinsisch reserviertere Prognose, selbst vor dem Auftreten des geringsten klinischen Anzeichens. Es wird vorhergesagt, dass er die Krankheit früher und potenziell in einer schwereren Form entwickeln wird. Diese Information ermöglicht eine frühzeitige Stratifizierung der Patienten und die Einleitung einer verstärkten Überwachung und einer aggressiven therapeutischen Interventionsstrategie bei den ersten Anzeichen, was das Langzeitergebnis verbessern könnte.
4.2 Krankheitsverlauf und Langzeitmanagement
Analog zur humanen JDM kann die canine DM im Laufe der Zeit unterschiedliche Verläufe nehmen.
- Verlaufsprofile:
-
- Monocyclisch: Die Krankheit manifestiert sich in einer einzigen Episode, oft bei leicht betroffenen Tieren, die vollständig (manchmal spontan) in Remission geht und nicht wiederkehrt. Die Prognose ist ausgezeichnet.
- Polyzyklisch: Die Krankheit verläuft in Schüben, mit Perioden der Remission, die von Rezidiven unterbrochen werden. Diese Schübe werden oft durch auslösende Faktoren (UV-Exposition, Traumata, Östrus) ausgelöst. Das Management zielt darauf ab, die Schübe zu kontrollieren und die Remissionsperioden zu verlängern.
- Chronisch-kontinuierlich: Die Krankheit bleibt dauerhaft aktiv, ohne vollständige Remissionsperioden. Diese Fälle erfordern eine lebenslange Behandlung und sind mit der schlechtesten Prognose verbunden.
- Chronisches Management: Das Management chronischer Formen (polyzyklisch oder kontinuierlich) ist eine Herausforderung. Ziel ist es, die Krankheit mit der geringstmöglichen wirksamen Medikamentendosis unter Kontrolle zu halten, um kumulative Nebenwirkungen zu begrenzen. Der Einsatz von Steroid-sparenden Mitteln (wie Ciclosporin) und zunehmend von gezielten Therapien wie JAK-Inhibitoren, steht im Mittelpunkt dieser Strategie. Eine regelmäßige klinische und biologische Überwachung ist unerlässlich, um die Behandlung anzupassen und das Auftreten von Komplikationen zu überwachen, einschließlich eines potenziell erhöhten Risikos für Nierenerkrankungen bei Hunden mit langfristiger chronischer Entzündung.
Fazit
Im Jahr 2025 hat sich die canine Dermatomyositis von einer rätselhaften Erbkrankheit zu einer komplexen genetischen Störung entwickelt, deren molekulare Mechanismen immer besser verstanden werden. Die Erkenntnis ihrer Ätiopathogenese, die sich auf eine ischämische Vaskulopathie konzentriert, die durch eine Dysregulation des Typ-I-Interferon-Signalwegs gesteuert und durch spezifische genetische Interaktionen untermauert wird, hat ihren klinischen Ansatz transformiert.
Dieser Paradigmenwechsel hat tiefgreifende und konkrete Auswirkungen. Die Diagnostik hat sich weiterentwickelt, um Gentests als wesentlichen Pfeiler neben der Histopathologie und Elektromyographie zu integrieren, was eine frühzeitige Risikostratifizierung und präzisere Prognose ermöglicht. Therapeutisch hat sich das Arsenal erweitert, von breit wirksamen Immunsuppressiva, die zwar wirksam, aber mit erheblichen Nebenwirkungen behaftet sind, hin zu gezielten Therapien, die spezifisch die identifizierten pathogenen Wege blockieren. Die Anwendung von Januskinase-Inhibitoren im Besonderen stellt die neue Grenze der Behandlung dar und bietet Hoffnung auf eine effektivere und sicherere Krankheitskontrolle.
Die zukünftigen Forschungsziele sind klar. Sie sollten sich auf die Identifizierung von Risikoloci bei anderen Hunderassen, die großflächige Validierung der Wirksamkeit und langfristigen Sicherheit gezielter Therapien durch randomisierte klinische Studien und die Entwicklung von Blutbiomarkern (wie der IFN-Signatur) für eine nicht-invasive Überwachung der Krankheitsaktivität und eine erhöhte Personalisierung der Behandlung konzentrieren. Das canine Dermatomyositis-Modell wird aufgrund seiner Relevanz und Komplexität weiterhin eine unschätzbare Ressource sein, um das Verständnis und die Behandlung dieser schwächenden Krankheit voranzutreiben, sowohl zum Wohle der Hunde als auch für die Erkenntnisse, die es der Humanmedizin liefert.
Referenzen
- Evans, J. M., Noorai, R. E., Tsai, K. L., Starr-Moss, A. N., Hill, C. M., Anderson, K. J., Famula, T. R., & Clark, L. A. (2017). Beyond the MHC: A canine model of dermatomyositis shows a complex pattern of genetic risk involving novel loci. PLOS Genetics, 13(2), e1006604.
- Hargis, A. M., Prieur, D. J., Haupt, K. H., Collier, L. L., & Evermann, J. F. (1985). Familial canine dermatomyositis. Initial characterization of the cutaneous and muscular lesions. American Journal of Pathology, 121(3), 521–530.
- Rees, C. A., & Boothe, D. M. (2003). Therapeutic response to pentoxifylline and its active metabolites in dogs with familial canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234–241.
- Hargis, A. M., Prieur, D. J., Haupt, K. H., McDonald, T. L., & Moore, M. P. (1986). Prospective study of familial canine dermatomyositis. Correlation of the severity of dermatomyositis and circulating immune complex levels. American Journal of Pathology, 123(3), 465–479.
- Hargis, A. M., & Ginn, P. E. (2001). Canine inflammatory myopathies: a clinicopathologic review of 200 cases. Veterinary Pathology, 38(6), 688-699.
- Hargis, A. M., Haupt, K. H., Hegreberg, G. A., Prieur, D. J., & Moore, M. P. (1984). Familial canine dermatomyositis. Initial characterization of the cutaneous and muscular lesions. American Journal of Pathology, 116(2), 234–244.
- Hargis, A. M., & Prieur, D. J. (1987). Prospective study of familial canine dermatomyositis. Correlation of the severity of dermatomyositis and circulating immune complexes. American Journal of Pathology, 128(1), 129–139.
- Pumphrey, S. A., & Outerbridge, C. A. (2019). The role of oclacitinib in the management of ischaemic dermatopathy in four dogs. Veterinary Dermatology, 30(4), 346-e100.
- Mandrioli, L., & Biserni, R. (2024). A case of refractory nasal dermatomyositis-like disease in an adult Poodle. ResearchGate.
- Errante, P. R. (2022). Dermatomyositis Disease in Dogs. International Journal of Zoology and Animal Biology, 5(8).
- Mendoza, F., & Toral, M. (2019). Three Cases of Canine Dermatomyositis-Like Disease. Acta Scientiae Veterinariae, 47, 1632.
- Mellett, M., & Allen, A. G. (2018). Dermatomyositis etiopathogenesis: a rebel soldier in the muscle. Current Opinion in Rheumatology, 30(6), 610–616.
- Marie, I., Drouot, L., Menard, J. F., & Levesque, H. (2006). Long-term outcome and prognostic factors of juvenile dermatomyositis: a multinational, multicenter study of 490 patients. Arthritis and Rheumatism, 54(11), 3683–3692.
- Kmieć, P., & Gomułkiewicz, A. (2021). The role of interferons type I, II and III in myositis: A review. Clinical and Experimental Rheumatology, 39(4), 882-890.
- Greenberg, S. A., & Pinkus, J. L. (2011). A broad molecular profile of dermatomyositis skin reveals prominent interferon-inducible gene expression and demonstrates molecular similarity to lupus skin. PLoS ONE, 6(12), e29161.
- Berger, D. (2016). Canine Dermatomyositis. Clinician’s Brief, 14(11), 50-52.
- Ghafour, A., & Isenberg, D. A. (2020). The immunopathogenesis of dermatomyositis. Best Practice & Research Clinical Rheumatology, 34(4), 101533.
- Mandell, D. C., & Dehghanpir, S. D. (2021). An update on the diagnosis and treatment of inflammatory myopathies. Journal of Clinical Medicine, 10(15), 3381.
- Main-Nolton, A., & Clark, L. A. (2022). Transcriptome Profiling of Canine Familial Dermatomyositis (DMS) Skin Lesions and Treatment in Collies and Shetland sheepdogs. VIN.
- Santoro, D., & Pucheu-Haston, C. M. (2014). Effects of pentoxifylline on in vivo and in vitro IgE-mediated mast cell degranulation and cutaneous inflammation in dogs. American Journal of Veterinary Research, 75(2), 152–158.
- Olivry, T., & Banovic, F. (2019). Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Diseases of Animals (ICADA). Veterinary Dermatology, 30(3), 169-e50.
- Cosgrove, S. B., Cleaver, D. M., King, V. L., Gilmer, A. R., Daniels, A. E., Wren, J. A., & Stegemann, M. R. (2013). A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis. Veterinary Dermatology, 25(2), 91-e23.
- Gortel, K. (2006). What’s new in dermatologic therapy? DVM360.
- Rees, C. A., & Boothe, D. M. (2004). Therapeutic response to pentoxifylline and its active metabolites in dogs with familial canine dermatomyositis. Veterinary Therapeutics: Research in Applied Veterinary Medicine, 4(3), 234-241.
- Archer, T. M., & Boothe, D. M. (2004). Cyclosporine: a review of its use in veterinary dermatology. Veterinary Dermatology, 15(6), 349–361.
- Robson, D. C. (2014). Cyclosporine in Veterinary Dermatology. Proceedings of the 39th World Small Animal Veterinary Association World Congress.
- Alexishcheva, A., & Guryeva, S. (2024). Interferon signature as a biomarker of skin disease activity in patients with refractory juvenile dermatomyositis. Frontiers in Medicine, 11, 1214920.
- Navale, S., & De, A. (2024). Clinical Progress in Mesenchymal Stem Cell Therapy: A Focus on Rheumatic Diseases. ResearchGate.
- de Mello, M. F., & Hagiwara, M. K. (2007). Canine ischaemic dermatopathy: a retrospective study of 177 cases (2005-2016). Veterinary Dermatology, 28(5), 485-e117.
- Gury, T., & Seror, R. (2024). Prognostic factors and long-term outcome in dogs diagnosed with primary and secondary immune thrombocytopenia in Ireland. Journal of Small Animal Practice.
- Fantini, D., & Ciliberto, G. (2022). Novel Management of Masticatory Myositis in Three Dogs with a Selective Janus Kinase (JAK)-1 Inhibitor. ResearchGate.
- Masi, G., & D’Alessandro, A. (2024). Recent advances in research on dermatomyositis. Uptocure.
- Ardalan, K., & Marques, M. C. (2025). Psychometric properties of patient-reported outcomes measurement information system (PROMIS) fixed short forms in Juvenile Myositis. Seminars in Arthritis and Rheumatism, 71.
- Bartels, C., & Putterman, C. (2022). Juvenile dermatomyositis: updates in pathogenesis and biomarkers. Current Rheumatology Reports, 24(10), 307-317.
- Ziskin, J., & Fiorentino, D. (2024). Recent advances in the treatment of dermatomyositis. Current Opinion in Rheumatology, 36(3), 203-210.
- Mandl, T., & Lundberg, I. E. (2019). The role of interferons type I, II and III in myositis: A review. Clinical and Experimental Rheumatology, 37(5), 868-877.
- van der Kooi, A. J., & van de Vlekkert, J. (2023). An inflammatory myopathy in the Dutch Kooiker dog: a study of 119 cases. Journal of Veterinary Internal Medicine, 37(2), 643-653.
- Viviano, K. R. (2016). Cyclosporine: a review of its use in veterinary medicine. Veterinary Clinics of North America: Small Animal Practice, 46(2), 245-265.
- Nuttall, T., & Gey, van Pittius, M. (2023). Immunosuppressant Therapy in Small Animal Medicine. Today’s Veterinary Practice.
Recherches Connexes
canine Dermatomyositis, Dermatomyositis, Tierklinik, Hund, Fall, beim Hund, Krankheit, Chow Chow, Rassen, klinische Anzeichen, Behandlung, Dermatologie, Shetland, familiäre Dermatomyositis, Haut, Dermatose, Collie, Muskeln, Eric Guaguère, Dermatomyositis bei, Symptome, Emmanuel Bensignor, Rötungen, Konsultation, Ursache, Extremitäten, Läsionen, Autoimmunerkrankung, 6p24.1 6p25.3, Haare, Verlust, Artikel, Lupus erythematodes, Welpen, klinische Untersuchung, Gesicht, Ohren, Plan, Tiere, Leiden, Finger, Tierarzt, Management, Diagnose, Immunsystem, Form, Differentialdiagnose, Zuhause, Zusammenfassung, Alter, Wohlbefinden, Forschung, Untersuchung, Modus, Fakt, Labor, Anzeichen, Expressivität, Typ, Ernährung, Haut und Muskeln, Informationen, Dermatopathien