In der veterinärmedizinischen Dermatologie stellen nur wenige Mikroorganismen eine so konstante und komplexe klinische Herausforderung dar wie Pseudomonas aeruginosa. Dieses gramnegative Stäbchen ist weit mehr als nur ein einfacher Infektionserreger – es erweist sich als furchtbarer Gegner, ein opportunistischer Krankheitserreger par excellence, der mit beeindruckender Effizienz jede noch so geringfügige Störung der Hautbarriere oder jede Schwäche des Immunsystems des Wirtes ausnutzt.
Einleitung
Die von ihm verursachten Infektionen, hauptsächlich chronische Otitis externa und tiefe Pyodermien, sind häufig durch ihren Schweregrad, ihre Chronizität und ihre Therapieresistenz gekennzeichnet.
Die Behandlung dieser Erkrankungen wird durch zwei grundlegende biologische Eigenschaften dieses Erregers besonders erschwert. Einerseits besitzt P. aeruginosa eine intrinsische Resistenz gegen zahlreiche Antibiotikaklassen, eine Fähigkeit, die es durch eine bemerkenswerte Eignung ergänzt, neue Resistenzmechanismen zu erwerben, was zur Entstehung multiresistenter (MDR) Stämme führt. Andererseits stellt seine Fähigkeit zur Bildung von Biofilmen – strukturierten bakteriellen Gemeinschaften, die durch eine extrazelluläre Matrix geschützt sind – eine wahre Festung dar, die ihn vor den Immunabwehrkräften des Wirtes und antimikrobiellen Wirkstoffen schützt. Diese doppelte Verteidigungs- und Persistenzstrategie ist die Hauptursache für Therapieversagen und frustrierende Rezidive für den Kliniker.
Angesichts dieser zunehmenden Problematik ist ein vereinfachter oder empirischer therapeutischer Ansatz zum Scheitern verurteilt. Diese Übersichtsarbeit hat zum Ziel, eine umfassende und integrierte Analyse zu liefern, die auf den neuesten wissenschaftlichen Daten basiert, für die Behandlung dermatologischer Infektionen durch P. aeruginosa. Dieser Referenzartikel wird die Biologie und Pathogenese dieses Mikroorganismus detailliert darstellen, einen strukturierten diagnostischen Ansatz vorschlagen und multimodale Therapiestrategien eingehend erörtern. Besondere Aufmerksamkeit wird der kritischen Interpretation des Antibiogramms im Lichte der neuen Empfehlungen, der Behandlung multiresistenter Infektionen und der Bewertung vielversprechender therapeutischer Innovationen wie antibiofilmaktiven Substanzen und der Phagentherapie gewidmet. Das Ziel dieser Arbeit ist es, dem Kliniker die konzeptuellen und praktischen Werkzeuge zu liefern, die notwendig sind, um die Behandlung dieser komplexen Fälle von einem unsicheren Kampf in eine beherrschte und wirksame Therapiestrategie zu verwandeln.
1. Pseudomonas aeruginosa: Porträt eines gefährlichen opportunistischen Erregers
1.1. Ökologie und mikrobiologische Eigenschaften
Das Verständnis der Natur von Pseudomonas aeruginosa beginnt mit der Anerkennung seiner Ubiquität. Dieser Mikroorganismus ist allgegenwärtig in der Umwelt und besiedelt mühelos Boden, Süßwasser, Pflanzenoberflächen und organisches Material im Abbau. Diese ökologische Plastizität erklärt nicht nur seine häufige Präsenz als einfacher Umweltkontaminant, sondern auch seine führende Rolle bei nosokomialen Infektionen, wo es in so unterschiedlichen Reservoirs wie Desinfektionsmitteln, Waschbecken oder medizinischen Geräten überleben und sich vermehren kann. Es ist grundlegend zu beachten, dass P. aeruginosa nicht zur kommensalen Mikroflora des äußeren Gehörgangs oder der gesunden Haut des Hundes gehört. Seine Anwesenheit in einer dermatologischen Probe ist daher immer klinisch bedeutsam.
Mikrobiologisch handelt es sich um ein gramnegatives Stäbchen, das streng aerob ist und sich durch seine Beweglichkeit auszeichnet, die durch eine einzelne polare Geißel gewährleistet wird. Seine minimalen Nährstoffanforderungen und seine Fähigkeit, ein breites Spektrum physikalisch-chemischer Bedingungen zu tolerieren, einschließlich Temperaturen bis zu 42 °C, verleihen ihm eine außergewöhnliche Überlebens- und Anpassungsfähigkeit und ermöglichen es ihm, feindliche Umgebungen zu besiedeln, in denen nur wenige andere Bakterien überleben können.
1.2. Virulenzarsenal: Von Toxinen bis zu Enzymen
Die pathogene Kraft von P. aeruginosa beruht nicht auf einem einzelnen Toxin, sondern auf einem komplexen und redundanten Arsenal von Virulenzfaktoren, die synergistisch wirken, um Gewebe zu infiltrieren, der Immunantwort zu entkommen und Zellschäden zu verursachen.
Zu den bekanntesten Faktoren gehören seine Pigmente. Pyocyanin, ein blaugrünes Pigment, das dem “pyocyanischen” Eiter seine charakteristische Farbe verleiht, ist nicht nur ein visueller Marker. Es übt starke proinflammatorische Wirkungen auf Phagozyten aus und beeinträchtigt die Immunfunktionen von Epithelzellen, wodurch es aktiv zur Pathogenese beiträgt. Die Gewebeinvasion wird durch eine Batterie extrazellulärer Enzyme erleichtert. Elastase baut Kollagen und Elastin ab, Hauptbestandteile der extrazellulären Matrix, während alkalische Protease die Fibrinbildung stört und die Eindämmung der Infektion verhindert. Phospholipasen bauen Phospholipide der Zellmembranen ab und führen zu Zelllyse.
Zu diesem Arsenal kommen starke Toxine hinzu. Das Zytotoxin (oder Leukozidin) und die Hämolysine zielen auf Immunzellen und Erythrozyten ab und zerstören sie. Darüber hinaus nutzt P. aeruginosa ausgeklügelte Sekretionssysteme wie das Typ-III-Sekretionssystem (T3SS), das wie eine molekulare Spritze wirkt, um toxische Effektoren (Exotoxine S und A) direkt in das Innere der Wirtszellen zu injizieren. Diese Exotoxine lähmen zelluläre Funktionen, insbesondere die Phagozytose, und induzieren eine lokalisierte Gewebenekrose, wodurch ein für die bakterielle Vermehrung günstiges Umfeld geschaffen wird.
1.3. Biofilmbildung: Eine bakterielle Festung
Vielleicht ist der entscheidendste Virulenzfaktor für die Chronizität von P. aeruginosa-Infektionen seine Fähigkeit, einen Biofilm zu bilden. Es handelt sich nicht um eine einfache Aggregation von Bakterien, sondern um eine hochorganisierte mikrobielle Gemeinschaft, eingebettet in eine selbstproduzierte Matrix aus Exopolysacchariden, die hauptsächlich aus Alginat besteht. Diese viskose Matrix verankert die Bakterien fest an der Oberfläche des Gehörgangs oder der ulzerierten Haut und bildet eine wahre Festung.
Diese Struktur verleiht dem Bakterium mehrere Vorteile. Erstens bildet sie eine physikalische Barriere, die es vor den phagozytären Zellen des Immunsystems schützt und das Eindringen von Antibiotika erheblich einschränkt. Studien haben gezeigt, dass in einem Biofilm organisierte Bakterien hundert- oder sogar tausendfach resistenter gegen antimikrobielle Wirkstoffe sein können als ihre planktonischen (freien) Gegenstücke. Zweitens kommunizieren die Bakterien innerhalb des Biofilms über ein System chemischer Signale, das als Quorum Sensing bezeichnet wird. Dieser Mechanismus, der von der Zelldichte abhängt, ermöglicht es ihnen, die Expression von Virulenzgenen und Abwehrstrategien kollektiv zu koordinieren und sich wie ein mehrzellulärer Organismus zu verhalten.
Die klinische Auswirkung dieser Strategie ist erheblich. Die Prävalenz der Biofilmbildung durch klinische Isolate von P. aeruginosa aus caniner Otitis ist extrem hoch und wird in 40 % bis über 90 % der Fälle je nach Studie angegeben. Eine umfangreiche europäische Studie ergab sogar, dass 82 % der Isolate in der Lage waren, starke Biofilme zu bilden. Diese Fähigkeit ist eine direkte Ursache für Therapieversagen, Persistenz der Infektion trotz scheinbar angepasster Antibiotikatherapie und die Etablierung einer chronisch destruktiven Entzündung.
1.4. Mechanismen der Antibiotikaresistenz: Intrinsische und erworbene Strategien
Die beeindruckende Fähigkeit von P. aeruginosa, Antibiotika zu widerstehen, basiert auf einer doppelten Strategie: einer natürlichen (intrinsischen) Resistenz und einer außergewöhnlichen Anpassungsfähigkeit (erworbene Resistenz).
Die intrinsische Resistenz ist eine der Art inhärente Eigenschaft. Sie beruht hauptsächlich auf der geringen Permeabilität seiner äußeren Membran, die den Eintritt vieler Moleküle einschränkt. Hinzu kommt ein Arsenal von Effluxpumpen, Membranproteinen, die Antibiotika aktiv aus der Zelle ausschleusen, bevor sie ihr Ziel erreichen. Schließlich exprimiert P. aeruginosa konstitutiv eine chromosomale β-Lactamase (AmpC), ein Enzym, das bestimmte Penicilline und Cephalosporine inaktivieren kann.
Die erworbene Resistenz ist noch besorgniserregender. Sie resultiert entweder aus spontanen chromosomalen Mutationen oder, häufiger, aus dem Erwerb von mobilem genetischem Material (Plasmide, Transposons) durch horizontalen Transfer von anderen Bakterien. Diese Mechanismen ermöglichen es dem Bakterium, Resistenzen gegen Antibiotikaklassen zu entwickeln, gegen die es ursprünglich empfindlich war, was zur Entstehung von Multiresistenz-Phänotypen (MDR) führt. Die wichtigsten erworbenen Mechanismen umfassen die Produktion zusätzlicher inaktivierender Enzyme (wie Extended-Spectrum-β-Lactamasen oder Carbapenemasen), die Modifikation des Antibiotikaziels (z. B. Mutationen in DNA-Gyrase-Genen, die Resistenz gegen Fluorchinolone verleihen) oder die Überexpression von Effluxpumpen.
Diese Kombination aus aggressiver Virulenz, Schutz durch den Biofilm und multiplen Resistenzmechanismen macht P. aeruginosa zu einem besonders schwer zu eradizierenden Erreger. Sein klinischer Erfolg ist nicht das Ergebnis eines einzelnen Faktors, sondern einer integrierten und synergistischen Überlebensstrategie. Das Bakterium nutzt zunächst seine Enzyme und Toxine, um sich zu etablieren und Gewebe zu schädigen. Dann baut es seine Festung, den Biofilm, um sich vor den ersten Abwehrwellen des Wirtes und Behandlungen zu schützen. Geschützt hat es Zeit, Resistenzgene zu entwickeln und auszutauschen und rüstet sich für zukünftige Angriffe. Jeder therapeutische Ansatz, der diese globale Strategie nicht berücksichtigt, ist unweigerlich zum Scheitern verurteilt. Die Behandlung muss daher multimodal sein und gleichzeitig darauf abzielen, die Festung zu zerstören, die Erreger zu neutralisieren und die dem Wirt zugefügten Schäden zu reparieren.
Tabelle 1: Wichtige Virulenzfaktoren von P. aeruginosa und ihre pathogenen Rollen
|
Virulenzfaktor |
Kategorie |
Hauptpathogene Rolle |
|
Pyocyanin |
Pigment |
Beeinträchtigung der Immunantwort, oxidativer Stress, proinflammatorische Wirkungen |
|
Elastase, alkalische Protease |
Extrazelluläre Enzyme |
Zerstörung der extrazellulären Matrix (Kollagen, Elastin), Gewebeinvasion |
|
Phospholipase C |
Extrazelluläres Enzym |
Lyse von Wirtszellen durch Abbau von Lipidmembranen |
|
Exotoxin A, Exoenzym S |
Toxine (T3-Sekretionssystem) |
Hemmung der Proteinsynthese, Apoptose von Wirtszellen, Lähmung der Phagozyten |
|
Lipopolysaccharid (LPS) |
Membranbestandteil |
Induktion einer starken Entzündungsreaktion, septischer Schock |
|
Alginat / Biofilm |
Schutzmatrix |
Schutz vor Antibiotika und Immunsystem, Adhäsion, chronische Persistenz |
|
Effluxpumpen |
Resistenzmechanismus |
Aktive Ausschleusung mehrerer Antibiotikaklassen aus der Bakterienzelle |
|
β-Lactamasen (AmpC, etc.) |
Resistenzenzyme |
Enzymatische Inaktivierung von Antibiotika der β-Lactam-Familie |
2. Klinische Manifestationen und Epidemiologie
2.1. Otitis durch Pseudomonas aeruginosa
Die Otitis durch Pseudomonas aeruginosa stellt eine der schwersten und frustrierendsten klinischen Entitäten in der caninen Dermatologie dar. Es ist entscheidend zu verstehen, dass sie nur sehr selten eine primäre Infektion ist. Sie ist fast systematisch eine Komplikation einer chronischen oder rezidivierenden Otitis externa, die anfänglich durch eine Proliferation anderer Erreger verursacht wurde, typischerweise Hefen (Malassezia pachydermatis) oder Kokken (Staphylococcus pseudintermedius). Das Fortschreiten zu einer Pseudomonas-Infektion ist eine wahre pathologische Eskalation, begünstigt durch eine Reihe von Faktoren. Die prädisponierenden Faktoren (Ohrkonformation mit engem Gehörgang oder hängendem Ohrläppchen, übermäßige Feuchtigkeit), die primären Faktoren (die ursprüngliche Ursache der Entzündung, wie atopische Dermatitis, Futtermittelallergie oder Fremdkörper) und die perpetuierenden Faktoren (pathologische Veränderungen des Gehörgangs wie Hyperplasie der Ceruminaldrüsen, Stenose oder Trommelfellruptur) schaffen ein ideales Mikroumfeld für die Besiedlung durch diesen opportunistischen Erreger.
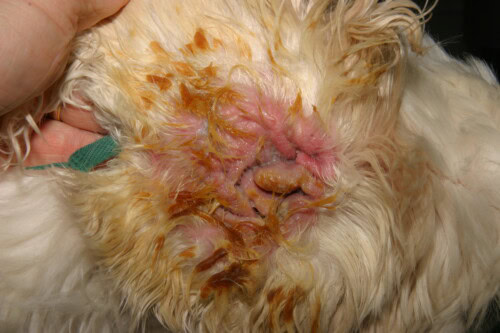
Schwere Pseudomonas-Otitis bei einem Cocker Spaniel
Die klinische Präsentation ist oft charakteristisch. Die Erkrankung ist häufig einseitig, obwohl sie im Kontext einer zugrunde liegenden allergischen Erkrankung bilateral sein kann. Sie manifestiert sich durch intensive Ohrenschmerzen, oft stärker ausgeprägt als Juckreiz, eine schwere erythematöse Entzündung des Gehörgangs und Ulzerationen des Epithels. Das auffälligste Zeichen ist die Beschaffenheit des Exsudats: Es ist typischerweise reichlich, mukoid oder purulent, übelriechend und von einer charakteristischen gelb-grünlichen Farbe aufgrund der Produktion bakterieller Pigmente. In schweren Fällen kann dieses Exsudat hämorrhagisch sein. Die sorgfältige Untersuchung der Ohrmuschel und des Gehörgangeingangs kann das Vorhandensein von klebrigen Bereichen aufdecken, eine direkte klinische Manifestation des bakteriellen Biofilms. Eine häufige und schwerwiegende Komplikation ist die Ausbreitung der Infektion auf das Mittelohr. Man schätzt, dass mehr als 80 % der Hunde mit chronischer Otitis externa durch Pseudomonas eine begleitende Otitis media aufweisen. Diese kann sich durch neurologische Symptome wie Horner-Syndrom, Fazialislähmung oder vestibuläre Störungen manifestieren.
Epidemiologisch gesehen ist Otitis externa eine extrem häufige Erkrankung, die zwischen 10 % und 20 % der Hundepopulation betrifft. Innerhalb dieser Population erweist sich P. aeruginosa als der am häufigsten isolierte Erreger in chronischen und therapieresistenten Fällen und ist mit fast 35 % dieser schweren Formen assoziiert. Andere Studien, die an spezifischen Populationen von Hunden mit Otitis durchgeführt wurden, berichten von Prävalenzen zwischen 25 % und über 50 %.
2.2. Pyodermie durch Pseudomonas aeruginosa
Obwohl seltener als Otitiden, sind Pyodermien durch P. aeruginosa oft spektakuläre und schwere Erkrankungen. Sie präsentieren sich im Allgemeinen in zwei Hauptformen.
Die akute tiefe Pyodermie ist die dramatischste Form. Sie zeichnet sich durch das plötzliche Auftreten extrem schmerzhafter Läsionen aus, die klassischerweise entlang der Rückenlinie lokalisiert sind. Die klinische Untersuchung zeigt multiple kreisförmige Ulzera (ringförmig), hämorrhagische Krusten und Furunkel, aus denen ein blutiges Exsudat austreten kann. Der Allgemeinzustand des Tieres ist oft beeinträchtigt, mit Lethargie und Fieber.
Das Intertrigo (oder Hautfaltentzündung) durch Pseudomonas ist eine weitere Präsentation. Es entwickelt sich in Hautfaltenbereichen, wo Mazeration und Reibung günstige Bedingungen schaffen (Gesichtsfalten bei brachyzephalen Rassen, Schwanzfalte, Vulvafalten). Die Läsionen bestehen aus Erosionen und tiefen Ulzerationen, bedeckt mit einem grünlichen, dicken und besonders klebrigen Exsudat, das sehr charakteristisch für die Beteiligung dieses Keims ist.
Die genaue Prävalenz von Pseudomonas-Pyodermien ist weniger gut dokumentiert als die von Otitiden. Studien zu caninen Hautinfektionen haben jedoch P. aeruginosa in etwa 11 % bis 13 % der Fälle identifiziert. Eine in Rumänien durchgeführte Studie zu oberflächlichen Hautinfektionen isolierte den Keim in fast 34 % der Pyodermie-Proben.
Das Auftreten einer P. aeruginosa-Infektion, sei es im Ohr oder auf der Haut, sollte vom Kliniker als Alarmsignal interpretiert werden. Es ist kein zufälliges Ereignis, sondern der Höhepunkt einer pathologischen Kaskade. Chronizität ist der Hauptrisikofaktor. Persistierende Entzündung, Feuchtigkeit und vor allem wiederholte Antibiotikatherapien, oft breitspektrig, erzeugen einen intensiven Selektionsdruck. Sie eliminieren die schützende Kommensalflora und die empfindlicheren Erreger und überlassen P. aeruginosa das Feld, der intrinsisch resistenter und perfekt an diese feindliche und veränderte Umgebung angepasst ist. Daher ist die Identifizierung von P. aeruginosa nicht das Ende der Diagnose, sondern der Beginn einer tiefer gehenden Untersuchung. Sie erfordert eine gründliche Suche nach der primären Ursache (Allergie, endokrine Störung usw.), die die Etablierung dieser “Krise” ermöglicht hat. Ohne die Behandlung dieses anfänglichen Faktors wird jeder Versuch, die Pseudomonas-Infektion zu behandeln, selbst mit dem stärksten Antibiotikum, nur eine vorübergehende Atempause vor einem unvermeidlichen Rückfall sein.
3. Strukturierter diagnostischer Ansatz
Das effektive Management einer P. aeruginosa-Infektion beruht auf einem strukturierten und hierarchischen diagnostischen Ansatz. Das Ziel ist nicht nur die Identifizierung des Erregers, sondern auch das Verständnis des Kontexts seiner Entwicklung, die Bewertung des Ausmaßes der Läsionen und die Lenkung einer gezielten und rationalen Therapie.
3.1. Klinische und otoskopische Untersuchung: Entscheidende erste Schritte
Jeder diagnostische Ansatz beginnt mit einer gründlichen Anamnese und einer vollständigen klinischen Untersuchung. Die Befragung des Besitzers sollte nach Anzeichen zugrunde liegender Erkrankungen suchen, insbesondere Juckreiz außerhalb der Ohren, Verdauungsstörungen oder rezidivierende Hautinfektionen, die auf eine atopische Dermatitis oder eine Futtermittelallergie hindeuten können. Anzeichen von Polyurie-Polydipsie oder Gewichtszunahme können auf eine Endokrinopathie hinweisen. Die dermatologische Untersuchung sollte umfassend sein, da die Otitis oft nur eine der Manifestationen einer umfassenderen Dermatose ist.
Die otoskopische Untersuchung ist ein grundlegender Schritt. Die Verwendung eines Video-Otoskops ist ideal, da es eine überlegene Vergrößerung, Beleuchtung und Aufnahmefähigkeit bietet und eine genaue Bewertung und Nachverfolgung erleichtert. Die Otoskopie ermöglicht die Beurteilung des Zustands des äußeren Gehörgangs: Grad des Erythems, Vorhandensein von Ulzerationen, Gewebeproliferationen (Stenose) oder Massen. Sie ist auch unerlässlich zur Beurteilung der Integrität des Trommelfells. Ein rupturiertes, vorgewölbtes oder verfärbtes Trommelfell ist ein starkes Zeichen für eine Mittelohrbeteiligung. Die Visualisierung eines purulenten Exsudats und von Ulzera ist stark suggestiv für eine Infektion durch gramnegative Bazillen.
3.2. Zytologische Untersuchung: Ein diagnostisches Werkzeug erster Wahl
Die zytologische Untersuchung des Ohrs ist die wichtigste, schnellste und kosteneffektivste ergänzende Untersuchung bei der Behandlung von Otitiden. Sie sollte bei jeder Konsultation wegen einer Otitis systematisch durchgeführt werden. Die Probenentnahme erfolgt mit einem Tupfer und versucht, die Verbindung zwischen dem vertikalen und horizontalen Gehörgang zu erreichen, wo die Sekrete am repräsentativsten für die Infektion sind. Die Probe wird dann auf einen Objektträger aufgetragen, gefärbt (z. B. mit einer schnellen Romanowsky-Färbung) und unter dem Mikroskop untersucht.
Im Kontext einer P. aeruginosa-Infektion sind die Ergebnisse oft charakteristisch. Die Beobachtung von stäbchenförmigen Bakterien (Bazillen), oft in großer Anzahl, ist das Hauptwarnzeichen. Diese Bazillen werden typischerweise von einer dichten Entzündungspopulation begleitet, die hauptsächlich aus degenerierten Neutrophilen besteht, was auf eine aktive und eitrige Infektion hinweist. Die Zytologie bietet eine nahezu sofortige diagnostische und therapeutische Orientierung und ermöglicht die Einleitung einer gezielten topischen Behandlung gegen gramnegative Bazillen, ohne auf die Ergebnisse einer Kultur zu warten.
3.3. Bakterielle Kultur und Antibiogramm: Indikationen und Entnahmeprotokoll
Die bakterielle Kultur mit Antibiogramm ist keine Routineuntersuchung für eine erste unkomplizierte Otitis. Ihre Verschreibung sollte begründet sein und spezifischen klinischen Situationen vorbehalten bleiben, in denen sie entscheidende Informationen für die weitere Behandlung liefert:
- Bestätigtes Vorhandensein von Bazillen in der zytologischen Untersuchung, insbesondere wenn die Infektion chronisch oder rezidivierend ist.
- Versagen einer gut durchgeführten empirischen Erstlinienbehandlung.
- Notwendigkeit der Erwägung einer systemischen Antibiotikatherapie, insbesondere bei bestätigter Otitis media oder assoziierter tiefer Pyodermie. In diesem Fall ist das Antibiogramm unerlässlich, um die Wahl des Wirkstoffs zu leiten.
Das Entnahmeprotokoll ist entscheidend für die Zuverlässigkeit des Ergebnisses. Die Probe sollte so aseptisch wie möglich entnommen werden, idealerweise aus dem tiefen Teil des Gehörgangs. Bei Verdacht auf Otitis media mit intaktem Trommelfell ist die einzige Möglichkeit, eine repräsentative Probe der Paukenhöhle zu erhalten, die Durchführung einer Myringotomie. Dieser Eingriff, der unter Vollnarkose und video-otoskopischer Führung durchgeführt wird, besteht darin, das Trommelfell steril zu perforieren, um den Inhalt des Mittelohrs für eine zytologische Analyse und Kultivierung zu aspirieren.
3.4. Medizinische Bildgebung bei der Untersuchung der Otitis media
Wenn eine Beteiligung des Mittelohrs vermutet wird (basierend auf klinischen Anzeichen, Otoskopie oder Therapieversagen), wird die medizinische Bildgebung zu einem wesentlichen diagnostischen Werkzeug. Sie ermöglicht die Bestätigung der Beteiligung, die Bewertung ihres Schweregrads und die Planung eines möglichen chirurgischen Eingriffs.
Die Computertomographie (CT) gilt als die bildgebende Methode der Wahl. Sie bietet eine hervorragende Auflösung zur Visualisierung der Knochenstrukturen, insbesondere der Wand der Paukenhöhle (Suche nach Knochenlyse) und der Gehörknöchelchen, sowie zur Erkennung von Flüssigkeit oder abnormalem Weichgewebe im Mittelohr. Die Magnetresonanztomographie (MRT) ist eine Alternative, die eine bessere Visualisierung von Weichteilen bietet und besonders bei Verdacht auf eine Tumormasse oder eine Ausbreitung der Infektion auf die umgebenden Nervenstrukturen indiziert ist.
Dieser sequenzielle Ansatz, von der schnellen Zytologie bis zur fortgeschrittenen Bildgebung, verkörpert einen rationalen diagnostischen Ansatz. Jede ergänzende Untersuchung wird nicht zufällig verschrieben, sondern zielt darauf ab, eine spezifische klinische Frage zu beantworten, die sich in einer bestimmten Phase des Prozesses stellt. Die Zytologie orientiert die Anfangsbehandlung. Das Versagen dieser Behandlung wirft die Frage der Resistenz auf (Antwort durch Kultur) oder der anatomischen Ausdehnung (Antwort durch CT). Diese Hierarchisierung verhindert eine ungerechtfertigte therapeutische Eskalation und fördert einen vernünftigen Einsatz von Antibiotika und kostspieligen Untersuchungen.
4. Integrierte Therapiestrategien
Die Behandlung von P. aeruginosa-Infektionen ist ein anspruchsvoller Prozess, der einen multimodalen und ausdauernden Ansatz erfordert. Der Erfolg beruht nicht auf einem einzigen “Wunder”-Molekül, sondern auf einer integrierten Strategie, die darauf abzielt, den Erreger zu eliminieren, die Entzündung zu kontrollieren, die zugrunde liegenden Faktoren zu korrigieren und ein gesundes Ohrumfeld wiederherzustellen.
4.1. Grundprinzipien: Management der primären Ursache und Entzündungskontrolle
Das grundlegendste Prinzip, das jedoch manchmal vernachlässigt wird, ist, dass die Langzeitbehandlung einer Pseudomonas-Infektion untrennbar mit der Identifizierung und Behandlung der primären Ursache der Otitis verbunden ist. Ob es sich um eine Allergie, eine Endokrinopathie oder eine Masse handelt, ihre Kontrolle ist die einzige Garantie gegen Rückfälle. Die Pseudomonas-Infektion ist eine Folge; nur die Folge zu behandeln, ohne die Ursache anzugehen, ist eine therapeutische Sackgasse.
Parallel dazu ist die Kontrolle der Entzündung eine Säule der Behandlung. Chronische Entzündung verursacht Ödeme, Schmerzen, Hyperplasie der Talg- und Ceruminaldrüsen und Stenose des Gehörgangs. Diese Veränderungen perpetuieren die Infektion und verhindern das Eindringen topischer Behandlungen. Die Verwendung von Glukokortikoiden, topisch und/oder systemisch (z. B. Prednisolon in antientzündlicher Dosis), ist daher in der Anfangsphase entscheidend. Sie ermöglichen es, den Gehörgang zu “öffnen”, die Exsudatproduktion zu verringern, den Komfort des Tieres zu verbessern und folglich die Wirksamkeit antimikrobieller Wirkstoffe zu erhöhen.
4.2. Topische Therapie: Eckpfeiler der Behandlung
Die topische Therapie steht im Mittelpunkt der therapeutischen Strategie, da nur sie es ermöglicht, antimikrobielle Konzentrationen am Infektionsort zu erreichen, die weit über denen liegen, die durch systemische Gabe erreicht werden. Ihre Wirksamkeit hängt von zwei Schlüsselschritten ab: Reinigung und Anwendung gezielter Wirkstoffe.
Die Ohrreinigung ist ein unverzichtbarer Schritt. Das purulente Exsudat und der Biofilm wirken als physikalische Barriere und können bestimmte Antibiotika, insbesondere Aminoglykoside, chemisch inaktivieren. Eine anfängliche gründliche Reinigung, die unter Vollnarkose mit reichlicher Spülung durchgeführt wird, ist oft unerlässlich, um die Mehrheit der Ablagerungen zu entfernen. Anschließend sind regelmäßige Reinigungen zu Hause durch den Besitzer erforderlich, um den Gehörgang sauber zu halten.
Die Wirksamkeit der topischen Therapie kann durch die Verwendung von Lösungen, die Tris-EDTA enthalten, erheblich gesteigert werden. EDTA (Ethylendiamintetraessigsäure) ist ein Chelatbildner, der sich an Metallionen (Calcium, Magnesium) bindet, die für die Stabilität der äußeren Membran gramnegativer Bakterien essentiell sind. Durch Destabilisierung dieser Membran macht Tris-EDTA sie durchlässiger für Antibiotika und potenziert so deren Wirkung. Studien haben gezeigt, dass es die Wirksamkeit von Fluorchinolonen und Aminoglykosiden gegen P. aeruginosa signifikant erhöht. Das optimale Protokoll besteht darin, die Tris-EDTA-Lösung in den Gehörgang zu träufeln und 20 bis 30 Minuten zu warten, bevor das antibiotische Medikament angewendet wird, um dem Chelatbildner Zeit zu geben, zu wirken.
Die Wahl des topischen antimikrobiellen Wirkstoffs sollte durchdacht sein. Mehrere Optionen sind verfügbar:
- Die Fluorchinolone (Marbofloxacin, Enrofloxacin) und die Aminoglykoside (Gentamicin, Amikacin) sind häufige Wahlmöglichkeiten und oft wirksam. Vorsicht ist bei Aminoglykosiden im Falle einer Trommelfellruptur geboten, da sie potenziell ototoxisch sind.
- Das Polymyxin B ist ein weiteres wirksames Antibiotikum gegen P. aeruginosa.
- Das Silbersulfadiazin (SSD) ist eine besonders interessante Option, insbesondere bei multiresistenten Stämmen. Als 1%ige Creme hat es eine ausgezeichnete in vitro-Aktivität gegen canine P. aeruginosa-Isolate gezeigt, mit sehr niedrigen minimalen Hemmkonzentrationen (MHK) (1-64 µg/ml), die weit unter der Konzentration der kommerziellen Zubereitung liegen. Sein Wirkmechanismus, der die Zellwand und Membran angreift, unterscheidet sich von dem vieler anderer Antibiotika.
4.3. Systemische Antibiotikatherapie: Indikationen, Auswahl und Risiken
Die systemische Antibiotikatherapie ist keine Erstlinienbehandlung für eine Otitis externa, selbst bei Pseudomonas. Die im Cerumen und Epithel des Gehörgangs erreichten Konzentrationen sind oft unzureichend. Ihre Verwendung sollte spezifischen und gerechtfertigten Indikationen vorbehalten sein:
- Otitis media, bestätigt durch Bildgebung oder Otoskopie.
- Assoziierte tiefe Pyodermie.
- Entzündung und Gewebehyperplasie so schwer, dass sie jede wirksame topische Anwendung verhindern.
- Nachgewiesenes Versagen einer aggressiven und gut durchgeführten topischen Behandlung.
Die Wahl des Wirkstoffs muss zwingend durch ein Antibiogramm geleitet werden.
- Die Fluorchinolone sind die einzige oral verfügbare Klasse mit zuverlässiger Aktivität. Allerdings sind hohe Dosen außerhalb der Zulassung erforderlich, um gegen P. aeruginosa wirksam zu sein: Enrofloxacin bei 10-20 mg/kg/Tag und Marbofloxacin bei 5,5 mg/kg/Tag. Es ist zu beachten, dass sich Resistenzen während der Behandlung schnell entwickeln können.
- Parenterale (injizierbare) Optionen umfassen Cephalosporine der dritten Generation (wie Ceftazidim) und Aminoglykoside (Amikacin, Gentamicin). Die systemische Anwendung von Aminoglykosiden ist durch ihr Risiko für Nephrotoxizität und Ototoxizität begrenzt und erfordert eine perfekte Hydratation des Tieres sowie eine Überwachung der Nierenfunktion.
- Die Carbapeneme (Imipenem, Meropenem) und die Anti-Pseudomonas-Penicilline (Ticarcillin) sind Reserveantibiotika, die nur für dokumentierte multiresistente Infektionen verwendet werden sollten, unter Einhaltung der Prinzipien der Antibiotic Stewardship zur Erhaltung ihrer Wirksamkeit in der Human- und Veterinärmedizin.
- Zu beachten ist, dass diese letzteren Moleküle gemäß den geltenden Vorschriften und Empfehlungen jedes Landes einzusetzen sind, zum Beispiel GEDAC für Frankreich.
Tabelle 2: Dosierungen systemischer Anti-Pseudomonas-Antibiotika beim Hund
|
Wirkstoff |
Klasse |
Dosierung (Weg) |
Klinische Kommentare / Vorsichtsmaßnahmen |
|
Enrofloxacin |
Fluorchinolon |
10–20 mg/kg/Tag (PO, IV, SC) |
Erfordert hohe Dosen. Resistenz kann sich schnell entwickeln. |
|
Marbofloxacin |
Fluorchinolon |
5,5 mg/kg/Tag (PO) |
Maximale Dosis erforderlich für Wirksamkeit gegen Stämme mit intermediärer Empfindlichkeit. |
|
Amikacin |
Aminoglykosid |
15–30 mg/kg/Tag (IV, IM, SC) |
Risiko für Nephrotoxizität und Ototoxizität. Gute Hydratation sicherstellen und Nierenfunktion überwachen. |
|
Gentamicin |
Aminoglykosid |
10–14 mg/kg/Tag (IV, IM, SC) |
Höheres Toxizitätsrisiko als Amikacin. Überwachung erforderlich. |
4.4. Kritische Interpretation des Antibiogramms nach CLSI VET-Standards
Das Antibiogramm ist ein mächtiges Werkzeug, aber seine Interpretation sollte nicht passiv sein. Das Clinical and Laboratory Standards Institute (CLSI) hat kürzlich eine wichtige Aktualisierung der kritischen Grenzwerte (Breakpoints) für Fluorchinolone beim Hund veröffentlicht, die ihre Interpretation radikal verändert.
Die alten, höheren Grenzwerte konnten einen Stamm als “Sensibel” (S) klassifizieren, der auf eine Standarddosisbehandlung nicht ansprechen würde. Die neuen Grenzwerte sind viel niedriger und führen eine neue Kategorie ein: “Sensibel-Dosis-abhängig” (SDD). Diese Kategorie zeigt an, dass ein Stamm erfolgreich behandelt werden kann, aber nur wenn die höchste Dosis des zugelassenen Dosisbereichs verwendet wird.
Diese Entwicklung verwandelt das Antibiogramm von einem einfachen “S/I/R”-Bericht in einen echten Verschreibungsleitfaden. Bei einem als SDD klassifizierten Stamm weiß der Kliniker, dass er die maximal empfohlene Dosis (z. B. 20 mg/kg/Tag für Enrofloxacin) verschreiben muss, um eine Chance auf klinischen Erfolg zu haben. Die Verwendung einer Standarddosis bei einem SDD-Stamm ist eine vorhersehbare Ursache für Therapieversagen und Resistenzentwicklung.
Tabelle 3: Überarbeitete CLSI VET-Grenzwerte (2023) für Enrofloxacin und Marbofloxacin beim Hund (Orale Gabe)
|
Antibiotikum |
Kategorie und MHK-Grenzwert (µg/ml) |
Entsprechende Dosis |
|
Enrofloxacin (überarbeitet) |
S ≤ 0,06 |
5 mg/kg/Tag |
|
SDD 0,12–0,25 |
10–20 mg/kg/Tag |
|
|
R ≥ 0,5 |
– |
|
|
Marbofloxacin (überarbeitet) |
S ≤ 0,12 |
2,8 mg/kg/Tag |
|
SDD 0,25 |
5,5 mg/kg/Tag |
|
|
R ≥ 0,5 |
– |
Letztendlich sollte die therapeutische Strategie nicht als einfacher “Antibiotika-Kampf” gesehen werden, sondern als “Ökosystem-Management”. Das Ziel ist nicht nur die Eradikation von P. aeruginosa, sondern die Wiederherstellung eines Haut- oder Ohrumfelds, in dem es sich nicht mehr vermehren kann. Die Reinigung, Tris-EDTA und Entzündungshemmer verändern die physikalische, chemische und immunologische Umgebung. Die Behandlung der primären Ursache korrigiert das grundlegende Ungleichgewicht. In diesem Schema sind Antibiotika nur ein Werkzeug, oft vorübergehend, um die bakterielle Last zu reduzieren, während andere Maßnahmen das Gleichgewicht wiederherstellen. Der Erfolg wird weniger an der Heilung der Infektionsepisode gemessen als an der Verhinderung ihres Wiederauftretens.
5. Management multiresistenter Infektionen und Zukunftsperspektiven
Die Entstehung von P. aeruginosa-Stämmen mit Multiresistenz (MDR) stellt die ultimative Herausforderung in der Veterinärdermatologie dar. Angesichts eines Antibiogramms, das nur wenige oder keine Empfindlichkeiten zeigt, muss der Kliniker die Idee einer einfachen Lösung aufgeben und alternative und kombinierte Strategien annehmen, während er sich innovativen Therapien zuwendet, die den Kampf gegen bakterielle Infektionen neu definieren.
5.1. Kombinierte Strategien für multiresistente Stämme (MDR)
Das Management einer MDR-Infektion durch P. aeruginosa basiert auf einer Intensivierung des multimodalen Ansatzes. Jede Komponente der Behandlung wird kritisch. Eine gründliche und wiederholte mechanische Reinigung, oft unter Narkose, ist der erste Schritt, um den Biofilm physikalisch abzubauen und die bakterielle Last zu reduzieren. Die systematische Verwendung von Tris-EDTA als Vorbehandlung wird nicht mehr zu einer Option, sondern zu einer Notwendigkeit, um zu versuchen, eine Empfindlichkeit, auch nur teilweise, gegenüber Antibiotika wiederherzustellen.
Die Wahl der topischen Wirkstoffe sollte kreativ sein und auf den wenigen verbleibenden Optionen basieren. Silbersulfadiazin ist in diesem Kontext oft eine ausgezeichnete empirische Wahl. Die extemporane Herstellung topischer Lösungen auf Basis injizierbarer Antibiotika wie Ticarcillin oder Amikacin kann in Betracht gezogen werden, obwohl die Stabilität dieser Zubereitungen ein Problem darstellt. Die systemische Antibiotikatherapie, wenn absolut notwendig, muss sorgfältig durch das Antibiogramm geleitet werden und die Erwägung von Reserveantibiotika nach einer strengen Bewertung des Nutzen-Risiko-Verhältnisses.
5.2. Biofilm-Disruption: Die Rolle von N-Acetylcystein (NAC)
Die Anerkennung des Biofilms als Festung zum Schutz von Bakterien hat den Weg für die Suche nach “Anti-Biofilm”-Wirkstoffen geebnet. N-Acetylcystein (NAC), ein bekanntes Mukolytikum, hat sich als sehr vielversprechender Kandidat erwiesen. In vitro-Studien haben gezeigt, dass NAC nicht nur eine direkte antibakterielle Aktivität gegen Otitis-Erreger, einschließlich P. aeruginosa, besitzt, sondern vor allem in der Lage ist, die Biofilm-Matrix zu stören, sie abzubauen und so die darin enthaltenen Bakterien freizulegen.
Die in vitro-Daten sind überzeugend: NAC hemmt das Wachstum von P. aeruginosa bei minimalen Hemmkonzentrationen (MHK) von 5 bis 20 mg/ml, Werte, die als sicher gelten und bei topischer Anwendung erreichbar sind. Seine Kombination mit Tris-EDTA könnte eine synergistische Wirkung bieten, wobei Tris-EDTA die Bakterienwand schwächt, während NAC die extrazelluläre Matrix abbaut. Obwohl prospektive klinische Studien noch erforderlich sind, um ihre in vivo-Wirksamkeit zu validieren, stellt NAC eine adjuvante therapeutische Option von großem Interesse für chronische und Biofilm-Infektionen dar, ergänzend zu antimikrobiellen Behandlungen.
5.3. Innovative Therapien: Phagentherapie als vielversprechende Alternative
Angesichts der Sackgasse der Antibiotikaresistenz wendet sich die wissenschaftliche Gemeinschaft radikal anderen Ansätzen zu, und die Phagentherapie ist eine der vielversprechendsten. Diese Technik verwendet Bakteriophagen (oder Phagen), Viren, die die natürlichen Räuber von Bakterien sind. Sogenannte “lytische” Phagen infizieren ein spezifisches Zielbakterium, vermehren sich darin und lassen es dann platzen (Lyse), wobei Dutzende neuer Viruspartikel freigesetzt werden, die bereit sind, benachbarte Bakterien zu infizieren.
Die Vorteile dieses Ansatzes sind vielfältig. Phagen besitzen eine hohe Spezifität, indem sie nur das pathogene Bakterium angreifen, ohne die nützliche Mikroflora des Wirtes zu beeinträchtigen. Sie haben die Fähigkeit, sich am Infektionsort selbst zu replizieren, solange ihr Ziel vorhanden ist. Vor allem sind sie gegen multiresistente Bakterien wirksam, da ihr Wirkmechanismus völlig unabhängig von der Antibiotika-Empfindlichkeit ist. Darüber hinaus produzieren viele Phagen Enzyme, die in der Lage sind, die Matrix von Biofilmen abzubauen, wodurch sie in diese Schutzstruktur eindringen können.
Die Phagentherapie ist derzeit ein äußerst aktives Forschungsgebiet in der Veterinärmedizin. In vitro-Studien und veröffentlichte Fallberichte haben sehr ermutigende Ergebnisse bei der Behandlung von Hautinfektionen, Otitiden und chirurgischen Wundinfektionen durch P. aeruginosa MDR bei Hunden und Katzen gezeigt. Klinische Studien sind im Gange, um die Wirksamkeit und Sicherheit von Phagen-Cocktails streng zu bewerten. Die synergistische Kombination von Phagen und Antibiotika wird ebenfalls untersucht, wobei der Phage die Bakterienpopulation schwächt und sie anfälliger für Antibiotika macht.
Der Kampf gegen P. aeruginosa MDR veranschaulicht eine wichtige strategische Entwicklung. Wir gehen von einer Logik der “rohen Gewalt”, bei der wir nach immer stärkeren Antibiotika suchen, zu einer Logik der “asymmetrischen Kriegsführung” über, die darauf abzielt, die strukturellen und biologischen Schwächen des Bakteriums auszunutzen. Anstatt zu versuchen, die Mauern der Festung mit einem größeren Rammbock zu durchbrechen, zielen die neuen Strategien darauf ab, den Mörtel aufzulösen, der die Steine zusammenhält (NAC), oder spezialisierte Agenten zu entsenden, die die Verteidigung umgehen können (Phagen). Die Zukunft der Behandlung dieser Infektionen liegt wahrscheinlich nicht in einem einzigen “Super-Antibiotikum”, sondern in der Kunst, diese neuen Waffen intelligent zu kombinieren, um die ausgeklügelten Abwehrmechanismen dieses gewaltigen Gegners zu zerlegen.
Schlussfolgerung und zukünftige Forschungswege
Die Behandlung von Pyodermien und Otitiden durch Pseudomonas aeruginosa beim Hund stellt ein Paradigma der modernen Infektionsmedizin dar, bei dem das Verständnis der Biologie des Erregers und seiner Wechselwirkungen mit dem Wirt der Schlüssel zum therapeutischen Erfolg ist. Diese Synthese hat gezeigt, dass P. aeruginosa kein einfacher Infektionserreger ist, sondern ein hochanpassungsfähiger opportunistischer Erreger, dessen effektives Management die bloße Verschreibung von Antibiotika transzendiert. Der Erfolg basiert auf einem ganzheitlichen und sorgfältigen Ansatz, dessen Säulen sind: eine präzise und hierarchische Diagnose, die durch Zytologie eingeleitet wird; die zwingende Kontrolle der zugrunde liegenden primären Ursache und der Entzündung; eine aggressive topische Therapie, die mechanische Reinigung und Potenzierungsmittel wie Tris-EDTA kombiniert; und eine umsichtige und begründete Verwendung systemischer Antibiotikatherapie, geleitet durch ein Antibiogramm, das im Lichte der neuesten Standards und pharmakodynamischen Konzepte interpretiert wird.
Die Ära der empirischen und verlängerten Antibiotikatherapie geht zu Ende und wird durch einen strategischen Ansatz ersetzt, der das Management des Haut- und Ohr-Ökosystems integriert. Viele Fragen bleiben jedoch bestehen, und wichtige Herausforderungen, insbesondere die zunehmende Multiresistenz, erfordern kontinuierliche und innovative Forschung. Mehrere zukünftige Forschungswege erscheinen als vorrangig, um die klinische Versorgung zu verbessern:
- Entwicklung und klinische Validierung synergistischer topischer Formulierungen: Es ist entscheidend, prospektive, randomisierte und kontrollierte klinische Studien durchzuführen, um die in vivo-Wirksamkeit von Formulierungen zu bewerten, die Anti-Biofilm-Wirkstoffe (wie N-Acetylcystein) und Antimikrobiotika kombinieren. Der Nachweis einer klinischen Synergie würde die Etablierung neuer Behandlungsstandards für chronische Infektionen ermöglichen.
- Klinische Studien zur Phagentherapie: Die Phagentherapie stellt eine vielversprechende Alternative dar, aber ihr Potenzial muss durch strenge Studien validiert werden. Die Erstellung von Banken gut charakterisierter Phagen und die Durchführung klinischer Studien zur Bewertung der Wirksamkeit und Sicherheit von Phagen-Cocktails zur Behandlung von P. aeruginosa MDR-Infektionen sind eine absolute Priorität.
- Studie des Ohrmikrobioms: Ein besseres Verständnis der Dysbiose, die der Besiedlung durch P. aeruginosa vorausgeht und diese begünstigt, ist notwendig. Die Analyse des Ohrmikrobioms bei gesunden und atopischen Hunden könnte die Identifizierung von Risikomarkern und die Erforschung des Potenzials von Mikrobiom-modulierenden Therapien wie topischen Probiotika zur Prävention ermöglichen.
- Entwicklung von Schnelldiagnosewerkzeugen: Die Entwicklung von Point-of-Care-Schnelltests, die innerhalb weniger Minuten nicht nur das Vorhandensein von P. aeruginosa nachweisen, sondern auch wichtige genetische Resistenzmarker, würde eine viel frühere gezielte Therapie ermöglichen, die Prognose verbessern und den Selektionsdruck begrenzen.
- Pharmakokinetik und Pharmakodynamik topischer Behandlungen: Die Daten zur Diffusion und Persistenz topischer antimikrobieller Wirkstoffe im entzündeten Gehörgang und in Gegenwart von Biofilm sind erstaunlich selten. Gezielte PK/PD-Studien sind erforderlich, um Konzentrationen, Formulierungen und Verabreichungshäufigkeiten zu optimieren, um die Wirksamkeit zu maximieren und die Entstehung von Resistenzen zu minimieren.
Zusammenfassend bleibt Pseudomonas aeruginosa zwar ein gewaltiger Gegner, aber ein besseres Verständnis seiner Biologie in Verbindung mit einem rigorosen klinischen Ansatz und der Integration innovativer Therapien bietet ermutigende Perspektiven, um die Prognose dieser komplexen Erkrankungen erheblich zu verbessern.
Literatur
Buckley, L. M., McEwan, N. A., & Nuttall, T. (2013). Tris-EDTA significantly enhances antibiotic efficacy against multidrug-resistant Pseudomonas aeruginosa in vitro. Veterinary Dermatology, 24(5), 519-e122.
Carlotti, D. N., Ghibaudo, G., & Damborg, P. (2010). In vitro antimicrobial activity of a commercial ear antiseptic containing chlorhexidine and Tris-EDTA. Veterinary Dermatology, 21(3), 282-286.
Cole, L. K., Kwochka, K. W., Kowalski, J. J., & Hillier, A. (2008). Comparison of enrofloxacin and marbofloxacin for the treatment of canine Pseudomonas otitis. Veterinary Therapeutics, 9(2), 141-151.
Fusconi, G., Ghibaudo, G., & Damborg, P. (2011). In vitro activity of a commercial ear antiseptic on planktonic and biofilm-embedded Pseudomonas aeruginosa. Veterinary Dermatology, 22(4), 366-372.
Hattab, J., et al. (2021). Prevalence of five virulence genes in Pseudomonas aeruginosa isolates from canine infections. Journal of Applied Microbiology, 130(5), 1548-1556.
Hawkins, C., Harper, D., & Soothill, J. (2010). Topical treatment of Pseudomonas aeruginosa otitis of dogs with a bacteriophage mixture: a before/after clinical trial. Veterinary Microbiology, 146(3-4), 309-313.
Hillier, A., et al. (2023). Revision of the CLSI antimicrobial susceptibility testing breakpoints for enrofloxacin and marbofloxacin in dogs. American Journal of Veterinary Research, 84(11).
May, E. R., Conklin, K. A., & Bemis, D. A. (2016). Antibacterial effect of N-acetylcysteine on common canine otitis externa isolates. Veterinary Dermatology, 27(3), 188-e47.
Morris, D. O., et al. (2023). A retrospective study of the primary causes of Pseudomonas otitis in 60 dogs. Journal of Small Animal Practice, 64(4), 241-247.
Nuttall, T., & Cole, L. K. (2007). Evidence-based veterinary dermatology: a systematic review of interventions for treatment of Pseudomonas otitis in dogs. Veterinary Dermatology, 18(2), 69-77.
Pye, C. (2018). Surgical management of end-stage otitis in dogs. Veterinary Clinics: Small Animal Practice, 48(1), 75-91.
Robinson, A., et al. (2019). Genomic and phenotypic characterisation of Pseudomonas aeruginosa isolates from canine otitis externa. Frontiers in Microbiology, 10, 1234.
Secker, B., et al. (2023). A multinational European survey of Pseudomonas aeruginosa isolates from canine otitis: antimicrobial resistance, biofilm formation, and virulence gene profiles. Frontiers in Microbiology, 14, 1526843.
Wright, A., Hawkins, C., Änggård, E. E., & Harper, D. R. (2009). A controlled clinical trial of a therapeutic bacteriophage preparation in chronic otitis due to antibiotic-resistant Pseudomonas aeruginosa; a preliminary report of efficacy. Clinical Otolaryngology, 34(4), 349-357.
Yoon, J., & Park, C. (2024). In vitro synergistic efficacy of N-acetylcysteine with antimicrobial agents against Pseudomonas aeruginosa isolated from dogs with otitis externa. Korean Journal of Veterinary Research, 64(1), e5.