Dermatozoonosen bilden eine vielfältige Gruppe von Hautkrankheiten, die zwischen Wirbeltieren und Menschen übertragen werden können. Obwohl diese Pathologien im Vergleich zu allen bekannten Zoonosen relativ selten sind, stellen sie ein erhebliches Gesundheitsproblem dar, insbesondere im städtischen Umfeld, wo die Nähe zu Haustieren zunimmt.
Der praktizierende Tierarzt an der Schnittstelle zwischen Tier- und Humanmedizin spielt eine entscheidende Rolle bei der Erkennung, Behandlung und Prävention dieser Krankheiten.
Die enge Beziehung zwischen Mensch und Tier bringt zwar unbestreitbare psychologische und soziale Vorteile mit sich, setzt aber auch Besitzer und Tierärzte verschiedenen übertragbaren Krankheitserregern aus. Diese Dermatozoonosen, die mykotischen, parasitären, bakteriellen oder viralen Ursprungs sein können, erfordern besondere Wachsamkeit und einen kollaborativen Ansatz zwischen Ärzten und Tierärzten für eine optimale Versorgung der Patienten, ob zweibeinig oder vierbeinig.
Definition und Klassifizierung von Dermatozoonosen
Dermatozoonosen stellen eine spezifische Untergruppe des weiten Feldes der Zoonosen dar. Sie werden definiert als Krankheiten oder Infektionen, die natürlicherweise von Wirbeltieren auf den Menschen und umgekehrt übertragbar sind und sich beim Menschen klinisch durch Hautläsionen manifestieren, mit Ausnahme von generalisierten allergischen Reaktionen. Dieser Begriff leitet sich von den griechischen Wurzeln “zoo” (Tier) und “nosos” (Krankheit) ab, wurde im 19. Jahrhundert von Virchow konzeptualisiert und 1959 von der Weltgesundheitsorganisation präzisiert.
Im städtischen Umfeld sind die Hauptwirbeltiere, die für diese Erkrankungen verantwortlich sind, Haustiere – domestizierte Fleischfresser wie Hunde und Katzen, aber auch Nagetiere und Hasentiere, die zunehmend in unseren Haushalten präsent sind. Die exponierten Populationen umfassen nicht nur Tierhalter, sondern auch verschiedene Risikoberufe: Tierärzte und ihr Personal, Züchter, Hundefriseure und andere Fachleute, die regelmäßig mit diesen Tieren in Kontakt stehen.
Klassifizierung nach Übertragungsweise
Die Weltgesundheitsorganisation schlägt eine Klassifizierung von Zoonosen in vier verschiedene Kategorien vor, basierend auf ihren Übertragungsweisen:
- Orthozoonose oder direkte Zoonose: Der kausale Erreger benötigt nur eine Wirbeltierart für seine Erhaltung, obwohl er mehrere Arten befallen kann. Diese Art ermöglicht die Übertragung auf den Menschen. Die Mehrheit der klassischen Infektionskrankheiten wie Tollwut, Milzbrand oder Brucellose gehört zu dieser Kategorie.
- Cyclozoonose: In diesem Fall umfasst der biologische Kreislauf mehrere Wirbeltierarten, aber nur eine davon ist für die menschliche Kontamination verantwortlich. Die Echinokokkose veranschaulicht diesen Prozess perfekt, mit ihrem Kreislauf, der Hunde und Pflanzenfresser einschließt, wobei der Hund als Kontaminator des Menschen fungiert.
- Metazoonose: Diese Kategorie erfordert den Durchgang durch einen Wirbellosen, in der Regel ein Arthropode, der die Übertragung auf den Menschen ermöglicht. Arbovirosen wie Gelbfieber (auf Affen und Beuteltieren erhalten und dann durch Mücken auf den Menschen übertragen), Rickettsiosen und Leishmaniose fallen in diese Klassifikation.
- Saprozoonose: Diese Krankheiten erfordern den Durchgang des kausalen Erregers in die äußere Umgebung. Die Fasciolose veranschaulicht diesen Mechanismus, mit der Reifung der Zerkarien, die für die Furkokerkariendermatose verantwortlich sind.
Diese systematische Klassifikation ermöglicht ein besseres Verständnis der epidemiologischen Zyklen und fördert somit die Umsetzung von Präventionsstrategien, die an jede Art der Übertragung angepasst sind.
Mykotische Dermatozoonosen
Pilzinfektionen, die zwischen Tier und Mensch übertragbar sind, stellen ein wichtiges Kapitel der Dermatozoonosen dar. Diese Erkrankungen, hauptsächlich vertreten durch Dermatophytosen und Sporotrichose, verdienen aufgrund ihrer Prävalenz und ihres potenziellen Einflusses auf die menschliche Gesundheit besondere Aufmerksamkeit.
Dermatophytosen
Dermatophytosen, allgemein als “Ringelflechte” bezeichnet, sind oberflächliche infektiöse Mykosen, die durch epidermotrophe, keratinophile und keratinolytische Pilze – die Dermatophyten – verursacht werden. Diese Pilze haben die Besonderheit, sich von Keratin zu ernähren, einem Protein, das Bestandteil von oberflächlichen Strukturen wie Haaren, Nägeln und der Hornschicht der Epidermis ist.
Zoophile Dermatophyten tierischen Ursprungs stellen eine Hauptquelle für Dermatozoonosen dar. Drei Hauptarten sind zu berücksichtigen:
- Microsporum canis: Das Hauptreservoir ist die Katze (seltener der Hund, insbesondere die Rasse Yorkshire Terrier, und andere kleine Säugetiere). Diese Art ist für etwa 95 % der felinen Dermatophytosen und 65 % der kaninen Fälle verantwortlich.
- Trichophyton mentagrophytes: Sein Reservoir bilden Nagetiere, Hasentiere und Equiden. Der Prozentsatz der asymptomatischen Träger variiert erheblich je nach Art: etwa 15 % bei Meerschweinchen, 10 bis 40 % bei Kaninchen und fast 50 % bei Maus und Ratte.
- Trichophyton verrucosum: Hauptsächlich bei Wiederkäuern gefunden.
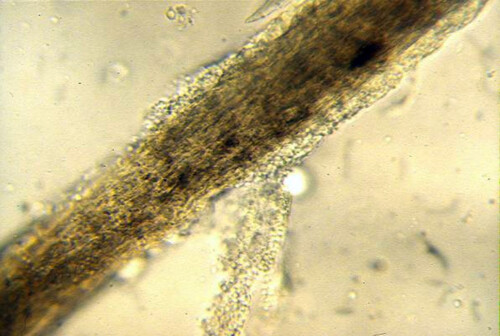
Befallenes Haar
Die meisten Dermatophyten weisen eine enge Anpassung an eine Zielart auf, bei der sie im Allgemeinen nur wenige klinische Anzeichen hervorrufen. Bei der Katze liegt die Inzidenz asymptomatischer Träger von M. canis beispielsweise bei etwa 10 %, kann aber bei streunenden Katzen oder bestimmten Rassen wie Persern deutlich höhere Prozentsätze erreichen. Alarmierend ist, dass etwa 50 % der Personen, die mit einer infizierten Katze in Kontakt kommen, egal ob asymptomatisch oder klinisch krank, Hautläsionen entwickeln.
Klinisches Bild bei Tieren
Bei der Katze sind die klassischen Läsionen von M. canis durch einzelne oder multizentrische, erythematöse, nicht juckende, schuppige Haarausfälle mit zentrifugalem Wachstum gekennzeichnet. Bevorzugte Lokalisationen sind Gesicht, Ohren und Pfoten. Eine späte Diagnose kann eine lokale oder generalisierte Alopezie zeigen, die manchmal von juckender Entzündung begleitet wird. In einigen Fällen ist lediglich ein keratoseborrhoischer Zustand am Rücken und Lendenbereich sichtbar. Onychomykosen durch M. canis sind selten, während Mycetome ausschließlich bei immungeschwächten Tieren und bei der Perserkatze auftreten.
Beim Hund werden neben M. canis drei weitere Arten gefunden: T. mentagrophytes, M. persicolor (beide zoophile Erreger) und M. gypseum (geophiler Erreger). Es gibt bestimmte Rasseprädispositionen: Yorkshire Terrier scheinen besonders anfällig für generalisierte Ringelflechte durch M. canis zu sein, während Terrier (Foxterrier und andere Jagdhunde) eine erhöhte Anfälligkeit für Gesichts-Dermatophytose durch T. mentagrophytes und M. persicolor aufweisen.
Die Mehrheit der betroffenen Hunde zeigt klassische Läsionen: einzelne oder multizentrische, runde, leicht schuppige Haarausfälle, die sich zentrifugal entwickeln und im Allgemeinen wenig jucken. Bevorzugte Lokalisationen sind Gesicht und distale Gliedmaßen. Kerione (entzündliche eitrige Knotenläsionen) werden regelmäßig beobachtet, insbesondere bei T. mentagrophytes.
Bei Nagetieren und Hasenartigen, die als Haustiere immer beliebter werden, ist der fast ausschließliche Erreger T. mentagrophytes, seltener M. canis. Klinisch manifestieren sich Dermatophytosen durch zentrifugale Haarausfälle, oft juckend und stark entzündlich.
Diagnose von Dermatophytosen
Die Diagnose basiert auf einem vielfältigen Ansatz:
- Untersuchung mit der Wood-Lampe: Eine typische grüne Fluoreszenz der kontaminierten Haare ist in 50 % der Fälle von M. canis beobachtbar. Diese Technik erfordert jedoch eine gewisse Erfahrung, um die spezifische Fluoreszenz von Artefakt-Fluoreszenzen zu unterscheiden.
- Direkte mikroskopische Untersuchung von Haaren und Schuppen: Sie kann eine Veränderung des Haarschafts zeigen, der von Sporenkragen umhüllt ist (Haarinvastion vom endo-ectothrix-Typ im Falle von M. canis).
- Mykologische Kultur: Sie ermöglicht die definitive Identifizierung des verantwortlichen Dermatophyten. Bei asymptomatischen Trägern kann die Probenahme durch Bürsten der gesamten Körperoberfläche mit einer sterilen Zahnbürste oder einem sterilen Teppichquadrat erfolgen und anschließend auf Sabouraud-Agar kultiviert werden.
Behandlung und Prävention
Die Behandlung ist zwingend erforderlich, auch wenn eine spontane Heilung möglich ist (obwohl sie mehrere Monate oder sogar Jahre dauern kann). Die therapeutische Wirksamkeit hängt von der Berücksichtigung zweier wesentlicher Faktoren ab:
- Die hohe Ansteckungsfähigkeit von Dermatophytosen
- Die langanhaltende Resistenz der Sporen in der Umwelt (mehrere Jahre)
Der therapeutische Ansatz kombiniert:
- Topische Behandlung: Scheren (je nach Fall diskutiert), Shampoos und Bäder auf Basis von Enilconazol oder Miconazol in Kombination mit Chlorhexidin
- Systemische Behandlung: Griseofulvin, Ketoconazol, Itraconazol
- Umweltbehandlung: Enilconazol oder Bleichmittel
Die Behandlung muss bis zur mykologisch bestätigten Heilung durch Negativierung der Kulturen fortgesetzt werden, mit zwei negativen Kontrollen im Abstand von einem Monat. In der Zucht bleibt das Hauptproblem die ständige Rekontamination aufgrund der hohen Sporenlast in der Umgebung, wodurch eine Ausrottung trotz sanitärer Leerstände praktisch unmöglich wird. Idealerweise sollte in nicht befallenen Zuchten jedes neue Tier in Quarantäne gehalten werden, bis eine negative mykologische Kultur vorliegt.
Auswirkungen auf den Menschen
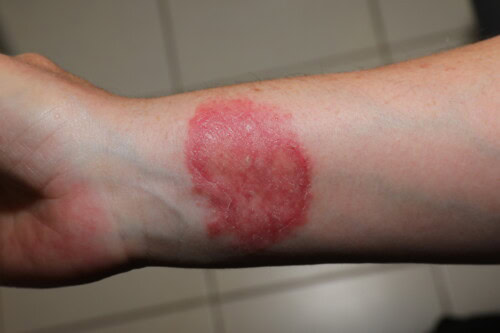
Beim Menschen zeichnen sich Dermatophytosen tierischen Ursprungs durch einen bemerkenswerten klinischen Polymorphismus aus:
- Erythematös-schuppige Läsionen der Kopfhaut (hauptsächlich verursacht durch M. canis)
- Kreisförmige erythematös-schuppige Läsionen unbehaarter Stellen, oft polyzyklisch mit vesikulär-schuppigem Rand (M. canis, T. mentagrophytes)
- Krustige und schmerzhafte Läsionen mit schwerer Entzündungsreaktion (Kerion) der Kopfhaut, des Nackens oder des Bartes (Sycosis), hauptsächlich verursacht durch T. mentagrophytes, seltener M. canis
Menschliche Kontamination bei Ringelflechte
Es ist wichtig zu beachten, dass die Ringelflechte in der Tabelle Nr. 46 der Berufskrankheiten (Hautmykosen) aufgeführt ist. Gemäß dem Arbeitsgesetzbuch und den europäischen Richtlinien fallen die Pflichten des Arbeitgebers in den Bereich der Prävention von Berufsrisiken, spezifischer gesetzlicher Maßnahmen, Hygiene- und Sicherheitsmaßnahmen sowie der medizinischen Überwachung.
Sporotrichose
Sporotrichose ist eine tiefe Mykose mit hohem zoonotischem Potenzial, verursacht durch einen dimorphen Pilz, Sporothrix schenckii. Dieser Erreger besitzt eine bemerkenswerte Eigenschaft: Er existiert in filamentöser Form in der Umgebung (verrottende Pflanzen, Humus, Boden) und verwandelt sich nach dem Eindringen in die Gewebe des Wirtes durch eine Hautverletzung in eine Hefe.
Kontaminationswege
Während Stiche und Verletzungen durch verunreinigte pflanzliche Materialien den klassischen Kontaminationsweg darstellen, ist die infizierte Katze eine besonders besorgniserregende Kontaminationsquelle. Tierhalter, Tierärzte und ihr Personal sind einem erheblichen Risiko ausgesetzt, wenn sie bei der Handhabung des kranken Tieres durch bestehende Hautläsionen und Exsudate in Kontakt kommen.
Ein charakteristisches Merkmal dieser Infektion ist der unterschiedliche Pilzgehalt je nach Wirtsart: Beim Hund oder Menschen ist der Pilz in den Läsionen in geringer Menge vorhanden, während bei der Katze die Pilzelemente extrem hohe Konzentrationen erreichen. Die Übertragung auf den Menschen erfolgt hauptsächlich durch Hauttrauma: Biss oder Kratzer einer kontaminierten Katze.
Es ist zu beachten, dass die canine Sporotrichose, die seltener ist als ihr feliner Gegenstück, bisher nicht mit nachgewiesenen Fällen menschlicher Kontamination in Verbindung gebracht wurde.
Klinische Präsentation bei Tieren
Bei Hunden und Katzen wurden drei verschiedene klinische Formen beschrieben, mit einer variablen Inkubationszeit von einer Woche bis zwei Monaten:
- Kutane-lymphatische Form (80% der Fälle): Sie zeichnet sich an der Inokulationsstelle durch die progressive Entwicklung eines einzelnen Knotens aus, der anfänglich asymptomatisch, dann ulzeriert ist und sich im Gesicht oder an einem Extremitätenende befindet. Weitere ulzerierte und fistulierende Knoten können entlang der Lymphgefäße auftreten.
- Strikt kutane Form (seltener): Die bevorzugten Lokalisationen sind die Gliedmaßenenden, die noduläre Läsionen oder Bereiche mit Depilation und erhöhten Rändern, Ulzerationen und Krusten aufweisen.
- Generalisierte Form: Hauptsächlich bei immungeschwächten Katzen beobachtet, resultiert sie aus der hämatogenen Ausbreitung der infektiösen Sporen.
Diagnose und Behandlung
Die Diagnose basiert auf der zytologischen Untersuchung von Hautabstrichen und Biopsien, die bei der Katze eine bemerkenswerte Fülle von Pilzelementen zeigen. Die mykologische Kultur bestätigt die Diagnose.
Die Behandlung basiert auf der Verabreichung von systemischen Antimykotika, wobei Itraconazol und Fluconazol bevorzugt werden. Bei systemischen Formen liefert Amphotericin B ausgezeichnete Ergebnisse. Die Behandlung muss mindestens einen Monat nach der scheinbaren klinischen Heilung fortgesetzt werden. Bei der Katze sind zusätzlich zur systemischen Fungizidbehandlung strenge hygienische Maßnahmen unerlässlich:
- Sorgfältige Reinigung der Hände und Arme mit antimykotischen Substanzen (Chlorhexidin, Povidon-Jod)
- Obligatorisches Tragen von Schutzhandschuhen
- Klare Information der Besitzer über das große zoonotische Risiko
Aufgrund des hohen Übertragungsrisikos und der langen Behandlungsdauer kann bei infizierten Katzen eine Euthanasie legitim in Betracht gezogen werden.
Manifestationen beim Menschen
Beim Menschen variiert die Inkubationszeit von drei Wochen bis drei Monaten. Die kutan-lymphatische Form, die am häufigsten vorkommt, äußert sich an der Inokulationsstelle durch einen fortschreitenden Knoten, der zunächst asymptomatisch ist und dann ulzeriert, typischerweise am Handrücken, einem Finger, einem Fuß oder im Gesicht lokalisiert.
Parasitäre Dermatozoonosen
Hauterkrankungen parasitären Ursprungs, die zwischen Tier und Mensch übertragbar sind, stellen eine heterogene, aber wichtige Gruppe der Dermatozoonosen dar. Diese Parasitosen, die verschiedene Milben, Insekten oder Helminthen betreffen, weisen sowohl bei Tieren als auch beim Menschen unterschiedliche klinische Bilder auf.
Die Räudeformen
Sarkoptesräude
Die Sarcoptes-Räude stellt eine hochansteckende Akarose dar, die durch die Proliferation von Sarcoptiformes Milben, Sarcoptes scabiei var. canis, in der Epidermis verursacht wird. Ihre Bedeutung in der Veterinär- und Human-Dermatologie leitet sich aus ihrer zunehmenden Häufigkeit, ihrer klinischen Schwere und ihrem nachgewiesenen zoonotischen Potenzial ab.
Die Hauptarten, die von Sarcoptes scabiei var. canis betroffen sind, sind Hunde, Füchse und Frettchen, gelegentlich aber auch Katzen, Menschen und Pferde. Der Entwicklungszyklus zeichnet sich bei günstigen Umweltbedingungen durch seine Schnelligkeit aus (10 bis 13 Tage). Die Weibchen, extrem produktiv, legen täglich 2 bis 3 Eier (ca. 50 Eier pro Weibchen) für 2 bis 4 Wochen. Nach der Befruchtung graben sie Epidermishöhlen (im Gegensatz zu den bei menschlichen Sarkoptes beobachteten Gängen), um dort ihre Eier abzulegen.
Diese Eier schlüpfen in 2-3 Tagen und setzen sechsbeinige Larven frei, die sich zu Nymphen und dann zu Adulten entwickeln. Die Sarcoptes ernähren sich von epidermalen Geweben (Histophagen). Ihre Überlebensdauer in der Außenumgebung ist auf etwa 10 Tage begrenzt, was spezifische Bedingungen erfordert (15-25°C, relative Luftfeuchtigkeit zwischen 25 und 85%).
Die Sarkoptesräude wird beim Hund nach wie vor unterdiagnostiziert. Sie betrifft hauptsächlich junge Hunde unter einem Jahr, insbesondere in Gemeinschaftsumfeldern (Zwinger, Tierheime), kann aber auch erwachsene oder ältere Hunde erreichen, die durch eine interkurrente Erkrankung geschwächt sind.
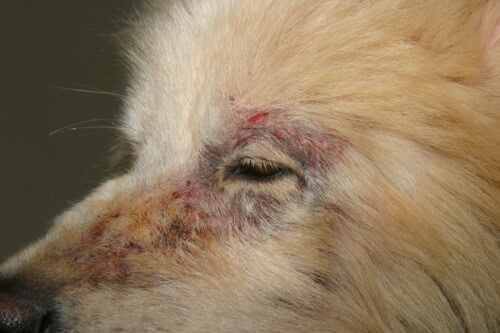
Sarkoptesräude mit Gesichtsbeeinträchtigung
Die pathogene Wirkung von Sarcoptes scabiei var. canis äußert sich durch verschiedene Mechanismen:
- Mechanische und chemische Wirkungen (Inokulation von vasodilatatorischen und gerinnungshemmenden Proteinen)
- Antigene Wirkung (Exkremente, Häutungsprodukte, Speichel)
- Induktion von Hypersensibilitätsphänomenen der Typen I, IV und III
Eine Überempfindlichkeitsreaktion vom Typ III kann Ablagerungen von Immunkomplexen in verschiedenen Organen, insbesondere den Nieren, verursachen, was zu Glomerulonephritis führt. Diese systemische Dimension rechtfertigt es, die canine Sarkoptes-Räude als eine allgemeine und nicht nur dermatologische Erkrankung zu betrachten.
Klinisch, nach einer variablen Inkubationszeit (ca. 3 Wochen nach Kontakt), zeigt das klassische Bild eine Kombination aus:
- Intenser Juckreiz mit positivem Ohr-Pfoten-Reflex
- Erythematöse und papulöse Läsionen (“Krätzebeulen”)
- Patchy Haarausfall
- Krustenbildung
Die Läsionsverteilung ist zu Beginn der Entwicklung charakteristisch und betrifft vorrangig das Gesicht (freie Ränder der Ohrmuscheln), die Gliedmaßen (Ellenbogen) und das Brustbein. Systemische Manifestationen können bei altem Befall oder bei älteren Hunden auftreten: Hyperthermie, Anorexie, Abmagerung, Polyurie/Polydipsie sekundär zur immunologischen Glomerulonephritis.
Atypische Formen werden zunehmend berichtet:
- Begrenzte, kaum juckende und wenig ansteckende frustrane Formen
- “Norwegische Krätze” gekennzeichnet durch dicke, kompakte Schuppen, mäßigen Juckreiz und das massive Vorhandensein von Sarkoptes in verschiedenen Entwicklungsstadien in Hautabschabungen (typischerweise bei immungeschwächten Tieren)
Die Diagnose ist manchmal schwierig. Die mikroskopische Untersuchung tiefer Hautgeschabe, die in den Prädilektionszonen durchgeführt werden, zeigt die Parasiten oder ihre Spuren (Sarkoptes, Eier, Exkremente) nur in etwa 50 % der Fälle. Die serologische Diagnose stellt eine Alternative dar, mit einer Sensitivität und Spezifität von etwa 80-90 %. Bei starkem klinischem Verdacht ohne parasitologische Bestätigung wird eine Therapaversuch nach dem Prinzip “if you suspect it, treat it” empfohlen.
Die Behandlung umfasst zwei Ansätze:
- Topische Akarizide (verdünntes Amitraz)
- Systemische Akarizide als Spot-on (Selamectin oder Moxidectin)
Die zoonotische Dimension ist signifikant, da menschliche Kontaminationen in 25 bis 50 % der Fälle von Räude bei Hunden beobachtet werden. Die Inkubationszeit beim Menschen beträgt 8 bis 15 Tage, was zu einem Prurigo des Rumpfes, der Arme und der Beine führt. Charakteristischerweise werden keine Krätzegänge beobachtet, im Gegensatz zur Humanräude.
Dies erklärt sich dadurch, dass Sarcoptes scabiei var. canis beim Menschen nicht länger als 15 bis 20 Tage überleben kann, aufgrund einer engen Wirtsspezifität. Der Parasit ist in der menschlichen Haut nicht in der Lage, sich zu vermehren (Fehlen von eierlegenden Weibchen in der Epidermis, keine Gänge) und bleibt oberflächlich, ohne bohrende oder antigene Wirkung.
Folglich reicht die geeignete Behandlung des räudigen Tieres normalerweise aus, um die Symptome beim Menschen zu beseitigen – die Sarcoptes-Räude wird als “Hemizoonose” betrachtet, bei der der Parasit in der menschlichen Haut schnell stirbt, ohne sich dort zu vermehren. Ein Fortbestehen menschlicher Symptome sollte eine hartnäckige Kontaminationsquelle vermuten lassen: ein unbehandeltes oder schlecht behandeltes Tier, ein nicht identifizierter asymptomatischer Artgenosse oder das Überleben der Parasiten in der Umwelt.
Notoedres-Räude
Notoedres-Räude ist eine ansteckende Akarose, die hauptsächlich Katzen, Ratten und Hamster betrifft. Sie wird durch die Vermehrung von psorischen Milben der Familie Sarcoptidae auf der Oberfläche und in der Epidermis verursacht: Notoedres cati bei Katzen und Notoedres muris bei Nagetieren.
Diese Erkrankung ist in der französischen Metropole bei Katzen relativ selten, aber häufiger in Übersee-Départements und -Gebieten (Réunion, Antillen) sowie in Italien, Slowenien und Spanien. Bei Hamstern und Ratten ist sie eine der häufigsten juckenden Dermatosen.
Der biologische Zyklus der Notoedres ist vergleichbar mit dem der Sarkoptes, mit einer ausgeprägten Ansteckungsfähigkeit, insbesondere durch direkten Kontakt, die potenziell Katzen, Hunde und Menschen befallen kann. Dieser Befall kann enzootisch oder epizootisch mit einer erheblichen Morbidität auftreten. Zu den Sensitivitätsfaktoren gehören das junge Alter (Kätzchen), die Immunsuppression (FeLV- oder FIV-positive Katzen) und bei Nagetieren der Status als Jungtier oder trächtiges Weibchen.
Klinisch beginnen bei Katzen die Läsionen in der Regel im Gesicht (Nasenrücken, Lippen, Augenlider, Ohrmuscheln), bevor sie sich auf die Gliedmaßen sowie die Perianal- und Bauchregion ausbreiten. Sie äußern sich in diffusen erythematösen und schuppigen Alopezien, die sich schnell zu Krustenbildungen entwickeln. Der Juckreiz ist normalerweise intensiv.
Bei Hamstern umfassen die Hautmanifestationen Krustenbildung, die bevorzugt an Maul, Ohrmuscheln und Gliedmaßenenden lokalisiert ist, mit häufigem Genitalbefall. Der Juckreiz variiert von mäßig bis intensiv.
Bei der Ratte ist die Läsionsverteilung begrenzter, beschränkt auf den freien Rand der Ohrmuscheln und das Maul, in Form von pseudotumorösen Warzen. Papulokrustöse Läsionen werden typischerweise am Schwanz beobachtet, aber eine Generalisierung ist ungewöhnlich. Die Intensität des Juckreizes variiert von mäßig bis schwer.
Menschliche Kontaminationen, deren genaue Inzidenz schwer einzuschätzen ist, führen zu Hauterscheinungen, die denen der Sarkoptesräude des Hundes ähneln: Prurigo des Rumpfes, der Arme und Beine. Wie bei Sarcoptes scabiei var. canis können sich Notoedres nicht in der menschlichen Haut vermehren (Fehlen ovigerer Weibchen in der Epidermis und von Gängen) und bleiben oberflächlich, ohne bohrenden Einfluss oder signifikante antigene Reaktion. Die Heilung der Räude beim Tier führt daher in der Regel zur Heilung beim Menschen, da diese Notoedres-Räude ebenfalls als Hemizoonose betrachtet wird.
Die Diagnose, die relativ einfach ist, basiert auf der Identifizierung von Notoedres in verschiedenen Entwicklungsstadien (Adulte, Nymphen, Larven, Eier) und ihren Exkrementen bei Hautgeschaben.
Die Behandlung erfolgt mit systemischen Akariziden (Avermectine und Milbemycine), wobei alle Tiere der Gruppe behandelt werden müssen, unabhängig davon, ob sie klinische Anzeichen zeigen oder nicht.
Trixacarus-Räude
Die Trixacarus caviae-Räude ist eine ansteckende Akarose, die spezifisch für Meerschweinchen (und gelegentlich Mäuse) ist und durch eine psorische Milbe der Familie Sarcoptidae verursacht wird. Die auslösenden Faktoren bleiben weitgehend ungeklärt, wobei die Kontaminationsbedingungen oft diskret sind und die Inkubationszeit variiert.
Die Rekonstruktion der Infektionsgeschichte ist oft komplex, da die Kontamination häufig dem Erwerb der Tiere vorausgeht. Diese Meerschweinchen beherbergen wahrscheinlich eine kleine Anzahl von Parasiten ohne klinische Manifestation, bis Umweltveränderungen (Fütterung, Lebensraum, Überbevölkerung) oder eine Verschlechterung des Gesundheitszustands eine Parasitenvermehrung über die pathogene Schwelle hinaus verursachen.
Bemerkenswerterweise führt das Vorhandensein schwer betroffener Tiere nicht systematisch zur Kontamination von Artgenossen im Kontakt, was auf eine individuelle Komponente in der Anfälligkeit für den Befall hindeutet.
Das klinische Bild kombiniert einen konstanten, frühen und oft intensiven Juckreiz mit schnell generalisierten Läsionen: Erythem, Papeln, Schuppen, die sich zu ausgedehnten krustösen Formationen entwickeln. Die Verteilung kann lokal-regional oder generalisiert sein. Der Allgemeinzustand kann sich bei chronischem Verlauf verschlechtern, mit Apathie, Anorexie, Abmagerung und manchmal tödlichem Ausgang.
Regelmäßig gemeldete menschliche Kontaminationen resultieren aus einem häufigen und längeren Kontakt mit dem kranken Tier. Infektionsepisoden wurden insbesondere in Schulkantinen beschrieben, an denen Kinder im Kindergartenalter beteiligt waren, die Kontakt zu einem schwer erkrankten Meerschweinchen hatten.
Beim Menschen äußert sich diese Skabies in einer papulösen, juckenden Dermatose (Prurigo-Typ), die hauptsächlich Arme, Hals und Beine betrifft. Wie bei anderen tierischen Skabiesformen reicht die geeignete Behandlung des Tieres in der Regel aus, um die menschlichen Symptome zu beheben, da diese Trixacarus-Skabies ebenfalls eine Hemizoonose ist, bei der sich der Parasit in der menschlichen Haut nicht vermehren kann.
Das therapeutische Protokoll basiert auf der Anwendung topischer oder systemischer Akarizide (Avermectine oder Milbemycine), wobei alle Artgenossen obligatorisch behandelt werden müssen. Eine Reinigung und Entmilbung der Umgebung vervollständigen die Behandlung.
Cheyletiellosen
Cheyletiellosen sind eine Gruppe von parasitären Dermatosen, die durch Milben der Gattung Cheyletiella, der Familie der Cheyletidae, verursacht werden. Drei Hauptarten werden identifiziert, jede mit einer Vorliebe für einen bestimmten Wirt: Cheyletiella yasguri (Hund), Cheyletiella blakei (Katze) und Cheyletiella parasitivorax (Kaninchen).
Diese Milben weisen besondere biologische Merkmale auf: Die Adulten legen Eier an der Basis der Haare ab und ernähren sich von Hautpartikeln und Gewebeflüssigkeiten. Im Gegensatz zu anderen oberflächlichen Ektoparasiten können sich Cheyletiellen in epidermale Ablagerungen, sogar in die Hornschicht, eingraben und Taschen bilden. Ihre Beweglichkeit auf der Haut ist bemerkenswert.
Es handelt sich um obligate Parasiten, die ihren gesamten Lebenszyklus auf ihrem Wirt durchlaufen, mit einer Entwicklungsdauer von etwa 35 Tagen. Die Übertragung erfolgt hauptsächlich durch direkten Kontakt mit klinisch erkrankten oder asymptomatischen Tieren, aber auch indirekt über die Umwelt, wo die Weibchen bis zu 10 Tage überleben können. Interspzifische Kontaminationen sind möglich, und das Überleben könnte unter günstigen Umweltbedingungen (relativ niedrige Temperatur, hohe Luftfeuchtigkeit, moderate Helligkeit) verlängert werden. Die Parasiten können das Liegeflächen der Tiere, die Ritzen in Wänden und Parkettböden kontaminieren, manchmal sogar in Abwesenheit von Tieren.
Cheyletiellosen betreffen hauptsächlich junge Tiere (Welpen und Kätzchen aus Zwingern oder Katzenzuchten), aber auch erwachsene Hunde (häufig asymptomatische Träger) und erwachsene Katzen. Einige Rasseprädispositionen wurden beobachtet: Zwerghunderassen (Yorkshire Terrier, Bichon, Pudel) und bei Katzen die Perserkatze.
Das klinische Bild variiert je nach Art und Alter:
- Beim Welpen: starker Juckreiz mit positivem Ohr-Pfoten-Reflex und ausgeprägter Schuppenbildung an Kopf, Rücken und Lenden
- Beim Kätzchen: diskrete Symptome, beschränkt auf eine pityriasiforme Schuppenbildung am Rücken und Lendenbereich
- Bei der erwachsenen Katze: stärkere entzündliche Hautläsionen mit juckender papulokrustöser Dermatitis
- Beim Kaninchen: oft asymptomatischer Befall oder juckende und schuppige Dermatose, hauptsächlich am Rumpf
Die menschliche Kontamination ist häufig (>50 % der Fälle) und tritt in der Regel bei C. blakei und C. yasguri auf. Diese oft unterschätzte Übertragung resultiert hauptsächlich aus direktem Kontakt mit dem parasitierten Tier (klinisch erkrankt oder asymptomatischer Träger), kann aber auch indirekt erfolgen.
Beim Menschen treten die klinischen Manifestationen schnell auf, bereits am zweiten Tag nach dem Kontakt, in Form von stark juckenden Papeln, die an den Unterarmen, den Ellbogenbeugen und den Armen, der Brust, dem Bauch und den Oberschenkeln lokalisiert sind.
Die Diagnose, die im Allgemeinen einfach ist, basiert auf dem Nachweis von Cheyletiellen durch Hautgeschaben, Bürsten oder “Klebebandtests” und der mikroskopischen Beobachtung von Schuppen und Ablagerungen. Die Visualisierung der Parasiten ist beim Hund (Adulte, Nymphen, Eier) in der Regel einfach, aber bei der Katze schwieriger, wo Adulte selten identifiziert werden und nur Eier an der Haarbasis beobachtet werden können. Beim Kaninchen sind die parasitären Formen leicht nachweisbar.
Die spezifische Behandlung kombiniert:
- Topische oder systemische Akarizide (Avermectine oder Milbemecine)
- Längere Behandlung (mindestens acht Wochen) aufgrund der Resistenz der Eier gegen Akarizide
- Obligatorische Behandlung aller in Kontakt gekommenen Tiere
- Umweltbehandlung
Die Isolation und geeignete Behandlung der Tiere führt in der Regel zur spontanen Rückbildung der Läsionen beim Menschen, da sich Cheyletiellen in der menschlichen Haut nicht vermehren können.
Pulikosen
Flohbefall (Pulicosen) ist eine der häufigsten Ektoparasitosen bei Hunden und Katzen. Die vorherrschende Art ist Ctenocephalides felis felis – “der Katzenfloh” – seltener Ctenocephalides canis. Obwohl Pulicosen nicht streng als Zoonosen im eigentlichen Sinne betrachtet werden, rechtfertigen ihre Häufigkeit und ihre schädlichen Folgen für den Menschen ihre Aufnahme in diese Analyse der Dermatozoonosen.
Flöhe sind aphaniptere (flügellose), lateral abgeflachte Insekten. Die adulten, kosmopolitischen und sesshaften Parasiten verbringen die meiste Zeit auf dem Wirtstier. Ihr biologischer Zyklus weist mehrere Besonderheiten auf: Die Weibchen beginnen innerhalb von 24 bis 48 Stunden nach ihrer ersten Blutmahlzeit, ihre Eier auf dem Wirt abzulegen. Diese Eier mit glatter Oberfläche fallen in die Umgebung, wo die Entwicklung stattfindet (Eier, drei Larvenstadien, Nymphenstadium).
Der vollständige Zyklus dauert unter optimalen Bedingungen etwa drei Wochen, kann aber unter ungünstigen Umweltbedingungen verlangsamt werden. Ein entscheidendes Element der Epidemiologie ist die Fähigkeit vonprä-emergierten Adulten (noch in den Nymphenkokons), mehrere Monate in der Umwelt zu persistieren und ein erhebliches Parasitenreservoir zu bilden. Diese Adulten schlüpfen unter dem Einfluss spezifischer Reize (Vibrationen, Licht, chemische Signale) und bilden das, was gemeinhin als “Parkettflöhe” bezeichnet wird.
Flohbefall ist bei gesunden Tieren in der Regel unauffällig. Gesunde Hunde unterliegen einem moderaten Parasitendruck, und die Flohpopulation wird auf natürliche Weise durch Selbstputzverhalten (Beißen, Lecken) und Kratzbewegungen begrenzt, die die Parasiten aus dem Fell vertreiben. Diese Besonderheit erklärt die gelegentliche Schwierigkeit, Parasiten bei infizierten Tieren nachzuweisen.
Die krankhaften Folgen von Pulicosis umfassen zwei Dimensionen:
- Eine mechanische Hautirritation durch wiederholte Stiche und die Bewegung der Parasiten
- Die Entwicklung einer Dermatitis durch Hypersensitivität auf Flohbisse (DHPP) bei einigen sensibilisierten Individuen, die die häufigste allergische Dermatose sowohl bei Katzen als auch bei Hunden darstellt
Beim Hund äußert sich die DHPP durch einen Haarausfall im Rücken-Lenden-Bereich, der mit Erythem, Papeln und Krusten sowie im Allgemeinen intensivem Juckreiz einhergeht. Ohne adäquate Behandlung sind sekundäre infektiöse Komplikationen häufig. Bei der Katze zeichnet sich das Bild durch eine juckende Papulokrusten-Dermatitis, eosinophile Plaques und/oder einen Haarausfall im Rücken-Lenden-Bereich aus.
Die Übertragung auf den Menschen erfolgt hauptsächlich bei massivem Befall, wenn die Überbevölkerung die Flöhe zwingt, den Wirt zu wechseln. Es ist zu beachten, dass die direkte Übertragung adulter Flöhe zwischen Tieren oder auf den Menschen relativ begrenzt ist (durchschnittlich 10 bis 15 %). Die menschliche Kontamination stammt hauptsächlich von jungen, frisch aus den Kokons geschlüpften Adultflöhen, die aktiv einen verfügbaren Wirt suchen, egal welcher Art.
Beim Menschen befällt die Flohspeichelallergiedermatitis (DHPP) bevorzugt die Gliedmaßen (Knöchel, Handgelenke) und kann sich bei Kindern auf den Rumpf ausbreiten. Die Läsionen, die intensiv jucken, erscheinen als urtikarielle Papeln, quaddelartige Plaques oder transiente Bläschen. Ein sekundäres Impetigo durch Kratzen und bakterielle Superinfektionen wird manchmal beobachtet.
Die Diagnose von Pulikose basiert auf der direkten Identifizierung adulter Flöhe oder deren Exkremente, entweder mit bloßem Auge oder durch Bürsten mit einem speziellen Flohkamm. Bei der DHPP stützt sich die Diagnose auf suggestive anamnestische Daten (saisonale Dermatose, Vorhandensein mehrerer Hunde/Katzen in der Umgebung) und kompatible klinische Läsionen (juckende Dermatose im Rücken-Lenden-Bereich). Paradoxerweise ist bei Tieren mit DHPP der sichtbare Flohbefall oft minimal.
Beim Hund können Intradermaltests mit Flohgesamtextrakten eine DHPP durch positive Sofortreaktionen nach 20 Minuten und/oder verzögerte Reaktionen nach 48 Stunden bestätigen, obwohl ihr Fehlen die Diagnose nicht ausschließt. Diese Tests gelten bei Katzen als wenig zuverlässig.
Die Behandlung von Pulikosen und DHPP sollte niemals bagatellisiert werden und erfordert einen ganzheitlichen Ansatz:
- Beseitigung der Flöhe auf dem erkrankten Tier
- Obligatorische Behandlung der mitbetroffenen Tiere
- Sanierung der Umwelt
Diese integrierte Strategie erfordert oft eine enge Zusammenarbeit mit dem Besitzer, um ein effektives Kontrollprogramm zu etablieren. Die Flohkontrolle am Tier basiert auf der Verwendung von langwirksamen Adulteziden, während die Bekämpfung nicht-parasitärer Stadien in der Umwelt Insektenwachstumsregulatoren und Umweltadultezide erfordert. Ergänzende mechanische Maßnahmen (methodische Reinigung, Beseitigung ökologischer Nischen) sind ebenfalls unerlässlich.
Helminthische Dermatozoonosen
Kutane Larva migrans
Das Phänomen der kutanen Larva migrans (LMC) wird in der französischen Metropolregion hauptsächlich bei Personen beobachtet, die aus tropischen Regionen zurückkehren, wo streunende Hunde die Strände mit ihrem Kot kontaminieren. Diese Hunde, in der Regel nicht medizinisch versorgt und nicht entwurmt, sind häufig von Ancylostomatiden (Ancylostoma spp. und Uncinaria spp.), Verdauungsnematoden, die bei ihnen hämorrhagische Gastroenteritis verursachen, befallen. Die jüngste Beschreibung einer Enzootie von Larva migrans zu Ankylostoma in der Bretagne erfordert jedoch eine erhöhte Wachsamkeit auf dem französischen Festland.
Die Hautmanifestationen sind mit dem transkutanen Eindringen von inffektiösen L3-Larven verbunden. Klinisch äußern sie sich in Papeln, die oft krustös und juckend, manchmal pustulös sind und bevorzugt an dünnhäutigen Stellen (Bauch) und Gliedmaßen (Zwischenzehenräume und Handflächen) lokalisiert sind. Diese relativ unspezifischen Anzeichen erfordern eine genaue Anamnese, die einen möglichen Kontakt mit kontaminierten Umgebungen (Zwingerhaltungs-Hund, ländliches Umfeld, Jagdhund) nahelegt.
Neben den Hautmanifestationen kann der Befall auch Atemwegssymptome im Zusammenhang mit der Larvenwanderung (Bronchopneumonie) hervorrufen, die oft unterdiagnostiziert werden. Verdauungsstörungen (hämorrhagische Enteritis) und allgemeine Symptome (Abmagerung, Anämie) werden bei chronischem Befall regelmäßig beobachtet.
Kontaminationsquellen sind Hunde (und Katzen) als Träger sowie feuchte Böden, die mit infektionsfähigen L3-Larven kontaminiert sind. Schlecht gepflegte Zwinger mit Erdboden bilden eine ideale Umgebung für die Larvenentwicklung, was die besondere Anfälligkeit von Jagdhunden erklärt. Zu beachten ist auch die Möglichkeit einer indirekten Infektion durch Aufnahme von Small Animals (Kleinnagern) durch Hunde, die selbst L3-Larven aufgenommen haben.
Die Diagnose von transkutanen Migrationen ist oft schwierig. Der direkte Nachweis von L3-Larven durch Hautgeschabe ist selten erfolgreich. Die histopathologische Untersuchung von Hautbiopsien kann solche Migrationen nahelegen (eosinophiler Infiltrat und gelegentlich Vorhandensein von Larven). Die koproskopische Untersuchung ermöglicht in der Regel die leichte Identifizierung der Eier, die oft zahlreich sind.
Die Prävention und Kontrolle umfassen einen mehrstufigen Ansatz:
- Zerstörung kontaminierter Umgebungen
- Regelmäßige und vernünftige Entwurmung, insbesondere von trächtigen Hündinnen (Anthelmintika mit larvizider Wirkung)
- Wiederaufbau von verunreinigten Erd-Zwingern
- Tägliches Aufsammeln der Exkremente
- Wöchentliche intensive Reinigung mit Kresol
Beim Menschen produziert die in die Haut eindringende Larve einen charakteristischen wurmförmigen Ausschlag. Dieser Befall stellt jedoch einen parasitischen Blindgang dar, wobei die Läsionen in der Regel spontan innerhalb weniger Wochen bis Monate zurückgehen.
Furkokerkariendermatose oder Schwimmer-Dermatitis
Die Furcocerkarialdermatitis, auch als Schwimmerdermatitis (oder Badegästdermatitis) bekannt, stellt eine saisonale Dermatozoonose (Juni bis September) dar, die zunehmend häufiger auftritt. Diese Metazoonose wird durch das epidermale Eindringen von Larven eines Trematoden, Trichobilharzia ocellata, eines Parasiten der Ente, verursacht, manchmal ungenau als “Entenfloh” bezeichnet. Die Kontamination erfolgt beim Baden in Süßwasser, insbesondere in Seegebieten (Annecy-See, Bourget-See, Genfersee, Schweizer und italienische Seen).
Der parasitische Zyklus beinhaltet den Trematoden T. ocellata, einen Verdauungsparasiten der Ente, der im Kot ausgeschieden wird. Diese Trematoden werden dann von Wasserschnecken der Gattung Lymnaea, insbesondere Lymnaea stagnalis, aufgenommen. Die Zerkarien (Larvenformen) werden später ins Wasser freigesetzt, wo sie beim Baden die Ente (Endwirt) sowie den Menschen oder den Hund (akzidentelle Wirte) kontaminieren können.
Obwohl der Hund ähnliche Läsionen wie der Mensch aufweisen kann, ist es wichtig zu betonen, dass der Mensch sich in keinem Fall von einem erkrankten Hund anstecken kann.
Beim Menschen ist das klinische Bild durch eine eruptive, stark juckende, makulo-papulöse Dermatitis gekennzeichnet, die an den exponierten Stellen lokalisiert ist. Das plötzliche Auftreten der Papeln erfolgt in der Regel innerhalb von 10 bis 30 Minuten nach dem Eintauchen in Süßwasser. Der Verlauf ist günstig, mit spontaner Heilung innerhalb von 2 bis 3 Wochen, obwohl eine symptomatische Behandlung (Antihistaminika oder Dermokortikoide) häufig erforderlich ist.
Die sanitäre Prophylaxe beruht auf der Unterbrechung des biologischen Zyklus des Parasiten, was die Beseitigung von Schnecken und Enten aus den betroffenen Gewässern einschließt. Da die Beseitigung von Mollusken besonders schwierig ist, wird Badegästen empfohlen, Bereiche mit flachem Wasser und reicher Wasservegetation, einem bevorzugten Lebensraum für Schnecken, zu meiden.
Die Leishmaniose
Die Leishmaniose ist eine durch Inokulation übertragbare infektiöse Protozoonose, gekennzeichnet durch die intrazelluläre Vermehrung eines begeißelten Protozoons, Leishmania infantum, in den Zellen des mononukleären Phagozytensystems. Die Übertragung erfolgt durch den Stich von Sandmücken, wobei der Hund das Hauptreservoir darstellt. In Frankreich konzentrieren sich die Enzootieherde des Hundes hauptsächlich im Südosten, am Mittelmeer, von der italienischen bis zur spanischen Grenze und vom Meeresspiegel bis etwa 800 Meter Höhe.
Obwohl der Parasit auch bei Fuchs und Katze isoliert wurde, scheint ihre epidemiologische Rolle marginal zu sein. Jüngste Entdeckungen haben zudem andere Übertragungswege aufgedeckt: Nadelnwechsel unter Heroinsüchtigen, Kontamination durch Blutprodukte, was auf die gelegentliche Existenz eines anthropozoonotischen Zyklus hindeutet.
Beim Hund präsentiert sich die Leishmaniose als eine allgemeine Krankheit mit bemerkenswertem klinischem Polymorphismus. Epidemiologische Erhebungen in den Alpes-Maritimes und der Region Marseille zeigen, dass etwa jeder zweite Leishmaniose-Hund asymptomatischer Träger ist. Obwohl die Erkrankung bei dieser Art systemisch ist, äußert sie sich hauptsächlich durch Hautläsionen, die niemals isoliert auftreten, sondern mit verschiedenen klinischen Anzeichen verbunden sind:
- Polyadenomegalie (häufig)
- Splenomegalie (seltener)
- Beeinträchtigung des Allgemeinzustandes (Asthenie, faziale Muskelatrophie)
- Verschiedene Komplikationen: bilaterale Uveitis, Arthritis, Glomerulonephritis (manchmal einzige klinische Manifestation, mit ungünstiger Prognose)
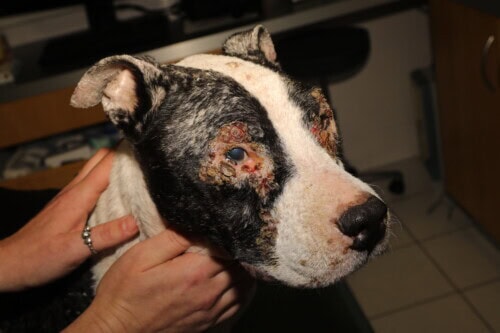
Die Hautläsionen, die typischerweise chronisch verlaufen, weisen eine große morphologische Vielfalt auf:
- Generalisierte exfoliative Dermatose, die Kopf, Ohrmuscheln und Gliedmaßen betrifft
- Ulzerationen an den Pfoten und Druckstellen
- Depigmentation des Nasenspiegels (primär oder sekundär zu Ulzera)
- Verdickung des Nasenspiegels und/oder der Fußballen
- Nicht ulzerierte Noduli, einzeln oder multipel (insbesondere bei bestimmten Rassen wie Boxer oder Dobermann)
- Generalisierte sterile pustulöse Dermatitis
Hundeleishmaniose
Beim Menschen äußert sich die Leishmaniose als systemische Erkrankung, die hauptsächlich Kinder und immungeschwächte Erwachsene betrifft. Sie kann auch in streng kutaner Form auftreten, mit Läsionen, die an der Inokulationsstelle lokalisiert sind, in der Regel an unbedeckten Stellen. Diese nodulären, ulzerierten und verkrusteten Läsionen sind charakteristischerweise schmerzlos, von variabler Größe und chronischem Verlauf.
- Direkter Nachweis des Parasiten durch Zytologie (Adenogramm, Myelogramm)
- Serologie (ELISA, indirekte Immunfluoreszenz)
- Genspezifische Amplifikation (PCR)
In Endemiegebieten wird ein jährliches systematisches Screening empfohlen, idealerweise nach der Expositionszeit (November bis Januar), unter Berücksichtigung der variablen, aber in der Regel mehrmonatigen Inkubationszeit.
Die Behandlung infizierter Hunde birgt viele Kontroversen. Denn selbst behandelte Tiere bleiben Träger des Parasiten. Da die viszerale Leishmaniose beim Menschen ohne Behandlung potenziell tödlich ist und in Enzootiegebieten zunehmend häufiger auftritt, scheint die Eliminierung des Parasitenreservoirs logisch. Dieser Ansatz würde jedoch verantwortungsbewusste Tierhalter, deren Tiere ordnungsgemäß medizinisch versorgt werden, benachteiligen, während eine unkontrollierte Hundepopulation bestehen bliebe. Paradoxerweise hat die systematische Euthanasie von infizierten Tieren, wenn sie angewendet wurde, nicht die erwarteten Ergebnisse erzielt und sogar zu einem Anstieg der menschlichen Fälle geführt.
Der Tierarzt spielt eine entscheidende Rolle bei der Aufklärung der Besitzer über die Risiken und die Notwendigkeit einer rigorosen klinischen und biologischen Überwachung.
Die Behandlung der caninen Leishmaniose basiert auf der Kombination von stibiierten Derivaten und Allopurinol, mit einer engen therapeutischen Überwachung. Trotz der Sensibilisierung der Besitzer entzieht sich ein Teil der Hunde unweigerlich der Kontrolle oder erhält eine intermittierende Selbstmedikation, was das ernste Problem der potenziellen Entstehung resistenter Stämme aufwirft. Folglich müssen Tierärzte auf die Verwendung einiger hochwirksamer Moleküle wie Amphotericin B verzichten, die für diese Indikation ausschließlich der Humanmedizin vorbehalten sein sollte.
Die Entwicklung eines Hundeimpfstoffs wäre die ideale Lösung zur epidemiologischen Kontrolle, stößt jedoch derzeit auf viele Hindernisse.
Bakterielle Dermatozoonosen
Benigne Lymphoretikulose oder Katzenkratzkrankheit
Die gutartige Lymphoretikulose, besser bekannt als Katzenkratzkrankheit (MGC) aufgrund ihres vorherrschenden Übertragungsweges, stellt beim Menschen eine subakute regionale Lymphadenopathie bakteriellen Ursprungs dar. Der kausale Erreger, Bartonella henselae (Familie der Bartonellaceae), wurde erst 1992 identifiziert. Einige Fälle könnten auch auf Bartonella clarridgeiae zurückgeführt werden. Die beiden bekannten Genotypen (I und II) von B. henselae sind an dieser Erkrankung beteiligt.
B. henselae ist zusammen mit B. quintana auch an der Ätiologie der bazillären Angiomatose und der Peliosis beteiligt, vaskulär-proliferative Erkrankungen, die hauptsächlich bei HIV-infizierten Patienten beobachtet werden.
Die Katze stellt das wichtigste, ja sogar einzige Reservoir des Bakteriums dar. Die Rolle des Hundes beim Tragen der Infektion scheint sehr begrenzt zu sein. Obwohl selten, wurden Fälle ohne direkte Exposition gegenüber einem Tier gemeldet, was auf andere mögliche Übertragungswege hindeutet (Floh- oder Zeckenstiche). Die menschliche Kontamination tritt in 70 % der Fälle nach Kratzern und in 10 % nach Katzenbissen auf. Ausnahmsweise könnte ein einfacher Kontakt (Streicheln, Küssen) die Kontamination einer bereits bestehenden Haut- oder Schleimhautwunde ermöglichen, wie es die manchmal bei Personen beobachtete okulo-ganglionäre Form zeigt, die sich wahrscheinlich das Auge gerieben haben, nachdem sie eine Katze gestreichelt hatten.
Die experimentelle Infektion bei der Katze führt schnell (weniger als eine Woche) zu einer verlängerten asymptomatischen Bakteriämie, die 2 bis 3 Monate oder länger bei einigen Tieren anhält (eine rezidivierende persistierende Bakteriämie wurde bei einer Katze über 22 Monate beobachtet). Einige Katzen weisen bemerkenswert hohe Bakteriämie-Level auf (über 10^6 KBE/ml Blut). Die Bakteriämie ist statistisch häufiger bei jungen Katzen (unter einem Jahr). B. henselae und B. clarridgeiae können dasselbe Tier koinfizieren. Vor kurzem wurden zwei neue Bartonella-Arten, B. koehlerae und B. weissii, bei Katzen in den Vereinigten Staaten isoliert, aber ihre pathogene Rolle bei der MGC muss noch nachgewiesen werden.
Epidemiologische Studien zeigen, dass ein erheblicher Anteil der getesteten Katzen bakteriämisch ist, wobei der Prozentsatz bei streunenden Katzen im Vergleich zu Hauskatzen höher ist. Verschiedene Erhebungen ergaben, dass die Raten bakteriämischer Katzen in streunenden Katzenpopulationen zwischen 16,5 % und 53 % variierten, davon etwa ein Drittel mit B. clarridgeiae infiziert.
Der Katzenfloh (Ctenocephalides felis felis) spielt eine übergeordnete Rolle bei der Übertragung der Infektion innerhalb dieser Art. B. henselae kann übrigens aus Flohlären von bakteriämischen Katzen isoliert werden. Der Floh eliminiert das Bakterium in seinen Exkrementen und kontaminiert somit das Fell des Tieres. Die Bakterien können sich im Verdauungstrakt des Insekts vermehren und in seinen Exkrementen überleben. Die Katze kontaminiert ihre Krallen während der Fellpflege und etabliert so die Übertragungskette auf den Menschen. Streunende Katzen, die häufiger infiziert sind, stellen eine Kontaminationsquelle für Hauskatzen dar.
Die Katzenkratzkrankheit ist eine ubiquitäre Erkrankung (geschätzt 22.000 menschliche Fälle pro Jahr in den USA und 2.000 in den Niederlanden im Jahr 2003), die alle Altersgruppen betreffen kann, aber hauptsächlich Kinder und junge Erwachsene. Die Hälfte der Fälle wird bei Kindern unter 15 Jahren gemeldet. Die bazilläre Angiomatose, eine schwere Form der Krankheit, wird hauptsächlich bei immungeschwächten Erwachsenen (insbesondere HIV-positiven Patienten) diagnostiziert. Die Katzenkratzkrankheit tritt in der Regel sporadisch auf, aber kleine familiäre Epidemien werden manchmal beschrieben.
Das klassische klinische Bild beginnt mit einer progressiven Adenopathie. An der Inokulationsstelle erscheint innerhalb einer Woche eine Papel, die sich zu einer Vesiko-pustel entwickelt. In über 90 % der Fälle bleibt diese initiale Läsion, die in 1 bis 3 Tagen heilt, unbemerkt. Normalerweise entwickelt sich 2 bis 3 Wochen später eine persistierende Lymphadenopathie, die bei 10 bis 30 % der Patienten zur Eiterung fortschreitet. Diese satellitäre Adenopathie, in 85 % der Fälle einzigartig, wird von einer leichten Hyperthermie begleitet. Die Läsionen bilden sich spontan zurück (was die Bezeichnung “gutartig” rechtfertigt) innerhalb mehrerer Wochen bis Monate, obwohl eine chronische Eiterung manchmal bestehen bleiben kann.
Die Katzenkratzkrankheit kann sich auch in verschiedenen atypischen Formen manifestieren, einschließlich des okuloglandulären Syndroms von Parinaud und anderen manchmal schwerwiegenden Manifestationen (Endokarditis, Enzephalitis, Sepsis, Purpura), selbst bei immunkompetenten Personen. Bei immungeschwächten Patienten stellen die bazilläre Angiomatose und die Peliosis die wichtigsten klinischen Manifestationen dar.
Die Diagnose stützt sich auf epidemiologische und klinische Kriterien. Die Differentialdiagnose umfasst andere Lymphadenopathien, die mit verschiedenen Allgemeinerkrankungen (Röteln, Tularämie) oder mit banalen Wunden, Biss- oder Kratzverletzungen, die durch unspezifische Bakterien oder durch Pasteurella spp. infiziert sind, zusammenhängen.
Die Überträger-Katzen bleiben klinisch gesund. Der Erreger kann nur bei einer bakteriämischen Katze durch Blutkultur und Identifizierung mittels PCR isoliert werden. Die Serologie ist ebenfalls verwendbar, aber eine positive Reaktion korreliert nicht notwendigerweise mit einer aktiven Bakteriämie.
Eine antibiotische Therapie, selbst wenn sie verlängert wird, scheint die Bakteriämie bei Katzen nicht zu eliminieren. Spezifische prophylaktische Maßnahmen bleiben daher begrenzt. Andererseits kann die regelmäßige Anwendung von Flohschutzmitteln die Kontamination des felinen Reservoirs reduzieren. Es sollte beachtet werden, dass das Entkrallen, das manchmal als präventive Maßnahme vorgeschlagen wird, keinen Nutzen hat.
Die Prävention basiert auf einer klaren Information von Risikopersonen (insbesondere immungeschwächten Patienten), der vernünftigen Flohbekämpfung bei Katzen, dem Händewaschen nach Tierkontakt und, wie bei allen durch Biss oder Kratzer übertragenen Krankheiten, der sofortigen Reinigung und Desinfektion von Wunden.
Pasteurellose
Tierische Pasteurellosen, die häufig bei vielen Arten (Wiederkäuer, Schweine, Geflügel, Hasentiere) vorkommen, äußern sich klinisch durch verschiedene Erkrankungen: Broncho- und Pleuropneumonien, subkutane Abszesse oder septischämische Formen (Hühnercholera).
Diese Infektionen werden auf den Menschen durch die üblichen Übertragungswege (direkte Kontakte, Nahrung, Inhalation) übertragen, der Hauptmechanismus ist jedoch die Inokulation durch Katzenbiss, Hundebiss, seltener Ratten- oder Kaninchenbiss. Dieser Biss kann von einem klinisch kranken Tier, häufiger aber von einem scheinbar gesunden Tier, verursacht werden, da Pasteurella spp. ein Kommensalbakterium der oberen Atem- und Verdauungswege vieler Tiere ist, das in 40 bis 80 % der Proben bei den betroffenen Arten isoliert wird.
Die bei gebissenen Personen isolierten Pasteurellen sind hauptsächlich P. multocida, P. canis und P. dagmatis. Fälle von menschlicher Pasteurellose ohne identifizierten Biss sind selten; sie umfassen Pneumonien, Pleuraergüsse, Perikarditiden, Endokarditiden, Arthritiden und Septikämien. Wenn eine Kontamination tierischer Herkunft durch Inhalation oder Ingestion möglich ist, könnte Pasteurella spp. auch beim Menschen wie beim Tier als Kommensale auf den Schleimhäuten überleben und ihre pathogenen Eigenschaften nur in Verbindung mit Erkrankungen oder schwächenden Krankheiten (Virusinfektionen, Krebs, urämisches Syndrom, Zirrhose) zum Ausdruck bringen. In diesen spezifischen Fällen wären diese Pasteurellosen nicht streng als Zoonosen zu betrachten.
Beim Menschen wird das klinische Bild von lokalisierten Formen mit kutanem Eintrittsportal dominiert. Akute Formen zeichnen sich durch intensive und frühe lokale Entzündungszeichen aus. Innerhalb weniger Stunden nach dem Eindringen des Keims wird die Wunde (oft anfänglich unauffällig) warm, rot, ödematös und sehr schmerzhaft; eine Eiterung in Form von einigen serösen Tröpfchen tritt schnell auf. Eine Lymphangitis und eine satellitäre Adenopathie sind häufig assoziiert.
Die subakuten lokal-regionalen Formen entwickeln sich anders: Nach ähnlichen oder diskreteren initialen Manifestationen treten schmerzhafte und persistierende, nicht-eitrige Tenosynovitiden in der Nähe der Inokulationsstelle oder metakarpophalangeale Arthropathien auf, begleitet von vasomotoren Störungen (Schweregefühl, Zyanose oder Blässe, Parästhesien).
Die klinische Diagnose basiert auf der schnellen Entwicklung einer ödematösen Entzündung der gebissenen Region. Die bakteriologische Isolierung aus dem Eiter muss frühzeitig auf gewöhnlichen Nährmedien erfolgen, die Ergebnisse sind jedoch variabel.
Die Behandlung von Inokulations-Pasteurellosen erfolgt mit Tetracyclinen. Die menschliche Prophylaxe ist angesichts der Unmöglichkeit, das Tierreservoir im ständigen Kontakt mit dem Menschen zu eliminieren, komplex. Angesichts der Häufigkeit von felinen Kontaminationen und der manchmal beobachteten funktionellen Folgen ist eine vorbeugende Maßnahme in Betracht zu ziehen, nämlich jeder gebissenen oder gekratzten Person sofort eine antibiotische Behandlung zu verabreichen, selbst wenn keine frühen klinischen Anzeichen vorhanden sind.
Virale Dermatozoonosen
Die Kuhpocken-Virusinfektion
Die Kuhpocken-Virose ist eine Viruserkrankung, die durch ein Orthopoxvirus, das Kuhpocken-Virus, verursacht wird und bei vielen Arten beschrieben wurde: Rind, Kamel, Büffel, Kaninchen, Katze und in jüngerer Zeit Ratte. Die Viren dieser Familie (Pocken, Kuhpocken, Vakzinia und Affenpocken) sind eng miteinander verwandt und gehören alle zur Gattung Orthopoxvirus. Diese Erreger lassen sich selbst aus Läsionen und infizierten Organen nur schwer isolieren.
Die Diagnose einer Orthopoxvirus-Infektion kann durch verschiedene Techniken gestellt werden:
- Elektronenmikroskopie
- Serologie
- Genamplifikation (PCR)
- DNA-Sequenzierung nach Isolierung oder Kultur zur genauen Identifizierung der Virusart
Aufgrund ihrer genetischen Nähe sind Verwechslungen bei der Identifizierung dieser Viren möglich.
Bei Katzen wird die Pockenvirusinfektion seit etwa 30 Jahren in Großbritannien, den Niederlanden, Belgien und Deutschland beobachtet. Ihre Präsenz in Frankreich wird seit 1999 regelmäßig gemeldet. Diese Infektion betrifft fast ausschließlich jagende Landkatzen. Die Kontamination stammt hauptsächlich von kleinen wildlebenden Nagetieren (Wühlmäuse, Spitzmäuse), seltener von Rindern.
Die Rötelmaus (Clethrionomys glareolus) und, in geringerem Maße, die Erdmaus (Microtus agrestis) spielen eine übergeordnete Rolle bei der Aufrechterhaltung der Infektion. Diese Nagetiere können das Virus auch auf andere Arten übertragen, die denselben natürlichen Lebensraum teilen (syntopisch), wie die Waldmaus (Apodemus sylvaticus), oder sogar Gerbils und Erdhörnchen in den östlichen Regionen. Fälle wurden auch bei aus Osteuropa importierten Ratten gemeldet. Die saisonale Zunahme der Fälle (Sommer und Herbst) entspricht dem Zeitraum der Hauptaktivität und Proliferation dieser kleinen Nagetiere.
Die Übertragung erfolgt hauptsächlich transkutan, manchmal auch oronasal.
Klinisch äußert sich die Infektion bei der Katze anfänglich durch eine einzelne makulöse und erythematöse Läsion am Kopf, Hals oder an den Vordergliedmaßen. Innerhalb von etwa zehn Tagen treten zahlreiche sekundäre juckende Läsionen auf: Makulen, Papeln, erythematöse Noduli, die allmählich ulzerieren und den gesamten Körper, einschließlich der Mundhöhle, betreffen können. Allgemeine Anzeichen (Fieber, Rhinitis, Konjunktivitis) werden häufig beobachtet.
Der Verlauf ist in der Regel günstig, mit spontaner Rückbildung der Sekundärläsionen innerhalb von 3 bis 8 Wochen. Komplikationen wie bakterielle Sekundärinfektionen oder retrovirale Koinfektionen können jedoch zu einer Generalisierung der Hautläsionen und einer manchmal tödlichen Pneumonie führen.
Bei der Ratte sind die Hautmanifestationen vergleichbar mit denen der Katze.
Die Übertragung auf den Menschen wurde sowohl von Katzen als auch von Ratten dokumentiert, wobei die Prognose bei immungeschwächten oder älteren Personen besonders ungünstig ist. Die Einstellung der Pockenimpfung könnte den Kreuzschutz gegen Pockenviren in der Allgemeinbevölkerung verringert haben, wodurch nicht geimpfte Personen, insbesondere wenn sie immungeschwächt sind, für diese Infektionen prädisponiert sind.
Beim Menschen sind die Hautmanifestationen der Kuhpocken nach einer Inkubationszeit von 2 bis 6 Tagen im Allgemeinen gutartig: papulöse, vesikuläre, umbilikierte und umgebene Läsionen, die sich im Gesicht, an den Händen, Armen und manchmal an den Schleimhäuten (insbesondere bei Kindern) befinden. Allgemeine Symptome (Fieber, Lymphadenopathie) begleiten den Ausschlag häufig. Bei immungeschwächten Patienten kann die Infektion einen schweren Verlauf nehmen, mit generalisierten pustulösen und hämorrhagischen Pocken, die potenziell tödlich sein kann.
Die Diagnose bei Tieren stützt sich hauptsächlich auf die Histopathologie von Hautbiopsien, die spezifische Läsionen von Pockenvirusinfektionen aufzeigen. Weniger verbreitete Techniken umfassen Elektronenmikroskopie, Serologie, Virusisolation und PCR.
Die Behandlung bei Katzen ist im Wesentlichen symptomatisch und zielt darauf ab, bakterielle Superinfektionen zu kontrollieren und trotz schmerzhafter Mundläsionen eine adäquate Ernährung aufrechtzuerhalten.
Die prophylaktischen Maßnahmen sind von grundlegender Bedeutung:
- Isolierung des kranken Katers, um eine Ansteckung unter Katzen zu vermeiden
- Euthanasie befallener Ratten
- Desinfektion der Umgebung (Bleichmittel) aufgrund der Virusresistenz
- Vorsichtsmaßnahmen bei der Handhabung (Handschuhe tragen), um das zoonotische Risiko zu begrenzen, insbesondere für gefährdete Personen (Immunschwache, Kinder, ältere Menschen)
Auswirkungen auf die öffentliche Gesundheit und Präventionsstrategien
Dermatozoonosen stellen, obwohl sie weniger Beachtung finden als andere systemische Zoonosen, ein nicht zu unterschätzendes Problem für die öffentliche Gesundheit dar, insbesondere im Kontext einer immer engeren Mensch-Tier-Beziehung. Eine retrospektive Untersuchung in einer tierärztlichen dermatologischen Praxis zeigt, dass fast 35 % der Besitzer das Bett mit ihrem Tier (Katze oder Hund) teilen und diese Gewohnheit beibehalten, selbst wenn sie selbst dermatologische Läsionen aufweisen, die ihrem Tier zuzuschreiben sind.
Diese Nähe, verbunden mit der Vielfalt potenziell übertragbarer Krankheitserreger, unterstreicht die Bedeutung eines koordinierten Präventionsansatzes zwischen Ärzten, Tierärzten und Tierhaltern.
Rolle des praktizierenden Tierarztes
Der praktizierende Tierarzt nimmt eine strategische Position an der Schnittstelle zwischen Tier- und Humanmedizin ein. Seine Rolle beschränkt sich nicht auf die Diagnose und Behandlung von Tierkrankheiten; sie erstreckt sich auf:
- Information des Besitzers über potenzielle zoonotische Risiken, die mit seinem Tier verbunden sind
- Aufklärung über Präventionsmaßnahmen, die an jede Situation angepasst sind
- Früherkennung von Erkrankungen mit zoonotischem Potenzial
- Umsetzung geeigneter Behandlungen, die nicht nur das Tier heilen, sondern auch die Übertragungskette auf den Menschen unterbrechen
- Zusammenarbeit mit Ärzten für eine ganzheitliche Betreuung von Fällen, die eine Übertragung auf den Menschen beinhalten
Diese Aufgabe im Bereich der öffentlichen Gesundheit erweist sich als besonders heikel, da sie die emotionale Bindung der Besitzer zu ihren Tieren mit den hygienischen Notwendigkeiten in Einklang bringen muss. Es ist oft illusorisch, die Verhaltensweisen des Zusammenlebens zwischen Besitzern und ihren Gefährten radikal ändern zu wollen, aber eine klare und objektive Information ermöglicht in der Regel die Annahme vernünftiger Vorsichtsmaßnahmen.
Besonders gefährdete Bevölkerungsgruppen
Einige Populationen weisen eine erhöhte Anfälligkeit für Dermatozoonosen auf und verdienen besondere Aufmerksamkeit:
- Immunsupprimierte Personen (Patienten unter Immunsuppressiva, HIV-positive Personen, Transplantatempfänger, Patienten unter Chemotherapie): Insbesondere die HIV-Infektion verleiht dem zoonotischen Risiko eine besondere Dimension, mit potenziell schwerwiegenderen Manifestationen von Krankheiten wie Sporotrichose, Leishmaniose, Pockenvirusinfektionen oder Tuberkulose.
- Kleinkinder: Ihr noch unreifes Immunsystem, verbunden mit Risikoverhalten (enger Kontakt mit Tieren, nicht systematische Händehygiene), setzt sie besonders aus.
- Ältere Menschen: Immunschwäche im Zusammenhang mit dem Alter
- Schwangere Frauen: spezifische Risiken im Zusammenhang mit bestimmten Krankheitserregern
- Fachleute im Tierkontakt: Tierärzte und ihr Personal, Züchter, Hundefriseure, Tierheimpersonal
Für diese Bevölkerungsgruppen müssen spezifische Empfehlungen formuliert werden, die von einfachen, verstärkten Hygienemaßnahmen bis hin zur vorübergehenden Vermeidung bestimmter Tierarten je nach klinischem Kontext reichen können.
Spezifische Präventionsstrategien
Für Dermatophytosen
- Screening asymptomatischer Träger in Tiergemeinschaften
- Isolation und frühzeitige Behandlung erkrankter Tiere
- Gründliche Desinfektion der Umgebung
- Vorsichtsmaßnahmen beim Erwerb neuer Tiere (insbesondere Kätzchen aus Zuchten oder Tierhandlungen)
- Besondere Sensibilisierung der Verantwortlichen von Kindereinrichtungen (Schulen, Kindergärten) bezüglich der Risiken von Klassentieren
Für Räude und andere Ektoparasitosen
- Regelmäßige antiparasitäre Behandlung von Haustieren
- Kontrolle der Populationen von streunenden Tieren
- Erhöhte Vorsichtsmaßnahmen bei der Adoption von Tieren aus Tierheimen
- Identifizierung und Behandlung aller Kontakttiere im Falle einer positiven Diagnose
Für Leishmaniose
- Jährliches Screening in Enzootiegebieten
- Verwendung von Repellentien gegen Sandmücken während der vektoriellen Aktivitätssaison
- Begrenzung der nächtlichen Ausflüge von Hunden in Endemiegebieten
- Rigrose Überwachung infizierter Hunde
- Klare Information der Besitzer über Risiken und Präventionsmaßnahmen
Für durch Biss oder Kratzer übertragene Krankheiten
- Aufklärung der Besitzer über den richtigen Umgang mit Tieren
- Sofortige Desinfektion jeder Wunde, auch der kleinsten
- Schnelle ärztliche Konsultation bei Auftreten von Entzündungszeichen
- Flohbekämpfungsprogramm zur Begrenzung der Übertragung von B. henselae bei Katzen
“One Health” Ansatz
Das Konzept “One Health” (Eine Gesundheit) erkennt die Interdependenz zwischen menschlicher Gesundheit, Tiergesundheit und Umweltgesundheit an. Dieser Ansatz gewinnt in der Verwaltung von Dermatozoonosen, die diese Vernetzung perfekt veranschaulichen, an Bedeutung.
Die enge Zusammenarbeit zwischen Ärzten und Tierärzten ist der Eckpfeiler einer effektiven Bewältigung dieser Krankheiten.
Diese Zusammenarbeit muss sich auf mehrere Achsen konzentrieren:
- Informationsaustausch über identifizierte Fälle und epidemiologische Entwicklungen
- Standardisierung der Diagnoseprotokolle, um Vergleiche zwischen menschlichen und tierischen Fällen zu erleichtern
- Koordination der therapeutischen Ansätze, um die Entstehung von Resistenzen zu vermeiden
- Gemeinsame Erarbeitung kohärenter Präventionsbotschaften für die Öffentlichkeit
- Kollaborative Forschung zu Übertragungsmechanismen und Risikofaktoren
Diese interprofessionelle Zusammenarbeit muss in einen breiteren Rahmen eingebettet sein, der auch Folgendes umfasst:
- Die Gesundheitsbehörden
- Diagnoselabore
- Forschungseinrichtungen
- Tierschutzverbände
- Zucht- und Zoohandelsfachleute
Nur ein solcher integrierter Ansatz ermöglicht eine optimale Bewältigung dieser Krankheiten an der Schnittstelle von Mensch und Tier.
Grundlegende Vorsichtsmaßnahmen
Einige grundlegende Vorsichtsmaßnahmen, die für alle Dermatozoonosen gelten, können Tierhaltern und Fachleuten empfohlen werden:
- Gründliche Händehygiene nach jedem Tierkontakt, insbesondere vor den Mahlzeiten
- Regelmäßige Entwurmung und externe Parasitenbehandlung von Haustieren
- Regelmäßige veterinärmedizinische Überwachung mit ausdrücklicher Erwähnung jeglichen Kontakts mit gefährdeten Personen
- Häufige Reinigung der Liegeplätze der Tiere
- Handschuhe tragen bei der Manipulation von Tieren mit Hautläsionen
- Vorübergehende Vermeidung enger Kontakte (Teilen des Bettes, Lecken des Gesichts) bei diagnostizierter Tierdermatose
- Schnelle ärztliche Beratung bei Auftreten von Hautläsionen beim Menschen nach Kontakt mit einem kranken Tier
Diese einfachen Maßnahmen, verbunden mit einer erhöhten Sensibilisierung der Besitzer für Warnzeichen, könnten die Inzidenz von Übertragungsfällen auf den Menschen signifikant reduzieren.
Schlussfolgerung
Dermatozoonosen bilden eine heterogene Gruppe von Hauterkrankungen, die zwischen Wirbeltieren und Menschen übertragbar sind, mit einer relativ geringen Prävalenz im Vergleich zu allen Zoonosen, aber einem potenziell signifikanten Einfluss auf die öffentliche Gesundheit. Mit Ausnahme einiger spezifischer Entitäten wie Sporotrichose, Katzenkratzkrankheit, Leishmaniose und Kuhpockenvirusinfektionen weisen diese Erkrankungen beim Menschen selten einen medizinisch schwerwiegenden Charakter auf, da der Mensch in der Regel eine parasitäre Sackgasse darstellt.
Die Heilung des betroffenen Besitzers, mit oder ohne Behandlung, ist jedoch zum Scheitern verurteilt, wenn die Kontaminationsquelle – das Tier – nicht identifiziert und adäquat behandelt wird. Diese Interdependenz unterstreicht die entscheidende Bedeutung eines koordinierten Ansatzes zwischen Veterinärmedizin und Humanmedizin.
Der praktizierende Tierarzt spielt in seiner strategischen Position an der Schnittstelle zwischen Mensch und Tier eine Schlüsselrolle bei der Früherkennung, der angemessenen Behandlung und der Prävention dieser Krankheiten. Seine Verantwortung geht über die Tierpflege hinaus und umfasst eine Dimension der öffentlichen Gesundheit, die Information, Aufklärung und Zusammenarbeit mit Ärzten beinhaltet.
Angesichts der zunehmenden Integration von Haustieren in Familien und der immer häufigeren engen physischen Kontakte gewinnt die Wachsamkeit gegenüber Dermatozoonosen an Bedeutung. Diese Nähe, obwohl Quelle unbestreitbarer psychologischer und sozialer Vorteile, erfordert eine adäquate medizinische Versorgung von Haustieren als unverzichtbares Korrelat ihrer familiären Integration.
Schließlich bietet der “One Health”-Ansatz, der die Vernetzung von menschlicher Gesundheit, Tiergesundheit und Umweltgesundheit anerkennt, einen relevanten konzeptuellen Rahmen für die Behandlung dieser Pathologien. Nur eine enge Zusammenarbeit zwischen allen beteiligten Akteuren – Tierärzten, Ärzten, Tierhaltern, Gesundheitsbehörden – wird es ermöglichen, die Übertragungsrisiken zu minimieren und gleichzeitig die Vorteile der Mensch-Tier-Beziehung zu erhalten.
FAQ
1. Zeigen Tiere, die zoonotische Keime tragen, immer identifizierbare klinische Anzeichen?
Nein, viele Tiere können asymptomatische Träger von auf den Menschen übertragbaren Krankheitserregern sein. Dies gilt insbesondere für Dermatophytosen (insbesondere bei der Katze), Leishmaniose (etwa 50 % der infizierten Hunde in Endemiegebieten sind asymptomatisch) oder die Katzenkratzkrankheit (bakteriämische Katzen zeigen in der Regel keine klinischen Anzeichen). Diese Besonderheit erschwert die Erkennung und rechtfertigt systematische Präventivmaßnahmen, insbesondere für Risikogruppen.
2. Wie kann man klinisch die verschiedenen Formen der Tierräude unterscheiden und ihr zoonotisches Potenzial bewerten?
Die verschiedenen Tierräudemilben (Sarcoptes, Notoedres, Trixacarus) weisen bei Tieren relativ ähnliche klinische Bilder auf (erythematös-schuppig-krustöse Läsionen und Juckreiz), unterscheiden sich aber in ihrer bevorzugten Verteilung und der betroffenen Tierart. Ihr zoonotisches Potenzial ist variabel: Alle können beim Menschen Läsionen hervorrufen, stellen aber in der Regel “Hemizoonosen” dar, bei denen der Parasit seinen vollständigen Zyklus in der menschlichen Haut nicht durchlaufen kann. Eine genaue parasitologische Diagnose durch Hautgeschabsel ist unerlässlich, um das Übertragungsrisiko zu bewerten und die Präventivmaßnahmen anzupassen.
3. Bieten kommerziell erhältliche präventive Antiparasitika für Haustiere einen vollständigen Schutz vor parasitären Dermatozoonosen?
Moderne externe Antiparasitika, insbesondere solche auf Basis von Isoxazolinen, Avermectinen oder Milbemycinen, bieten einen hervorragenden Schutz gegen die meisten ektoparasitären Erreger von Dermatozoonosen (Flöhe, Sarkoptes, Notoedres, Cheyletiellen). Ihre Wirksamkeit ist jedoch nicht absolut und hängt von zahlreichen Faktoren ab: Compliance der Behandlung, Abdeckung des Parasitenspektrums, aufkommende Resistenzen, individuelle Besonderheiten. Darüber hinaus bieten diese Behandlungen im Allgemeinen keinen Schutz gegen Pilz-, bakterielle oder virale Dermatozoonosen. Ein umfassender Präventionsansatz, der Antiparasitika, angemessene Hygiene und regelmäßige tierärztliche Überwachung kombiniert, bleibt daher unerlässlich.
4. Wie sollte man vorgehen, wenn ein Tier in einem Haushalt mit immungeschwächten Personen Hautläsionen aufweist?
In einer solchen Risikosituation sind mehrere Maßnahmen erforderlich: sofortige tierärztliche Konsultation zur präzisen Diagnose, vorübergehende Isolation des Tieres in einem eigenen Raum bis zur Abheilung der Läsionen, Tragen von Handschuhen bei notwendigen Manipulationen, gründliche Desinfektion der Kontaktflächen und verstärkte Händehygiene. Je nach Diagnose und Grad der Immunsuppression der betroffenen Person können strengere Maßnahmen in Betracht gezogen werden, immer in Absprache zwischen Tierarzt und behandelndem Arzt. In einigen speziellen Fällen, die hochpathogene Erreger wie Sporothrix schenckii bei einem schwer immungeschwächten Patienten betreffen, kann eine vorübergehende Trennung erforderlich sein.
5. Spiegelt der in den letzten Jahrzehnten beobachtete Anstieg der Dermatozoonosen ein tatsächliches Auftreten wider oder lediglich eine bessere Erkennung?
Die scheinbare Entwicklung der Inzidenz von Dermatozoonosen resultiert wahrscheinlich aus einer Kombination von Faktoren. Einerseits ermöglichen diagnostische Fortschritte und die erhöhte Sensibilisierung von Gesundheitsfachkräften eine bessere Identifizierung von Fällen. Andererseits begünstigen mehrere Faktoren ein tatsächliches Auftreten: Zunahme der Anzahl von Haustieren und Intensivierung des physischen Kontakts, Zunahme internationaler Reisen, die die Verbreitung neuer Krankheitserreger erleichtern, Wachstum immungeschwächter Populationen, die anfälliger für diese Infektionen sind, Umweltveränderungen, die die Parasitenzyklen beeinflussen, und das Auftreten von Resistenzen gegen antiparasitäre Behandlungen. Ein rigoroser epidemiologischer Ansatz, der Human- und Veterinärmedizin kombiniert, ist notwendig, um diese Trends genau zu quantifizieren und die Präventionsstrategien anzupassen.
Referenzen
- guaguère é. dermatozoonosen en milieu urbain: le point de vue du dermatologue vétérinaire = dermatozoonoses in urban settings: the veterinary dermatologist’s point of view. 33522539.pdf.
- martin s, schmutz jl. les dermatozoonoses. nouv dermatol 2002 ; 21 : suppl.2 : 37-42.
- viaud s, bensignor e. les dermatozoonoses du chien et du chat. prat med chir anim comp 2008 : 43, 131-9.
- euzéby j. mycologie médicale comparée : les mycoses des animaux et leurs relations avec les mycoses de l’homme. tome i. oullins: fondation marcel merieux; 1992.
- moriello ka, de boer dj. dermatophyties in: guaguère e, prélaud p, editors. guide pratique de dermatologie féline. lyon: mérial; 2000. p. 4.1–11.
- brouta f, deschamps f, losson b, mignon b. données récentes sur la pathogénèse de l’infection de microsporum canis chez les carnivores domestiques. ann med vet 2001; 145: 236–42.
- mignon b. dermatophyties. in: guaguère e, prélaud p, editors. guide pratique de dermatologie canine. lyon: kalianxis; 2006. p. 153–66.
- guaguère e, hubert t, muller a. dermatologie des petits mammifères de compagnie. in : encyclopédie vétérinaire – dermatologie, elsevier, paris, 2007 ; vol 2 (3700) 1-17.
- carlotti dn. le traitement des dermatophytoses du chien et du chat. gestion de la teigne en chatterie. prat med chir anim comp 2008; 43 : 1–13.
- viguié-vallanet c. les teignes. ann dermatol venereol 1999 ; 126 : 349-56.
- ferrer l, fondati a. mycoses profondes. in: guaguère e, prélaud p, editors. guide pratique de dermatologie feline. lyon: mérial; 2000. p. 25.1-11.
- schubach tm, schubach a, okamoto t, barros mb, figueiredo fb, cuzzi t, et al. evaluation of an epidemic sporotrichosis in cats: 347 cases (1998—2001). j am vet med assoc 2004; 224: 1623-9.
- cafarchia c, sasanelli m, lia rp, de caprariis d, guillot j, otranto d. lymphocutaneous and nasal sporotrichosis in a dog from sou-thern italy: case report. mycopathologia 2007; 163: 75—9.
- verde m. dermatozoonoses. in: guaguère e, prélaud p, editors. guide pratique de dermatologie féline. lyon: mérial; 2000. p. 25.1–7.
- guaguère e, beugnet f. dermatoses parasitaires. in: guaguère e, prélaud p, editors. guide pratique de dermatologie canine. lyon: kalianxis; 2006; p 181- 231.
- paterson s. skin diseases of exotic pets (paterson s, ed), blackwell publishing, oxford, 2006 ; 333 p.
- ellis c, mori m. skin diseases of rodents and small exotic mammals. vet clin north am exotic anim pract 2007 ; 4 : 523-7.
Ähnliche Suchen
Dermato-Zoonosen, Standpunkt, Dermatologie, beim Menschen, Dermatozoonosen, Tiere, Dermatologe, Zoonosen, Krankheiten, Dienst, Umgebung, Katze, Hund, Parasiten, Knötchen, S, Praxis, Dermatophyten, Mensch, Infektion, Microsporum canis, Kontakt, Haut, Pusteln, Trichophyton verrucosum, B, Vol., Viaud, Nagetiere, Flöhe, bei der Katze, Arten, Biss, Virus, Fall, Befall, Frankreich, Kenntnisse, Gesundheit, Risiko, Dermatosen, Dermatitis, Milbe, Übertragung, Läsionen, DOI, Tierarzt, Umwelt, Haustiere, Vögel, Kinder, Hausfleischfresser, Unterarme, klinische Anzeichen, Zoo, Trichophyton mentagrophytes, Ursache, Autoren, Papeln, Stiche, Informationen, Personen, Sarcoptes, Diagnose, Begleiter, Anzeichen, Ansteckung