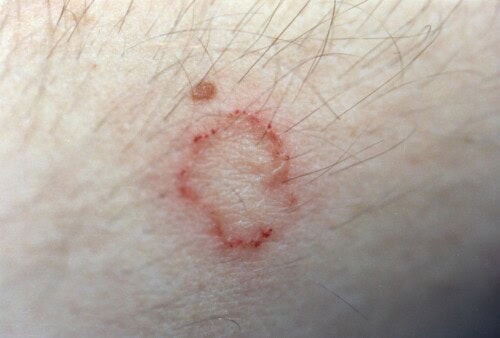
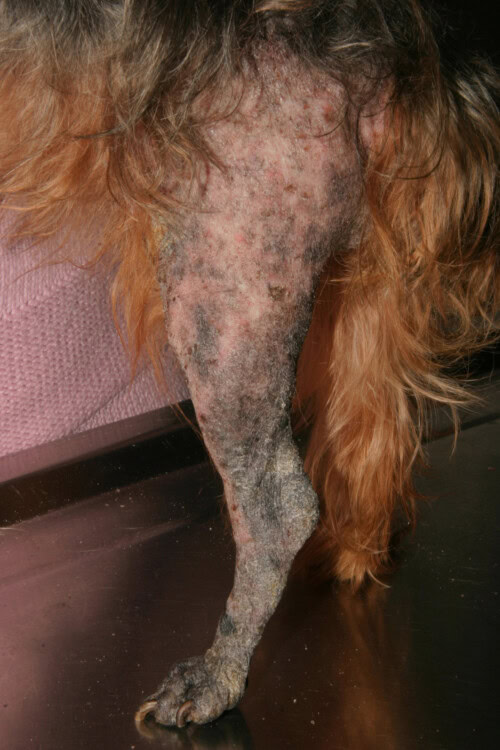
Die Dermatophytose, auch bekannt als Tinea oder Pilzinfektion, ist eine oberflächliche Pilzinfektion der Haut und ihrer Anhänge. Diese Hauterkrankung, verursacht durch keratinophile Pilze der Gattungen Microsporum und Trichophyton, ist in der Veterinärmedizin aufgrund ihres ansteckenden, infektiösen und zoonotischen Potenzials von besonderer Bedeutung.
Einleitung
Obwohl sie bei immunkompetenten Hunden im Allgemeinen als gutartige Erkrankung angesehen wird, bleibt ihr klinisches Management aufgrund ihrer polymorphen Präsentation und ihrer Auswirkungen auf die öffentliche Gesundheit eine Herausforderung.
Ätiologie und Krankheitserreger
Die für Infektionen bei Hunden verantwortlichen Dermatophyten lassen sich nach ihrem natürlichen Lebensraum in drei Kategorien einteilen:
Die zoophilen Arten, die an das Leben auf tierischen Wirten angepasst sind, stellen die wichtigsten Krankheitserreger dar. Microsporum canis ist der vorherrschende ätiologische Erreger (40-80 % der Fälle), gefolgt von Trichophyton mentagrophytes (5-35 % der Fälle).
Unter den geophilen Arten spielt Microsporum gypseum eine nicht zu vernachlässigende Rolle mit bis zu 25 % der gemeldeten Fälle. Diese Pilze, die natürlicherweise im Boden vorkommen, werden mit dem Abbau von Keratin aus organischen Stoffen in Verbindung gebracht.
Microsporum persicolor verdient besondere Beachtung, da seine Prävalenz bei Jagd- und Arbeitshunden erhöht ist, was wahrscheinlich auf häufigeren Kontakt mit Wildnagern und kontaminiertem Boden zurückzuführen ist.
Epidemiologie und Risikofaktoren
Globale Verbreitung und Prävalenz
Die epidemiologische Analyse der kaninen Dermatophytose beleuchtet eine komplexe und multifaktorielle Verteilung. Eine umfassende Metaanalyse, die Studien aus 29 Ländern umfasst, zeigt erhebliche Unterschiede je nach geografischem Kontext und untersuchten HUNDEPopulationen. Im Rahmen der täglichen tierärztlichen Praxis liegt die Prävalenz dieser Erkrankung zwischen 0,26 und 5,6 % der dermatologischen Fälle, was ihre relativ seltene Natur im Vergleich zu anderen Dermatosen unterstreicht.
Geografische Verteilung und Umwelteinflüsse
Epidemiologische Daten zeigen eine besondere geografische Verteilung mit einer ausgeprägten Prävalenz in Gebieten mit warmem und feuchtem Klima. Dieser Trend ist besonders in Brasilien, Chile, Indien, Italien und den südlichen Regionen der Vereinigten Staaten zu beobachten. Diese spezifische geografische Verteilung lässt einen engen Zusammenhang zwischen klimatischen Bedingungen und der Ökologie der Dermatophyten vermuten, der ihre Überlebens- und Verbreitungsfähigkeit in der Umwelt beeinflusst.
Die genaue Bestimmung der Prävalenz und der Rasseprädispositionen stößt auf mehrere methodische Hindernisse. Tatsächlich ist diese Dermatophytose keine meldepflichtige Krankheit, ihr natürlicher Verlauf kann bei vielen immunkompetenten Tieren spontan auflösend sein, und ihre klinische Präsentation variiert erheblich in ihrer Schwere. Diese Faktoren können potenzielle Verzerrungen bei der Interpretation epidemiologischer Daten einführen.
Die Analyse der Risikofaktoren zeigt mehrere bestimmende Elemente auf:
Das Alter ist ein vorherrschender Faktor, wobei junge Tiere eine erhöhte Anfälligkeit zeigen. Diese Anfälligkeit könnte durch die Unreife ihres Immunsystems und das Fehlen einer vorherigen Exposition gegenüber Krankheitserregern erklärt werden.
Rassische Prädispositionen und vergleichende Analyse
Epidemiologische Studien zeigen signifikante Unterschiede in der Anfälligkeit zwischen den Hunderassen. Yorkshire-Terrier zeigen eine besonders ausgeprägte Prädisposition für dermatophytische Infektionen, insbesondere für M. canis. Diese Anfälligkeit äußert sich sowohl in oberflächlichen als auch in nodulären Formen der Infektion. Die Analyse klinischer Daten bestätigt diese Beobachtung: Eine Studie mit 55 Fällen von Dermatophytose ergab, dass 23,6 % der betroffenen Hunde dieser Rasse angehörten. Diese Überrepräsentation wurde durch eine zweite Studie bestätigt, in der Yorkshire-Terrier 37 % der Fälle ausmachten (10 von 27 Hunden). Diese Prädisposition könnte durch genetische Faktoren erklärt werden, die die Immunantwort oder die Zusammensetzung der Hautbarriere beeinflussen, obwohl die genauen Mechanismen noch geklärt werden müssen.
Arbeits- und Jagdhunde weisen ein unterschiedliches Anfälligkeitsprofil auf, das durch eine erhöhte Anfälligkeit für Infektionen mit M. persicolor und M. gypseum gekennzeichnet ist. Diese epidemiologische Besonderheit betrifft insbesondere Rassen wie den Deutsch Kurzhaar, den Foxterrier, den Labrador Retriever, den Belgischen Schäferhund Groenendael, den Beagle und den Jagdterrier. Diese Prädisposition scheint eher mit Verhaltens- und Umweltfaktoren als mit einer intrinsischen Empfindlichkeit zusammenzuhängen, da diese Rassen bei ihren Aktivitäten häufig kontaminierten Böden und Wildreservoiren ausgesetzt sind.
Jagd- und Arbeitshunde weisen ein unterschiedliches Risikoprofil auf. Rassen wie Deutsch Kurzhaar, Foxterrier, Labrador Retriever, Belgischer Schäferhund Groenendael und Beagle zeigen eine erhöhte Anfälligkeit für Infektionen mit M. persicolor und M. gypseum. Diese Prädisposition ist wahrscheinlich auf ihren häufigen Kontakt mit kontaminiertem Boden und wilden Tierreservoiren zurückzuführen.
Der Immunstatus spielt eine entscheidende Rolle bei der Anfälligkeit für dermatophytische Infektionen. Immunsuppressive Zustände, insbesondere Hyperadrenokortizismus, können die Entwicklung schwererer und länger anhaltender Infektionen begünstigen. Die wissenschaftliche Literatur dokumentiert Fälle von Dermatophytose in Verbindung mit verschiedenen systemischen Erkrankungen: Leishmaniose (4 Fälle), Leishmaniose in Verbindung mit Ehrlichiose (1 Fall) und Diabetes mellitus (1 Fall). Die Koexistenz einer gleichzeitigen Demodektie, obwohl selten in der Literatur berichtet, ist wahrscheinlich eine häufigere Assoziation, als die verfügbaren Veröffentlichungen vermuten lassen.
Die Übertragung der Dermatophytose erfolgt hauptsächlich durch direkten Kontakt mit einem infizierten Tier oder über kontaminierte Gegenstände, einschließlich Pflegeartikel, Bettwäsche, Halsbänder und Ektoparasiten. Hautmikrotrauma ist ein wesentlicher begünstigender Faktor für die Etablierung einer klinischen Infektion. Infektionen mit M. canis resultieren typischerweise aus dem Kontakt mit einem infizierten Tier, hauptsächlich Katzen, während eine reine Umweltübertragung wenig effizient bleibt. Trichophyton-Infektionen sind im Allgemeinen mit dem Kontakt mit infizierten Nagetieren oder deren Nestern verbunden. Weniger häufige M. gypseum-Infektionen resultieren vermutlich aus dem Kontakt mit kontaminiertem Boden, was die geophile Natur dieses Organismus widerspiegelt.
Dermatophytose beim Menschen
Pathogenese und Immunantwort
Die Etablierung einer dermatophytischen Infektion resultiert aus einer komplexen Abfolge molekularer und zellulärer Ereignisse, die durch die Interaktionen zwischen Pathogen und Wirt orchestriert werden. Dieser Prozess läuft in drei unterschiedlichen und sequenziellen Phasen ab, die jeweils durch spezifische Mechanismen gekennzeichnet sind.
Die anfängliche Adhäsionsphase ist ein kritischer Schritt, der 2-6 Stunden nach der Exposition auftritt. Diese Adhäsion wird durch spezifische Adhäsine vermittelt, die auf der Oberfläche der Arthrokonidien exprimiert werden, sowie durch dermatophytische Proteasen, insbesondere Subtilisine. Diese vom Pilz sezernierten Enzyme spielen eine entscheidende Rolle bei der Etablierung der Infektion, indem sie die Adhäsion an die Korneozyten des Wirtes erleichtern.
Die zweite Phase, die durch die Keimung der Pilzkonidien gekennzeichnet ist, beginnt zwischen 4 und 6 Stunden nach der initialen Adhäsion. In dieser Phase wachsen Keimschläuche aus den Arthrokonidien und dringen in das Stratum Corneum ein. Diese Invasion wurde dank In-vitro-Modellen, die isolierte Korneozyten und rekonstruierte Epidermis verwenden, detailliert dokumentiert, was die Beobachtung des Fortschreitens der Infektion ermöglicht.
Die dritte Phase entspricht der aktiven Invasion keratinisierter Strukturen. Die Pilzhyphen besiedeln das Stratum Corneum und entwickeln sich in verschiedene Richtungen, wobei in den meisten veterinärmedizinischen Dermatophyten eine deutliche Präferenz für die Follikeleinheit besteht. Diese Kolonisierung wird von einer intensiven enzymatischen Aktivität begleitet, insbesondere der Sekretion von Endoproteasen (Subtilisine und Fungalysine) und Exoproteasen, die Keratin in verdauliche Peptide und Aminosäuren abbauen. Ein ausgeklügelter Mechanismus, der eine Sulfit-Effluxpumpe, die durch das SSU1-Gen kodiert wird, umfasst, erleichtert den Keratinabbau durch Spaltung der Disulfidbrücken. Die Regulation der Sulfitbildung aus Cystein hängt von einem Schlüsselenzym, der Cystein-Dioxygenase (Cdo1), ab.
Die Dermatophyten haben ausgeklügelte Strategien entwickelt, um die Immunantwort des Wirtes zu unterdrücken. Diese Mechanismen umfassen die Lymphozytenhemmung durch Mannane der Zellwand, die Beeinträchtigung der Makrophagenfunktion und die Veränderung der Keratinozyten-Turnover. Der Wirt entwickelt jedoch eine komplexe Immunantwort, die humorale und zelluläre Komponenten umfasst.
Die natürliche Infektion mit M. canis induziert sofortige und verzögerte Hautreaktionen auf Pilzproteine, begleitet von einem Anstieg der Antikörpertiter und Veränderungen der lymphoblastischen Reaktion auf Pilzantigene. Immunologische Studien haben gezeigt, dass Katzen, die mit M. canis infiziert oder zuvor exponiert waren, eine signifikant höhere lymphozytäre Reaktivität auf dermatophytische Antigene aufweisen als nicht infizierte Kontrollen. Obwohl die lymphozytäre Reaktivität bei Kultur-positiven Tieren und infizierten/geheilten Tieren ähnlich ist, sind die Antikörpertiter in der Kultur-positiven Gruppe signifikant höher. Diese Beobachtung deutet darauf hin, dass die erhöhte lymphozytäre Reaktivität eine zellvermittelte Th1-Antwort darstellen könnte, während die Antikörper eher die Exposition widerspiegeln, ohne einen signifikanten Schutz zu vermitteln.
Die klinische Heilung und der Schutz vor Reinfektionen hängen im Wesentlichen von einer robusten zellvermittelten Immunantwort ab, die Effektorzellen wie Makrophagen und Neutrophile umfasst und durch verschiedene Zytokine, insbesondere Interferon-Gamma, orchestriert wird. Diese adaptive Immunantwort trägt nicht nur zur Eliminierung der aktiven Infektion bei, sondern auch zur Etablierung einer schützenden Immunität gegen nachfolgende Infektionen.
Klinisches Bild und Differentialdiagnose
Die kaninen Dermatophytosen zeigen einen bemerkenswerten klinischen Polymorphismus, der die Pathogenese der Pilzinfektion und die Immunantwort des Wirts widerspiegelt. Die initialen Manifestationen treten in der Regel ein bis drei Wochen nach der Exposition gegenüber den infektiösen Arthrosporen auf. Klassische Läsionen sind durch gut abgegrenzte, kreisförmige, periphere alopezische Bereiche gekennzeichnet, die im Allgemeinen asymmetrisch sind. Erythem, besonders sichtbar auf hellen Hautbereichen, wird von Schuppen und Krusten aufgrund mäßiger Exsudation begleitet. Der Juckreiz, variabel in seiner Intensität, ist im Allgemeinen minimal bis nicht vorhanden, obwohl seine Anwesenheit die Läsionen durch Selbsttrauma verschlimmern kann.
Dermatophytose bei einem Yorkshire
Atypische klinische Präsentationen verdienen besondere Aufmerksamkeit:
Die pustulöse Dermatophytose stellt eine seltene, aber signifikante Form dar, die klinisch und histologisch einen Pemphigus foliaceus simulieren kann. Diese besondere Manifestation unterstreicht die Bedeutung, die Dermatophytose in die Differentialdiagnose pustulöser Dermatosen einzubeziehen.
Kerion sind eine entzündliche Form, die durch erythematöse, alopezische, kuppelförmige und exsudierende Knötchen gekennzeichnet ist. Die histopathologische Untersuchung zeigt eine granulomatöse oder pyogranulomatöse Bildung, oft zusammen mit Fragmenten von Haarschäften, die Pilzsporen enthalten. Diese Präsentation wird hauptsächlich bei Infektionen mit M. gypseum oder T. mentagrophytes beobachtet.
Pseudomyzetome und Myzetome stellen seltenere, aber signifikante Komplikationen dar. Klinisch äußern sie sich als einzelne oder mehrere Knötchen, die fistulieren und ulzerieren und seropurulentes Material mit Gewebegranula ableiten. Die histopathologische Untersuchung zeigt eine granulomatöse Dermatitis oder Pannikulitis, die Granula aus Pilzhyphen oder Pseudohyphen enthält.
Die Differentialdiagnose erfordert einen systematischen Ansatz und muss Folgendes berücksichtigen:
Bakterielle Follikulitis und Demodikose stellen die Hauptdifferentialdiagnosen dar. Bei bakterieller Follikulitis sind Papeln oder follikuläre Pusteln, epidermale Kragen und ein zerzaustes Fell charakteristisch. Die Demodikose zeichnet sich durch das Vorhandensein von Komedonen und eine deutliche Abgrenzung der alopezischen Bereiche aus.
Autoimmunerkrankungen, insbesondere Pemphigus foliaceus und kutaner Lupus erythematodes, müssen berücksichtigt werden, insbesondere bei Gesichtslesionen. Pemphigus foliaceus ist durch nicht-follikuläre Pusteln, Krusten und Alopezie gekennzeichnet. Der diskoidale Lupus erythematodes verursacht häufig schuppige, papulopustulöse oder krustige Läsionen, die den Nasenrücken betreffen, im Gegensatz zur Dermatophytose.
Alopezia areata und Pseudopelade zeichnen sich durch kreisförmige Alopeziebereiche aus, in denen die Haut meist normal erscheint.
Generalisierte exfoliative Dermatosen umfassen ein breites Spektrum von Erkrankungen: Endokrinopathien, Leishmaniose, exfoliativer Lupus erythematodes, granulomatöse Talgdrüsenadenitis und kutanes Lymphom. Diese Erkrankungen können klinische Ähnlichkeiten mit den generalisierten Formen der Dermatophytose aufweisen.
Das klinische Bild kann durch mehrere Faktoren beeinflusst werden, darunter die beteiligte Dermatophytenart, der Immunstatus des Wirtes und die vorherige Verabreichung von Behandlungen. Infektionen mit M. persicolor beispielsweise sind zunächst durch eine nicht-follikuläre Beteiligung mit Erythem, Schuppen und Krusten gekennzeichnet, wobei die Alopezie erst sekundär auftritt. Diese besondere Form betrifft bevorzugt Jagdhunde und äußert sich häufig in Gesichtslesionen.
Fazit
Der Pilz stellt eine komplexe dermatologische Erkrankung dar, deren variables klinisches Bild einen strengen diagnostischen Ansatz erfordert. Bei der therapeutischen Behandlung müssen nicht nur die Wirksamkeit der Therapie, sondern auch zoonotische und Umweltaspekte berücksichtigt werden. Ein tiefgreifendes Verständnis ihrer Pathogenese und klinischen Manifestationen ist für eine optimale Behandlung unerlässlich.
Häufig gestellte Fragen (FAQ)
-
Deutet das Vorhandensein von Sporen auf dem Fell immer auf eine aktive Infektion hin? Nein, das Vorhandensein von Sporen kann lediglich eine mechanische Trägerschaft ohne follikuläre Invasion widerspiegeln.
-
Haben immungeschwächte Hunde ein erhöhtes Risiko für eine schwere Infektion? Ja, insbesondere bei Tieren mit Hyperadrenokortizismus, bei denen die Infektion schwerwiegender und länger andauernd sein kann.
-
Stellt eine Umweltkontamination ein großes Übertragungsrisiko dar? Nein, Studien zeigen, dass die Übertragung durch direkten Kontakt mit einem infizierten Tier viel häufiger ist als die alleinige Umweltkontamination.
-
Kann man sich bei der Diagnose ausschließlich auf das klinische Erscheinungsbild verlassen? Nein, die polymorphe Präsentation der Dermatophytose erfordert eine diagnostische Bestätigung durch ergänzende Untersuchungen.
Bibliographie
-
Begum, J., & Kumar, R. (2020). Prevalence of dermatophytosis in animals and antifungal susceptibility testing of isolated Trichophyton and Microsporum species. Tropical Animal Health and Production, 53(3), 1-8.
-
Moriello, K. A., Coyner, K., Paterson, S., & Mignon, B. (2017). Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Veterinary Dermatology, 28(3), 266-e68.
-
Pin, D. (2017). Non-dermatophyte dermatoses mimicking dermatophytoses in animals. Mycopathologia, 182(1-2), 1-13.
-
Yamada, S., Anzawa, K., & Mochizuki, T. (2019). An epidemiological study of feline and canine dermatophytoses in Japan. Medical Mycology Journal, 60(2), 39-44.
-
ESCCAP. (2016). Lutte contre les dermatophytes chez les chiens et les chats – Adaptation du guide de recommandations ESCCAP no. 2 pour la Suisse, août 2016. (Guide de recommandations pour la lutte contre les dermatophytoses)
Verwandte Suchanfragen
Hund, Ringelflechte, Ringelflechte beim Hund, klinische Anzeichen, Körper, Behandlung von Ringelflechte, Rumpf, Gesicht, Haare, Pilz, Menschen, Menschen, Umwelt, Verlust, Gliedmaßen, Flecken, Modi, Umwelt, Symptome, Arme, Mann, UV-Lampe, Bleichmittel, Prävention, Symptome von Ringelflechte, Pferde, Juckreiz, Meerschweinchen, Ringelflechte Hund, Ringelflechte des Hundes, Kaninchen, Ringelflechte Hund, Ringelflechte, Hund, klinische Anzeichen, Ringelflechte beim Hund, Krankheit, beim Hund, Tier, Behandlung, Haut, Haare, Pilze, Microsporum canis, UV-Lampe, Ursachen, Symptome, Haustier, Entwicklung, Ringelflechte des Hundes, Texte, Prävention, Besitzer, Menschen, Praktiken, Gesundheit, Aussehen, Pilz, Umwelt, Tierarzt, Verlust, Dermatophyten, Infektion, Oberflächen, Trichophyton mentagrophytes, Umwelt, Katze, Wohlbefinden, Untersuchung, Läsionen, Bleichmittel, Tatsache, Hund hat Ringelflechte, Dermatophytosen, Sporen, Diagnose, Ringelflechten, Behandlung von Ringelflechte, Keratin, Immunsystem, Körper, Kontakt, Dermatophytose, Ansteckung, Haarausfall, Terrier, Nagetiere, Fälle, wie man Ringelflechte vorbeugt, Ansteckungsfähigkeit, Ringelflechte ist eine Krankheit, Lampe, Last, Sturz, Krallen, Aufnahme, Rassen, Besitzer, Holz, Ringelflechte vorbeugen, Hautläsionen