Kutane Kalzinosen stellen eine wichtige diagnostische und therapeutische Herausforderung in der Veterinärdermatologie beim Hund dar. Diese Erkrankungen, die durch abnormale Ansammlung von Kalziumsalzen in dermalen und hypodermalen Strukturen charakterisiert sind, erfordern einen rigorosen klinischen Ansatz, der auf einem präzisen Verständnis ihrer unterschiedlichen pathophysiologischen Mechanismen basiert.
September 2025
Die frühzeitige Identifizierung der verschiedenen Kalzinose-Typen und die Einleitung einer angepassten Behandlung bedingen direkt die funktionelle und ästhetische Prognose. Während der letzten jährlichen Tagung des GEDAC präsentierte unser Kollege Vincent Bruet, Präsident des GEDAC, die jüngsten Fortschritte in der ätiologischen Klassifikation, den zeitgenössischen diagnostischen Modalitäten und den aufkommenden therapeutischen Perspektiven, insbesondere jenen, die von in der Humanmedizin entwickelten Protokollen inspiriert sind.
Definition und Nomenklatur der kutanen Kalzinose
Die kutane Kalzinose wird präzise durch abnormale Ablagerungen von Kalziumsalzen in der Dermis und Hypodermis definiert. Diese Mineralansammlungen manifestieren sich klinisch in Form von Knötchen oder verhärteten Plaques, die typischerweise eine charakteristische weißliche Färbung aufweisen und die Hautoberfläche erheblich verändern können. Die moderne Klassifikation unterscheidet drei hauptsächliche klinische Entitäten entsprechend ihrer anatomischen Ausdehnung und morphologischen Präsentation.
Die kutane Kalzinose stellt den generischen Begriff dar, der alle kalzischen Ablagerungen umfasst, die die Hautstrukturen betreffen, unabhängig von ihrer Lokalisation oder Ausdehnung. Diese allgemeine Bezeichnung ermöglicht es, den grundlegenden pathologischen Prozess zu identifizieren, ohne seine spezifischen Charakteristika vorauszusetzen.
Die Kalzinose circumscripta stellt eine lokalisierte klinische Form dar, die durch umschriebene kalzische Ablagerungen charakterisiert ist, die häufig in periartikulären Regionen oder in der Nähe der Extremitäten beobachtet werden. Diese bevorzugte Lokalisation deutet auf die Beteiligung lokaler mechanischer Faktoren bei der Entstehung dieser Läsionen hin.
Die Kalzinose universalis stellt die ausgedehnteste und schwerste Form dar, die durch eine diffuse Beteiligung charakterisiert ist, die nicht nur die Hautstrukturen, sondern auch das subkutane Gewebe, Muskel- und Sehnengewebe betrifft. Diese systemische Form ist im Allgemeinen mit einer zurückhaltenderen Prognose verbunden und erfordert eine komplexe multidisziplinäre Betreuung.
Pathophysiologische Grundlagen und moderne Klassifikation der Kalzinosen
Die aktuelle Taxonomie der kutanen Kalzinosen gliedert sich um fünf verschiedene pathophysiologische Entitäten, die jeweils auf spezifische biologische Mechanismen reagieren. Diese Stratifikation bildet die Grundlage für jeden rationellen therapeutischen Ansatz, da sie die diagnostische Orientierung bestimmt und die therapeutischen Entscheidungen bedingt.
Die dystrophische Kalzinose
Sie nimmt eine zentrale Position in der Veterinärdermatologie ein. Ihre Entwicklung tritt ausschließlich in Geweben auf, die zuvor durch entzündliche, nekrotische oder degenerative Prozesse verändert wurden, in einem physiologischen metabolischen Kontext, der durch Normokalzämie und Normophosphatämie charakterisiert ist. Die anfänglichen Gewebeschäden lösen eine komplexe molekulare Kaskade aus, die die Freisetzung von Zellproteinen mit Phosphat-Affinität, insbesondere mitochondriale Proteine, beinhaltet, die die Bildung kristalliner Nukleationszentren fördern, gefolgt von der progressiven Ausfällung kalzischer Verbindungen um die fibrillären Strukturen der Dermis, insbesondere Kollagen- und Elastinfasern.
In der Humanmedizin stellt diese Form die häufigste Manifestation dar und betrifft bis zu 70% der Kinder mit Dermatomyositis. Kollagenosen stellen die hauptsächlichen Ätiologien dar, einschließlich Sklerodermie, Dermatomyositis, systemischem Lupus erythematodes und gemischten Kollagenosen. Infektiöse und neoplastische Prozesse sowie bestimmte erbliche Dermatosen wie das Ehlers-Danlos-Syndrom vervollständigen das ätiologische Spektrum dieser Form.
Die metastatische Kalzinose
Sie folgt einem radikal anderen Mechanismus, der die kalzische Ausfällung in strukturell intakten Geweben beinhaltet. Diese Form resultiert direkt aus systemischen metabolischen Anomalien, die eine Hyperkalzämie, eine Hyperphosphatämie oder beide gleichzeitig verursachen. Der Hyperparathyreoidismus, ob primär oder sekundär, stellt den hauptsächlichen auslösenden Faktor durch drei konvergierende metabolische Wege dar: die Aktivierung der osteoklastischen Resorption, die Erhöhung der tubulären renalen Kalziumreabsorption und die indirekte Stimulation der Calcitriol-Synthese, die die intestinale Kalziumabsorption intensiviert.
Das Konzept des Phosphokalzium-Produkts nimmt hier eine zentrale Bedeutung ein. Wenn dieses Produkt (Serum-Kalzium × Serum-Phosphor) die kritische Schwelle von 70 mg²/dL² überschreitet, beginnen spontane Kristallisationsphänomene in verschiedenen organischen Strukturen. Obwohl die viszeralen Organe (Magen, Lunge, Nieren, Myokard) die bevorzugten Ziele darstellen, kann auch die Haut betroffen sein, wenn auch seltener.
Besondere und aufkommende Formen
Die idiopathische Kalzinose stellt eine rätselhafte Entität dar, die durch das Fehlen jeder nachweisbaren metabolischen Anomalie und vorbestehender Gewebsläsion charakterisiert ist. Diese Form wirft grundlegende Fragen über die Existenz noch unbekannter pathophysiologischer Mechanismen oder latenter genetischer Prädispositionen auf. In der Humanmedizin umfasst diese Kategorie die tumorale Kalzinose (tumoral calcinosis), kalzifizierte subepidermale Knötchen und die skrotale Kalzinose.
Die iatrogene Kalzinose resultiert direkt aus spezifischen medizinischen Eingriffen oder Behandlungen. Die lokale oder systemische Verabreichung kalzium- oder phosphathaltiger Produkte wie Kalziumglukonat kann lokalisierte kalzische Ablagerungen verursachen. Übermäßige Vitamin-D-Supplementierung stellt ebenfalls einen anerkannten Risikofaktor dar, insbesondere bei Tieren, die unkontrollierte Nahrungsergänzungsmittel erhalten.
Die Calciphylaxie stellt zweifellos die gefürchtetste Form dar. Diese Entität zeichnet sich durch die selektive Verkalkung der Media dermaler und hypodermaler Arteriolen aus, die einen progressiven ischämischen Prozess erzeugt. Die klinischen Konsequenzen erweisen sich als dramatisch: ausgedehnte Hautnekrosen, Gewebszerfall, wiederkehrende septische Superinfektionen und hohe Mortalität. Diese Form bleibt eng mit Endstadien chronischer Niereninsuffizienz verbunden und wird besonders bei dialysierten Patienten in der Humanmedizin beobachtet.
Detaillierte pathophysiologische Mechanismen der dystrophischen Kalzinose
Bei der dystrophischen Kalzinose bleiben die Serumspiegel von Kalzium und Phosphat innerhalb der normalen physiologischen Grenzen. Der pathologische Prozess beginnt mit Gewebeschäden, die zur massiven Freisetzung intrazellulärer Proteine führen, insbesondere mitochondrialer Proteine mit besonderer Affinität für Phosphat. Diese Proteine wirken als Nukleationszentren und fördern die lokale Ausfällung kalzischer Salze.
Die lokale Gewebshypoxie, direkte Folge der anfänglichen Läsionen, schafft eine für die Verkalkung günstige Umgebung. Die chronische Entzündung unterhält diesen Prozess durch die anhaltende Freisetzung proinflammatorischer Zytokine, insbesondere TNF-α, IL-6 und IL-1β. Diese Entzündungsmediatoren verstärken die lokale Gewebsantwort und perpetuieren die für pathologische Mineralisierung günstigen Bedingungen.
Die Bildung intrazellulärer Kristalle stellt ein bedeutendes schädigendes Ereignis dar, das unweigerlich zur Zellnekrose führt. Dieser Zelltod setzt neue Nukleationszentren frei und unterhält einen selbstunterhaltenden Teufelskreis progressiver Verkalkung. Der Prozess dehnt sich graduell auf benachbarte Strukturen aus, insbesondere Kollagen- und Elastinfasern der Dermis, wodurch die klinisch beobachteten charakteristischen Läsionen entstehen.
Epidemiologie und ätiologische Besonderheiten in der kaninen Veterinärmedizin
Ätiologische Verteilung und quantitative Daten
Die epidemiologische Analyse zeigt eine besonders charakteristische ätiologische Verteilung in der kaninen Veterinärmedizin. Eine umfangreiche retrospektive Studie ermöglichte es, die Verteilung der zugrunde liegenden Ursachen präzise zu etablieren und dabei unterschiedliche Muster zu denen in der Humanmedizin beobachteten zu zeigen.
Der Hyperkortizismus dominiert massiv das ätiologische Bild und repräsentiert etwa 80% aller beobachteten Fälle. Diese Vorherrschaft erklärt sich durch die Häufigkeit systemischer Kortikotherapien in der Veterinärmedizin und durch die nicht vernachlässigbare Inzidenz spontaner Cushing-Syndrome bei der Hundeart. Innerhalb dieser majoritären Kategorie stellt der iatrogene Hyperkortizismus, direkte Folge verlängerter Kortikoidbehandlungen, etwa 70% der Fälle dar, während endogene Hyperkortizismen (hypophysär und adrenal) die verbleibenden 30% repräsentieren.
Diese Vorherrschaft des iatrogenen Hyperkortizismus erklärt sich durch die häufige Verwendung von Kortikosteroiden in der Veterinärmedizin zur Behandlung verschiedener entzündlicher, allergischer und autoimmunischer Erkrankungen. Der einfache Zugang zu diesen Molekülen und ihre unmittelbare therapeutische Wirksamkeit fördern manchmal ihre verlängerte Verschreibung und schaffen die für die Entwicklung kutaner Kalzinosen günstigen Bedingungen.
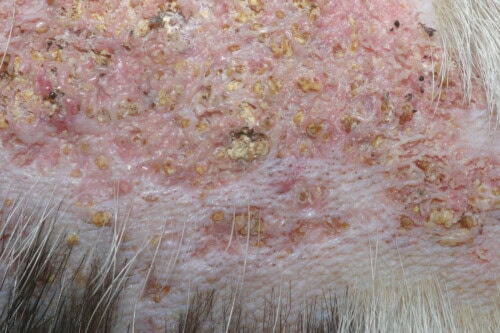
Kutane Kalzinose: Nahaufnahme
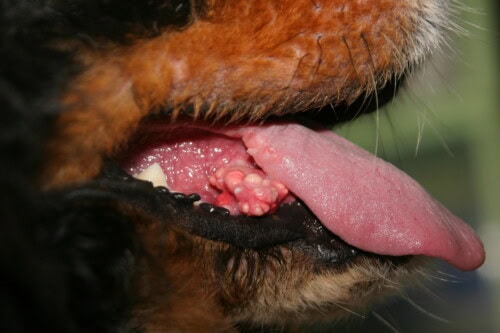
Kutane Kalzinose: Sublinguale Läsionen
Minoritäre Ursachen und besondere Situationen
Die chronische Niereninsuffizienz nimmt die zweite ätiologische Position mit etwa 10% der dokumentierten Fälle ein. Dieser relativ bescheidene Anteil erklärt sich durch die Vorliebe metastatischer kalzischer Ablagerungen für viszerale Weichgewebe anstatt für Hautstrukturen bei dieser Pathologie. Dennoch sind die kutanen Formen, wenn sie auftreten, im Allgemeinen mit fortgeschrittenen Stadien der Nierenerkrankung verbunden und stellen einen ungünstigen prognostischen Indikator dar.
Das letzte Dezil gruppiert eine heterogene Menge seltener, aber klinisch bedeutsamer Ätiologien. Die post-traumatische dystrophische Kalzinose kann als Folge wiederholter Traumata oder chronischer mechanischer Läsionen auftreten, insbesondere in Bereichen, die wiederkehrenden Reibungen oder anhaltenden mechanischen Drücken ausgesetzt sind.
Post-inflammatorische Formen werden manchmal im Kontext schwerer systemischer Infektionen beobachtet, insbesondere tiefe Mykosen wie Blastomykose oder Histoplasmose und bestimmte Leptospirosen. Diese Infektionen schaffen einen systemischen Entzündungszustand, der für die Entwicklung dystrophischer Verkalkungsläsionen günstig ist.
Die idiopathische Kalzinose verdient trotz ihrer Seltenheit besondere Aufmerksamkeit, da sie grundlegende Fragen zu unserem Verständnis der pathophysiologischen Mechanismen aufwirft. Das Fehlen einer identifizierten zugrunde liegenden Ursache deutet auf die Existenz noch unbekannter genetischer oder umweltbedingter Prädispositionsfaktoren hin.
Nicht-kortikoidale iatrogene Kalzinosen, die mit Infusionen kalzischer Lösungen oder übermäßigen Vitaminsupplementierungen verbunden sind, vervollständigen dieses ätiologische Bild. Diese vermeidbaren Formen unterstreichen die Bedeutung einer aufmerksamen Überwachung bei der Verabreichung potenziell verkalkender Behandlungen.
Rassebezogene Überlegungen und Prädispositionen
Obwohl keine Rasseexklusivität formal etabliert ist, deuten bestimmte klinische Beobachtungen auf eine Prädisposition großer Rassen hin. Diese Tendenz könnte sich durch eine erhöhte Anfälligkeit für endokrinologische Pathologien, insbesondere Hyperadrenokortizismus, oder durch Unterschiede in den therapeutischen Praktiken je nach Tiergröße erklären.
Die Englische Bulldogge ist Gegenstand besonderer Aufmerksamkeit in der veterinärmedizinischen Literatur, wobei bestimmte Daten auf eine spezifische Prädisposition in dieser Rasse hindeuten. Diese Anfälligkeit könnte mit den anatomischen Besonderheiten der Rasse, insbesondere den zahlreichen Hautfalten, die wiederholte Mikrotraumata schaffen, oder mit noch nicht aufgeklärten spezifischen genetischen Faktoren verbunden sein.
Brachyzephale Rassen in ihrer Gesamtheit könnten eine relative Prädisposition aufweisen, möglicherweise im Zusammenhang mit ihrer Neigung zu chronischen Atemwegserkrankungen, die verlängerte entzündungshemmende Behandlungen erfordern. Diese Hypothese erfordert jedoch tiefergehende epidemiologische Studien zur Bestätigung.
Klinische Semiologie und zeitgenössischer diagnostischer Ansatz
Polymorphismus der klinischen Manifestationen
Die klinische Präsentation kutaner Kalzinosen beim Hund zeichnet sich durch einen bemerkenswerten Polymorphismus aus, der die Vielfalt der zugrunde liegenden pathophysiologischen Mechanismen und die Heterogenität individueller Gewebsantworten widerspiegelt. Diese semiologische Variabilität stellt manchmal eine beträchtliche diagnostische Herausforderung dar, die einen methodischen und erfahrenen klinischen Ansatz erfordert.
Die anatomische Lokalisation bevorzugt klassischerweise die Rückenregion, die den am häufigsten beobachteten Betroffenheitsort darstellt. Jedoch kann sich die Beteiligung auf ventrale haarlose Bereiche ausdehnen, insbesondere Abdomen und Leistengegend, auf Hautfalten, wo Mazerationsphenomene lokale Entzündungen fördern, auf die Halsregion und die Achselhöhlen. Diese nicht zufällige topographische Verteilung deutet auf die Beteiligung lokaler mechanischer Faktoren, insbesondere wiederholte Reibungen und Drücke, oder regionaler vaskulärer Besonderheiten bei der Entwicklung und dem Fortschreiten der Läsionen hin.
Die Prädilektionszonen entsprechen oft Regionen, die besonderen mechanischen Belastungen unterliegen oder spezifische anatomische Charakteristika aufweisen. Hautfalten schaffen beispielsweise eine feuchte und warme Mikroumgebung, die für chronische Entzündungen günstig ist, während Kontaktzonen mit dem Boden oder Liegeflächen wiederholte Traumata geringer Intensität erleiden.
Morphologische Charakteristika der Läsionen
Das Läsionsaussehen zeigt zwei verschiedene Hauptphänotypen, die jeweils wahrscheinlich verschiedenen evolutionären Stadien oder spezifischen pathophysiologischen Mechanismen entsprechen. Der erste Phänotyp manifestiert sich durch feste bis ausgesprochen harte Plaques, die eine charakteristische gelbliche Färbung aufweisen und von einem markierten erythematösen Wulst umgeben sind, der von der intensiven periläsionalen Entzündungsreaktion zeugt. Diese Präsentation entspricht im Allgemeinen akuten oder subakuten Stadien des pathologischen Prozesses.
Der zweite Phänotyp entspricht ausgedehnten alopezischen Plaques, bemerkenswert verhärtet, die eine intensive rosafarbene Tönung aufweisen, die an eine chronische zugrunde liegende Entzündung erinnert. Diese Läsionen zeugen im Allgemeinen von einer längeren Evolution und einer Chronifizierung des lokalen Entzündungsprozesses.
Die Palpation zeigt eine charakteristische Konsistenz, die zwischen ausgeprägter Festigkeit und ausgesprochen steinartiger Härte je nach Mineralisationsgrad oszilliert. Diese Verhärtung stellt ein pathognomonisches semiologisches Element dar, das es ermöglicht, Kalzinosen von anderen chronischen entzündlichen Dermatosen zu unterscheiden.
Die Läsionsoberfläche kann verschiedene Veränderungen aufweisen: lokalisierte Hyperkeratose, Bildung oberflächlicher Krusten, Exsudation variabler Zusammensetzung und in den am weitesten entwickelten Fällen offene Ulzeration mit Exposition der darunter liegenden Dermis. Das Vorhandensein purulenten Exsudats zeugt im Allgemeinen von einer sekundären bakteriellen Superinfektion.
Pathognomonische Zeichen und Läsionsevolution
Die Läsionsevolution folgt im Allgemeinen einem vorhersagbaren Muster, obwohl die Chronologie beträchtlich von einem Individuum zum anderen variieren kann. Die anfänglichen Phasen sind häufig von oberflächlichen Krusten und einem Exsudat variabler Zusammensetzung begleitet, das von einfacher seröser Durchfeuchtung bis zu purulentem Ausfluss bei Superinfektion reicht.
Ein besonders evokatives pathognomonisches Zeichen liegt in der spontanen Extrusion kreidigen weißlichen Materials durch die Epidermis. Dieses Phänomen entspricht der transkutanen Elimination kalzischer Kristalle und stellt ein diagnostisches Element von primärer Bedeutung dar. Die Beobachtung dieses kristallinen Materials, leicht erkennbar durch seine charakteristische Textur und Färbung, ermöglicht oft, die Diagnose mit fast Gewissheit zu stellen.
Die Ulzeration stellt eine häufige Komplikation dar, insbesondere in schweren oder vernachlässigten Formen. Diese Ulzera weisen spezifische Charakteristika auf: erhöhte und verhärtete Ränder, gewundener Grund mit Granulationsgewebe ausgekleidet, Tendenz zur Chronifizierung und Resistenz gegen konventionelle heilungsfördernde Behandlungen.
Während der Resolutionsphase, die hauptsächlich nach Korrektur der zugrunde liegenden Ursache beobachtet wird, unterliegen die Läsionen einer progressiven Transformation ihres Aussehens. Die entzündliche Komponente schwächt sich graduell ab, was sich in einer Verringerung des periläsionalen Erythems und der lokalen Empfindlichkeit äußert. Die Färbung entwickelt sich zu mattgrauen Tönen, die von der progressiven Normalisierung der lokalen Gewebsprozesse zeugen. Jedoch kann die Verhärtung Monate lang anhalten, sogar in bestimmten Fällen definitiv.
Infektiöse Komplikationen und Evolution
Sekundäre bakterielle Superinfektionen stellen eine quasi-konstante Komplikation dar, begünstigt durch die Veränderung der epidermalen Barriere und durch die lokale entzündliche Umgebung, die die natürlichen Abwehrmechanismen kompromittiert. Diese Superinfektionen können die zugrunde liegenden Läsionen maskieren und die diagnostische Bewertung erheblich erschweren.
Die beteiligte bakterielle Flora umfasst klassischerweise Staphylokokken und Streptokokken, aber resistentere opportunistische Keime können chronische Läsionen besiedeln. Die präzise Identifizierung dieser Pathogene durch bakterielle Kultur und Antibiogramm erweist sich oft als notwendig, um die lokale oder systemische Antibiotherapie anzupassen.
Das Vorhandensein kalzischen Materials in den Geweben schafft eine besonders für die Entwicklung bakterieller Biofilme günstige Umgebung, komplexe dreidimensionale Strukturen, die Mikroorganismen vor der Wirkung von Antimikrobiellen und den Abwehrmechanismen des Wirts schützen. Diese Besonderheit erklärt die häufige Resistenz gegen konventionelle antibiotische Behandlungen und die Neigung zur Rezidiv von Superinfektionen.
Differentialdiagnostische Strategie
Die Diagnosestellung der Kalzinose beruht hauptsächlich auf der Erkennung charakteristischer klinischer Muster und auf der Analyse des anamnestischen Kontexts. Die tiefe chronische oder rezidivierende Pyodermie stellt die hauptsächliche diagnostische Falle dar, zumal beide Erkrankungen koexistieren und sich gegenseitig potenzieren können.
Mehrere Elemente ermöglichen es, die Differentialdiagnose zu orientieren: die besonders harte Konsistenz von Kalzinoseläsionen kontrastiert mit der weicheren Konsistenz von Pyodermien, die Extrusion kreidigen Materials stellt ein pathognomonisches Zeichen der Kalzinose dar, und der anamnestische Kontext (Kortikotherapie, Cushing-Syndrom) orientiert stark zu einer Kalzinose.
Andere Erkrankungen können gelegentlich zu Verwechslungen führen: Fremdkörpergranulome, kalzifizierte Hauttumoren, infizierte Talgzysten oder chronische Panniculitiden. Die Berücksichtigung aller klinischen und anamnestischen Elemente ermöglicht es im Allgemeinen, diese diagnostischen Unklarheiten zu beseitigen.
Die Hautzytologie erweist sich als besonders wertvoll zur Charakterisierung begleitender bakterieller Superinfektionen und zur Orientierung lokaler antimikrobieller Entscheidungen. Obwohl sie keine formale Bestätigung der Kalzinose-Diagnose ermöglicht, trägt diese Untersuchung zur globalen Bewertung des Läsionszustands bei und leitet ergänzende therapeutische Entscheidungen. Die Beobachtung kalzischer Kristalle bei der zytologischen Untersuchung kann den diagnostischen Verdacht verstärken.
In bestimmten komplexen oder atypischen Fällen kann sich die Hauthistopathologie als notwendig erweisen, um die Diagnose zu bestätigen und den Kalzinose-Typ präzise zu charakterisieren. Diese Untersuchung ermöglicht es, das Vorhandensein kalzischer Ablagerungen in dermalen Strukturen zu objektivieren und die Intensität der assoziierten Entzündungsreaktion zu bewerten.
Aktuelle therapeutische Strategien und Limitationen
Grundprinzip: Korrektur der primären Ursache
Die therapeutische Behandlung kutaner Kalzinosen beruht auf einem kardinalen Prinzip: die Identifizierung und Korrektur der zugrunde liegenden Ursache stellen den grundlegenden Schritt dar, der die gesamte Prognose bedingt. Dieser ätiologische Ansatz hat Vorrang vor jeder symptomatischen Betrachtung und bestimmt die Chancen auf mittelfristige und langfristige Läsionsregression.
Im majoritären Kontext des iatrogenen Hyperkortizismus beinhaltet dieser Ansatz das progressive und sorgfältig kontrollierte Absetzen der Kortikotherapie. Diese Reduzierung muss an die Dauer der vorherigen Behandlung, die verwendeten Dosen und die ursprünglich behandelte Pathologie angepasst werden. Ein zu abruptes Absetzen setzt dem Risiko einer iatrogenen Nebenniereninsuffizienz aus, die besonders gefürchtet ist nach verlängerten Behandlungen mit hohen Dosen.
Das Reduzierungsprotokoll muss die biologische Halbwertszeit der verwendeten Kortikosteroide und die Dauer der Suppression der Hypothalamus-Hypophysen-Nebennieren-Achse berücksichtigen. Im Allgemeinen stellt eine Reduzierung von 25 bis 50% der Dosis alle zwei Wochen einen akzeptablen Kompromiss zwischen Wirksamkeit und Sicherheit dar. In bestimmten Fällen kann eine Substitution durch alternative Entzündungshemmer (Immunsuppressiva, Biotherapien) das Kortikoid-Absetzen erleichtern.
Die Regression der Hautläsionen wird tatsächlich nach Korrektur der primären Ursache beobachtet, aber ihr Ausmaß bleibt unvorhersagbar und oszilliert zwischen vollständiger Resolution und nur teilweiser Verbesserung. Die Faktoren, die diese Variabilität beeinflussen, umfassen die Dauer der Läsionsevolution vor der Behandlung, die Intensität der Kortikosteroid-Exposition und die individuelle Gewebsregenerationsfähigkeit.
Lokale Pflege und Komplikationsmanagement
Die lokale Antisepsis stellt einen unverzichtbaren therapeutischen Pfeiler in der Behandlung kutaner Kalzinosen dar. Die rigorose Anwendung topischer Antiseptika, insbesondere Chlorhexidin in angepasster Konzentration (0,5 bis 2% je nach lokaler Verträglichkeit), erweist sich als fundamental zur Kontrolle sekundärer bakterieller Superinfektionen und zur Aufrechterhaltung einer für die Heilung günstigen lokalen Umgebung.
Dieser präventive Ansatz ermöglicht es, infektiöse Komplikationen zu begrenzen, die die natürliche Evolution der Läsionen maskieren und die Bewertung der therapeutischen Wirksamkeit kompromittieren können. Chlorhexidin bietet den Vorteil einer ausgezeichneten lokalen Verträglichkeit und eines breiten antimikrobiellen Spektrums, einschließlich gram-positiver und gram-negativer Bakterien, die gewöhnlich bei Hautinfektionen beteiligt sind.
Andere Antiseptika können als Alternative oder in Rotation verwendet werden: Povidon-Jod, besonders wirksam aber potenziell reizend, chlorhaltige Derivate in niedriger Konzentration oder silberbasierte Antiseptika für resistente ulzerierte Läsionen. Die Alternierung der Antiseptika kann die Entwicklung bakterieller Resistenzen verhindern.
Die systemische Antibiotherapie bleibt in der Routinebehandlung selten indiziert, außer bei nachgewiesener Sepsis, ausgedehnter Superinfektion mit systemischen Zeichen oder Versagen lokaler antiseptischer Behandlungen. Wenn sie sich als notwendig erweist, sollte die Antibiotikaauswahl von einer bakteriellen Kultur und einem Antibiogramm geleitet werden, angesichts der Häufigkeit von Resistenzen in diesem Kontext.
Die Verwendung keratomodulierender und erweichender Mittel kann die Erweichung hyperkeratotischer und krustiger Bereiche erleichtern und so den Komfort des Tieres verbessern und die Elimination oberflächlicher Debris fördern. Diese Topika, einschließlich Harnstoff, Salicylsäure in niedriger Konzentration oder Ceramide, tragen ebenfalls zur progressiven Wiederherstellung der Hautelastizität in den Randbereichen der Läsionen bei.
Okklusive Verbände können vorteilhaft sein, um die lokale Hydratation aufrechtzuerhalten und ulzerierte Läsionen vor mechanischen Traumata zu schützen. Jedoch erfordert ihre Verwendung eine aufmerksame Überwachung, um übermäßige Mazeration zu verhindern, die Superinfektionen fördern würde.
Selektive chirurgische Ansätze
Die chirurgische Exzision behält ihre Relevanz für einzigartige, sehr lokalisierte Läsionen, die eine Quelle erheblichen Unbehagens für das Tier darstellen. Diese therapeutische Option muss sorgfältig nach mehreren Kriterien bewertet werden: Größe und Lokalisation der Läsionen, Allgemeinzustand des Tieres, technische Durchführbarkeit der Exzision und Heilungsaussichten.
Die Vorteile des chirurgischen Ansatzes umfassen die sofortige Resolution problematischer Läsionen, die Möglichkeit einer histopathologischen Bestätigungsanalyse und die schnelle Verbesserung des Tierkomforts. Jedoch umfassen die Nachteile Anästhesierisiken, besonders bei Tieren mit Hyperkortizismus mit seinen kardiovaskulären und metabolischen Komplikationen, und das Risiko von Heilungsstörungen im Zusammenhang mit Hyperkortizismus.
Der CO2-Laser kann eine interessante Alternative für bestimmte besondere Situationen darstellen. Diese Technik bietet den Vorteil besserer Hämostase, überlegener Schnittpräzision und potenziell verbesserter Heilung. Jedoch bleibt ihre Zugänglichkeit begrenzt und ihre Verwendung erfordert spezifische technische Expertise.
Rekonstruktive Chirurgietechniken können sich für ausgedehnte Läsionen als notwendig erweisen, insbesondere in Bereichen, wo ein primärer Verschluss unmöglich ist. Lokale Hautlappen oder Transplantate können in Betracht gezogen werden, obwohl Hyperkortizismus oft die Transplantatannahme kompromittiert.
Dimethylsulfoxid: Kontroverse Wirksamkeit und Grenzen
DMSO, ein organisches Lösungsmittel mit anerkannten entzündungshemmenden Eigenschaften, insbesondere durch Abfangen freier Radikale und Hemmung bestimmter Entzündungswege, profitiert von einer historischen Verwendung in der Behandlung von Kalzinosen. Seine bemerkenswerte Gewebspenetrationsfähigkeit, verbunden mit seiner besonderen Molekularstruktur, macht es theoretisch zu einem interessanten Kandidaten für diese topische Indikation.
Die physikochemischen Eigenschaften von DMSO erklären sein potenzielles Interesse: niedriges Molekulargewicht, das die transkutane Diffusion erleichtert, Fähigkeit zur Solubilisierung vieler Substanzen, entzündungshemmende Eigenschaften durch Hemmung der Polymerisation freier Radikale und lokale analgetische Wirkung durch Blockierung kleiner Nervenfasern.
Jedoch bleibt seine tatsächliche Wirksamkeit durch rigorose kontrollierte Studien zu demonstrieren. Die Bewertungsschwierigkeit rührt daher, dass Kalzinosen spontan zurückgehen können, sobald die primäre Ursache korrigiert ist, was die Zuordnung beobachteter Verbesserungen zur DMSO-Behandlung komplex macht. Der genaue Wirkungsmechanismus in diesem Kontext bleibt rätselhaft: direkte Auflösung kalzischer Kristalle, unspezifische entzündungshemmende Wirkung, Verbesserung der lokalen Mikrozirkulation oder einfacher Placebo-Effekt.
Das Fehlen eines standardisierten Protokolls stellt eine wichtige Limitation dar, die die objektive Bewertung dieser Therapie kompromittiert. Die Literatur berichtet über extrem variable therapeutische Schemata, von drei bis vier täglichen Anwendungen für maximal zwei Wochen bis zu einer zweiwöchentlichen Anwendung über mehrere Wochen nach bestimmten Fallberichten. Die Empfehlungen von Muller & Kirk befürworten zwei tägliche Anwendungen ohne Angabe der Dauer, während andere Quellen eine Anwendung alle zwei Tage über mehrere Wochen vorschlagen.
Diese protokollarische Heterogenität reflektiert das Fehlen solider Evidenzdaten und die empirische Natur dieser Verwendung. Die Etablierung eines standardisierten Protokolls würde randomisierte kontrollierte klinische Studien erfordern, die verschiedene therapeutische Schemata mit einem Placebo vergleichen.
Die potenziellen Nebenwirkungen erfordern besondere Wachsamkeit und begrenzen die Verwendung dieses Moleküls. Für den Anwender ist das Tragen dicker Gummihandschuhe unerlässlich, um die perkutane Absorption zu vermeiden, die unerwünschte systemische Wirkungen verursachen kann. Das Einatmen der Dämpfe muss ebenfalls vermieden werden, was eine angemessene Belüftung der Anwendungsräume erfordert.
Beim behandelten Tier wurden verschiedene lokale Reaktionen berichtet: sofortiges Brennen nach Anwendung, vorübergehendes Erythem und Ödem, Hauttrockenheit und Desquamation und in bestimmten Fällen paradoxe Verschlechterung der lokalen Entzündung. Augeneffekte bei längerer Verwendung oder hoher Dosis umfassen Kristallinveränderungen und Akkommodationsstörungen. Unspezifisches allgemeines Unwohlsein kann ebenfalls auftreten, besonders bei Anwendungen auf ausgedehnten Oberflächen.
Die Daten bezüglich einer möglichen Nephrotoxizität oder Hepatotoxizität bleiben widersprüchlich und unzureichend belegt. Bestimmte Berichte deuten auf Veränderungen der Leberparameter bei verlängerten Anwendungen hin, während andere Studien keine signifikante systemische Toxizität finden. Diese Unsicherheit erfordert eine klinische und biologische Überwachung bei Tieren, die längere Zeit behandelt werden.
Bei Verwendung auf großen Hautoberflächen wird ein vorsichtiger Ansatz, der kleine Bereiche sequenziell behandelt, dringend empfohlen, um die Risiken systemischer Absorption und unerwünschter Wirkungen zu minimieren. Diese Strategie ermöglicht es auch, die lokale Verträglichkeit zu bewerten, bevor die Behandlung ausgedehnt wird.
Vielfalt humanmedizinischer pharmakologischer Ansätze
Die Humanmedizin hat ein substantielles therapeutisches Arsenal für die Behandlung von Kalzinosen entwickelt, das verschiedene pathophysiologische Mechanismen angreift. Diese multiplen Ansätze bieten interessante Perspektiven für eine Übertragung in die Veterinärmedizin, obwohl noch keine systematische Bewertung in der Hundeart unternommen wurde. Das Fehlen einer universell wirksamen Standardbehandlung in der Humanmedizin unterstreicht die Komplexität dieser Pathologie und die Notwendigkeit individualisierter Ansätze.
Die humanmedizinischen therapeutischen Strategien zielen auf mehrere Mechanismen ab: Hemmung der kalzischen Kristallbildung, Verbesserung ihrer Solubilisierung in den Geweben, Verringerung lokaler und systemischer Entzündung oder Modulation der Kalzium- und Phosphatstoffwechselwege. Dieser multimodale Ansatz ermöglicht es, die Behandlung an die vorherrschenden pathophysiologischen Mechanismen in jedem besonderen Fall anzupassen.
Diltiazem, ein Kalziumantagonist
Es hemmt den intrazellulären Kalziumeintritt durch Blockierung spannungsabhängiger L-Typ-Kalziumkanäle. Diese Wirkung könnte theoretisch Gewebsverkalkungsprozesse begrenzen, indem die Verfügbarkeit von intrazellulärem Kalzium für die Kristallbildung reduziert wird. Die humane Dosierung von 2 bis 4 mg/kg/Tag zeigt begrenzte Toxizität, hauptsächlich kardiovaskulär (Hypotonie, Bradykardie), aber die Unbedenklichkeit bei längerer Anwendung beim Hund bleibt undokumentiert.
Die Verwendung von Diltiazem in der veterinärkardiologischen Medizin, insbesondere zur Behandlung der felinen hypertrophen Kardiomyopathie, deutet auf eine akzeptable Verträglichkeit hin. Jedoch würden Dosisanpassung und Überwachung von Nebenwirkungen spezifische Studien für die Kalzinose-Indikation erfordern.
Bisphosphonate: Modulatoren der Makrophagenaktivität
Die Bisphosphonate (Alendronat, Pamidronat, Etidronat) üben ihre Wirkung durch Hemmung der Makrophagenaktivität und der kalzischen Knochenresorption aus. Diese Moleküle, strukturelle Analoga des Pyrophosphats, binden bevorzugt an Hydroxyapatit und interferieren mit Mineralisations- und Demineralisationsprozessen.
Ihre Wirksamkeit wurde in mehreren humanen Kollagenosen dokumentiert, insbesondere bei Sklerodermie und Dermatomyositis, wo sie signifikant die Größe und Anzahl kalzischer Ablagerungen reduzieren. Der Wirkungsmechanismus beinhaltet wahrscheinlich eine Hemmung der Aktivität von Gewebsmakrophagen, die aktiv an dystrophischen Verkalkungsprozessen teilnehmen.
Potenzielle Nebenwirkungen umfassen Hypokalzämie, manchmal schwer und eine Supplementierung erfordernd, Fieber nach Verabreichung (besonders bei intravenösen Formen) und Kiefernekrose, eine seltene aber schwere Komplikation, die hauptsächlich bei Bisphosphonaten der dritten Generation beobachtet wird.
In der kaninen Veterinärmedizin bleibt ihre Verwendung derzeit begrenzt, aber bestimmte Moleküle wie Pamidronat werden für die Behandlung metastatischer Knochenschmerzen oder tumoraler Osteolysen verwendet. Diese begrenzte klinische Erfahrung deutet auf eine akzeptable Verträglichkeit hin, würde aber eine Anpassung für die kutane Kalzinose-Indikation erfordern.
Chelatbildner und Löslichkeitsmodulatoren
Natriumthiosulfat hat die Eigenschaft, die Kalziumlöslichkeit durch Bildung löslicher Komplexe mit Kalziumionen zu erhöhen. Dieses Molekül kann je nach Indikation und Verträglichkeit topisch, intraläsional oder intravenös verwendet werden. Sein Wirkungsmechanismus beinhaltet eine direkte Chelatisierung von Gewebekalzium und eine Verbesserung seiner Mobilisierung zur systemischen Zirkulation.
Seine bemerkenswerte systemische Toxizität umfasst Übelkeit und Erbrechen, potenziell schwere Hypokalzämie und verschiedene Elektrolytstörungen einschließlich Hypomagnesiämie und Hypokaliämie. Diese unerwünschten Wirkungen erfordern eine enge biologische Überwachung bei systemischen Anwendungen.
Obwohl derzeit keine Verwendung beim Hund berichtet wird, könnten Forschungen für eine lokale Anwendung in Form von Gel oder topischer Lösung in Betracht gezogen werden. Dieser Ansatz würde die Risiken systemischer Wirkungen minimieren, während die gewünschte lokale Wirkung erhalten bliebe.
Aluminiumhydroxid wirkt als Phosphatbinder auf Darmebene und reduziert die digestive Absorption des letzteren. Diese indirekte Wirkung auf den Phosphokalzium-Stoffwechsel könnte bei metastatischen Formen der Kalzinose von Interesse sein. Die humanen Dosen von 1,8 bis 2,4 g/Tag deuten auf eine potenzielle Verwendung beim Tier hin, aber diese Anwendung bleibt im Kontext der Kalzinose nicht validiert.
Die Verwendung dieses Moleküls in der Veterinärmedizin für die Behandlung der Hyperphosphatämie bei chronischen Niereninsuffizienten deutet auf eine akzeptable Verträglichkeit hin. Jedoch würden Dosisanpassung und Bewertung der spezifischen Wirksamkeit gewidmete Studien erfordern.
Antibiotika mit antikalzifizierenden Eigenschaften
Minocyclin zeigt besonders interessante multiple Eigenschaften: Hemmung der Matrix-Metalloproteasen (MMP), die an Gewebsumbauprozessen teilnehmen, direkte Kalziumchelatisierung durch seine funktionellen Gruppen und Reduktion der Entzündung durch Hemmung der Mikroglia-Aktivierung und der Produktion proinflammatorischer Zytokine.
Die humane Dosierung von 50 bis 100 mg/Tag eröffnet Verwendungsperspektiven beim Hund, zumal dieses Molekül bereits in bestimmten veterinärdermatologischen Indikationen existiert, insbesondere zur Behandlung von Pyodermien mit resistenten Keimen. Diese bereits existierende klinische Erfahrung würde die Dosisanpassung und Überwachung von Nebenwirkungen erleichtern.
Matrix-Metalloproteasen spielen eine entscheidende Rolle bei dystrophischen Verkalkungsprozessen, indem sie die extrazelluläre Matrix abbauen und Faktoren freisetzen, die die Mineralisierung fördern. Ihre Hemmung durch Minocyclin könnte daher von direktem therapeutischem Interesse sein.
Ceftriaxon bietet eine potenziell vorteilhafte Nebenwirkung durch Hemmung der Matrix-Metalloproteasen, Kalziumchelatisierung durch seine β-Lactam-Gruppen und unspezifische entzündungshemmende Wirkung. Jedoch verbieten die Regeln für verantwortliche Antibiotikaverordnung, besonders streng für Cephalosporine der dritten Generation, formal die Überlegung ihrer Verwendung in der Veterinärmedizin für diese nicht-infektiöse Indikation.
Diese regulatorische Beschränkung unterstreicht die Bedeutung der Entwicklung nicht-antibiotischer Alternativen, um die Beitragung zur Antibiotikaresistenz zu vermeiden, während innovative therapeutische Wege erforscht werden.
Modulatoren des Phosphokalzium-Stoffwechsels
Probenecid erhöht die renale Phosphatausscheidung durch Hemmung seiner tubulären Reabsorption. Seine vorteilhafte Wirkung wurde bei juveniler Dermatomyositis dokumentiert, wo es signifikant kalzische Hautablagerungen reduziert. Dieses Molekül wird derzeit nicht in der Veterinärmedizin verwendet, aber sein Wirkungsmechanismus könnte bei metastatischen Formen der Kalzinose von Interesse sein.
Die Anpassung dieses Ansatzes in der Veterinärmedizin würde pharmakokinetische Vorstudien erfordern, um angemessene Dosierungen zu bestimmen und die Verträglichkeit in der Hundeart zu bewerten. Humane Nebenwirkungen umfassen hauptsächlich Verdauungsstörungen und Überempfindlichkeitsreaktionen.
Colchicin
Es zeigt spezifische entzündungshemmende Eigenschaften durch Hemmung der Mikrotubuli-Polymerisation und Modulation der Neutrophilen-Aktivierung. Seine Verwendung in der Veterinärmedizin bleibt wenig entwickelt, aber einige Anwendungen existieren, insbesondere zur Behandlung des familiären Fiebers des Shar-Pei.
Ein besonders ermutigender Fallbericht dokumentierte eine deutliche Verbesserung von Kalzinose-Läsionen bei einem Hund, der mit Colchicin in der für das familiäre Fieber des Shar-Pei verwendeten Dosis behandelt wurde (etwa 0,01 bis 0,03 mg/kg/Tag). Obwohl diese Daten sehr vorläufig bleiben und nur eine isolierte Beobachtung darstellen, illustrieren sie das potenzielle Interesse gezielter Entzündungshemmer und unterstreichen die Notwendigkeit, klinische Studien zur rigorosen Bewertung dieser neuen Optionen durchzuführen.
Der Wirkungsmechanismus von Colchicin in diesem Kontext könnte eine Hemmung der Inflammasom-Aktivierung beinhalten, multiproteische Komplexe, die für die Reifung von IL-1β und IL-18 verantwortlich sind, Schlüsselzytokine bei dystrophischen Verkalkungsprozessen.
Diese vorläufige Beobachtung mit Colchicin eröffnet besonders interessante Perspektiven, da sie die Durchführbarkeit eines spezifischen pharmakologischen Ansatzes in der Veterinärmedizin demonstriert. Die scheinbar zufriedenstellende Verträglichkeit und die beobachtete klinische Verbesserung rechtfertigen die Einrichtung rigoroserer klinischer Studien.
Der Vorteil von Colchicin liegt in seinem gut etablierten Sicherheitsprofil beim Hund dank seiner Verwendung beim familiären Fieber des Shar-Pei und in seinem spezifischen Wirkungsmechanismus auf Entzündungswege, die bei dystrophischer Verkalkung beteiligt sind.
Praktische Empfehlungen und Entscheidungsalgorithmus
Strukturierter diagnostischer Ansatz
Die frühzeitige Erkennung von Kalzinosen beruht auf einem diagnostischen Dreiklang: Identifikation charakteristischer klinischer Muster, Analyse des anamnestischen Kontexts und Ausschluss der hauptsächlichen Differentialdiagnosen. Dieser systematische Ansatz ermöglicht es, diagnostische Verzögerungen zu vermeiden, die die therapeutische Wirksamkeit kompromittieren, und die frühzeitige Betreuung zu optimieren.
Die anamnestische Befragung muss besonders sorgfältig sein und systematisch nach Vorgeschichte einer Kortikotherapie suchen (Molekül, Dosierung, Dauer, Verabreichungsweg), Zeichen spontanen Hyperkortizismus (Polyurie-Polydipsie, Polyphagie, bilaterale symmetrische Alopezien, Muskelatrophie, abdominale Distension) und Pathologien, die Störungen des Phosphokalzium-Stoffwechsels verursachen können (chronische Niereninsuffizienz, maligne Tumoren, Hyperparathyreoidismus).
Die klinische Untersuchung muss systematisch und vollständig sein, sich nicht auf Hautläsionen beschränken, sondern auch assoziierte systemische Zeichen suchen. Die aufmerksame Palpation des gesamten Integuments ermöglicht es, beginnende oder asymptomatische Läsionen zu identifizieren, die auf eine diffusere Beteiligung hinweisen.
Die Bewertung der zugrunde liegenden Ursache muss exhaustiv und durch epidemiologische Daten orientiert sein. Die Suche nach Hyperkortizismus, ob iatrogen oder spontan, stellt die absolute Priorität dar angesichts seiner dominanten Häufigkeit. Diese Bewertung umfasst die Messung des basalen Cortisols, Dexamethason-Suppressionstests und eventuell die Dosierung des endogenen ACTH zur Unterscheidung hypophysärer und adrenaler Formen.
Die Exploration chronischer Niereninsuffizienz ist in zweiter Intention erforderlich, besonders bei älteren Tieren oder solchen mit Nephropathie-Vorgeschichte. Diese Bewertung umfasst die Messung von Serum-Kreatinin und -Harnstoff, vollständige Urinanalyse und Bewertung des Phosphokalzium-Stoffwechsels (Kalzämie, Phosphatämie, Parathormon falls verfügbar).
Hierarchisierte therapeutische Strategie
Die Korrektur der primären Ursache bleibt der unverzichtbare grundlegende Schritt, der die gesamte mittel- und langfristige Prognose bedingt. Dieser ätiologische Ansatz muss jeder symptomatischen Betrachtung vorgezogen werden, da er direkt die Chancen auf spontane Läsionsregression bestimmt.
Im majoritären Fall des iatrogenen Hyperkortizismus muss das progressive Absetzen der Kortikotherapie individuell geplant werden entsprechend der Dauer der vorherigen Behandlung, den verwendeten Dosen und der ursprünglich behandelten Pathologie. Ein progressives Reduzierungsprotokoll über 4 bis 8 Wochen minimiert die Risiken iatrogener Nebenniereninsuffizienz und ermöglicht eine Erholung der Hypothalamus-Hypophysen-Nebennieren-Achse.
Für spontane Hyperkortizismen muss die spezifische Behandlung (Trilostan, Mitotan) oder chirurgische (Adrenalektomie, Hypophysektomie) entsprechend den etablierten Empfehlungen für diese Pathologien unternommen werden. Die Behandlung der Kalzinosen wird dann sekundär und folgt im Allgemeinen der Verbesserung des Hyperkortizismus.
Lokale antiseptische Pflege stellt eine unverzichtbare Ergänzung dar, um infektiöse Komplikationen zu verhindern und die Integrität der umgebenden Gewebe zu erhalten. Dieser präventive Ansatz ermöglicht es, optimale Bedingungen für spontane Heilung zu bewahren und verschlechternde Faktoren zu vermeiden.
Das empfohlene antiseptische Protokoll umfasst eine zweimal tägliche Reinigung der Läsionen mit einer Chlorhexidin-Lösung 0,5-2% je nach lokaler Verträglichkeit, gefolgt von sorgfältigem Trocknen und eventueller Anwendung eines Erweichungsmittels. Diese Routine muss bis zur vollständigen Resolution der Läsionen aufrechterhalten werden.
Die Verwendung spezifischer Behandlungen wie DMSO sollte schweren oder resistenten Fällen vorbehalten bleiben, unter strikter Beachtung der Anwendungsvorsichtsmaßnahmen und unter Information der Besitzer über die Unsicherheiten bezüglich der tatsächlichen Wirksamkeit. Ein sequenzieller Ansatz, der kleine Bereiche nacheinander behandelt, minimiert die Risiken systemischer Wirkungen und ermöglicht eine Bewertung der lokalen Verträglichkeit.
Überwachungskriterien und prognostische Indikatoren
Die Bewertung der Läsionsevolution erfordert standardisierte objektive Kriterien, um eine reproduzierbare Einschätzung der therapeutischen Wirksamkeit zu ermöglichen. Serielle medizinische Fotografie stellt ein wertvolles Werkzeug dar, um morphologische Veränderungen zu dokumentieren und die Evolution der Läsionsoberfläche quantitativ zu bewerten.
Die zu überwachenden Parameter umfassen die Größe der Läsionen (bidimensionale Messung), ihr Aussehen (Färbung, Relief, Verhärtung), das Vorhandensein von Komplikationen (Ulzeration, Extrusion kalzischen Materials, Superinfektion) und den Allgemeinzustand des Tieres (Juckreiz, Schmerz, funktionelle Beeinträchtigung).
Ein zusammengesetzter Läsions-Score, der diese verschiedenen Parameter integriert, würde die standardisierte Bewertung und interindividuelle Vergleiche erleichtern. Dieser Score könnte eine Bewertung von 0 bis 3 für jeden Parameter (Größe, Verhärtung, Entzündung, Ulzeration) mit einer maximalen Gesamtpunktzahl umfassen, die zur Schwere orientiert.
Die Überwachung potenzieller Komplikationen, insbesondere infektiöser, erfordert regelmäßige klinische Untersuchungen in Intervallen, die an die anfängliche Schwere angepasst sind. Ein wöchentlicher Rhythmus für schwere Formen, zweiwöchentlich für moderate Formen und monatlich für geringfügige Formen stellt einen vernünftigen Kompromiss zwischen optimaler Überwachung und praktischen Zwängen dar.
Wiederholte Hautzytologie ermöglicht es, bakterielle Superinfektionen frühzeitig zu erkennen und antiseptische Protokolle anzupassen. Diese mikrobiologische Überwachung erweist sich als besonders wichtig für ulzerierte oder exsudative Läsionen, die ein erhöhtes Infektionsrisiko aufweisen.
Management therapeutischer Fehlschläge
Das Fehlen einer Verbesserung nach 6 bis 8 Wochen gut durchgeführter ätiologischer Behandlung muss die Diagnose überdenken lassen oder nach unerkannten verschlechternden Faktoren suchen. Diese Situation erfordert eine vollständige Neubewertung einschließlich der Überprüfung der effektiven Korrektur der primären Ursache und der Suche nach Komorbiditäten.
Ursachen therapeutischen Versagens umfassen das Bestehen eines residuellen Hyperkortizismus (unzureichende Reduzierung, unerkannter spontaner Hyperkortizismus), das Vorhandensein unkontrollierter infektiöser Komplikationen oder die Existenz intrinsischer Resistenzfaktoren (übermäßige Chronizität, Heilungsstörungen).
In diesen therapeutischen Sackgassen-Situationen kann die Verwendung adjuvanter Behandlungen, die von der Humanmedizin inspiriert sind, in Ermangelung einer Alternative in Betracht gezogen werden. Dieser mitfühlende Ansatz erfordert eine aufgeklärte Information der Besitzer über den experimentellen Charakter dieser Behandlungen und die Notwendigkeit verstärkter Überwachung.
Prävention und Aufklärung
Die primäre Prävention iatrogener Kalzinosen beruht auf der vernünftigen Verwendung von Kortikosteroiden: Verschreibung in minimal wirksamer Dosis, Begrenzung der Behandlungsdauer, Suche nach therapeutischen Alternativen wann immer möglich und regelmäßige klinische Überwachung von Patienten unter verlängerter Kortikotherapie.
Die Aufklärung der Besitzer spielt eine entscheidende Rolle bei der frühen Erkennung von Läsionen und der therapeutischen Compliance. Die Ratschläge umfassen tägliche Überwachung des Hautzustands, Erkennung von Alarmzeichen, die eine dringende Konsultation erfordern, und die Bedeutung der Compliance mit dem verschriebenen therapeutischen Protokoll.
Die kontinuierliche Fortbildung der Praktiker über die neuesten diagnostischen und therapeutischen Fortschritte würde ermöglichen, die Qualität der Betreuung zu verbessern und diagnostische Verzögerungen zu reduzieren. Diese Ausbildung sollte die Erkennung atypischer Formen und das Wissen über neue therapeutische Optionen umfassen.
Schlussfolgerung und Zukunftsperspektiven
Die kutane Kalzinose beim Hund stellt ein exemplarisches Modell einer dermatologischen Pathologie dar, die einen multidisziplinären Ansatz erfordert, der Dermatologie, Endokrinologie und Innere Medizin integriert. Das tiefgreifende Verständnis der zugrunde liegenden pathophysiologischen Mechanismen und die präzise Identifikation ätiologischer Ursachen bilden die Grundlagen einer optimalen Betreuung, die direkt die funktionelle und ästhetische Prognose bedingt.
Die überwältigende Vorherrschaft des Hyperkortizismus in der Ätiologie kaniner Kalzinosen, kontrastierend mit der Vielfalt der in der Humanmedizin beobachteten Ursachen, unterstreicht die epidemiologischen Besonderheiten dieser Erkrankung in der Hundeart. Diese ätiologische Spezifität vereinfacht relativ den diagnostischen Ansatz, sollte aber die minoritären Formen nicht vernachlässigen lassen, die angepasste therapeutische Strategien erfordern.
Die aktuellen Limitationen des veterinärtherapeutischen Arsenals kontrastieren auffällig mit dem Reichtum der in der Humanmedizin entwickelten Optionen. Diese Disparität unterstreicht die Dringlichkeit der Entwicklung translationaler Forschungsprogramme zur Bewertung der Wirksamkeit und Unbedenklichkeit vielversprechender pharmakologischer Ansätze in der Hundeart. Die humane Erfahrung bietet ein beträchtliches Reservoir therapeutischer Innovationen, die eine Anpassung und Validierung in der Veterinärmedizin verdienen würden.
Das Fehlen kontrollierter klinischer Studien bleibt die hauptsächliche Limitation des therapeutischen Fortschritts in diesem Bereich. Diese methodologische Lücke perpetuiert die Verwendung empirischer Behandlungen und begrenzt die Fähigkeit, evidenzbasierte Empfehlungen zu etablieren. Die Einrichtung randomisierter multizentrischer klinischer Studien stellt einen Imperativ dar, um das Wissen voranzubringen und die Versorgungsqualität zu verbessern.
Die Grundlagenforschung über die molekularen Mechanismen kutaner Verkalkung beim Hund könnte speziesspezifische Besonderheiten aufdecken und neue therapeutische Ziele identifizieren. Dieser mechanistische Ansatz ist unverzichtbar für die Entwicklung rationaler und wirksamer Behandlungen.