Die Veterinärdermatologie hat in den letzten zwei Jahrzehnten eine radikale Transformation erfahren, die durch das Auftreten und die weltweite Verbreitung von Methicillin-resistenten Staphylokokken (MRS) geprägt war. Früher als einfache bakterielle Infektionen betrachtet, die vorhersagbar auf Behandlungen ansprachen, stehen heute Pyodermien bei Hunden im Zentrum einer Krise der Antimikrobiellen Resistenz.
September 2025
Einleitung: Das Aufkommen einer klinischen und öffentlichen Gesundheitsherausforderung
Diese Entwicklung hat den Veterinärberuf dazu gezwungen, seine diagnostischen, therapeutischen und Biosicherheitsansätze grundlegend zu überdenken. Dieser Bericht zielt darauf ab, eine umfassende Analyse der Bedeutung von MRS in der Veterinärdermatologie zu liefern, basierend auf aktuellen wissenschaftlichen Daten zur Aufklärung der klinischen Praxis und öffentlichen Gesundheit.
Das Hauptproblem liegt darin, dass die Methicillin-Resistenz, die eine klinische Unwirksamkeit der gesamten Klasse der Beta-Lactame verleiht, sehr häufig mit einem Multiresistenz-Phänotyp (MDR) assoziiert ist. Diese Assoziation macht viele andere Antibiotikafamilien unwirksam, wie Makrolide, Lincosamide, Fluorchinolone oder Aminoglykoside. Diese Situation hat einen therapeutischen Paradigmenwechsel bewirkt. Das Versagen von empirischen Behandlungen, die früher wirksam waren, zwingt Kliniker dazu, auf Antibiotika als letztes Mittel zurückzugreifen, wie Chloramphenicol oder Rifampicin. Diese Alternativen, obwohl potenziell wirksam wenn das Antibiogramm es bestätigt, weisen problematischere Nebenwirkungsprofile auf und erfordern eine engere biologische Überwachung, was die Komplexität, Risiken und Kosten der Behandlung erhöht.
Es ist zu bemerken, dass für die GEDAC (Französische Studiengruppe für Dermatologie bei Heimtieren) Rifampicin zu den Antibiotika gehört, die niemals verwendet werden sollten, um es für die Humanmedizin zur Behandlung schwerer menschlicher Infektionen wie Tuberkulose zu bewahren. Dasselbe gilt für Mupirocin.
Historischer Kontext und Paradigmenwechsel
Die Ära nach dem Zweiten Weltkrieg führte Antimikrobielle in die Veterinärmedizin ein und revolutionierte die Behandlung von Infektionskrankheiten. Jahrzehntelang wurden Pyodermien bei Hunden, hauptsächlich durch Staphylokokken verursacht, erfolgreich mit β-Lactam-Antibiotika behandelt, wie Penicillinen und Cephalosporinen. Diese weit verbreitete, oft empirische Verwendung übte jedoch einen intensiven Selektionsdruck auf bakterielle Populationen aus. Das unvermeidliche Ergebnis dieses Drucks war die Entstehung resistenter Stämme, die ein handhabbares klinisches Problem in eine große therapeutische Herausforderung verwandelten. Das signifikante Auftreten von Methicillin-resistentem Staphylococcus pseudintermedius (MRSP) um die Mitte der 2000er Jahre markierte einen Wendepunkt und signalisierte das Ende der Ära des Vertrauens in empirische Behandlungen für Pyodermie. Dies ist kein isoliertes Ereignis, sondern die direkte und vorhersagbare Konsequenz unserer vergangenen therapeutischen Praktiken. Da die Pyodermie bei Hunden eine extrem häufige Erkrankung ist und die Erstlinienbehandlung historisch ein β-Lactam-Antibiotikum war, schuf die wiederholte Verwendung dieser Medikamente eine ideale evolutionäre Umgebung für die Selektion und Verbreitung von Stämmen, die Resistenzgene tragen. So haben unsere eigenen Behandlungsprotokolle unbeabsichtigt die Entstehung der Pathogene geprägt, die heute am schwierigsten zu behandeln sind.
Definition und Taxonomie
Die Methicillin-Resistenz bei Staphylokokken ist ein Phänotyp, der Resistenz gegen praktisch alle Antibiotika der β-Lactam-Klasse verleiht, einschließlich Penicilline, Cephalosporine und Carbapeneme. Der zugrunde liegende molekulare Mechanismus ist das Vorhandensein des mecA-Gens, das auf einem mobilen genetischen Element namens Staphylokokken-Chromosomale Kassette (SCCmec) lokalisiert ist. Dieses Gen kodiert für ein modifiziertes Penicillin-bindendes Protein, PBP2a (Penicillin-Binding Protein 2a), das eine sehr geringe Affinität zu β-Lactam-Antibiotika besitzt. Folglich kann die Synthese der bakteriellen Zellwand auch in Anwesenheit dieser Antibiotika fortgesetzt werden, was sie unwirksam macht.
Der Multiresistenz-Phänotyp (MDR), der häufig bei MRS beobachtet wird, ist kein zufälliges Phänomen. Die SCCmec-Kassette ist eine genetische Plattform, die zusätzlich zum mecA-Gen Gene transportieren und übertragen kann, die Resistenz gegen andere Antibiotikaklassen verleihen (z.B. Tetracycline, Makrolide). So kann der Selektionsdruck durch die Verwendung eines Beta-Lactams nicht nur Methicillin-resistente Stämme selektieren, sondern auch in einem einzigen Ereignis eine Resistenz gegen mehrere andere Antibiotikafamilien ko-selektieren. Dieses Phänomen der Ko-Selektion erklärt das schnelle Auftreten quasi-unbehandelbarer Stämme und verstärkt das Argument gegen die empirische Verwendung von Beta-Lactamen bei Staphylokokken-Infektionen.
Ein grundlegender Punkt zum Verständnis der aktuellen Epidemiologie ist die taxonomische Umklassifikation, die 2005 stattfand. Zuvor wurden die meisten Koagulase-positiven Staphylokokken, die bei Hunden isoliert wurden, als Staphylococcus intermedius identifiziert. Molekulare Techniken ermöglichten es, drei verschiedene Arten innerhalb der Staphylococcus intermedius Gruppe (SIG) zu unterscheiden: S. intermedius, S. delphini und S. pseudintermedius. Diese Revision enthüllte, dass S. pseudintermedius die vorherrschende Art ist, die Hunde und Katzen kolonisiert und Infektionen verursacht. Folglich war die große Mehrheit der Isolate, die zuvor in der veterinärmedizinischen Literatur als S. intermedius identifiziert wurden, tatsächlich S. pseudintermedius. In der Hundedermatologie sind drei MRS-Arten besonders relevant: S. pseudintermedius (MRSP), S. aureus (MRSA) und S. schleiferi (MRSS).
Globale Bedeutung und das “One Health”-Konzept
Das Problem der MRS bei Heimtieren geht weit über die Wände der Veterinärklinik hinaus und wird zu einem Problem der öffentlichen Gesundheit. Diese Situation passt perfekt in den Rahmen des “One Health” (Eine Gesundheit)-Konzepts, das die tiefe und untrennbare Verbindung zwischen menschlicher Gesundheit, Tiergesundheit und Umweltgesundheit anerkennt. Heimtiere teilen unsere häusliche Umgebung, erhalten oft ähnliche Antibiotikaklassen wie die in der Humanmedizin verwendeten und können als Reservoire oder Vektoren für resistente Bakterien dienen. Das Vorhandensein von MRSA und MRSP bei Heimtieren stellt sie in das Zentrum eines dynamischen Übertragungsdreiecks zwischen Menschen, Tieren und ihrer gemeinsamen Umgebung. Das Management der Antibiotikaresistenz in der Veterinärdermatologie ist daher nicht nur eine Frage des Tierwohls, sondern auch eine geteilte Verantwortung im weltweiten Kampf gegen die wachsende Bedrohung durch “Superbakterien”.
Epidemiologie und Entwicklung resistenter Staphylokokken
Die Epidemiologie der MRS in der Veterinärmedizin ist ein dynamisches Gebiet, das durch das schnelle Auftreten resistenter Klone und ihre weltweite Verbreitung charakterisiert ist. Das Verständnis der Prävalenz, Risikofaktoren und Reservoire dieser Pathogene ist für ein effektives klinisches und präventives Management unerlässlich.
A. Methicillin-resistenter Staphylococcus pseudintermedius (MRSP): Der dominante Hundepathogen
Geschichte des Auftretens
Obwohl sporadische Fälle in den 1990er Jahren berichtet wurden, ist das signifikante Auftreten von MRSP als großer klinischer Pathogen ein relativ neues Phänomen, das ab 2006 an Bedeutung gewann. Die ersten offiziellen Anerkennungen datieren von 2001 in Nordamerika und 2007 in Europa. Dieses schnelle Auftreten war nicht das Ergebnis mehrerer unabhängiger Resistenzereignisse, sondern wurde hauptsächlich durch die explosive klonale Verbreitung einiger sehr erfolgreicher bakterieller Linien verursacht.
Weltweite klonale Verbreitung
Die Analyse durch Multilocus-Sequenztypisierung (MLST) ermöglichte es, die weltweite Verbreitung von MRSP zu kartieren. Eine systematische Übersicht identifizierte fünf große klonale Komplexe (CC), die die epidemiologische Landschaft dominieren.
- CC71: Ursprünglich als der “europäische epidemische Klon” beschrieben, ist er heute weltweit verbreitet, obwohl die Mehrheit der Isolate noch aus Europa stammt.
- CC68: Bekannt als der “nordamerikanische epidemische Klon”, wird er häufig in Nordamerika isoliert, wurde aber auch in Europa identifiziert.
- CC258: Zunehmend in Europa gemeldet, zeigt dieser Klon ein anderes Resistenzprofil als CC71.
- CC45 und CC112: Diese Linien sind besonders in Asien prävalent, wurden aber auch auf anderen Kontinenten nachgewiesen.
Diese Dynamik illustriert einen zweistufigen Prozess: erstens die lokale Selektion dieser Klone durch den Druck der Antibiotikaverwendung in der Veterinärmedizin, insbesondere Beta-Lactame; zweitens ihre globale Verbreitung, die durch zunehmende internationale Bewegungen von Heimtieren erleichtert wird. Diese schnelle Verbreitung über große geografische Gebiete wird stark durch internationale Hundereisen erleichtert, sei es für Ausstellungen, Zucht oder Reisen. Eine Studie in Grenada dokumentierte zum ersten Mal die Einführung von MRSP auf die Insel, mit genotypischen und epidemiologischen Daten, die darauf hindeuten, dass “besuchende” Hunde den Pathogen an die lokale Hundepopulation übertrugen.
Prävalenz
Die Prävalenz von MRSP variiert spektakulär je nach untersuchter Hundepopulation, was direkte Auswirkungen auf den klinischen Verdacht hat.
- Bei gesunden Hunden: Das MRSP-Trägertum bei gesunden Hunden ist generell gering. Studien berichten von Prävalenzraten zwischen 0% und 4,5%. Diese Tiere sind asymptomatische Träger.
- Bei kranken Hunden: Die Situation ist radikal anders in Populationen von Hunden, die wegen dermatologischer Probleme vorgestellt werden. In spezialisierten Dermatologiekliniken kann die Prävalenz von MRSP bei Hunden mit Pyodermie extrem hoch sein und bis zu 40,5% in einer Studie erreichen. Eine andere in Thailand durchgeführte Studie an Hunden mit Pyodermie ergab eine Gesamt-MRS-Prävalenz von 35,7%. Diese Diskrepanz unterstreicht, dass Hunde mit chronischen Hauterkrankungen eine Hochrisikopopulation darstellen. Eine große Studie in den USA zwischen 2019 und 2022 analysierte Zehntausende klinischer Isolate und identifizierte 110.423 MRSP-Isolate. In Frankreich berichten neuere Daten von kranken Tieren eine MRSP-Häufigkeit von 17%.
Risikofaktoren
Die Identifizierung von Risikofaktoren ist entscheidend für die Ausrichtung von Diagnose- und Präventionsbemühungen. Mehrere Faktoren wurden konstant mit einem erhöhten Risiko einer MRSP-Infektion oder -Kolonisation assoziiert:
- Vorherige Antibiotikaverwendung: Dies ist der wichtigste und am häufigsten zitierte Risikofaktor. Die kürzliche Exposition gegenüber Antibiotika, insbesondere β-Lactamen und Fluorchinolonen, selektiert resistente Stämme durch Eliminierung der konkurrierenden empfindlichen Flora.
- Kontakt mit dem veterinärmedizinischen Umfeld: Kürzliche Krankenhausaufenthalte oder häufige Besuche in Veterinärkliniken erhöhen das Risiko einer MRSP-Exposition.
- Chronische zugrunde liegende Hauterkrankungen: Hunde mit atopischer Dermatitis, Allergien oder chronischen Otitiden sind besonders prädisponiert. Diese Bedingungen verändern die Hautbarriere und erfordern oft wiederholte antimikrobielle Behandlungen, was einen Teufelskreis schafft.
Umweltreservoire
Staphylokokken sind robuste Bakterien, die über lange Zeiträume auf unbelebten Oberflächen überleben können. Veterinärkliniken fungieren als wichtige Umweltreservoire für MRSP. Eine Studie zeigte, dass MRSP auf 10% der in Primärversorgungskliniken beprobten Oberflächen isoliert werden konnte, ohne signifikanten Unterschied zwischen handkontaktierten Oberflächen (z.B. Türgriffe, Tastaturen) und tierkontaktierten Oberflächen (z.B. Untersuchungstische). Die Typisierung der Stämme zeigte eine große Ähnlichkeit zwischen Isolaten desselben Krankenhauses, aber geringe Ähnlichkeit zwischen Krankenhäusern, was auf eine intra-hospitaläre Übertragung und Persistenz hinweist. Ununterscheidbare MRSP-Stämme wurden sowohl bei Hundepatienten als auch auf Umweltoberflächen innerhalb derselben Klinik gefunden, was die Rolle der Umgebung bei der nosokomialen Übertragung bestätigt. Eine unzureichende Handhygiene des Veterinärpersonals, mit einer berichteten Compliance von nur 14%, ist ein wichtiger Faktor, der zu dieser Übertragung beiträgt.
B. Methicillin-resistenter Staphylococcus aureus (MRSA) und S. schleiferi (MRSS): Eine vergleichende Perspektive
Obwohl MRSP der Hauptakteur ist, spielen andere MRS eine Rolle in der Hundedermatologie.
Staphylococcus aureus (MRSA)
- S. aureus ist in erster Linie ein menschlicher Kommensale und Pathogen. Seine Präsenz beim Hund ist daher epidemiologisch von der von S. pseudintermedius verschieden.
- Herkunft und Übertragung: S. aureus ist kein Mitglied der normalen kommensalen Flora des Hundes. Daher handelt es sich bei der Isolierung eines MRSA bei einem Hund meist um eine transiente Kolonisation oder Infektion infolge einer Übertragung vom Menschen auf das Tier, ein Phänomen, das als umgekehrte Zoonose oder Anthroponose bekannt ist. Diese Kolonisation ist in der Regel von kurzer Dauer, wobei der Organismus in wenigen Wochen eliminiert wird, wenn keine Reexposition stattfindet.
- Prävalenz und Risikofaktoren: Die Prävalenz des MRSA-Trägertums bei gesunden Hunden ist gering, generell zwischen 0 und 4%. Jedoch kann dieser Wert in spezifischen Tierpopulationen höher sein, die engen Kontakt mit dem menschlichen Gesundheitssystem haben, wie Therapiehunde, die Krankenhäuser besuchen, oder Heimtiere von Gesundheitsfachkräften. Die identifizierten Risikofaktoren bei Heimtieren für den Erwerb von MRSA spiegeln die des Menschen wider: vorherige Antibiotherapie, Krankenhausaufenthalt und Kontakt mit einer MRSA-infizierten oder kolonisierten Person.
- Klinische Bedeutung: Obwohl seltener als MRSP, ist MRSA ein opportunistischer Pathogen, der klinische Infektionen beim Hund verursachen kann, einschließlich Pyodermien, chirurgischer Wundinfektionen und Harnwegsinfektionen.
Staphylococcus schleiferi (MRSS)
- S. schleiferi, der in zwei Unterarten existiert (S. schleiferi subsp. schleiferi, Koagulase-negativ, und S. schleiferi subsp. coagulans, Koagulase-positiv), wird zunehmend als wichtiger Hautpathogen beim Hund anerkannt.
- Aufkommender Pathogen: Er wird nun als bedeutende Ursache von Pyodermie und Otitis externa bei Hunden identifiziert. In einigen Studien ist er der zweithäufigste Staphylokokke, der bei diesen Bedingungen isoliert wird.
- Hohe Resistenzraten: Ein besorgniserregendes Merkmal von S. schleiferi ist seine hohe Methicillin-Resistenzrate. Studien in dermatologischen Referenzzentren berichteten Resistenzraten von 40% bis 46,6%. Eine Studie an einer weniger voreingenommenen Population fand eine Resistenzrate von 20% bei Hunden mit entzündlicher Dermatitis.
- Multiresistenz: Wie MRSP zeigt MRSS oft Multiresistenz, insbesondere häufige Resistenz gegen Fluorchinolone, was die therapeutischen Optionen weiter verkompliziert.
Die Unterscheidung zwischen diesen drei Pathogenen ist von höchster Bedeutung in der klinischen Praxis. Ein Laborbericht, der einen “Methicillin-resistenten Staphylokokken” identifiziert, erfordert eine aufgeklärte Interpretation zur Lenkung des Fallmanagements, der Kommunikation mit dem Kunden und der Biosicherheitsmaßnahmen. Zum Beispiel sollte die Identifikation eines MRSA (S. aureus) sofort eine menschliche Quelle vermuten lassen und eine Diskussion über potenzielle Risiken für die Gesundheit der Haushaltsmitglieder auslösen. Umgekehrt wird eine Diagnose von MRSP die Untersuchung auf das Management der zugrunde liegenden Hauterkrankung des Hundes und die Kontrolle der Umweltkontamination lenken. Die folgende Tabelle fasst diese wichtigen Unterschiede zusammen.
|
Merkmal |
Staphylococcus pseudintermedius (MRSP) |
Staphylococcus aureus (MRSA) |
Staphylococcus schleiferi (MRSS) |
|
Hauptkommensaler Status |
Hund (normale Flora von Haut und Schleimhäuten) |
Mensch (transiente Hundekolonisation) |
Hund und Mensch (Hautflora) |
|
Prävalenz bei Hundepyodermie |
Sehr hoch (dominanter Pathogen) |
Gering bis mäßig |
Gering bis mäßig (aufkommender Pathogen) |
|
Hauptreservoir |
Tier (Hund) |
Mensch (Gesundheitssystem, Gemeinschaft) |
Tier und Mensch |
|
Hauptübertragungsweg |
Tier-Tier, Umwelt-Tier |
Mensch-Tier (umgekehrte Zoonose) |
Weniger definiert, wahrscheinlich Tier-Tier |
|
Zoonotisches Potenzial (Tier → Mensch) |
Gering aber dokumentiert |
Signifikant (größere öffentliche Gesundheitssorge) |
Selten, hauptsächlich nosokomial beim Menschen |
Pathogenese der Staphylokokken-Pyodermie
Die Staphylokokken-Pyodermie ist nicht einfach das Vorhandensein von Bakterien auf der Haut; sie ist das Ergebnis einer komplexen Interaktion zwischen Pathogen, Wirt und Umwelt. Der Übergang von S. pseudintermedius von einem einfachen Hautbewohner zu einem Infektionserreger hängt von der Störung des empfindlichen Gleichgewichts ab, das die Hauthomöostase aufrechterhält.
Vom Kommensalen zum opportunistischen Pathogen: Die Rolle der Hautbarriere
- S. pseudintermedius ist ein gut an seinen caninen Wirt angepasster Kommensale, der die Haut und Schleimhäute (Nase, Mund, Rachen, Perineum) von 46% bis 92% gesunder Hunde ohne Krankheitsverursachung kolonisiert. Die Infektion ist ein opportunistisches Ereignis, das nur auftritt, wenn die Wirtsabwehr geschwächt ist. Die Hautbarriere, bestehend aus physischen (Stratum corneum), chemischen (Lipide, antimikrobielle Peptide) und immunologischen Elementen, ist die primäre Verteidigungslinie. Jede Veränderung dieser Barriere schafft eine Eintrittspforte für bakterielle Invasion.
Die klinische Bedeutung von MRSP liegt nicht in einer erhöhten Virulenz im Vergleich zu seinem empfindlichen Gegenstück (MSSP). Tatsächlich haben Studien nicht gezeigt, dass Methicillin-resistente Stämme intrinsisch aggressiver oder pathogener sind. Die Mechanismen der Krankheit und die klinischen Läsionen, die sie verursachen, sind ununterscheidbar. Das wahre Problem liegt woanders: Es liegt im therapeutischen Versagen. Bei einer MRSP-Infektion ist eine empirische Behandlung mit einem Erstlinien-Antibiotikum wie Cephalexin zum Scheitern verurteilt. Dieses anfängliche Versagen löst eine Kaskade negativer Konsequenzen aus: Die Krankheit verlängert sich, wodurch Morbidität und Unbehagen des Tieres zunehmen; die bakterielle Last am Tier und in seiner Umgebung steigt, was das Übertragungsrisiko erhöht; und dies führt oft zu Zyklen aufeinanderfolgender und ineffektiver Antibiotherapien, die nicht nur das Problem nicht lösen, sondern zusätzlichen Selektionsdruck ausüben und die Entstehung zusätzlicher Resistenzen begünstigen. So verwandelt sich eine einfache Pyodermie in einen komplexen, chronischen, kostspieligen und frustrierenden klinischen Fall mit potenziellen Auswirkungen auf die öffentliche Gesundheit. Es ist diese Dimension des therapeutischen Versagens, die MRSP seine verheerende klinische Bedeutung verleiht.
Rolle der Virulenzfaktoren
Sobald die Barriere durchbrochen ist, nutzt S. pseudintermedius ein Arsenal von Virulenzfaktoren, um die Infektion zu etablieren.
- Exfoliative Toxine (ExpA und ExpB): Diese Proteine sind Schlüsselakteure bei der Bildung von Pyodermie-Läsionen. Sie wirken als hochspezifische Proteasen, die canines Desmoglein-1 angreifen und spalten, ein desmosomales Cadherin, das für die Adhäsion zwischen Keratinozyten in der Epidermis essentiell ist. Der Abbau von Desmoglein-1 stört die Kohäsion der Epidermis und verursacht eine intraepidermale Spaltung (Akantholyse) und die Bildung von subcornealen Pusteln. Die intradermale Injektion dieser gereinigten Toxine bei Hunden reproduziert die klinischen Zeichen der Pyodermie, wie Erythem und Krustenbildung, was ihre direkte pathogene Rolle bestätigt. Andere Toxine umfassen das exfoliative Toxin SIET, ein bikomponentes Leukotoxin, Luk-I, das polymorphkernige Leukozyten angreift und zerstört, und superantigene Enterotoxine, wie SECCANINE, die eine polyklonale T-Lymphozyten-Aktivierung verursachen können.
- Adhäsine und Oberflächenproteine: Um eine Infektion zu initiieren, muss das Bakterium zuerst an Wirtszellen adhärieren. S. pseudintermedius exprimiert eine Reihe von Oberflächenproteinen, genannt Adhäsine (Sps-Familie), die sich spezifisch an Komponenten der extrazellulären Matrix des Wirts binden, wie Fibrinogen, Fibronektin und Cytokeratin-10. Proteine wie SpsD und SpsL erleichtern nicht nur die Adhäsion an Korneozyten, sondern auch die Invasion von Keratinozyten und die Biofilmbildung.
- Biofilmbildung: Der Biofilm ist eine strukturierte Gemeinschaft von Bakterien, die in eine selbstproduzierte polymere Matrix eingehüllt sind, die Schutz vor Wirtsimmunantworten und Antibiotika bietet und so zur Chronizität von Infektionen beiträgt. Die Biofilmbildung ist besonders kritisch bei chronischen Infektionen, Otitiden und Infektionen chirurgischer Stellen, insbesondere auf inerten Materialien wie Implantaten oder Nahtmaterial. Der Biofilm schützt Bakterien effektiv vor der Immunantwort des Wirts und dem Eindringen von Antibiotika, was die Eradikation der Infektion extrem schwierig macht.
Der zentrale prädisponierende Faktor: Ruptur der Hautbarriere
Die Quasi-Gesamtheit der Fälle von Staphylokokken-Pyodermie bei Hunden sind sekundäre Erkrankungen. Die Aussage, dass “gesunde Hunde keine Hautinfektionen entwickeln”, ist ein grundlegendes Prinzip in der Veterinärdermatologie. Die Identifizierung und das Management der zugrunde liegenden Ursache sind daher nicht nur wichtig für die Behandlung, sondern absolut essentiell für die Rezidivprävention.
- Atopische Dermatitis und Allergien: Dies ist die häufigste zugrunde liegende Ursache. Die allergische Entzündung (sei sie durch Umweltallergene, Nahrungsmittel oder Flohbisse verursacht) kompromittiert die Hautbarriere auf mehrere Weise. Erstens führt der intensive Juckreiz, den sie verursacht, zu Selbsttrauma (Kratzen, Lecken, Beißen), das das Stratum corneum physisch schädigt. Zweitens verändert die Entzündung selbst die Zusammensetzung und Organisation der interzellulären Lipide (Ceramide) und verringert die Produktion natürlicher antimikrobieller Peptide, wodurch die Haut durchlässiger und weniger fähig wird, sich gegen Mikroben zu verteidigen. Diese entzündete und geschädigte Hautumgebung ist ein idealer Boden für die Proliferation von S. pseudintermedius.
- Andere prädisponierende Faktoren: Andere Bedingungen können auch die Hautintegrität verändern und zu Infektionen prädisponieren. Dazu gehören Endokrinopathien wie Hypothyreose und Hyperkortisolismus (Cushing-Syndrom), die die Hauterneuerung und lokale Immunität beeinträchtigen; Ektoparasiten (Demodex, Sarcoptes), die direkte Schäden und Entzündungen verursachen; und Keratinisierungsstörungen (Seborrhö), die die Hautoberfläche verändern.
Klinischer und diagnostischer Ansatz bei Pyodermien durch resistente Staphylokokken
Bei einem Pyodermie-Fall muss der Kliniker einen systematischen und evidenzbasierten Ansatz verfolgen. Das Zeitalter der antimikrobiellen Resistenz erfordert größere diagnostische Strenge, um therapeutische Versagen zu vermeiden und eine umsichtige Antibiotikaverwendung zu fördern.
A. Klinische Darstellung
Staphylokokken-Hautinfektionen beim Hund werden nach der Tiefe der Gewebsbeteiligung klassifiziert.
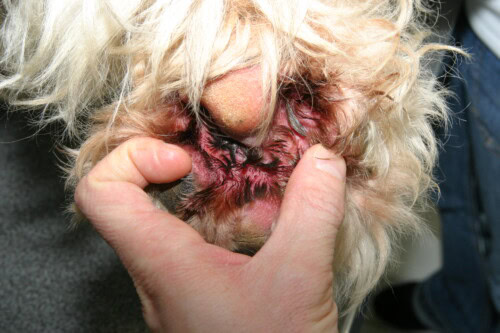
- Oberflächliche Pyodermie: Die Infektion ist auf die Epidermis und Haarfollikel beschränkt. Die häufigste Form ist die oberflächliche bakterielle Follikulitis. Die typischen klinischen Läsionen sind vielfältig und umfassen:
- Follikuläre Papeln und Pusteln: Kleine rote Erhebungen (Papeln) oder mit Eiter gefüllte (Pusteln), die um ein Haar zentriert sind.
- Epidermale Halskrausen: Diese sind sehr charakteristische Läsionen. Sie präsentieren sich als kreisförmige Alopeziebereiche mit einem Rand aus Schuppen oder Krusten, der sich zentrifugal ausbreitet.
- Zielläsionen: Bereiche zentralen Erythems mit einem blasseren Rand und einem peripheren erythematösen Ring.
- “Mottenfraß”-Aussehen: Bei kurzhaarigen Hunden kann sich Follikulitis durch multiple kleine Alopeziebereiche manifestieren, was dem Fell ein “mottenzerfressenes” Aussehen verleiht.
- Andere Zeichen wie Krusten, Erythem und post-inflammatorische Hyperpigmentierung sind ebenfalls häufig.
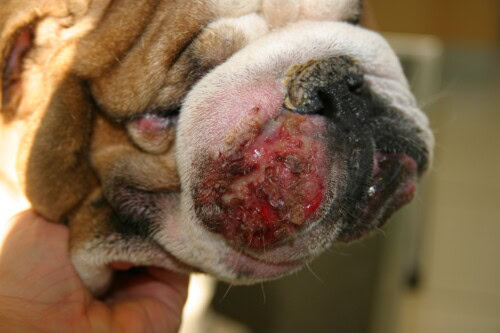
- Tiefe Pyodermie: Diese Form ist schwerwiegender, da sie eine Ruptur der Haarfollikel (Furunkulose) und eine Ausbreitung der Infektion in die Dermis und manchmal Hypodermis (Zellulitis) beinhaltet. Die klinischen Zeichen sind spektakulärer und oft schmerzhaft:
- Knoten und hämorrhagische Blasen: Erhobene, feste oder fluktuierende Läsionen, oft mit eitrigem oder blutigem Inhalt gefüllt.
- Drainierende Fisteln: Öffnungen in der Haut, durch die seröser, blutiger oder eitriger Ausfluss austritt.
- Schwere Zeichen: Ödem, Ulzera, dicke Krusten und ausgeprägte Entzündung sind häufig. Im Gegensatz zur oberflächlichen Pyodermie können Hunde mit tiefer Pyodermie systemische Zeichen wie Fieber, Lethargie und Anorexie zeigen.
Ein Punkt von höchster Bedeutung muss hervorgehoben werden: Es ist klinisch unmöglich, eine Pyodermie durch einen Methicillin-resistenten Staphylokokken-Stamm von einer Infektion durch einen empfindlichen Stamm zu unterscheiden. Die Läsionen sind morphologisch identisch. Der Verdacht auf eine resistente Infektion sollte daher niemals auf dem Aussehen der Läsionen beruhen, sondern vielmehr auf der Anamnese des Patienten, dem Vorhandensein von Risikofaktoren und vor allem der Behandlungsresponse.
B. Evidenzbasierte diagnostische Strategie
Das Aufkommen der MRS hat einen Paradigmenwechsel im diagnostischen Ansatz der Pyodermie erzwungen. Der historische Ansatz “erst behandeln, dann Fragen stellen” mit empirischen Antibiotika ist nicht nur obsolet geworden, sondern wird nun als gefährlich und den Prinzipien der Antibiotic Stewardship widersprechend betrachtet. Die Zytologie, früher als ergänzendes Werkzeug betrachtet, ist zu einem essentiellen und nicht verhandelbaren Schritt der Erstuntersuchung geworden. Die Zytologie in der aktuellen Resistenzlage zu ignorieren, stellt einen professionellen Fehler dar. Sie ist der Dreh- und Angelpunkt der klinischen Entscheidung: Sie bestätigt das Vorhandensein einer bakteriellen Infektion und rechtfertigt so die Einleitung einer antimikrobiellen Behandlung (die in erster Linie topisch sein sollte), sie leitet die Erkennung von Fällen, die sofortige Kultur benötigen (Vorhandensein von Bazillen, tiefe Pyodermie), und sie ermöglicht die Bewertung der Behandlungsresponse.
Hautzytologie: Das unverzichtbare Erstlinien-Werkzeug
Die Zytologie ist ein schneller, kostengünstiger, minimal invasiver und in der Klinik durchführbarer diagnostischer Test, der systematisch bei jedem Patienten mit Läsionen durchgeführt werden sollte, die mit einer Pyodermie vereinbar sind.
- Entnahmetechnik: Die Methode hängt von der Art der Läsion ab.
- Direkter Objektträgerabdruck: Für feuchte oder exsudative Läsionen oder nach Aufbrechen einer intakten Pustel mit einer sterilen Nadel.
- Klebestreifentest: Ideal für trockene, schuppige Läsionen oder solche in schwer zugänglichen Bereichen wie Zehenzwischenräumen.
- Tupfer: Nützlich für die Entnahme von Material aus Gehörgängen oder Fisteln.
- Interpretation: Die Probe wird gefärbt (z.B. mit einer modifizierten Wright-Giemsa-Färbung) und mikroskopisch untersucht. Die Entdeckung von Kokken, die von degenerierten Neutrophilen phagozytiert wurden, ist der pathognomonische Beweis einer bakteriellen Pyodermie. Das Vorhandensein zahlreicher extrazellulärer Bakterien in Verbindung mit einer Entzündungszellpopulation ist ebenfalls sehr suggestiv. Die Zytologie ermöglicht auch die Erkennung anderer Erreger (Hefen vom Typ Malassezia, Bazillen) und die Bewertung der Art der Entzündungsreaktion.
Die Zytologie ist die erste wesentliche Untersuchung, die durchgeführt werden muss
Bakterienkultur und Antibiogramm: Der Schlüssel zur gezielten Therapie
Die Bakterienkultur mit antimikrobiellem Empfindlichkeitstest (Antibiogramm) ist nicht für alle Pyodermie-Fälle notwendig, aber sie ist zwingend erforderlich unter spezifischen Umständen zur Lenkung einer rationalen Therapie.
- Klare Indikationen: Kultur und Antibiogramm sind stark empfohlen, sogar obligatorisch, in folgenden Situationen:
- Unzureichende klinische Response (weniger als 50% Verbesserung der Läsionen) nach zwei Wochen angemessener systemischer Antibiotherapie.
- Auftreten neuer Läsionen (Papeln, Pusteln) während einer laufenden Antibiotikabehandlung seit mindestens zwei Wochen.
- Vorhandensein von Bazillen bei der zytologischen Untersuchung.
- Vorhandensein von tiefen Pyodermie-Läsionen (Furunkulose, Zellulitis, Knoten).
- Anamnese einer multiresistenten Infektion beim Tier oder einem anderen Tier im Haushalt.
- Entnahmemethodik: Um zuverlässig zu sein, muss die Entnahme für die Kultur aseptisch durchgeführt werden, um jede Kontamination zu vermeiden. Die Qualität der Entnahme ist entscheidend. Die idealen Entnahmestellen und -techniken sind:
- Intakte Pustel: Dies ist die ideale Stelle. Nach sanfter Desinfektion wird die Pustel steril mit einer Nadel aufgebrochen und ihr Inhalt mit einem Tupfer gesammelt.
- Kruste: Der Tupfer wird über die feuchte Hautoberfläche geführt, nachdem eine frische Kruste vorsichtig angehoben wurde.
- Epidermale Halskrause: Der Tupfer wird fest über den aktiven Rand der Läsion gerollt.
- Knoten oder Fistel: Eine Gewebebiopsie für Kultur ist die Methode der Wahl für tiefe Läsionen.
- Interpretation und Nutzen: Das Labor wird die Bakterienart identifizieren und ihre Empfindlichkeit gegenüber einem Panel von Antibiotika testen. Für Staphylokokken wird der Empfindlichkeitstest für Oxacillin oder Cefoxitin verwendet, um Methicillin-Resistenz (Vorhandensein des mecA-Gens) zu erkennen. Das Antibiogramm ist der einzige Weg, ein systemisches Antibiotikum zu wählen, das gegen einen MRSP-Stamm wirksam ist, der oft multiresistent ist.
Das Antibiogramm erweist sich als wesentlich im Management der MRS
Therapeutische Prinzipien und Management von MRSP-Infektionen
Das Management von MRSP-Pyodermien hat sich zu einem multimodalen Ansatz entwickelt, der topische Therapie betont, systemische Antibiotherapie für spezifische Indikationen reserviert und vor allem die zugrunde liegende Ursache der Infektion angeht.
A. Topische Therapie: Eckpfeiler der Behandlung
Angesichts der zunehmenden Resistenz wurde die topische Therapie vom Status einer unterstützenden Behandlung zur Erstlinienbehandlung erhoben. Internationale Richtlinien, wie die der World Association for Veterinary Dermatology (WAVD), empfehlen nun topische Therapie als bevorzugte Behandlungsmodalität für oberflächliche Pyodermien, ob sie durch empfindliche oder resistente Stämme verursacht werden. Mehrere Studien haben gezeigt, dass ein gut durchgeführtes topisches Behandlungsprotokoll genauso wirksam sein kann wie eine systemische Antibiotherapie zur Lösung einer oberflächlichen Pyodermie, einschließlich solcher, die durch MRSP verursacht werden. Die Vorteile sind vielfältig: Erreichen sehr hoher Antiseptika-Konzentrationen am Infektionsort (weit über der minimalen Hemmkonzentration), Reduzierung des Risikos der Resistenzselektion in anderen Systemen (wie dem Verdauungstrakt) und unspezifische vorteilhafte Effekte wie mechanisches Debridement von Krusten und Debris.
Wirksame antiseptische Wirkstoffe
Mehrere Wirkstoffe haben ihre Wirksamkeit bewiesen.
- Chlorhexidin: Dies ist der am meisten untersuchte und empfohlene topische Wirkstoff aufgrund seiner starken antimikrobiellen Aktivität in vivo und seiner Langzeitwirkung. Es ist bakterizid gegen Staphylokokken, einschließlich Methicillin-resistenter Stämme. Die wirksamen Konzentrationen in Veterinärprodukten variieren generell von 2% bis 4%.
- Benzoylperoxid: In Konzentrationen von 2,5% bis 3% besitzt es antimikrobielle Aktivität sowie keratolytische (hilft bei der Entfernung toter Hautschichten), comedolytische (öffnet Haarfollikel) und entfettende Eigenschaften. Es kann jedoch austrocknend und irritierend für die Haut sein, was seine Verwendung begrenzen oder die gleichzeitige Verwendung von Weichmachern erfordern kann.
- Andere Wirkstoffe: Andere Antiseptika wie verdünntes Natriumhypochlorit (verdünnte Bleiche), Essigsäure/Borsäure und Ethyllactat haben ebenfalls gewisse Wirksamkeit gezeigt und können wertvolle Optionen sein.
Anwendungsprotokolle
Der Erfolg der topischen Therapie hängt kritisch von der Einhaltung des Protokolls ab.
- Formulierungen: Die Wahl der Formulierung hängt von der Ausdehnung der Läsionen, der Art des Fells und der Anwendungsfreundlichkeit für den Besitzer ab.
- Shampoos: Ideal für generalisierte Infektionen, ermöglichen sie die Behandlung großer Hautflächen.
- Schäume, Sprays, Tücher: Sehr nützlich für die tägliche Anwendung, für lokalisierte Behandlungen oder für Tage ohne Bad. Sie erfordern in der Regel kein Spülen.
- Cremes, Salben, Gele: Geeignet für lokalisierte Läsionen und wenig behaarte Bereiche.
- Häufigkeit und Kontaktzeit: Eine Kontaktzeit von mindestens 10 Minuten ist entscheidend, damit antiseptische Shampoos ihre bakterizide Wirkung entfalten können. Die empfohlene Badehäufigkeit beträgt in der Regel 2 bis 3 Mal pro Woche, kann aber bei schweren MRSP-Fällen auf täglich erhöht werden. Schäume und Sprays können ein- bis zweimal täglich angewendet werden. Die Behandlung sollte mindestens 7 bis 10 Tage nach vollständiger klinischer Lösung der Läsionen fortgesetzt werden, um frühe Rückfälle zu verhindern. Bei Tieren mit langem oder dichtem Haar ist oft eine Schur unerlässlich, damit das Produkt die Haut erreichen und wirksam wirken kann.
Tabelle 1: Protokolle der topischen Therapie für oberflächliche Hundepyodermie
|
Wirkstoff |
Übliche Konzentrationen |
Verfügbare Formulierungen |
Empfohlenes Anwendungsprotokoll |
Klinische Bemerkungen |
|
Chlorhexidin |
2%, 3%, 4% |
Shampoo, Schaum, Spray, Tücher, Gel |
Shampoo: 2-3 mal/Woche, 10 Minuten Kontaktzeit. Schaum/Spray/Tücher: 1-2 mal/Tag, besonders an Tagen ohne Shampoo. |
Antiseptikum der ersten Wahl. Sehr gute Wirksamkeit und Verträglichkeit. Schur verbessert die Wirksamkeit erheblich. |
|
Benzoylperoxid |
2,5%, 3% |
Shampoo, Gel |
Shampoo: 2-3 mal/Woche, 5-10 Minuten Kontaktzeit. |
Keratolytische und entfettende Wirkung nützlich in bestimmten Fällen. Höheres Irritations- und Austrocknungspotenzial als Chlorhexidin. |
|
Natriumhypochlorit |
0,005% (Verdünnung) |
Lösung für Bäder |
Bäder: 2-3 mal/Woche, 10-15 Minuten Kontaktzeit. |
Interessante und kostengünstige Alternative. Frische Zubereitung erforderlich (verdünnte Bleiche). |
|
Topische Antibiotika (Mupirocin, Fusidinsäure) |
2% |
Salbe, Creme |
Anwendung: 2-3 mal/Tag auf sehr lokalisierte Läsionen. |
Reserviert für fokale Läsionen. Ausgedehnte Verwendung ist zu vermeiden, um das Risiko der Resistenzselektion zu begrenzen. Mupirocin sollte nicht verwendet werden (GEDAC-Empfehlungen) |
B. Systemische Antibiotherapie: Ein vernünftiger und gezielter Ansatz
Die Verwendung systemischer Antibiotika sollte eine durchdachte und gerechtfertigte Entscheidung sein, nicht ein Reflex. Sie ist tiefen Pyodermien vorbehalten, wo die Infektion Gewebe erreicht, die topische Therapie nicht effektiv durchdringen kann, und Fällen generalisierter oberflächlicher Pyodermie, die nicht auf eine allein gut durchgeführte topische Behandlung ansprechen.
Auswahlprinzip
Die Wahl eines systemischen Antibiotikums für eine vermutete oder bestätigte MRSP-Infektion muss zwingend auf den Ergebnissen eines Antibiogramms basieren. Die empirische Verwendung von Zweit- oder Drittlinien-Antibiotika ist eine gefährliche Praxis, die die Entstehung noch ausgedehnteren Resistenzen fördert. Es ist entscheidend, die “Expertenregel” zu beachten: Ein Oxacillin-resistenter Staphylokokke muss als klinisch resistent gegen alle Beta-Lactame betrachtet werden, auch wenn das Antibiogramm scheinbare Empfindlichkeit gegenüber bestimmten Cephalosporinen suggeriert. Die Behandlungsdauer muss ausreichend lang sein: mindestens 3 bis 4 Wochen für oberflächliche Pyodermie und 6 bis 8 Wochen für tiefe Pyodermie, wobei die Behandlung immer 1 bis 2 Wochen nach vollständiger klinischer Lösung fortgesetzt wird.
Therapeutische Optionen für MRSP (basierend auf Empfindlichkeit)
MRSP ist per Definition resistent gegen alle β-Lactam-Antibiotika. Darüber hinaus sind epidemische Klone oft multiresistent und zeigen Kreuzresistenz gegen viele andere Antibiotikaklassen, die häufig in der Veterinärmedizin verwendet werden, wie Tetracycline, Makrolide (Erythromycin), Lincosamide (Clindamycin) und Fluorchinolone (Enrofloxacin). Die therapeutischen Optionen sind daher begrenzt und müssen sorgfältig basierend auf den Kulturergebnissen gewählt werden. Die Verwendung von Antibiotika von kritischer Bedeutung in der Humanmedizin (Vancomycin, Linezolid, Teicoplanin) wird stark abgeraten.
Tabelle 2: Optionen der systemischen Antibiotherapie für resistente Staphylokokken-Infektionen beim Hund (basierend auf einem Antibiogramm)
|
Antibiotikum |
Dosierung (Hund) |
Verabreichungshäufigkeit |
Bemerkenswerte Nebenwirkungen |
Vorsichtsmaßnahmen und empfohlene Überwachung |
|
Chloramphenicol |
50 mg/kg |
Alle 8 Stunden (TID) |
Gastrointestinale Störungen (Erbrechen, Durchfall), neurologische Schwäche, reversible Myelosuppression (dosisabhängig). |
Enge Sicherheitsmarge. Hämatologische Überwachung bei längeren Behandlungen empfohlen. Kontraindiziert bei Zuchttieren. |
|
Doxycyclin / Minocyclin |
5-10 mg/kg |
Alle 12 Stunden (BID) |
Gastrointestinale Störungen (Erbrechen, Ösophagitis). Minocyclin kann wirksamer als Doxycyclin gegen bestimmte Stämme sein. |
Mit Futter und Wasser verabreichen, um das Risiko einer Ösophagitis zu reduzieren. Photosensibilität ist selten aber möglich. |
|
Clindamycin |
11 mg/kg |
Alle 12 Stunden (BID) |
Gastrointestinale Störungen. |
Oft unwirksam gegen MRSP aufgrund häufiger Ko-Resistenz. Wirksamkeit bedingt durch Antibiogramm. |
|
Rifampicin |
5-10 mg/kg |
Alle 24 Stunden (SID) |
Potenziell schwere Hepatotoxizität, gastrointestinale Störungen, orange Verfärbung von Urin und Tränen. |
Niemals als Monotherapie verwenden (Risiko schneller Selektion resistenter Mutanten). Überwachung der Leberenzyme vor und während der Behandlung zwingend (z.B. nach 2 und 4 Wochen). Niemals verwenden (GEDAC-Empfehlungen) |
|
Potenzierte Sulfonamide (TMS) |
15-30 mg/kg |
Alle 12 Stunden (BID) |
Keratokonjunktivitis sicca (KCS), Überempfindlichkeitsreaktionen (Polyarthritis, Anämie, Thrombozytopenie), Hepatopathien. |
Hohes idiosynkratisches Risiko bei bestimmten Rassen (Dobermann). Überwachung des Schirmer-Tests bei langen Behandlungen empfohlen. |
Herausforderungen und Nebenwirkungen
Die Behandlung von MRSP-Infektionen mit “Reserve”-Antibiotika ist nicht ohne Schwierigkeiten.
- Chloramphenicol: Obwohl oft in vitro wirksam, ist es mit einer sehr hohen Inzidenz gastrointestinaler Nebenwirkungen (Erbrechen, Durchfall, Anorexie) verbunden, die häufig zum Behandlungsabbruch führen. Fälle reversibler Neurotoxizität (Parese der Hintergliedmaßen) wurden ebenfalls beschrieben.
- Doxycyclin/Minocyclin: Klinische Versagen wurden trotz günstiger Empfindlichkeitstests berichtet. Dies kann auf Empfindlichkeitsinterpretationsschwellen (Breakpoints) zurückzuführen sein, die nicht immer die klinische Wirksamkeit für S. pseudintermedius genau vorhersagen.
- Rifampicin: Muss in Kombination mit einem anderen wirksamen Antibiotikum verwendet werden, um die schnelle Selektion resistenter Mutanten zu verhindern. Überwachung der Leberfunktion wird aufgrund des Hepatotoxizitätsrisikos empfohlen.
- Aminoglykoside (z.B. Amikacin): Diese Medikamente erfordern Injektion und sorgfältige Überwachung der Nierenfunktion aufgrund ihrer potenziellen Nephrotoxizität.
C. Management der zugrunde liegenden Ursache: Der Schlüssel zur Rezidivprävention
Die antimikrobielle Behandlung, ob topisch oder systemisch, geht nur die Konsequenzen der Krankheit (die bakterielle Infektion) und nicht ihre Ursache an. Ohne eine Diagnose und rigorose Kontrolle der zugrunde liegenden Primärkrankheit (atopische Dermatitis, Nahrungsmittelallergie, Hypothyreose, etc.) sind Pyodermie-Rezidive unvermeidlich. Jedes Rezidiv erfordert einen neuen Behandlungszyklus, erhöht den Selektionsdruck für Resistenz und das Risiko der Entstehung noch schwerer zu behandelnder Stämme. Das Langzeitmanagement dieser Primärerkrankungen ist daher die effektivste Strategie, um diesen Zyklus zu durchbrechen, die Lebensqualität des Tieres zu verbessern und die Gesamtabhängigkeit von Antibiotika zu reduzieren.
Kolonisation versus Infektion: Klinische und epidemiologische Implikationen
Die Unterscheidung zwischen Kolonisation und Infektion durch einen MRS ist ein grundlegendes Konzept, dessen Verständnis für ein rationales Patientenmanagement und die Übertragungsprävention wesentlich ist. Diese beiden Zustände repräsentieren sehr unterschiedliche biologische und klinische Szenarien mit unterschiedlichen Implikationen für Behandlung und öffentliche Gesundheit.
Definition und Unterscheidung
- Kolonisation (oder Trägertum): Dieser Zustand ist definiert durch das Vorhandensein und die Vermehrung eines Bakteriums, wie MRSP, auf den Körperoberflächen eines Wirts (Haut, Nasen-, Mund-, Analschleimhäute) ohne dass klinische Krankheitszeichen oder eine Entzündungsreaktion des Wirts vorliegen. Das Tier ist ein “gesunder Träger“; das Bakterium ist Teil seiner Oberflächenmikroflora, vorübergehend oder dauerhaft, verursacht aber keinen Schaden.
- Infektion: Die Infektion tritt auf, wenn das Bakterium die Wirtsabwehr durchbricht, Gewebe eindringt und sich vermehrt, eine Entzündungsreaktion auslöst und klinische Krankheitszeichen verursacht (z.B. Pusteln und Entzündung der Pyodermie).
Klinische und epidemiologische Bedeutung des Trägertums
Der Trägerstatus hat, obwohl asymptomatisch, tiefgreifende klinische und epidemiologische Konsequenzen. Die Persistenz der Kolonisation nach Lösung einer klinischen Infektion ist ein besonders besorgniserregendes Phänomen, das den Begriff der “Heilung” neu definiert. Ein Tier, dessen Hautläsionen verschwunden sind, kann klinisch geheilt erscheinen, aber es kann ein asymptomatischer Träger bleiben. Dieser “versteckte” Trägerstatus verwandelt das geheilte Tier in eine latente epidemiologische Bedrohung. Es wird zu einem “Trojanischen Pferd“, das den Pathogen in die klinische Umgebung wieder einführen, andere vulnerable Patienten kontaminieren und als Reservoir für seine eigene zukünftige Reinfektion dienen kann. Diese Erkenntnis erfordert einen Perspektivenwechsel: Der therapeutische Erfolg kann nicht länger nur aufgrund der Lösung klinischer Zeichen beurteilt werden. Er muss eine Langzeitmanagementstrategie des Trägerstatus integrieren, die auf Hygiene, rigoroser Kontrolle der zugrunde liegenden Krankheit zur Stärkung der Hautbarriere und klarer Kommunikation mit dem Besitzer über persistierende Risiken basiert.
- Persistenz nach Behandlung: Eine der wichtigsten Erkenntnisse ist, dass die klinische Heilung einer MRSP-Pyodermie nicht notwendigerweise zur Eradikation des Bakteriums aus dem Organismus führt. Eine Folgestudie zeigte, dass unter den Hunden, die initial mit einer MRSP-Pyodermie diagnostiziert wurden, 45,2% noch MRSP-Träger auf ihrer Haut und 47,6% auf ihren mukosalen Trägerstellen (Nase, Rektum) nach vollständiger Lösung der klinischen Zeichen waren.
- Quelle endogener Reinfektion: Ein kolonisiertes Tier wird zu seinem eigenen Reservoir für zukünftige Infektionen. Das Bakterium residiert auf den Schleimhäuten und kann leicht auf die Haut übertragen werden beim Putzen oder Lecken. Wenn die Hautbarriere des Tieres erneut kompromittiert wird (z.B. bei einem allergischen Schub), kann das Bakterium schnell proliferieren und eine neue Infektion verursachen.
- Quelle exogener Übertragung: Asymptomatische Trägertiere verbreiten kontinuierlich MRSP in ihrer Umgebung (Zuhause, Parks, Veterinärkliniken), kontaminieren Oberflächen und fungieren als stille Übertragungsquelle auf andere Tiere und möglicherweise Menschen.
- Nosokomiale Akquisition der Kolonisation: Die klinische Umgebung ist ein Hochrisikoort für den Erwerb des Trägerstatus. Dieselbe Studie enthüllte, dass unter den Hunden, die zu Beginn der Behandlung ihrer Pyodermie (verursacht durch einen empfindlichen Stamm) kein MRSP hatten, 28,3% nach der Behandlung auf ihrer Haut mit MRSP kolonisiert wurden. Der mukosale Trägertatus in dieser Gruppe stieg signifikant von 7,8% vor Behandlung auf 26,7% nach Behandlung. Dies deutet darauf hin, dass die Krankenhausumgebung und Behandlungsverfahren die Übertragung und Kolonisation durch resistente Stämme erleichtern können.
Ansatz der Dekolonisation
Die Frage, ob aktiv versucht werden sollte, den Trägerstatus zu eliminieren (Dekolonisation), ist komplex und kontrovers.
- Allgemeine Nicht-Empfehlung: Für die meisten Fälle wird eine aktive Dekolonisation gesunder Träger nicht empfohlen.
- Begründung:
- Die Kolonisation durch MRSA (S. aureus) bei Heimtieren ist oft vorübergehend und eliminiert sich natürlich in wenigen Wochen, vorausgesetzt, die Quelle der Reexposition (normalerweise menschlich) wird kontrolliert.
- Die Verwendung systemischer Antibiotika zur Eradikation des Trägertums ist nicht nur unwirksam (Antibiotika erreichen keine ausreichenden Konzentrationen auf mukosalen Oberflächen), sondern auch kontraproduktiv, da sie zusätzlichen Selektionsdruck zugunsten der Resistenz ausübt.
- Obwohl topische Therapien (antiseptische Shampoos, nasale Salben) die bakterielle Last vorübergehend reduzieren können, ist ihre Langzeitwirksamkeit für eine vollständige Eradikation des Trägertums nicht in kontrollierten Studien nachgewiesen worden.
Derzeit gibt es keinen wissenschaftlichen Konsens, um eine systematische Dekolonisationsversuche bei diesen Trägertieren zu empfehlen. Die untersuchten Protokolle zeigten begrenzte und unbeständige Wirksamkeit mit einem nicht unerheblichen Risiko, noch resistentere Stämme zu selektieren. Der bevorzugte Ansatz für das Management kolonisierter Tiere konzentriert sich daher auf nicht-antibiotische Maßnahmen: Verstärkung der Hygiene (regelmäßige antiseptische Bäder zur Reduzierung der Hautlast), strikte Kontrolle der zugrunde liegenden Krankheit zur Aufrechterhaltung einer gesunden Hautbarriere und Implementierung von Infektionskontrollmaßnahmen zur Begrenzung der Übertragung.
Zoonotisches Potenzial und Übertragungsprävention
Das Vorhandensein multiresistenter Bakterien bei Heimtieren, die unsere intimste Umgebung teilen, wirft berechtigte Fragen der öffentlichen Gesundheit auf. Die Bewertung des zoonotischen Risikos und die Implementierung von Infektionskontrollmaßnahmen sind geteilte Verantwortungen von Tierärzten und Tierbesitzern.
A. Bewertung des zoonotischen Risikos
Es ist entscheidend, das mit verschiedenen Staphylokokkenarten verbundene Risiko zu differenzieren, da es nicht einheitlich ist.
- Vergleich MRSP vs MRSA:
- Methicillin-resistenter S. aureus (MRSA): Das mit MRSA verbundene zoonotische Risiko ist gut etabliert und wird als signifikant betrachtet. MRSA ist ein wichtiger menschlicher Pathogen, und Heimtiere fungieren meist als Kollateralschäden der menschlichen Epidemie, indem sie von Stämmen menschlichen Ursprungs kolonisiert werden (umgekehrte Zoonose). Einmal kolonisiert oder infiziert, können sie jedoch zu stillen Reservoiren im Haushalt werden, zur Persistenz von MRSA in der Gemeinschaft beitragen und ein Risiko der (Re-)Infektion für Menschen darstellen. Die Übertragung kann in beide Richtungen erfolgen.
- Methicillin-resistenter S. pseudintermedius (MRSP): Das direkte zoonotische Risiko von MRSP wird als gering betrachtet. S. pseudintermedius ist ein hochgradig an den caninen Wirt angepasstes Bakterium und ist schlecht ausgerüstet, um Menschen dauerhaft zu kolonisieren oder bei gesunden Menschen Infektionen zu verursachen. Jedoch ist dieses Risiko, obwohl gering, nicht null. Fälle menschlicher MRSP-Infektionen wurden berichtet, gewöhnlich bei immunsupprimierten Personen oder solchen in sehr engem Kontakt. Das Hauptrisiko von MRSP für die menschliche Gesundheit könnte indirekt sein: es kann als Reservoir für Resistenzgene (wie das mecA-Gen) fungieren, die möglicherweise auf virulenteren menschliche Pathogene wie S. aureus übertragen werden könnten.
- Asymmetrische Übertragungsdynamik:
- Für MRSA: Das Hauptreservoir ist der Mensch. Heimtiere sind meist “Kollateralschäden”. Der vorherrschende Übertragungsweg ist Mensch → Tier.
- Für MRSP: Das Haupt- und quasi-exklusive Reservoir ist der Hund. Die Übertragung ist hauptsächlich inter-canin. Die Übertragung auf Menschen ist, obwohl möglich, ein seltenes Ereignis (gelegentlicher zoonotischer Spillover).
- Übertragungsnachweis:
- Tier-Mensch-Übertragung: Mehrere Studien haben molekulare Typisierung verwendet, um die Übertragung identischer MRSP-Stämme zwischen infizierten Hunden und ihren Besitzern zu beweisen.
- Berufsrisiko für Veterinärpersonal: Veterinärpersonal stellt eine Risikopopulation für berufliches Trägertum dar. Eine Studie auf einer veterinärdermatologischen Konferenz ergab eine nasale MRSP-Trägerrate von 3,9% bei den Teilnehmern.
B. Infektionskontrollmaßnahmen
Die Prävention der MRS-Übertragung beruht auf der rigorosen Anwendung von Hygiene- und Biosicherheitsprotokollen, sowohl in klinischen als auch häuslichen Umgebungen.
Empfehlungen für Veterinärkliniken
Jede Veterinärklinik sollte ein formelles Infektionskontrollprogramm implementieren. Die grundlegenden Maßnahmen, basierend auf “Standardvorsichtsmaßnahmen“, umfassen:
- Handhygiene: Dies ist die einfachste und effektivste Maßnahme zur Prävention von Kreuzübertragungen.
- Persönliche Schutzausrüstung (PSA): Das Tragen von Handschuhen ist obligatorisch bei der Handhabung jedes Tieres mit Hautläsionen. Schutzkittel oder -schürzen müssen getragen werden.
- Patientenmanagement: Hospitalisierte Patienten mit bestätigter oder vermuteter MRS-Infektion müssen in Isolation gebracht werden. Für ambulante Konsultationen wird empfohlen, diese Patienten am Ende des Tages zu terminieren.
- Umweltreinigung und -desinfektion: Hochkontakt-Oberflächen und wiederverwendbare Ausrüstung müssen zwischen jedem Patienten gründlich gereinigt und desinfiziert werden.
Ratschläge für Besitzer infizierter oder kolonisierter Tiere
Die Aufklärung der Besitzer ist eine wesentliche Komponente. Die Ratschläge müssen klar, praktisch und nicht alarmierend sein.
- Rigorose Handhygiene: Besitzer müssen angewiesen werden, sich systematisch die Hände zu waschen, nachdem sie ihr Tier berührt haben.
- Begrenzung enger Kontakte: Während der aktiven Infektionsphase ist es ratsam, intime Kontakte zu begrenzen (Gesichtslecken, im Bett schlafen).
- Schutz gefährdeter Personen: Wenn immunsupprimierte Personen, sehr kleine Kinder, ältere Menschen oder Personen mit Hautwunden im Haushalt leben, sind zusätzliche Vorsichtsmaßnahmen erforderlich.
- Häusliche Umwelthygiene: Die Bettwäsche des Tieres, seine Spielzeuge und Näpfe müssen regelmäßig mit heißem Wasser und Seife gewaschen werden.
Schlussfolgerung: Hin zu einem integrierten Management durch Antibiotic Stewardship und den “One Health”-Ansatz
Das Auftreten von Methicillin-resistenten Staphylokokken, und insbesondere von MRSP, in der Veterinärdermatologie stellt weit mehr dar als nur eine therapeutische Herausforderung. Es repräsentiert eine komplexe Bedrohung, die die Schwächen unserer vergangenen Ansätze zur Antimikrobienverwendung aufzeigt und die tiefe Verbindung zwischen Tiergesundheit, menschlicher Gesundheit und Umwelt unterstreicht. Das effektive Management dieses Problems kann nicht länger nur auf der Suche nach einem neuen “Wunder”-Antibiotikum beruhen, sondern erfordert einen integrierten, holistischen und nachhaltigen Ansatz, basierend auf den Prinzipien des Antibiotic Stewardship und dem “One Health”-Konzept.
Zusammenfassung der Bedeutung
Die MRS haben die Hundepyodermie, eine einst banale Erkrankung, in eine potenziell chronische, schwer zu behandelnde und kostspielige Krankheit verwandelt. Die Bedeutung von MRSP liegt nicht in einer erhöhten Virulenz, sondern in seiner Fähigkeit, unseren Erstlinientherapien zu entkommen, was zu therapeutischen Versagen, verlängerter Morbidität und erhöhtem Übertragungsrisiko führt. Die Persistenz der Kolonisation nach klinischer Heilung schafft stille Reservoire, die den Zyklus von Infektion und Kontamination perpetuieren. Darüber hinaus stellt das zoonotische Potenzial, obwohl variabel je nach Staphylokokkenart, das Management dieser Infektionen an die Schnittstelle von Veterinärmedizin und öffentlicher Gesundheit.
Prinzipien des Antibiotic Stewardship
Der Kampf gegen die Ausbreitung der antimikrobiellen Resistenz führt unweigerlich über eine verantwortlichere und umsichtigere Verwendung von Antibiotika. Antibiotic Stewardship ist ein koordinierter Ansatz zur Förderung der angemessenen Verwendung von Antimikrobiellen zur Verbesserung der Patientenergebnisse bei gleichzeitiger Minimierung unbeabsichtigter Konsequenzen. In der Veterinärdermatologie übersetzt sich dies in konkrete Maßnahmen:
- Bevorzugung der topischen Therapie: Erhebung der topischen Therapie zum Status der Erstlinienbehandlung für alle oberflächlichen Pyodermien.
- Diagnose vor Behandlung: Systematische Verwendung der Zytologie zur Bestätigung der Infektion und Reservierung der systemischen Antibiotherapie für Fälle, wo sie absolut notwendig ist.
- Evidenzbasierte Behandlung: Basierung der Wahl jedes systemischen Antibiotikums auf den Ergebnissen eines Antibiogramms.
- Behandlung der Ursache, nicht nur des Symptoms: Identifizierung und rigorose Behandlung der zugrunde liegenden Krankheit zur Rezidivprävention.
- Einhaltung der Protokolle: Verwendung der richtigen Dosis, der richtigen Dauer und des richtigen Verabreichungswegs.
Das Erfordernis eines “One Health”-Ansatzes
Das Problem von MRSP in der Hundedermatologie ist ein Mikrokosmos der globalen Antibiotikaresistenz-Krise. Es illustriert perfekt, warum ein isolierter Ansatz zum Scheitern verurteilt ist. Antibiotikaresistenz ist ein Problem, das keine Grenzen zwischen Arten oder Ökosystemen kennt. Die Verwendung von Antibiotika bei einem Hund in einer Veterinärklinik kann Auswirkungen haben, die sich auf die Gesundheit der Menschen in seinem Haushalt erstrecken. Ein effektiver “One Health”-Ansatz erfordert aktive Zusammenarbeit zwischen Ärzten, Tierärzten und Verantwortlichen der öffentlichen Gesundheit zur Implementierung integrierter Resistenzüberwachung, Harmonisierung von Richtlinien, Aufklärung der Öffentlichkeit und Förderung der Forschung.
Zukunftsperspektiven
Die Zukunft des MRS-Managements in der Veterinärdermatologie wird von unserer Fähigkeit abhängen, diese Prinzipien vollständig in die tägliche Praxis zu integrieren. Zukünftige Entwicklungsachsen umfassen die Stärkung der epidemiologischen Überwachung, die Entwicklung und Validierung neuer nicht-antibiotischer therapeutischer Strategien und die kontinuierliche Verbesserung der Bildung. Zukünftige Forschungsachsen müssen sich auf mehrere komplementäre Fronten orientieren:
- Entwicklung alternativer Therapien: Die Forschung muss sich intensivieren, um “Post-Antibiotika“-Ansätze zu entwickeln und zu validieren. Diese umfassen die Verwendung von Bakteriophagen (bakterientötende Viren), antimikrobiellen Peptiden, Pflanzenextrakten, zellwandlysierenden Enzymen (Endolysine) oder Molekülen, die Virulenzfaktoren statt bakterielles Wachstum angreifen.
- Optimierung des Antibiotic Stewardship: Robuste und kontinuierliche epidemiologische Überwachungssysteme sind notwendig, um die Evolution von MRSP-Klonen und ihrer Resistenzprofile in Echtzeit auf lokaler und nationaler Ebene zu verfolgen.
- Verständnis des Übergangs Kommensale-Pathogen: Ein besseres Verständnis der Faktoren, die den Übergang von S. pseudintermedius von einem harmlosen Kommensalen zu einem Infektionserreger auslösen, ist ein vielversprechender Forschungsweg zur Prävention der Infektionsinzidenz.
Die Herausforderung ist groß, aber ein proaktiver, kollaborativer und wissenschaftsbasierter Ansatz kann es uns ermöglichen, die Wirksamkeit unserer Antimikrobien zu bewahren und die Gesundheit unserer tierischen Patienten und der menschlichen Gemeinschaft insgesamt zu schützen.
Literatur
- Frank, L. A., & Loeffler, A. (2012). Meticillin-resistant Staphylococcus pseudintermedius: clinical challenge and treatment options. Veterinary Dermatology, 23(4), 283-e56.
- van Duijkeren, E., Catry, B., Greko, C., Moreno, M. A., Pomba, C., Pyörälä, S., Ružauskas, M., Sanders, P., Threlfall, E. J., & Torren-Edo, J. (2011). Review on methicillin-resistant Staphylococcus pseudintermedius. Journal of Antimicrobial Chemotherapy, 66(12), 2705-2714.
- Morris, D. O., Boston, R. C., O’Shea, K., & Rankin, S. C. (2010). The prevalence of carriage of meticillin-resistant staphylococci by veterinary dermatology practice staff and their respective pets. Veterinary Dermatology, 21(4), 400-407.
- Cohn, L. A., & Middleton, J. R. (2010). A veterinary perspective on methicillin-resistant staphylococci. Journal of Veterinary Emergency and Critical Care, 20(1), 31-45.
- Duquette, R. A., & Nuttall, T. J. (2004). Methicillin-resistant Staphylococcus aureus in dogs and cats: an emerging problem? Journal of Small Animal Practice, 45(12), 591-597.
- Papich, M. G. (2023). Antimicrobial agents in small animal dermatology for treating staphylococcal infections. Journal of the American Veterinary Medical Association, 261(S1), S130-S139.
- Griffeth, G. C., Morris, D. O., Abraham, J. L., Shofer, F. S., & Rankin, S. C. (2008). Screening for skin carriage of methicillin-resistant coagulase-positive staphylococci and Staphylococcus schleiferi in dogs with healthy and inflamed skin. Veterinary Dermatology, 19(3), 142-149.
- Lilenbaum, W., et al. (2024). Nationwide analysis of methicillin-resistant staphylococci in cats and dogs: resistance patterns and geographic distribution. American Journal of Veterinary Research.
- Pomba, C., Rantala, M., Greko, C., Baptiste, K. E., Catry, B., van Duijkeren, E., Mateus, A., Moreno, M. A., Pyörälä, S., Ružauskas, M., & Torren-Edo, J. (2017). Public health risk of antimicrobial resistance transfer from companion animals. Journal of Antimicrobial Chemotherapy, 72(4), 957-968.
- Hillier, A., Lloyd, D. H., Weese, J. S., Blondeau, J. M., Cossens, C., Guardabassi, L., Papich, M. G., & Frank, L. (2014). Recommendations for approaches to meticillin-resistant staphylococcal infections of small animals: diagnosis, therapeutic considerations and preventative measures. Veterinary Dermatology, 25(3), e39-e53..
- Ngassam, C. T., et al. (2025). Mieux traiter les pyodermites nécessite de mieux les reconnaitre et de savoir détecter les résistances bactériennes aux antibiotiques. Le Nouveau Praticien Vétérinaire canine-féline.
- Gmyterco, V. C., Luciano, F. B., Ludwig, L. A., Evangelista, A. G., Ferreira, T. S., Borek, F., & de Farias, M. R. (2025). Comparative study of a commercial formula containing natural antimicrobials versus oral cephalexin or topical chlorhexidine-miconazole therapies for treating superficial pyoderma in dogs. Veterinary Dermatology.
- Perreten, V., Kadlec, K., Schwarz, S., Grönlund Andersson, U., Finn, M., Greko, C., Moodley, A., Kania, S. A., Frank, L. A., Bemis, D. A., Franco, A., Iurescia, M., Battisti, A., Duim, B., Wagenaar, J. A., van Duijkeren, E., Weese, J. S., & Guardabassi, L. (2010). Clonal spread of methicillin-resistant Staphylococcus pseudintermedius in Europe and North America: an international collaborative study. Journal of Antimicrobial Chemotherapy, 65(6), 1145-1154.
- Loeffler, A., & Lloyd, D. H. (2010). Companion animals: a reservoir for methicillin-resistant Staphylococcus aureus. Journal of Antimicrobial Chemotherapy, 65(4), 594-601.