Das spektakuläre demografische Wachstum der Französischen Bulldogge im letzten Jahrzehnt hat durch einen genetischen Flaschenhalseffekt und extreme phänotypische Selektion die Prävalenz komplexer dermatologischer Erkrankungen verstärkt. Ein Überblick über die wichtigsten sie betreffenden Dermatosen und deren Behandlung.
Anatomische und genetische Besonderheiten der Französischen Bulldogge
Prävalenz der atopischen Dermatitis und rassespezifische Vulnerabilität
Die Französische Bulldogge nimmt eine einzigartige Position in der Veterinärdermatologie ein, nicht nur aufgrund ihrer wachsenden Popularität in den westlichen Ländern, sondern vor allem durch die einzigartige Konvergenz anatomischer, genetischer und immunologischer Faktoren, die diese Rasse für ein außergewöhnlich breites dermatologisches Krankheitsspektrum prädisponieren. Neuere epidemiologische Daten zeigen eine Prävalenz der atopischen Dermatitis von 15 bis 20% in dieser Hundepopulation, was einem dreimal höheren Wert als der interrassischen Durchschnitt entspricht. Diese kutane Vulnerabilität resultiert aus einer extremen brachyzephalen Körperarchitektur, die mit dokumentierten genetischen Anomalien verbunden ist, welche die epidermale Kohäsion und die Immunantwort beeinträchtigen.
Auswirkungen der brachyzephalen Konformation auf das Intertrigo
Die brachyzephale Konformation der Französischen Bulldogge erzeugt erhebliche dermatologische Auswirkungen durch die Bildung multipler Hautfalten. Die kranio-faziale Verkürzung, die teilweise aus einer Mutation des BMP3-Gens resultiert, führt zu einem Überschuss an Gesichtshautgewebe, das sich in tiefe Falten legt, insbesondere im nasolabial, interlabial und bei der Hündin perivulvär gelegenen Bereich. Diese anaeroben Mikroumgebungen weisen eine relative Feuchtigkeit von über 80%, eine um 2 bis 3 Grad erhöhte Temperatur gegenüber exponierten Bereichen und eine permanente Okklusion auf, die das mikrobielle Wachstum fördert. Die Pathophysiologie des daraus resultierenden Intertrigoes beruht auf einer initialen epidermalen Mazeration gefolgt von einer Ruptur der Hautbarriere, die die Kolonisation durch Staphylococcus pseudintermedius und Hefen der Gattung Malassezia ermöglicht. Der Haut-pH in diesen abgeschlossenen Bereichen alkalisiert progressiv, steigt von 5,5 auf 7,2, wodurch ein günstiger Boden für logarithmisches bakterielles Wachstum geschaffen wird.
Überexpression von Zytokinrezeptoren und JAK-STAT-Signalweg
Das kutane Immunsystem der Französischen Bulldogge weist ebenfalls dokumentierte funktionelle Besonderheiten auf. Die transkriptomische Analyse nicht-läsionaler Hautbiopsien bei atopischen Individuen dieser Rasse zeigt eine konstitutive Überexpression der Gene, die für Interleukin-31-Rezeptoren (IL-31RA) und Oncostatin-M-Rezeptoren (OSMR) kodieren, mit mRNA-Spiegeln, die über denen gesunder Hunde liegen. Diese erhöhte Expression prädisponiert zu einer übermäßigen Aktivierung des JAK1/JAK2-STAT3-Signalwegs in Gegenwart selbst physiologischer IL-31-Konzentrationen, einer wichtigen pruritogenen Zytokine, die von T-Helfer-Typ-2-Lymphozyten produziert wird. Der heterodimere IL-31RA/OSMR-Komplex phosphoryliert die Tyrosinkinasen JAK1 und JAK2, die anschließend STAT3 durch Phosphorylierung seines Tyrosin 705 aktivieren und die transkriptionelle Kaskade des Juckreizes auslösen. Diese molekulare Hypersensibilität erklärt die bei dieser Rasse klinisch beobachtete Juckreizintensität, selbst bei minimalen antigenen Stimulationen.
Follikuläre Dichte und Sebummangel
Die follikuläre Dichte stellt eine weitere anatomische Eigenschaft dar, die die dermatologische Pathologie der Französischen Bulldogge beeinflusst. Quantitative histomorphometrische Studien zeigen eine geringere durchschnittliche follikuläre Dichte als bei langhaarigen Rassen wie Pudel oder Yorkshire Terrier. Diese follikuläre Rarefizierung geht mit einer proportionalen Reduktion der Sebumsekretion einher, da die anhängenden Talgdrüsen weniger voluminös sind. Das an Triglyceriden und freien Fettsäuren reiche Hundesebum beteiligt sich aktiv an der antimikrobiellen kutanen Abwehr durch seine lipophile Wirkung auf Pathogene und seine Rolle bei der Aufrechterhaltung des sauren Oberflächen-pH. Der relative Sebummangel bei der Französischen Bulldogge beeinträchtigt diese erste Verteidigungslinie und begünstigt die Kolonisation durch opportunistische Mikroorganismen.
Ultrastrukturelle und lipidomische Anomalien des Stratum corneum
Die Architektur des Stratum corneum zeigt auch ultrastrukturelle Anomalien bei atopischen Französischen Bulldoggen im Vergleich zu gesunden Individuen derselben Rasse. Transmissionselektronenmikroskopische Studien zeigen einen erweiterten interkorneozyträren Abstand mit Lipidlücken innerhalb der extrazellulären Lamellen. Die lipidomische Analyse mittels Flüssigchromatographie gekoppelt mit Massenspektrometrie zeigt eine Reduktion von 35 bis 40% der sehr langkettigen Ceramide, insbesondere der Ceramide der Klassen [NP] und [EOS], die für die lamellare Organisation des interkorneozyträren Zements wesentlich sind. Die [EOS]-Ceramide, charakterisiert durch ein mit einer Linolsäure verestertes Sphingosin, spielen eine kritische strukturelle Rolle bei der Verankerung der Lipidlamellen an der kornealen Proteinhülle. Ihr Defizit kompromittiert die architektonische Organisation des Stratum corneum und erhöht die Permeabilität für Umweltallergene und Mikroorganismen.
Veränderung der epidermalen Erneuerung und PROM1-Gen
Die genetische Prädisposition für Atopie bei der Französischen Bulldogge betrifft auch Variationen des PROM1-Gens, das für Prominin-1 kodiert, ein Transmembranglykoprotein, das in epidermalen Stammzellen exprimiert wird. Eine besondere Variante dieses Gens, identifiziert durch Next-Generation-Sequenzierung bei 156 atopischen Französischen Bulldoggen, ist mit einer Veränderung der epidermalen Erneuerung verbunden, mit einer verlängerten Keratinozyten-Zyklusdauer von durchschnittlich 19 Tagen gegenüber 14 bis 16 Tagen bei gesunden Hunden. Diese verlangsamte epidermale Kinetik stört die terminale Reifung der Keratinozyten und die Synthese der Barrierekomponenten, wodurch ein Teufelskreis entsteht, in dem die strukturelle Dysfunktion Entzündungen fördert, die ihrerseits die Störung der epidermalen Differenzierung verstärkt.
Mangel an antimikrobiellen Peptiden und Biofilmbildung
Die bei dieser Rasse beobachtete Anfälligkeit für wiederkehrende Hautinfektionen findet auch eine Erklärung in der reduzierten Expression endogener antimikrobieller Peptide. Die caninen Beta-Defensine, insbesondere cBD1, cBD3 und cBD103, stellen eine wesentliche angeborene Abwehr gegen kutane Pathogene dar. RT-PCR-Analysen von Hautbiopsien atopischer Französischer Bulldoggen zeigen eine um 60% verringerte cBD103-Expression im Vergleich zu gesunden Kontrollen, mit durchschnittlichen mRNA-Spiegeln von 0,4 relativen Einheiten gegenüber 1,0. Diese defiziente angeborene Immunität erleichtert die Etablierung organisierter bakterieller Biofilme, insbesondere von Staphylococcus pseudintermedius, deren Eradikation aufgrund des durch die dreidimensionale Struktur des Biofilms verliehenen Matrixschutzes progressiv schwieriger wird.
Modul 2: Dysfunktion der epidermalen Barriere – Molekulare Mechanismen
Architektonisches “Ziegel-und-Mörtel”-Modell
Die epidermale Barriere der Französischen Bulldogge zeigt strukturelle und funktionelle Anomalien, die das primäre pathophysiologische Substrat ihrer dermatologischen Vulnerabilität darstellen. Diese im Stratum corneum lokalisierte Barriere beruht auf einem architektonischen Modell namens “Ziegel und Mörtel”, wobei die Korneozyten die Ziegel und die interzellulären Lipidlamellen den Mörtel bilden. Bei der für Atopie prädisponierten Französischen Bulldogge erfährt dieses System eine Desorganisation auf mehreren molekularen Ebenen, wodurch seine Funktion als Bollwerk gegen Allergenenpenetration, mikrobielle Kolonisation und transepidermalen Wasserverlust kompromittiert wird.
Zentrale Rolle des Fillaggrins bei der epidermalen Kohäsion
Das Filaggrin (Filament-aggregierendes Protein) spielt eine zentrale Rolle bei der Bildung der Hautbarriere. Dieses 400 kDa-Protein, kodiert durch das FLG-Gen, unterliegt einer komplexen proteolytischen Reifung während der terminalen Keratinozyten-Differenzierung. In der Körnerschicht wird Profilaggrin dephosphoryliert und dann durch spezifische Proteasen gespalten, um funktionelle Filaggrin-Monomere zu erzeugen. Diese Monomere aggregieren Keratinfilamente zu dichten Makrofibrillen und tragen zur Abflachung der Korneozyten und Verdichtung des Stratum corneum bei. Bei atopischen Französischen Bulldoggen zeigen immunhistochemische Analysen eine reduzierte Filaggrin-Expression mit einer um 45% verminderten Färbungsintensität im Vergleich zu altersgleichen gesunden Kontrollen.
Natürliche Feuchtigkeitsfaktoren (NMF) und Wasserverlust
Der weitere Abbau von Filaggrin erzeugt natürliche Feuchtigkeitsfaktoren (NMF – Natural Moisturizing Factors), die für die Aufrechterhaltung der kornealen Hydratation wesentlich sind. Peptidase-Enzyme, insbesondere Caspase-14 und Bleomycin-Hydrolasen, fragmentieren Filaggrin in freie Aminosäuren, einschließlich Histidin, Serin und Arginin. Histidin wird anschließend durch Histidase zu trans-Urocansäure deaminiert, die hygroskopische und photoprotektive Eigenschaften besitzt. Arginin wird durch Peptidylarginin-Deiminasen zu Citrullin konvertiert. Bei der Französischen Bulldogge zeigt die Quantifizierung des Stratum corneum mittels Hochleistungsflüssigchromatographie eine Reduktion von 42% der freien Aminosäurespiegel und eine 38%ige Abnahme der Urocansäure im Vergleich zu nicht prädisponierten Rassen. Dieser NMF-Mangel führt zu einer chronischen Dehydratation des Stratum corneum mit einem messbaren Anstieg des unmerklichen Wasserverlusts von 12-15 g/m²/h bei gesunden Hunden auf 28-35 g/m²/h bei Atopikern.
Veränderung der Tight Junctions
Die Tight Junctions der Körnerschicht bilden eine zweite Ebene der epidermalen Barriere und kontrollieren die parazelluläre Permeabilität. Diese Proteinkomplexe, die hauptsächlich aus Claudinen (Claudin-1, Claudin-4), Occludin und Zonula-occludens-Proteinen (ZO-1, ZO-2) bestehen, bilden ein anastomosierendes Netzwerk, das einen interzellulären Verschluss schafft. Transkriptomische Analysen atopischer Haut der Französischen Bulldogge zeigen eine signifikante Unterexpression der Gene CLDN1 und OCLN, die für Claudin-1 bzw. Occludin kodieren, mit mRNA-Expressionsreduktionen von 2,1- bzw. 1,7-fach. Diese Veränderung der Tight Junctions ermöglicht eine erleichterte Penetration von Allergenen mit hohem Molekulargewicht, die normalerweise durch diese selektive Barriere ausgeschlossen werden, und löst die unangemessene Aktivierung des kutanen Immunsystems aus.
Störung des epidermalen Lipidstoffwechsels
Der epidermale Lipidstoffwechsel zeigt quantitative und qualitative Hauptanomalien bei dieser Rasse. Die Stratum-corneum-Lipide, die in den Keratinozyten der Körnerschicht synthetisiert und in den Odland-Körpern gespeichert werden, werden durch Exozytose in den interkorneozyträren Raum sezerniert. Diese Lipide umfassen drei Hauptklassen: Ceramide (50%), Cholesterin (25%) und freie Fettsäuren (10-15%) in einem optimalen molaren Verhältnis von 1:1:1, das für die Bildung undurchlässiger orthorhombischer Lamellen erforderlich ist. Bei atopischen Französischen Bulldoggen zeigen Analysen mittels Gaschromatographie gekoppelt mit Massenspektrometrie eine Störung des Lipidverhältnisses mit einer relativen Reduktion der Ceramide auf 38% und einer kompensatorischen Erhöhung des Cholesterins auf 35%, was die lamellare Kristallinität verändert und die Permeabilität erhöht.
Bedeutung der [EOS]-Klasse-Ceramide
Ceramide, komplexe Sphingolipide bestehend aus einem durch eine Amidbindung mit einer Fettsäure verbundenen Sphingosin, unterteilen sich je nach Art ihrer Sphingoidbase und Fettsäure in 12 Klassen. Die [EOS]-Klasse-Ceramide (Acylceramide mit Linoleat-Veresterung) sind besonders kritisch für die kutane Impermeabilität. Ihre Biosynthese umfasst eine enzymatische Kaskade mit Serin-Palmitoyltransferase, Ceramid-Synthasen (insbesondere CerS3 für ultra-lange Fettsäuren) und Glucosylceramid-Beta-Glucosidase, die Glucosylceramide zu freien Ceramiden hydrolysiert. Western-Blot-Studien an epidermalen Proteinextrakten atopischer Französischer Bulldoggen zeigen eine um 52% reduzierte CerS3-Expression im Vergleich zu Kontrollen, was mit der Abnahme sehr langkettiger Ceramide (C28-C32) korreliert.
Aktivität der Beta-Glucocerebrosidase (GBA)
Das Enzym Beta-Glucocerebrosidase (GBA), lokalisiert in den Lamellenkörperchen, katalysiert den terminalen Konversionsschritt von Glucosylceramiden zu funktionellen Ceramiden zum Zeitpunkt der Sekretion in den extrazellulären Raum. Ein Mangel an diesem Enzym, dokumentiert bei einigen atopischen Hunden, führt zu einer Akkumulation nicht-funktioneller glucosylierter Vorstufen und einem Defizit an reifen Ceramiden. Die GBA-Enzymaktivität, gemessen durch Fluorometrie an Stratum-corneum-Homogenaten der Französischen Bulldogge, ist bei atopischen Tieren um durchschnittlich 38% reduziert, was eine Störung des post-sekretorischen Lipidreifungsprozesses nahelegt.
Rolle der Sphingomyelin-Deacylase (SMase)
Die Sphingomyelin-Deacylase (SMase), auch bekannt als alkalische Ceramidase, reguliert die Ceramid-Homöostase durch Katalyse ihrer Hydrolyse. Ein empfindliches Gleichgewicht zwischen Synthese und Abbau von Ceramiden bestimmt ihre Gewebekonzentration. Bei der Französischen Bulldogge legen enzymatische Studien eine relative Hyperaktivität bestimmter Ceramidasen nahe, die zur beobachteten Ceramidverarmung beiträgt. Die Genexpression von ASAH2, das für neutrale Ceramidase kodiert, ist in läsionaler atopischer Haut um das 1,6-fache erhöht, was einen übermäßigen Ceramidkatabolismus begünstigt, der die Barrierendysfunktion verschlechtert.
Mangel an freien Fettsäuren und Linolsäure
Die freien Fettsäuren des Stratum corneum, hauptsächlich Linolsäure (C18:2 ω-6), Ölsäure (C18:1 ω-9) und Palmitinsäure (C16:0), beteiligen sich aktiv an der lamellaren Organisation und besitzen intrinsische entzündungshemmende Eigenschaften. Linolsäure, eine essentielle Fettsäure, wird durch Veresterung des ω-Hydroxiceramid-Rests in [EOS]-Ceramide eingebaut. Ihr alimentärer oder metabolischer Mangel führt zu ihrem Ersatz durch Ölsäure, wodurch strukturell abnormale [EOO]-Ceramide entstehen, die die lamellare Organisation stören. Vergleichende lipidomische Analysen zeigen, dass 23% der atopischen Französischen Bulldoggen ein Linolsäure/Ölsäure-Verhältnis unter 2,5 im Stratum corneum aufweisen, eine Schwelle, unterhalb derer sich die Barrierefunktion signifikant verschlechtert.
Hyperaktivierung von Calpain-1 und desmosomaler Abbau
Calpain-1, eine calciumabhängige Protease, reguliert die kontrollierte Proteolyse von Desmoglein-1 und Corneodesmosin, interkorneozyträren Adhäsionsproteinen. Diese physiologische Proteolyse ermöglicht die geordnete Desquamation der Hornschicht. In einem entzündlichen Kontext beschleunigt jedoch die Hyperaktivierung von Calpain-1 durch Th2-Zytokine, insbesondere IL-4 und IL-13, den vorzeitigen desmosomalen Abbau und schafft Mikrorisse im Stratum corneum. Bei atopischen Französischen Bulldoggen ist die Calpain-1-Enzymaktivität, gemessen durch fluorogene Substrate, in läsionaler Haut um das 2,8-fache erhöht, was mit einer pathologischen Desquamation und einer Verschlechterung der Permeabilität korreliert.
Fragilität der kornealen Hülle
Die korneale Hülle, eine hochvernetzte Proteinstruktur, die unter der Plasmamembran der Korneozyten gebildet wird, bildet ein wesentliches architektonisches Skelett. Ihre Bildung involviert epidermale Transglutaminase-1, die die Bildung von Isopeptidbindungen zwischen Vorläuferproteinen (Loricrin, Involucrin, kleine prolinreiche Proteine) katalysiert. Loricrin macht 70 bis 80% der Proteinmasse der Hülle aus. Biochemische Analysen isolierter Korneozyten atopischer Französischer Bulldoggen zeigen eine defiziente Hüllenvernetzung mit einer um 35% reduzierten mechanischen Widerstandsfähigkeit, gemessen durch mikromechanische Zugtests. Diese strukturelle Fragilität begünstigt die vorzeitige Fragmentierung der Korneozyten und die Bildung von Brüchen in der Barriere.
Modul 3: Atopische Dermatitis – Epidemiologie und Rassenpathogenese
Beginnende atopische Dermatitis bei einer Französischen Bulldogge
Allgemeine Charakteristika der caninen atopischen Dermatitis
Die canine atopische Dermatitis stellt die häufigste dermatologische Pathologie bei der Französischen Bulldogge dar und betrifft 15 bis 20% der Rassenpopulation laut europäischen und nordamerikanischen epidemiologischen Studien. Dies sollte jedoch mit gewissen Rekrutierungsverzerrungen relativiert werden. Diese chronisch-rezidivierende entzündliche Dermatose ist charakterisiert durch intensiven Juckreiz, eine stereotype Läsionsverteilung und einen klinischen Verlauf, der von Schüben unterbrochen von partiellen Remissionen geprägt ist. Die komplexe Pathogenese dieser Erkrankung umfasst eine Interaktion zwischen einer polygenen genetischen Prädisposition, einer primären epidermalen Barrierendysfunktion, einer immunologischen Dysregulation mit übermäßiger Th2-Polarisierung und umweltbedingten auslösenden Faktoren einschließlich luftgetragener und alimentärer Allergene.
Chronologie und Frühzeitigkeit der klinischen Zeichen
Das Erkrankungsalter der klinischen Manifestationen bei der Französischen Bulldogge liegt typischerweise zwischen 6 Monaten und 3 Jahren, mit einem Inzidenzgipfel zwischen 12 und 18 Monaten. Eine retrospektive Studie an 487 atopischen Französischen Bulldoggen zeigt, dass 62% der Fälle sich vor dem Alter von 24 Monaten manifestieren und 89% vor 4 Jahren. Diese frühe Manifestation kontrastiert mit bestimmten Rassen wie dem Deutschen Schäferhund, wo Zeichen später auftreten können. Der initiale klinische Ausdruck ist häufig durch isolierten Gesichtsjuckreiz charakterisiert, der periokulär, am Ohrläppchen und an den Lippenwinkeln auftritt und sich über einen Zeitraum von 6 bis 18 Monaten progressiv zu einer Generalisierung mit Pododalbefall, axillärem und ventralem Befall entwickelt. Der CADESI-4-Score (Canine Atopic Dermatitis Extent and Severity Index), der Erythem und Läsionen an 20 anatomischen Stellen bewertet, zeigt bei unbehandelten Französischen Bulldoggen Durchschnittswerte von 35 bis 45 im Vergleich zu 25-30 für andere atopische Rassen, was eine erhöhte klinische Schwere bezeugt.
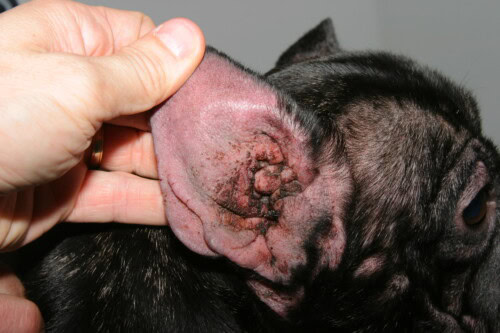
Otitis atopischen Ursprungs
Besonderheiten der Läsionsverteilung und Hypermastocytose
Die Läsionsverteilung bei dieser Rasse zeigt bestimmte Besonderheiten im Vergleich zum klassischen Muster der atopischen Dermatitis. Wenn auch der Befall der klassischen Bereiche (Gesicht, Ohren, Interdigitalräume, Achsel- und Leistenfalten) konstant bleibt, entwickelt die Französische Bulldogge häufig schwere Läsionen im Bereich der Gesichtsfalten und der nasolabialen Furche, wo Mazeration die zugrunde liegende atopische Entzündung verschlechtert.
Die wichtige Entdeckung der SLAMF1-Variante
Die kürzliche Entdeckung einer wichtigen genetischen Variante, die mit der caninen atopischen Dermatitis assoziiert ist, stellt einen bedeutenden Fortschritt im Verständnis der Mechanismen dar, die den dermatologischen Prädispositionen der Französischen Bulldogge zugrunde liegen. Eine pangenom-weite Assoziationsstudie, die an über 28.000 Hunden durchgeführt wurde, die mit mittel-dichten Polymorphismus-Nukleotid-Chips genotypisiert wurden, identifizierte ein statistisch signifikantes Signal auf dem caninen Chromosom 38, das bei der Französischen Bulldogge besonders intensiv war. Die vollständige Genomsequenzierung von Fällen und Kontrollen enthüllte eine Spleißvariante an der Donorseite im SLAMF1-Gen, das für das Signaling Lymphocyte Activation Molecule 1 kodiert, auch als CD150 bezeichnet. Die SLAMF1-Mutation verändert die hochkonservierte Donor-Spleißstelle stromabwärts von Exon 4, was zur Nutzung einer kryptischen Stelle und der aberranten Addition von 41 Basenpaaren zu Exon 4 führt. Diese Modifikation erzeugt ein trunkiertes Protein mit 83 aberranten Aminosäuren vor vorzeitiger Termination, wodurch der zytoplasmatische Schwanz von SLAMF1 einschließlich der für die Bindung von zellulären Signalliganden wesentlichen ITSM-Motive eliminiert wird.
Die Prävalenz dieser Variante ist bei der Französischen Bulldogge besonders alarmierend. Die Daten zeigen, dass diese Variante bei 71% der Individuen der Rasse vorhanden ist, gegenüber 40% bei Boxern, was eine unbeabsichtigte genetische Fixierung durch Rassenselektion nahelegt. Die klinische Auswirkung ist direkt und quantifizierbar: Die Anwesenheit dieser Variante erhöht signifikant das Risiko, eine canine atopische Dermatitis (CAD) zu entwickeln. Relative Risikoanalysen zeigen, dass Hunde mit einer Kopie der Variante ein um den Faktor 1,89 erhöhtes Risiko haben, während Homozygote für die Variante ihr Risiko um den Faktor 3,57 vervielfachen.
Der SLAMF1-Rezeptor, exprimiert auf der Oberfläche von T-, B-, NK-Lymphozyten und dendritischen Zellen, spielt eine kritische regulatorische Rolle bei Immunantworten. Die Disruption des zytoplasmatischen Schwanzes verhindert die Bindung des Adapterproteins SAP und hemmt die Bildung des ternären SLAM-SAP-Fyn-SH3-Komplexes, einer Signalkaskade, die an der Modulation der Produktion inflammatorischer Zytokine durch aus Monozyten abgeleitete dendritische Zellen beteiligt ist. Die pathogenetische Hypothese basiert auf einer Dysregulation inflammatorischer Antworten infolge allergener Stimuli, da homotypische SLAM-SLAM-Interaktionen normalerweise die durch CD40 induzierte Produktion pro-inflammatorischer Zytokine hemmen. Die Allelfrequenz der SLAMF1-Variante liegt bei 0,082 in der Dog10k-Datenbank und erweist sich als besonders hoch oder sogar fixiert in bestimmten Linien von Französischen Bulldoggen, Boxern und Boston Terriern. Die Analyse des Erbgangs und die Berechnung der Odds Ratios zeigen, dass diese Variante ein verdoppeltes Risiko für die Entwicklung einer atopischen Dermatitis verleiht, mit einem dosisabhängigen Effekt, der je nach untersuchten Rassen einen dominanten oder additiven Erbgang nahelegt.
Diese molekulare Bestätigung validiert die klinische Beobachtung einer schweren “rassischen Atopie”. Die Dysfunktion von SLAMF1 könnte die Tendenz der Rasse erklären, unverhältnismäßige inflammatorische Antworten auf Umweltallergene zu entwickeln, die über den einfachen Rahmen der Hypersensitivität gegen Dermatophagoides farinae hinausgehen und eine intrinsische immunologische Dysregulation einschließen.
Immunologische Pathogenese und Th2-Polarisierung
Die immunologische Pathogenese der atopischen Dermatitis bei der Französischen Bulldogge beinhaltet eine Kaskade zellulärer und molekularer Ereignisse, die durch die transkutane Penetration von Umweltallergenen durch die defiziente epidermale Barriere initiiert wird. Epidermale Langerhans-Zellen, antigen-präsentierende dendritische Zellen, erfassen die Allergene und migrieren zu den drainierenden Lymphknoten, wo sie naive T-Lymphozyten aktivieren. In einem genetisch prädisponierten Kontext orientiert diese Aktivierung bevorzugt die Differenzierung zu einem Th2-Phänotyp, charakterisiert durch die Produktion der Interleukine IL-4, IL-5, IL-13 und IL-31. IL-4 und IL-13 induzieren den Isotypwechsel der B-Lymphozyten zur Produktion von allergenspezifischen Immunglobulin E (IgE), die sich an die hochaffinen FcεRI-Rezeptoren binden, die von kutanen Mastzellen und Basophilen exprimiert werden.
Mastzell-Degranulation und IgE-Hyperproduktion
Die IgE-abhängige Mastzell-Degranulation, ausgelöst durch allergene Reexposition und Kreuzvernetzung der membranären IgE, setzt eine Vielzahl präformierter und neugebildeter Mediatoren frei. Präformierte Mediatoren umfassen Histamin, Tryptase, Chymase und Heparin, verantwortlich für Vasodilatation, Erythem und akuten Juckreiz. Neugebildete Mediatoren, synthetisiert nach Zellaktivierung, umfassen Leukotriene (LTB4, LTC4) aus dem Arachidonsäure-Metabolismus durch 5-Lipoxygenase und Prostaglandine (PGD2), erzeugt über Cyclooxygenase-2.
Zentrale Rolle von Interleukin-31 (IL-31) beim Juckreiz
Interleukin-31, ein hauptsächlich von aktivierten Th2-Lymphozyten produziertes pruritogenes Zytokin, spielt eine zentrale Rolle in der Pathophysiologie des atopischen Juckreizes. Dieses Zytokin bindet an einen heterodimeren Rezeptorkomplex, bestehend aus IL-31RA und OSMR, der konstitutiv auf kutanen sensorischen Neuronen und Keratinozyten exprimiert wird. Die Aktivierung dieses Komplexes löst die sequentielle Phosphorylierung der Kinasen JAK1, JAK2 und der Transkriptionsfaktoren STAT1, STAT3 und STAT5 aus und induziert die Expression von pruraritogenen und pro-inflammatorischen Genen. Serum-IL-31-Messungen bei atopischen Französischen Bulldoggen zeigen Durchschnittskonzentrationen von 485 pg/ml, signifikant höher als die 125 pg/ml bei gesunden Hunden, mit einer positiven Korrelation (r=0,72, p<0,001) zwischen IL-31-Spiegeln und Juckreizintensität, bewertet durch eine visuelle Analogskala.
Verstärkung der Antwort durch TSLP
Das Thymic Stromal Lymphopoietin (TSLP), ein epitheliales Zytokin, das von Keratinozyten als Antwort auf mechanische Aggressionen und allergene Proteasen produziert wird, verstärkt die Th2-Antwort durch Aktivierung dendritischer Zellen zu einem pro-allergischen Phänotyp. TSLP induziert die Expression von OX40-Ligand auf dendritischen Zellen, einem kostimulatorischen Molekül, das für die Th2-Differenzierung wesentlich ist. Transkriptomische Analysen läsionaler Haut atopischer Französischer Bulldoggen zeigen eine 4,2-fache TSLP-Überexpression im Vergleich zu gesunder Haut, mit mRNA-Spiegeln, die mit der Epidermisdicke und dem Grad der Akanthose korrelieren. Diese Verstärkungsschleife zwischen Keratinozyten-Dendrozyten-T-Lymphozyten perpetuiert die chronische Entzündung und die progressive allergische Sensibilisierung.
Rekrutierung und Auswirkung von Gewebe-Eosinophilen
Eosinophile, hauptsächliche Effektorzellen der Typ-2-Inflammation, akkumulieren in der Dermis atopischer Läsionen unter dem chemotaktischen Einfluss von IL-5, Eotaxin (CCL11) und RANTES (CCL5). Diese Zellen setzen zytotoxische kationische Granula-Proteine frei, insbesondere Major Basic Protein (MBP), eosinophile Peroxidase (EPO) und eosinophiles kationisches Protein (ECP), die umgebende Gewebe schädigen und Entzündungen verstärken. Histologische Eosinophilen-Zählungen in der Dermis von Hautbiopsien atopischer Französischer Bulldoggen zeigen durchschnittliche Dichten von 215 Zellen pro Quadratmillimeter, gegenüber 15 bis 25 bei gesunden Kontrollen. Diese Gewebe-Eosinophilie korreliert mit der Chronizität der Krankheit und dem Vorhandensein lichenifizierter Läsionen.
Dysbiose des kutanen Mikrobioms
Das kutane Mikrobiom atopischer Französischer Bulldoggen zeigt tiefgreifende Veränderungen seiner Zusammensetzung und Diversität. 16S-rRNA-Sequenzierungsanalysen zeigen eine Dysbiose, charakterisiert durch einen Verlust der Alpha-Diversität (Shannon-Index reduziert von 4,2 auf 2,1) und eine klonale Expansion von Staphylococcus pseudintermedius, dessen relative Abundanz von 5-10% bei gesunden Hunden auf 45-65% in läsionalen Bereichen steigt. Diese Staphylokokken-Proliferation stellt nicht nur eine opportunistische Kolonisation dar, sondern beteiligt sich aktiv an der Pathogenese durch Produktion von Exotoxinen mit superantigener Aktivität. Staphylokokken-Enterotoxine (SEA, SEB, SEC) aktivieren T-Lymphozyten polyklonal unabhängig von ihrer antigenen Spezifität, indem sie den T-Zell-Rezeptor (TCR) mit dem Haupthistokompatibilitätskomplex Klasse II (MHC-II) verbrücken und die inflammatorische Antwort massiv verstärken.
Profil der allergenen Sensibilisierung und Polysensibilisierung
Die allergene Sensibilisierung bei atopischen Französischen Bulldoggen folgt einem charakteristischen Profil, identifiziert durch Intradermaltests und spezifische IgE-Messungen. Eine europäische multizentrische Studie an 842 atopischen Französischen Bulldoggen zeigt, dass 78% positive Reaktionen auf Hausstaubmilben (Dermatophagoides farinae, Dermatophagoides pteronyssinus), 56% auf Gräserpollen, 48% auf Innenraum-Schimmelpilze (Malassezia sympodialis, Aspergillus fumigatus) und 34% auf epitheliale Allergene aufweisen. Die Polysensibilisierung, definiert durch mindestens 5 signifikante Reaktivitäten, betrifft 67% der Individuen und legt eine globale allergene Hyperreaktivität nahe, eher als eine monoallergene Sensibilisierung. Diese Polysensibilisierung kompliziert das therapeutische Management und begrenzt die Wirksamkeit der spezifischen allergenen Immuntherapie.
Modul 4: Falten-Dermatosen und infektiöse Komplikationen
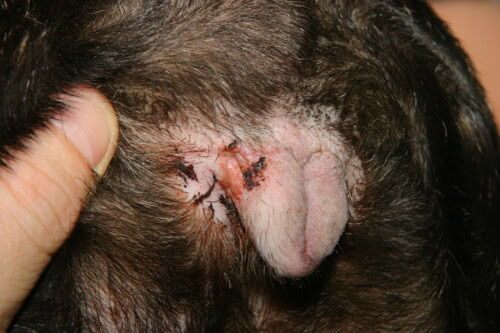
Vulväres Intertrigo
Pathophysiologie des Intertrigoes
Das Intertrigo oder die Falten-Dermatitis stellt eine quasi pathognomonische klinische Entität der Französischen Bulldogge dar, die direkt aus ihrer extremen brachyzephalen Konformation resultiert. Diese inflammatorische Dermatose entwickelt sich in Bereichen von Hautfalten, wo die permanente Apposition zweier epidermaler Oberflächen eine okklusive, warme und feuchte Mikroumgebung schafft, die der Gewebsmazeration und mikrobiellen Proliferation förderlich ist. Die bevorzugten anatomischen Lokalisationen umfassen die nasofaziale Falte, die Unterlippenfalte, Vulvafalten bei der Hündin und sekundär die Rutenfalten, wenn diese korkenzieherartig eingerollt ist. Die Pathophysiologie des Intertrigoes beruht auf einer Kaskade von Ereignissen, die durch kontinuierliche mechanische Reibung zwischen gegenüberliegenden Hautoberflächen initiiert wird und eine Kontaktentzündung mit Freisetzung pro-inflammatorischer Zytokine durch traumatisierte Keratinozyten erzeugt.
Folgen der Mazeration und Alkalisierung des pH-Werts
Die epidermale Mazeration, zentraler Prozess der Intertrigo-Pathogenese, resultiert aus der Akkumulation von Tränen-, Speichel- und Talgsekretionen im abgeschlossenen Raum der Falte. Die relative Feuchtigkeit in diesen Bereichen erreicht 85 bis 95%, begünstigt die übermäßige Hydratation des Stratum corneum, das seine strukturelle Kohäsion verliert. pH-Messungen der Haut mit Oberflächenelektroden zeigen eine progressive Alkalisierung der Faltenmikroumgebung mit Werten, die von 5,5 in exponierten Hautbereichen auf 7,0-7,5 in tiefen Falten steigen. Diese pH-Erhöhung inaktiviert teilweise die proteolytischen Enzyme des Stratum corneum, die normalerweise im sauren Milieu aktiv sind, stört die physiologische Desquamation und begünstigt die Akkumulation zellulärer Detritus. Die Alkalisierung verändert auch die Zusammensetzung des Oberflächenlipidfilms, reduziert seine natürliche antimikrobielle Aktivität und schafft einen günstigen Boden für bakterielle und fungale Kolonisation.
Mikrobielle Kolonisationssequenz
Die mikrobielle Kolonisation mazerierter Falten folgt einer vorhersagbaren Sequenz, beginnend mit einer Expansion der residenten kommensalen Flora, hauptsächlich Staphylococcus pseudintermedius und Malassezia pachydermatis-Hefen, die zu einem opportunistisch pathogenen Status evolvieren. Quantitative mikrobiologische Zählungen durch standardisierte Abstrichtechnik zeigen durchschnittliche bakterielle Lasten von 10^6 bis 10^7 koloniebildenden Einheiten pro Quadratzentimeter in entzündeten Falten, gegenüber 10^3 bis 10^4 KBE/cm² auf angrenzender gesunder Haut. Staphylococcus pseudintermedius, Gram-positive Koagulase-produzierende Kokken, sezerniert ein Arsenal von Enzymen und Toxinen, die seine Gewebsinvasion fördern, insbesondere Lipasen, Proteasen, Nukleasen und Staphylokokken-Protein A, das die Opsonisierung durch Bindung am Fc-Fragment der Immunglobuline hemmt. Der Übergang von kommensalen zu pathogenen Status geht mit einer Modifikation des bakteriellen genomischen Profils einher, mit Überexpression von Virulenzfaktoren, die durch das Quorum-Sensing-System agr (accessory gene regulator) reguliert werden.
Klassifikation und Diagnose oberflächlicher Pyodermitiden
Oberflächliche Pyodermitiden stellen die natürliche Entwicklung unbehandelter oder chronischer Intertrigines bei der Französischen Bulldogge dar. Diese bakteriellen Hautinfektionen sind durch neutrophile Infiltration der oberflächlichen Dermis mit Bildung intraepidermaler oder subkornealer Pusteln charakterisiert. Die anatomische Klassifikation unterscheidet Impetigo (Befall oberflächlicher Epidermisschichten), oberflächliche Follikulitis (Infektion des oberen Drittels des Haarfollikels) und diffuse oberflächliche Pyodermitis. Bei der Französischen Bulldogge manifestiert sich die oberflächliche bakterielle Follikulitis klinisch durch erythematöse Papeln mit zentraler Pustel, die nach Pustelruptur zu epidermalen Kragen evolvieren. Kahl oder spärlich behaarte Bereiche wie die Achsel- und Leistenregion sind bevorzugt betroffen. Die zytologische Untersuchung durch Glasobjektträger-Apposition zeigt eine degenerierte neutrophile Population mit Phagozytose von in Haufen angeordneten Kokken (Staphylokokken) in 92% der Fälle, was den bakteriellen Ursprung der Infektion bestätigt.
Problematik resistenter Staphylokokken (MRSP)
Die Antibiotikaresistenz von Staphylococcus pseudintermedius stellt eine wachsende Problematik in der Veterinärdermatologie der Französischen Bulldogge dar, einer Rasse, die häufig iterative Antibiotherapien für ihre rezidivierenden Hautinfektionen erhält. Methicillin-resistente Stämme (MRSP – Methicillin-Resistant Staphylococcus pseudintermedius) sind seit den 2000er Jahren aufgetaucht und haben das mecA-Gen erworben, das für ein modifiziertes Penicillin-bindendes Protein (PBP2a) mit geringer Affinität zu Beta-Lactamen kodiert. Eine in 28 französischen Tierkliniken durchgeführte Prävalenzstudie zeigt eine MRSP-Trägerrate von 18% bei Französischen Bulldoggen, die wegen Dermatitis konsultieren, gegenüber 8% im Durchschnitt aller Rassen. Diese MRSP-Stämme zeigen häufig eine Multiresistenz, die Resistenz gegen Fluorchinolone (Mutationen in den Genen gyrA und parC, die für DNA-Gyrase und Topoisomerase IV kodieren), Makrolide (Erwerb des ermB-Gens) und Aminoglykoside kombiniert und das verfügbare therapeutische Arsenal drastisch begrenzt.
Persistenz durch bakterielle Biofilme
Bakterielle Biofilme, komplexe dreidimensionale Strukturen, in denen sich Bakterien in Gemeinschaften organisieren, die in einer extrazellulären Matrix aus Polysacchariden, Proteinen und extrazellulärer DNA eingekapselt sind, stellen einen wichtigen Persistenzmechanismus chronischer Hautinfektionen dar. Staphylococcus pseudintermedius produziert ein interzelluläres Adhäsionspolysaccharid (PIA), das durch das icaADBC-Operon kodiert wird und die bakterielle Adhäsion an Korneozyten und die Bildung einer reifen Biofilm-Architektur ermöglicht. Sessile Bakterien im Biofilm zeigen eine um 100 bis 1000-fach erhöhte antimikrobielle Toleranz im Vergleich zu freien planktonischen Formen, resultierend aus mehreren Mechanismen: begrenzte Antibiotika-Penetration durch die polymere Matrix, ungünstiges nutritives Mikroenvironment, das eine bakterielle metabolische Verlangsamung induziert, und Expression biofilm-spezifischer Resistenzgene. Die Konfokalmikroskopie von Hautbiopsien Französischer Bulldoggen mit chronisch-rezidivierender Pyodermitis zeigt das Vorhandensein organisierter Biofilme in 68% der Fälle, was die Schwierigkeit der Eradikation durch konventionelle Antibiotherapie erklärt.
Pyotraumatische Dermatitis (Hot Spot)
Die pyotraumatische Dermatitis, allgemein als Hot Spot oder akute feuchte Dermatitis bezeichnet, stellt eine häufige Komplikation bei atopischen Französischen Bulldoggen dar. Diese erythematöse exsudative Läsion mit fulminantem Verlauf resultiert aus intensiver Selbstverstümmelung, ausgelöst durch lokalisierten Juckreiz, oft allergischen oder parasitären Ursprungs. Zwanghaftes Lecken und Kratzen schaffen eine epidermale Erosion, die rasch von opportunistischer Hautflora kolonisiert wird, hauptsächlich Staphylococcus pseudintermedius. Die Freisetzung inflammatorischer Mediatoren, insbesondere des antimikrobiellen Peptids LL-37, das paradoxerweise chemotaktische Eigenschaften für Neutrophile besitzt, rekrutiert massiv diese Granulozyten und verstärkt die lokale Entzündung. Das reichliche seropurulente Exsudat mazeriert benachbarte Haare und schafft ein feuchtes, übelriechendes alopezisches Areal von 3 bis 10 Zentimetern Durchmesser, typischerweise lokalisiert in Regionen mit hoher Follikeldichte wie der Temporal-, Präaurikular- oder Kruppen-Region.
Komplikationen durch Malassezia-Hefen
Malassezia-Infektionen stellen eine häufige Komplikation des Intertrigoes und der atopischen Dermatitis bei der Französischen Bulldogge dar. Diese lipophilen kommensalen Hefen der Gattung Malassezia, hauptsächlich M. pachydermatis (nicht lipid-abhängige Art) und M. sympodialis, proliferieren opportunistisch in warmen, feuchten und lipidreichen Umgebungen der Hautfalten. Die Pathogenese der Malassezia-Dermatitis umfasst eine komplexe Interaktion zwischen quantitativer fungaler Proliferation und immunologischer Reaktivität des Wirts. Einige Hunde entwickeln eine Typ-I- und Typ-IV-Hypersensitivität gegen Malassezia-Antigene, vermittelt durch spezifische IgE bzw. T-Lymphozyten-vermittelte Zellreaktion. Zytologische Zählungen mittels Scotch-Tape-Technik zeigen Hefedichten von über 10 Organismen pro mikroskopischem Feld bei hoher Vergrößerung in betroffenen Bereichen, gegenüber weniger als 2 Organismen bei asymptomatischen Trägern.
Externe Otitiden und Gehörgangsumbau
Externe Otitiden, eine quasi-konstante Affektion bei atopischen Französischen Bulldoggen, resultieren aus einer Extension der Hautentzündung auf den äußeren Gehörgang, einen Bereich, der als modifizierte Hautfalte betrachtet wird. Die besondere Konformation des Ohrs der Französischen Bulldogge mit einem kurzen, weiten und horizontal orientierten äußeren Gehörgang begünstigt die Cerumen-Akkumulation und Feuchtigkeitsretention. Die allergische Entzündung des Gehörgangsepithels führt zu einer Hyperplasie der Ceruminaldrüsen mit Produktion eines modifizierten, visköseren und in übermäßiger Menge produzierten Cerumens, das ein optimales nutritives Substrat für Malassezia pachydermatis schafft. Zytologische Cerumen-Analysen von Französischen Bulldoggen mit externer Otitis zeigen eine Malassezia-Dominanz in 76% der Fälle, eine gemischte bakterielle Infektion in 18% und eine reine bakterielle Infektion in nur 6%. Die chronische Otitis induziert progressiv irreversible strukturelle Modifikationen des Gehörgangs mit Fibrose, Verkalkung des Ohrknorpels und progressiver Stenose, die in terminalen Stadien einen chirurgischen Eingriff mit Gehörgangsablation und Bullaosteotomie erforderlich machen kann.
Modul 5: Malassezia-Dermatitis und rezidivierende Pyodermitiden
Biologie von Malassezia pachydermatis
Die Malassezia-Dermatitis stellt eine wichtige klinische Entität bei der Französischen Bulldogge dar, die entweder als Komplikation einer zugrunde liegenden atopischen Dermatitis oder als Manifestation einer primären Hypersensitivität gegen fungale Antigene auftritt. Hefen der Gattung Malassezia stellen ubiquitäre lipophile kommensale Organismen der caninen Haut und Schleimhäute dar, mit sieben beim Hund identifizierten Arten, wobei Malassezia pachydermatis die häufigste bleibt. Diese Art zeigt die einzigartige Besonderheit, nicht lipid-abhängig für ihre in vitro Kultur zu sein, im Gegensatz zu anderen Malassezia-Arten, die eine lipidische Anreicherung des Mediums benötigen. Die zelluläre Morphologie von M. pachydermatis ist durch ovale bis monopolare Blastokonidien von 3 bis 8 Mikrometern mit unipolarer Knospung charakterisiert, leicht identifizierbar bei der zytologischen Untersuchung nach Schnellfärbung vom Typ Diff-Quik oder Gram-Färbung, wo sie als violette bis blaue erdnussförmige Kokken erscheinen.
Mechanismen des Übergangs zur Pathogenität
Der Übergang von kommensal zu pathogen von Malassezia-Hefen beinhaltet mehrere miteinander verbundene Mechanismen. Vollgenom-Sequenzierungsstudien von M. pachydermatis zeigen ein 7,98-Megabasen-Genom, das für ein enzymatisches Arsenal kodiert, das sekretierte Lipasen, Phospholipasen und Proteasen umfasst, die Hautlipide und epidermale Strukturproteine abbauen. Lipasen hydrolysieren Sebum-Triglyceride zu freien Fettsäuren, von denen einige wie Ölsäure irritierende Eigenschaften besitzen und die Barrierefunktion weiter beeinträchtigen. Von Malassezia sekretierte Phospholipasen A2 spalten keratinozyträre Membranphospholipide und erzeugen Arachidonsäure, einen Vorläufer der pro-inflammatorischen Mediatoren Prostaglandine und Leukotriene über Cyclooxygenase- und Lipoxygenase-Wege. Diese pro-inflammatorische enzymatische Aktivität erklärt, wie selbst eine quantitativ moderate Kolonisation bei genetisch prädisponierten Individuen eine klinisch signifikante Entzündung induzieren kann.
Immunerkennung und Entzündung
Die Immunerkennung von Malassezia-Antigenen durch das kutane Immunsystem stellt ein zentrales pathogenetisches Element dar. Dermale und epidermale dendritische Zellen exprimieren Mustererkennungsrezeptoren (PRR – Pattern Recognition Receptors), insbesondere die Toll-like-Rezeptoren TLR2 und TLR4, die Komponenten der fungalen Zellwand wie Mannane und Beta-Glucane erkennen. Diese Erkennung löst die Aktivierung des NF-κB-Signalwegs mit Produktion pro-inflammatorischer Zytokine IL-1β, IL-6, IL-8 und TNF-α durch Keratinozyten und residente Immunzellen aus. Bei sensibilisierten Französischen Bulldoggen induziert die wiederholte Exposition gegenüber Malassezia-Antigenen eine Th2-Polarisierung mit Produktion spezifischer IgE, die sich an FcεRI-Rezeptoren kutaner Mastzellen fixieren. Die erneute Antigen-Exposition löst dann eine rasche Mastzell-Degranulation mit Histamin-Freisetzung aus und verursacht Juckreiz und Erythem innerhalb von Minuten.
Klinische Symptomatologie der Malassezia-Dermatitis
Die klinischen Manifestationen der Malassezia-Dermatitis bei der Französischen Bulldogge zeigen eine charakteristische Symptomatologie. Das intensive Erythem, das bevorzugt intertriginöse Bereiche (Gesichtsfalten, Interdigitalräume, Achsel- und Leistenfalten) betrifft, geht mit starkem Juckreiz und einem besonderen ranzigen Geruch einher, der aus dem lipidischen Abbau durch fungale Lipasen resultiert. Die betroffene Haut zeigt ein glänzend-fettiges Aussehen mit manchmal feiner anhaftender Schuppung. Die post-inflammatorische Hyperpigmentierung tritt rasch in chronischen Bereichen auf und verleiht der ursprünglich erythematösen Haut ein bräunliches Aussehen. Die Interdigitalräume, besonders bei atopischen Tieren, werden zu einem Prädilektionsort mit intensivem Erythem, Exsudation und Bildung von Interdigitalzysten sekundär zu tiefer follikulärer Entzündung. Das zwanghafte Pfotenlecken stellt häufig das erste Warnzeichen dar, mit einer braunrötlichen Färbung weißer Haare durch Speichelporphyrine, was auf chronisches Lecken hinweist.
Zytologische Diagnose und pathologische Schwellenwerte
Die zytologische Diagnose der Malassezia-Dermatitis beruht auf dem Nachweis einer abnorm hohen Anzahl von Hefen bei der mikroskopischen Untersuchung. Mehrere Entnahmetechniken sind verwendbar: die direkte Appositionstechnik durch Druck eines Glasobjektträgers auf die erythematöse Haut, Abstrich gefolgt von Aufrollen auf Objektträger oder Scotch-Tape-Test, besonders geeignet für Interdigitalräume und Falten. Nach Schnellfärbung ermöglicht die mikroskopische Zählung bei 1000-facher Vergrößerung unter Immersion eine Semiquantifizierung. Der pathologische Schwellenwert bleibt umstritten, aber ein Konsens schlägt als signifikant das Vorhandensein von mehr als 10 Hefen pro mikroskopischem Feld im Durchschnitt über 10 Felder oder mehr als 3 bis 5 Hefen pro Feld in normalerweise an Malassezia armen Bereichen wie dem Rumpf vor. Bei der Französischen Bulldogge zeigen zytologische Zählungen in läsionalen Bereichen häufig 25 bis 50 Organismen pro Feld, was eine massive Proliferation bezeugt.
Problematik rezidivierender Pyodermitiden
Rezidivierende Pyodermitiden stellen eine wichtige therapeutische Problematik bei der Französischen Bulldogge dar, definiert durch das Auftreten von drei oder mehr Episoden bakterieller Pyodermitis über einen Zeitraum von 12 Monaten. Diese Rezidive resultieren selten aus einem Versagen der antibiotischen Behandlung der initialen Episode, sondern eher aus der Persistenz nicht kontrollierter zugrunde liegender prädisponierender Faktoren. Dokumentierte zugrunde liegende Ursachen bei der Französischen Bulldogge umfassen atopische Dermatitis in 68% der Fälle, Hypothyreose in 8%, Cushing-Syndrom in 3% und seltene Immundefekte. Die nicht kontrollierte Atopie schafft einen Teufelskreis, in dem chronische Entzündung, Barrierendysfunktion und Juckreiz mit Selbsttrauma die günstigen Bedingungen für bakterielle Infektion perpetuieren. Die Erkennung und Behandlung dieser zugrunde liegenden Ursache ist imperativ, um den rezidivierenden Infektionszyklus zu durchbrechen.
Tiefe bakterielle Follikulitis und Furunkulose
Die tiefe bakterielle Follikulitis, potenzielle Entwicklung einer unbehandelten oder rezidivierenden oberflächlichen Follikulitis, erreicht das untere Segment des Haarfollikels und kann sich als Furunkulose ins subkutane Gewebe ausbreiten. Diese schwere Infektion ist klinisch durch feste, schmerzhafte erythematöse Knoten charakterisiert, die zur Abszessbildung mit Bildung fistulärer Gänge, die hämorrhagisches oder eitriges Exsudat drainieren, evolvieren können. Körperbereiche mit tiefen Follikeln wie die Kinnregion (Kinn-Follikulitis oder canine Akne), Interdigitalräume und Druckpunkte sind bevorzugt betroffen. Die histopathologische Untersuchung zeigt eine Follikelwandruptur mit Freisetzung des follikulären Inhalts (Bakterien, Keratin, Sebum) in die umgebende Dermis und löst eine intensive pyogranulomatöse Reaktion um keratinöse Detritus aus. Das Vorhandensein von epitheloiden Makrophagen, multinukleären Riesenzellen und progressiver Fibrose charakterisiert diese chronische Entzündung.
Pododermatitis und Interdigitalzysten
Die Pododermatitis, Entzündung der Pfotenballen und Interdigitalräume, stellt eine besonders problematische Lokalisation bei der Französischen Bulldogge dar aufgrund der anatomischen Konformation der Gliedmaßen und des hohen Körpergewichts auf einer reduzierten Auflagefläche. Die Pododermatitis der Französischen Bulldogge zeigt oft eine multifaktorielle Ätiologie, die atopische Dermatitis, Malassezia-Dermatitis und sekundäre bakterielle Pyodermitis kombiniert. Die Interdigitalräume werden erythematös, ödematös und schmerzhaft mit Bildung hämorrhagischer Blasen und fistulärer Gänge in schweren Fällen. Das zwanghafte Lecken verschlechtert die Läsionen durch wiederholtes mechanisches Trauma und kontinuierliche Speichelinokulation. Interdigitalzysten, fluktuierende oder feste Knoten der Interdigitalräume, resultieren aus tiefer Follikulitis und Furunkulose mit Bildung enkystierter Abszesse. Die zytologische Untersuchung des Zysteninhalts zeigt typischerweise eine pyogranulomatöse Entzündung mit degenerierten Neutrophilen, aktivierten Makrophagen und keratinösem Material, mit oder ohne sichtbare Bakterien je nach Entwicklungsstadium.
Mukokutane Pyodermitis: Erosionen und Ulzerationen
Die mukokutane Pyodermitis, eine seltene, aber beim Deutschen Schäferhund dokumentierte und sporadisch bei anderen Rassen einschließlich der Französischen Bulldogge berichtete dermatologische Erkrankung, ist durch erosive und ulzerative Entzündung der mukokutanen Übergänge charakterisiert, besonders labial, nasal, perianal und genital. Diese Dermatose zeigt eine komplexe immunologische Pathophysiologie, die eine Hypersensitivitätsreaktion gegen staphylokokkale bakterielle Antigene mit einem funktionellen Defizit der T-Suppressor-Lymphozyten kombiniert. Die Läsionen beginnen mit Erythem und Ödem des mukokutanen Übergangs und evolvieren rasch zu Erosionen dann oberflächlichen schmerzhaften Ulzerationen mit Bildung hämorrhagischer Krusten. Die histopathologische Untersuchung zeigt eine lichenoide Interface-Dermatitis mit hydropischer Degeneration der Basalschicht, perivaskulärem lymphoplasmozyträrem Infiltrat und keratinozyträrer Apoptose. Die bakterielle Kultur isoliert regelmäßig Staphylococcus pseudintermedius, aber die Verbesserung unter Antibiotherapie bleibt partiell und transient und erfordert häufig die Hinzufügung von Immunmodulatoren.
Modul 6: Die Demodikose
Juvenile Demodikose
Eine parasitäre Dermatose, die nicht verschwunden ist
Die canine Demodikose resultiert aus der übermäßigen pathologischen Proliferation kommensaler Milben der Gattung Demodex, hauptsächlich Demodex canis und seltener Demodex injai, die normalerweise Haarfollikel und Talgdrüsen der caninen Haut in geringen Dichten besiedeln. Die Übertragung von Demodex canis erfolgt vertikal von der Hündin auf die neugeborenen Welpen durch direkten Kontakt während der ersten Laktationstage, wobei die Milben von den mütterlichen Zitzen zu den Haarfollikeln von Gesicht und Vordergliedmaßen der Neugeborenen migrieren. Bei der Mehrheit der Hunde bleiben die Milbenpopulationen während der gesamten Existenz in homöostatischem Gleichgewicht bei Dichten unterhalb der pathologischen Schwelle, unter Kontrolle gehalten durch lokale angeborene und adaptive Immunabwehr. Bei einer Minderheit von Individuen ermöglicht eine Ruptur dieses Gleichgewichts die übermäßige Milbenproliferation, die entzündliche Hautläsionen erzeugt. Diese homöostatische Ruptur erfolgt entweder durch primäre, genetisch determinierte Immundefekte bei der juvenilen Demodikose oder durch sekundäre erworbene Immunsuppression bei der adulten Demodikose.
Die britische epidemiologische VetCompass-Analyse, durchgeführt an 455.553 Hunden in der primären Veterinärversorgung während des Jahres 2013, zeigt eine jährliche Gesamtprävalenz von 0,17% mit 95%-Konfidenzintervall von 0,16 bis 0,19% für Demodikose in der allgemeinen Hundepopulation. Die Unterscheidung nach Alter zeigt eine dramatisch höhere Prävalenz bei Jungtieren mit 0,48% und Konfidenzintervall von 0,45 bis 0,52% für Hunde unter 2 Jahren, verglichen mit 0,05% und Konfidenzintervall von 0,04 bis 0,06% für Hunde über 4 Jahre, ein Verhältnis, das illustriert, dass juvenile Demodikose etwa zehnmal häufiger auftritt als die adulte Form. Von den 702 Fällen, für die das Alter bei Erstdiagnose verfügbar war, lag das mediane Alter bei 7 Monaten mit Interquartilbereich von 4 bis 13 Monaten, 72,4% der Fälle waren unter 1 Jahr alt, 79,6% unter 1,5 Jahren, 81,6% unter 2 Jahren und nur 14,0% über 4 Jahre. Diese Altersverteilung bestätigt das massive Überwiegen der juvenilen Präsentation der caninen Demodikose in der primären Veterinärpraxis.
Die Französische Bulldogge zeigt eine signifikante rassische Anfälligkeit für juvenile Demodikose mit einer adjustierten Odds Ratio von 5,07 und Konfidenzintervall von 3,37 bis 7,63 verglichen mit Mischlingen im multivariaten Modell einschließlich Rasse, Gewicht relativ zum rassischen Durchschnitt, Alter und Geschlecht-Kastrationsstatus mit Tierklinik als Zufallseffekt. Diese Prädisposition platziert die Französische Bulldogge auf dem sechsten Rang der Hochrisiko-Rassen nach der Englischen Bulldogge mit Odds Ratio von 11,26, dem Staffordshire Bull Terrier mit Odds Ratio von 7,11, dem Chinesischen Shar-Pei mit Odds Ratio von 6,57, der Bordeaux-Dogge mit Odds Ratio von 5,92 und dem Mops mit Odds Ratio von 5,41. Die jährliche Rohprävalenz der Demodikose bei Französischen Bulldoggen unter 2 Jahren erreicht 1,88% mit Konfidenzintervall von 1,30 bis 2,73%, viermal die bei Mischlingen beobachtete Prävalenz von 0,37% und zwei- bis dreimal höher als die des Boxers. Bemerkenswert ist, dass kein Fall von Demodikose bei Französischen Bulldoggen über 4 Jahren in dieser Kohorte identifiziert wurde, was entweder nahelegt, dass Individuen mit genetischer Anfälligkeit ihre Krankheit früh manifestieren oder dass von juveniler Demodikose betroffene Französische Bulldoggen mehrheitlich geheilt werden und keine rezidivierende Form im Erwachsenenalter entwickeln.
Die gemeinsame Zugehörigkeit der Englischen Bulldogge, Französischen Bulldogge, des Staffordshire Bull Terriers, der Bordeaux-Dogge und des Boxers zum selben genetischen Clade, identifiziert durch pangenom-phylogenetische Analysen, legt stark eine geteilte genetische Basis für die Anfälligkeit für juvenile Demodikose nahe. Dieses Clade, das Rassen vom Bulldoggen- und Bull-Terrier-Typ gruppiert, teilt gemeinsame ancestrale genetische Varianten, die aus historischen populationellen Engpässen und intensiver Selektion auf gemeinsame morphologische Charakteristika einschließlich Brachyzephalie, gedrungener Körper und Temperament resultieren. Die konvergente Beobachtung unabhängiger amerikanischer und britischer epidemiologischer Studien, die dieselben Rassen dieses genetischen Clades unter den am meisten prädisponierten identifizieren, verstärkt die Hypothese eines substantiellen genetischen Determinismus für juvenile Demodikose. Die genaue Natur der kausalen Varianten, ihr Übertragungsmodus und ihre Penetranz bleiben jedoch ungeklärt. Der aktuelle Konsens postuliert einen komplexen polygenen Erbgang, der multiple Loci mit moderatem Effekt involviert, eher als eine Mendelsche monogene Mutation, kohärent mit der phänotypischen Variabilität, die innerhalb betroffener Würfe beobachtet wird.
Eine immunologische Dysfunktion vor allem
Die Pathophysiologie der juvenilen Demodikose beinhaltet eine spezifische Immundefekte gegen Demodex-Milben, wobei betroffene Hunde normale Immunantworten gegenüber anderen Pathogenen manifestieren. Immunologische Untersuchungen haben quantitative und qualitative Störungen der T-Lymphozyten-Subpopulationen bei demodikotischen Hunden gezeigt. Eine funktionelle Studie zeigte, dass T-Lymphozyten demodikotischer Hunde eine reduzierte blastische Proliferation als Antwort auf Stimulation durch Phytohämagglutinin und Concanavalin A verglichen mit gesunden Kontrollen zeigten, was ein T-Lymphozyten-Reaktivitätsdefizit nahelegt. Die Verhältnisse der CD4-positiven und CD8-positiven Lymphozyten-Subpopulationen erwiesen sich als verändert mit einem reduzierten Anteil von CD4-positiven T-Helfer-Lymphozyten. Die Zytokinproduktion durch stimulierte Lymphozyten manifestierte ein Ungleichgewicht zu einer Th2-Polarisierung mit erhöhter Sekretion von immunsuppressiven Interleukin-4 und Interleukin-10 auf Kosten von pro-inflammatorischem Interferon-gamma und Interleukin-2 vom Th1-Typ, eine ungeeignete Polarisierung für die Kontrolle einer intrafollikulären Parasitenbefall, die eine robuste zytotoxische Zellantwort erfordert.
Eine sehr pleomorphe Dermatose
Die klinische Präsentation der caninen Demodikose erfolgt nach zwei komplementären Klassifikationen. Die Altersklassifikation unterscheidet die juvenile Form, die typischerweise zwischen 3 und 18 Monaten beginnt, von der adulten Form, die nach dem Alter auftritt. Die Klassifikation nach Läsionsausdehnung differenziert die lokalisierte Form, charakterisiert durch weniger als fünf fokale Läsionen mit einem Durchmesser unter 2,5 Zentimetern und günstige Prognose für spontane Auflösung in 90% der Fälle ohne akarizide Behandlung, von der generalisierten Form, definiert durch mehr als fünf Läsionen, Befall von mehr als zwei anatomischen Regionen, Pododemodikose, die mindestens zwei Pfoten betrifft, oder extensive Läsionen, die eine Gesamtkörperoberfläche größer als die einer Gliedmaße bedecken. Die generalisierte Demodikose erfordert ausnahmslos eine systemische akarizide Behandlung und hat eine zurückhaltende Prognose. Primäre Hautläsionen bestehen aus multifokalen bis koaleszierenden nicht-inflammatorischen Alopezien, die initial in periokulären Regionen, Lippenwinkeln, inneren Ohrläppchen und Gliedmaßen dominieren, anatomischen Bereichen, wo die initiale Milbenbesiedlung der neugeborenen Welpen maximal ist.
In komplizierten Formen, häufig bei der Französischen Bulldogge aufgrund der gewöhnlichen Koexistenz mit atopischer Dermatitis und Hautfalten, bricht massiver demodikotischer Befall die follikuläre Hautbarriere und begünstigt schwere sekundäre bakterielle Infektionen. Bakterielle Follikulitis dann Furunkulose durch Staphylococcus pseudintermedius erzeugt Pusteln, erythematöse Papeln, Krusten, seropurulente Exsudation und intensive lokale Schmerzen. Tiefe Formen evolvieren zu dermaler und hypodermaler Zellulitis mit massivem Ödem, Fistelbildung, purulenter Drainage und Satelliten-Adenomegalie. Interdigitale demodikotische Pododermatitiden, besonders häufig und refraktär, kombinieren violettes Erythem, Schwellung der Interdigitalräume, drainierende Fisteln, palmo-plantare Hyperkeratose und Lahmheit durch Druckschmerz. Chronizität induziert Hyperpigmentierung, Lichenifikation, dermale Fibrose und irreversible cicatrizielle Alopezie in vernachlässigten Fällen.
Eine schnelle und einfache Diagnose
Die Diagnose der Demodikose beruht auf der mikroskopischen Identifikation einer abnormen Anzahl von Demodex-Milben in tiefen Hautschabungen. Die standardisierte Technik erfordert kräftige Kompression einer Hautfalte zwischen Daumen und Zeigefinger für 10 bis 15 Sekunden, um Milben aus der Tiefe der Haarfollikel zu exprimieren, gefolgt von unmittelbarem senkrechtem Schaben in Haarwuchsrichtung mit einer zuvor mit Mineralöl bestrichenen Skalpellklinge, fortgesetzt bis zu kapillarem Blutetropfen, Garant für ausreichende Schabungstiefe, die die dermo-epidermale Übergangszone erreicht. Das geschabte Material wird auf einen Objektträger übertragen, mit einem Deckglas bedeckt und unter dem Mikroskop bei 40-facher und 100-facher Vergrößerung untersucht, um adulte fusiforme Milben, Nymphen, hexapode Larven und charakteristische operkulierte Eier zu zählen. Minimum fünf Schabungen von verschiedenen läsionalen Stellen sollten durchgeführt werden, um die diagnostische Sensitivität zu maximieren. Das Trichogramm, bestehend aus dem Ausreißen multipler Haare mit einer Pinzette gefolgt von ihrer mikroskopischen Untersuchung nach Einbettung zwischen Objektträger und Deckglas in Öl, stellt eine weniger invasive Alternative dar, besonders nützlich für periokuläre und interdigitale Lokalisationen, die schwer zu schaben sind.
Die Revolution der Isoxazoline
Die therapeutischen Protokolle der caninen Demodikose wurden durch das Aufkommen oraler Isoxazoline revolutioniert, einer pharmakologischen Klasse von Ektoparasitiziden, die GABA- und Glutamat-abhängige Chlorkanäle der Wirbellosen modulieren und Paralyse und Tod der Arthropodenparasiten induzieren.
Die adulte Demodikose, selten aber nicht zu vernachlässigen
Die Behandlung der adulten Demodikose erfordert imperativ die Identifikation und Behandlung der zugrunde liegenden Immunsuppressionsursachen. Endokrine Erkrankungen einschließlich Hypothyreose, spontaner oder iatrogener Hyperkortizismus und Diabetes mellitus sollten systematisch durch geeignete hormonelle Messungen gescreent werden. Neoplasien, besonders Lymphom und Mastocytom, und systemische Autoimmunerkrankungen stellen andere Immunsuppressionsursachen dar, die adulte Demodikose begünstigen. Immunsuppressive Behandlungen einschließlich systemischer Glukokortikoide, Ciclosporin und Chemotherapeutika müssen wenn möglich unterbrochen werden.
Modul 7: Multimodale diagnostische Herangehensweise
Klinische Methodik und DAMN-IT-System
Die dermatologische Diagnose bei der Französischen Bulldogge erfordert eine methodische Herangehensweise, die detaillierte Anamnese, rigorose klinische Untersuchung und gezielte komplementäre Untersuchungen integriert. Die Komplexität des dermatologischen Bildes dieser Rasse, die häufig mehrere überlagerte Pathologien kombiniert (primäre Atopie, Malassezia-Dermatitis, sekundäre Pyodermitis, Intertrigo), erfordert vom Praktiker die Fähigkeit zur sequenziellen Analyse, um die primäre initiale Affektion und ihre sekundären Komplikationen zu identifizieren. Die strukturierte diagnostische Herangehensweise nach der DAMN-IT-Methode (Developmental, Allergic, Metabolic, Neoplastic, Inflammatory, Traumatic, Infectious, Immunologic) ermöglicht es, eine erschöpfende Differentialliste zu erstellen, bevor sie progressiv durch Elimination oder diagnostische Bestätigung eingeschränkt wird.
Die Anamnese: Grundpfeiler des diagnostischen Denkens
Die Anamnese bildet den Grundstein des diagnostischen Denkens in der Dermatologie. Die minutiöse Befragung des Besitzers muss mehrere zeitliche und kontextuelle Parameter dokumentieren. Das Erkrankungsalter der ersten klinischen Zeichen orientiert signifikant die Differentialdiagnose: ein früher Beginn vor 6 Monaten legt eine kongenitale oder hereditäre Dermatose nahe, während ein Beginn zwischen 6 Monaten und 3 Jahren stark eine atopische Dermatitis evoziert. Die Saisonalität der Symptome differenziert eine saisonale pollenbezogene Atopie von einer perennialen, durch Hausstaubmilben oder Nahrungsmittelallergene induzierten Atopie. Der pruriginöse Charakter der Affektion, bewertet durch standardisierten Fragebogen oder visuelle Analogskala, stellt ein wichtiges diagnostisches Kriterium dar: ein Juckreiz sine materia (Juckreiz ohne sichtbare primäre Läsion) orientiert zu einer allergischen Hypersensitivität, während primäre Läsionen ohne Juckreiz eine metabolische oder neoplastische Dermatose nahelegen. Das Lebensumfeld (städtisch/ländlich), die Unterbringungsart (innen/außen), Exposition gegenüber anderen Tieren und Reiseanamnese dokumentieren das Expositionsrisiko für Ektoparasiten oder infektiöse Agenten.
Systematische klinische Untersuchung und Otoskopie
Die dermatologische klinische Untersuchung der Französischen Bulldogge folgt einer systematischen Methodik, beginnend mit der Fernbeobachtung des Allgemeinzustands, Verhaltens und Juckreizzeichen (Lecken, Knabbern, Reiben). Die Nahuntersuchung bewertet die Läsionsverteilung nach einem standardisierten anatomischen Schema und unterscheidet primäre Läsionen (Maculae, Papeln, Pusteln, Vesikel, Knoten) von sekundären Läsionen (Erosionen, Ulzera, Krusten, Schuppen, Hyperpigmentierung, Lichenifikation). Die Palpation schätzt Hautverdickung, subkutanes Ödem und Druckschmerzhaftigkeit betroffener Bereiche ein. Die Untersuchung der sichtbaren Schleimhäute (konjunktival, oral, genital) sucht nach einer Ausweitung der Läsionen auf mukokutane Übergänge. Die bilaterale otoskopische Inspektion bewertet den Zustand des äußeren Gehörgangs und Trommelfells, wobei externe Otitis bei 75 bis 80% der atopischen Französischen Bulldoggen vorhanden ist. Die Palpation der regionären Lymphknoten (submandibulär, präskapulär, popliteal) erkennt reaktionäre Lymphadenomegalie, die Hautentzündung oder -infektion des drainierten Territoriums anzeigt.
Kutane Zytologie: zelluläre und mikrobielle Identifikation
Die kutane zytologische Untersuchung stellt die komplementäre Untersuchung erster Wahl in der Veterinärdermatologie dar, durchführbar in der Konsultation ohne sophistizierte Ausrüstung. Mehrere Entnahmetechniken finden je nach Läsionstyp Anwendung. Die direkte Appositionstechnik auf Glasobjektträger wird für erythematöse oder exsudative Oberflächen verwendet. Der Scotch-Tape-Test, besonders geeignet für Interdigitalräume und Falten, besteht darin, ein Stück transparenten Klebestreifen auf den zu untersuchenden Bereich zu legen und dann auf einen Objektträger zu kleben. Abstrich gefolgt von Aufrollen auf Objektträger ermöglicht die Erkundung von Gehörgängen oder tiefen Läsionen. Die Feinnadelaspiration (Zytoponktion) von Knoten oder Zysten entnimmt zelluläre Inhalte zur Analyse. Nach Lufttrocknung werden die Objektträger einer Schnellfärbung vom Typ Diff-Quik (Äquivalent zu May-Grünwald-Giemsa) unterzogen, die zelluläre Differenzierung ermöglicht. Die mikroskopische Untersuchung bei 400-facher dann 1000-facher Vergrößerung unter Immersion charakterisiert die inflammatorische Zellpopulation (Neutrophile, Eosinophile, Makrophagen, Lymphozyten), identifiziert Mikroorganismen (bakterielle Kokken oder Bazillen, Malassezia-Hefen, seltene Dermatophyten) und erkennt atypische Zellen, die eine Neoplasie nahelegen.
Hautschabung und parasitologische Diagnose
Die Hautschabung, eine essentielle parasitologische Untersuchung, sucht nach Milben, die für Räuden verantwortlich sind. Zwei Typen von Schabungen werden je nach gesuchter Tiefe durchgeführt. Die oberflächliche Schabung, durchgeführt bis zum Auftreten eines leichten Erythems, erkennt Sarcoptes scabiei, die für sarkoptische Räude verantwortliche Milbe, charakterisiert durch intensiven, hartnäckigen Juckreiz. Die tiefe Schabung, fortgesetzt bis zu kapillarem Blutetropfen, weist Demodex canis nach, eine follikuläre kommensale Milbe, die bei Demodikose proliferieren kann. Obwohl die Französische Bulldogge nicht zu den Rassen mit hohem Risiko für generalisierte Demodikose gehört (im Gegensatz zu Shar-Pei oder Bull Terrier), treten gelegentlich Fälle von lokalisierter periokulärer oder Lippendemodikose auf. Das Schabematerial, übertragen auf Objektträger mit einem Tropfen Mineralöl oder Lactophenol, wird unter dem Mikroskop bei 100-facher dann 400-facher Vergrößerung untersucht. Die Identifikation von Adulten, Larven, Nymphen oder Milbeneiern bestätigt die parasitologische Diagnose.
Trichoskopie: Analyse des Haarschafts und Zyklus
Die Trichoskopie oder mikroskopische Haaruntersuchung ergänzt das diagnostische Arsenal für Alopezien. Eine Haarprobe durch sanftes Ausreißen mit hämostatischer Pinzette in alopezischen Bereichen ermöglicht die Analyse des Haarschafts und der Zwiebel. Die mikroskopische Untersuchung bei geringer dann hoher Vergrößerung bewertet die Phase des Haarzyklus (Anagen mit pigmentierter Zwiebel und Epithelscheide, Telogen mit keulenförmiger Zwiebel ohne Scheide), sucht nach strukturellen Anomalien des Schafts (Trichorrhexis nodosa, Trichomalacia) und identifiziert Pilzsporen bei Dermatophytose. Bei der Französischen Bulldogge resultiert Alopezie meist aus juckrebedingtem mechanischem Ausreißen der Haare (traumatische Alopezie), und die Trichoskopie zeigt dann frakturierte Haarschäfte mit unregelmäßigen Enden ohne Zwiebelanomalie, kontrastierend mit endokrinen Alopezien, wo Haare leicht epilierbar sind mit Telogen-Zwiebeln.
Allergologische Tests: IDT und serologische IgE-Messungen
Allergologische Tests sind bei der Französischen Bulldogge nach Bestätigung der atopischen Dermatitis-Diagnose nach Favrot-Kriterien indiziert, um beteiligte Allergene zu identifizieren und eine spezifische Immuntherapie zu erwägen. Zwei komplementäre Ansätze koexistieren: Intradermaltests (IDT) und serologische Messungen spezifischer IgE. Der Intradermaltest stellt den Gold Standard dar und injiziert intradermal am geschorenen Thorax eine Batterie standardisierter Allergene (Milben, Pollen, Schimmelpilze, Epithelien), verdünnt in physiologischer Lösung. Die Ablesung nach 15 bis 20 Minuten quantifiziert die papulöse und erythematöse Reaktion verglichen mit positiven (Histamin) und negativen (physiologische Lösung) Kontrollen. Ein positives Ergebnis definiert sich durch eine Papel mit Durchmesser größer als 50% der Histamin-Reaktion. Serologische allergenspezifische IgE-Messungen mittels ELISA- oder Immunoblot-Technik stellen eine weniger invasive Alternative dar, obwohl ihre Sensitivität und Spezifität den IDT unterlegen bleiben. Eine unvollständige Übereinstimmung existiert zwischen diesen beiden Methoden mit Übereinstimmung in nur 60 bis 70% der Fälle, was die klinische Interpretation der Ergebnisse rechtfertigt statt ihrer mechanischen Anwendung.
Eliminationsdiät und Nahrungsmittelprovokationstest
Die Eliminationsdiät stellt den einzigen zuverlässigen diagnostischen Test dar, um eine zum klinischen Bild beitragende Nahrungsmittelhypersensitivität zu bestätigen oder auszuschließen. Diese Diät besteht darin, den Hund 8 bis 12 Wochen lang ausschließlich mit einer Protein- und Kohlenhydratquelle zu füttern, denen das Tier nie zuvor ausgesetzt war (Diät mit neuen Proteinen) oder mit einem hydrolysierten Futter, dessen zu niedermolekularen Peptiden (< 10 kDa) fragmentierte Proteine ihre Allergenität verlieren. Die strikte Compliance stellt den hauptsächlichen limitierenden Faktor dieses Tests dar, jede alimentäre Übertretung (Leckerli, Tischreste, aromatisierte Medikamente) macht das Ergebnis ungültig. Eine klinische Verbesserung von über 50% des Juckreizes und der Hautläsionen unter Diät evoziert stark eine Nahrungsmittelkomponente. Die diagnostische Bestätigung erfordert einen Provokationstest durch Wiedereinführung der früheren Ernährung, der eine Rückfall binnen 7 bis 14 Tagen auslösen sollte. Wenn der Rückfall eintritt, ermöglicht die progressive Wiedereinführung individueller Inhaltsstoffe die Identifikation des oder der spezifischen verantwortlichen Allergene.
Histopathologische Untersuchung und Hautbiopsien
Die kutane histopathologische Untersuchung, obwohl nicht spezifisch für atopische Dermatitis, ist bei atypischer klinischer Präsentation, unzureichender therapeutischer Antwort oder Verdacht auf neoplastischen oder autoimmunen Prozess indiziert. Hautbiopsien mit 6 bis 8 Millimeter Punch erfolgen unter lokaler oder Vollnarkose und entnehmen repräsentative primäre Läsionen unter Vermeidung von Bereichen extremer Chronizität oder Superinfektion. Die Entnahme von Läsionen verschiedener Entwicklungsstadien und Einschluss einer gesunden peripheren Hautprobe optimieren die diagnostische Information. Die in 10% gepuffertem Formalin fixierten Proben werden einer Standard-Histotechnik mit Paraffin-Einbettung, Schnitt und Hämatoxylin-Eosin-Färbung unterzogen. Die mikroskopische Analyse durch einen Veterinärdermatopathologen charakterisiert die läsionale Architektur, Typ und Verteilung des inflammatorischen Infiltrats und sucht nach ätiologischen Hinweisen. Die atopische Dermatitis zeigt typischerweise eine oberflächliche perivaskuläre Dermatitis mit lymphohistiozytärem und eosinophilem Infiltrat, epidermaler Hyperplasie (Akanthose), orthokeratotischer Hyperkeratose und variabler Spongiose je nach läsionaler Akuität.
Modul 8: Integrierte therapeutische Strategien und Perspektiven
Ziele einer multimodalen Behandlung
Die therapeutische Behandlung der atopischen Dermatitis und assoziierter dermatologischer Komplikationen bei der Französischen Bulldogge erfordert eine multimodale und individualisierte Herangehensweise, die Kontrolle sekundärer Infektionen, anti-inflammatorische und anti-pruriginöse Behandlung, Wiederherstellung der Hautbarriere und Management von Umweltfaktoren kombiniert. Das realistische therapeutische Ziel strebt nicht die definitive Heilung dieser chronischen Dermatose an, sondern die zufriedenstellende Kontrolle der Symptome, die eine akzeptable Lebensqualität für das Tier und seinen Besitzer ermöglicht, mit Minimierung der Nebenwirkungen und wirtschaftlichen Kosten auf lange Sicht. Die therapeutische Strategie entwickelt sich entsprechend der initialen Schwere, Antwort auf Behandlungen und Vorhandensein von Komorbiditäten und erfordert regelmäßige Neubewertungen und posologische oder molekulare Anpassungen.
Behandlung sekundärer Infektionen und Antibiotherapie
Die Behandlung sekundärer Infektionen bildet imperativ den ersten therapeutischen Schritt vor Bewertung der Antwort auf Antiphlogistika. Oberflächliche Pyodermitiden durch Methicillin-sensible Staphylococcus pseudintermedius sprechen generell auf eine systemische Antibiotherapie mit Cephalosporinen erster Generation (Cephalexin 15 bis 25 mg/kg per os zweimal täglich) oder Amoxicillin-Clavulansäure (12,5 bis 25 mg/kg per os zweimal täglich) für mindestens 21 bis 28 Tage, das heißt eine Woche über die vollständige klinische Auflösung hinaus, an. Tiefe Pyodermitiden oder MRSP-Stämme erfordern prolongierte Antibiotherapien von 6 bis 8 Wochen mit breitspektrigen Molekülen: Fluorchinolone (Enrofloxacin 5 bis 10 mg/kg einmal täglich, Marbofloxacin 2,75 bis 5,5 mg/kg einmal täglich) nach Durchführung einer bakteriellen Kultur mit Antibiogramm. Die zunehmende Resistenz erfordert einen vernünftigen Antibiotika-Einsatz nach Empfehlungen für umsichtige Antibiotherapie, wobei topische Behandlungen wenn möglich bevorzugt werden.
Verwendung topischer Antiseptika und Chlorhexidin
Topische Antiseptika stellen eine wertvolle Alternative oder Ergänzung zur systemischen Antibiotherapie dar, besonders für lokalisierte oder rezidivierende Infektionen. Chlorhexidin, ein kationisches Biguanid mit breitem bakterizidem und fungizidem Spektrum, wird als Shampoo mit 2 bis 4%iger Konzentration mit 10-minütiger Kontaktzeit vor Spülung verwendet, zwei- bis dreimal wöchentlich. Sein Wirkungsmechanismus beruht auf der Membrandisorganisation von Bakterien durch Bindung an anionische Phospholipide. Kontrollierte klinische Studien zeigen eine Wirksamkeit von 3%igem Chlorhexidin vergleichbar mit systemischen Antibiotika für oberflächliche lokalisierte Pyodermitiden mit dem Vorteil, systemische Resistenzselektion zu vermeiden. Formulierungen, die Chlorhexidin und Miconazol (Azol-Antimykotikum) kombinieren, behandeln gleichzeitig bakterielle und Malassezia-Infektionen, die bei der Französischen Bulldogge häufig verwoben sind. Mit Chlorhexidin imprägnierte Tücher erleichtern die tägliche Antisepsis der Gesichtsfalten und beugen Intertrigo vor.
Janus-Kinase-Inhibitoren
Janus-Kinase-Inhibitoren (JAK-Inhibitoren) stellen einen wichtigen therapeutischen Fortschritt in der Veterinärdermatologie seit der Marktzulassung von Oclacitinib im Jahr 2013 für die symptomatische Behandlung des caninen atopischen Juckreizes dar. Oclacitinib, ein oral verabreichtes synthetisches kleines Molekül, hemmt selektiv die Tyrosinkinasen JAK1 und JAK3 (und in geringerem Maße JAK2) und blockiert so die Signaltransduktion multipler pruraritogener und pro-inflammatorischer Zytokine einschließlich IL-31, IL-4, IL-13 und IL-2. Kürzlich wurden neue Janus-Kinase-Inhibitoren vermarktet, nämlich Ilunocitinib (Zenrelia) und Atinvicitinib (Numelvi), die jeweils verschiedene Vor- und Nachteile aufweisen.
Lokivetmab: monoklonaler Anti-IL-31-Antikörper
Lokivetmab, ein caninisierter monoklonaler Antikörper, der spezifisch gegen Interleukin-31 gerichtet ist, stellt eine Biotherapie-Alternative zu Oclacitinib dar. Dieser durch rekombinante Technologie produzierte therapeutische Antikörper neutralisiert zirkulierendes IL-31 durch hochaffine Bindung und verhindert seine Interaktion mit dem IL-31RA/OSMR-Rezeptorkomplex. Die Verabreichung erfolgt subkutan in einer Dosierung von 1 bis 2 mg/kg mit einer verlängerten Wirkdauer von 4 bis 8 Wochen, die monatliche Injektionen ermöglicht. Pivotal-Phase-III-Studien zeigen eine Juckreizreduktion von mehr als 50% bei 79% der behandelten Hunde nach der ersten Injektion mit einer medianen Wirkungszeit von 1,2 Tagen. Der Hauptvorteil von Lokivetmab liegt in seiner extremen immunologischen Spezifität, die ausschließlich IL-31 anvisiert, ohne mit anderen Signalwegen zu interferieren und dadurch systemische Nebenwirkungen minimiert. Seine proteinische Natur als canines Immunglobulin begrenzt das Immunogenitätsrisiko mit Bildung von Anti-Medikament-Antikörpern im Gegensatz zu nicht-caninisierten rekombinanten Proteinen.
Ciclosporin und Calcineurin-Hemmung
Ciclosporin, ein Calcineurin-hemmender Immunmodulator, stellt historisch die erste validierte systemische Behandlung für canine atopische Dermatitis mit Marktzulassung seit 2003 dar. Dieses zyklische lipophile Molekül, abgeleitet vom Pilz Tolypocladium inflatum, hemmt die T-Lymphozyten-Aktivierung durch Blockierung der Phosphatase Calcineurin und verhindert die Dephosphorylierung des Transkriptionsfaktors NFAT (Nuclear Factor of Activated T-cells) und seine nukleare Translokation. Die transkriptionelle Kaskade der pro-inflammatorischen Zytokine IL-2, IL-4, IL-5, IL-13 und TNF-α wird so blockiert. Die initiale Dosierung von 5 mg/kg per os einmal täglich, nüchtern verabreicht zur Absorptionsoptimierung, wird 4 bis 6 Wochen bis zum Erreichen einer zufriedenstellenden klinischen Antwort fortgesetzt, dann progressiv auf die minimal effektive Dosis reduziert, oft 2,5 bis 5 mg/kg alle 2 bis 3 Tage in der Erhaltung. Gastrointestinale Nebenwirkungen (Erbrechen, Durchfall, Anorexie) treten bei 20 bis 30% der Hunde auf, hauptsächlich während der ersten Wochen, und mildern sich generell spontan oder durch Verabreichung mit einer leichten Mahlzeit trotz reduzierter Absorption.
Platz der Glukokortikoide in akuten Schüben
Systemische Glukokortikoide, potente schnellwirkende Antiphlogistika, behalten trotz ihrer langfristigen Nebenwirkungen einen Platz in der Notfallbehandlung schwerer akuter Schübe. Prednisolon oder Prednison wird in anti-inflammatorischer Dosis von 0,5 bis 1 mg/kg per os ein- bis zweimal täglich bis zur Juckreiz- und Entzündungskontrolle (generell 7 bis 14 Tage) verabreicht, gefolgt von einer progressiven Reduktion über 2 bis 3 Wochen dann vollständigem Absetzen oder Übergang zu einer alternativen Behandlung. Die chronische tägliche Verwendung von Kortikoiden führt unvermeidlich zu einem iatrogenen Cushing-Syndrom mit Polyurie-Polydipsie, Polyphagie, Muskelatrophie, Hepatomegalie und Immunsuppression, die opportunistische Infektionen begünstigt. Ein alterndes Schema mit Verabreichung jeden zweiten Tag begrenzt teilweise die Suppression der Hypothalamus-Hypophysen-Nebennieren-Achse. Injizierbare Langzeit-Kortikoide (Methylprednisolon-Acetat) sind in der Dermatologie formal kontraindiziert aufgrund der Unmöglichkeit posologischer Anpassung und des erhöhten Risikos schwerer Nebenwirkungen.
Rolle von Emollientien und barriererestrukturierenden Topika
Topische Emollientien und Barriere-Restrukturierer spielen eine oft unterschätzte wesentliche adjuvante therapeutische Rolle. Formulierungen, angereichert mit physiologischen Ceramiden, Cholesterin und essentiellen Fettsäuren in einem äquimolaren Verhältnis, das die Lipidzusammensetzung des Stratum corneum nachahmt, stellen teilweise die defiziente Barrierefunktion wieder her. Eine prospektive randomisierte kontrollierte klinische Studie zur Bewertung eines restrukturierenden Sprays mit einem Komplex aus Ceramiden, Fettsäuren und Phytosphingosin bei 60 atopischen Hunden zeigt eine signifikante CADESI-Score-Reduktion von 42% nach 8-wöchiger zweimal täglicher Anwendung, verbunden mit einer 38%igen Abnahme des unmerklichen transepidermalen Wasserverlusts. Therapeutische Shampoos auf Basis von kolloidalem Hafer, Omega-6-Fettsäuren und Glycerin üben eine sofortige antipruriginöse und hydratisierende Wirkung aus mit optimalem Nutzen bei zweiwöchentlicher Verwendung mit 10-minütiger Kontaktzeit. Seifenfreie Formulierungen (Syndets oder Synthetic Detergents) mit physiologisch saurem pH bewahren den kutanen Lipidfilm im Gegensatz zu konventionellen alkalischen Shampoos.
Spezifische allergene Immuntherapie (Desensibilisierung)
Die allergenspezifische Immuntherapie (Desensibilisierung oder Hyposensibilisierung) stellt die einzige potentiell krankheitsmodifizierende Behandlung der atopischen Erkrankung dar, die darauf abzielt, eine immunologische Toleranz gegenüber identifizierten Allergenen zu induzieren, anstatt einfach Symptome zu unterdrücken. Das klassische subkutane Protokoll beginnt mit einer Induktionsphase mit wöchentlichen Injektionen von Allergenextrakten in steigenden Konzentrationen über 16 bis 20 Wochen, gefolgt von einer Erhaltungsphase mit monatlichen Injektionen, die minimum 12 Monate, ideal 2 bis 3 Jahre fortgesetzt werden. Die beteiligten immunologischen Mechanismen umfassen die Deviation der Th2-Antwort zu Th1, Induktion regulatorischer T-Lymphozyten, die immunsuppressive IL-10 und TGF-β produzieren, und den Isotyp-Switch von IgE-Produktion zu blockierenden IgG4. Die in der veterinären Literatur berichteten Erfolgsraten variieren beträchtlich je nach Studien, mit exzellenter bis guter Verbesserung bei 60 bis 75% der Hunde, moderater Verbesserung bei 15 bis 20% und Versagen bei 10 bis 15%. Die optimale Antwort erfordert oft 9 bis 12 Monate Behandlung vor definitiver Bewertung. Regionale intradermale Protokolle und sublinguale Formulierungen entstehen als potentiell sicherere und besser tolerierte Alternativen.
Auswirkungen polyungesättigter Fettsäuren (Omega-3 und 6)
Langkettige polyungesättigte Omega-3- und Omega-6-Fettsäuren üben durch mehrere Mechanismen anti-inflammatorische und barriererestrukturierende Wirkungen aus. Eicosapentaensäure (EPA, C20:5 ω-3) und Docosahexaensäure (DHA, C22:6 ω-3), enthalten in Fischölen, werden in die Membranphospholipide von Entzündungszellen eingebaut und ersetzen teilweise Arachidonsäure (C20:4 ω-6). Bei Zellaktivierung setzt Phospholipase A2 diese Fettsäuren frei, die von Cyclooxygenasen und Lipoxygenasen zu Mediatoren der Serie 3 und 5 (Prostaglandine PGE3, Leukotriene LTB5) metabolisiert werden, die weniger pro-inflammatorisch sind als ihre Homologe der Serie 2 und 4, die von Arachidonsäure abgeleitet sind. Die Hochdosis-Supplementierung (75 bis 150 mg/kg EPA+DHA pro Tag) für minimum 8 bis 12 Wochen übt eine moderate Wirkung auf atopischen Juckreiz aus mit einer durchschnittlichen Reduktion von 20 bis 30% in kontrollierten Studien, was ihre Verwendung als therapeutisches Adjuvans rechtfertigt, aber nicht als Monotherapie.
Zukünftige therapeutische Perspektiven und Gentherapie
Die zukünftigen therapeutischen Perspektiven in der caninen atopischen Dermatologie orientieren sich zu immer spezifischeren molekularen Zielen. Dupilumab, ein humaner monoklonaler Antikörper, der die Alpha-Untereinheit des IL-4-Rezeptors anvisiert und so die Signalgebung von IL-4 und IL-13 blockiert, revolutioniert derzeit die Behandlung schwerer humaner atopischer Dermatitis mit Ansprechraten über 70%. Die Entwicklung eines caninisierten caninen Äquivalents stellt einen vielversprechenden Weg dar. Topische JAK-Inhibitoren (Ruxolitinib, Tofacitinib in dermischen Formulierungen) würden eine gezielte Blockierung der kutanen pro-inflammatorischen Signalgebung ohne systemische Immunsuppression ermöglichen. Probiotika und Präbiotika, die darauf abzielen, das kutane und intestinale Mikrobiom zu modulieren, sind Gegenstand intensiver Forschung, wobei bestimmte Lactobacillus-Stämme in vitro immunmodulatorische Eigenschaften mit Induktion regulatorischer T-Lymphozyten zeigen. Gentherapie durch Transfer des funktionellen FLG-Gens in Keratinozyten bleibt experimentell, könnte aber theoretisch das primäre Filaggrin-Defizit korrigieren. Therapeutische Vakzine auf Basis immunmodulatorischer Peptide, die vom Allergen abgeleitet sind, aber IgE-reaktive Epitope entbehren, könnten Toleranz ohne anaphylaktisches Risiko induzieren.
Schlussfolgerung
Die Französische Bulldogge zeigt eine außergewöhnliche dermatologische Vulnerabilität, die aus einer einzigartigen Konvergenz anatomischer, genetischer und immunologischer Faktoren resultiert. Die extreme brachyzephale Konformation erzeugt pathologische Hautfalten, die zu Intertrigo und mikrobiellen Superinfektionen prädisponieren. Dokumentierte genetische Anomalien, die das PROM1-Gen und die Expression epidermaler Barriereproteine betreffen, kompromittieren die Stratum-corneum-Kohäsion und erhöhen die transkutane Permeabilität für Allergene. Die primäre Barrierendysfunktion ist durch Filaggrin-Mangel, Ceramidverarmung und Tight-Junction-Veränderung charakterisiert, was das pathophysiologische Substrat der atopischen Dermatitis schafft, deren Prävalenz 15 bis 20% in dieser Rassenpopulation erreicht.
Die komplexe immunologische Pathogenese involviert eine übermäßige Th2-Polarisierung mit Hyperproduktion von IL-4, IL-13, IL-5 und IL-31, die zu massiver allergenspezifischer IgE-Synthese und eosinophiler Geweberekrutierung führt. Die kutane Dysbiose mit Expansion von Staphylococcus pseudintermedius und Malassezia pachydermatis verstärkt die Entzündung durch Produktion superantigener Exotoxine und proteolytischer Enzyme. Sekundäre infektiöse Komplikationen, insbesondere rezidivierende Pyodermitiden und Malassezia-Dermatitiden, stellen eher die Regel als die Ausnahme dar und erfordern eine rigorose antimikrobielle Behandlung vor jeder Bewertung der anti-inflammatorischen Antwort.
Die diagnostische Herangehensweise beruht auf einer strukturierten klinischen Methodik, die detaillierte Anamnese, systematische dermatologische Untersuchung und gezielte komplementäre Untersuchungen integriert, insbesondere die als erste Intention durchführbare kutane Zytologie. Die Identifikation sekundärer Infektionen und ihre angemessene Behandlung bilden imperativ den ersten therapeutischen Schritt. Die langfristige Kontrollstrategie kombiniert symptomatische Juckreizbehandlung durch JAK-Inhibitoren oder Anti-IL-31-Antikörper, epidermale Barrierewiederherstellung durch restrukturierende Topika und Management auslösender Umweltfaktoren.
Die zukünftigen Forschungsperspektiven müssen die Charakterisierung des rassischen genetischen Determinismus durch pangenom-weite Assoziationsstudien vertiefen, spezifische Varianten der epidermalen Barrieregene identifizieren, die bei der Französischen Bulldogge für Atopie prädisponieren, und gezielte Therapien entwickeln, die diese primären molekularen Defizite korrigieren. Die Erforschung des kutanen Mikrobioms durch metagenomische Sequenzierung und die Identifikation dysbiotischer Signaturen, die für die klinische Entwicklung prädiktiv sind, könnten frühe Interventionen durch Probiotika oder mikrobielle Transplantation ermöglichen. Die Entwicklung caniner Biotherapien, die Schlüssel-Th2-Zytokine anvisieren, insbesondere monoklonaler Anti-IL-4Rα- oder Anti-IL-13-Antikörper, eröffnet revolutionäre therapeutische Perspektiven. Schließlich verdienen frühe präventive Strategien, die darauf abzielen, die epidermale Barriere bereits in den ersten Lebensmonaten bei Risiko-Welpen wiederherzustellen, eine vertiefte Untersuchung, um zu bestimmen, ob eine neonatale Intervention die Etablierung klinisch manifester atopischer Dermatitis verhindern oder verzögern könnte.
Literatur
Outerbridge CA, Jordan TJM. Current Knowledge on Canine Atopic Dermatitis: Pathogenesis and Treatment. Advances in Small Animal Care. 2021;2(1):101-117. PMC9204668.
Bajwa J. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. Canadian Veterinary Journal. 2015;56(8):758-765. PMC4531508.
Zur G, Ihrke PJ, White SD, Kass PH. Canine atopic dermatitis: a retrospective study of 266 cases examined at the University of California, Davis, 1992-1998. Part I. Clinical features and allergy testing results. Veterinary Dermatology. 2002;13(2):89-102.
Marsella R, Olivry T, Nicklin C, Lopez J. Pilot investigation of a model for canine atopic dermatitis: environmental house dust mite challenge of high-IgE-producing beagles, mite hypersensitive dogs with atopic dermatitis and normal dogs. Veterinary Dermatology. 2006;17(1):24-35.
Olivry T, DeBoer DJ, Favrot C, et al. Treatment of canine atopic dermatitis: 2015 updated guidelines from the International Committee on Allergic Diseases of Animals (ICADA). BMC Veterinary Research. 2015;11:210. PMC4531508.
Chermprapai S, Broere F, Gooris G, Schlotter YM, Rutten VPMG, Bouwstra JA. Altered lipid properties of the stratum corneum in Canine Atopic Dermatitis. Biochim Biophys Acta Biomembr. 2018;1860(2):526-533.
Pucheu-Haston CM, Bizikova P, Eisenschenk MN, Santoro D, Nuttall T, Marsella R. Review: The role of antibodies, autoantigens and food allergens in canine atopic dermatitis. Veterinary Dermatology. 2015;26(2):115-e30.
Santoro D, Marsella R, Pucheu-Haston CM, et al. Review: Pathogenesis of canine atopic dermatitis: skin barrier and host-micro-organism interaction. Veterinary Dermatology. 2015;26(2):84-e25.
Banovic F, Linder KE, Olivry T. Clinical, microscopic and microbial characterization of exfoliative superficial pyoderma-associated epidermal collarettes in dogs. Veterinary Dermatology. 2017;28(1):107-e23.
Hensel P, Santoro D, Favrot C, Hill P, Griffin C. Canine atopic dermatitis: detailed guidelines for diagnosis and allergen identification. BMC Veterinary Research. 2015;11:196. PMC4531508.
Cosgrove SB, Wren JA, Cleaver DM, et al. A blinded, randomized, placebo-controlled trial of the efficacy and safety of the Janus kinase inhibitor oclacitinib (Apoquel®) in client-owned dogs with atopic dermatitis. Veterinary Dermatology. 2013;24(6):587-597.
Gonzales AJ, Humphrey WR, Messamore JE, et al. Interleukin-31: its role in canine pruritus and naturally occurring canine atopic dermatitis. Veterinary Dermatology. 2013;24(1):48-e12.
Michels GM, Ramsey DS, Walsh KF, et al. A blinded, controlled study to investigate the efficacy and safety of a canine anti-IL-31 monoclonal antibody in client-owned dogs with atopic dermatitis. Veterinary Dermatology. 2016;27(6):505-e136.
Olivry T, Bizikova P. A systematic review of randomized controlled trials for prevention or treatment of atopic dermatitis in dogs: 2008-2011 update. Veterinary Dermatology. 2013;24(1):97-e26.
Marsella R, Girolomoni G. Canine models of atopic dermatitis: a useful tool with untapped potential. Journal of Investigative Dermatology. 2009;129(10):2351-2357.
Banovic F, Olivry T, Bazzle L, Tobias JR, Atlee B, Linder KE. Deep pyoderma caused by Pseudomonas aeruginosa in dogs: 20 cases. Veterinary Dermatology. 2016;27(6):494-e131.
Little PR, King VL, Davis KR, et al. A blinded, controlled multicenter study to assess the effectiveness and rate of flea kill of orally administered afoxolaner compared with topically applied fipronil/(S)-methoprene in dogs with flea allergy dermatitis. Veterinary Parasitology. 2015;207(3-4):306-312.
Loeffler A, Cobb MA, Bond R. Comparison of a chlorhexidine and a benzoyl peroxide shampoo as sole treatment in canine superficial pyoderma. Veterinary Record. 2011;169(10):249.
Mueller RS, Bergvall K, Bensignor E, Bond R. A review of topical therapy for skin infections with bacteria and yeast. Veterinary Dermatology. 2012;23(4):330-e62.
Noli C, Borio S, Varina A, Schievano C. Development and validation of a questionnaire to evaluate the Quality of Life of cats with skin disease and their owners, and its use in 185 cats with skin disease. Veterinary Dermatology. 2016;27(4):247-e58.
Nuttall TJ, Marsella R, Rosenbaum MR, Gonzales AJ, Fadok VA. Update on pathogenesis, diagnosis, and treatment of atopic dermatitis in dogs. Journal of the American Veterinary Medical Association. 2019;254(11):1291-1300.
Olivry T, Mueller RS, International Task Force on Canine Atopic Dermatitis. Evidence-based veterinary dermatology: a systematic review of the pharmacotherapy of canine atopic dermatitis. Veterinary Dermatology. 2003;14(3):121-146.
Piekutowska A, Pin D, Reme CA, Gatto H, Haftek M. Effects of a topically applied preparation of epidermal lipids on the stratum corneum barrier of atopic dogs. Journal of Comparative Pathology. 2008;138(4):197-203.
Reedy LM, Miller WH, Willemse T. Allergic Skin Diseases of Dogs and Cats. 2nd ed. London: WB Saunders; 1997.
Saridomichelakis MN, Koutinas AF, Farmaki R, Leontides LS, Kasabalis D. Relative sensitivity of hair pluckings and exudate microscopy for the diagnosis of canine demodicosis. Veterinary Dermatology. 2007;18(2):138-141.
Shimada K, Yoon JS, Yoshihara T, Iwasaki T, Nishifuji K. Increased transepidermal water loss and decreased ceramide content in lesional and non-lesional skin of dogs with atopic dermatitis. Veterinary Dermatology. 2009;20(5-6):541-546.
Shumaker AK, Angus JC, Coyner KS, Loeffler DG, Van Den Broek AHM, Sánchez A. Microbiological and histopathological features of canine pyotraumatic dermatitis (“hot spots”). Veterinary Dermatology. 2008;19(3):131-139.
Steffan J, Alexander D, Brovedani F, Fisch RD. Comparison of cyclosporine A with methylprednisolone for treatment of canine atopic dermatitis: a parallel, blinded, randomized controlled trial. Veterinary Dermatology. 2003;14(1):11-22.
Steffan J, Favrot C, Mueller R. A systematic review and meta-analysis of the efficacy and safety of cyclosporin for the treatment of atopic dermatitis in dogs. Veterinary Dermatology. 2006;17(1):3-16.
Thyssen JP, Godoy-Gijon E, Elias PM. Ichthyosis vulgaris: the filaggrin mutation disease. British Journal of Dermatology. 2013;168(6):1155-1166.
Wilhem S, Kovalik M, Favrot C. Breed-associated phenotypes in canine atopic dermatitis. Veterinary Dermatology. 2011;22(2):143-149.
Bizikova P, Papiernik D, Mendoza ME, Haile B, Olivry T. Studies Using Antibodies against Filaggrin and Filaggrin 2 in Canine Normal and Atopic Skin Biopsies. Veterinary Sciences. 2024;11(2):53. PMC10854974.
Zur G, White SD, Ihrke PJ, Kass PH, Toebe N. Canine atopic dermatitis: a retrospective study of 169 cases examined at the University of California, Davis, 1992-1998. Part II. Response to hyposensitization. Veterinary Dermatology. 2002;13(2):103-111.
Marsella R, Samuelson D, Doerr K. Transmission electron microscopy studies in an experimental model of canine atopic dermatitis. Veterinary Dermatology. 2010;21(1):81-88.
Marsella R, Olivry T, Carlotti DN. Current evidence of skin barrier dysfunction in human and canine atopic dermatitis. Veterinary Dermatology. 2011;22(3):239-248.
Nuttall T, Knight PA, McAleese SM, Lamb JR, Hill PB. Expression of Th1, Th2 and immunosuppressive cytokine gene transcripts in canine atopic dermatitis. Clinical & Experimental Allergy. 2002;32(5):789-795.
Bruet V, Bourdeau PJ, Roussel A, Imparato L, Desfontis JC. Characterization of pruritus in canine atopic dermatitis, flea bite hypersensitivity and flea infestation and its role in diagnosis. Veterinary Dermatology. 2012;23(6):487-e93.
Olivry T, Dunston SM, Murphy KM, Moore PF. Characterization of the inflammatory infiltrate during IgE-mediated late phase reactions in the skin of normal and atopic dogs. Veterinary Dermatology. 2001;12(1):49-58.
Sousa CA, Marsella R. The ACVD task force on canine atopic dermatitis (II): genetic factors. Veterinary Immunology and Immunopathology. 2001;81(3-4):153-157.
DeBoer DJ, Marsella R. The ACVD task force on canine atopic dermatitis (XII): the relationship of cutaneous infections to the pathogenesis and clinical course of canine atopic dermatitis. Veterinary Immunology and Immunopathology. 2001;81(3-4):239-249.
Older CE, Diesel A, Patterson AP, Meason-Smith C, Johnson TJ, Rodrigues Hoffmann A. The feline skin microbiota: The bacteria inhabiting the skin of healthy and allergic cats. PLoS One. 2017;12(6):e0178555.
Bradley CW, Morris DO, Rankin SC, et al. Longitudinal evaluation of the skin microbiome and association with microenvironment and treatment in canine atopic dermatitis. Journal of Investigative Dermatology. 2016;136(6):1182-1190.
Rodrigues Hoffmann A, Patterson AP, Diesel A, et al. The skin microbiome in healthy and allergic dogs. PLoS One. 2014;9(1):e83197.
Yeon SC, Erb HN, Houpt KA. A retrospective study of canine house soiling: diagnosis and treatment. Applied Animal Behaviour Science. 1999;66(1-2):81-95.
Nuttal T, Mueller R. Advances in atopic dermatitis. Companion Animal. 2018;23(2):70-77.
Torres SMF, Gomez N, Dent P. Mast cell quantification in skin biopsies from dogs with allergic skin disease: a retrospective study. Veterinary Dermatology. 2012;23(Suppl 1):3-8.
Keppel KE, Campbell KL, Zuckermann FA, Greeley EA, Schaeffer DJ, Husmann RJ. Quantitation of canine regulatory T cell populations, serum interleukin-10 and allergen-specific IgE concentrations in healthy control dogs and canine atopic dermatitis patients receiving allergen-specific immunotherapy. Veterinary Immunology and Immunopathology. 2008;123(3-4):337-344.
Masuda K, Sakaguchi M, Fujiwara S, et al. Positive reactions to common allergens in 42 atopic dogs in Japan. Veterinary Immunology and Immunopathology. 2000;73(2):193-204.
Hill PB, Hillier A, Olivry T. The ACVD task force on canine atopic dermatitis (VI): IgE-induced immediate and late-phase reactions, two inflammatory sequences at sites of intradermal allergen injections. Veterinary Immunology and Immunopathology. 2001;81(3-4):199-204.
Bizikova P, Santoro D, Marsella R, Nuttall T, Eisenschenk MN, Pucheu-Haston CM. Review: Clinical and histological manifestations of canine atopic dermatitis. Veterinary Dermatology. 2015;26(2):79-e24.