La pododermatite canina non costituisce un’entità nosologica unica, ma rappresenta piuttosto un pattern reazionale cutaneo complesso e multifattoriale, risultante da un’interazione dinamica tra cause primarie, fattori predisponenti ed elementi perpetuanti. Questo rapporto di sintesi ha l’obiettivo di fornire un’analisi esaustiva, dettagliata e aggiornata dell’eziologia, della fisiopatologia e delle strategie terapeutiche delle pododermatiti canine.
Questa revisione integra i dati scientifici più recenti, in particolare le linee guida 2025 dell’ISCAID (International Society for Companion Animal Infectious Diseases) sull’uso razionale degli antimicrobici, i consensus del WAVD (World Association for Veterinary Dermatology) sulla demodicosi e la dermatite da Malassezia, nonché i progressi tecnologici in biomodulazione mediante fluorescenza. L’analisi si basa anche sulle nuove tendenze di resistenza batterica osservate in Europa e in Asia, sottolineando l’urgenza di un approccio diagnostico rigoroso e di una gestione terapeutica parsimoniosa nell’uso di antibiotici.
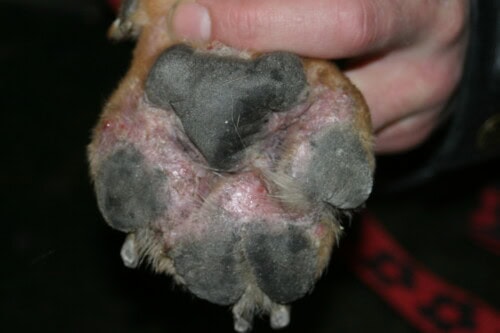
Nella pratica clinica quotidiana, la pododermatite canina rimane uno dei motivi di consultazione più frequenti, ma anche uno dei più frustranti sia per il veterinario che per il proprietario. La presentazione clinica, sebbene spesso stereotipata — caratterizzata da eritema interdigitale, alopecia, edema ed essudazione siero-purulenta — maschera una considerevole diversità eziologica. Questa si estende dall’ipersensibilità ambientale banale ai disordini autoimmuni complessi, passando per malattie metaboliche sistemiche gravi come la sindrome epatocutanea.
Per il dermatologo veterinario, la sfida non risiede solamente nella gestione sintomatica dell’infiammazione o del prurito podale, ma nell’elucidazione precisa della cascata patogenetica sottostante. Una presa in carico inadeguata, spesso limitata a un’antibioticoterapia empirica ripetuta senza indagine eziologica, conduce inevitabilmente alla cronicità. Quest’ultima si caratterizza per una fibrosi dermica irreversibile, la formazione di cisti follicolari, la comparsa di modificazioni conformazionali del piede e l’emergenza di ceppi batterici multiresistenti, in particolare lo Staphylococcus pseudintermedius resistente alla meticillina (SPRM) e bacilli Gram negativi come Pseudomonas aeruginosa o Escherichia coli.
I. Fisiopatologia e Anatomia Funzionale: Il Terreno della Malattia
1.1 La Barriera Cutanea Interdigitale e il Microclima Podale
La comprensione della patogenesi inizia dall’analisi dell’anatomia funzionale. La cute degli spazi interdigitali presenta delle particolarità che la predispongono intrinsecamente all’infiammazione e all’infezione. Contrariamente alla cute glabra, l’epidermide interdigitale è eccezionalmente ricca di ghiandole sebacee e apocrine. Questa densità ghiandolare, associata alla configurazione anatomica “chiusa” dello spazio interdigitale, crea un microclima caldo, umido e lipidico, particolarmente favorevole alla proliferazione microbica.
Questo ambiente costituisce una nicchia ecologica ideale per le popolazioni commensali, in particolare gli stafilococchi coagulasi-positivi e il lievito lipido-dipendente Malassezia pachydermatis. Inoltre, la barriera cutanea a questo livello è sottoposta a costanti e intense sollecitazioni meccaniche dovute alla locomozione e al peso dell’animale. Qualsiasi alterazione di questa barriera, sia essa di origine allergica, parassitaria o traumatica, permette la penetrazione di allergeni e patogeni, scatenando una risposta immunitaria locale spesso sproporzionata.
1.2 Il Concetto di Cisti Follicolare e di Foruncolosi: Meccanismo della Cronicità
Un meccanismo fisiopatologico centrale nell’instaurarsi della cronicità delle pododermatiti è la rottura del follicolo pilifero, che porta alla foruncolosi. Questo fenomeno è spesso mal compreso e erroneamente qualificato come “cisti sebacea”. Sotto l’effetto dell’infiammazione iniziale (dovuta a un’allergia o a una demodicosi) o di traumatismi frizionali (difetti di appiombo, sovrappeso), l’ostio follicolare si ostruisce per ipercheratosi. Questa ostruzione conduce a una dilatazione cistica del follicolo.
La rottura della parete follicolare indebolita libera quindi il contenuto del follicolo nel derma circostante: cheratina libera, fusti piliferi e batteri. La cheratina, una volta fuori dal follicolo, è riconosciuta come un corpo estraneo endogeno dal sistema immunitario. Essa scatena una grave reazione infiammatoria piogranulomatosa, inizialmente sterile, che evolve rapidamente verso un’infezione batterica profonda. I frammenti di peli agiscono come spine irritative persistenti, mantenendo l’infiammazione anche dopo l’apparente sterilizzazione batterica. È questo processo di reazione da corpo estraneo che spiega perché gli antibiotici da soli falliscono sistematicamente nel risolvere le lesioni nodulari croniche e perché la chirurgia o il laser sono talvolta necessari.
II. Approccio Diagnostico Algoritmico e Ragionato
Di fronte a una pododermatite, l’approccio clinico deve essere rigoroso, sequenziale ed esaustivo per evitare errori diagnostici e la prescrizione inutile di trattamenti sintomatici che mascherano la causa primaria.
2.1 Anamnesi e Commemorativi: Gli Indizi Iniziali
L’indagine clinica inizia con un’anamnesi dettagliata. L’età di comparsa dei segni è un indicatore discriminante maggiore. Una pododermatite che insorge in un cane giovane (meno di un anno) deve immediatamente orientare il clinico verso una demodicosi giovanile o una dermatite atopica precoce. Al contrario, la comparsa di lesioni podali in un cane anziano, senza precedenti dermatologici, impone di considerare cause metaboliche gravi come la sindrome epatocutanea, neoplasie (carcinoma squamocellulare, linfoma cutaneo) o malattie autoimmuni (pemfigo foliaceo).
La stagionalità dei segni è un altro elemento chiave: un’esacerbazione in primavera o in estate suggerisce un’atopia ambientale (pollini), mentre una pododermatite non stagionale può indicare un’allergia alimentare o una causa non allergica. La nozione di contagio ad altri animali del nucleo familiare o ai proprietari (prurito nell’uomo) orienta verso un’origine parassitaria zoonotica, come la rogna sarcoptica, o fungina, come la dermatofitosi.
2.2 Esame Clinico Dermatologico
L’esame fisico non deve limitarsi alle sole estremità. La distribuzione delle lesioni sul corpo fornisce indizi preziosi sull’eziologia:
- Pododermatite isolata (unipodale): Questa presentazione suggerisce una causa locale come un corpo estraneo (forasacco), un trauma, una neoplasia, o un’infezione fungina opportunistica localizzata.
- Pododermatite generalizzata (quadripodale): L’interessamento simultaneo delle quattro zampe è fortemente suggestivo di cause sistemiche: allergie (alimentari o ambientali), malattie autoimmuni (pemfigo), cause metaboliche, o leishmaniosi.
- Localizzazione precisa sul piede: Un interessamento dei cuscinetti (ipercheratosi, ulcere, depigmentazione) orienta verso il pemfigo, la sindrome epatocutanea o la leishmaniosi, mentre un interessamento strettamente interdigitale dorsale è più classico dell’atopia o della demodicosi.
2.3 Esami Complementari Immediati
Il raschiato cutaneo profondo e il tricogramma sono imperativi non negoziabili. Devono essere realizzati sistematicamente per escludere la demodicosi, anche nel cane adulto che riceve una profilassi antiparassitaria apparente (isossazoline), poiché possono verificarsi fallimenti terapeutici, problemi di compliance o deficit immunitari severi. Nelle forme croniche con fibrosi, gli acari possono essere difficili da evidenziare mediante raschiato; la biopsia cutanea diventa quindi necessaria.
2.4 Citologia Cutanea: La Pietra Angolare della Diagnosi Infettiva
La citologia, realizzata mediante impronta diretta, con tampone o mediante aspirazione con ago sottile per i noduli, è l’esame più redditizio e più informativo. Permette di quantificare oggettivamente la presenza di:
- Batteri: La distinzione tra cocchi (generalmente Staphylococcus) e bastoncelli è cruciale. La presenza di bastoncelli deve immediatamente allertare il clinico su una possibile infezione da Gram negativi, potenzialmente Pseudomonas, giustificando una coltura batterica immediata.
- Lieviti: Il rilevamento di Malassezia pachydermatis (lieviti a forma di “bottiglia” o di “arachide”) è frequente nelle pododermatiti allergiche.
- Cellule infiammatorie: La caratterizzazione dell’infiltrato (neutrofili degenerati, eosinofili, macrofagi, cellule acantolitiche) orienta la diagnosi. La presenza di cellule acantolitiche in lamine suggerisce fortemente un pemfigo foliaceo.
III. Eziologia: Classificazione Dettagliata delle Cause Primarie
È fondamentale distinguere le cause primarie, che iniziano il processo, dalle cause secondarie (infezioni) e perpetuanti (modificazioni anatomiche). Il trattamento delle cause secondarie senza gestione della causa primaria conduce inevitabilmente alla recidiva.
3.1 Dermatosi Allergiche: La Causa Predominante
Le allergie costituiscono, di gran lunga, la causa primaria più frequente di pododermatite canina cronica.
- Dermatite Atopica Canina (DAC): Il prurito podale è un segno cardinale della DAC, spesso il primo a comparire. L’eritema interdigitale, inizialmente ventrale poi dorsale, e il leccamento compulsivo causano una caratteristica colorazione brunastra dei peli dovuta alle porfirine salivari (cromonichia salivare). Le linee guida dell’ICADA sottolineano l’importanza della gestione multimodale, mirando sia alla disfunzione della barriera cutanea che alla deregolazione immunitaria.
- Allergia Alimentare (Reazione Avversa agli Alimenti): Clinicamente indistinguibile dalla DAC, può manifestarsi con una pododermatite isolata o associata a disturbi digestivi (feci molli, borborigmi) e otite. La dieta di eliminazione rimane il “gold standard” diagnostico.
- Dermatite da Contatto: Spesso sottodiagnosticata, colpisce principalmente le zone glabre a contatto diretto con il suolo (superficie palmare/plantare delle dita, spazi interdigitali ventrali) risparmiando gli spazi dorsali con peli. Gli allergeni frequenti includono i prodotti per la pulizia dei pavimenti, i fertilizzanti, i cementi o alcune piante (Erba della Pampa, Tradescantia).
Pododermatite di origine atopica
3.2 Malattie Parassitarie
- Demodicosi da Demodex canis: La forma podale, o pododemodicosi, può essere un esito cronico di una forma generalizzata giovanile non risolta o comparire de novo in età adulta. Nell’adulto, è spesso associata a un’immunosoppressione sottostante (ipotiroidismo, sindrome di Cushing, chemioterapia, corticoterapia a lungo termine). Le lesioni sono tipicamente squamose, alopeciche, comedoniche e iperpigmentate (“piedi blu”), evolvendo frequentemente verso una piodermite profonda grave con foruncolosi ed edema marcato.
- Demodicosi da Demodex injai: Questo parassita, morfologicamente più lungo di D. canis, risiede preferenzialmente nelle ghiandole sebacee. Sebbene provochi classicamente una dermatite seborroica dorsale (“stato cheratoseborroico grasso”) nei Terrier, può anche indurre prurito podale ed eritema diffuso, spesso confusi con un’allergia.
- Dermatite da Pelodera strongyloides: Questo nematode saprofita penetra la cute a contatto con una lettiera umida e sporca (paglia). Provoca una pododermatite eritematosa, alopecica ed estremamente pruriginosa, colpendo le zone a contatto con il suolo.
- Anchilostomiasi: Le larve di Ancylostoma possono penetrare per via percutanea a livello degli spazi interdigitali, causando una dermatite papulosa pruriginosa e un’ipercheratosi dei cuscinetti.
3.3 Endocrinopatie e Malattie Metaboliche
L’ipotiroidismo e l’iperadrenocorticismo (Sindrome di Cushing) non causano direttamente una pododermatite infiammatoria per se, ma predispongono fortemente alle infezioni secondarie batteriche e fungine mediante alterazione dell’immunità cutanea e della barriera epidermica. La calcinosi cutanea distrofica, complicanza della sindrome di Cushing iatrogena o spontanea, può manifestarsi con placche dure, biancastre e calcificate sui cuscinetti o negli spazi interdigitali, circondate da una reazione infiammatoria da corpo estraneo.
La dermatite necrolitica superficiale
Chiamata anche eritema necrolitico migrante, è una dermatosi grave associata a un’epatopatia vacuolare cronica severa o, più raramente, a un tumore pancreatico secernente glucagone (glucagonoma). La patogenesi implica una profonda carenza di aminoacidi essenziali circolanti, causando una necrosi dei cheratinociti dello strato granuloso. Le lesioni podali sono caratteristiche e dolorose: ipercheratosi severa dei cuscinetti con fessure profonde, eritema essudativo e croste aderenti. L’istopatologia rivela il segno patognomonico “Rosso, Bianco e Blu” (paracheratosi, edema, iperplasia basale). L’aspetto ecografico del fegato a “nido d’ape” (honeycomb pattern) è altamente evocativo.
Pododermatite dovuta a dermatite necrolitica superficiale
3.4 Malattie Autoimmuni e Immunomediate
- Pemfigo Foliaceo: È la malattia autoimmune più frequente nel cane. Colpisce la desmogleina-1, causando acantolisi superficiale. Clinicamente, si manifesta con pustole (raramente intatte perché fragili), collaretti epidermici, croste giallastre e ipercheratosi villositaria dei cuscinetti, spesso dolorosa. L’interessamento delle unghie è raro, a differenza dell’interessamento facciale e auricolare. Studi recenti suggeriscono che la presenza di lesioni vasculopatiche concomitanti peggiora la prognosi.
- Onicodistrofia Lupoide Simmetrica (SLO): Questa affezione, che colpisce preferenzialmente il Pastore Tedesco, il Gordon Setter e il Bearded Collie, è unica perché interessa esclusivamente le unghie. Inizia spesso con la perdita acuta e dolorosa di una o due unghie (onicòmadesi), seguita sequenzialmente dall’interessamento di tutte le unghie su più zampe. La ricrescita è anormale, producendo unghie fragili, deformate, corte e friabili (onicodistrofia). È considerata una vasculopatia o una dermatite d’interfaccia che colpisce specificamente la matrice ungueale.
Interessamento podale durante pemfigo foliaceo
3.5 Leishmaniosi Canina
Nelle zone endemiche (bacino del Mediterraneo) o nei cani che hanno viaggiato, la leishmaniosi da Leishmania infantum deve essere sistematicamente considerata di fronte a qualsiasi pododermatite. Il parassita induce una risposta immunitaria complessa. Oltre alla dermatite esfoliativa (scaglie giganti), provoca un’onicogrifosi spettacolare (unghie anormalmente lunghe e curve come corna d’ariete). Questo sintomo non è una semplice ipertrofia, ma risulta da un’infiammazione cronica della matrice ungueale mediata dal deposito di complessi immuni circolanti. Ulcere dei cuscinetti, ipercheratosi naso-digitale e vasculite necrotizzante della punta delle orecchie sono anch’esse frequenti.
IV. Fattori Predisponenti e Perpetuanti: Il Circolo Vizioso
Il riconoscimento di questi fattori è cruciale quanto l’identificazione della causa primaria. Ignorare i fattori perpetuanti condanna qualsiasi terapia medica al fallimento a lungo termine.
4.1 Fattori Conformazionali e Biomeccanici
Le razze pesanti a pelo corto (Bulldog Inglese, Bulldog Francese, Labrador, Boxer, Bull Terrier) sono geneticamente predisposte. L’obesità aggrava considerevolmente il problema aumentando la pressione sui cuscinetti e provocando uno schiacciamento degli spazi interdigitali (splayed toes). Questo schiacciamento aumenta la superficie di attrito pelle contro pelle durante la deambulazione. Inoltre, le zampe cosiddette “allargate” o che presentano palmature profonde favoriscono la ritenzione di umidità e la macerazione.
4.2 La “Follicolite Traumatica” e le Cisti Interdigitali
Le cisti interdigitali e la foruncolosi sono spesso mantenute da un fattore meccanico semplice ma devastante: la natura del pelo. Nelle razze a pelo corto e rigido, i peli spezzati agiscono come aghi. Durante la deambulazione, l’attrito costante spinge questi fusti piliferi spezzati all’indietro, nel derma o attraverso la parete follicolare (peli incarniti). Questo crea un circolo vizioso: infiammazione -> edema -> attrito aumentato -> rottura follicolare -> reazione da corpo estraneo -> fibrosi. La fibrosi cicatriziale finisce per imprigionare detriti follicolari, formando nidi di infezione cronica inaccessibili agli antibiotici e alle difese immunitarie.
V. Gestione Terapeutica Avanzata: Protocolli 2025
La gestione della pododermatite canina è per essenza multimodale. Deve simultaneamente:
- Trattare l’infezione (batterica e fungina).
- Controllare l’infiammazione e il prurito per fermare l’autotraumatismo.
- Identificare e gestire la causa primaria.
- Correggere i fattori perpetuanti (chirurgia, gestione del peso).
5.1 Gestione delle Infezioni Batteriche: Nuove Linee Guida ISCAID 2025
Le nuove linee guida dell’ISCAID, pubblicate nel 2025, segnano una svolta nell’approccio alle piodermiti, insistendo sulla drastica riduzione dell’uso sistemico degli antibiotici per combattere l’antibioticoresistenza crescente.
Piodermite di Superficie e Superficiale
Per le infezioni limitate alla superficie (intertrigine) o ai follicoli superficiali, il trattamento topico è ora la regola assoluta in prima intenzione. L’uso di shampoo, schiume o salviette a base di clorexidina (concentrazione dal 2% al 4%) è raccomandato quotidianamente o ogni due giorni. La mupirocina pomata è un’opzione eccellente per le lesioni focali localizzate, in particolare contro gli stafilococchi multiresistenti.
Piodermite Profonda e Foruncolosi
L’antibioticoterapia sistemica rimane spesso necessaria per le forme profonde (foruncolosi, cellulite), ma deve imperativamente essere guidata da una coltura batterica e un antibiogramma. L’antibioticoterapia empirica è fortemente sconsigliata in questo contesto.
- Durata del trattamento: È prolungata. Le raccomandazioni attuali preconizzano un trattamento di almeno 4-6 settimane, e soprattutto, la prosecuzione del trattamento per 2-3 settimane dopo la risoluzione clinica completa delle lesioni (scomparsa dei noduli palpabili). Un’interruzione prematura è la causa principale di recidiva.
- Scelta delle molecole (Gerarchizzazione ISCAID):
- Livello 1 (Prima intenzione se antibiogramma favorevole): Cefalexina, Amoxicillina-Acido Clavulanico, Clindamicina, Trimetoprim-Sulfamidici (TMS).
- Livello 2 (Molecole di riserva): Fluorochinoloni (Enrofloxacina, Marbofloxacina, Pradofloxacina), Doxiciclina, Minociclina. Da utilizzare solo su prova di resistenza alle molecole di livello 1.
Dati Recenti sulla Resistenza (2024-2025)
Studi epidemiologici recenti condotti in Europa e in Cina hanno evidenziato tendenze preoccupanti. È stata osservata un’elevata resistenza di Escherichia coli (spesso implicato nelle pododermatiti profonde croniche) all’amoxicillina (fino al 62% di resistenza). Al contrario, la sensibilità al Trimetoprim-Sulfamidico (TMS) rimane relativamente stabile, il che ne fa un’opzione empirica (in attesa di coltura) più razionale rispetto alle penicilline per i sospetti di Gram negativi. La resistenza all’amoxicillina-acido clavulanico mostra una tendenza al ribasso in alcune regioni, suggerendo un’efficacia preservata se utilizzata giudiziosamente.
|
Tipo di Infezione |
Approccio Terapeutico Raccomandato (Consensus ISCAID 2025) |
Durata Media del Trattamento |
Molecole Privilegiate |
|
Di superficie / Intertrigine |
Solo topico (Clorexidina 4%, Mupirocina) |
2-3 settimane |
Antisettici locali |
|
Superficiale |
Topico prioritario +/- Sistemico breve |
3 settimane (1 sett. dopo guarigione) |
Cefalexina, Clindamicina |
|
Profonda (Foruncolosi) |
Sistemico (secondo antibiogramma) + Topico adiuvante |
4-8 settimane + (2-3 sett. dopo guarigione) |
Secondo coltura (spesso Fluorochinoloni, TMS) |
|
SARM / SPRM |
Topico aggressivo + Sistemico mirato (se possibile) |
Variabile |
Cloramfenicolo, Doxiciclina |
5.2 Gestione delle Infezioni Fungine (Malassezia)
La dermatite da Malassezia complica frequentemente le allergie, provocando un prurito intenso, un odore rancido e un essudato brunastro.
- Trattamento topico: Spesso sufficiente. Shampoo contenenti 2% di miconazolo e 2% di clorexidina.
- Trattamento sistemico: In caso di fallimento del topico, di interessamento severo o di conformazione che rende difficili le cure locali.
- Itraconazolo: 5 mg/kg/die o protocollo pulsato (2 giorni consecutivi a settimana).
- Ketoconazolo: 5-10 mg/kg/die (attenzione all’epatotossicità).
- Terbinafina: 30 mg/kg/die.
5.3 Strategie di Gestione dell’Infiammazione e del Prurito
Il controllo rapido del prurito è essenziale per spezzare il ciclo “prurito-grattamento-infiammazione”.
- Glucocorticoidi (Prednisolone/Metilprednisolone): Rimangono lo strumento più rapido e più efficace per ridurre l’edema severo e la fibrosi infiammatoria delle cisti interdigitali in fase acuta. Dose antinfiammatoria (0,5-1 mg/kg/die) in ciclo breve.
- Oclacitinib (Inibitore JAK): Molto efficace per il controllo del prurito allergico con un tempo di azione rapido (simile agli steroidi). Studi comparativi (Little et al., 2015) hanno dimostrato che l’oclacitinib agisce più velocemente della ciclosporina e con meno effetti collaterali gastrointestinali. È ideale per la diagnosi terapeutica dell’atopia.
- Lokivetmab (Anticorpo monoclonale anti-IL31): Colpisce specificamente l’interleuchina-31, mediatore chiave del prurito atopico. È un’opzione sicura, senza effetti collaterali metabolici o immunosoppressori, utilizzabile nei cani giovani o con comorbilità.
- Ciclosporina: Efficace per i casi cronici di atopia e alcune malattie autoimmuni, ma il suo tempo di azione è lento (4-6 settimane per un effetto massimo), il che limita la sua utilità in fase acuta.
5.4 Terapie Innovative: La Biomodulazione mediante Fluorescenza (Phovia)
La Biomodulazione mediante Fluorescenza (FLE – Fluorescent Light Energy) rappresenta un importante progresso tecnologico non invasivo per la gestione delle piodermiti profonde e delle foruncolosi interdigitali.
- Meccanismo: Il sistema Phovia si basa sull’applicazione di un gel contenente cromofori specifici, illuminato da una lampada LED blu. I cromofori assorbono i fotoni blu e riemettono energia luminosa per fluorescenza a diverse lunghezze d’onda (verde, giallo, rosso) nello spettro visibile. Questa energia penetra a diverse profondità del derma, stimolando i mitocondri cellulari, favorendo la produzione di ATP, riducendo l’infiammazione e stimolando la rigenerazione tissutale, pur avendo un effetto battericida diretto.
- Efficacia Clinica: Studi clinici prospettici randomizzati (Marchegiani et al., 2021, 2022) hanno dimostrato che l’aggiunta della FLE al trattamento antibiotico standard accelera significativamente la guarigione clinica (riduzione del tempo di trattamento necessario alla risoluzione) e migliora la qualità della cicatrizzazione delle lesioni profonde. Un protocollo di un’applicazione settimanale si è rivelato statisticamente efficace quanto due applicazioni a settimana, il che facilita notevolmente l’osservanza da parte dei proprietari.
5.5 Opzioni Chirurgiche: L’Ultima Risorsa
In caso di pododermatite fibrosante cronica refrattaria a qualsiasi gestione medica ottimale (e solo dopo controllo rigoroso delle cause primarie), la chirurgia può essere considerata come soluzione di salvataggio (“salvage procedure”).
- Chirurgia con Laser CO2: Permette l’exeresi precisa delle cisti, dei follicoli malati e dei tessuti fibrosati con un’eccellente emostasi e una sterilizzazione del sito operatorio. È la tecnica di scelta per le lesioni nodulari focali.
- Podoplastica di Fusione (Fusion Podoplasty): Questo intervento pesante consiste nell’asportare la totalità dei tessuti interdigitali malati e nel suturare le dita insieme (fusione dei cuscinetti). Sebbene efficace nell’eliminare il dolore cronico e le infezioni ricorrenti, presenta un alto tasso di complicanze post-operatorie: deiscenza della ferita (molto frequente), necrosi, e convalescenza lunga e dolorosa. Inoltre, studi di follow-up (Papazoglou et al., 2011) mostrano che alcuni cani conservano una zoppia meccanica residua o un disagio alla deambulazione a lungo termine. Questa chirurgia deve essere proposta solo nei casi estremi (“end-stage pododermatitis”).
VI. Trattamenti Specifici secondo l’Eziologia
L’adattamento del protocollo all’eziologia precisa è la chiave del successo.
6.1 Onicodistrofia Lupoide Simmetrica (SLO)
Il trattamento della SLO è essenzialmente medico e deve spesso essere mantenuto per tutta la vita.
- Protocollo di base (Immunomodulazione dolce): L’associazione di Tetraciclina (o Doxiciclina) e di Niacinamide (Vitamina B3) è il trattamento di scelta storico. I dosaggi raccomandati sono di 250 mg di ciascuno (per cani <20kg) a 500 mg di ciascuno (cani > 20kg), tre volte al giorno. Questo protocollo è spesso associato a una supplementazione massiva di Acidi Grassi Essenziali (Omega-3), in particolare EPA (Acido Eicosapentaenoico), a dosi elevate (400 mg/10kg).
- Casi refrattari: Se la risposta è insufficiente dopo 2-3 mesi, immunosoppressori più potenti come il Prednisolone, l’Azatioprina o la Pentossifillina (per migliorare la microcircolazione) possono essere aggiunti.
- Chirurgia: L’ablazione delle unghie (onicectomia) è molto raramente necessaria, salvo in caso di dolore incoercibile su un’unghia specifica. L’onicòmadesi spontanea fa parte dell’evoluzione naturale della malattia.
6.2 Sindrome Epatocutanea (SND)
La prognosi è sfavorevole, con una sopravvivenza mediana spesso breve. La gestione è palliativa ed essenzialmente nutrizionale, mirando a correggere l’ipoaminoacidemia.
- Perfusione di aminoacidi: La somministrazione endovenosa di soluzioni di aminoacidi cristallini (tipo Aminosyn 10%) è la pietra angolare del trattamento. Il protocollo implica perfusioni lente (su 8-10h) ripetute ogni 2-3 settimane per colmare il deficit catabolico e ridurre le lesioni cutanee.
- Gestione nutrizionale orale: Una dieta ricca di proteine di alta qualità è imperativa. L’aggiunta di tuorli d’uovo crudi (3-6 al giorno secondo la taglia del cane) è un metodo semplice ed efficace per apportare aminoacidi. Una supplementazione di Zinco (Zinco Metionina) e di acidi grassi essenziali è anche raccomandata.
- Terapie avanzate: Nei rari casi di glucagonoma identificato, l’exeresi chirurgica o l’utilizzo di analoghi della somatostatina (Octreotide) per inibire la secrezione di glucagone ha mostrato risultati promettenti ma rimane costosa.
6.3 Leishmaniosi Canina
Il trattamento si basa sull’associazione sinergica di un leishmanicida e di un leishmaniostatico.
- Protocollo Standard: Antimoniato di meglumina (Glucantime) in iniezione SC per 4 settimane + Allopurinolo per os a lungo termine (minimo 6-12 mesi).
- Alternativa: Miltefosina per os + Allopurinolo (utile in caso di insufficienza renale che limita l’uso degli antimoniati).
- Gestione dei Complessi Immuni: L’allopurinolo aiuta a ridurre il carico parassitario e quindi la formazione dei complessi immuni responsabili dell’onicogrifosi e della glomerulonefrite. Il monitoraggio della funzione renale è prioritario rispetto alla gestione dei segni cutanei.
Conclusione
La gestione delle pododermatiti canine esige dal veterinario clinico una messa in discussione delle pratiche tradizionali. Non si tratta mai di una semplice “infezione della zampa” da trattare con un’iniezione di antibiotico, ma di un segnale di allarme complesso che riflette una disfunzione locale o sistemica. La chiave del successo terapeutico risiede nell’abbandono dell’antibioticoterapia riflessa a favore di un approccio investigativo completo (citologia, raschiati, biopsia) e di una terapia multimodale.
L’integrazione delle nuove linee guida dell’ISCAID, privilegiando la terapia topica, e l’adozione di tecnologie adiuvanti come la biomodulazione mediante fluorescenza, permettono oggi di gestire casi un tempo considerati disperati. Di fronte all’emergenza mondiale delle resistenze batteriche, il dermatologo veterinario deve essere il garante di una medicina responsabile, precisa e fattuale, dove ogni prescrizione è giustificata da una prova diagnostica.
Riferimenti
Loeffler, A., Cain, C. L., Ferrer, L., Nishifuji, K., Varjonen, K., Papich, M. G., Guardabassi, L., Frosini, S. M., Barker, E. N., & Weese, J. S. (2025). Antimicrobial use guidelines for canine pyoderma by the International Society for Companion Animal Infectious Diseases (ISCAID). Veterinary Dermatology, 36, 234–282.
Marchegiani, A., Fruganti, A., Spaterna, A., Cerquetella, M., Tambella, A. M., & Paterson, S. (2021). The Effectiveness of Fluorescent Light Energy as Adjunct Therapy in Canine Deep Pyoderma: A Randomized Clinical Trial. Veterinary Medicine International, 2021, 6643416.
Mueller, R. S., Rosenkrantz, W., Bensignor, E., Karaś-Tęcza, J., Paterson, T., & Shipstone, M. A. (2020). Diagnosis and treatment of demodicosis in dogs and cats: Clinical consensus guidelines of the World Association for Veterinary Dermatology. Veterinary Dermatology, 31(1), 4–e2.
Bond, R., Morris, D. O., Guillot, J., Bensignor, E. J., Robson, D., Mason, K. V., Kano, R., & Hill, P. B. (2020). Biology, diagnosis and treatment of Malassezia dermatitis in dogs and cats: Clinical consensus guidelines of the World Association for Veterinary Dermatology. Veterinary Dermatology, 31(1), 27–e4.
Little, P. R., King, V. L., Davis, K. R., Cosgrove, S. B., & Stegemann, M. R. (2015). A blinded, randomized clinical trial comparing the efficacy and safety of oclacitinib and ciclosporin for the control of atopic dermatitis in client-owned dogs. Veterinary Dermatology, 26, 23–e8.
Auxilia, S. T., Hill, P. B., & Thoday, K. L. (2001). Canine symmetrical lupoid onychodystrophy: a retrospective study with particular reference to management. Journal of Small Animal Practice, 42(2), 82–87.
Papazoglou, L. G., Ellison, G. W., Farese, J. P., et al. (2011). Fusion Podoplasty for the Management of Chronic Pedal Conditions in Seven Dogs and One Cat. Journal of the American Animal Hospital Association, 47(6), e199–e205
Marsella, R. (2025). How to Determine the Causes of Pododermatitis in Small Animals. Today’s Veterinary Practice.
Bajwa, J. (2016). Canine pododermatitis. The Canadian Veterinary Journal, 57(9), 991–993.
World Association for Veterinary Dermatology (WAVD). (2025). Clinical Consensus Guidelines [Online]. Available at: wavd.org
International Society for Companion Animal Infectious Diseases (ISCAID). (2025). Guidelines for the diagnosis and management of bacterial urinary tract infections in dogs and cats.
Forsythe, P. (2015). Canine Pododermatitis. World Small Animal Veterinary Association World Congress Proceedings.
Outerbridge, C. A. (2013). Hepatocutaneous Syndrome. Veterinary Clinics of North America: Small Animal Practice.