Les calcinoses cutanées représentent un défi diagnostique et thérapeutique majeur en dermatologie vétérinaire canine. Ces affections, caractérisées par l’accumulation anormale de sels calciques dans les structures dermiques et hypodermiques, nécessitent une approche clinique rigoureuse fondée sur une compréhension précise de leurs mécanismes physiopathologiques distincts.
Septembre 2025
L’identification précoce des différents types de calcinose et l’instauration d’un traitement adapté conditionnent directement le pronostic fonctionnel et esthétique. Lors des dernières journées annuelles du GEDAC, notre confrère Vincent Bruet, président du GEDAC, a présenté les avancées récentes dans la classification étiologique, les modalités diagnostiques contemporaines et les perspectives thérapeutiques émergentes, particulièrement celles inspirées des protocoles développés en médecine humaine.
Définition et Nomenclature de la Calcinose Cutanée
La calcinose cutanée se définit précisément par des dépôts anormaux de sels de calcium dans le derme et l’hypoderme. Ces accumulations minérales se manifestent cliniquement sous forme de nodules ou de plaques indurés, présentant typiquement une coloration blanchâtre caractéristique, et sont susceptibles d’altérer significativement la surface cutanée. La classification moderne distingue trois entités cliniques principales selon leur extension anatomique et leur présentation morphologique.
La calcinose cutanée constitue le terme générique englobant l’ensemble des dépôts calciques affectant les structures cutanées, indépendamment de leur localisation ou de leur étendue. Cette dénomination générale permet d’identifier le processus pathologique fondamental sans préjuger de ses caractéristiques spécifiques.
La calcinose circumscripta représente une forme clinique localisée, caractérisée par des dépôts calciques circonscrits, fréquemment observés dans les régions péri-articulaires ou à proximité des extrémités. Cette localisation préférentielle suggère l’intervention de facteurs mécaniques locaux dans la genèse de ces lésions.
La calcinose universalis constitue la forme la plus extensive et la plus sévère, caractérisée par une atteinte diffuse affectant non seulement les structures cutanées mais également les tissus sous-cutanés, musculaires et tendineux. Cette forme systémique s’associe généralement à un pronostic plus réservé et nécessite une prise en charge multidisciplinaire complexe.
Fondements Physiopathologiques et Classification Moderne des Calcinoses
La taxonomie actuelle des calcinoses cutanées s’articule autour de cinq entités physiopathologiques distinctes, chacune répondant à des mécanismes biologiques spécifiques. Cette stratification constitue le socle de toute démarche thérapeutique rationnelle, car elle détermine l’orientation diagnostique et conditionne les choix thérapeutiques.
La calcinose dystrophique
Elle occupe une position centrale en dermatologie vétérinaire. Son développement survient exclusivement sur des tissus préalablement altérés par des processus inflammatoires, nécrotiques ou dégénératifs, dans un contexte métabolique physiologique caractérisé par une normocalcémie et une normophosphatémie. Les dommages tissulaires initiaux déclenchent une cascade moléculaire complexe impliquant la libération de protéines cellulaires à affinité phosphatique, notamment les protéines mitochondriales, qui favorisent la formation de foyers de nucléation cristalline, puis la précipitation progressive de composés calciques autour des structures fibrillaires du derme, notamment les fibres de collagène et d’élastine.
En médecine humaine, cette forme représente la manifestation la plus fréquente et concerne jusqu’à 70% des enfants atteints de dermatomyosite. Les connectivites constituent les étiologies principales, incluant la sclérodermie, la dermatomyosite, le lupus érythémateux et les connectivites mixtes. Les processus infectieux, néoplasiques et certaines dermatoses héréditaires comme le syndrome d’Ehlers-Danlos complètent le spectre étiologique de cette forme.
La Calcinose Métastatique
Elle procède d’un mécanisme radicalement différent, impliquant la précipitation calcique dans des tissus structurellement intacts. Cette forme résulte directement d’anomalies métaboliques systémiques provoquant une hypercalcémie, une hyperphosphatémie, ou les deux simultanément. L’hyperparathyroïdie, qu’elle soit primaire ou secondaire, constitue le principal facteur déclenchant par l’intermédiaire de trois voies métaboliques convergentes : l’activation de la résorption ostéoclastique, l’augmentation de la réabsorption tubulaire rénale du calcium, et la stimulation indirecte de la synthèse de calcitriol qui intensifie l’absorption intestinale calcique.
Le concept de produit phosphocalcique revêt ici une importance capitale. Lorsque ce produit (calcium sérique × phosphore sérique) franchit le seuil critique de 70 mg²/dL², des phénomènes de cristallisation spontanée s’amorcent dans diverses structures organiques. Bien que les organes viscéraux (estomac, poumons, reins, myocarde) constituent les cibles privilégiées, la peau peut également être affectée, bien que plus rarement.
Formes Particulières et Émergentes
La calcinose idiopathique représente une entité énigmatique caractérisée par l’absence de toute anomalie métabolique décelable et de lésion tissulaire préexistante. Cette forme soulève des interrogations fondamentales concernant l’existence de mécanismes physiopathologiques encore méconnus ou de prédispositions génétiques latentes. En médecine humaine, cette catégorie inclut la calcinose tumorale (tumoral calcinosis), les nodules calcifiés sous-épidermiques et la calcinose scrotale.
La calcinose iatrogène résulte directement d’interventions ou de traitements médicaux spécifiques. L’administration locale ou systémique de produits contenant du calcium ou du phosphate, comme le gluconate de calcium, peut provoquer des dépôts calciques localisés. La supplémentation excessive en vitamine D constitue également un facteur de risque reconnu, particulièrement chez les animaux recevant des compléments nutritionnels non contrôlés.
La calciphylaxie constitue indéniablement la forme la plus redoutable. Cette entité se distingue par la calcification sélective de la média des artérioles dermiques et hypodermiques, générant un processus ischémique progressif. Les conséquences cliniques s’avèrent dramatiques : nécroses cutanées extensives, délabrements tissulaires, surinfections septiques récurrentes et mortalité élevée. Cette forme demeure étroitement associée aux stades terminaux d’insuffisance rénale chronique et s’observe particulièrement chez les patients dialysés en médecine humaine.
Mécanismes Physiopathologiques Détaillés de la Calcinose Dystrophique
Dans la calcinose dystrophique, les taux sériques de calcium et de phosphate demeurent dans les limites physiologiques normales. Le processus pathologique s’initie par des dommages tissulaires qui entraînent la libération massive de protéines intracellulaires, notamment les protéines mitochondriales dotées d’une affinité particulière pour le phosphate. Ces protéines agissent comme des centres de nucléation, favorisant la précipitation locale des sels calciques.
L’hypoxie tissulaire locale, conséquence directe des lésions initiales, crée un environnement favorable à la calcification. L’inflammation chronique entretient ce processus par la libération soutenue de cytokines pro-inflammatoires, particulièrement le TNF-α, l’IL-6 et l’IL-1β. Ces médiateurs inflammatoires amplifient la réponse tissulaire locale et pérennisent les conditions propices à la minéralisation pathologique.
La formation de cristaux intracellulaires constitue un événement délétère majeur, conduisant inéluctablement à la nécrose cellulaire. Cette mort cellulaire libère de nouveaux foyers de nucléation et entretient un cercle vicieux auto-entretenu de calcification progressive. Le processus s’étend graduellement aux structures adjacentes, particulièrement les fibres de collagène et d’élastine du derme, créant les lésions caractéristiques observées cliniquement.
Épidémiologie et Particularités Étiologiques en Médecine Vétérinaire Canine
Distribution Étiologique et Données Quantitatives
L’analyse épidémiologique révèle une répartition étiologique particulièrement caractéristique en médecine vétérinaire canine. Une étude rétrospective d’envergure a permis d’établir avec précision la distribution des causes sous-jacentes, révélant des patterns distincts de ceux observés en médecine humaine.
L’hypercorticisme domine massivement le paysage étiologique, représentant approximativement 80% de l’ensemble des cas observés. Cette prédominance s’explique par la fréquence des corticothérapies systémiques en médecine vétérinaire et par l’incidence non négligeable des syndromes de Cushing spontanés dans l’espèce canine. Au sein de cette catégorie majoritaire, l’hypercorticisme iatrogène, conséquence directe de traitements corticoïdes prolongés, constitue environ 70% des cas, tandis que les hypercorticismes endogènes (hypophysaires et surrénaliens) représentent les 30% restants.
Cette prédominance de l’hypercorticisme iatrogène s’explique par l’utilisation fréquente des corticostéroïdes en médecine vétérinaire pour le traitement de diverses affections inflammatoires, allergiques et auto-immunes. La facilité d’accès à ces molécules et leur efficacité thérapeutique immédiate favorisent parfois leur prescription prolongée, créant les conditions propices au développement de calcinoses cutanées.
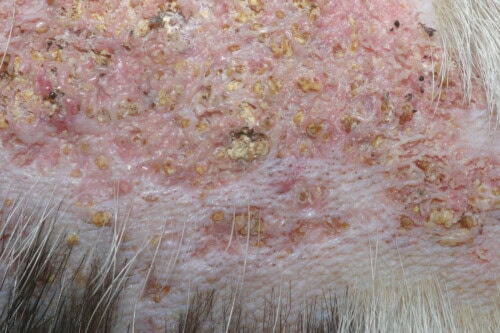
Calcinose cutanée : Vue rapprochée
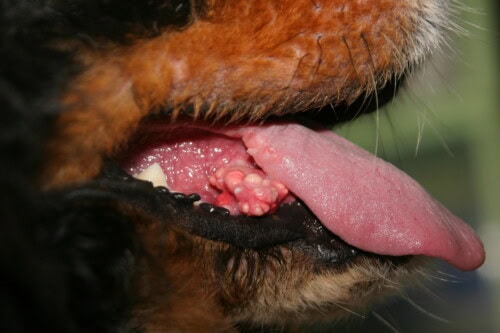
Calcinose cutanée : Lésions sous linguales
Causes Minoritaires et Situations Particulières
L’insuffisance rénale chronique occupe la seconde position étiologique avec approximativement 10% des cas documentés. Cette proportion relativement modeste s’explique par la prédilection des dépôts calciques métastatiques pour les tissus mous viscéraux plutôt que pour les structures cutanées dans cette pathologie. Néanmoins, les formes cutanées, lorsqu’elles surviennent, s’associent généralement à des stades avancés de la maladie rénale et constituent un indicateur pronostique défavorable.
Le dernier décile regroupe un ensemble hétérogène d’étiologies rares mais cliniquement significatives. La calcinose dystrophique post-traumatique peut survenir consécutivement à des traumatismes répétés ou à des lésions mécaniques chroniques, particulièrement dans les zones soumises à des frictions récurrentes ou à des pressions mécaniques soutenues.
Les formes post-inflammatoires s’observent parfois dans le contexte d’infections systémiques sévères, particulièrement les mycoses profondes comme la blastomycose ou l’histoplasmose, et certaines leptospiroses. Ces infections créent un état inflammatoire systémique propice au développement de lésions de calcification dystrophique.
La calcinose idiopathique, bien que rare, mérite une attention particulière car elle soulève des questions fondamentales sur notre compréhension des mécanismes physiopathologiques. L’absence de cause sous-jacente identifiée suggère l’existence de facteurs prédisposants génétiques ou environnementaux encore méconnus.
Les calcinoses iatrogènes non corticoïdes, liées aux perfusions de solutés calciques ou aux supplémentations vitaminiques excessives, complètent ce tableau étiologique. Ces formes évitables soulignent l’importance d’une surveillance attentive lors de l’administration de traitements potentiellement calcifiants.
Considérations Raciales et Prédispositions
Bien qu’aucune exclusivité raciale ne soit établie de manière formelle, certaines observations cliniques suggèrent une prédisposition des races de grande taille. Cette tendance pourrait s’expliquer par une susceptibilité accrue aux pathologies endocriniennes, notamment l’hyperadrénocorticisme, ou par des différences dans les pratiques thérapeutiques selon la taille des animaux.
Le Bulldog anglais fait l’objet d’une attention particulière dans la littérature vétérinaire, certaines données suggérant une prédisposition spécifique dans cette race. Cette susceptibilité pourrait être liée aux particularités anatomiques de la race, notamment les plis cutanés nombreux créant des microtraumatismes répétés, ou à des facteurs génétiques spécifiques encore non élucidés.
Les races brachycéphales dans leur ensemble pourraient présenter une prédisposition relative, possiblement en relation avec leur propension aux troubles respiratoires chroniques nécessitant des traitements anti-inflammatoires prolongés. Cette hypothèse nécessite cependant des études épidémiologiques plus approfondies pour être confirmée.
Sémiologie Clinique et Approche Diagnostique Contemporaine
Polymorphisme des Manifestations Cliniques
La présentation clinique des calcinoses cutanées canines se caractérise par un polymorphisme remarquable, reflétant la diversité des mécanismes physiopathologiques sous-jacents et l’hétérogénéité des réponses tissulaires individuelles. Cette variabilité sémiologique constitue parfois un défi diagnostique considérable, nécessitant une approche clinique méthodique et expérimentée.
La localisation anatomique privilégie classiquement la région dorsale, constituant le site d’atteinte le plus fréquemment observé. Cependant, l’atteinte peut s’étendre aux zones ventrales glabres, particulièrement l’abdomen et la région inguinale, aux plis cutanés où les phénomènes de macération favorisent l’inflammation locale, à la région cervicale et aux aisselles. Cette distribution topographique non aléatoire suggère l’intervention de facteurs mécaniques locaux, notamment les frictions et les pressions répétées, ou de particularités vasculaires régionales dans le développement et la progression des lésions.
Les zones de prédilection correspondent souvent aux régions soumises à des contraintes mécaniques particulières ou présentant des caractéristiques anatomiques spécifiques. Les plis cutanés, par exemple, créent un microenvironnement humide et chaud propice à l’inflammation chronique, tandis que les zones de contact avec le sol ou les surfaces de couchage subissent des traumatismes répétés de faible intensité.
Caractéristiques Morphologiques des Lésions
L’aspect lésionnel présente deux phénotypes principaux distincts, chacun correspondant probablement à des stades évolutifs différents ou à des mécanismes physiopathologiques spécifiques. Le premier phénotype se manifeste par des plaques fermes à franchement dures, arborant une coloration jaunâtre caractéristique et circonscrites par un bourrelet érythémateux marqué témoignant de l’intense réaction inflammatoire périlésionnelle. Cette présentation correspond généralement aux stades aigus ou subaigus du processus pathologique.
Le second phénotype correspond à des plaques alopéciques étendues, remarquablement indurées, présentant une teinte rosée intense évocatrice d’une inflammation chronique sous-jacente. Ces lésions témoignent généralement d’une évolution plus prolongée et d’une chronicisation du processus inflammatoire local.
La palpation révèle une consistance caractéristique, oscillant entre la fermeté marquée et la dureté franchement pierreuse selon le degré de minéralisation. Cette induration constitue un élément sémiologique pathognomonique, permettant de différencier les calcinoses des autres dermatoses inflammatoires chroniques.
La surface lésionnelle peut présenter diverses altérations : hyperkératose localisée, formation de croûtes superficielles, exsudation de composition variable, et dans les cas les plus évolués, ulcération franche avec exposition du derme sous-jacent. La présence d’un exsudat purulent témoigne généralement d’une surinfection bactérienne secondaire.
Signes Pathognomoniques et Évolution Lésionnelle
L’évolution lésionnelle suit généralement un pattern prévisible, bien que la chronologie puisse varier considérablement d’un individu à l’autre. Les phases initiales s’accompagnent fréquemment de croûtes superficielles et d’un exsudat de composition variable, allant d’un simple suintement séreux à un écoulement purulent en cas de surinfection.
Un signe pathognomonique particulièrement évocateur réside dans l’extrusion spontanée de matériel crayeux blanchâtre à travers l’épiderme. Ce phénomène correspond à l’élimination transcutanée des cristaux calciques et constitue un élément diagnostique de première importance. L’observation de ce matériel cristallin, facilement reconnaissable par sa texture et sa coloration caractéristiques, permet souvent d’établir le diagnostic avec une quasi-certitude.
L’ulcération représente une complication courante, particulièrement dans les formes sévères ou négligées. Ces ulcères présentent des caractéristiques spécifiques : bords surélevés et indurés, fond anfractueux tapissé de tissu de granulation, tendance à la chronicisation et résistance aux traitements cicatrisants conventionnels.
Durant la phase de résolution, observée principalement après correction de la cause sous-jacente, les lésions subissent une transformation progressive de leur aspect. La composante inflammatoire s’atténue graduellement, se traduisant par une diminution de l’érythème périlésionnel et de la sensibilité locale. La coloration évolue vers des tonalités grisâtres plus ternes, témoignant de la normalisation progressive des processus tissulaires locaux. Cependant, l’induration peut persister pendant des mois, voire définitivement dans certains cas.
Complications Infectieuses et Évolution
Les surinfections bactériennes secondaires constituent une complication quasi-constante, favorisées par l’altération de la barrière épidermique et par l’environnement inflammatoire local qui compromet les mécanismes de défense naturels. Ces surinfections peuvent masquer les lésions sous-jacentes et compliquer significativement l’évaluation diagnostique.
La flore bactérienne impliquée comprend classiquement les staphylocoques et les streptocoques, mais des germes opportunistes plus résistants peuvent coloniser les lésions chroniques. L’identification précise de ces agents pathogènes par culture bactérienne et antibiogramme s’avère souvent nécessaire pour adapter l’antibiothérapie locale ou systémique.
La présence de matériel calcique dans les tissus crée un environnement particulièrement propice au développement de biofilms bactériens, structures tridimensionnelles complexes qui protègent les micro-organismes de l’action des antimicrobiens et des mécanismes de défense de l’hôte. Cette particularité explique la résistance fréquente aux traitements antibiotiques conventionnels et la tendance à la récidive des surinfections.
Stratégie Diagnostique Différentielle
L’établissement du diagnostic de calcinose repose principalement sur la reconnaissance des patterns cliniques caractéristiques et sur l’analyse du contexte anamnestique. La pyodermite profonde chronique ou récidivante constitue le principal piège diagnostique, d’autant que les deux affections peuvent coexister et se potentialiser mutuellement.
Plusieurs éléments permettent d’orienter le diagnostic différentiel : la consistance particulièrement dure des lésions de calcinose contraste avec la consistance plus molle des pyodermites, l’extrusion de matériel crayeux constitue un signe pathognomonique de calcinose, et le contexte anamnestique (corticothérapie, syndrome de Cushing) oriente fortement vers une calcinose.
D’autres affections peuvent occasionnellement prêter à confusion : les granulomes à corps étrangers, les tumeurs cutanées calcifiées, les kystes sébacés infectés, ou les panniculites chroniques. La prise en compte de l’ensemble des éléments cliniques et anamnestiques permet généralement de lever ces ambiguïtés diagnostiques.
La cytologie cutanée s’avère particulièrement précieuse pour caractériser les surinfections bactériennes concomitantes et orienter les choix antimicrobiens locaux. Bien que ne permettant pas la confirmation formelle du diagnostic de calcinose, cet examen contribue à l’évaluation globale de l’état lésionnel et guide les décisions thérapeutiques complémentaires. L’observation de cristaux calciques lors de l’examen cytologique peut renforcer la suspicion diagnostique.
Dans certains cas complexes ou atypiques, l’histopathologie cutanée peut s’avérer nécessaire pour confirmer le diagnostic et caractériser précisément le type de calcinose. Cet examen permet d’objectiver la présence de dépôts calciques dans les structures dermiques et d’évaluer l’intensité de la réaction inflammatoire associée.
Stratégies Thérapeutiques Actuelles et Limitations
Principe Fondamental : Correction de la Cause Primaire
La prise en charge thérapeutique des calcinoses cutanées repose sur un principe cardinal : l’identification et la correction de la cause sous-jacente constituent l’étape fondamentale, conditionnant l’ensemble du pronostic. Cette approche étiologique prime sur toute considération symptomatique et détermine les chances de régression lésionnelle à moyen et long terme.
Dans le contexte majoritaire de l’hypercorticisme iatrogène, cette démarche implique l’arrêt progressif et soigneusement contrôlé de la corticothérapie. Cette décroissance doit être adaptée à la durée du traitement antérieur, aux doses utilisées et à la pathologie initialement traitée. Un sevrage trop brutal expose au risque d’insuffisance surrénalienne iatrogène, particulièrement redoutable après des traitements prolongés à doses élevées.
Le protocole de décroissance doit tenir compte de la demi-vie biologique des corticostéroïdes utilisés et de la durée de suppression de l’axe hypothalamo-hypophyso-surrénalien. Généralement, une réduction de 25 à 50% de la dose toutes les deux semaines constitue un compromis acceptable entre efficacité et sécurité. Dans certains cas, une substitution par des anti-inflammatoires alternatifs (immunosuppresseurs, biothérapies) peut faciliter le sevrage corticoïde.
La régression des lésions cutanées s’observe effectivement après correction de la cause primaire, mais son ampleur demeure imprévisible, oscillant entre une résolution complète et une amélioration seulement partielle. Les facteurs influençant cette variabilité incluent la durée d’évolution des lésions avant traitement, l’intensité de l’exposition aux corticostéroïdes, et la capacité de régénération tissulaire individuelle.
Soins Locaux et Gestion des Complications
L’antisepsie locale constitue un pilier thérapeutique incontournable dans la prise en charge des calcinoses cutanées. L’application rigoureuse d’antiseptiques topiques, particulièrement la chlorhexidine à concentration adaptée (0,5 à 2% selon la tolérance locale), s’avère fondamentale pour contrôler les surinfections bactériennes secondaires et maintenir un environnement local propice à la cicatrisation.
Cette approche préventive permet de limiter les complications infectieuses qui peuvent masquer l’évolution naturelle des lésions et compromettre l’évaluation de l’efficacité thérapeutique. La chlorhexidine présente l’avantage d’une excellente tolérance locale et d’un spectre antimicrobien large, incluant les bactéries gram-positives et gram-négatives habituellement impliquées dans les surinfections cutanées.
D’autres antiseptiques peuvent être utilisés en alternative ou en rotation : la povidone iodée, particulièrement efficace mais potentiellement irritante, les dérivés chlorés à faible concentration, ou les antiseptiques à base d’argent pour les lésions ulcérées résistantes. L’alternance des antiseptiques peut prévenir le développement de résistances bactériennes.
L’antibiothérapie systémique demeure rarement indiquée dans la prise en charge de routine, sauf en cas de septicémie avérée, de surinfection extensive avec signes systémiques, ou d’échec des traitements antiseptiques locaux. Lorsqu’elle s’avère nécessaire, le choix de l’antibiotique doit être guidé par une culture bactérienne et un antibiogramme, compte tenu de la fréquence des résistances dans ce contexte.
L’utilisation d’agents kératomodulateurs et émollients peut faciliter le ramollissement des zones hyperkératosiques et croûteuses, améliorant ainsi le confort de l’animal et favorisant l’élimination des débris superficiels. Ces topiques, incluant l’urée, l’acide salicylique à faible concentration, ou les céramides, contribuent également à la restauration progressive de la souplesse cutanée dans les zones périphériques aux lésions.
Les pansements occlusifs peuvent être bénéfiques pour maintenir l’hydratation locale et protéger les lésions ulcérées des traumatismes mécaniques. Cependant, leur utilisation nécessite une surveillance attentive pour prévenir la macération excessive qui favoriserait les surinfections.
Approches Chirurgicales Sélectives
L’exérèse chirurgicale conserve sa pertinence pour des lésions uniques, très localisées et sources d’inconfort majeur pour l’animal. Cette option thérapeutique doit être soigneusement évaluée en fonction de plusieurs critères : la taille et la localisation des lésions, l’état général de l’animal, la faisabilité technique de l’exérèse, et les perspectives de cicatrisation.
Les avantages de l’approche chirurgicale incluent la résolution immédiate des lésions problématiques, la possibilité d’analyse histopathologique de confirmation, et l’amélioration rapide du confort de l’animal. Cependant, les inconvénients comprennent les risques anesthésiques, particulièrement chez les animaux présentant un hypercorticisme avec ses complications cardiovasculaires et métaboliques, et le risque de troubles de cicatrisation liés à l’hypercorticisme.
Le laser CO2 peut constituer une alternative intéressante pour certaines situations particulières. Cette technique présente l’avantage d’une meilleure hémostase, d’une précision de coupe supérieure, et potentiellement d’une cicatrisation améliorée. Cependant, son accessibilité demeure limitée et son utilisation nécessite une expertise technique spécifique.
Les techniques de chirurgie reconstructrice peuvent s’avérer nécessaires pour les lésions étendues, particulièrement dans les zones où la fermeture primaire s’avère impossible. Les lambeaux cutanés locaux ou les greffes peuvent être envisagés, bien que l’hypercorticisme compromette souvent la prise des greffes.
Le Diméthylsulfoxyde : Efficacité Controversée et Limites
Le DMSO, solvant organique aux propriétés anti-inflammatoires reconnues, notamment par piégeage des radicaux libres et inhibition de certaines voies inflammatoires, bénéficie d’une utilisation historique dans le traitement des calcinoses. Sa capacité de pénétration tissulaire remarquable, liée à sa structure moléculaire particulière, en fait théoriquement un candidat intéressant pour cette indication topique.
Les propriétés physicochimiques du DMSO expliquent son intérêt potentiel : poids moléculaire faible facilitant la diffusion transcutanée, capacité de solubilisation de nombreuses substances, propriétés anti-inflammatoires par inhibition de la polymérisation des radicaux libres, et effet antalgique local par blocage des fibres nerveuses de petit calibre.
Cependant, son efficacité réelle reste à démontrer par des études contrôlées rigoureuses. La difficulté d’évaluation provient du fait que les calcinoses peuvent régresser spontanément une fois la cause primaire corrigée, rendant complexe l’attribution des améliorations observées au traitement par DMSO. Le mécanisme d’action exact dans ce contexte demeure énigmatique : dissolution directe des cristaux calciques, effet anti-inflammatoire non spécifique, amélioration de la microcirculation locale, ou simple effet placebo.
L’absence de protocole standardisé constitue une limitation majeure qui compromet l’évaluation objective de cette thérapeutique. La littérature rapporte des schémas thérapeutiques extrêmement variables, depuis trois à quatre applications quotidiennes pendant deux semaines maximum jusqu’à une application bihebdomadaire sur plusieurs semaines selon certains rapports de cas. Les recommandations de Muller & Kirk préconisent deux applications quotidiennes sans précision de durée, tandis que d’autres sources suggèrent une application tous les deux jours sur plusieurs semaines.
Cette hétérogénéité protocolaire reflète l’absence de données probantes solides et la nature empirique de cette utilisation. L’établissement d’un protocole standardisé nécessiterait des études cliniques contrôlées randomisées comparant différents schémas thérapeutiques à un placebo.
Les effets secondaires potentiels imposent une vigilance particulière et limitent l’usage de cette molécule. Pour l’applicateur, le port de gants en caoutchouc épais s’avère indispensable pour éviter l’absorption percutanée qui peut provoquer des effets systémiques indésirables. L’inhalation des vapeurs doit également être évitée, nécessitant une ventilation adéquate des locaux d’application.
Chez l’animal traité, des réactions locales diverses ont été rapportées : sensation de brûlure immédiate après application, érythème et œdème transitoires, sécheresse cutanée et desquamation, et dans certains cas, aggravation paradoxale de l’inflammation locale. Les effets oculaires en cas d’utilisation prolongée ou à forte dose incluent des modifications du cristallin et des troubles de l’accommodation. Un malaise général non spécifique peut également survenir, particulièrement lors d’applications sur des surfaces étendues.
Les données concernant une éventuelle néphrotoxicité ou hépatotoxicité demeurent contradictoires et insuffisamment étayées. Certains rapports suggèrent des altérations des paramètres hépatiques lors d’utilisations prolongées, tandis que d’autres études ne retrouvent aucune toxicité systémique significative. Cette incertitude impose une surveillance clinique et biologique chez les animaux traités de manière prolongée.
En cas d’utilisation sur de larges surfaces cutanées, une approche prudente consistant à traiter de petites zones de manière séquentielle est fortement recommandée pour minimiser les risques d’absorption systémique et d’effets indésirables. Cette stratégie permet également d’évaluer la tolérance locale avant d’étendre le traitement.
Diversité des Approches Pharmacologiques Humaines
La médecine humaine a développé un arsenal thérapeutique substantiel pour la prise en charge des calcinoses, ciblant différents mécanismes physiopathologiques. Ces approches multiples offrent des perspectives intéressantes pour une transposition en médecine vétérinaire, bien qu’aucune évaluation systématique n’ait encore été entreprise dans l’espèce canine. L’absence de traitement standard universellement efficace en médecine humaine souligne la complexité de cette pathologie et la nécessité d’approches individualisées.
Les stratégies thérapeutiques humaines visent plusieurs mécanismes : inhibition de la formation des cristaux calciques, amélioration de leur solubilisation dans les tissus, diminution de l’inflammation locale et systémique, ou modulation des voies métaboliques du calcium et du phosphate. Cette approche multimodale permet d’adapter le traitement aux mécanismes physiopathologiques prédominants dans chaque cas particulier.
Le diltiazem, antagoniste calcique
Il inhibe l’entrée du calcium intracellulaire par blocage des canaux calciques voltage-dépendants de type L. Cette action pourrait théoriquement limiter les processus de calcification tissulaire en réduisant la disponibilité du calcium intracellulaire pour la formation de cristaux. La posologie humaine de 2 à 4 mg/kg/jour présente une toxicité limitée, principalement cardiovasculaire (hypotension, bradycardie), mais l’innocuité en usage prolongé chez le chien demeure non documentée.
L’utilisation du diltiazem en médecine vétérinaire cardiologique, notamment pour le traitement de la cardiomyopathie hypertrophique féline, suggère une tolérance acceptable. Cependant, l’adaptation posologique et la surveillance des effets secondaires nécessiteraient des études spécifiques pour l’indication calcinose.
Bisphosphonates : Modulateurs de l’Activité Macrophagique
Les bisphosphonates (alendronate, pamidronate, étidronate) exercent leur action par inhibition de l’activité macrophagique et de la résorption calcique osseuse. Ces molécules, analogues structuraux du pyrophosphate, se fixent préférentiellement sur l’hydroxyapatite et interfèrent avec les processus de minéralisation et de déminéralisation.
Leur efficacité a été documentée dans plusieurs connectivites humaines, particulièrement la sclérodermie et la dermatomyosite, où ils réduisent significativement la taille et le nombre des dépôts calciques. Le mécanisme d’action implique probablement une inhibition de l’activité des macrophages tissulaires qui participent activement aux processus de calcification dystrophique.
Les effets secondaires potentiels incluent l’hypocalcémie, parfois sévère et nécessitant une supplémentation, la fièvre post-administration (particulièrement avec les formes intraveineuses), et l’ostéonécrose mandibulaire, complication rare mais grave observée principalement avec les bisphosphonates de troisième génération.
En médecine vétérinaire canine, leur usage demeure actuellement limité mais certaines molécules comme le pamidronate sont utilisées pour la gestion des douleurs osseuses métastatiques ou des ostéolyses tumorales. Cette expérience clinique limitée suggère une tolérance acceptable, mais nécessiterait une adaptation pour l’indication calcinose cutanée.
Agents Chélateurs et Modulateurs de Solubilité
Le sodium thiosulfate présente la propriété d’augmenter la solubilité calcique par formation de complexes solubles avec les ions calcium. Cette molécule peut être utilisée par voie topique, intralésionnelle ou intraveineuse selon les indications et la tolérance. Son mécanisme d’action implique une chélation directe du calcium tissulaire et une amélioration de sa mobilisation vers la circulation systémique.
Sa toxicité systémique notable comprend des nausées et vomissements, une hypocalcémie potentiellement sévère, et divers troubles électrolytiques incluant une hypomagnésémie et une hypokaliémie. Ces effets indésirables imposent une surveillance biologique étroite lors d’utilisations systémiques.
Bien qu’aucune utilisation actuelle ne soit rapportée chez le chien, des recherches pourraient être envisagées pour un usage local sous forme de gel ou de solution topique. Cette approche minimiserait les risques d’effets systémiques tout en conservant l’effet local recherché.
L’hydroxyde d’aluminium agit comme liant du phosphate au niveau intestinal et réduit l’absorption digestive de ce dernier. Cette action indirecte sur le métabolisme phosphocalcique pourrait présenter un intérêt dans les formes métastatiques de calcinose. Les doses humaines de 1,8 à 2,4 g/jour suggèrent une utilisation potentielle chez l’animal, mais cette application demeure non validée dans le contexte de la calcinose.
L’utilisation de cette molécule en médecine vétérinaire pour la gestion de l’hyperphosphatémie chez les insuffisants rénaux chroniques suggère une tolérance acceptable. Cependant, l’adaptation posologique et l’évaluation de l’efficacité spécifique nécessiteraient des études dédiées.
Antibiotiques aux Propriétés Anti-calcifiantes
La minocycline présente des propriétés multiples particulièrement intéressantes : inhibition des métalloprotéases matricielles (MMP) qui participent aux processus de remodelage tissulaire, chélation calcique directe par ses groupements fonctionnels, et réduction de l’inflammation par inhibition de l’activation microgliale et de la production de cytokines pro-inflammatoires.
La posologie humaine de 50 à 100 mg/jour ouvre des perspectives d’utilisation chez le chien, d’autant que cette molécule existe déjà dans certaines indications dermatologiques vétérinaires, notamment pour le traitement des pyodermites à germes résistants. Cette expérience clinique préexistante faciliterait l’adaptation posologique et la surveillance des effets secondaires.
Les métalloprotéases matricielles jouent un rôle crucial dans les processus de calcification dystrophique en dégradant la matrice extracellulaire et en libérant des facteurs favorisant la minéralisation. Leur inhibition par la minocycline pourrait donc présenter un intérêt thérapeutique direct.
La ceftriaxone offre un effet secondaire potentiellement bénéfique par inhibition des métalloprotéases matricielles, chélation du calcium par ses groupements β-lactame, et action anti-inflammatoire non spécifique. Cependant, les règles de prescription responsable des antibiotiques, particulièrement strictes pour les céphalosporines de troisième génération, interdisent formellement d’envisager son utilisation en médecine vétérinaire pour cette indication non infectieuse.
Cette restriction réglementaire souligne l’importance de développer des alternatives non antibiotiques pour éviter la contribution à l’antibiorésistance tout en explorant des voies thérapeutiques innovantes.
Modulateurs du Métabolisme Phosphocalcique
Le probenecid augmente l’excrétion rénale du phosphate par inhibition de sa réabsorption tubulaire. Son effet bénéfique a été documenté dans la dermatomyosite juvénile, où il réduit significativement les dépôts calciques cutanés. Cette molécule n’est actuellement pas utilisée en médecine vétérinaire, mais son mécanisme d’action pourrait présenter un intérêt pour les formes métastatiques de calcinose.
L’adaptation de cette approche en médecine vétérinaire nécessiterait des études pharmacocinétiques préalables pour déterminer les posologies appropriées et évaluer la tolérance dans l’espèce canine. Les effets secondaires humains incluent principalement des troubles digestifs et des réactions d’hypersensibilité.
La colchicine
Elle présente des propriétés anti-inflammatoires spécifiques par inhibition de la polymérisation des microtubules et modulation de l’activation des neutrophiles. Son utilisation en médecine vétérinaire demeure peu développée, mais quelques applications existent, notamment pour le traitement de la fièvre familiale du Shar-Pei.
Un rapport de cas particulièrement encourageant a documenté une nette amélioration de lésions de calcinose chez un chien traité avec de la colchicine à la dose utilisée pour la fièvre familiale du Shar-Pei (soit environ 0,01 à 0,03 mg/kg/jour). Bien que cette donnée demeure très préliminaire et ne constitue qu’une observation isolée, elle illustre l’intérêt potentiel d’agents anti-inflammatoires ciblés et souligne la nécessité de mener des études cliniques pour évaluer rigoureusement ces nouvelles options.
Le mécanisme d’action de la colchicine dans ce contexte pourrait impliquer une inhibition de l’activation des inflammasomes, complexes multiprotéiques responsables de la maturation de l’IL-1β et de l’IL-18, cytokines clés dans les processus de calcification dystrophique.
Cette observation préliminaire avec la colchicine ouvre des perspectives particulièrement intéressantes car elle démontre la faisabilité d’une approche pharmacologique spécifique en médecine vétérinaire. La tolérance apparemment satisfaisante et l’amélioration clinique observée justifient la mise en place d’études cliniques plus rigoureuses.
L’avantage de la colchicine réside dans son profil de sécurité bien établi chez le chien, grâce à son utilisation dans la fièvre familiale du Shar-Pei, et dans son mécanisme d’action spécifique sur les voies inflammatoires impliquées dans la calcification dystrophique.
Recommandations Pratiques et Algorithme Décisionnel
Démarche Diagnostique Structurée
La reconnaissance précoce des calcinoses repose sur un triptyque diagnostique : identification des patterns cliniques caractéristiques, analyse du contexte anamnestique et exclusion des diagnostics différentiels principaux. Cette approche systématique permet d’éviter les retards diagnostiques qui compromettent l’efficacité thérapeutique et d’optimiser la prise en charge précoce.
L’interrogatoire anamnestique doit être particulièrement minutieux, recherchant systématiquement les antécédents de corticothérapie (molécule, posologie, durée, voie d’administration), les signes d’hypercorticisme spontané (polyuro-polydipsie, polyphagie, alopécies bilatérales symétriques, amyotrophie, distension abdominale), et les pathologies susceptibles de provoquer des troubles du métabolisme phosphocalcique (insuffisance rénale chronique, tumeurs malignes, hyperparathyroïdie).
L’examen clinique doit être systématique et complet, ne se limitant pas aux lésions cutanées mais recherchant également les signes systémiques associés. La palpation attentive de l’ensemble du tégument permet d’identifier des lésions débutantes ou asymptomatiques qui orientent vers une atteinte plus diffuse.
L’évaluation de la cause sous-jacente doit être exhaustive et orientée par les données épidémiologiques. La recherche d’un hypercorticisme, qu’il soit iatrogène ou spontané, constitue la priorité absolue compte tenu de sa fréquence dominante. Cette évaluation inclut la mesure du cortisol basal, les tests de freination à la dexaméthasone, et éventuellement le dosage de l’ACTH endogène pour différencier les formes hypophysaires et surrénaliennes.
L’exploration de l’insuffisance rénale chronique s’impose en seconde intention, particulièrement chez les animaux âgés ou présentant des antécédents de néphropathie. Cette évaluation comprend la mesure de la créatinine et de l’urée sériques, l’analyse d’urine complète, et l’évaluation du métabolisme phosphocalcique (calcémie, phosphatémie, parathormone si disponible).
Stratégie Thérapeutique Hiérarchisée
La correction de la cause primaire demeure l’étape fondamentale incontournable, conditionnant l’ensemble du pronostic à moyen et long terme. Cette approche étiologique doit être privilégiée sur toute considération symptomatique, car elle détermine directement les chances de régression lésionnelle spontanée.
Dans le cas majoritaire de l’hypercorticisme iatrogène, l’arrêt progressif de la corticothérapie doit être planifié de manière individualisée selon la durée du traitement antérieur, les doses utilisées, et la pathologie initialement traitée. Un protocole de décroissance progressive sur 4 à 8 semaines minimise les risques d’insuffisance surrénalienne iatrogène tout en permettant une récupération de l’axe hypothalamo-hypophyso-surrénalien.
Pour les hypercorticismes spontanés, le traitement spécifique (trilostane, mitotane) ou chirurgical (surrénalectomie, hypophysectomie) doit être entrepris selon les recommandations établies pour ces pathologies. La gestion des calcinoses devient alors secondaire et suit généralement l’amélioration de l’hypercorticisme.
Les soins locaux antiseptiques constituent un complément indispensable pour prévenir les complications infectieuses et maintenir l’intégrité des tissus environnants. Cette approche préventive permet de préserver les conditions optimales pour la cicatrisation spontanée et d’éviter les facteurs aggravants.
Le protocole antiseptique recommandé comprend un nettoyage biquotidien des lésions avec une solution de chlorhexidine à 0,5-2% selon la tolérance locale, suivi d’un séchage soigneux et de l’application éventuelle d’un agent émollient. Cette routine doit être maintenue jusqu’à résolution complète des lésions.
L’utilisation de traitements spécifiques comme le DMSO doit être réservée aux cas sévères ou résistants, en respectant scrupuleusement les précautions d’emploi et en informant les propriétaires des incertitudes concernant l’efficacité réelle. Une approche séquentielle, traitant de petites zones successivement, minimise les risques d’effets systémiques tout en permettant une évaluation de la tolérance locale.
Critères de Surveillance et Indicateurs Pronostiques
L’évaluation de l’évolution lésionnelle nécessite des critères objectifs standardisés pour permettre une appréciation reproductible de l’efficacité thérapeutique. La photographie médicale sériée constitue un outil précieux pour documenter les modifications morphologiques et apprécier quantitativement l’évolution de la surface lésionnelle.
Les paramètres à surveiller incluent la taille des lésions (mesure bidimensionnelle), leur aspect (coloration, relief, induration), la présence de complications (ulcération, extrusion de matériel calcique, surinfection), et l’état général de l’animal (prurit, douleur, gêne fonctionnelle).
Un score lésionnel composite intégrant ces différents paramètres faciliterait l’évaluation standardisée et la comparaison inter-individuelle. Ce score pourrait inclure une cotation de 0 à 3 pour chaque paramètre (taille, induration, inflammation, ulcération) avec un score global maximal orientant vers la sévérité.
La surveillance des complications potentielles, particulièrement infectieuses, impose des examens cliniques réguliers à intervalles adaptés à la sévérité initiale. Un rythme hebdomadaire pour les formes sévères, bimensuel pour les formes modérées, et mensuel pour les formes mineures constitue un compromis raisonnable entre surveillance optimale et contraintes pratiques.
La cytologie cutanée répétée permet de détecter précocement les surinfections bactériennes et d’ajuster les protocoles antiseptiques. Cette surveillance microbiologique s’avère particulièrement importante pour les lésions ulcérées ou exsudatives qui présentent un risque infectieux majoré.
Gestion des Échecs Thérapeutiques
L’absence d’amélioration après 6 à 8 semaines de traitement étiologique bien conduit doit faire reconsidérer le diagnostic ou rechercher des facteurs aggravants méconnus. Cette situation impose une réévaluation complète incluant la vérification de la correction effective de la cause primaire et la recherche de comorbidités.
Les causes d’échec thérapeutique incluent la persistance d’un hypercorticisme résiduel (décroissance insuffisante, hypercorticisme spontané méconnu), la présence de complications infectieuses non contrôlées, ou l’existence de facteurs intrinsèques de résistance (chronicité excessive, troubles de la cicatrisation).
Dans ces situations d’impasse thérapeutique, l’utilisation de traitements adjuvants inspirés de la médecine humaine peut être envisagée en l’absence d’alternative. Cette approche compassionnelle nécessite une information éclairée des propriétaires sur le caractère expérimental de ces traitements et la nécessité d’une surveillance renforcée.
Prévention et Éducation
La prévention primaire des calcinoses iatrogènes repose sur l’utilisation raisonnée des corticostéroïdes : prescription à la dose minimale efficace, limitation de la durée de traitement, recherche d’alternatives thérapeutiques chaque fois que possible, et surveillance clinique régulière des patients sous corticothérapie prolongée.
L’éducation des propriétaires joue un rôle crucial dans la détection précoce des lésions et l’observance thérapeutique. Les conseils incluent la surveillance quotidienne de l’état cutané, la reconnaissance des signes d’alarme nécessitant une consultation urgente, et l’importance de la compliance au protocole thérapeutique prescrit.
La formation continue des praticiens sur les dernières avancées diagnostiques et thérapeutiques permettrait d’améliorer la qualité de la prise en charge et de réduire les retards diagnostiques. Cette formation devrait inclure la reconnaissance des formes atypiques et la connaissance des nouvelles options thérapeutiques.
Conclusion et Perspectives d’Avenir
La calcinose cutanée canine représente un modèle exemplaire de pathologie dermatologique nécessitant une approche multidisciplinaire intégrant dermatologie, endocrinologie et médecine interne. La compréhension approfondie des mécanismes physiopathologiques sous-jacents et l’identification précise des causes étiologiques constituent les fondements d’une prise en charge optimale qui conditionne directement le pronostic fonctionnel et esthétique.
La prédominance écrasante de l’hypercorticisme dans l’étiologie des calcinoses canines, contrastant avec la diversité des causes observées en médecine humaine, souligne les particularités épidémiologiques de cette affection dans l’espèce canine. Cette spécificité étiologique simplifie relativement l’approche diagnostique mais ne doit pas faire négliger les formes minoritaires qui nécessitent des stratégies thérapeutiques adaptées.
Les limitations actuelles de l’arsenal thérapeutique vétérinaire contrastent de manière frappante avec la richesse des options développées en médecine humaine. Cette disparité souligne l’urgence de développer des programmes de recherche translationnelle pour évaluer l’efficacité et l’innocuité des approches pharmacologiques prometteuses dans l’espèce canine. L’expérience humaine offre un réservoir considérable d’innovations thérapeutiques qui mériteraient une adaptation et une validation en médecine vétérinaire.
L’absence d’études cliniques contrôlées demeure la principale limitation au progrès thérapeutique dans ce domaine. Cette lacune méthodologique perpétue l’utilisation de traitements empiriques et limite la capacité à établir des recommandations basées sur les preuves. La mise en place d’essais cliniques randomisés multicentriques constitue un impératif pour faire progresser les connaissances et améliorer la qualité des soins.
La recherche fondamentale sur les mécanismes moléculaires de la calcification cutanée canine pourrait révéler des particularités spécifiques à l’espèce et identifier de nouvelles cibles thérapeutiques. Cette approche mécanistique est indispensable pour développer des traitements rationnels et efficaces.