Les affections cutanées d’origine immunitaire chez le chat, bien que rares, présentent un défi diagnostique et thérapeutique pour les praticiens vétérinaires. Ces pathologies, caractérisées par une dysrégulation de la réponse immunitaire normale, peuvent se manifester par des signes cliniques variables, allant de l’érythème et l’alopécie aux érosions cutanées, avec ou sans prurit, mimant souvent d’autres affections dermatologiques plus courantes.
La familiarisation avec les caractéristiques cliniques distinctives des dermatoses d’origine immunitaire s’avère essentielle pour permettre un diagnostic précoce et précis, conduisant à une prise en charge thérapeutique appropriée. Cet article examine les principales affections cutanées immunitaires félines, notamment le complexe pemphigus, le lupus érythémateux cutané et les dermatites exfoliatives associées ou non au thymome, en détaillant leurs manifestations cliniques, approches diagnostiques, options thérapeutiques et pronostics.
Le pemphigus foliacé félin
Pathogenèse et signalement
Le pemphigus foliacé (PF), considéré comme la dermatose auto-immune la plus fréquente chez le chat, se caractérise par la liaison d’auto-anticorps pathogènes aux protéines d’adhésion desmosomales épidermiques. Cette liaison provoque une acantholyse et le recrutement de cellules inflammatoires, conduisant à la formation de vésicules dans l’épiderme superficiel. Contrairement aux humains et aux chiens, où les cibles desmosomales des auto-anticorps sont bien caractérisées, les investigations chez le chat se limitent à la détection d’IgG anti-kératinocytaires par immunofluorescence directe et indirecte. La cible desmosomale demeure actuellement inconnue, mais elle est probablement différente de celle du chien en raison de la détection d’un immunomarquage positif sur le tissu muqueux buccal.
Le PF a été rapporté chez différentes races félines (siamois, persan et croisé persan, burmese, etc.) sans prédisposition raciale ou sexuelle spécifique. Selon les séries de cas publiées, le PF affecte généralement les chats adultes avec un âge médian de 5-6 ans, bien que la fourchette varie entre 5 mois et 17 ans selon les études.
À l’instar du PF canin, la majorité des chats ne présentent pas de facteurs déclenchants sous-jacents associés au développement du PF. Historiquement, quelques rares cas de PF d’origine médicamenteuse ont été rapportés, et un cas unique a présenté simultanément une dermatite exfoliative associée à un thymome et un PF dans le cadre d’un syndrome paranéoplasique.
Approche diagnostique
Le diagnostic du PF félin repose actuellement sur une combinaison de critères comprenant : (i) l’anamnèse et la distribution caractéristique des lésions cutanées, (ii) l’exclusion d’autres dermatoses pustuleuses neutrophiliques acantholytiques (pyodermite staphylococcique superficielle, dermatophytose pustuleuse), et (iii) une cytologie et/ou histopathologie confirmant une dermatite pustuleuse acantholytique.
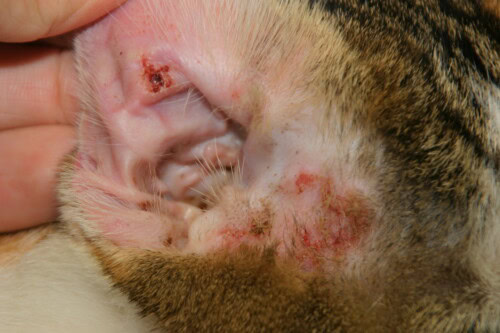
Les macules érythémateuses et les pustules représentent les lésions cutanées primaires du PF félin. Cependant, en raison de leur localisation épidermique superficielle, les pustules sont transitoires et évoluent rapidement vers des érosions et des croûtes, souvent les lésions les plus fréquemment observées lors de l’examen physique. Les zones les plus communément affectées comprennent la tête/face (planum nasal, paupières, menton), les pavillons auriculaires, les replis cutanés unguéaux, les coussinets plantaires et les zones périaréolaires. Lorsque le PF affecte les replis cutanés unguéaux, on observe généralement une formation importante de croûtes, avec accumulation d’exsudat purulent à caséeux et des érosions pouvant évoluer en ulcérations.
Le prurit est rapporté chez la plupart des chats atteints de PF, et certains patients présentent des signes systémiques comprenant léthargie, fièvre, perte de poids, lymphadénopathie et anorexie.
La présence d’acantholyse dans les lésions suspectes de PF peut être évaluée par cytologie (coloration standard Diff-Quik) à partir de pustules intactes, sous des croûtes humides récentes, ou à partir d’exsudat purulent dans les plis unguéaux et/ou par biopsie de ces lésions. La cytologie classique des lésions de PF révèle la présence de kératinocytes acantholytiques avec un nombre variable de neutrophiles et/ou d’éosinophiles bien conservés. L’examen histopathologique montre des pustules sous-cornées ou intragranulaires avec des kératinocytes acantholytiques et un infiltrat neutrophilique ou mixte neutrophilique et éosinophilique périvasculaire à interstitiel.
Au niveau clinique, un pemphigus foliacé peut mimer une dermatite allergique
Traitement et pronostic
Bien que la majorité des chats atteints de PF n’aient pas de facteur déclenchant sous-jacent (médicaments par exemple), l’élimination de tout facteur causal suspecté doit être mise en œuvre immédiatement. L’exposition aux rayons ultraviolets a été associée à l’exacerbation des lésions cutanées de PF chez l’homme et le chien. Bien qu’aucun cas de poussée induite par les UV n’ait été rapporté chez les chats atteints de PF, les propriétaires doivent être informés de ce facteur potentiellement aggravant.
La prise en charge thérapeutique du PF félin reste difficile et nécessite généralement des médicaments immunosuppresseurs pour obtenir une rémission clinique et un contrôle à long terme de la maladie. La monothérapie par glucocorticoïdes oraux a été considérée comme le pilier du traitement du PF félin (prednisolone 2-4 mg/kg/jour ; triamcinolone acétonide 0,2-2 mg/kg/jour ; dexaméthasone 0,1-0,2 mg/kg/jour). La prednisone, une prodrogue métabolisée en prednisolone active, n’est pas recommandée chez les chats en raison d’une absorption plus faible et/ou d’une conversion réduite de la prednisone en prednisolone.
Bien que la plupart des chats atteints de PF obtiennent une rémission complète (absence de nouvelles lésions avec guérison des lésions originales) dans les quelques semaines suivant une monothérapie par glucocorticoïdes, seule une minorité de chats (4-15 %) maintiennent cette rémission si l’administration de glucocorticoïdes est interrompue. Par conséquent, des adjuvants d’épargne cortisonique, tels que la ciclosporine (5-10 mg/kg/jour) et le chlorambucil (0,1-0,3 mg/kg/jour), ont été suggérés pour induire une rémission clinique plus précoce et assurer un contrôle à long terme du PF.
En général, le PF félin a un bon pronostic, la plupart des chats atteignant une rémission complète avec la prise en charge médicale (monothérapie par glucocorticoïdes) dans un délai médian de 22-36 jours. Toutefois, des récidives sous traitement d’entretien sont fréquentes, particulièrement lors de la réduction ou de l’arrêt du traitement. Contrairement aux chiens, les chats atteints de PF sont rarement euthanasiés en raison de la progression des lésions cutanées malgré le traitement, des effets indésirables associés au traitement ou d’une qualité de vie médiocre.
Le pemphigus vulgaris
Contrairement au PF, peu d’informations sont disponibles concernant le pemphigus vulgaris (PV) félin. Les caractéristiques cliniques et histopathologiques du PV félin ressemblent à celles du PV canin et humain; un mécanisme pathologique similaire de ciblage des anticorps desmosomaux est donc proposé pour le PV félin. Les investigations chez l’homme et le chien ont identifié la desmogléine-3 comme principal auto-antigène. Actuellement, les cibles des auto-anticorps dans les lésions cutanées du PV félin demeurent inconnues.
D’après les quelques cas rapportés dans la littérature, les vésicules flasques sont rarement observées dans le PV félin. En revanche, les érosions et ulcérations superficielles des jonctions muco-cutanées constituent les principales caractéristiques cliniques. Dans les cas rapportés, les lésions cutanées affectent fréquemment les lèvres, les gencives, le palais dur, le planum nasal et le philtrum; les lésions cutanées poilues et/ou des coussinets sont occasionnellement impliquées. Compte tenu de la localisation des lésions, léthargie, anorexie, halitose, hypersalivation et lymphadénopathie sous-mandibulaire sont communément observées.
Le diagnostic définitif repose sur l’anamnèse, les signes cliniques et la biopsie cutanée, qui montre une acantholyse suprabasale, la formation de clivages et une disposition en “pierres tombales” de la couche basale. Des biopsies multiples sont nécessaires pour capturer les zones diagnostiques du PV, les vésicules intactes et/ou les marges d’érosions à ulcères avec la peau adjacente “normale” étant généralement prélevées.
Le traitement des patients félins atteints de PV avec des glucocorticoïdes oraux (4-6 mg/kg/jour de prednisolone) ressemble à l’approche utilisée chez l’homme et le chien, et montre un certain succès dans le contrôle de la maladie. Cependant, dans les cas réfractaires de PV félin, des immunomodulateurs d’épargne cortisonique (chlorambucil, ciclosporine) doivent être envisagés, similairement au traitement du PF félin.
Le lupus érythémateux
Le lupus érythémateux cutané (LEC) peut n’affecter que la peau ou se présenter dans le cadre d’un ensemble diversifié de signes cliniques potentiellement mortels chez les patients atteints de lupus érythémateux systémique (LES). Contrairement à l’homme et au chien, le LES et les variantes du LEC comme le lupus érythémateux discoïde (LED) ont rarement été publiés chez le chat.
Un cas unique de LES (anémie, thrombocytopénie, anticorps antinucléaires positifs) avec des signes de LEC présentait une alopécie symétrique bien délimitée, des érosions à ulcérations et des croûtes sur le visage, les oreilles, le cou, le ventre, les membres et les coussinets plantaires. Les rapports originaux sur le LED félin décrivaient des signes cliniques d’érythème, desquamation, alopécie, érosions à ulcérations et croûtes avec ou sans dyspigmentation (hyperpigmentation ou dépigmentation) affectant la tête, les pavillons auriculaires, le tronc et les coussinets plantaires; aucune description plus récente n’a été publiée. En 2005, deux chats adultes atteints de LEC présentaient une dermatite exfoliative (alopécie, desquamation) et des érosions à ulcérations ressemblant aux lésions cutanées observées dans la dermatite exfoliative associée au thymome félin.
Dans les cas de LES/LEC félins décrits, l’examen histologique des biopsies cutanées a révélé une dermatite d’interface riche en lymphocytes spécifique du LEC avec dégénérescence vacuolaire (hydropique) des kératinocytes basaux, ainsi qu’une folliculite d’interface murale lymphocytaire. Le traitement des patients félins atteints de LES/LEC ressemble à l’approche utilisée chez l’homme et le chien, impliquant l’évitement du soleil, l’utilisation de glucocorticoïdes topiques/tacrolimus pour les lésions localisées et des médicaments immunomodulateurs systémiques pour les lésions généralisées.
Les dermatites exfoliatives associées ou non au thymome
Dermatite exfoliative associée au thymome
La dermatite exfoliative associée au thymome est un syndrome paranéoplasique rare où les signes cutanés sont fréquemment notés en premier, malgré la présence probable initiale du processus néoplasique. Les lésions cutanées non cancéreuses liées à une néoplasie surviennent à un site distinct de la tumeur primaire ou de ses métastases. Chez le chat, le thymome est la néoplasie thymique la plus courante, provenant des cellules épithéliales thymiques dans le médiastin crânial.
La pathogenèse de la dermatite exfoliative associée au thymome félin n’a pas été élucidée, mais on suspecte un processus à médiation immunitaire similaire à la maladie du greffon contre l’hôte. Il a été proposé que la dermatite exfoliative associée au thymome chez le chat résulte d’un processus médié par les lymphocytes T CD3+ causé par une présentation anormale d’antigènes par les cellules épithéliales thymiques néoplasiques qui réagissent de manière croisée avec les kératinocytes épidermiques.
Cette maladie affecte généralement les chats d’âge moyen à âgés, bien qu’elle ait été rapportée chez des chats aussi jeunes que 4 ans. Aucune prédisposition sexuelle ou raciale n’a été identifiée.
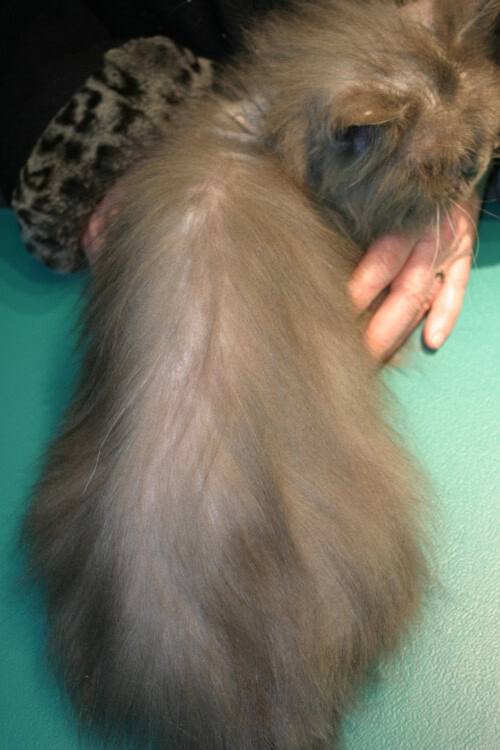
Chez les chats atteints de dermatite exfoliative associée au thymome, les lésions cutanées apparaissent d’abord sur la tête et les pavillons auriculaires, puis progressent graduellement vers le dos et le tronc avant de se généraliser. Ces zones deviennent progressivement squameuses. L’alopécie se développe à mesure que l’exfoliation s’intensifie et les lésions se généralisent selon un schéma asymétrique. Des débris séborrhéiques, bruns et cireux s’accumulent dans les plis unguéaux et entre les doigts. Le prurit n’est pas courant, mais les chats affectés peuvent devenir légèrement prurigineux.
Outre les signes cutanés, les chats atteints de dermatite exfoliative associée au thymome peuvent présenter une léthargie légère à sévère et des signes respiratoires et gastro-intestinaux, tels que dyspnée, toux, vomissements et régurgitation. Au moment de la présentation, ces signes sont généralement proportionnels à la taille de la masse médiastinale et s’intensifient à mesure que la masse augmente.
Le diagnostic de la dermatite exfoliative associée au thymome repose sur l’anamnèse, les résultats cliniques et histopathologiques, et la présence d’une masse médiastinale crâniale à l’examen d’imagerie. L’histopathologie montre : une orthokératose marquée à parakératose focale; une hyperplasie épidermique légère à modérée, avec dégénérescence hydropique des kératinocytes basaux et kératinocytes apoptotiques transépidermiques; une dermatite d’interface pauvre à riche en cellules composée principalement de lymphocytes CD3+ avec moins de plasmocytes et un faible nombre de mastocytes et de neutrophiles.
L’excision chirurgicale de la tumeur constitue le traitement de choix pour la majorité des chats suspects de dermatite exfoliative associée au thymome. Le pronostic pour les animaux présentant des thymomes non invasifs et résécables est bon, les lésions cutanées se résolvant progressivement après l’excision de la tumeur. Chez les chats traités par excision chirurgicale seule, un taux de survie global à 3 ans de 74 % a été observé. En revanche, les chats présentant des thymomes invasifs ont des taux de récidive plus élevés et, en postopératoire, une mortalité variant de 11 % à 22 %.
Alopécie diffuse dorsolombaire liée à un thymome
Dermatite exfoliative non associée au thymome
Un syndrome de dermatite exfoliative similaire à la dermatite exfoliative associée au thymome a été rapporté chez des chats, mais sans étiologie déterminée. Cette affection est appelée dermatite exfoliative non associée au thymome car les lésions cutanées et l’examen histopathologique sont indiscernables des cas de dermatite exfoliative associée au thymome. Chez les chats ayant bénéficié d’un suivi à long terme, aucun développement de thymome n’a été observé.
Comme pour la dermatite exfoliative associée au thymome, un processus à médiation immunitaire est suggéré pour la dermatite exfoliative non associée au thymome, avec infiltration de lymphocytes T CD3+ et cytotoxicité épidermique à l’examen histologique.
Pour tous les chats présentant une dermatite exfoliative, l’examen d’imagerie est crucial pour confirmer ou infirmer la présence d’une masse médiastinale crâniale, car le protocole de traitement change radicalement pour la dermatite exfoliative non associée au thymome.
Les chats atteints de dermatite exfoliative non associée au thymome répondent à un traitement immunosuppresseur, et la plupart des patients nécessitent un traitement à long terme pour maintenir la rémission. La majorité des cas atteignent une rémission avec la ciclosporine modifiée (6,75-7,5 mg/kg toutes les 24 heures) seule ou associée à la prednisolone (2-4 mg/kg toutes les 24 heures). Les rechutes peuvent survenir, particulièrement si le traitement immunosuppresseur est interrompu.
En conclusion, bien que les maladies cutanées à médiation immunitaire chez le chat soient rares, elles peuvent être associées à des signes cliniques systémiques graves, conduisant à une qualité de vie médiocre et parfois à l’euthanasie. Une connaissance approfondie des caractéristiques cliniques distinctives des différents troubles cutanés d’origine immunitaire est essentielle pour permettre un diagnostic précoce et précis, ainsi qu’un traitement approprié.
Banovic F, Gomes P, Trainor K. Feline immune-mediated skin disorders – Part 1. J Feline Med Surg. 2025;27:1-13.