Les dernières journées annuelles du GEDAC qui ont eu lieu à Ajaccio ont été l’occasion pour notre confrère Vincent Bruet, de faire le point sur les fistules périanales, leur pathogénie, leurs manifestations cliniques, et leurs approches thérapeutiques actuelles.
Les fistules périanales chez le chien représentent une affection dermatologique potentiellement invalidante qui, en l’absence de traitement approprié et rapide, peut entraîner des modifications irréversibles du rectum et de l’anus, conduisant parfois à l’euthanasie. Cette pathologie, également connue sous le nom de furonculose anale, affecte principalement les chiens de race Berger Allemand mais peut toucher d’autres races et se manifeste par des trajets fistulaires ou des ulcérations autour de l’anus.
Longtemps considérée comme étant liée à des facteurs anatomiques, la pathogénie des fistules périanales est aujourd’hui reconnue comme principalement immuno-médiée. La prise en charge thérapeutique a également évolué, passant d’une approche essentiellement chirurgicale à une stratégie principalement médicale. Cet article propose une synthèse des connaissances actuelles sur cette affection et présente les recommandations thérapeutiques basées sur une analyse méthodique de la littérature scientifique.
Pathogénie et aspects cliniques des fistules périanales canines
Une étiologie complexe et multifactorielle
La pathogénie exacte des fistules périanales reste partiellement élucidée, malgré de nombreuses études. Historiquement, plusieurs hypothèses ont été avancées pour expliquer l’apparition de cette affection. L’incidence élevée chez les Bergers Allemands a initialement fait suspecter un lien génétique, mais aucun marqueur génétique spécifique n’a été identifié à ce jour. De même, le port de queue bas a été considéré comme facteur prédisposant, théorie aujourd’hui réfutée puisque d’autres races sont affectées et l’amputation de la queue n’est pas efficace comme traitement.
Les recherches récentes orientent vers une pathogénie immuno-médiée. Des modifications de la réponse inflammatoire locale ont été mises en évidence, avec notamment une infiltration par des lymphocytes T CD31+ et une augmentation de l’expression des cytokines associées aux lymphocytes T helper de type 1 dans la peau lésionnelle. Ces mécanismes impliquent probablement:
- Une inflammation locale médiée par les lymphocytes T
- Une activation anormale des macrophages, avec surexpression des métalloprotéinases matricielles MMP-9 et MMP-13
- Une réponse immunitaire dysfonctionnelle aux microbes de la région périanale
- De possibles anomalies de cicatrisation au niveau périanal
- Une potentielle réaction d’hypersensibilité alimentaire, bien que cette hypothèse reste à confirmer
Une étude génétique a mis en évidence une association entre l’allèle de classe II du CMH DLA-DRB1*00101 et un risque accru de développer des fistules périanales chez les Bergers Allemands. Les molécules de classe II du complexe majeur d’histocompatibilité participent à la présentation d’antigènes et à l’activation des lymphocytes T, ce qui renforce l’hypothèse d’une pathogénie immuno-médiée. Une autre étude a révélé une association potentielle avec les régions géniques ADAMTS16 et CTNND2, cette dernière étant également associée à la maladie de Crohn et à la colite ulcéreuse chez l’homme.
Présentation clinique et signalement
Prédisposition raciale et âge d’apparition
Les fistules périanales affectent principalement les chiens de race Berger Allemand, qui représenteraient plus de 80% de la population touchée selon certaines études. Toutefois, plusieurs autres races peuvent être affectées, notamment:
- Beagles
- Border Collies
- Bergers Australiens
- Setters Irlandais
- Retrievers de la Baie de Chesapeake
- Leonbergers
- Staffordshire Bull Terriers
- Shih Tzu
- Welsh Corgis Pembroke
- Boxers
- Retrievers du Labrador
- Chiens croisés
L’âge d’apparition se situe généralement entre le jeune adulte et l’âge moyen, avec une fourchette de 2 à 9 ans pour la plupart des patients. Aucune prédisposition liée au sexe ou au statut de stérilisation n’a été clairement établie, bien qu’une étude ait suggéré un risque accru chez les Bergers Allemands mâles entiers par rapport aux mâles castrés.
Aspects lésionnels et manifestations cliniques
Les lésions caractéristiques des fistules périanales comprennent:
- Des sinus ou trajets fistulaires autour de l’anus
- Des ulcérations périanales
- Des érosions
- Des pustules dans les cas moins sévères
- Des fistules rectales plus rarement
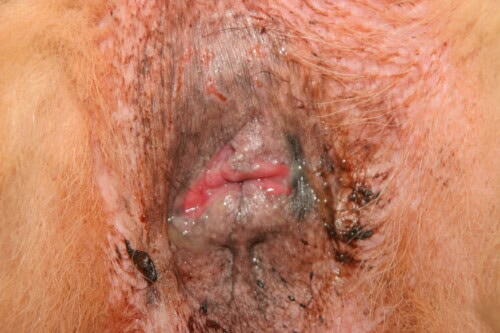
Lésions de fistules périanales modérées
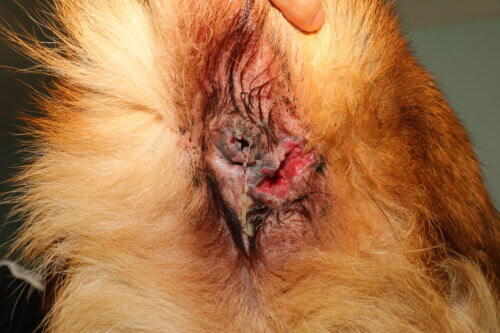
Sévères lésions occupant essentiellement le quadrant inférieur droit
Il est important de noter que, contrairement à ce que suggère le terme “fistule périanale”, les trajets sinusaux cutanés ne communiquent généralement pas avec la lumière rectale, à la différence des fistules observées dans la maladie de Crohn chez l’homme. Ces lésions peuvent être uniques ou multiples, et leur gravité varie de légère à sévère, avec une douleur associée souvent importante.
Les signes cliniques rapportés par les propriétaires incluent:
- Ténesme (efforts de défécation)
- Hématochézie (présence de sang dans les selles)
- Dyschézie (douleur lors de la défécation)
- Émission de petits volumes de selles fréquentes
- Léchage périanal excessif
- Écoulement purulent
- Constipation
- Coprophagie
- Anorexie
- Diarrhée
- Incontinence fécale
- Perte de poids
- Léthargie
Ces manifestations cliniques peuvent être fortement invalidantes et avoir un impact significatif sur la qualité de vie de l’animal. Une association entre fistules périanales et colite a été démontrée, et certains chiens atteints présentent également des selles molles ou mucoïdes, de la diarrhée et une augmentation de la fréquence des défécations.
Approche diagnostique
Examen clinique et diagnostic différentiel
Le diagnostic des fistules périanales est principalement basé sur la présentation clinique et l’examen physique, particulièrement chez les Bergers Allemands. Un examen approfondi de la région périanale et un toucher rectal sont essentiels pour évaluer l’étendue des lésions et identifier d’éventuelles anomalies associées. En raison de la douleur et de l’inconfort causés par cette affection, une sédation peut être nécessaire pour réaliser un examen rectal complet.
L’exploration des trajets fistulaires à l’aide d’un applicateur à bout cotonné ou d’un instrument similaire permet de déterminer leur profondeur. Le suivi clinique peut être effectué en mesurant les profondeurs de ces trajets. Selon la gravité et la durée de la maladie, l’examen rectal peut révéler une absence d’anomalies internes ou une fibrose sévère, identifiable par un épaississement de la région périanale avec possibilité de sténoses anales.
Pour tous les patients, une palpation approfondie et l’expression des sacs anaux doivent être réalisées afin d’exclure un abcès de la glande anale et de déterminer si les fistules périanales communiquent avec les sacs anaux. De plus, les trajets fistulaires peuvent être irrigués à l’aide d’un cathéter et de sérum physiologique stérile pour déterminer s’ils communiquent entre eux ou s’il existe une implication des sacs anaux.
Le diagnostic différentiel varie considérablement selon les signes cliniques présents:
- En cas de prurit périanal uniquement: dermatite allergique (dermatite atopique et réaction alimentaire indésirable), abcès des sacs anaux
- En cas de ténesme et d’hématochézie sans trajets fistulaires visibles: affections gastro-intestinales (maladie inflammatoire de l’intestin, parasites intestinaux, sténoses rectales)
- Néoplasie périanale ulcérée (adénome ou adénocarcinome périanal)
- Lupus érythémateux cutanéomuqueux (LECM)
Il est important de noter que les Bergers Allemands sont également prédisposés au LECM, qui peut présenter des lésions anales ou périanales. Les fistules périanales se distinguent généralement du LECM par des trajets sinusaux ou des ulcères cratériformes bien délimités, tandis que le LECM est associé à des érosions, des ulcères, un érythème et des croûtes plus confluents.
Si la différenciation clinique entre fistules périanales et LECM est difficile, des biopsies cutanées pour histopathologie peuvent être utiles. De même, si le chien appartient à une race moins communément affectée, d’autres causes basées sur les signes cliniques doivent d’abord être écartées.
Évaluation histopathologique
Bien que l’histopathologie soit rarement réalisée pour le diagnostic des fistules périanales canines, elle peut être envisagée dans les cas de présentation clinique inhabituelle ou chez une race moins classiquement affectée. Les caractéristiques histopathologiques comprennent:
- Une inflammation périadnexale avec ou sans furonculose
- Une hidradénite prononcée
- Une fibrose périadnexale
- Une ulcération
- La formation de trajets sinusaux tapissés d’épithélium dans le derme
Les infiltrats inflammatoires, composés de neutrophiles, lymphocytes, plasmocytes et macrophages, peuvent être observés dans les trajets sinusaux. Les lésions plus profondes peuvent également être associées à une cellulite pyogranulomateuse et à des follicules lymphoïdes.
Les biopsies coliques de chiens atteints de fistules périanales peuvent montrer des signes histopathologiques de colite; une étude a trouvé des modifications histopathologiques compatibles avec un diagnostic de colite chez 9 chiens sur 18 atteints de fistules périanales.
Approches thérapeutiques des fistules périanales
Gestion chirurgicale: un rôle limité
Évolution des pratiques chirurgicales
La prise en charge des fistules périanales a considérablement évolué au fil du temps. Des années 1940 aux années 1970, ces lésions étaient considérées comme une pathologie exclusivement chirurgicale. Les interventions comprenaient généralement la résection de tous les tissus atteints, avec ou sans ablation des sacs anaux. Cette procédure pouvait impliquer une résection focale ou s’étendre jusqu’à une résection circonférentielle complète (360 degrés) avec anoplastie.
Diverses techniques chirurgicales ont été décrites:
- Excision en bloc suivie d’une reconstruction chirurgicale
- Excision au laser (notamment laser ND:YAG)
- Cryothérapie pour détruire le tissu malade
- Amputation de la base de la queue (lorsque les fistules étaient considérées comme associées au port de queue bas)
Typiquement, les patients recevaient un émollient fécal après l’opération pour diminuer la pression lors des mouvements intestinaux et permettre à la zone de cicatriser.
Limites et complications de l’approche chirurgicale
L’utilisation de la chirurgie comme thérapie exclusive présente plusieurs problèmes majeurs:
- Taux élevé de récidives (rapporté chez plus de 50% des chiens dans une étude)
- Absence de résolution complète dans de nombreux cas
- Complications chirurgicales significatives:
- Déhiscence des plaies
- Flatulences
- Incontinence fécale
- Diarrhée
- Ténesme
- Constipation
- Sténoses rectales
Les résultats des études varient, mais la chirurgie a été rapportée comme inefficace chez 6% à 21% des chiens, certains étant abandonnés ou euthanasiés en conséquence.
Approche chirurgicale complémentaire
Plus récemment, plusieurs études ont décrit l’utilisation de la chirurgie après que l’efficacité des thérapies immunosuppressives a atteint un plateau. Cette approche combinée, où le traitement médical précède l’intervention chirurgicale, semble donner de meilleurs résultats que la chirurgie seule.
Dans cette stratégie, le traitement chirurgical intervient:
- Lorsque l’amélioration médicale a atteint un plateau
- Pour gérer les lésions persistantes après une amélioration obtenue par traitement médical
- Chez les animaux présentant encore une gêne ou une douleur (qualité de vie altérée)
- Pour des raisons budgétaires, lorsque le traitement médical à long terme est trop coûteux
Les procédures chirurgicales réalisées dans ce contexte comprennent:
- L’excision des fistules persistantes
- La sacculectomie
- La cryptectomie
- La suture des fistules rectales éventuelles
Thérapies immunomodulatrices: pierre angulaire du traitement
Inhibiteurs de la calcineurine
Cyclosporine A
La cyclosporine A est considérée comme l’un des traitements de référence pour les fistules périanales canines. Son mécanisme d’action implique la liaison à la protéine intracellulaire cyclophiline-1, inhibant la calcineurine. Cette inhibition empêche la déphosphorylation du facteur nucléaire des lymphocytes T activés et la production subséquente de cytokines pro-inflammatoires, notamment l’IL-2. La diminution de production d’IL-2 entraîne une réduction de la croissance et de l’activation des lymphocytes T.
Plusieurs études, dont des essais cliniques randomisés et contrôlés, ont démontré l’efficacité de la cyclosporine A. Dans un essai clinique randomisé comparant la cyclosporine A à un placebo chez des Bergers Allemands atteints de fistules périanales, une résolution complète des lésions a été rapportée chez 17 des 20 chiens (85%) recevant la cyclosporine A après 16 semaines de traitement. La surface totale moyenne et la profondeur des lésions ont diminué respectivement de 78% et 62% après 4 semaines de thérapie.
Les doses de cyclosporine A étudiées pour le traitement des fistules périanales varient considérablement, allant de 1,5 mg/kg toutes les 24 heures à 10 mg/kg toutes les 12 heures. En général, les doses plus élevées sont associées à de meilleurs résultats, l’efficacité étant dose-dépendante. Les formulations modifiées ou microémulsifiées de cyclosporine A ont une biodisponibilité supérieure chez les chiens et devraient être utilisées préférentiellement. La biodisponibilité de la cyclosporine A est également réduite par la présence de nourriture ; elle est donc mieux administrée à jeun (2 heures avant ou après un repas).
Le coût de la cyclosporine A, en particulier à des doses élevées ou pour les grands chiens, peut être prohibitif. L’administration conjointe de cyclosporine A et de kétoconazole peut inhiber le métabolisme de la cyclosporine A par les microenzymes hépatiques du cytochrome P450 et améliorer sa biodisponibilité via l’inhibition de la P-glycoprotéine intestinale (diminuant ainsi le transport de la cyclosporine A vers la lumière intestinale). La co-administration des deux médicaments peut améliorer la biodisponibilité de la cyclosporine A de 75% ou plus, selon la dose de kétoconazole, et permettre une réduction de la dose de cyclosporine A.
L’association de cyclosporine A (à des doses de 1 mg/kg/j à 5,5 mg/kg/j) et de kétoconazole (à des doses de 5,1 mg/kg/j à 11 mg/kg/j) s’est avérée efficace dans des essais cliniques avec une résolution complète des lésions chez 93% des chiens en 16 semaines, 100% des chiens en 3 à 10 semaines, et 67% des chiens avec un temps moyen de résolution de 13,9 semaines.
Des récidives peuvent survenir lorsque le traitement immunomodulateur est interrompu. Pour cette raison, après la résolution complète des lésions (qui nécessite généralement 8 à 12 semaines de traitement), il est recommandé de réduire progressivement les doses de cyclosporine A et de kétoconazole jusqu’à la posologie et la fréquence d’administration efficaces les plus faibles.
Tacrolimus
Le tacrolimus en pommade à 0,1% s’est également avéré efficace pour le traitement des fistules périanales canines, bien que des essais cliniques randomisés et contrôlés n’aient pas été réalisés. Dans une étude portant sur 10 chiens traités avec une pommade de tacrolimus à 0,1% appliquée sur la peau périanale deux fois par jour pendant 16 semaines, 5 chiens ont obtenu une résolution complète des lésions.
Le tacrolimus est plus approprié pour l’application topique que la cyclosporine A en raison de son poids moléculaire plus faible, ce qui permet une meilleure absorption à travers l’épiderme. En raison de l’inconfort potentiellement associé à l’application, la pommade de tacrolimus est généralement recommandée pour les chiens présentant des lésions légères ou pour ceux ayant des lésions plus sévères après résolution complète ou partielle avec la cyclosporine A orale (le plus souvent en association avec le kétoconazole).
Certains chiens peuvent passer à la pommade de tacrolimus topique seule pour le maintien et la prévention des récidives de fistules périanales. L’avantage principal de ce traitement topique est d’éviter l’immunosuppression systémique.
Une étude plus large a montré une rémission complète sur 16 semaines chez 15 des 19 patients (79%) et une amélioration marquée chez les 4 patients restants lorsque le tacrolimus était utilisé en association avec la prednisolone, un régime alimentaire à base de protéines nouvelles et une courte cure de métronidazole. Lorsque le tacrolimus est administré seul, une rémission complète n’a été rapportée que chez 50% des patients.
Glucocorticoïdes
Des doses immunosuppressives de prednisolone (2 à 4 mg/kg PO q24h) ont été décrites comme efficaces, avec 33,3% des patients obtenant une rémission complète, 33,3% montrant une amélioration des signes cliniques et 33,3% ne montrant aucune amélioration. Un avantage de la thérapie à la prednisolone est son action rapide comparée à d’autres thérapies immunosuppressives; le problème avec la thérapie à la prednisolone réside dans les effets secondaires à long terme.
En raison de la nécessité d’une administration continue d’agents immunomodulateurs pour la gestion, ainsi que du risque d’effets secondaires avec l’administration à long terme de corticostéroïdes, les corticostéroïdes ne sont généralement pas utilisés seuls pour la gestion des fistules périanales canines. Ils peuvent cependant être utiles dans le cadre d’une prise en charge multimodale, particulièrement en phase initiale pour leur action anti-inflammatoire rapide.
Autres immunomodulateurs
Azathioprine
L’azathioprine, en association avec le métronidazole, s’est révélée efficace pour diminuer la taille des fistules périanales avant l’ablation chirurgicale de la maladie résiduelle. Dans les cas rapportés, l’azathioprine était poursuivie pendant 2 à 6 semaines après la chirurgie. Une autre étude a montré que la monothérapie avec l’azathioprine conduisait à une rémission complète chez un peu plus de la moitié des chiens la recevant. Cependant, l’azathioprine peut entraîner des effets secondaires significatifs (par exemple, myélosuppression sévère, hépatotoxicité, pancréatite), qui doivent être pris en compte lors de l’utilisation de ce médicament.
Dans une étude de Harkin et collaborateurs, 14 chiens atteints de fistules périanales ont été traités par azathioprine seule. Après 16 semaines de traitement, 8 des 14 chiens (57%) ont obtenu une résolution complète des lésions.
Mycophénolate mofétil
Il n’existe, à la connaissance de l’auteur, qu’un seul rapport sur l’utilisation du mycophénolate mofétil pour la gestion des fistules périanales dans la littérature vétérinaire; ce chien a été traité pendant 4 semaines sans amélioration des lésions.
Thérapies alternatives et émergentes
Injections de cellules souches mésenchymateuses
Les injections de cellules souches mésenchymateuses, administrées directement dans les fistules, se sont avérées efficaces chez l’homme atteint de maladie de Crohn fistulisante. Les cellules souches mésenchymateuses ont une activité immunomodulatrice, diminuant la prolifération et l’activation des lymphocytes T et des cellules dendritiques et augmentant la production de cellules T régulatrices.
L’efficacité des injections de cellules souches mésenchymateuses pour les fistules périanales canines a été rapportée pour un petit nombre de chiens. Six chiens atteints de fistules périanales qui n’avaient pas répondu à la thérapie par cyclosporine A à dosage standard pendant au moins 6 mois d’administration ont été inclus dans un essai ouvert et ont reçu une injection unique de cellules souches mésenchymateuses dérivées de cellules souches embryonnaires humaines dans les lésions périanales. Les chiens ont été suivis pendant 6 mois après l’injection; tous les chiens ont présenté une résolution des trajets sinusaux ou des ulcères 3 mois après l’injection de cellules souches. Deux chiens ont présenté une récidive des fistules périanales 6 mois après l’injection.
Après 1 à 2 mois, la dose moyenne de cyclosporine a pu être diminuée à 3,59 mg/kg/j (à 3 mois) contre 8,22 mg/kg/j initialement. Bien que les injections de cellules souches mésenchymateuses soient une option de traitement prometteuse pour les fistules périanales canines, des études contrôlées supplémentaires sont nécessaires pour appliquer ces résultats à des populations plus importantes de chiens affectés et pour déterminer la fréquence optimale des injections.
Autres thérapies innovantes
Plusieurs thérapies alternatives ciblant la cicatrisation des plaies sont devenues populaires comme options de traitement pour les fistules périanales.
-
Plasma riche en plaquettes: Une monothérapie au plasma riche en plaquettes administrée sous forme d’injections intralésionnelles chez un chien a entraîné une rémission complète sans récidive après un an.
-
Énergie lumineuse fluorescente: Cette thérapie nécessite un traitement hebdomadaire pour aider à diminuer l’inflammation et augmenter la cicatrisation des plaies. Une étude portant sur 4 cas a montré une diminution de 74,3% de la surface lésée après 6 semaines, bien qu’aucune guérison complète n’ait été observée. La commercialisation récente de l’énergie lumineuse fluorescente l’a rendue plus facilement disponible pour les vétérinaires.
-
Oclacitinib: Une série de cas récente a rapporté l’utilisation de l’oclacitinib à des doses supérieures à celles utilisées pour la dermatite atopique (1,125 mg/kg BID et 0,88 mg/kg BID) avec une guérison complète dans les deux cas après 1 mois de traitement. Ce médicament agit en bloquant l’action des interférons et de la voie JAK-STAT, ce qui pourrait en faire un traitement étiologique pertinent compte tenu de l’activation des interférons dans les lésions de fistule périanale.
Traitements adjuvants et considérations complémentaires
Gestion des infections secondaires
Les infections secondaires peuvent accompagner les fistules périanales et doivent être traitées de manière appropriée, soit par des médicaments systémiques, soit par des applications topiques (chlorhexidine). Les soins hygiéniques de routine de la région périanale peuvent être bénéfiques (par exemple, bains antiseptiques 2 à 3 fois par semaine, voire quotidiennement, selon la gravité des lésions).
Il est important de noter que les antibiotiques seuls ne semblent pas efficaces pour la gestion des fistules périanales chez les chiens. De nombreux chiens sont traités avec des antimicrobiens au moment de l’apparition des signes cliniques de fistules périanales mais continuent à présenter une progression de la maladie.
Quelques études ont rapporté l’utilisation du métronidazole en combinaison avec d’autres thérapies (azathioprine, pommade de tacrolimus, prednisolone et régime alimentaire à base de protéines nouvelles) pour le traitement des chiens atteints de fistules périanales. En plus de son activité contre les bactéries anaérobies et les protozoaires, le métronidazole peut également avoir une activité anti-inflammatoire, notamment en favorisant la différenciation des cellules T régulatrices. Cette activité anti-inflammatoire peut aider au traitement des maladies à médiation immunitaire, mais l’efficacité du métronidazole seul pour le traitement des fistules périanales est inconnue à ce jour.
Gestion de la douleur et du confort
Les chiens atteints de fistules périanales actives peuvent souffrir, en particulier lors de la défécation. Les émollients fécaux doivent être envisagés et, dans certains cas, des lavements peuvent être nécessaires pour soulager le ténesme. L’analgésie doit être une priorité pour les chiens présentant des lésions actives, mais le potentiel de constipation avec l’utilisation de certains analgésiques, tels que les agonistes opioïdes, doit être pris en compte lors de l’élaboration d’un plan de gestion de la douleur.
Considérations alimentaires
Un lien entre les fistules périanales et les réactions alimentaires indésirables a été identifié. Dans une étude, 18,8% des chiens atteints de fistule périanale souffraient également d’allergies alimentaires. On ignore s’il existe une corrélation directe entre ces maladies ou si les chiens avaient simplement deux maladies concomitantes. Quoi qu’il en soit, l’utilisation d’un régime à base de protéines nouvelles ou d’un régime hydrolysé a été bénéfique pour certains patients.
Trois études ont rapporté une réponse clinique positive à un régime à base de protéines nouvelles chez des chiens atteints de fistules périanales. Dans une étude, un régime à base de poisson et de pommes de terre a été administré à long terme après l’excision chirurgicale des trajets sinusaux et la sacculectomie anale bilatérale. Dans la deuxième étude, les chiens ont reçu un régime exclusif à base de venaison et de pommes de terre ou de poisson et de pommes de terre, mais ont également reçu initialement du métronidazole ainsi que de la pommade de tacrolimus à 0,1% en topique et une cure dégressive de prednisolone orale pendant 16 semaines. Dans la troisième étude, les chiens ont reçu un régime commercial à base d’agneau et de riz ou végétarien, mais ont également reçu simultanément une cure dégressive de prednisolone orale à une dose immunosuppressive initiale.
Bien que la mise en place d’un régime d’éviction à l’aide d’un aliment à base de protéines nouvelles ou de protéines hydrolysées soit recommandée dans le cadre du bilan diagnostique des chiens atteints de fistules périanales, il n’est pas clair, d’après la littérature disponible, combien de chiens peuvent obtenir une rémission à long terme avec un contrôle alimentaire seul.
Recommandations consensuelles pour la prise en charge des fistules périanales
Méthodologie d’élaboration du consensus
Face à l’absence de consensus sur la gestion des fistules périanales, le conseil scientifique du GEDAC (Groupe d’Étude en Dermatologie des Animaux de Compagnie) a entrepris d’établir un état des lieux de la littérature afin d’aboutir à des recommandations de prise en charge médicale.
La méthodologie adoptée s’appuie sur la taxonomie de force de recommandation (SoRT) développée par les rédacteurs de revues de médecine généraliste et de soins d’urgence aux États-Unis. Le niveau de preuve (LoE) a été classé selon une échelle à trois niveaux:
- LoE 1: Preuves de bonne qualité (méta-analyse, étude prospective contrôlée randomisée de bonne qualité)
- LoE 2: Preuves de qualité limitée (étude prospective contrôlée randomisée de faible qualité, essai contrôlé, étude de cas versus un groupe contrôle, étude prospective de bonne qualité)
- LoE 3: Autres preuves, y compris les lignes directrices de consensus, les opinions, les études de cas
Une recherche systématique de la littérature publiée entre 1980 et octobre 2023 a été effectuée dans la base de données PubMed. Les articles en anglais et en français ont été recherchés à l’aide de mots-clés spécifiques, et les types d’études suivants ont été initialement sélectionnés: essais contrôlés randomisés, essais cliniques, études de cohorte et séries de cas.
Pour l’élaboration des recommandations, une échelle à trois niveaux a été utilisée:
- Niveau A: Recommandation forte, basée sur des preuves de bonne qualité, cohérentes
- Niveau B: Recommandation modérée, basée sur des preuves incohérentes ou de qualité limitée
- Niveau C: Recommandation faible, basée principalement sur l’opinion d’experts
Recommandations thérapeutiques principales
Cyclosporine A
- L’efficacité de la cyclosporine est réelle (niveau de recommandation A)
- L’efficacité est dose-dépendante et indépendante de la sévérité clinique
- La dose minimale recommandée est de 5 mg/kg/jour, pouvant aller jusqu’à 10 mg/kg deux fois par jour
- La dose efficace doit être maintenue jusqu’à obtention de la guérison clinique (niveau C)
- Une durée de trois mois peut être nécessaire pour observer la guérison sous cyclosporine
Association cyclosporine-kétoconazole
- Cette association est efficace
- Cependant, les experts ne recommandent pas cette association afin de limiter les risques de résistance aux antifongiques et les atteintes hépatiques
Tacrolimus
En France, l’évolution de la législation rend l’utilisation du tacrolimus difficile à envisager.
Prednisolone
- Les experts ne recommandent pas l’utilisation de la prednisolone seule
- La corticothérapie est conseillée dans le cadre d’une prise en charge multimodale
- Il est conseillé de ne pas dépasser 1 mg/kg/jour en dose d’attaque pour limiter les effets indésirables
- La corticothérapie locale pourrait être intéressante malgré l’absence de données scientifiques solides à ce sujet
Autres immunomodulateurs
Les experts ne recommandent pas l’utilisation de l’azathioprine, du mycophénolate mofétil, de l’oclacitinib, de la photobiomodulation ou des cellules souches par manque de données fiables et répétées disponibles à ce jour.
Antibiothérapie
- Une antibiothérapie n’est pas nécessaire pour obtenir la guérison
- Le métronidazole, peu utilisé dans les études, ne permet pas d’évaluer son impact sur l’évolution de la maladie
- Les experts ne recommandent pas l’utilisation systématique d’antibiotiques
- L’antibiothérapie est recommandée uniquement en cas de fistule rectale ou d’infection des sacs anaux, basée sur les résultats d’une culture bactérienne
Approche chirurgicale
- Les experts recommandent le recours à la chirurgie en seconde intention
- Cette approche est indiquée chez un animal présentant encore une gêne ou une douleur (qualité de vie altérée) après amélioration par traitement médical
- L’utilisation de la chirurgie peut être conditionnée par des raisons budgétaires ou une stagnation de l’amélioration clinique chez un animal dont la qualité de vie reste insuffisante
Alimentation
- Aucune preuve scientifique ne permet de recommander l’utilisation des alimentations à base de protéines nouvelles ou hydrolysées
- Par analogie avec la maladie de Crohn chez l’homme et sur la base de l’expérience clinique, les experts conseillent la mise en place d’une alimentation hypoallergénique (niveau C)
Suivi et adaptation thérapeutique
- Il est recommandé d’évaluer le traitement médical après 6 à 10 semaines et de le modifier selon la réponse observée
- Après obtention de la guérison ou en présence de lésions persistantes modérées associées à une bonne qualité de vie, le traitement pourra être simplifié voire arrêté
- En l’absence de données scientifiques, les experts préconisent une simplification ou un arrêt progressif et adapté du traitement
Discussion et perspectives
Parallèles avec les pathologies humaines
Deux affections humaines, l’hidradénite suppurée et la maladie de Crohn fistulisante, ont été proposées comme corrélats des fistules périanales canines. Comme les fistules périanales chez les chiens, ces deux affections sont douloureuses, invalidantes et peuvent avoir un impact négatif sur la qualité de vie des patients.
L’hidradénite suppurée est associée à des nodules, des abcès, des trajets sinusaux et des cicatrices, principalement dans les régions intertrigineuses (aisselle, aine, région périanale et région mammaire). Elle a été initialement proposée comme un corrélat potentiel des fistules périanales canines en raison de caractéristiques histopathologiques similaires, notamment la furonculose, l’hidradénite et la formation de trajets sinusaux tapissés d’épithélium. La pathogenèse de l’hidradénite suppurée n’a pas été entièrement élucidée, mais il s’agit probablement d’une affection à médiation immunitaire avec une susceptibilité génétique. Des altérations du microbiote cutané ou intestinal peuvent jouer un rôle dans la pathogenèse.
Les manifestations périanales de la maladie de Crohn sont fréquentes, estimées affecter 25% à 33% des patients atteints de la maladie de Crohn. Les fistules périanales sont plus fréquentes chez les patients atteints de maladie colique ou rectale et peuvent être simples (un trajet fistuleux avec une seule ouverture externe) ou complexes (multiples trajets fistuleux, abcès périanaux ou sténose anale/rectale). Contrairement à la maladie typique chez les chiens, ce sont de véritables fistules qui communiquent avec la lumière intestinale. La pathogenèse des fistules périanales dans la maladie de Crohn n’est pas entièrement comprise mais impliquerait une transition épithélio-mésenchymateuse et une régulation positive des métaloprotéinases matricielles et des cytokines pro-inflammatoires.
Des similitudes dans la pathogenèse de l’hidradénite suppurée et de la maladie de Crohn ont été démontrées, en particulier l’infiltration des tissus malades par des lymphocytes T helper de type 17. Les études futures devraient se concentrer sur une meilleure caractérisation de l’étiologie sous-jacente de ces trois affections et pourraient aider à orienter le développement de futures thérapies, telles que des anticorps ciblant des cytokines spécifiques, pour les fistules périanales chez les chiens.
Perspectives futures et pistes de recherche
Plusieurs domaines de recherche méritent une attention particulière pour améliorer la prise en charge des fistules périanales canines:
-
Étude approfondie de la pathogénie immunitaire: Une meilleure compréhension des mécanismes immuno-médiés impliqués pourrait conduire au développement de thérapies ciblées, comme l’utilisation d’inhibiteurs de JAK (oclacitinib) dont l’efficacité a été suggérée par quelques études préliminaires.
-
Caractérisation du microbiome cutané et intestinal: L’exploration du rôle joué par le microbiome dans le développement et la persistence des fistules périanales pourrait ouvrir de nouvelles pistes thérapeutiques, comme l’utilisation de probiotiques ou la transplantation fécale.
-
Optimisation des protocoles thérapeutiques: Des études contrôlées sont nécessaires pour déterminer les doses optimales, les durées de traitement et les stratégies de sevrage des différentes options thérapeutiques.
-
Évaluation plus standardisée de la qualité de vie: Le développement d’outils spécifiques pour évaluer l’impact des fistules périanales et de leurs traitements sur la qualité de vie des chiens permettrait une approche plus centrée sur le bien-être animal.
-
Développement de thérapies innovantes: Les résultats préliminaires encourageants obtenus avec les cellules souches mésenchymateuses, le plasma riche en plaquettes ou l’énergie lumineuse fluorescente méritent d’être approfondis par des études contrôlées sur de plus grandes populations.
-
Étude des liens avec les allergies alimentaires: La clarification des liens potentiels entre fistules périanales et réactions alimentaires adverses permettrait d’optimiser les approches nutritionnelles.
- Identification de biomarqueurs prédictifs: La recherche de marqueurs biologiques permettant de prédire la réponse au traitement ou le risque de récidive améliorerait la personnalisation thérapeutique.
Importance de l’approche individualisée
La gestion des fistules périanales canines nécessite une approche individualisée, prenant en compte plusieurs facteurs:
-
Équilibre thérapeutique: La recherche d’un équilibre entre efficacité du traitement, coût, effets indésirables et qualité de vie de l’animal est essentielle.
-
Objectifs réalistes: Si la guérison clinique complète reste l’objectif théorique, l’amélioration clinique avec une qualité de vie préservée peut constituer un objectif acceptable dans certains cas.
-
Adaptabilité thérapeutique: L’évaluation régulière de la réponse au traitement et l’ajustement des protocoles en fonction de cette réponse sont cruciaux pour optimiser la prise en charge.
-
Approche multimodale: La combinaison de différentes modalités thérapeutiques (médicaments immunomodulateurs, soins locaux, gestion de la douleur, approche nutritionnelle) offre souvent les meilleures chances de succès.
-
Prise en compte du contexte: Les contraintes financières, la capacité du propriétaire à administrer les traitements et à effectuer les soins nécessaires, ainsi que les comorbidités éventuelles doivent être intégrées dans la stratégie thérapeutique.
Conclusion
Les fistules périanales canines représentent une affection dermatologique complexe à pathogénie immuno-médiée dont la prévalence est particulièrement élevée chez le Berger Allemand. Cette pathologie, potentiellement invalidante, peut avoir un impact majeur sur la qualité de vie des animaux affectés et nécessite une prise en charge rapide et adaptée.
La compréhension de cette maladie a considérablement évolué au fil des décennies, avec un changement de paradigme passant d’une vision principalement anatomique et chirurgicale à une approche immuno-médiée et médicale. Les thérapies immunomodulatrices, en particulier la cyclosporine A, constituent aujourd’hui la pierre angulaire du traitement, permettant d’obtenir des taux de guérison significatifs.
L’analyse méthodique de la littérature scientifique a permis d’établir des recommandations consensuelles pour guider les cliniciens dans leurs choix thérapeutiques. Ces recommandations soulignent l’efficacité de la cyclosporine A à des doses adaptées (minimum 5 mg/kg/jour), le rôle limité mais complémentaire de la corticothérapie, et l’intérêt potentiel de certaines thérapies émergentes comme l’oclacitinib ou les cellules souches mésenchymateuses.
La chirurgie, autrefois considérée comme le traitement de référence, est aujourd’hui réservée aux cas réfractaires ou comme complément après stabilisation médicale. L’approche alimentaire, bien que manquant encore de preuves scientifiques solides, est souvent intégrée dans la stratégie thérapeutique globale.
Les parallèles établis avec des pathologies humaines comme l’hidradénite suppurée ou la maladie de Crohn fistulisante ouvrent des perspectives intéressantes pour la recherche translationnelle et le développement de nouvelles approches thérapeutiques ciblées.
L’objectif ultime de la prise en charge reste l’amélioration de la qualité de vie de l’animal, ce qui peut parfois être atteint sans guérison complète des lésions. Une approche individualisée, tenant compte des spécificités de chaque patient, des contraintes pratiques et des attentes des propriétaires, demeure essentielle pour optimiser les chances de succès thérapeutique à long terme.
Questions fréquemment posées
1. La sévérité initiale des lésions influence-t-elle le pronostic et la réponse au traitement?
Les études n’ont pas démontré de corrélation significative entre la gravité initiale des lésions et la réponse au traitement, notamment avec la cyclosporine. Cependant, un diagnostic précoce et la mise en place rapide d’un traitement adapté améliorent généralement le pronostic. Les cas chroniques, avec fibrose établie, peuvent être plus réfractaires à la thérapie.
2. Comment gérer les récidives après arrêt du traitement?
En cas de récidive après l’arrêt du traitement, la reprise du protocole initialement efficace est généralement recommandée. Une fois la rémission obtenue, un sevrage plus progressif peut être envisagé, ou une thérapie d’entretien à dose minimale efficace (par exemple, cyclosporine à dose réduite ou tacrolimus topique) peut être maintenue à long terme. L’identification et la gestion des facteurs déclenchants potentiels, comme les allergies alimentaires, sont également importantes.
3. Les facteurs environnementaux influencent-ils l’évolution des fistules périanales?
Bien que peu étudiés spécifiquement, certains facteurs environnementaux semblent influencer l’évolution de la maladie. L’hygiène périanale, la consistance des selles (influencée par l’alimentation), le stress et l’activité physique peuvent tous avoir un impact sur la cicatrisation et le confort de l’animal. Un environnement propre et des soins locaux réguliers contribuent positivement à la gestion de l’affection.
4. Quels sont les risques d’effets secondaires à long terme des traitements immunosuppresseurs?
Les traitements immunosuppresseurs à long terme présentent plusieurs risques:
- Pour la cyclosporine: troubles digestifs, hyperplasie gingivale, hirsutisme, risque accru d’infections opportunistes et potentiel développement de néoplasies (rare)
- Pour les corticostéroïdes: syndrome de Cushing iatrogène, diabète sucré, atrophie cutanée, immunosuppression, risque d’infections secondaires
- Pour l’azathioprine: myélosuppression, hépatotoxicité, pancréatite
Un suivi régulier incluant examen clinique, analyses sanguines et ajustements posologiques est essentiel pour minimiser ces risques.
5. Existe-t-il des moyens de prédire quels chiens Bergers Allemands développeront cette affection?
Actuellement, il n’existe pas de test prédictif validé permettant d’identifier avec certitude les Bergers Allemands à risque de développer des fistules périanales. Cependant, certains facteurs de risque ont été identifiés:
- Les chiens homozygotes pour l’allèle DLA-DRB1*00101 pourraient développer la maladie plus précocement
- Une histoire familiale de fistules périanales semble augmenter le risque
- Certains lignages semblent plus affectés que d’autres
Des recherches supplémentaires sur les marqueurs génétiques et immunologiques pourraient permettre le développement de tests prédictifs à l’avenir, ouvrant la voie à des stratégies préventives chez les individus à risque.