A l’occasion des dernières Journées Annuelles du GEDAC, à Ajaccio, en juin 2024, notre confrère, Vincent Bruet, DipECVD a fait une mise au point complète sur l’utilisation des antifongiques dans le traitement des dermatophytoses canines et félines.
Les dermatophytoses représentent les infections cutanées fongiques les plus fréquemment rencontrées en médecine vétérinaire des animaux de compagnie. Ces affections, causées par des champignons kératinophiles, soulèvent des défis thérapeutiques particuliers en raison de leur caractère contagieux et de leur potentiel zoonotique. Dans le contexte actuel, où la médicalisation des animaux de compagnie ne cesse de progresser, une mise à jour des connaissances sur les stratégies thérapeutiques s’avère essentielle.
Épidémiologie et aspects zoonotiques
En pratique clinique courante, les dermatophytes font l’objet d’une classification en constante évolution. Bien que les genres Microsporum et Trichophyton restent les plus communément utilisés, une nouvelle nomenclature intègre désormais le genre Nannizzia. Les quatre espèces prédominantes dans les infections des carnivores domestiques sont Microsporum canis, agent zoophile majeur, particulièrement chez le chat où la prévalence atteint 6% de la population féline en consultation, Trichophyton mentagrophytes, également zoophile, Nannizzia gypsea (anciennement Microsporum gypseum), agent géophile, et Nannizzia persicolor (anciennement Microsporum persicolor).
L’importance zoonotique de ces infections ne doit pas être sous-estimée. Les études révèlent des taux de contamination humaine significatifs : 30% des propriétaires de chats infectés et 15% des propriétaires de chiens infectés développent des lésions. La transmission peut être directe (contact avec un animal infecté) ou indirecte via l’environnement, avec une survie des spores dans le sol pouvant atteindre plusieurs mois.
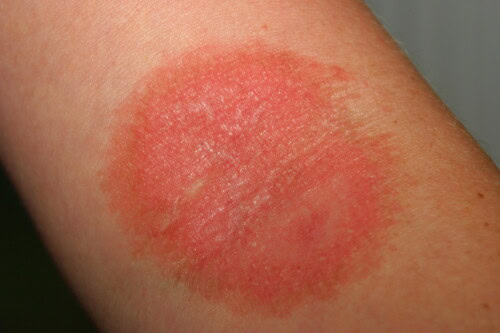
Photo 1 : Il ne faut pas oublier que la Teigne peut se transmettre à l’homme
La saisonnalité joue un rôle important dans l’épidémiologie de certaines espèces. Si M. canis ne montre pas de variation saisonnière marquée, T. mentagrophytes présente une recrudescence automnale, corrélée à la multiplication des petits rongeurs qui constituent son réservoir naturel.
Le mode d’envahissement du poil est principalement ectothrix chez les carnivores, avec des filaments à l’intérieur du poil et des arthrospores en surface. La spore, présentant une affinité particulière pour la kératine, pénètre dans le follicule pileux jusqu’à la zone isthmique, où elle trouve les conditions optimales pour sa croissance. Ce processus aboutit à une fragilisation du poil qui, en se cassant, libère de nouvelles spores, perpétuant ainsi le cycle infectieux selon une évolution centripète caractéristique. La période d’incubation varie de 10 à 30 jours.
Outils diagnostiques et suivi thérapeutique
Approche diagnostique multimodale
Le diagnostic des dermatophytoses repose sur une combinaison d’examens complémentaires. La lampe de Wood, bien qu’utile pour le dépistage de M. canis, ne détecte qu’environ 50% des cas positifs à cause de la production variable de métabolites fluorescents. Le trichogramme offre une approche rapide mais sa sensibilité dépend fortement de l’expérience de l’examinateur.
La culture mycologique demeure la méthode de référence, avec un délai d’obtention des résultats de 1 à 3 semaines. Les prélèvements peuvent être réalisés par raclage cutané, épilation ciblée sous lampe de Wood, ou brossage du pelage pour les infections asymptomatiques ou le suivi thérapeutique.
L’innovation majeure réside dans l’introduction de la PCR en temps réel. Cette technique offre plusieurs avantages : rapidité des résultats (quelques jours), robustesse face aux contaminations par moisissures, et différenciation précise des espèces. Elle permet notamment de distinguer les Microsporum spp., les Trichophyton spp. pathogènes (T. mentagrophytes, T. erinacei, T. tonsurans, T. equinum, T. verrucosum, T. rubrum), et les espèces géophiles. Sa sensibilité accrue facilite l’identification des porteurs asymptomatiques, particulièrement important dans le contrôle des collectivités.
Suivi thérapeutique et critères d’évaluation
Le monitoring thérapeutique doit être rigoureux et standardisé. Un premier contrôle mycologique est recommandé après 4 semaines de traitement. La poursuite ou l’arrêt du traitement dépend des résultats :
- En cas de culture positive : poursuite du traitement avec nouveau contrôle à 4 semaines
- En cas de culture négative : interruption du traitement mais nouveau contrôle à 4 semaines pour confirmation
- La guérison n’est confirmée qu’après deux cultures négatives espacées de 4 semaines
Dans les contextes d’élevage ou en cas de récidives multiples, un troisième contrôle négatif peut être requis avant de déclarer la guérison complète.
Stratégies thérapeutiques actualisées
Cas cliniques illustratifs et situations particulières
Le cas Princesse : Complexité des formes généralisées
Le cas de Princesse, Yorkshire terrier présentant une dermatophytose généralisée, illustre parfaitement la nécessité d’une approche globale. Cette chienne, vivant dans un élevage de Cavalier King Charles, présentait une dermatophytose extensive associée à une insuffisance rénale sous-jacente. Malgré des traitements antifongiques réguliers, l’amélioration n’a été obtenue qu’après la prise en charge de l’affection rénale, soulignant l’importance de rechercher et traiter les causes immunodépressives sous-jacentes dans les formes généralisées.
Particularités des formes cliniques atypiques
Les manifestations cliniques peuvent être trompeuses. Un cas remarquable concerne un chat Persan présenté initialement pour des troubles de la pousse du poil. Lors de la tonte thérapeutique, des zones “zébrées” sont apparues, révélant une hyperpigmentation post-inflammatoire caractéristique d’une dermatophytose chronique extensive.
La présentation clinique varie selon l’agent pathogène et l’espèce atteinte. Un exemple frappant est celui d’un chat et d’un cobaye présentés simultanément avec une infection à T. mentagrophytes : le cobaye, hôte habituel, présentait des lésions peu inflammatoires, tandis que le chat développait une forme très inflammatoire, illustrant l’importance de la relation hôte-parasite dans l’expression clinique.
Plusieurs facteurs influencent le développement des dermatophytoses. L’âge constitue un facteur majeur, les jeunes animaux de moins d’un an étant particulièrement sensibles. Certaines races présentent une prédisposition particulière, notamment les Yorkshire, Bouledogues et Jack Russell chez le chien, ainsi que les Persans chez le chat. Les conditions environnementales jouent également un rôle crucial, avec une prévalence accrue chez les animaux vivant en extérieur ou en collectivité.
Les manifestations cliniques varient considérablement. La forme classique se caractérise par des lésions alopéciques nummulaires peu inflammatoires, mais des présentations atypiques existent : dermatites miliaires félines, acné féline, ou encore des formes généralisées nécessitant la recherche d’une cause sous-jacente. Les teignes croûteuses, particulièrement observées avec persicolor, gypseum et mentagrophytes, témoignent d’une réaction inflammatoire plus marquée chez des hôtes moins adaptés à ces agents pathogènes.
Principes fondamentaux du traitement
L’approche thérapeutique moderne des dermatophytoses repose sur trois piliers essentiels : le traitement systémique, le traitement topique et la gestion environnementale. Cette triade thérapeutique vise non seulement à traiter l’animal infecté mais également à prévenir la dissémination des spores dans l’environnement.
La tonte du pelage, bien que controversée, peut s’avérer bénéfique, particulièrement chez les animaux fortement infectés et les chats à poils longs. Cette pratique doit être réalisée avec précaution dans une pièce dédiée, au-dessus d’un sac pour contenir les poils contaminés. Chez les Persans, les études montrent une meilleure réponse au traitement chez les animaux tondus comparés aux non tondus. Les soins topiques doivent être particulièrement minutieux au niveau des extrémités digitées, nécessitant l’utilisation de brosses douces pour retirer un maximum de spores.
Innovations dans la gestion environnementale
La désinfection environnementale, souvent négligée, s’avère cruciale pour le succès thérapeutique. L’hypochlorite de sodium (eau de Javel) en dilution appropriée (un bouchon ou une cuillère à soupe pour un litre à un litre et demi d’eau) émerge comme la solution la plus efficace, offrant une action fongicide persistante jusqu’à 24 heures après application. La Javel présente l’avantage d’être le seul désinfectant à action prolongée, capable de détruire les spores même sur des surfaces séchées après 24 heures – un atout majeur pour les élevages et refuges.
L’énilconazole à une concentration 5 fois plus concentrée que celle employée en application sur les animaux, constitue également un traitement environnemental très intéressant.
L’approche environnementale doit être méthodique. Il est conseillé de recouvrir les zones de repos de l’animal avec des draps lavables en machine, facilitant ainsi la décontamination régulière. L’aspiration fréquente des surfaces, avec changement systématique des sacs d’aspirateur pour éviter la redispersion des spores, complète le dispositif. Les spores de M. canis pouvant survivre plus de 18 mois dans l’environnement, cette vigilance doit être maintenue tout au long du traitement.
Suivi thérapeutique et critères de guérison
Le monitoring thérapeutique s’effectue par cultures mycologiques de contrôle, réalisées toutes les quatre semaines. La guérison est confirmée par l’obtention de deux cultures négatives successives à quatre semaines d’intervalle. Dans les cas complexes, notamment en élevage, un troisième contrôle négatif peut être requis.
Conclusion
La prise en charge des dermatophytoses chez les carnivores domestiques a considérablement évolué ces dernières années, s’orientant vers une approche plus intégrée combinant traitements médicamenteux et mesures environnementales. La réussite thérapeutique repose sur une stratégie personnalisée, tenant compte du contexte épidémiologique, de l’espèce affectée et de l’environnement de l’animal.