La dermatofitosi, infezione fungina dei tessuti cheratinizzati, rimane un’entità clinica frequente in medicina veterinaria. La sua presentazione polimorfica, unita alla diversità degli agenti eziologici e ai limiti inerenti a ciascuno strumento diagnostico, può talvolta trasformare la sua identificazione in una vera sfida.
In occasione dell’ultimo congresso NAVDF che si è tenuto a Orlando lo scorso aprile, il Professore Ross Bond che lavora al Royal Veterinary College di Londra, ha effettuato un’analisi approfondita degli aspetti epidemiologici, clinici e diagnostici della dermatofitosi, evidenziando le insidie da evitare e offrendo prospettive per un approccio consapevole, indispensabile per una gestione ottimale.
1. Introduzione: La Complessità Inerente ai Dermatofiti
La dermatofitosi, benché familiare ai praticanti, nasconde una complessità che merita un’attenzione continua. Causata da funghi cheratinofili, principalmente della famiglia delle Arthrodermataceae, questa affezione coinvolge i peli, le unghie e lo strato corneo [1]. Se i generi Microsporum et Trichophyton sono storicamente i più incriminati negli animali, la tassonomia fungina è in costante evoluzione. L’avvento della micologia molecolare ha così rivelato nuovi generi, come Nannizzia et Arthroderma, la cui menzione nei rapporti di laboratorio potrebbe divenire più frequente [2]. Epidermophyton, da parte sua, rimane una rarità nella patologia animale, essendo il suo tropismo quasi esclusivamente umano. Di fronte a questa diversità eziologica e ad un caleidoscopio di manifestazioni cliniche, come può il veterinario navigare con sicurezza verso una diagnosi precisa?
2. Epidemiologia e Spettro dei Dermatofiti
Comprendere l’ecologia e la distribuzione dei dermatofiti è un primo passo cruciale per comprendere la loro patogenicità.
2.1. Classificazione Ecologica: Una Triade Fondamentale
La classificazione ecologica tradizionale distingue tre grandi categorie di dermatofiti, la cui conoscenza orienta il sospetto clinico e la ricerca della fonte di infezione:
-
Zoofili : Queste specie, come il paradigmatico Microsporum canis (principalmente nel gatto), sono adattate agli animali e si trasmettono facilmente tra loro. La loro identificazione implica spesso un’indagine dell’ambiente e dei congeneri.
-
Geofili : Questi funghi, di cui Microsporum gypseum è un rappresentante tipico, trovano il loro serbatoio nel suolo dove degradano la cheratina. Il contatto con un suolo contaminato è quindi il principale modo di trasmissione.
-
Antropofili : Specificamente adattati all’ospite umano, questi dermatofiti, come Trichophyton rubrum, sono meno frequentemente la causa di zoonosi inverse (dall’uomo all’animale) ma questa possibilità non deve essere scartata.
2.2. Distribuzione Geografica e Specificità dell’Ospite: Variazioni da Considerare
La prevalenza delle diverse specie di dermatofiti non è uniforme, variando significativamente a seconda della regione geografica e della specie animale interessata.
-
Nel gatto, Microsporum canis regna in tutto il mondo [3].
-
Nei bovini, Trichophyton verrucosum è il principale agente eziologico della tigna, con una distribuzione anch’essa globale.
-
Nei equini, Trichophyton equinum è frequentemente isolato, ma è interessante notare l’esistenza di variazioni di ceppi, come quella distinta identificata in Australia [4].
2.2.1. Il Caso del Cane: Un Quadro Epidemiologico Sfumato
L’epidemiologia della dermatofitosi canina illustra particolarmente bene questa variabilità geografica:
-
Au Regno Unito, studi di lunga durata, in particolare un’indagine che si è estesa per 35 anni a Bristol analizzando 475 isolamenti, hanno evidenziato la predominanza di M. canis (circa due terzi dei casi) seguito da Trichophyton mentagrophytes (circa un quarto) [5]. Uno studio di follow-up più recente su 26 anni nella stessa regione ha confermato questa tendenza, con tassi del 42% per M. canis e del 38% per T. mentagrophytes [6].
-
Aux Stati Uniti, uno studio condotto alla Louisiana State University nel 1991 riportava il 43% di M. canis e l’11% di T. mentagrophytes [7]. Une enquête plus ancienne du CDC, datant de 1958 et portant sur 368 isolements issus de 35 états, montrait une proportion de 69% pour M. canis e dell’11% per T. mentagrophytes [8].
Risulta quindi che T. mentagrophytes svolge un ruolo proporzionalmente più importante nel cane nel Regno Unito rispetto agli Stati Uniti, anche se M. canis rimane un patogeno chiave in entrambe le regioni. Quali fattori ambientali o legati all’ospite potrebbero spiegare queste differenze?
2.2.2. Altri Dermatofiti Notabili e i loro Serbatoi Ecologici
È necessaria vigilanza anche per altre specie meno frequenti ma la cui identificazione può avere implicazioni cliniche ed epidemiologiche:
-
Trichophyton erinacei : Questo agente, responsabile della “tigna del riccio”, vede la sua prevalenza direttamente correlata alla presenza di questi insettivori.
-
Trichophyton verrucosum : Principalmente trasmesso dai bovini, è raramente diagnosticato nel cane negli Stati Uniti, e solo sporadicamente nel Regno Unito.
-
Microsporum persicolor : Avendo come serbatoio principale arvicole e topi, questo dermatofito è poco comune nel cane nel Regno Unito e non è stato riportato in questa specie negli Stati Uniti, sebbene la sua presenza in Nord America (ad esempio, in Ontario, Canada) sia confermata [9].
-
Microsporum gypseum : Questo fungo geofilo è un agente causale maggiore di dermatofitosi in Louisiana (44% dei casi canini) e rimane significativo in altri studi americani (18% dei casi). In netto contrasto, a Bristol, ci sono voluti 35 anni per isolare M. gypseum da soli quattro cani. Questa disparità solleva la questione dell’influenza dei fattori pedoclimatici, un suolo più caldo negli Stati Uniti potrebbe favorire la sua sopravvivenza e proliferazione.
2.3. Fattori Predisponenti: Identificare i Soggetti a Rischio
Alcuni fattori intrinseci all’animale o legati al suo ambiente possono aumentare la sua suscettibilità alla dermatofitosi:
-
Età : Gli animali giovani, il cui sistema immunitario è ancora immaturo, sono classicamente considerati più vulnerabili all’infezione da M. canis. Inversamente, gli animali più anziani, se sono migliori cacciatori, potrebbero essere più esposti ai dermatofiti trasmessi dalla fauna selvatica.
-
Razza : Sono state suggerite predisposizioni razziali. Gli Yorkshire Terrier sembrano più sensibili a M. canis (nel Regno Unito), mentre i Jack Russell Terrier potrebbero essere più inclini alle dermatofitosi acquisite dalla fauna selvatica. I gatti a pelo lungo, di tipo Persiano, sono anche frequentemente citati.
-
Stagionalità : Se in Regno Unito si notano poche variazioni stagionali marcate, uno studio americano ha suggerito un’incidenza aumentata di T. mentagrophytes in autunno.
3. Il Volto Polimorfo della Dermatofitosi: Riconoscere i Segni
La dermatofitosi è una “grande simulatrice”. La sua presentazione clinica può essere così variata da imporre al praticante un indice di sospetto elevato. Come ricordava Michael Schaer, “Se non ci pensi, non la troverai” [10] – un detto particolarmente pertinente qui.
3.1. Presentazioni Classiche: I Segni di Allerta
Alcune manifestazioni sono considerate più tipiche, benché non patognomoniche:
-
Nei bovini (T. verrucosum): Lesioni caratteristiche, ben circoscritte, alopeciche, ricoperte di squame grigiastre e dense, localizzate preferenzialmente sulla testa, sul collo e sulle orecchie. Queste lesioni sono più frequenti negli animali confinati all’interno durante l’inverno.
-
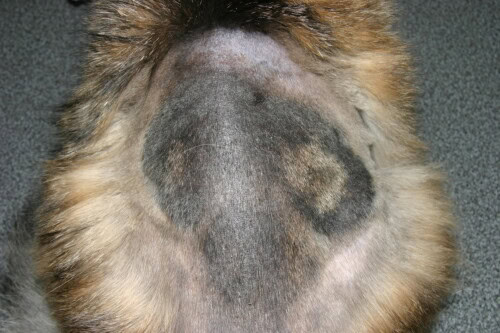
Nei cani e gatti (M. canis): La lesione classica è un’alopecia circolare, squamosa, a volte eritematosa e crostosa, posizionata spesso sulla testa. Tuttavia, si osservano anche forme meno infiammatorie, limitate a una zona di alopecia senza reazione cutanea marcata.
È sempre importante tenere a mente l’avvertimento di Danny Scott: “Se sembra tigna [nel cane], probabilmente non lo è. È probabilmente una follicolite stafilococcica.” [11]. Infatti, nel cane, le lesioni anulari espansive sono più spesso di origine batterica.
3.2. Forme Atypique e Trappole Diagnostiche
È qui che la diagnosi può diventare un vero esercizio di finezza:
-
Follicolite e Furunculosi del Muso (Dermatofiti Silvestri) : Frequentemente associate a T. mentagrophytes ou T. erinacei nei cani che hanno contatti con roditori o ricci (cani da caccia, terrier). Queste lesioni possono essere unilaterali o asimmetriche, con una tendenza alla guarigione centrale e un’infiammazione periferica attiva. Il piano nasale è tipicamente risparmiato.
-
Lesioni Nodulari e Placche (Chirone, Pseudomicetoma) :
-
Un Jack Russell Terrier che ha esplorato una tana di conigli ha sviluppato una placca eritematosa e squamo-crostosa sul petto, oltre a una lesione nodulare distinta sul carpo, entrambe confermate come dovute a T. mentagrophytes.
-
Un Doberman con multiple placche eritematose, per le quali inizialmente si sospettava un linfoma cutaneo, si è rivelato affetto da una dermatofitosi da T. mentagrophytes. Quale sorpresa per il clinico di fronte a questa diagnosi inaspettata?
-
Nel gatto Persiano, il pseudomicetoma (o cherion profondo) causato da M. canis è una entità ben descritta, che si manifesta con noduli, tragitti fistolosi e talvolta l’espulsione di granuli che ricordano i “grani di zolfo”.
-
Un caso riportato in Croazia descrive un cherion in un gatto – un nodulo fluttuante e purulento – causato da M. gypseum in associazione con una sovrainfezione stafilococcica.
-
-
Lesioni Irregolari e Sottili : Un gatto cacciatore ha presentato una alopecia discreta sul muso e lesioni eritemato-desquamative sul padiglione auricolare dovute a T. mentagrophytes, una specie tuttavia poco comune nei felini. Ciò sottolinea l’importanza di non affidarsi unicamente alle associazioni classiche specie fungina/ospite.
-
Infezioni Nosocomiali : Lesioni di dermatofitosi possono svilupparsi su siti precedentemente tosati per un intervento chirurgico o l’inserimento di un catetere endovenoso. L’igiene rigorosa del materiale da toelettatura, con una disinfezione sistematica tra ogni animale, è quindi una misura preventiva non trascurabile.
-
Forma Squamosa Generalizzata (M. persicolor) : Contrariamente alla maggior parte degli altri dermatofiti, M. persicolor non invade lo stelo pilifero ma colonizza unicamente lo strato corneo. Ne consegue una desquamazione generalizzata, talvolta intensa, senza alopecia significativa. Un caso illustrativo è quello di un cane con una storia di quattro anni di scaglie generalizzate, infine diagnosticato come un’infezione da M. persicolor.
Forma molto estesa di una dermatofitosi felina
3.3. Casi Particolari: Cavie e Conigli – Il Tranello del Portaggio Asintomatico
Questi piccoli mammiferi, particolarmente quelli provenienti da negozi di animali o comunità, possono essere portatori asintomatici del complesso T. mentagrophytes (frequentemente identificato con tecniche molecolari sotto il nome di T. benhamiae). Questo portaggio asintomatico rappresenta una sfida maggiore per il controllo dell’infezione.
-
Prevalenza del portaggio asintomatico :
-
Nei negozi di animali belgi, studi hanno mostrato che il 3,5% delle cavie e il 3,8% dei conigli clinicamente sani erano portatori [12].
-
Nei negozi di animali slovacchi, queste cifre si elevavano al 10% per le cavie e al 6% per i conigli sani [13].
-
Uno studio condotto in negozi di animali berlinesi, utilizzando la PCR, ha rivelato che se il 9% delle cavie presentava lesioni cliniche, un numero sorprendente del 90% dell’insieme delle cavie testate era portatore del DNA di T. benhamiae [14]. Ces chiffres interpellent quant à la source potentielle d’infection pour d’autres animaux ou pour l’homme.
-
-
Casi clinici (conigli in Spagna) : Tra i conigli che presentavano lesioni cliniche di dermatofitosi, il 54% degli isolamenti corrispondeva a T. mentagrophytes e il 27% a M. canis [15].
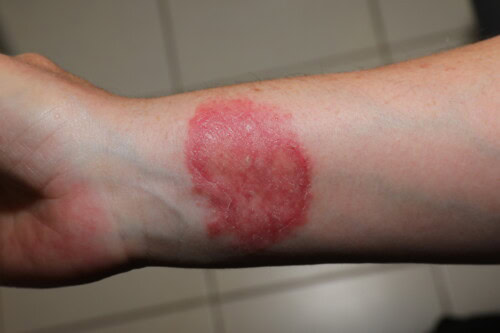
3.4. La Dermatofitosi come Zoonosi: Una Preoccupazione Costante
È imperativo ricordarsi del potenziale zoonotico della dermatofitosi. Numerosi casi di trasmissione all’uomo sono documentati, interessando sia i proprietari (e i loro figli, come illustrato da un caso di trasmissione a partire da una cavia infetta) sia il personale veterinario (un residente in neurologia che ha contratto l’infezione da un paziente canino).
Contaminazione umana da un dermatofita
4. Strategie Diagnostiche: Verso un Approccio Multimodale
La diagnosi della dermatofitosi non si basa su un test unico infallibile. Un approccio multimodale, che combina l’esame clinico a vari test complementari, è la chiave.
4.1. Esame Microscopico Diretto (Tricogramma): Il primo esame da realizzare
Questo esame semplice e rapido può fornire indizi preziosi.
-
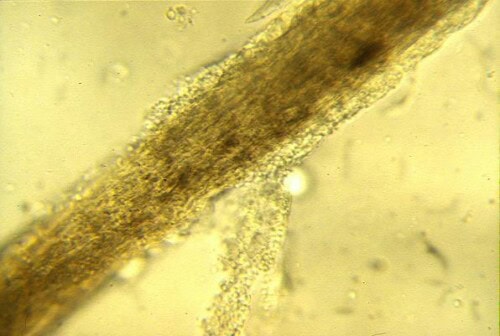
Tecnica : È opportuno prelevare peli nella periferia attiva delle lesioni, focalizzandosi su quelli che appaiono “cottonosi”, spezzati o anormali. Il campione è montato tra vetrino e coprivetrino, classicamente in una goccia di KOH al 10-20% (che aiuta a chiarire i detriti cheratinici) o semplicemente in olio minerale. L’elemento cruciale è di abbassare il condensatore del microscopio e regolare il diaframma per aumentare il contrasto, poiché gli elementi fungini sono spesso poco refringenti in luce bianca. Si ricerca la presenza di artrospore ectotrix (che formano una guaina intorno al pelo) o di ife segmentate endotrix (all’interno dello stelo pilifero).
-
Sensibilità : Lo studio di Bristol, confrontando la microscopia alla cultura, ha riportato una sensibilità globale del 55%. Era più elevata per M. canis (58%), spesso associato a una produzione abbondante di spore facilmente visibili, che per T. mentagrophytes (44%), dove le ife possono essere più discrete e localizzate nelle squame. È probabile che la sensibilità sia minore per i medici meno esperti.
-
Trappole e artefatti : La confusione è possibile con artefatti come guaine pilifere interne o esterne, detriti di cheratina, bolle d’aria, o anche conidi di funghi saprofiti che possono contaminare la superficie della pelle. Una buona conoscenza della morfologia fungina è indispensabile.
-
Coloranti aggiuntivi : Anche se non indispensabili se la tecnica d’illuminazione è padroneggiata, coloranti come il “Potash Kwik” (una soluzione commerciale di KOH contenente un inchiostro) o l’inchiostro Parker possono aiutare a contrastare gli elementi fungini. Il Calcofluor White è un’opzione più sofisticata (vedi sezione 4.5).
Pelo tignoso
4.2. Lampada di Wood: Uno Strumento Classico dai Limiti Conosciuti
La lampada di Wood rimane uno strumento utile, a patto di conoscerne le specificità.
-
Principio e fluorescenza : Alcuni ceppi di M. canis (ma non tutti) producono, nel corso del loro metabolismo, pteridina, una sostanza che emette una fluorescenza verde mela caratteristica quando esposta a una luce ultravioletta di una lunghezza d’onda specifica (circa 365 nm). È importante notare che sono i peli attivamente infetti a fluorescere, e non le squame, le croste o le colonie in coltura.
-
Specificità e limiti : Questo esame è principalmente pertinente per il sospetto di infezione da M. canis. La maggioranza delle specie di Trichophyton non producono questa fluorescenza. Inoltre, anche per M. canis, non tutti i ceppi sono fluorescenti.
-
Condizioni ottimali di esame : Per massimizzare le possibilità di rilevamento, l’esame deve essere realizzato in una stanza totalmente oscura. La lampada deve essere correttamente preriscaldata per diversi minuti prima dell’uso. Si raccomanda vivamente l’utilizzo di una lampada di Wood di qualità, specificamente progettata per uso veterinario e idealmente equipaggiata con una lente d’ingrandimento.
-
Sensibilità : Per le infezioni da M. canis, la sensibilità della lampada di Wood varia secondo gli studi, situandosi generalmente tra il 54% e il 70% [16]. Un risultato negativo non esclude quindi mai una dermatofitosi.
4.3. Coltura Fungina: Identificazione e Vitalità
La coltura fungina rimane un metodo di riferimento per l’identificazione precisa della specie e la conferma della vitalità del patogeno.
-
Prelievo dei campioni : I peli e le squame o croste devono essere prelevati alla periferia delle lesioni più attive. Per il rilevamento dei portatori asintomatici o il monitoraggio dell’efficacia terapeutica, il metodo del pennello sterile (tipo pennello di McKenzie) passato su tutta la pelliccia, o l’uso di piastre di agar con un lato testurizzato per il prelievo (come il Derm-Duet), sono tecniche comprovate.
-
Terreni di coltura : Il terreno di Sabouraud Dextrose Agar (SDA) è il mezzo base classicamente usato. L’incubazione deve essere effettuata a una temperatura di 26-27°C e può richiedere fino a 4 settimane prima che una coltura possa essere considerata definitivamente negativa.
-
Identificazione delle colonie : L’identificazione si basa su una combinazione di criteri:
-
Macroscopici : Aspetto della colonia (colore, texture – cotonosa, polverosa, granulosa), velocità di crescita, e produzione eventuale di un pigmento diffusibile nell’agar o visibile al rovescio della colonia.
-
Microscopici : Dopo prelievo di una porzione della colonia (spesso con l’ausilio di un nastro adesivo trasparente applicato sulla superficie poi trasferito su un vetrino) e colorazione (classicamento al blu di lattolunesina), l’osservazione delle macroconiidi e delle microconiidi (forma, dimensione, parete, settazione) è determinante per l’identificazione della specie. È cruciale ricordare che le macroconiidi sono strutture prodotte in vitro (in coltura) e generalmente non sono osservate su prelievi diretti dall’animale.
-
-
Terreno DTM (Dermatophyte Test Medium) : Questo terreno differenziale è un SDA modificato con l’aggiunta di un indicatore di pH (fenolo rosso) e di agenti inibitori (come il cicloesimide per inibire i saprofiti a crescita rapida, e antibiotici come la gentamicina e la clortetraciclina per inibire i batteri). Il principio si basa sul metabolismo preferenziale dei dermatofiti: utilizzano inizialmente le fonti proteiche del terreno, producendo metaboliti alcalini che cambiano l’indicatore del pH da giallo a rosso. I funghi saprofiti, invece, tendono a utilizzare inizialmente i carboidrati (acidificazione, quindi nessun cambiamento di colore iniziale o viraggio al giallo), poi, se la coltura continua, possono anche metabolizzare le proteine, portando a un ritardo nel viraggio al rosso che può causare confusione.
-
Interpretazione del DTM : Un cambiamento di colore rosso precoce, che appare contemporaneamente o prima della crescita visibile della colonia (generalmente nei 3-7 giorni), associato a una colonia con aspetto compatibile (spesso bianca, crema, soffice o polverosa), è fortemente indicativo di un dermatofita.
-
Limiti del DTM : L’interpretazione del DTM in clinica generale può rivelarsi meno affidabile rispetto a un laboratorio di micologia specializzato. Uno studio israeliano ha mostrato un tasso di concordanza di solo l’80% tra le letture in clinica e quelle di laboratorio, con falsi positivi e falsi negativi più frequenti in clinica [17]. Fattori come una temperatura di incubazione ambientale troppo bassa possono ritardare il cambiamento di colore. Inoltre, un’incubazione prolungata può portare a un cambiamento al rosso da parte dei funghi saprofiti, fonte di errori diagnostici.
-
4.4. Istopatologia: Quando la Lesione è Profonda o Atipica
L’esame istopatologico di biopsie cutanee può essere particolarmente informativo, soprattutto per le forme nodulari o quando gli altri test non sono conclusivi.
-
Visualizzazione degli elementi fungini : I feudi possono essere visualizzati nel fusto del pelo, nei follicoli piliferi, o talvolta liberamente nel derma in caso di foruncolosi. Spore possono essere osservate anche attorno ai peli. L’uso di colorazioni speciali come PAS (Periodic Acid-Schiff) o GMS (Grocott Methenamine Silver) è spesso indispensabile per evidenziare chiaramente le strutture fungine, che possono essere poco evidenti alla colorazione H&E standard.
-
Modelli infiammatori associati :
-
Nel caso di M. persicolor, l’infiammazione può essere discreta, con principalmente un’infiltrazione di linfociti nelle scaglie dello strato corneo.
-
Per la maggior parte degli altri dermatofiti invasivi, si possono osservare follicoliti (infiammazione del follicolo pilifero), perifollicoliti, o anche foruncolosi (rottura del follicolo con intensa reazione infiammatoria nel derma).
-
Nei casi di cherion o pseudomicetoma, si osservano tipicamente noduli infiammatori profondi, spesso granulomatosi o piogranulomatosi, contenenti elementi fungini, talvolta sotto forma di ‘granuli’.
-
4.5. PCR (Reazione a catena della polimerasi): Uno Strumento Molecolare in Crescita
La PCR consente la rilevazione sensibile dell’ADN fungino da campioni di peli e scaglie.
-
Principi e bersagli : I pannelli PCR veterinari generalmente mirano a sequenze di ADN conservate nei dermatofiti, permettendo una rilevazione di gruppo (ad esempio, Microsporum spp., Trichophyton spp.). Primer più specifici possono essere utilizzati successivamente per identificare alcune specie di interesse maggiore, come M. canis.
-
Interpretazione e sfumature :
-
Una PCR positiva in un animale che presenta segni clinici compatibili è fortemente indicativa di un’infezione attiva.
-
In un animale clinicamente sano, una PCR positiva può indicare un portare asintomatico o una semplice contaminazione ambientale transitoria dei peli. La soglia di rilevamento della PCR è spesso molto bassa.
-
Un limite importante della PCR è la sua capacità di rilevare l’ADN fungino che provenga da organismi vitali o non vitali. Pertanto, una PCR può restare positiva per un certo tempo dopo un trattamento antifungino efficace, rilevando semplicemente l’ADN delle spore morte. Non conferma quindi necessariamente un’infezione attiva in corso e la sua utilità per il monitoraggio terapeutico è discussa.
-
-
Confronto con la coltura fungina : Secondo l’esperto micologo Patrick Bourdeau, la coltura fungina, quando eseguita e interpretata da un laboratorio specializzato, può risultare più sensibile di alcune PCR commerciali. Inoltre, la coltura offre il vantaggio cruciale di permettere l’identificazione precisa della specie (essenziale per l’epidemiologia e la ricerca della fonte di contaminazione) e di confermare la vitalità del fungo.
-
Raccomandazioni dei consensus : Il consenso del 2017 sulla dermatofitosi felina dell’International Society of Companion Animal Infectious Diseases (ISCAID) riconosce la PCR come uno strumento diagnostico utile, ma sottolinea che la sua interpretazione deve essere prudente e contestualizzata con i dati clinici ed epidemiologici [18].
4.6. Microscopi a Fluorescenza con Calcofluor White: Migliorare la Rilevazione Diretta
Il Calcofluor White è un colorante non specifico che si lega con alta affinità alla cellulosa e alla chitina, componenti principali delle pareti cellulari fungine.
-
Tecnica : I campioni di peli e scaglie sono prima trattati con una soluzione di KOH (per chiarire i detriti cellulari dell’ospite), poi viene aggiunta una goccia di Calcofluor White. Dopo un breve tempo di incubazione, il campione è esaminato sotto un microscopio dotato di una fonte di luce UV e filtri appropriati (generalmente per un’eccitazione nell’UV vicino e un’emissione nel blu o nel verde).
-
Vantaggi : Gli elementi fungini (ife, spore) appaiono allora brillantemente fluorescenti, staccandosi nettamente dal fondo non fluorescente. Questa tecnica aumenta in modo significativo la sensibilità e la rapidità della rilevazione microscopica diretta rispetto all’esame in luce bianca convenzionale. È stato riportato che l’uso del Calcofluor White può praticamente raddoppiare la sensibilità della microscopia diretta.
La dermatofitosi è un vero crocevia di sfide diagnostiche. Come orientarsi?
-
La grande variabilità clinica : Impone di includere sempre la dermatofitosi nella diagnosi differenziale di molte affezioni cutanee, anche quelle che non presentano l’aspetto ‘classico’.
-
L’assenza di un ‘gold standard’ unico e infallibile : I recenti consensus di esperti sottolineano che nessun test diagnostico, preso isolatamente, è perfetto [18]. Un approccio combinato è spesso il più fruttuoso. L’associazione dell’esame con la lampada di Wood (se un’infezione da M. canis è sospettata) e dell’esame microscopico diretto (idealmente con Calcofluor White per aumentarne la sensibilità) costituisce un’ottima prima linea di investigazione in clinica.
-
La persistenza ambientale delle spore : Le spore di M. canis possono rimanere vitali nell’ambiente per periodi fino a 14 mesi, o anche di più. Questa longevità complica notevolmente la gestione dell’infezione, in particolare la prevenzione delle reinfezioni e la trasmissione ad altri animali o all’uomo. Tosare gli animali infetti (se realizabile e ben tollerato) può contribuire a ridurre la carica ambientale di peli contaminati e quindi di spore.
-
Il rischio zoonotico costante : L’infettività dell’animale per l’uomo diminuisce con l’instaurazione di un trattamento antifungino efficace, ma misure di precauzione (rigida igiene, limitazione dei contatti stretti, in particolare per bambini, anziani o individui immunodepressi) devono essere mantenute per tutta la durata del trattamento e fino alla conferma della guarigione micologica.
-
Le forme nodulari profonde (cheratoma o pseudomicetoma) : La loro diagnosi può essere particolarmente ardua e spesso ritardata se la sospetta iniziale di dermatofitosi è bassa. In questi casi, l’esame istopatologico di biopsie profonde, con colorazioni speciali per i funghi, e la coltura fungina a partire dal tessuto bioptico sono frequentemente indispensabili.
-
L’interpretazione critica dei risultati dei test e delle loro limitazioni intrinseche :
-
Microscopia diretta : La sua sensibilità è fortemente dipendente dall’esperienza dell’operatore e dalla precisione della tecnica impiegata (in particolare l’aggiustamento adeguato del condensatore).
-
DTM in clinica : Il rischio di errata interpretazione del cambiamento di colore (confusione con la crescita di funghi saprofiti in caso di lettura tardiva o di prolungata incubazione) è un limite riconosciuto.
-
PCR : Sebbene molto sensibile, la PCR non distingue l’ADN di un’infezione attiva dalla semplice presenza di spore vitali o non vitali. Pertanto, una PCR positiva su un animale in trattamento o recentemente trattato non significa necessariamente un fallimento terapeutico.
-
Coltura fungina : Considerata una metodologia di riferimento per l’identificazione della specie e la conferma della vitalità del patogeno, la coltura può tuttavia risultare falsamente negativa se il prelievo è inadeguato, se sono stati applicati recentemente antifungini topici sulle lesioni, o se la tecnica di laboratorio non è ottimale. Può anche essere contaminata da funghi saprofiti a crescita rapida che possono mascherare o essere confusi con i dermatofiti.
-
-
L’impatto dell’uso inappropriato dei corticosteroidi : La somministrazione di glucocorticoidi, sia per via sistemica che topica, in assenza di una diagnosi eziologica precisa, può significativamente aggravare una dermatofitosi preesistente (dermatofitosi incognito) o mascherarne i segni clinici, rendendo la diagnosi successiva più complessa e il trattamento più lungo.
-
Il concetto di dose infettante e di immunità : Una certa quantità di spore fungine è necessaria per avviare un’infezione clinica. Gli animali che sviluppano una risposta immunitaria efficace a seguito di una prima infezione possono mostrare una resistenza aumentata a una reinfezione successiva da una dose simile di spore.
6. Conclusioni e Prospettive: Verso una Pratica Informata
La dermatofitosi, per la sua natura proteiforme e le sfide inerenti alla sua diagnosi, richiede al clinico veterinario una vigilanza costante e un approccio diagnostico strategico. Non ci sono scorciatoie infallibili. Il riconoscimento delle varie manifestazioni cliniche, la comprensione dei limiti e dei vantaggi di ogni strumento diagnostico, e l’integrazione dei dati epidemiologici sono i pilastri di un approccio riuscito.
Il futuro probabilmente risiede nell’ottimizzazione e nella combinazione intelligente delle tecniche esistenti. La microscopia diretta, rivalorizzata da strumenti come il Calcofluor White, mantiene un ruolo di primo piano per una diagnosi rapida in clinica. La coltura fungina, idealmente eseguita in laboratori specializzati, rimane indispensabile per un’identificazione precisa e per valutare la vitalità, soprattutto nei casi complessi o per il monitoraggio terapeutico. La PCR, d’altro canto, offre un’elevata sensibilità ma la sua interpretazione deve essere prudente e sempre correlata al contesto clinico.
Forse assisteremo all’emergere di test molecolari rapidi “presso il letto del paziente” che combineranno sensibilità e specificità informando anche sulla vitalità? O ad algoritmi diagnostici più standardizzati che integrino le potenzialità di ciascun metodo?
Nell’attesa di questi sviluppi, il messaggio chiave resta: un alto sospetto clinico, una selezione giudiziosa dei test in base al caso, e un’interpretazione critica dei risultati sono i garanti di una gestione ottimale di questa affezione fungina, per il benessere dei nostri pazienti e la serenità dei loro proprietari.
Riferimenti
[1] Weitzman I, Summerbell RC. The dermatophytes. Clin Microbiol Rev. 1995 Apr;8(2):240-59.
[2] de Hoog GS, Guarro J, Gené J, Figueras MJ. Atlas of Clinical Fungi. 4th ed. Centraalbureau voor Schimmelcultures; 2020.
[3] Moriello KA, Coyner K, Paterson S, Mignon B. Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol. 2017 Jun;28(3):266-e68.
[4] Kano R, Hirai A, Yoshioka N, et al. Arthroderma vanbreuseghemii/Trichophyton mentagrophytes complex isolated from an Australian Cavy. Med Mycol J. 2009;50(3):309-12.
[5] Sparkes AH, Robinson A, MacKay AD, et al. A study of the dermatophytes of dogs and cats in the south of England. J Small Anim Pract. 1993 Oct;34(10):507-13.
[6] Donnely T. Personal communication/unpublished data cited in the presentation. (Note: This would require a formal citation if available, or acknowledgement of the source.)
[7] Miller WH Jr, Scott DW, Wellington JR. Isolation of dermatophytes from the haircoats of normal dogs and cats in the southeastern United States. J Am Anim Hosp Assoc. 1991;27:555-8.
[8] Kaplan W, Georg LK, Ajello L. Recent developments in animal ringworm and their public health implications. Ann N Y Acad Sci. 1958;70:636-49.
[9] Bourdeau P. Dermatophyties des carnivores domestiques : aspects épidémiocliniques et diagnostiques. Point Vét. 2005;36(254):44-51.
[10] Schaer M. Clinical Medicine of the Dog and Cat. 2nd ed. Manson Publishing; 2010. (Note: Attributing this specific quote directly to a publication by Schaer would require verification if not explicitly stated as such in the audio.)
[11] Scott DW, Miller WH Jr, Griffin CE. Muller and Kirk’s Small Animal Dermatology. 7th ed. Elsevier Health Sciences; 2012.
[12] Dekeyser H, Adriaensen C, Mignon B, et al. Asymptomatic carriage of dermatophytes by dogs and cats. Vet Dermatol. 2009 Aug;20(4):253-8.
[13] Čonková E, Kollarova L. Dermatophytes isolated from asymptomatic guinea pigs and rabbits in Slovakia. Mycoses. 2010 Jul;53(4):325-8.
[14] Kraemer A, Mueller RS, Schauer U, et al. Dermatophytes in pet guinea pigs and rabbits. Vet Microbiol. 2012 May 25;157(1-2):208-13.
[15] Cafarchia C, Figueredo LA, Otranto D. Fungal diseases of rabbits. Vet Microbiol. 2013 Nov 15;167(1-2):227-43.
[16] Newbury S. Wood’s lamp examination in small animal practice. Vet Clin North Am Small Anim Pract. 2000 Nov;30(6):1099-105.
[17] Kuzi S, Nivy R, Lavy E, et al. Comparison of real-time PCR and dermatophyte test medium culture for the diagnosis of dermatophytosis in a referral hospital setting. Vet Dermatol. 2016 Feb;27(1):32-e9.
[18] Moriello KA, Coyner K, Paterson S, Mignon B. Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol. 2017 Jun;28(3):266-e68.