La dermatophytose, infection fongique des tissus kératinisés, demeure une entité clinique fréquente en médecine vétérinaire. Sa présentation polymorphe, couplée à la diversité des agents étiologiques et aux limites inhérentes à chaque outil diagnostique, peut parfois transformer son identification en un véritable défi.
A l’occasion du dernier congrès NAVDF qui s’est déroulé à Orlando en avril dernier, le Professeur Ross Bond qui exerce au Royal Veterinary College à Londres, a effectué une analyse approfondie des aspects épidémiologiques, cliniques et diagnostiques de la dermatophytose, en soulignant les pièges à éviter et en offrant des perspectives pour une démarche éclairée, indispensable à une prise en charge optimale.
1. Introduction : La Complexité Inhérente aux Dermatophytes
La dermatophytose, bien que familière aux praticiens, cache une complexité qui mérite une attention soutenue. Causée par des champignons kératinophiles, principalement issus de la famille des Arthrodermataceae, cette affection touche les poils, les griffes et le stratum corneum [1]. Si les genres Microsporum et Trichophyton sont historiquement les plus incriminés chez l’animal, la taxonomie fongique est en constante évolution. L’avènement de la mycologie moléculaire a ainsi révélé de nouveaux genres, tels que Nannizzia et Arthroderma, dont la mention sur les rapports de laboratoire pourrait devenir plus fréquente [2]. Epidermophyton, quant à lui, reste une rareté en pathologie animale, son tropisme étant quasi exclusivement humain. Face à cette diversité étiologique et à un kaléidoscope de manifestations cliniques, comment le vétérinaire peut-il naviguer avec assurance vers un diagnostic précis ?
2. Épidémiologie et Spectre des Dermatophytes
Comprendre l’écologie et la distribution des dermatophytes est une première étape cruciale pour appréhender leur pathogénie.
2.1. Classification Écologique : Une Triade Fondamentale
La classification écologique traditionnelle distingue trois grandes catégories de dermatophytes, dont la connaissance oriente la suspicion clinique et la recherche de la source d’infection :
-
Zoophiles : Ces espèces, comme le paradigmatique Microsporum canis (principalement chez le chat), sont adaptées aux animaux et se transmettent aisément entre eux. Leur identification implique souvent une investigation de l’environnement et des congénères.
-
Géophiles : Ces champignons, dont Microsporum gypseum est un représentant typique, trouvent leur réservoir dans le sol où ils dégradent la kératine. Le contact avec un sol contaminé est donc le mode de transmission principal.
-
Anthropophiles : Spécifiquement adaptés à l’hôte humain, ces dermatophytes, tel Trichophyton rubrum, sont moins fréquemment la cause de zoonoses inversées (de l’homme vers l’animal) mais cette possibilité ne doit pas être écartée.
2.2. Distribution Géographique et Spécificité d’Hôte : Des Variations à Considérer
La prévalence des différentes espèces de dermatophytes n’est pas uniforme, variant significativement selon la région géographique et l’espèce animale concernée.
-
Chez le chat, Microsporum canis règne en maître à l’échelle mondiale [3].
-
Chez les bovins, Trichophyton verrucosum est l’agent étiologique majeur de la teigne, avec une distribution également globale.
-
Chez les équins, Trichophyton equinum est fréquemment isolé, mais il est intéressant de noter l’existence de variations de souches, comme celle distincte identifiée en Australie [4].
2.2.1. Le Cas du Chien : Un Tableau Épidémiologique Nuancé
L’épidémiologie de la dermatophytose canine illustre particulièrement bien cette variabilité géographique :
-
Au Royaume-Uni, des études de longue durée, notamment une enquête s’étalant sur 35 ans à Bristol et analysant 475 isolements, ont mis en évidence la prédominance de M. canis (environ deux tiers des cas) suivi de Trichophyton mentagrophytes (environ un quart) [5]. Une étude de suivi plus récente sur 26 ans dans la même région a confirmé cette tendance, avec des chiffres de 42% pour M. canis et 38% pour T. mentagrophytes [6].
-
Aux États-Unis, une étude menée à la Louisiana State University en 1991 rapportait 43% de M. canis et 11% de T. mentagrophytes [7]. Une enquête plus ancienne du CDC, datant de 1958 et portant sur 368 isolements issus de 35 états, montrait une proportion de 69% pour M. canis et de 11% pour T. mentagrophytes [8].
Il apparaît donc que T. mentagrophytes joue un rôle proportionnellement plus important chez le chien au Royaume-Uni qu’aux États-Unis, même si M. canis demeure un pathogène clé dans ces deux régions. Quels facteurs environnementaux ou liés à l’hôte pourraient expliquer ces différences ?
2.2.2. Autres Dermatophytes Notables et Leurs Réservoirs Écologiques
La vigilance s’impose également pour d’autres espèces moins fréquentes mais dont l’identification peut avoir des implications cliniques et épidémiologiques :
-
Trichophyton erinacei : Cet agent, responsable de la “teigne du hérisson”, voit sa prévalence directement corrélée à la présence de ces insectivores.
-
Trichophyton verrucosum : Principalement transmis par les bovins, il est rarement diagnostiqué chez le chien aux États-Unis, et seulement sporadiquement au Royaume-Uni.
-
Microsporum persicolor : Ayant pour réservoir principal les campagnols et les souris, ce dermatophyte est peu commun chez le chien au Royaume-Uni et n’a pas été rapporté chez cette espèce aux États-Unis, bien que sa présence en Amérique du Nord (par exemple, en Ontario, Canada) soit confirmée [9].
-
Microsporum gypseum : Ce champignon géophile est un agent causal majeur de dermatophytose en Louisiane (44% des cas canins) et reste significatif dans d’autres études américaines (18% des cas). En contraste frappant, à Bristol, il a fallu 35 ans pour isoler M. gypseum de seulement quatre chiens. Cette disparité soulève la question de l’influence des facteurs pédoclimatiques, un sol plus chaud aux États-Unis pouvant favoriser sa survie et sa prolifération.
2.3. Facteurs Prédisposants : Identifier les Sujets à Risque
Certains facteurs intrinsèques à l’animal ou liés à son environnement peuvent augmenter sa susceptibilité à la dermatophytose :
-
Âge : Les jeunes animaux, dont le système immunitaire est encore immature, sont classiquement considérés comme plus vulnérables à l’infection par M. canis. Inversement, les animaux plus âgés, s’ils sont de meilleurs chasseurs, pourraient être davantage exposés aux dermatophytes transmis par la faune sauvage.
-
Race : Des prédispositions raciales ont été suggérées. Les Yorkshire Terriers semblent plus sensibles à M. canis (au Royaume-Uni), tandis que les Jack Russell Terriers pourraient être plus enclins aux dermatophytoses acquises de la faune sauvage. Les chats à poils longs, de type Persan, sont également fréquemment cités.
-
Saisonnalité : Si peu de variations saisonnières marquées sont notées au Royaume-Uni, une étude américaine a suggéré une incidence accrue de T. mentagrophytes en automne.
3. Le Visage Polymorphe de la Dermatophytose : Reconnaître les Signes
La dermatophytose est une “grande simulatrice”. Sa présentation clinique peut être si variée qu’elle impose au praticien un indice de suspicion élevé. Comme le rappelait Michael Schaer, “Si vous n’y pensez pas, vous ne le trouverez pas” [10] – un adage particulièrement pertinent ici.
3.1. Présentations Classiques : Les Signes d’Appel
Certaines manifestations sont considérées comme plus typiques, bien que non pathognomoniques :
-
Chez les bovins (T. verrucosum) : Lésions caractéristiques, bien circonscrites, alopéciques, recouvertes de squames grisâtres et épaisses, localisées préférentiellement sur la tête, le cou et les oreilles. Ces lésions sont plus fréquentes chez les animaux confinés en intérieur durant l’hiver.
-
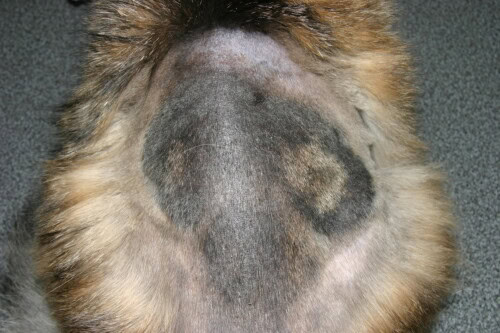
Chez les chiens et chats (M. canis) : La lésion classique est une alopécie circulaire, squameuse, parfois érythémateuse et croûteuse, siégeant souvent sur la tête. Cependant, des formes moins inflammatoires, se limitant à une zone d’alopécie sans réaction cutanée marquée, sont également observées.
Il convient de toujours garder à l’esprit l’avertissement de Danny Scott : “Si cela ressemble à la teigne [chez le chien], ce n’en est probablement pas. C’est probablement une folliculite staphylococcique.” [11]. En effet, chez le chien, les lésions annulaires expansives sont plus souvent d’origine bactérienne.
3.2. Formes Atypiques et Pièges Diagnostiques
C’est ici que le diagnostic peut devenir un véritable exercice de subtilité :
-
Folliculite et Furonculose du Museau (Dermatophytes Sylvatiques) : Fréquemment associées à T. mentagrophytes ou T. erinacei chez les chiens ayant des contacts avec des rongeurs ou des hérissons (chiens de chasse, terriers). Ces lésions peuvent être unilatérales ou asymétriques, avec une tendance à la guérison centrale et une inflammation périphérique active. Le planum nasal est typiquement épargné.
-
Lésions Nodulaires et Plaques (Kérion, Pseudomycétome) :
-
Un Jack Russell Terrier ayant exploré un terrier de lapins a développé une plaque érythémateuse et squamo-croûteuse sur le poitrail, ainsi qu’une lésion nodulaire distincte sur le carpe, toutes deux confirmées comme étant dues à T. mentagrophytes.
-
Un Doberman présentant de multiples plaques érythémateuses, pour lesquelles un lymphome cutané était initialement suspecté, s’est révélé être atteint d’une dermatophytose à T. mentagrophytes. Quelle ne fut pas la surprise du clinicien face à ce diagnostic inattendu ?
-
Chez le chat Persan, le pseudomycétome (ou kérion profond) causé par M. canis est une entité bien décrite, se manifestant par des nodules, des trajets fistuleux et parfois l’expulsion de grains évoquant des “grains de soufre”.
-
Un cas rapporté en Croatie décrit un kérion chez un chat – un nodule fluctuant et purulent – causé par M. gypseum en association avec une surinfection staphylococcique.
-
-
Lésions Irrégulières et Subtiles : Un chat chasseur a présenté une alopécie discrète sur le museau et des lésions érythémato-squameuses sur le pavillon auriculaire dues à T. mentagrophytes, une espèce pourtant peu commune chez le félin. Cela souligne l’importance de ne pas se fier uniquement aux associations classiques espèce fongique/hôte.
-
Infections Nosocomiales : Des lésions de dermatophytose peuvent se développer sur des sites préalablement tondus pour une intervention chirurgicale ou l’insertion d’un cathéter intraveineux. L’hygiène rigoureuse du matériel de tonte, avec une désinfection systématique entre chaque animal, est donc une mesure préventive non négligeable.
-
Forme Squameuse Généralisée (M. persicolor) : Contrairement à la majorité des autres dermatophytes, M. persicolor n’envahit pas la tige pilaire mais colonise uniquement le stratum corneum. Il en résulte une desquamation généralisée, parfois intense, sans alopécie significative. Un cas illustratif est celui d’un chien présentant une anamnèse de quatre ans de squames généralisées, finalement diagnostiqué comme une infection à M. persicolor.
Forme très étendue d’une dermatophytsoe féline
3.3. Cas Particuliers : Cochons d’Inde et Lapins – Le Piège du Portage Asymptomatique
Ces petits mammifères, particulièrement ceux issus d’animaleries ou de collectivités, peuvent être des porteurs asymptomatiques du complexe T. mentagrophytes (fréquemment identifié par les techniques moléculaires sous le nom de T. benhamiae). Ce portage asymptomatique représente un défi majeur pour le contrôle de l’infection.
-
Prévalence du portage asymptomatique :
-
Dans les animaleries belges, des études ont montré que 3.5% des cochons d’Inde et 3.8% des lapins cliniquement sains étaient porteurs [12].
-
Dans les animaleries slovaques, ces chiffres s’élevaient à 10% pour les cochons d’Inde et 6% pour les lapins sains [13].
-
Une étude menée dans des animaleries berlinoises, utilisant la PCR, a révélé que si 9% des cochons d’Inde présentaient des lésions cliniques, un nombre stupéfiant de 90% de l’ensemble des cochons d’Inde testés étaient porteurs de l’ADN de T. benhamiae [14]. Ces chiffres interpellent quant à la source potentielle d’infection pour d’autres animaux ou pour l’homme.
-
-
Cas cliniques (lapins en Espagne) : Parmi les lapins présentant des lésions cliniques de dermatophytose, 54% des isolements correspondaient à T. mentagrophytes et 27% à M. canis [15].
3.4. La Dermatophytose comme Zoonose : Une Préoccupation Constante
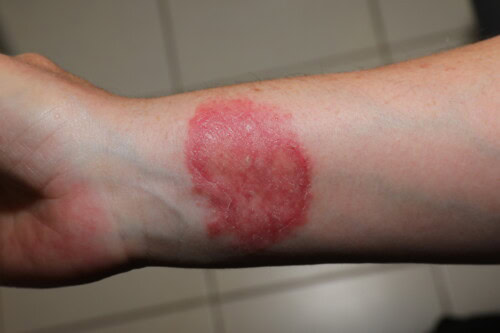
Il est impératif de se souvenir du potentiel zoonotique de la dermatophytose. De nombreux cas de transmission à l’homme sont documentés, affectant aussi bien les propriétaires (et leurs enfants, comme illustré par un cas de transmission à partir d’un cochon d’Inde infecté) que le personnel vétérinaire (un résident en neurologie ayant contracté l’infection à partir d’un patient canin).
Contamination humaine par un dermatophyte
4. Stratégies Diagnostiques : Vers une Approche Multimodale
Le diagnostic de la dermatophytose ne repose pas sur un test unique infaillible. Une approche multimodale, combinant l’examen clinique à divers tests complémentaires, est la clé.
4.1. Examen Microscopique Direct (Trichogramme) : Le premier examen à réaliser
Cet examen simple et rapide peut fournir des indices précieux.
-
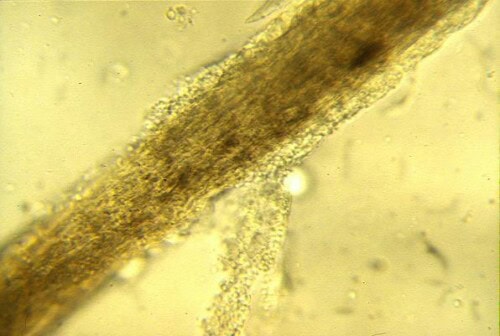
Technique : Il convient de prélever des poils en périphérie active des lésions, en ciblant ceux qui apparaissent “cotonneux”, cassés ou anormaux. L’échantillon est monté entre lame et lamelle, classiquement dans une goutte de KOH à 10-20% (qui aide à clarifier les débris kératiniques) ou simplement dans de l’huile minérale. L’étape cruciale est de baisser le condenseur du microscope et de jouer avec le diaphragme pour augmenter le contraste, les éléments fongiques étant souvent peu réfringents en lumière blanche. On recherche la présence d’arthrospores ectothrix (formant une gaine autour du poil) ou d’hyphes segmentées endothrix (à l’intérieur de la tige pilaire).
-
Sensibilité : L’étude de Bristol, comparant la microscopie à la culture, a rapporté une sensibilité globale de 55%. Elle était plus élevée pour M. canis (58%), souvent associé à une production abondante de spores facilement visibles, que pour T. mentagrophytes (44%), où les hyphes peuvent être plus discrètes et localisées dans les squames. Il est probable que la sensibilité soit moindre pour les praticiens moins expérimentés.
-
Pièges et artefacts : La confusion est possible avec des artefacts tels que les gaines pilaires internes ou externes, des débris de kératine, des bulles d’air, ou encore des conidies de champignons saprophytes qui peuvent contaminer la surface de la peau. Une bonne connaissance de la morphologie fongique est indispensable.
-
Colorants adjuvants : Bien que non indispensables si la technique d’éclairage est maîtrisée, des colorants comme le “Potash Kwik” (une solution commerciale de KOH contenant une encre) ou l’encre Parker peuvent aider à contraster les éléments fongiques. Le Calcofluor White est une option plus sophistiquée (voir section 4.5).
Poil teigneux
4.2. Lampe de Wood : Un Outil Classique aux Limites Connues
La lampe de Wood reste un outil utile, à condition de connaître ses spécificités.
-
Principe et fluorescence : Certaines souches de M. canis (mais pas toutes) produisent, au cours de leur métabolisme, de la ptéridine, une substance qui émet une fluorescence vert pomme caractéristique lorsqu’elle est exposée à une lumière ultraviolette d’une longueur d’onde spécifique (autour de 365 nm). Il est important de noter que ce sont les poils activement infectés qui fluorescent, et non les squames, les croûtes ou les colonies en culture.
-
Spécificité et limites : Cet examen est principalement pertinent pour la suspicion d’infection à M. canis. La majorité des espèces de Trichophyton ne produisent pas cette fluorescence. De plus, même pour M. canis, toutes les souches ne sont pas fluorescentes.
-
Conditions optimales d’examen : Pour maximiser les chances de détection, l’examen doit impérativement être réalisé dans une pièce totalement obscure. La lampe doit être correctement préchauffée pendant plusieurs minutes avant utilisation. L’utilisation d’une lampe de Wood de qualité, spécifiquement conçue pour un usage vétérinaire et idéalement équipée d’une lentille grossissante, est fortement recommandée.
-
Sensibilité : Pour les infections à M. canis, la sensibilité de la lampe de Wood varie selon les études, se situant généralement entre 54% et 70% [16]. Un résultat négatif n’exclut donc jamais une dermatophytose.
4.3. Culture Fongique : Identification et Viabilité
La culture fongique demeure une méthode de référence pour l’identification précise de l’espèce et la confirmation de la viabilité du pathogène.
-
Prélèvement des échantillons : Les poils et les squames ou croûtes doivent être prélevés en périphérie des lésions les plus actives. Pour le dépistage des porteurs asymptomatiques ou le suivi de l’efficacité thérapeutique, la méthode de la brosse stérile (type brosse de McKenzie) passée sur l’ensemble du pelage, ou l’utilisation de plaques de gélose avec un côté texturé pour le prélèvement (comme le Derm-Duet), sont des techniques éprouvées.
-
Milieux de culture : Le milieu de Sabouraud Dextrose Agar (SDA) est le milieu de base classiquement utilisé. L’incubation doit être réalisée à une température de 26-27°C et peut nécessiter jusqu’à 4 semaines avant qu’une culture puisse être considérée comme définitivement négative.
-
Identification des colonies : L’identification repose sur une combinaison de critères :
-
Macroscopiques : Aspect de la colonie (couleur, texture – cotonneuse, poudreuse, granuleuse), vitesse de croissance, et production éventuelle d’un pigment diffusible dans la gélose ou visible au revers de la colonie.
-
Microscopiques : Après prélèvement d’une portion de la colonie (souvent à l’aide d’un ruban adhésif transparent appliqué sur la surface puis transféré sur une lame) et coloration (classiquement au bleu de lactophénol), l’observation des macroconidies et des microconidies (forme, taille, paroi, septation) est déterminante pour l’identification de l’espèce. Il est crucial de se rappeler que les macroconidies sont des structures produites in vitro (en culture) et ne sont généralement pas observées sur les prélèvements directs de l’animal.
-
-
Milieu DTM (Dermatophyte Test Medium) : Ce milieu différentiel est un SDA modifié par l’ajout d’un indicateur de pH (le rouge de phénol) et d’agents inhibiteurs (comme le cycloheximide pour inhiber les saprophytes à croissance rapide, et des antibiotiques comme la gentamicine et la chlortétracycline pour inhiber les bactéries). Le principe repose sur le métabolisme préférentiel des dermatophytes : ils utilisent d’abord les sources protéiques du milieu, produisant des métabolites alcalins qui font virer l’indicateur de pH du jaune au rouge. Les champignons saprophytes, en revanche, tendent à utiliser d’abord les hydrates de carbone (acidification, donc pas de changement de couleur initial ou un virage au jaune), puis, si la culture se prolonge, peuvent également métaboliser les protéines, entraînant un virage tardif au rouge qui peut prêter à confusion.
-
Interprétation du DTM : Un changement de couleur rouge précoce, apparaissant en même temps ou avant la croissance visible de la colonie (généralement dans les 3 à 7 jours), associé à une colonie d’aspect compatible (souvent blanche, crème, duveteuse ou poudreuse), est fortement suggestif d’un dermatophyte.
-
Limites du DTM : L’interprétation du DTM en clinique généraliste peut s’avérer moins fiable qu’en laboratoire de mycologie spécialisé. Une étude israélienne a montré un taux d’accord de seulement 80% entre les lectures en clinique et celles du laboratoire, avec des faux positifs et des faux négatifs plus fréquents en clinique [17]. Des facteurs tels qu’une température d’incubation ambiante trop basse peuvent retarder le virage de couleur. De plus, une incubation prolongée peut conduire à un virage au rouge par des champignons saprophytes, source d’erreur diagnostique.
-
4.4. Histopathologie : Quand la Lésion est Profonde ou Atypique
L’examen histopathologique de biopsies cutanées peut être particulièrement informatif, surtout pour les formes nodulaires ou lorsque les autres tests sont non concluants.
-
Visualisation des éléments fongiques : Des hyphes peuvent être visualisées dans la tige pilaire, dans les follicules pileux, ou parfois librement dans le derme en cas de furonculose. Des spores peuvent également être observées autour des poils. L’utilisation de colorations spéciales comme le PAS (Periodic Acid-Schiff) ou le GMS (Grocott Methenamine Silver) est souvent indispensable pour mettre clairement en évidence les structures fongiques, qui peuvent être discrètes à la coloration H&E standard.
-
Modèles inflammatoires associés :
-
Dans le cas de M. persicolor, l’inflammation peut être discrète, avec principalement une infiltration de lymphocytes dans les squames du stratum corneum.
-
Pour la plupart des autres dermatophytes invasifs, une folliculite (inflammation du follicule pileux), une perifolliculite, voire une furonculose (rupture du follicule avec réaction inflammatoire intense dans le derme) peuvent être observées.
-
Dans les cas de kérion ou de pseudomycétome, on observe typiquement des nodules inflammatoires profonds, souvent granulomateux ou pyogranulomateux, contenant des éléments fongiques, parfois sous forme de “grains”.
-
4.5. PCR (Polymerase Chain Reaction) : Un Outil Moléculaire en Essor
La PCR permet la détection sensible de l’ADN fongique à partir de prélèvements de poils et de squames.
-
Principes et cibles : Les panels de PCR vétérinaires ciblent généralement des séquences d’ADN conservées chez les dermatophytes, permettant une détection de groupe (par exemple, Microsporum spp., Trichophyton spp.). Des amorces plus spécifiques peuvent ensuite être utilisées pour identifier certaines espèces d’intérêt majeur, comme M. canis.
-
Interprétation et nuances :
-
Une PCR positive chez un animal présentant des signes cliniques compatibles est fortement suggestive d’une infection active.
-
Chez un animal cliniquement sain, une PCR positive peut indiquer un portage asymptomatique ou une simple contamination environnementale transitoire des poils. Le seuil de détection de la PCR est souvent très bas.
-
Une limite majeure de la PCR est sa capacité à détecter l’ADN fongique qu’il provienne d’organismes viables ou non viables. Ainsi, une PCR peut rester positive pendant un certain temps après un traitement antifongique efficace, simplement en détectant l’ADN de spores mortes. Elle ne confirme donc pas nécessairement une infection active en cours et son utilité pour le suivi thérapeutique est débattue.
-
-
Comparaison avec la culture fongique : Selon l’expert mycologue Patrick Bourdeau, la culture fongique, lorsqu’elle est réalisée et interprétée par un laboratoire spécialisé, peut s’avérer plus sensible que certaines PCR commerciales. De plus, la culture offre l’avantage crucial de permettre l’identification précise de l’espèce (essentielle pour l’épidémiologie et la recherche de la source de contamination) et de confirmer la viabilité du champignon.
-
Recommandations des consensus : Le consensus de 2017 sur la dermatophytose féline de l’International Society of Companion Animal Infectious Diseases (ISCAID) reconnaît la PCR comme un outil diagnostique utile, mais souligne que son interprétation doit être prudente et contextualisée avec les données cliniques et épidémiologiques [18].
4.6. Microscopie à Fluorescence avec Calcofluor White : Améliorer la Détection Directe
Le Calcofluor White est un colorant non spécifique qui se lie avec une haute affinité à la cellulose et à la chitine, des composants majeurs des parois cellulaires fongiques.
-
Technique : Les prélèvements de poils et de squames sont d’abord traités avec une solution de KOH (pour clarifier les débris cellulaires de l’hôte), puis une goutte de Calcofluor White est ajoutée. Après un court temps d’incubation, l’échantillon est examiné sous un microscope équipé d’une source de lumière UV et de filtres appropriés (généralement pour une excitation dans l’UV proche et une émission dans le bleu ou le vert).
-
Avantages : Les éléments fongiques (hyphes, spores) apparaissent alors brillamment fluorescents, se détachant nettement du fond non fluorescent. Cette technique augmente de manière significative la sensibilité et la rapidité de la détection microscopique directe par rapport à l’examen en lumière blanche conventionnelle. Il a été rapporté que l’utilisation du Calcofluor White peut pratiquement doubler la sensibilité de la microscopie directe.
La dermatophytose est un véritable carrefour de défis diagnostiques. Comment s’y retrouver ?
-
La grande variabilité clinique : Elle impose de toujours inclure la dermatophytose dans le diagnostic différentiel de nombreuses affections cutanées, même celles qui ne présentent pas l’aspect “classique”.
-
L’absence de “gold standard” unique et infaillible : Les consensus d’experts récents soulignent qu’aucun test diagnostique, pris isolément, n’est parfait [18]. Une approche combinée est souvent la plus fructueuse. L’association de l’examen à la lampe de Wood (si une infection à M. canis est suspectée) et de l’examen microscopique direct (idéalement avec Calcofluor White pour en augmenter la sensibilité) constitue une excellente première ligne d’investigation en clinique.
-
La persistance environnementale des spores : Les spores de M. canis peuvent demeurer viables dans l’environnement pendant des périodes allant jusqu’à 14 mois, voire plus. Cette longévité complique considérablement la gestion de l’infection, notamment la prévention des réinfections et la transmission à d’autres animaux ou à l’homme. La tonte des animaux infectés (si réalisable et bien tolérée) peut contribuer à réduire la charge environnementale en poils contaminés et donc en spores.
-
Le risque zoonotique constant : L’infectiosité de l’animal pour l’homme diminue avec l’instauration d’un traitement antifongique efficace, mais des mesures de précaution (hygiène stricte, limitation des contacts étroits, en particulier pour les enfants, les personnes âgées ou les individus immunodéprimés) doivent être maintenues pendant toute la durée du traitement et jusqu’à confirmation de la guérison mycologique.
-
Les formes nodulaires profondes (kérion ou pseudomycétome) : Leur diagnostic peut être particulièrement ardu et souvent retardé si la suspicion initiale de dermatophytose est faible. Dans ces cas, l’examen histopathologique de biopsies profondes, avec des colorations spéciales pour les champignons, et la culture fongique à partir du tissu biopsié sont fréquemment indispensables.
-
L’interprétation critique des résultats des tests et leurs limites intrinsèques :
-
Microscopie directe : Sa sensibilité est fortement dépendante de l’expérience de l’opérateur et de la rigueur de la technique employée (notamment l’ajustement adéquat du condenseur).
-
DTM en clinique : Le risque de mauvaise interprétation du virage de couleur (confusion avec la croissance de champignons saprophytes en cas de lecture tardive ou d’incubation prolongée) est une limitation reconnue.
-
PCR : Bien que très sensible, la PCR ne distingue pas l’ADN d’une infection active de la simple présence de spores viables ou non viables. Par conséquent, une PCR positive sur un animal en cours de traitement ou récemment traité ne signifie pas nécessairement un échec thérapeutique.
-
Culture fongique : Considérée comme une méthode de référence pour l’identification de l’espèce et la confirmation de la viabilité du pathogène, la culture peut néanmoins être faussement négative si le prélèvement est inadéquat, si des antifongiques topiques ont été appliqués récemment sur les lésions, ou si la technique de laboratoire n’est pas optimale. Elle peut également être contaminée par des champignons saprophytes à croissance rapide qui peuvent masquer ou être confondus avec les dermatophytes.
-
-
L’impact de l’utilisation inappropriée de corticostéroïdes : L’administration de glucocorticoïdes, que ce soit par voie systémique ou topique, en l’absence d’un diagnostic étiologique précis, peut significativement aggraver une dermatophytose préexistante (dermatophytose incognito) ou en masquer les signes cliniques, rendant le diagnostic ultérieur plus complexe et le traitement plus long.
-
Le concept de dose infectante et d’immunité : Une certaine quantité de spores fongiques est nécessaire pour initier une infection clinique. Les animaux qui développent une réponse immunitaire efficace suite à une première infection peuvent présenter une résistance accrue à une réinfection ultérieure par une dose similaire de spores.
6. Conclusion et Perspectives : Vers une Pratique Éclairée
La dermatophytose, par sa nature protéiforme et les défis inhérents à son diagnostic, exige du clinicien vétérinaire une vigilance constante et une approche diagnostique stratégique. Il n’existe pas de raccourci infaillible. La reconnaissance des diverses manifestations cliniques, la compréhension des limites et des avantages de chaque outil diagnostique, et l’intégration des données épidémiologiques sont les piliers d’une démarche réussie.
L’avenir réside probablement dans l’optimisation et la combinaison intelligente des techniques existantes. La microscopie directe, revalorisée par des outils comme le Calcofluor White, conserve une place de choix pour un diagnostic rapide en clinique. La culture fongique, idéalement réalisée dans des laboratoires spécialisés, reste indispensable pour une identification précise et pour évaluer la viabilité, surtout dans les cas complexes ou pour le suivi thérapeutique. La PCR, quant à elle, offre une sensibilité élevée mais son interprétation doit être prudente et toujours corrélée au contexte clinique.
Peut-être assisterons-nous à l’émergence de tests moléculaires rapides “au chevet du patient” qui combineront sensibilité et spécificité tout en informant sur la viabilité ? Ou à des algorithmes diagnostiques plus standardisés intégrant les forces de chaque méthode ?
En attendant ces avancées, le message clé demeure : une suspicion clinique élevée, une sélection judicieuse des tests en fonction du cas, et une interprétation critique des résultats sont les garants d’une prise en charge optimale de cette affection fongique, pour le bien-être de nos patients et la sérénité de leurs propriétaires.
Références
[1] Weitzman I, Summerbell RC. The dermatophytes. Clin Microbiol Rev. 1995 Apr;8(2):240-59.
[2] de Hoog GS, Guarro J, Gené J, Figueras MJ. Atlas of Clinical Fungi. 4th ed. Centraalbureau voor Schimmelcultures; 2020.
[3] Moriello KA, Coyner K, Paterson S, Mignon B. Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol. 2017 Jun;28(3):266-e68.
[4] Kano R, Hirai A, Yoshioka N, et al. Arthroderma vanbreuseghemii/Trichophyton mentagrophytes complex isolated from an Australian Cavy. Med Mycol J. 2009;50(3):309-12.
[5] Sparkes AH, Robinson A, MacKay AD, et al. A study of the dermatophytes of dogs and cats in the south of England. J Small Anim Pract. 1993 Oct;34(10):507-13.
[6] Donnely T. Personal communication/unpublished data cited in the presentation. (Note: This would require a formal citation if available, or acknowledgement of the source.)
[7] Miller WH Jr, Scott DW, Wellington JR. Isolation of dermatophytes from the haircoats of normal dogs and cats in the southeastern United States. J Am Anim Hosp Assoc. 1991;27:555-8.
[8] Kaplan W, Georg LK, Ajello L. Recent developments in animal ringworm and their public health implications. Ann N Y Acad Sci. 1958;70:636-49.
[9] Bourdeau P. Dermatophyties des carnivores domestiques : aspects épidémiocliniques et diagnostiques. Point Vét. 2005;36(254):44-51.
[10] Schaer M. Clinical Medicine of the Dog and Cat. 2nd ed. Manson Publishing; 2010. (Note: Attributing this specific quote directly to a publication by Schaer would require verification if not explicitly stated as such in the audio.)
[11] Scott DW, Miller WH Jr, Griffin CE. Muller and Kirk’s Small Animal Dermatology. 7th ed. Elsevier Health Sciences; 2012.
[12] Dekeyser H, Adriaensen C, Mignon B, et al. Asymptomatic carriage of dermatophytes by dogs and cats. Vet Dermatol. 2009 Aug;20(4):253-8.
[13] Čonková E, Kollarova L. Dermatophytes isolated from asymptomatic guinea pigs and rabbits in Slovakia. Mycoses. 2010 Jul;53(4):325-8.
[14] Kraemer A, Mueller RS, Schauer U, et al. Dermatophytes in pet guinea pigs and rabbits. Vet Microbiol. 2012 May 25;157(1-2):208-13.
[15] Cafarchia C, Figueredo LA, Otranto D. Fungal diseases of rabbits. Vet Microbiol. 2013 Nov 15;167(1-2):227-43.
[16] Newbury S. Wood’s lamp examination in small animal practice. Vet Clin North Am Small Anim Pract. 2000 Nov;30(6):1099-105.
[17] Kuzi S, Nivy R, Lavy E, et al. Comparison of real-time PCR and dermatophyte test medium culture for the diagnosis of dermatophytosis in a referral hospital setting. Vet Dermatol. 2016 Feb;27(1):32-e9.
[18] Moriello KA, Coyner K, Paterson S, Mignon B. Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol. 2017 Jun;28(3):266-e68.