La dermatofitosis, infección fúngica de los tejidos queratinizados, sigue siendo una entidad clínica frecuente en medicina veterinaria. Su presentación polimórfica, junto con la diversidad de agentes etiológicos y las limitaciones inherentes a cada herramienta diagnóstica, puede a veces transformar su identificación en un verdadero desafío.
Con motivo del último congreso NAVDF que se celebró en Orlando el pasado abril, el Profesor Ross Bond, que trabaja en el Royal Veterinary College de Londres, realizó un análisis detallado de los aspectos epidemiológicos, clínicos y diagnósticos de la dermatofitosis, destacando las trampas a evitar y ofreciendo perspectivas para un enfoque esclarecido, indispensable para una gestión óptima.
1. Introducción: La Complejidad Inherente a los Dermatofitos
La dermatofitosis, aunque familiar para los practicantes, esconde una complejidad que merece atención constante. Causada por hongos queratinofílicos, principalmente de la familia Arthrodermataceae, esta afección afecta el pelo, las garras y el estrato córneo [1]. Si los géneros Microsporum et Trichophyton han sido históricamente los más incriminados en animales, la taxonomía fúngica está en constante evolución. El advenimiento de la micología molecular ha revelado nuevos géneros, como Nannizzia et Arthroderma, cuya mención en los informes de laboratorio podría volverse más frecuente [2]. Epidermophyton, por su parte, sigue siendo una rareza en patología animal, ya que su tropismo es casi exclusivamente humano. Ante esta diversidad etiológica y un caleidoscopio de manifestaciones clínicas, ¿cómo puede el veterinario navegar con confianza hacia un diagnóstico preciso?
2. Epidemiología y Espectro de los Dermatofitos
Entender la ecología y distribución de los dermatofitos es un primer paso crucial para comprender su patogenia.
2.1. Clasificación Ecológica: Una Tríada Fundamental
La clasificación ecológica tradicional distingue tres grandes categorías de dermatofitos, cuyo conocimiento orienta la sospecha clínica y la búsqueda de la fuente de infección:
-
Zoófilos : Estas especies, como el paradigmático Microsporum canis (principalmente en el gato), están adaptadas a los animales y se transmiten fácilmente entre ellos. Su identificación a menudo implica una investigación del entorno y de los congéneres.
-
Geófilos : Estos hongos, de los cuales Microsporum gypseum es un representante típico, encuentran su reservorio en el suelo donde degradan la queratina. El contacto con un suelo contaminado es entonces el modo principal de transmisión.
-
Antropófilos : Específicamente adaptados al huésped humano, estos dermatofitos, como Trichophyton rubrum, son menos frecuentemente la causa de zoonosis inversas (del hombre al animal), pero esta posibilidad no debe descartarse.
2.2. Distribución Geográfica y Especificidad de Huésped: Variaciones a Considerar
La prevalencia de las diferentes especies de dermatofitos no es uniforme, variando significativamente según la región geográfica y la especie animal involucrada.
-
En el gato, Microsporum canis reina supremo a nivel mundial [3].
-
En los bovinos, Trichophyton verrucosum es el agente etiológico principal de la tiña, con una distribución también global.
-
En los équidos, Trichophyton equinum se aísla frecuentemente, pero es interesante notar la existencia de variaciones de cepas, como la distinta identificada en Australia [4].
2.2.1. El Caso del Perro: Un Panorama Epidemiológico Matizado
La epidemiología de la dermatofitosis canina ilustra particularmente bien esta variabilidad geográfica:
-
Au Reino Unido, estudios a largo plazo, en particular una investigación que abarcó 35 años en Bristol y analizando 475 aislamientos, evidenciaron la predominancia de M. canis (alrededor de dos tercios de los casos) seguido de Trichophyton mentagrophytes (alrededor de un cuarto) [5]. Un estudio de seguimiento más reciente en la misma región confirmó esta tendencia, con cifras de 42% para M. canis y 38% para T. mentagrophytes [6].
-
Aux Estados Unidos, un estudio realizado en la Universidad Estatal de Luisiana en 1991 reportó 43% de M. canis y 11% de T. mentagrophytes [7]. Une enquête plus ancienne du CDC, datant de 1958 et portant sur 368 isolements issus de 35 états, montrait une proportion de 69% pour M. canis y de 11% para T. mentagrophytes [8].
Parece que T. mentagrophytes juega un papel proporcionalmente más importante en el perro en el Reino Unido que en Estados Unidos, aunque M. canis sigue siendo un patógeno clave en ambas regiones. ¿Qué factores ambientales o relacionados con el huésped podrían explicar estas diferencias?
2.2.2. Otros Dermatofitos Notables y Sus Reservorios Ecológicos
La vigilancia también debe mantenerse para otras especies menos frecuentes pero cuya identificación puede tener implicaciones clínicas y epidemiológicas:
-
Trichophyton erinacei : Este agente, responsable de la “tiña del erizo”, ve su prevalencia directamente correlacionada con la presencia de estos insectívoros.
-
Trichophyton verrucosum : Principalmente transmitido por los bovinos, rara vez se diagnostica en perros en Estados Unidos, y solo esporádicamente en el Reino Unido.
-
Microsporum persicolor : Con un reservorio principal en los topillos y ratones, este dermatofito es poco común en perros en el Reino Unido y no se ha reportado en esta especie en Estados Unidos, aunque su presencia en América del Norte (por ejemplo, en Ontario, Canadá) está confirmada [9].
-
Microsporum gypseum : Este hongo geófilo es un agente causal principal de dermatofitosis en Luisiana (44% de los casos caninos) y sigue siendo significativo en otros estudios americanos (18% de los casos). En un contraste sorprendente, en Bristol, tomó 35 años aislar M. gypseum de solo cuatro perros. Esta disparidad plantea la cuestión de la influencia de los factores edafoclimáticos, un suelo más caliente en Estados Unidos podría favorecer su supervivencia y proliferación.
2.3. Factores Predisponentes: Identificar los Sujetos en Riesgo
Ciertos factores intrínsecos al animal o relacionados con su entorno pueden aumentar su susceptibilidad a la dermatofitosis:
-
Edad : Los animales jóvenes, cuyo sistema inmunológico aún está inmaduro, se consideran clásicamente más vulnerables a la infección por M. canis. Por el contrario, los animales más viejos, si son mejores cazadores, podrían estar más expuestos a los dermatofitos transmitidos por la fauna salvaje.
-
Raza : Se han sugerido predisposiciones raciales. Los Yorkshire Terriers parecen más sensibles a M. canis (en Reino Unido), mientras que los Jack Russell Terriers podrían ser más propensos a las dermatofitosis adquiridas de la fauna salvaje. Los gatos de pelo largo, tipo Persa, también se mencionan con frecuencia.
-
Estacionalidad : Aunque se observan pocas variaciones estacionales marcadas en el Reino Unido, un estudio estadounidense sugirió una mayor incidencia de T. mentagrophytes en otoño.
3. El Rostro Polimórfico de la Dermatofitosis: Reconocer los Signos
La dermatofitosis es una “gran simuladora”. Su presentación clínica puede ser tan variada que impone al practicante un alto índice de sospecha. Como recordaba Michael Schaer, “Si no lo piensas, no lo encontrarás” [10] – un adagio particularmente relevante aquí.
3.1. Presentaciones Clásicas: Los Signos de Alerta
Algunas manifestaciones se consideran más típicas, aunque no patognomónicas:
-
En los bovinos (T. verrucosum) : Lesiones características, bien circunscritas, alopécicas, cubiertas de escamas grisáceas y gruesas, localizadas preferentemente en la cabeza, el cuello y las orejas. Estas lesiones son más frecuentes en los animales confinados en interiores durante el invierno.
-
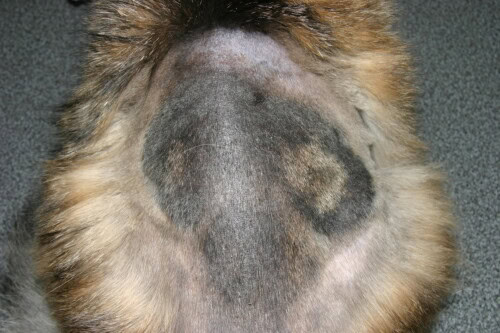
En los perros y gatos (M. canis) : La lesión clásica es una alopecia circular, escamosa, a veces eritematosa y costrosa, que a menudo se ubica en la cabeza. Sin embargo, también se observan formas menos inflamatorias, limitándose a una zona de alopecia sin una reacción cutánea marcada.
Il convient de toujours garder à l’esprit l’avertissement de Danny Scott : “Si cela ressemble à la teigne [chez le chien], ce n’en est probablement pas. C’est probablement une folliculite staphylococcique.” [11]. En effet, chez le chien, les lésions annulaires expansives sont plus souvent d’origine bactérienne.
3.2. Formas Atípicas y Trampas Diagnósticas
Aquí es donde el diagnóstico puede convertirse en un verdadero ejercicio de sutileza:
-
Foliculitis y Furunculosis del Hocico (Dermatofitos Silvestres) : Frecuentemente asociadas a T. mentagrophytes ou T. erinacei en perros que tienen contacto con roedores o erizos (perros de caza, terriers). Estas lesiones pueden ser unilaterales o asimétricas, con tendencia a la curación central y una inflamación periférica activa. El planum nasal típicamente está intacto.
-
Lesiones Nodulares y Placas (Kérion, Pseudomicetoma) :
-
Un Jack Russell Terrier que exploró una madriguera de conejos desarrolló una placa eritematosa y costrosa en el pecho, así como una lesión nodular distinta en el carpo, ambas confirmadas como causadas por T. mentagrophytes.
-
Un Doberman que presentaba múltiples placas eritematosas, para las cuales inicialmente se sospechaba un linfoma cutáneo, resultó estar afectado por una dermatofitosis causada por T. mentagrophytes. ¿Cuál fue la sorpresa del clínico ante este diagnóstico inesperado?
-
En el gato Persa, el pseudomicetoma (o querion profundo) causado por M. canis es una entidad bien descrita, manifestándose por nódulos, trayectos fistulosos y a veces la expulsión de granos que evocan “granos de azufre”.
-
Un caso reportado en Croacia describe un querion en un gato —un nódulo fluctuante y purulento— causado por M. gypseum en asociación con una sobreinfección estafilocócica.
-
-
Lesiones Irregulares y Sutiles : Un gato cazador presentó una alopecia discreta en el hocico y lesiones eritematoesculamosas en el pabellón auricular debido a T. mentagrophytes, una especie poco común en el felino. Esto subraya la importancia de no confiar únicamente en las asociaciones clásicas entre especie fúngica/hospedador.
-
Infecciones Nosocomiales : Pueden desarrollarse lesiones de dermatofitosis en sitios previamente rapados para una intervención quirúrgica o la inserción de un catéter intravenoso. La higiene rigurosa del material de corte, con una desinfección sistemática entre cada animal, es una medida preventiva no despreciable.
-
Forma Escamosa Generalizada (M. persicolor) : A diferencia de la mayoría de los otros dermatofitos, M. persicolor no invade la fibra pilosa sino que coloniza únicamente el estrato córneo. Resulta en una descamación generalizada, a veces intensa, sin alopecia significativa. Un caso ilustrativo es el de un perro con un historial de cuatro años de escamas generalizadas, diagnosticado finalmente como una infección por M. persicolor.
Forma muy extendida de una dermatofitosis felina
3.3. Casos Particulares: Cobayas y Conejos – La Trampa del Portador Asintomático
Estos pequeños mamíferos, especialmente aquellos procedentes de tiendas de animales o colectividades, pueden ser portadores asintomáticos del complejo T. mentagrophytes (frecuentemente identificado por técnicas moleculares bajo el nombre de T. benhamiae). Este portador asintomático representa un desafío mayor para el control de la infección.
-
Prevalencia del portador asintomático :
-
En las tiendas de mascotas belgas, estudios han mostrado que 3.5% de las cobayas y 3.8% de los conejos clínicamente sanos eran portadores [12].
-
En las tiendas de mascotas eslovacas, estas cifras ascendían a 10% para las cobayas y 6% para los conejos sanos [13].
-
Un estudio realizado en tiendas de mascotas berlinesas, utilizando PCR, reveló que si bien el 9% de las cobayas presentaban lesiones clínicas, un sorprendente 90% de todas las cobayas probadas eran portadoras del ADN de T. benhamiae [14]. Ces chiffres interpellent quant à la source potentielle d’infection pour d’autres animaux ou pour l’homme.
-
-
Casos clínicos (conejos en España) : Entre los conejos que presentaban lesiones clínicas de dermatofitosis, el 54% de los aislamientos correspondían a T. mentagrophytes y el 27% a M. canis [15].
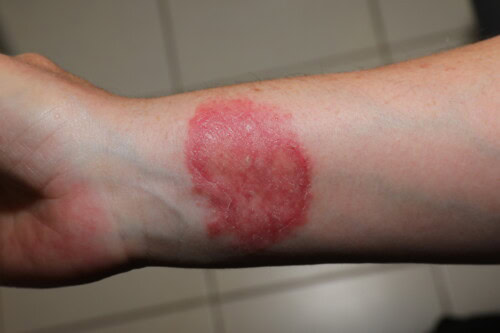
3.4. La Dermatofitosis como Zoonosis: Una Preocupación Constante
Es imperativo recordar el potencial zoonótico de la dermatofitosis. Se documentan numerosos casos de transmisión al ser humano, afectando tanto a propietarios (y sus hijos, como ilustrado por un caso de transmisión a partir de una cobaya infectada) como al personal veterinario (un residente en neurología que contrajo la infección a partir de un paciente canino).
Contaminación humana por un dermatofito
4. Estrategias Diagnósticas: Hacia un Enfoque Multimodal
El diagnóstico de la dermatofitosis no se basa en una prueba única infalible. Un enfoque multimodal, combinando el examen clínico con diversas pruebas complementarias, es clave.
4.1. Examen Microscópico Directo (Tricograma): El primer examen a realizar
Este examen simple y rápido puede proporcionar indicios valiosos.
-
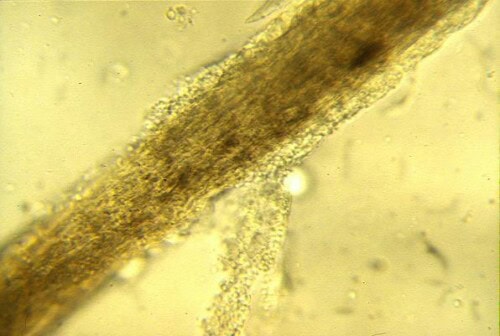
Técnica : Se deben tomar pelos en la periferia activa de las lesiones, enfocándose en aquellos que aparecen “algodonosos”, rotos o anormales. La muestra se monta entre portaobjetos y cubreobjetos, clásicamente en una gota de KOH al 10-20% (que ayuda a aclarar los desechos queratinosos) o simplemente en aceite mineral. El paso crucial es bajar el condensador del microscopio y jugar con el diafragma para aumentar el contraste, ya que los elementos fúngicos son a menudo poco refringentes a la luz blanca. Se busca la presencia de artrosporas ectothrix (formando una vaina alrededor del pelo) o hifas segmentadas endothrix (dentro de la fibra pilosa).
-
Sensibilidad : El estudio de Bristol, comparando la microscopía con el cultivo, reportó una sensibilidad global del 55%. Era más alta para M. canis (58%), frecuentemente asociado con una producción abundante de esporas fácilmente visibles, que para T. mentagrophytes (44%), donde las hifas pueden ser más discretas y localizadas en las escamas. Es probable que la sensibilidad sea menor para los practicantes menos experimentados.
-
Trampas y artefactos : La confusión es posible con artefactos como las vainas pilosas internas o externas, desechos de queratina, burbujas de aire, o incluso conidias de hongos saprofitos que pueden contaminar la superficie de la piel. Un buen conocimiento de la morfología fúngica es indispensable.
-
Colorantes adyuvantes : Aunque no son indispensables si se domina la técnica de iluminación, colorantes como el “Potash Kwik” (una solución comercial de KOH con tinta) o la tinta Parker pueden ayudar a contrastar los elementos fúngicos. El Calcofluor White es una opción más sofisticada (ver sección 4.5).
Pelo tiñoso
4.2. Lámpara de Wood: Una Herramienta Clásica con Límites Conocidos
La lámpara de Wood sigue siendo una herramienta útil, siempre que se conozcan sus especificidades.
-
Principio y fluorescencia : Algunas cepas de M. canis (pero no todas) producen, durante su metabolismo, pteridina, una sustancia que emite una fluorescencia verde manzana característica cuando se expone a una luz ultravioleta de una longitud de onda específica (alrededor de 365 nm). Es importante notar que son los pelos activamente infectados los que fluorescen, no las escamas, las costras ni las colonias en cultivo.
-
Especificidad y límites : Este examen es principalmente relevante para la sospecha de infección por M. canis. La mayoría de las especies de Trichophyton no producen esta fluorescencia. Además, incluso para M. canis, no todas las cepas son fluorescentes.
-
Condiciones óptimas de examen : Para maximizar las posibilidades de detección, el examen debe realizarse en una habitación totalmente oscura. La lámpara debe estar correctamente precalentada durante varios minutos antes de su uso. Se recomienda encarecidamente el uso de una lámpara de Wood de calidad, específicamente diseñada para uso veterinario y, idealmente, equipada con una lente magnificadora.
-
Sensibilidad : Para las infecciones por M. canis, la sensibilidad de la lámpara de Wood varía según los estudios, situándose generalmente entre el 54% y el 70% [16]. Un resultado negativo nunca excluye, por lo tanto, una dermatofitosis.
4.3. Cultivo Fúngico: Identificación y Viabilidad
El cultivo fúngico sigue siendo un método de referencia para la identificación precisa de la especie y la confirmación de la viabilidad del patógeno.
-
Toma de muestras : Los pelos y las escamas o costras deben ser tomadas en la periferia de las lesiones más activas. Para el cribado de portadores asintomáticos o el seguimiento de la eficacia terapéutica, el método del cepillo estéril (tipo cepillo de McKenzie) pasado por todo el pelaje, o el uso de placas de agar con un lado texturizado para la toma (como el Derm-Duet), son técnicas probadas.
-
Medios de cultivo : El medio de Sabouraud Dextrose Agar (SDA) es el medio básico clásicamente usado. La incubación debe realizarse a una temperatura de 26-27°C y puede requerir hasta 4 semanas antes de que un cultivo pueda considerarse definitivamente negativo.
-
Identificación de las colonias : La identificación se basa en una combinación de criterios:
-
Macroscópicos : Aspecto de la colonia (color, textura – algodonosa, polvorienta, granulosa), velocidad de crecimiento, y producción eventual de un pigmento difusible en el agar o visible en el reverso de la colonia.
-
Microscópicos : Tras la toma de una porción de la colonia (a menudo con una cinta adhesiva transparente aplicada en la superficie y luego transferida a un portaobjetos) y la tinción (clásicamente con azul de lactofenol), la observación de las macroconidias y microconidias (forma, tamaño, pared, septación) es determinante para la identificación de la especie. Es crucial recordar que las macroconidias son estructuras producidas in vitro (en cultivo) y generalmente no se observan en las muestras directas del animal.
-
-
Medio DTM (Dermatophyte Test Medium) : Este medio diferencial es un SDA modificado por la adición de un indicador de pH (fenol rojo) y agentes inhibidores (como la cicloheximida para inhibir los saprófitos de rápido crecimiento, y antibióticos como la gentamicina y la clortetraciclina para inhibir las bacterias). El principio se basa en el metabolismo preferencial de los dermatofitos: utilizan primero las fuentes proteicas del medio, produciendo metabolitos alcalinos que hacen cambiar el indicador de pH de amarillo a rojo. Los hongos saprófitos, en cambio, tienden a utilizar primero los hidratos de carbono (acidificación, por lo tanto sin cambio inicial de color o un cambio a amarillo), luego, si el cultivo se prolonga, pueden también metabolizar las proteínas, causando un cambio tardío a rojo que puede confundir.
-
Interpretación del DTM : Un cambio de color a rojo temprano, apareciendo al mismo tiempo o antes del crecimiento visible de la colonia (generalmente en 3 a 7 días), asociado con una colonia de aspecto compatible (a menudo blanca, crema, vellosa o pulverulenta), es fuertemente sugestivo de un dermatofito.
-
Límites del DTM : La interpretación del DTM en clínica general puede resultar menos confiable que en un laboratorio de micología especializado. Un estudio israelí mostró una tasa de concordancia de sólo el 80% entre las lecturas en clínica y las del laboratorio, con falsos positivos y negativos más frecuentes en clínicas [17]. Factores como una temperatura de incubación ambiente demasiado baja pueden retrasar el cambio de color. Además, una incubación prolongada puede llevar a un cambio a rojo por hongos saprófitos, fuente de error diagnóstico.
-
4.4. Histopatología: Cuando la Lesión es Profunda o Atípica
El examen histopatológico de biopsias cutáneas puede ser particularmente informativo, especialmente para las formas nodulares o cuando las otras pruebas no son concluyentes.
-
Visualización de elementos fúngicos : Se pueden visualizar hifas en el tallo piloso, en los folículos pilosos, o a veces libremente en la dermis en caso de forunculosis. También se pueden observar esporas alrededor de los pelos. El uso de coloraciones especiales como el PAS (Ácido Periódico de Schiff) o el GMS (Grocott Metenamina Plata) es a menudo indispensable para evidenciar claramente las estructuras fúngicas, que pueden ser discretas en la coloración H&E estándar.
-
Modelos inflamatorios asociados :
-
En el caso de M. persicolor, la inflamación puede ser discreta, con principalmente una infiltración de linfocitos en las escamas del estrato córneo.
-
Para la mayoría de otros dermatofitos invasivos, se pueden observar una foliculitis (inflamación del folículo piloso), perifoliculitis, e incluso forunculosis (ruptura del folículo con reacción inflamatoria intensa en la dermis).
-
En los casos de querion o pseudomycetoma, se observan típicamente nódulos inflamatorios profundos, a menudo granulomatosos o piogranulomatosos, conteniendo elementos fúngicos, a veces en forma de “granos”.
-
4.5. PCR (Reacción en Cadena de la Polimerasa): Una Herramienta Molecular en Auge
La PCR permite la detección sensible del ADN fúngico a partir de muestras de pelos y escamas.
-
Principios y objetivos : Los paneles de PCR veterinarios suelen dirigirse a secuencias de ADN conservadas en los dermatofitos, permitiendo una detección de grupo (por ejemplo, Microsporum spp., Trichophyton spp.). Se pueden usar cebadores más específicos luego para identificar ciertas especies de interés mayor, como M. canis.
-
Interpretación y matices :
-
Una PCR positiva en un animal que presenta signos clínicos compatibles es fuertemente sugestiva de una infección activa.
-
En un animal clínicamente sano, una PCR positiva puede indicar un portador asintomático o una simple contaminación ambiental transitoria de los pelos. El umbral de detección de la PCR suele ser muy bajo.
-
Una limitación importante de la PCR es su capacidad para detectar ADN fúngico ya provenga de organismos viables o no viables. Así, una PCR puede permanecer positiva durante un tiempo después de un tratamiento antifúngico eficaz, simplemente detectando el ADN de esporas muertas. Por lo tanto, no confirma necesariamente una infección activa en curso y su utilidad para el seguimiento terapéutico es debatida.
-
-
Comparación con el cultivo fúngico : Según el micólogo experto Patrick Bourdeau, el cultivo fúngico, cuando es realizado e interpretado por un laboratorio especializado, puede resultar más sensible que algunas PCR comerciales. Además, el cultivo ofrece la ventaja crucial de permitir la identificación precisa de la especie (esencial para la epidemiología y la búsqueda de la fuente de contaminación) y confirmar la viabilidad del hongo.
-
Recomendaciones de los consensos : El consenso de 2017 sobre la dermatofitosis felina de la Sociedad Internacional de Enfermedades Infecciosas de Animales de Compañía (ISCAID) reconoce la PCR como una herramienta diagnóstica útil, pero subraya que su interpretación debe ser prudente y contextualizada con los datos clínicos y epidemiológicos [18].
4.6. Microscopía de Fluorescencia con Calcofluor White: Mejorar la Detección Directa
El Calcofluor White es un colorante no específico que se une con alta afinidad a la celulosa y a la quitina, componentes principales de las paredes celulares fúngicas.
-
Técnica : Las muestras de pelos y escamas se tratan primero con una solución de KOH (para aclarar los restos celulares del huésped), luego se agrega una gota de Calcofluor White. Después de un corto tiempo de incubación, la muestra se examina bajo un microscopio equipado con una fuente de luz UV y filtros apropiados (generalmente para una excitación en el UV cercano y una emisión en azul o verde).
-
Ventajas : Los elementos fúngicos (hifas, esporas) aparecen entonces brillantemente fluorescentes, destacándose claramente del fondo no fluorescente. Esta técnica aumenta significativamente la sensibilidad y rapidez de la detección microscópica directa en comparación con el examen en luz blanca convencional. Se ha informado que el uso de Calcofluor White puede prácticamente duplicar la sensibilidad de la microscopía directa.
La dermatofitosis es un verdadero cruce de desafíos diagnósticos. ¿Cómo orientarse?
-
La gran variabilidad clínica : Impone siempre incluir la dermatofitosis en el diagnóstico diferencial de muchas afecciones cutáneas, incluso aquellas que no presentan el aspecto “clásico”.
-
La ausencia de “estándar de oro” único e infalible : Los consensos de expertos recientes subrayan que ninguna prueba diagnóstica, tomada aisladamente, es perfecta [18]. Un enfoque combinado suele ser el más fructífero. La asociación del examen con la lámpara de Wood (si se sospecha una infección por M. canis ) y el examen microscópico directo (idealmente con Calcofluor White para aumentar su sensibilidad) constituye una excelente primera línea de investigación en clínica.
-
La persistencia ambiental de las esporas : Las esporas de M. canis pueden permanecer viables en el ambiente por períodos que llegan hasta 14 meses, o incluso más. Esta longevidad complica considerablemente la gestión de la infección, en particular la prevención de reinfecciones y la transmisión a otros animales o al hombre. La esquila de los animales infectados (si es realizable y bien tolerada) puede contribuir a reducir la carga ambiental en pelos contaminados y por lo tanto en esporas.
-
El riesgo zoonótico constante : La capacidad infectiva del animal hacia el hombre disminuye con la instauración de un tratamiento antifúngico eficaz, pero las medidas de precaución (higiene estricta, limitación de los contactos estrechos, especialmente para niños, ancianos o individuos inmunodeprimidos) deben mantenerse durante todo el tratamiento y hasta la confirmación de la curación micológica.
-
Las formas nodulares profundas (querion o pseudomycetoma) : Su diagnóstico puede ser particularmente arduo y a menudo retardado si la sospecha inicial de dermatofitosis es baja. En estos casos, el examen histopatológico de biopsias profundas, con coloraciones especiales para los hongos, y el cultivo fúngico a partir del tejido biopsiado son frecuentemente indispensables.
-
La interpretación crítica de los resultados de las pruebas y sus límites intrínsecos :
-
Microscopía directa : Su sensibilidad depende enormemente de la experiencia del operador y de la rigurosidad de la técnica empleada (notablemente el ajuste adecuado del condensador).
-
DTM en clínica : El riesgo de mala interpretación del cambio de color (confusión con el crecimiento de hongos saprófitos en caso de lectura tardía o incubación prolongada) es una limitación reconocida.
-
PCR : Aunque muy sensible, la PCR no distingue el ADN de una infección activa de la simple presencia de esporas viables o no viables. Por lo tanto, una PCR positiva en un animal en tratamiento o recientemente tratado no significa necesariamente un fallo terapéutico.
-
Cultivo fúngico : Considerado como un método de referencia para la identificación de la especie y la confirmación de la viabilidad del patógeno, el cultivo puede no obstante resultar falsamente negativo si la muestra es inadecuada, si se han aplicado antifúngicos tópicos recientemente en las lesiones, o si la técnica de laboratorio no es óptima. También puede ser contaminado por hongos saprófitos de rápido crecimiento que pueden enmascarar o ser confundidos con los dermatofitos.
-
-
El impacto del uso inadecuado de corticosteroides : La administración de glucocorticoides, tanto por vía sistémica como tópica, en ausencia de un diagnóstico etiológico preciso, puede agravar significativamente una dermatofitosis preexistente (dermatofitosis incognito) o enmascarar los signos clínicos, haciendo que el diagnóstico posterior sea más complejo y el tratamiento más prolongado.
-
El concepto de dosis infectante e inmunidad : Se necesita una cierta cantidad de esporas fúngicas para iniciar una infección clínica. Los animales que desarrollan una respuesta inmunitaria eficaz tras una primera infección pueden presentar una resistencia aumentada a una reinfección posterior por una dosis similar de esporas.
6. Conclusión y Perspectivas: Hacia una Práctica Informada
La dermatofitosis, por su naturaleza proteiforme y los desafíos inherentes a su diagnóstico, exige del clínico veterinario una vigilancia constante y un enfoque diagnóstico estratégico. No existe un atajo infalible. El reconocimiento de las diversas manifestaciones clínicas, la comprensión de las limitaciones y ventajas de cada herramienta diagnóstica, y la integración de los datos epidemiológicos son los pilares de un enfoque exitoso.
El futuro probablemente reside en la optimización y la combinación inteligente de las técnicas existentes. La microscopía directa, revalorizada por herramientas como el Calcofluor White, conserva un lugar destacado para un diagnóstico rápido en clínica. El cultivo fúngico, idealmente realizado en laboratorios especializados, sigue siendo indispensable para una identificación precisa y para evaluar la viabilidad, especialmente en casos complejos o para el seguimiento terapéutico. La PCR, por su parte, ofrece una alta sensibilidad, pero su interpretación debe ser prudente y siempre correlacionada al contexto clínico.
¿Quizás veremos la aparición de pruebas moleculares rápidas “junto al paciente” que combinarán sensibilidad y especificidad mientras informan sobre la viabilidad? ¿O algoritmos diagnósticos más estandarizados que integren las fortalezas de cada método?
Mientras esperamos estos avances, el mensaje clave sigue siendo: una alta sospecha clínica, una selección juiciosa de las pruebas según el caso, y una interpretación crítica de los resultados son los garantes de una gestión óptima de esta afección fúngica, para el bienestar de nuestros pacientes y la serenidad de sus propietarios.
Referencias
[1] Weitzman I, Summerbell RC. The dermatophytes. Clin Microbiol Rev. 1995 Apr;8(2):240-59.
[2] de Hoog GS, Guarro J, Gené J, Figueras MJ. Atlas of Clinical Fungi. 4th ed. Centraalbureau voor Schimmelcultures; 2020.
[3] Moriello KA, Coyner K, Paterson S, Mignon B. Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol. 2017 Jun;28(3):266-e68.
[4] Kano R, Hirai A, Yoshioka N, et al. Arthroderma vanbreuseghemii/Trichophyton mentagrophytes complex isolated from an Australian Cavy. Med Mycol J. 2009;50(3):309-12.
[5] Sparkes AH, Robinson A, MacKay AD, et al. A study of the dermatophytes of dogs and cats in the south of England. J Small Anim Pract. 1993 Oct;34(10):507-13.
[6] Donnely T. Personal communication/unpublished data cited in the presentation. (Note: This would require a formal citation if available, or acknowledgement of the source.)
[7] Miller WH Jr, Scott DW, Wellington JR. Isolation of dermatophytes from the haircoats of normal dogs and cats in the southeastern United States. J Am Anim Hosp Assoc. 1991;27:555-8.
[8] Kaplan W, Georg LK, Ajello L. Recent developments in animal ringworm and their public health implications. Ann N Y Acad Sci. 1958;70:636-49.
[9] Bourdeau P. Dermatophyties des carnivores domestiques : aspects épidémiocliniques et diagnostiques. Point Vét. 2005;36(254):44-51.
[10] Schaer M. Clinical Medicine of the Dog and Cat. 2nd ed. Manson Publishing; 2010. (Note: Attributing this specific quote directly to a publication by Schaer would require verification if not explicitly stated as such in the audio.)
[11] Scott DW, Miller WH Jr, Griffin CE. Muller and Kirk’s Small Animal Dermatology. 7th ed. Elsevier Health Sciences; 2012.
[12] Dekeyser H, Adriaensen C, Mignon B, et al. Asymptomatic carriage of dermatophytes by dogs and cats. Vet Dermatol. 2009 Aug;20(4):253-8.
[13] Čonková E, Kollarova L. Dermatophytes isolated from asymptomatic guinea pigs and rabbits in Slovakia. Mycoses. 2010 Jul;53(4):325-8.
[14] Kraemer A, Mueller RS, Schauer U, et al. Dermatophytes in pet guinea pigs and rabbits. Vet Microbiol. 2012 May 25;157(1-2):208-13.
[15] Cafarchia C, Figueredo LA, Otranto D. Fungal diseases of rabbits. Vet Microbiol. 2013 Nov 15;167(1-2):227-43.
[16] Newbury S. Wood’s lamp examination in small animal practice. Vet Clin North Am Small Anim Pract. 2000 Nov;30(6):1099-105.
[17] Kuzi S, Nivy R, Lavy E, et al. Comparison of real-time PCR and dermatophyte test medium culture for the diagnosis of dermatophytosis in a referral hospital setting. Vet Dermatol. 2016 Feb;27(1):32-e9.
[18] Moriello KA, Coyner K, Paterson S, Mignon B. Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol. 2017 Jun;28(3):266-e68.