Dermatophytose, eine Pilzinfektion der verhornten Gewebe, bleibt eine häufige klinische Einheit in der Veterinärmedizin. Ihre polymorphe Präsentation, gepaart mit der Vielfalt der ätiologischen Erreger und den inhärenten Grenzen jedes diagnostischen Werkzeugs, kann ihre Identifizierung manchmal zu einer echten Herausforderung machen.
Anlässlich des letzten NAVDF-Kongresses, der im vergangenen April in Orlando stattfand, führte Professor Ross Bond, der am Royal Veterinary College in London tätig ist, eine tiefgehende Analyse der epidemiologischen, klinischen und diagnostischen Aspekte der Dermatophytose durch, indem er auf zu vermeidende Fallstricke hinwies und Perspektiven für ein fundiertes Vorgehen aufzeigte, das für eine optimale Betreuung unerlässlich ist.
1. Einführung: Die inhärente Komplexität der Dermatophyten
Die Dermatophytose, obwohl den Praktikern bekannt, verbirgt eine Komplexität, die eine anhaltende Aufmerksamkeit verdient. Verursacht durch keratinophile Pilze, hauptsächlich aus der Familie der Arthrodermataceae, betrifft diese Krankheit Haare, Krallen und das Stratum corneum [1]. Wenn die Gattungen Microsporum et Trichophyton historisch die am meisten bei Tieren beschuldigten sind, ist die Pilztaxonomie in ständiger Entwicklung. Die Entstehung der molekularen Mykologie hat so neue Gattungen wie Nannizzia et Arthrodermaoffenbart, deren Erwähnung auf Laborberichten häufiger werden könnte [2]. Epidermophytonbleibt hingegen eine Seltenheit in der Tierpathologie, sein Tropismus ist nahezu ausschließlich menschlich. Angesichts dieser ätiologischen Vielfalt und eines Kaleidoskops klinischer Erscheinungsformen, wie kann der Tierarzt mit Sicherheit zu einer präzisen Diagnose gelangen?
2. Epidemiologie und Spektrum der Dermatophyten
Das Verständnis der Ökologie und Verteilung der Dermatophyten ist ein erster entscheidender Schritt, um ihre Pathogenese zu erfassen.
2.1. Ökologische Klassifikation: Eine grundlegende Triade
Die traditionelle ökologische Klassifikation unterscheidet drei große Kategorien von Dermatophyten, deren Kenntnis die klinische Verdachtsdiagnose und die Suche nach der Infektionsquelle lenkt:
-
Zoophile : Diese Arten, wie das paradigmatische Microsporum canis (hauptsächlich bei Katzen), sind an Tiere angepasst und verbreiten sich leicht untereinander. Ihre Identifizierung erfordert oft eine Untersuchung der Umgebung und der Artgenossen.
-
Geophile : Diese Pilze, von denen Microsporum gypseum ein typischer Vertreter ist, finden ihr Reservoir im Boden, wo sie Keratin abbauen. Der Kontakt mit kontaminiertem Boden ist somit der Hauptübertragungsweg.
-
Anthropophile : Spezifisch an den menschlichen Wirt angepasst, sind diese Dermatophyten, wie Trichophyton rubrum, weniger häufig die Ursache von reversen Zoonosen (vom Menschen auf das Tier), aber diese Möglichkeit sollte nicht ausgeschlossen werden.
2.2. Geographische Verteilung und Wirtspezifität: Zu berücksichtigende Variationen
Die Prävalenz der verschiedenen Dermatophytenarten ist nicht einheitlich und variiert erheblich je nach geografischer Region und betroffener Tierart.
-
Bei der Katze, Microsporum canis dominiert weltweit [3].
-
Bei Rindern ist der Hauptätiologische Erreger der Ringelflechte, mit einer ebenfalls globalen Verbreitung., der Hauptätiologische Erreger der Ringelflechte, mit einer ebenfalls globalen Verbreitung. est l’agent étiologique majeur de la teigne, avec une distribution également globale.
-
Bei Rindern ist Pferden, Trichophyton equinum wird häufig isoliert, aber es ist interessant, die Existenz von Stammenvariationen zu beachten, wie zum Beispiel eine in Australien identifizierte [4].
2.2.1. Der Fall des Hundes: Ein nuanciertes epidemiologisches Bild
Die Epidemiologie der canine Dermatophytose illustriert besonders gut diese geografische Variabilität:
-
Au Vereinigten Königreich, langfristige Studien, insbesondere eine über 35 Jahre durchgeführte Umfrage in Bristol mit der Analyse von 475 Isolaten, zeigten die Vorherrschaft von M. canis (etwa zwei Drittel der Fälle), gefolgt von Trichophyton mentagrophytes (etwa ein Viertel) [5]. Eine neuere Verlaufsstudie über 26 Jahre in derselben Region bestätigte diesen Trend, mit Zahlen von 42% für M. canis und 38% für T. mentagrophytes [6].
-
Aux Vereinigten Staaten, eine Studie an der Louisiana State University im Jahr 1991 berichtete über 43% von M. canis und 11% von T. mentagrophytes [7]. Une enquête plus ancienne du CDC, datant de 1958 et portant sur 368 isolements issus de 35 états, montrait une proportion de 69% pour M. canis und 11% für T. mentagrophytes [8].
Es scheint also, dass T. mentagrophytes im Verhältnis eine wichtigere Rolle bei Hunden im Vereinigten Königreich spielt als in den Vereinigten Staaten, obwohl M. canis in beiden Regionen ein Schlüsselpathogen bleibt. Welche Umwelt- oder Wirtsfaktoren könnten diese Unterschiede erklären?
2.2.2. Andere bemerkenswerte Dermatophyten und ihre ökologischen Reservoirs
Vigilanz ist auch bei anderen, selteneren Arten geboten, deren Identifizierung klinische und epidemiologische Auswirkungen haben kann:
-
Trichophyton erinacei : Dieser Erreger, verantwortlich für den “Igelringwurm”, weist eine Prävalenz auf, die direkt mit der Präsenz dieser Insektenfresser korreliert ist.
-
der Hauptätiologische Erreger der Ringelflechte, mit einer ebenfalls globalen Verbreitung. : Hauptsächlich von Rindern übertragen, wird er selten bei Hunden in den Vereinigten Staaten diagnostiziert und nur sporadisch im Vereinigten Königreich.
-
Microsporum persicolor : Mit Hauptreservoir in Wühlmäusen und Mäusen, ist dieses Dermatophyt bei Hunden im Vereinigten Königreich wenig verbreitet und wurde bei dieser Spezies in den USA nicht berichtet, obwohl seine Präsenz in Nordamerika (zum Beispiel in Ontario, Kanada) bestätigt ist [9].
-
Microsporum gypseum : Dieser geophile Pilz ist ein Hauptverursacher von Dermatophytosen in Louisiana (44% der Hundeerkrankungen) und bleibt in anderen amerikanischen Studien signifikant (18% der Fälle). In scharfem Kontrast dauerte es in Bristol 35 Jahre, um M. gypseum bei nur vier Hunden zu isolieren. Diese Diskrepanz wirft die Frage nach dem Einfluss pedoklimatischer Faktoren auf, wobei ein wärmerer Boden in den USA sein Überleben und seine Vermehrung begünstigen könnte.
2.3. Prädisponierende Faktoren: Identifizierung von Risikogruppen
Bestimmte dem Tier innewohnende Faktoren oder solche, die mit seiner Umgebung zusammenhängen, können seine Anfälligkeit für Dermatophytosen erhöhen:
-
Alter : Junge Tiere, deren Immunsystem noch nicht ausgereift ist, werden klassisch als anfälliger für Infektionen durch M. canisangesehen. Umgekehrt könnten ältere Tiere, wenn sie bessere Jäger sind, stärker den von der Wildfauna übertragenen Dermatophyten ausgesetzt sein.
-
Rasse : Rassenspezifische Prädispositionen wurden vorgeschlagen. Yorkshire Terrier scheinen empfindlicher gegenüber M. canis (im Vereinigten Königreich) zu sein, während Jack Russell Terrier anfälliger für von der Wildfauna übertragene Dermatophytosen sein könnten. Langhaarige Katzen, wie Perserkatzen, werden ebenfalls häufig erwähnt.
-
Saisonalität : Auch wenn im Vereinigten Königreich wenig ausgeprägte saisonale Schwankungen festgestellt wurden, zeigte eine amerikanische Studie eine erhöhte Inzidenz von T. mentagrophytes im Herbst.
3. Die polymorphe Erscheinung der Dermatophytose: Erkennung der Zeichen
Dermatophytose ist eine “große Simulantin”. Ihre klinische Präsentation kann so vielfältig sein, dass sie vom Praktiker ein hohes Maß an Verdachtsmomenten erfordert. Wie Michael Schaer betonte: “Wenn Sie nicht daran denken, finden Sie es nicht” [10] – ein hier besonders zutreffender Spruch.
3.1. Klassische Präsentationen: Die Warnsignale
Einige Erscheinungsformen gelten als typischer, wenn auch nicht pathognomonisch:
-
Bei Rindern ist der Hauptätiologische Erreger der Ringelflechte, mit einer ebenfalls globalen Verbreitung. (T. verrucosum): Charakteristische, gut abgegrenzte, haarlose Läsionen, die mit gräulich-dicken Schuppen bedeckt sind, vorzugsweise am Kopf, Hals und an den Ohren lokalisiert. Diese Läsionen treten häufiger bei Tieren auf, die im Winter im Innenbereich gehalten werden.
-
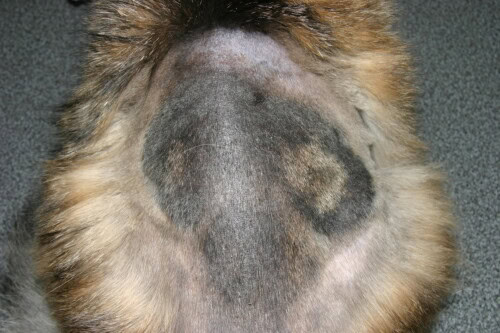
Bei Rindern ist Hunden und Katzen (M. canis): Die klassische Läsion ist ein kreisförmiger, schuppiger Haarausfall, manchmal erythematös und verkrustet, oft am Kopf sitzend. Es werden jedoch auch weniger entzündliche Formen beobachtet, die sich auf einen Bereich des Haarausfalls ohne ausgeprägte Hautreaktion beschränken.
Es ist immer wichtig, die Warnung von Danny Scott im Kopf zu behalten: “Wenn es beim Hund wie ein Ringelflechte aussieht, ist es das wahrscheinlich nicht. Es ist wahrscheinlich eine staphylokokkale Follikulitis.” [11]. Tatsächlich sind beim Hund die ringförmig expansiven Läsionen häufiger bakterieller Herkunft.
3.2. Atypische Formen und diagnostische Fallen
Hier kann die Diagnose zu einem echten Feinheitstest werden:
-
Follikulitis und Furunkulose des Nasenrückens (Wilddermatophyten) : Häufig assoziiert mit T. mentagrophytes ou T. erinacei bei Hunden, die Kontakt mit Nagetieren oder Igeln haben (Jagd-, Terrierrassen). Diese Läsionen können einseitig oder asymmetrisch sein, mit einer Tendenz zur zentralen Heilung und einer aktiven peripheren Entzündung. Der Nasenrücken ist typischerweise verschont.
-
Noduläre Läsionen und Plaques (Kérion, Pseudomycetom) :
-
Ein Jack Russell Terrier, der einen Kaninchenbau erkundet hatte, entwickelte eine erythematöse und schuppende Krustenplatte auf der Brust sowie eine deutliche Knotenläsion am Karpus, die beide als verursacht durch T. mentagrophytes.
-
Ein Dobermann mit mehreren erythematösen Plaques, bei dem zunächst ein kutanes Lymphom vermutet wurde, stellte sich als infiziert mit Dermatophytose durch T. mentagrophytesheraus. Wie überrascht war der Kliniker über diese unerwartete Diagnose?
-
Bei Perserkatzen ist das Pseudomycetom (oder tiefer Kerion) verursacht durch M. canis eine gut beschriebene Entität, die sich durch Knoten, Fistelgänge und manchmal die Ausscheidung von Körnern manifestiert, die an “Schwefelkörner” erinnern.
-
Ein in Kroatien gemeldeter Fall beschreibt ein Kerion bei einer Katze – ein schwellendes und eitriges Knötchen – verursacht durch M. gypseum in Verbindung mit einer staphylokokken Sekundärinfektion.
-
-
Unregelmäßige und subtile Läsionen : Eine jagende Katze zeigte eine diskrete Alopezie an der Schnauze und erythematosquame Läsionen auf der Ohrmuschel verursacht durch T. mentagrophytes, eine Art, die jedoch bei Katzen ungewöhnlich ist. Dies unterstreicht die Bedeutung, sich nicht ausschließlich auf klassische Pilzart/Wirt Assoziationen zu verlassen.
-
Nosokomiale Infektionen : Dermatophytose-Läsionen können sich an zuvor geschorenen Stellen für chirurgische Eingriffe oder die Einführung eines intravenösen Katheters entwickeln. Eine strenge Hygiene der Schermaterialien, mit systematischer Desinfektion zwischen jedem Tier, ist daher eine nicht zu vernachlässigende Präventionsmaßnahme.
-
Generalisierte Schuppenform (M. persicolor) : Im Gegensatz zu den meisten anderen Dermatophyten M. persicolor befällt die Haarschäfte nicht, sondern kolonisiert ausschließlich das Stratum corneum. Das Ergebnis ist eine manchmal intensive, flächendeckende Schuppung ohne signifikante Alopezie. Ein illustrativer Fall ist der eines Hundes, der über vier Jahre an generalisierten Schuppen litt, letztendlich als Infektion mit M. persicolor.
Diagnostiziert wurde. Sehr weit verbreitete Form einer feline Dermatophytose
3.3. Besondere Fälle: Meerschweinchen und Kaninchen – Die Falle des asymptomatischen Trägers
Diese kleinen Säugetiere, insbesondere aus Zoohandlungen oder Gemeinschaften, können asymptomatische Träger des Komplexes T. mentagrophytes sein (häufig durch molekulare Techniken als T. benhamiaeidentifiziert). Diese asymptomatische Trägerschaft stellt eine große Herausforderung für die Infektionskontrolle dar.
-
Prävalenz der asymptomatischen Trägerschaft :
-
In belgischen Zoohandlungen zeigten Studien, dass 3,5% der klinisch gesunden Meerschweinchen und 3,8% der klinisch gesunden Kaninchen Träger waren [12].
-
In slowakischen Zoohandlungen stiegen diese Zahlen auf 10% für Meerschweinchen und 6% für gesunde Kaninchen [13].
-
Eine in Berliner Zoohandlungen durchgeführte Studie, die PCR verwendete, ergab, dass zwar 9% der Meerschweinchen klinische Läsionen aufwiesen, ein erstaunlicher Anteil von 90% aller getesteten Meerschweinchen Träger der DNA von T. benhamiae [14]. Ces chiffres interpellent quant à la source potentielle d’infection pour d’autres animaux ou pour l’homme.
-
-
waren. Klinische Fälle (Kaninchen in Spanien) : Unter den Kaninchen mit klinischen Dermatophytose-Läsionen stimmten 54% der Isolate mit T. mentagrophytes und 27% mit M. canis [15].
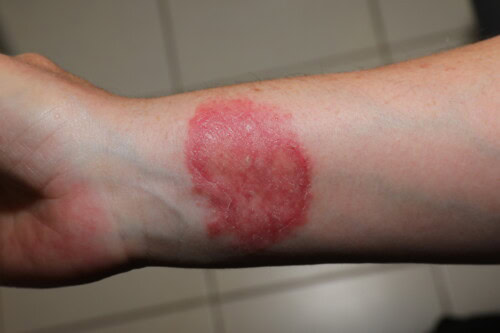
überein. 3.4. Dermatophytose als Zoonose: Eine ständige Sorge
Es ist unerlässlich, sich das zoonotische Potenzial der Dermatophytose ins Gedächtnis zu rufen. Zahlreiche Fälle von Übertragungen auf den Menschen sind dokumentiert, die sowohl Besitzer (und deren Kinder, wie in einem Fall der Übertragung von einem infizierten Meerschweinchen illustriert) als auch das tiermedizinische Personal betreffen (ein Neurologie-Resident, der sich von einem canine Patienten infizierte).
Menschliche Kontamination durch einen Dermatophyten
4. Diagnosestrategien: Auf eine multimodale Annäherung
Die Diagnose der Dermatophytose basiert nicht auf einem einzigen, unfehlbaren Test. Ein multimodaler Ansatz, der die klinische Untersuchung mit verschiedenen ergänzenden Tests kombiniert, ist der Schlüssel.
4.1. Direkte mikroskopische Untersuchung (Trichogramm): Die erste Untersuchung
Diese einfache und schnelle Untersuchung kann wertvolle Hinweise liefern.
-
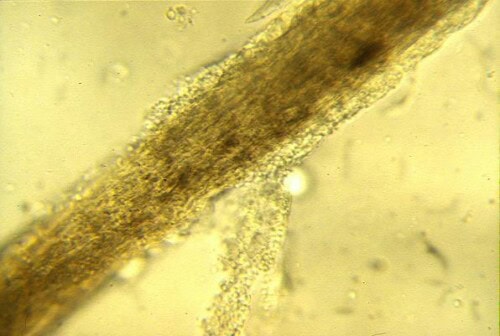
Technik : Es sollten Haare am aktiven Rand der Läsionen entnommen werden, wobei gezielt solche angesprochen werden, die “wattschig” erscheinen, gebrochen oder abnormal sind. Die Probe wird typischerweise in einem Tropfen 10-20% KOH (das hilft, keratinhaltige Trümmer zu klären) oder einfach in Mineralöl zwischen Objektträger und Deckglas montiert. Der entscheidende Schritt ist es, den Kondensor des Mikroskops abzusenken und mit der Blende zu arbeiten, um den Kontrast zu erhöhen, da die Pilzelemente unter weißem Licht oft wenig refraktär sind. Es wird nach dem Vorhandensein von ectothrix-Arthrosporen (die eine Hülle um das Haar bilden) oder segmentierten endothrix-Hyphen (im Haarschaft) gesucht.
-
Sensibilität : Die Studie aus Bristol, die Mikroskopie mit Kultur vergleicht, berichtete eine allgemeine Sensitivität von 55%. Diese war höher für M. canis (58%), oft verbunden mit einer reichlichen Sporenproduktion, die leicht sichtbar ist, als für T. mentagrophytes (44%), wo die Hyphen diskreter sein können und in den Schuppen lokalisiert sind. Es ist wahrscheinlich, dass die Empfindlichkeit bei weniger erfahrenen Praktikern geringer ist.
-
Fallen und Artefakte : Verwirrung ist möglich mit Artefakten wie inneren oder äußeren Haarumhüllungen, Keratintrümmern, Luftblasen oder sogar Konidien von saprophytischen Pilzen, die die Hautoberfläche kontaminieren können. Ein gutes Verständnis der Pilzmorphologie ist unerlässlich.
-
Zusätzliche Farbstoffe : Obwohl nicht unerlässlich, wenn die Beleuchtungstechnik beherrscht wird, können Farbstoffe wie “Potash Kwik” (eine kommerzielle KOH-Lösung mit Tinte) oder Parker-Tinte dabei helfen, die Pilzelemente zu kontrastieren. Calcofluor White ist eine fortgeschrittenere Option (siehe Abschnitt 4.5).
Teile der infizierten Haare
4.2. Wood-Lampe: Ein klassisches Werkzeug mit bekannten Einschränkungen
Die Wood-Lampe bleibt nützlich, wobei man ihre Besonderheiten kennen muss.
-
Prinzip und Fluoreszenz : Einige Stämme von M. canis (aber nicht alle) produzieren während ihres Stoffwechsels Pteridin, eine Substanz, die eine charakteristische apfelgrüne Fluoreszenz zeigt, wenn sie einer ultravioletten Lichtquelle mit einer spezifischen Wellenlänge (um 365 nm) ausgesetzt wird. Wichtig ist zu beachten, dass aktiv infizierte Haare fluoreszieren und nicht die Schuppen, Krusten oder Kulturen.
-
Spezifität und Einschränkungen : Diese Untersuchung ist hauptsächlich relevant für den Verdacht einer Infektion mit M. canis. Die Mehrheit der Trichophyton Arten zeigt diese Fluoreszenz nicht. Außerdem fluoreszieren auch bei M. canisnicht alle Stämme.
-
Optimale Untersuchungsbedingungen : Um die Chancen der Detektion zu maximieren, muss die Untersuchung zwingend in einem völlig dunklen Raum durchgeführt werden. Die Lampe sollte vor der Verwendung mehrere Minuten vorgewärmt werden. Die Verwendung einer hochwertigen Wood-Lampe, die speziell für die Veterinärmedizin entwickelt wurde und idealerweise mit einer Vergrößerungslinse ausgestattet ist, wird stark empfohlen.
-
Sensibilität : Für Infektionen mit M. canisvariiert die Sensibilität der Wood-Lampe je nach Studie gewöhnlich zwischen 54% und 70% [16]. Ein negatives Ergebnis schließt daher niemals eine Dermatophytose aus.
4.3. Pilzkultur: Identifikation und Lebensfähigkeit
Die Pilzkultur bleibt eine Referenzmethode für die genaue Speziesbestimmung und die Bestätigung der Lebensfähigkeit des Pathogens.
-
Probenentnahme : Haare und Schuppen oder Krusten sollten am aktiven Rand der auffälligsten Läsionen entnommen werden. Für das Screening asymptomatischer Träger oder zur Überprüfung der Behandlungseffektivität sind die Methode mit einer sterilen Bürste (z. B. McKenzie Bürste), die über das gesamte Fell geführt wird, oder die Verwendung von Nährböden mit einer texturierten Seite für die Probenahme (wie Derm-Duet) erprobte Techniken.
-
Kulturmedien : Sabouraud-Dextrose-Agar (SDA) ist das klassisch verwendete Basismedium. Die Inkubation erfolgt bei einer Temperatur von 26-27°C und kann bis zu 4 Wochen dauern, bevor eine Kultur endgültig als negativ betrachtet wird.
-
Identifikation der Kolonien : Die Identifikation basiert auf einer Kombination von Kriterien:
-
Makroskopisch : Aussehen der Kolonie (Farbe, Textur – baumwollartig, pudrig, körnig), Wachstumsgeschwindigkeit und eventuelle Produktion eines in das Agar diffundierenden Pigments oder gut erkennbar auf der Kolonierückseite.
-
Mikroskopisch : Nach Entnahme eines Teils der Kolonie (oft mit einem transparenten Klebeband aufgetragen und auf einen Objektträger übertragen) und Färbung (klassisch mit Laktophenolblau), ist die Beobachtung der Makrokonidien und Mikrokonidien (Form, Größe, Wand, Septierung) entscheidend für die Bestimmung der Art. Es ist wichtig zu beachten, dass Makrokonidien in vitro (in Kultur) produziert werden und auf direkten Proben vom Tier normalerweise nicht zu beobachten sind. produziert werden. DTM-Medium (Dermatophyte Test Medium)
-
-
Milieu DTM (Dermatophyte Test Medium) : Dieses differentielle Medium ist ein SDA (Sabouraud-Dextrose-Agar), der durch die Zugabe eines pH-Indikators (Phenolrot) und von Inhibitoren (wie Cycloheximid zur Hemmung schnell wachsender Saprophyten und Antibiotika wie Gentamicin und Chlortetracyclin zur Hemmung von Bakterien) modifiziert wurde. Das Prinzip beruht auf dem bevorzugten Metabolismus der Dermatophyten: Sie nutzen zunächst die Proteinquellen des Mediums, produzieren basische Metaboliten, die den pH-Indikator von Gelb nach Rot ändern. Saprophytische Pilze hingegen neigen dazu, zuerst die Kohlenhydrate zu nutzen (Säuerung, also keine anfängliche Farbänderung oder Wechsel zu Gelb), und können, wenn die Kultur verlängert wird, ebenfalls Proteine metabolisieren, was zu einer späten Rotfärbung führen kann, die Verwirrung stiftet.
-
Interpretation des DTM : Eine Rotfärbung frühzeitig, die gleichzeitig oder vor dem sichtbaren Wachstum der Kolonie auftritt (in der Regel innerhalb von 3 bis 7 Tagen) und mit einer kolonieerscheinung kongruent ist (häufig weiß, cremefarben, flauschig oder puderig), deutet stark auf ein Dermatophyten hin.
-
Grenzen des DTM : Die Interpretation des DTM in der allgemeinen Praxis kann weniger zuverlässig sein als in einem spezialisierten Mykologielabor. Eine israelische Studie zeigte eine Übereinstimmungsrate von nur 80% zwischen klinischen und laborbasierten Ablesungen, mit häufiger auftretenden falsch positiven und falsch negativen Ergebnissen in der Klinik [17]. Faktoren wie eine zu niedrige Umgebungsinkubationstemperatur können die Farbänderung verzögern. Außerdem kann eine verlängerte Inkubation zu einer Rotfärbung durch Saprophytpilze führen, was eine diagnostische Fehlinterpretation zur Folge haben kann.
-
4.4. Histopathologie: Wenn die Läsion tief oder atypisch ist
Die histopathologische Untersuchung von Hautbiopsien kann besonders informativ sein, insbesondere bei knotigen Formen oder wenn andere Tests zu keiner klaren Schlussfolgerung führen.
-
Visualisierung von Pilzelementen : Hyphen können im Haarschaft, in den Haarfollikeln oder manchmal frei in der Dermis bei Furunkulose sichtbar gemacht werden. Sporen können ebenfalls um die Haare herum beobachtet werden. Die Verwendung spezieller Färbungen wie PAS (Periodische Säure-Schiff-Reaktion) oder GMS (Grocott Methenamin Silber) ist oft unerlässlich, um die Pilzstrukturen, die bei der Standardfärbung H&E diskret sein können, deutlich zu erkennen.
-
Assoziierte Entzündungsmuster :
-
Im Falle von M. persicolorkann die Entzündung dezent sein, wobei hauptsächlich eine Infiltration von Lymphozyten in den Schuppen des Stratum corneum vorliegt.
-
Bei den meisten anderen invasiven Dermatophyten kann eine Follikulitis (Entzündung des Haarfollikels), eine Perifollikulitis oder sogar eine Furunkulose (Ruptur des Follikels mit intensiver Entzündungsreaktion in der Dermis) beobachtet werden.
-
Bei Kérion oder Pseudomyzetom sind typischerweise tiefe entzündliche Knoten zu beobachten, oft granulomatös oder pyogranulomatös, die Pilzelemente enthalten, manchmal in Form von “Körnern”.
-
4.5. PCR (Polymerase-Kettenreaktion): Ein wachsendes molekulares Werkzeug
Die PCR ermöglicht den empfindlichen Nachweis von Pilz-DNA aus Haar- und Schuppenproben.
-
Prinzipien und Ziele : Veterinär-PCR-Panels zielen in der Regel auf konservierte DNA-Sequenzen bei Dermatophyten ab, die eine Gruppenidentifikation ermöglichen (z.B. Microsporum spp., Trichophyton spp.). Spezifischere Primer können danach verwendet werden, um bestimmte Arten von besonderem Interesse zu identifizieren, wie M. canis.
-
Interpretation und Nuancen :
-
Ein positiver PCR-Befund bei einem Tier mit kompatiblen klinischen Symptomen deutet stark auf eine aktive Infektion hin.
-
Bei einem klinisch gesunden Tier kann ein positiver PCR-Befund auf ein asymptomatisches Trägertum oder eine einfache transitorische Umweltkontaminierung der Haare hinweisen. Die Nachweisgrenze der PCR ist oft sehr niedrig.
-
Eine wesentliche Grenze der PCR ist ihre Fähigkeit, Pilz-DNA zu detektieren, unabhängig davon, ob sie von lebensfähigen oder nicht lebensfähigen Organismen stammt,. Somit kann eine PCR auch nach einer wirksamen Antipilzbehandlung weiterhin positiv sein, indem sie einfach die DNA toter Sporen nachweist. Daher bestätigt sie nicht notwendigerweise eine aktive, laufende Infektion und ihr Nutzen für die therapeutische Nachverfolgung ist umstritten.
-
-
Vergleich mit der Pilzkultur : Nach Ansicht des Mykologenexperten Patrick Bourdeau kann die Pilzkultur, wenn sie von einem spezialisierten Labor durchgeführt und interpretiert wird, empfindlicher sein als einige kommerzielle PCR-Tests. Darüber hinaus bietet die Kultur den entscheidenden Vorteil, die genaue Identifizierung der Art (essentiell für die Epidemiologie und die Suche nach der Kontaminationsquelle) und die Bestätigung der Lebensfähigkeit des Pilzes zu ermöglichen.
-
Empfehlungen der Konsensen : Der Konsens von 2017 zur felinen Dermatophytose der International Society of Companion Animal Infectious Diseases (ISCAID) erkennt PCR als nützliches diagnostisches Werkzeug an, betont jedoch, dass ihre Interpretation mit Vorsicht und im Kontext klinischer und epidemiologischer Daten erfolgen sollte [18].
4.6. Fluoreszenzmikroskopie mit Calcofluor White: Verbesserung der direkten Detektion
Calcofluor White ist ein unspezifischer Farbstoff, der sich mit hoher Affinität an die Zellulose und das Chitin, die Hauptbestandteile der Pilzzellwände, bindet.
-
Technik : Die Haar- und Schuppenproben werden zuerst mit einer KOH-Lösung behandelt (um die Zelltrümmer des Wirts zu klären), dann wird ein Tropfen Calcofluor White hinzugefügt. Nach einer kurzen Inkubationszeit wird die Probe unter einem mit einer UV-Lichtquelle und geeigneten Filtern ausgestatteten Mikroskop untersucht (in der Regel für eine Anregung im nahen UV-Bereich und eine Emission im blauen oder grünen Spektrum).
-
Vorteile : Die Pilzelemente (Hyphen, Sporen) erscheinen dann glänzend fluoreszierend und heben sich deutlich vom nicht fluoreszierenden Hintergrund ab. Diese Technik erhöht signifikant die Empfindlichkeit und Geschwindigkeit der direkten mikroskopischen Detektion im Vergleich zur konventionellen Weißlichtmikroskopie. Es wurde berichtet, dass die Nutzung von Calcofluor White die Sensitivität der direkten Mikroskopie nahezu verdoppeln kann.
Die Dermatophytose ist eine echte Kreuzung aus diagnostischen Herausforderungen. Wie behält man den Überblick?
-
Die große klinische Variabilität : Sie zwingt dazu, die Dermatophytose immer in die Differenzialdiagnose vieler Hauterkrankungen einzubeziehen, auch solcher, die nicht das “klassische” Erscheinungsbild zeigen.
-
Das Fehlen eines einzigartigen und unfehlbaren “Goldstandards” : Jüngste Expertenkonsense betonen, dass kein diagnostischer Test einzeln perfekt ist [18]. Ein kombinierter Ansatz ist oft der erfolgreichste. Die Kombination der Untersuchung mit der Wood-Lampe (wenn eine Infektion mit M. canis vermutet wird) und der direkten mikroskopischen Untersuchung (ideal mit Calcofluor White zur Erhöhung der Empfindlichkeit) stellt eine hervorragende Erstlinienstudie in der Klinik dar.
-
Die Umweltpersistenz der Sporen : Die Sporen von M. canis können bis zu 14 Monate oder länger in der Umwelt lebensfähig bleiben. Diese Langlebigkeit erschwert die Infektionskontrolle erheblich, insbesondere die Prävention von Reinfektionen und die Übertragung auf andere Tiere oder Menschen. Das Scheren infizierter Tiere (wenn durchführbar und gut verträglich) kann dazu beitragen, die Umweltbelastung mit kontaminierten Haaren und somit mit Sporen zu verringern.
-
Das konstante zoonotische Risiko : Die Infektionsfähigkeit des Tieres für den Menschen nimmt mit der Einleitung einer wirksamen Antimykotika-Therapie ab, aber Vorsichtsmaßnahmen (strenge Hygiene, Begrenzung enger Kontakte, insbesondere für Kinder, ältere Menschen oder immungeschwächte Personen) sollten während der gesamten Behandlungsdauer und bis zur Bestätigung der mykologischen Heilung aufrechterhalten werden.
-
Die tiefen knotigen Formen (Kérion oder Pseudomyzetom) : Ihre Diagnose kann besonders schwierig und oft verzögert sein, wenn der anfängliche Verdacht auf eine Dermatophytose gering ist. In diesen Fällen sind die histopathologische Untersuchung tiefer Biopsien, mit speziellen Färbungen für Pilze, und die Pilzkultur aus dem biopsierten Gewebe häufig unverzichtbar.
-
Die kritische Interpretation von Testergebnissen und ihre inhärenten Grenzen :
-
Direkte Mikroskopie : Ihre Empfindlichkeit hängt stark von der Erfahrung des Operators und der Genauigkeit der angewandten Techniken ab (insbesondere der angemessenen justierung des Kondensators).
-
DTM in der Klinik : Das Risiko einer Fehlinterpretation der Farbänderung (Verwechslung mit dem Wachstum von Saprophytpilzen bei später Ablesung oder verlängerter Inkubation) ist eine anerkannte Einschränkung.
-
PCR : Obwohl sehr empfindlich, unterscheidet die PCR nicht zwischen der DNA einer aktiven Infektion und der bloßen Anwesenheit von lebensfähigen oder nicht lebensfähigen Sporen. Daher bedeutet ein positiver PCR-Befund bei einem Tier während oder nach einer Behandlung nicht notwendigerweise ein therapeutisches Versagen.
-
Pilzkultur : Sie wird als Referenzmethode zur Identifizierung der Art und zur Bestätigung der Lebensfähigkeit des Erregers angesehen, kann jedoch falsch negativ sein, wenn die Probe unzureichend ist, topische Antimykotika kürzlich auf die Läsionen aufgetragen wurden oder die Labortechnik nicht optimal ist. Sie kann auch durch schnell wachsende saprophytäre Pilze kontaminiert werden, die Dermatophyten maskieren oder mit ihnen verwechselt werden können.
-
-
Die Auswirkungen des unsachgemäßen Einsatzes von Kortikosteroiden : Die Verabreichung von Glukokortikoiden, sei es systemisch oder topisch, ohne eine präzise ätiologische Diagnose kann eine bestehende Dermatophytose signifikant verschlimmern (Dermatophytose incognito) oder die klinischen Anzeichen verschleiern, was die spätere Diagnose und die Behandlung erschwert und verlängert.
-
Das Konzept der infizierenden Dosis und der Immunität : Eine bestimmte Menge an Pilzsporen ist notwendig, um eine klinische Infektion zu initiieren. Tiere, die nach einer Erstinfektion eine effektive Immunantwort entwickeln, können eine erhöhte Resistenz gegen eine spätere Reinfektion mit einer ähnlichen Dosis von Sporen aufweisen.
6. Fazit und Ausblick: Hin zu einer erhellten Praxis
Die Dermatophytose, aufgrund ihrer vielseitigen Erscheinungsformen und der inhärenten Herausforderungen ihrer Diagnostik, erfordert vom tierärztlichen Kliniker ständige Wachsamkeit und eine strategische diagnostische Vorgehensweise. Es gibt keinen unfehlbaren Abkürzungsweg. Die Anerkennung der verschiedenen klinischen Erscheinungsformen, das Verständnis der Grenzen und Vorteile jedes diagnostischen Werkzeugs und die Integration epidemiologischer Daten sind die Säulen eines erfolgreichen Vorgehens.
Die Zukunft liegt wahrscheinlich in der Optimierung und intelligenter Kombination bestehender Techniken. Die direkte Mikroskopie, aufgewertet durch Werkzeuge wie Calcofluor White, behält einen bevorzugten Platz für eine schnelle Diagnose in der Klinik. Die Pilzkultur, idealerweise in spezialisierten Laboratorien durchgeführt, bleibt unerlässlich für eine präzise Identifikation und zur Beurteilung der Lebensfähigkeit, insbesondere in komplexen Fällen oder zur therapeutischen Überwachung. Die PCR bietet dabei eine hohe Sensitivität, aber ihre Interpretation muss vorsichtig und immer im klinischen Kontext erfolgen.
Werden wir vielleicht die Entwicklung schneller molekularer Tests „am Patientenbett“ erleben, die Sensitivität und Spezifität kombinieren und gleichzeitig über die Lebensfähigkeit informieren? Oder standardisiertere diagnostische Algorithmen, die die Stärken jeder Methode integrieren?
Bis zu diesen Fortschritten bleibt die Kernaussage: ein hohes klinisches Misstrauen, eine kluge Auswahl der Tests je nach Fall und eine kritische Interpretation der Ergebnisse sind die Garanten für eine optimale Versorgung dieser Pilzinfektion, zum Wohl unserer Patienten und zur Beruhigung ihrer Besitzer.
Referenzen
[1] Weitzman I, Summerbell RC. The dermatophytes. Clin Microbiol Rev. 1995 Apr;8(2):240-59.
[2] de Hoog GS, Guarro J, Gené J, Figueras MJ. Atlas of Clinical Fungi. 4th ed. Centraalbureau voor Schimmelcultures; 2020.
[3] Moriello KA, Coyner K, Paterson S, Mignon B. Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol. 2017 Jun;28(3):266-e68.
[4] Kano R, Hirai A, Yoshioka N, et al. Arthroderma vanbreuseghemii/Trichophyton mentagrophytes complex isolated from an Australian Cavy. Med Mycol J. 2009;50(3):309-12.
[5] Sparkes AH, Robinson A, MacKay AD, et al. A study of the dermatophytes of dogs and cats in the south of England. J Small Anim Pract. 1993 Oct;34(10):507-13.
[6] Donnely T. Personal communication/unpublished data cited in the presentation. (Note: This would require a formal citation if available, or acknowledgement of the source.)
[7] Miller WH Jr, Scott DW, Wellington JR. Isolation of dermatophytes from the haircoats of normal dogs and cats in the southeastern United States. J Am Anim Hosp Assoc. 1991;27:555-8.
[8] Kaplan W, Georg LK, Ajello L. Recent developments in animal ringworm and their public health implications. Ann N Y Acad Sci. 1958;70:636-49.
[9] Bourdeau P. Dermatophyties des carnivores domestiques : aspects épidémiocliniques et diagnostiques. Point Vét. 2005;36(254):44-51.
[10] Schaer M. Clinical Medicine of the Dog and Cat. 2nd ed. Manson Publishing; 2010. (Note: Attributing this specific quote directly to a publication by Schaer would require verification if not explicitly stated as such in the audio.)
[11] Scott DW, Miller WH Jr, Griffin CE. Muller and Kirk’s Small Animal Dermatology. 7th ed. Elsevier Health Sciences; 2012.
[12] Dekeyser H, Adriaensen C, Mignon B, et al. Asymptomatic carriage of dermatophytes by dogs and cats. Vet Dermatol. 2009 Aug;20(4):253-8.
[13] Čonková E, Kollarova L. Dermatophytes isolated from asymptomatic guinea pigs and rabbits in Slovakia. Mycoses. 2010 Jul;53(4):325-8.
[14] Kraemer A, Mueller RS, Schauer U, et al. Dermatophytes in pet guinea pigs and rabbits. Vet Microbiol. 2012 May 25;157(1-2):208-13.
[15] Cafarchia C, Figueredo LA, Otranto D. Fungal diseases of rabbits. Vet Microbiol. 2013 Nov 15;167(1-2):227-43.
[16] Newbury S. Wood’s lamp examination in small animal practice. Vet Clin North Am Small Anim Pract. 2000 Nov;30(6):1099-105.
[17] Kuzi S, Nivy R, Lavy E, et al. Comparison of real-time PCR and dermatophyte test medium culture for the diagnosis of dermatophytosis in a referral hospital setting. Vet Dermatol. 2016 Feb;27(1):32-e9.
[18] Moriello KA, Coyner K, Paterson S, Mignon B. Diagnosis and treatment of dermatophytosis in dogs and cats. Clinical Consensus Guidelines of the World Association for Veterinary Dermatology. Vet Dermatol. 2017 Jun;28(3):266-e68.